Похідні дипептидів та спосіб їх отримання
Номер патенту: 27254
Опубліковано: 15.08.2000
Автори: Масаакі Матсуо, Дайдзіро Хагівара, Хіросі Міяке
Текст
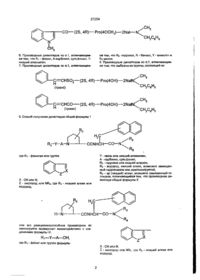
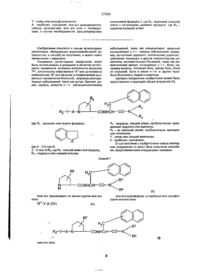
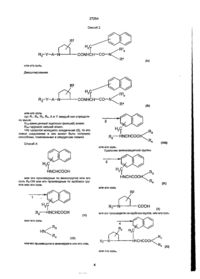
1. Производные дипептидов общей формулы (33) GB (46) 15.08.2000,Бюл. № 3, 2000 р. R-Y-A-N CONHCH—СО—N где Ri - фенил или группа X - СН или N; Z - кислород или NRs, где Rs - низший алкил или водород, Y - связь или низший алкенилен, , • А - карбонил, сульфонил, R2 - гидрокси или низший алкокси, F 3 - водород, низший алкил, возможно замещен? ный гидроксилом или ацилокси групп ой, Р4 - ар (низший) алкил, возможно замещенный га* лоидом. 2. Производные дипептидов по п.1, отличающие ся тем, что Ri -фенил, бензофурил, индазолил, индолил или н-низший алкилиндолил, Яз - водород, низший алкил, гидрокси (низший) алкил или ацилокси (низший) алкил, R4 -фенил (низший) алкил или гапогенфенил (низший) алкил. 3. Производные дипептидов по п.1, отличающиеся тем, что Ri -бензофурил, индазолил, индолил или 1-низший алкилиндолил, А - карбонил, Y - связь. 4. Производные дипептидов по п.1, отличающиеся тем, что Ri - бензофурил, индазолил, индолил, 1- метилиндолил или 1-изопропил-индолил, R2 - гидрокси, метокси, R3 - водород, метил, гидроксиэтил или ацетоксиэтил, R4 - бензил, фенэтил, о-фторбензил, м-фторбензил или п-фторбензил. 5. Производные дипептидов по п.1, отличающиеся тем, что выбраны из группы, состоящей из см < CO—(2S, 4R)—Рго(4ОН)—2Nal—NC *сн 2 с 6 н 5 СО— (2S, 4R)—Pro(4OH)—2NalN; о -СК -С-Нс 2 о о э зг 27254 CH, C O — (2S, 4 R ) — P r o ( 4 O C H 3 ) — 2 N a l — CH 2 C 6 H 5 6. Производные дипептидов по п.1, отличающиеся тем, что Ri - фенил, А-карбонил, сульфонил, Yнизший алкенилен. 7. Производные дипептидов по п.1, отличающие ся тем, что R2 -гидрокси, R - бензил, Y - винилен и Ra-метил. 8. Производные дипептидов по п.7, отпичающиеся тем, что выбраны из группы, состоящей из СН, =CHSO2—(2S, 4R)—Pro(4OH) сн 2 с е н 5 C=CHCO (2S, 4 R ) — P r o ( 4 O H ) — 2 N a l — Bzl Me CHCO (2S, 4R)—Pro(40H)—2Nal-N (d) ~ (1)Связывание 3Н-вещества с Р рецептором. Методика проведения опыта а) Необработанный препарат оболочки легкого. Умертвляли самцов морских свинок путем декапитации. Удаляли трахею и легкое и гомогенизировали в буферном растворе (0 25 М сахарозы, 500 мМ трис-НСІ, рН 7,5, 0,1 мМ эти ленд нами нтетрауксусной кислоты) с использованием Политорока (кинематика). Затем гомогенат центрифугировали (1000 хг, 10 мин) для удаления агрегации тканей и центрифугировали супернатант (14000хг, 20мин) для получения пилюпи. Пилюли вновь суспендировали в буферном растворе (5 мМ ТрисНСІ, рН 7,5), гомогенизировали с тифлоновым гомогенизатором и центрифугировали (14000хг, 20 Bzl мин), чтобы получить выход пилюль, которые относятся к необработанным фракциям оболочки. Полученные пилюли до употребления хранили при температуре - 70°С. б) Связывание Н-вещества П с препаратом оболочки. Замороженные необработанные фракции оболочки размораживали и суспендировали в среде I (50 мМ Трис-НСІ рН 7,5, 5мМ MnCl. 0,02% бычьего сыворотного альбумина, 2 мг/мл химостатина, 40 мг/мл лейпентина, 40 мг/мл бацитрацина) 3-Н вещество II (I нМ) инкубировали до 100 мл препарата оболочки в среде I при 4°С в течение 30 мин в конечном обьеме 500 мл. По окончании периода инкубации реагирующую смесь быстро профильт 27254 ровывали через стеклянный Ватман ҐФ/Б фильтр (который перед употреблением обрабатывали 3 ч 0.1 % пол иэтиленим ином) при аспирации. Затем фильтры промывали 4 раза 5 мл буферного раствора (50 мМ Трис-НСІ, рН 7,5). Измеряли радиоактивность в 5 мл Агвазола-2 в счетчике сцинциляции Паккарда (Packard Tri-Carb 4530). Результаты опыта: Опытные соединения (0,1 ц!мп) (а) Ингибирование, % 96 (б) 94 (в) 100 (г) 96 (2) Воздействие перорального применения на бронхиальный отек у морских свинок, вызванный веществом Р. Методика проведения опыта. Самцам морских свинок (300-400г) вводили внутривенно голубой раствор Иванса (20 мг/кг), содержащий гепарин (2000 МЕ/кг) и вещество II (ммолей/кг). Каждое опытное соединение (100 мг/кг), растворенное в диметилсульфоксиде, вводили перорально за 30 мин до инъекции. Через 10 мин животных умертвляли и перфузировали легкие с 50 мл солевого раствора. Отрезали трахею и бронхи, которые затем растворяли в 0,5 мл раствора 1N КОН при 37°С в течение 6 ч. После экстрагирования с 4,5 мл раствора ацетона - фосфата (0,6 NH3PO4: ацетон: 5:13) подсчитывали содержание ткани в голубом растворе Иванса колориметрическим анализом, которое было равно 620 нм. Результаты опыта. Опытные соединения (100 мг/кг) Ингибирование, % (а) 94 (б) 82 (в) 60 (г) 96 Следующие примеры даются для детальной иллюстрации настоящего изобретения. В этих примерах употребляются следующие сокращения е дополнение к аббревиатуре, принятой ИЮПАК: Ас - ацетил; Вое - т-бутоксикарбонил; BSA - бистриметилсилидацетамид; Bzl - бензил; Bzl (0-F) - о-фторбензил; Bzl (m-F) - м-фторбензил; Bzl (p-F) - р-фторбензил; НОВТ - N-гидроксибензотриазол; ІРЕ - изопропиловый эфир; Me - метил; 1 Nal - 3-(1-нафтил)аланин; 2 Nal - 3-(2-нафтил)аланин; NMM - N-метилморфолин, 4N-HCI/DOX - 4Ы-хлористый водород в 1,4-диоксане; Ph - фенил; Pri - изопропил; Pro (40H) - 4-гидроксипролин; ^ • ' Pro (40 Me) - 4-метоксипролин; TEA -триэтиламин; IFA - трифторуксусная кислота; THF - тетрагидрофуран; WSC - 1-этил-3-(3-диметиламинопропил)-карбодиимид. В таблице даны исходные соединения и целевые соединения, полученные в следующих способах получения и примерах, где верхняя формула формула исходного вещества, а нижняя - формула целевого соединения. Приготовление I К суспендированной смеси исходного соединения (2,0 г) в смешанном растворителе воды (30 мл) и ацетона (30 мл) добавили при охлаждении льдом триэтиламин (1,94 мл). К раствору добавили раствор ди-трет-бутилдикарбоната (2,43 г) в ацетоне (10 мл) и раствор перемешивали при той же температуре в течение двух часов и еще два часа при комнатной температуре, когда добавили ди-трет-бутилдикарбонат (0,4 г). После удаления ацетона добавили воду и водный раствор промыли один раз этилацетатом. Водный слой затем подкисляли до рН-добавлением 6Н хлористоводородной кислоты и экстрагировали с этилацетатом. Экстракт промыли водным раствором хлорида натрия и высушили над сульфатом магния. После выпаривания кристаллизировали остаток из смеси растворителя диизопропилового эфира и н-гексана, и собрали фильтрацией и высушили, что дало целевое соединение (2,46 г). Т.пл. 91-93°С. ИКС (Nujol): 3390, 1720, 1690, 1520, 1274, 1250,1170 см"' ЯМР (ДМСО-de, 5 ): 1,28 (9Н,с), 3,00 (IH, д, ABg, J = 13,7 Гц и 10,1 Гц), 3,20 (1Н, д, АВд, I = 13,7 Гц и 4,7 Гц), 4,20 (IH, м), 7,16 (IH, д, J = 8,5 Гц), 7,4-7,6 (ЗН, м), 7,7-7,9 (IH, м). Приготовление 2. К охлажденному льдом раствору исходного соединения (1,34 г), N-метилбензиламина (0,49 мл) и N-гидроксибензотриазола (0,51 г) в метиленхлориде (ЗО мл) добавляли 1этил-3-(3-диметиламинопропил)-карбодиимид НСІ (0,95 г). Раствор перемешивали при той же температуре 4ч и всю ночь при комнатной температуре. После выпаривания реагирующую смесь экстрагировали с этилацетатом и промывали органический слой последовательно водой и водным раствором карбоната натрия, 0,5 N хлористоводородной кислотой, водой и водным раствором хлорида натрия, затем высушивали над сульфатом натрия. Выпаривание дало целевое соединение в виде масла (1,74 г). ИКС (СНСІз): 3300,1710,1640,1490,1170 (см 1 ). ЯМР (DMCO - d 6 S); 1,22 и 1,32 (9Н, с), 2,76 и 2,87 (ЗН, с) 2,9-3,2 (2Н, м), 4,6- 4,8 (ЗН, м). 6,9-8,0 (13Н,м). Приготовление 3. К охлажденному льдом раствору исходного соединения (1,74 г) в хлориде метилена (17 мл) добавляли 4М-хлористый водород в 1,4-диоксане (17 мл). Раствор перемешивали при той же температуре 5 мин. Затем удаляли охлаждающую ванну и раствор перемешивали при комнатной температуре 30 мин, в это же время добавляли 4М-хлористый водород в 1,4-диоксане (8,4 мл). После выпаривания остаток растирали в порошок и высушивали над гидроокисью натрия в вакууме, что дало целевое соединение (1,54 г). 27254 Тпл 141-145°С. ИКС (Nujoh: 3320, 2700, 1660, 1605, 1580, 1495, 1280 (CM"V ЯМР (DMCO-de S): 2,65 и 2,71 (ЗН, с), 3,1-3,4 (2Н, м), 4,09, 4,59 и 4,35, 4,56 (2Н, два ABq, J - 16,2 и 14,9 Гц соответственно), 4,7-4,8 (1Н. м), 7,0-7,25 (5Н, м), 7,35-7,6 (ЗН, м), 7,8-8,0 (4Н, м), 8,51 (ЗН, с). Приготовление 4. К охлажденному льдом раствору исходного соединения (1,5 г), т-бутоксикарбонил-(2,2Р)-4-гидроксипролин-ОН (0,98 г) и N-гидроксибензотриазола (0,57 г) в смешанном растворителе хлорида метилена (40 мл) и диметилформамида (5 мл) добавляли 1-этил-3-(3-диметиламинопропил)-карбодиимид (0,77 мл). Раствор перемешивали при той же температуре 1 ч и при комнатной температуре в течение ночи. После выпаривания реакционную смесь экстрагировали с этилацетатом и промывали органический слой последовательно водным раствором гидрогенкарбоната натрия, водой, 0,5 N хлористоводородной кислотой, водой и водным раствором хлорида натрия, а затем высушивали над сульфатом магния. После выпаривания остаток очищали на силикагелевой колонне (75 г), используя в качестве растворителя смешанный растворитель хлороформа и метанола (50:1) и получили целевое соединение (1,74 г) в виде аморфного твердого вещества. ЯМР (DMCO-de. 5): 1,28 (9Н, с), 2,99 (1Н, дд, J = 13,1 и 5,5 Гц), 4,2-4,4 (ЗН, м), 7,05-7,25 (6Н, м), 7,4-7,55 (ЗН, м), 7,7-7,9 (4Н, м), 8,45; (1Н, д, J =5,8Гц). 1 Масса: М* 404. (3) ИКС (СНСІз): 3450, 3310, 1705, 1635, 1605, 1 1365 (см" ). ЯМР (DMCO-de 5): 1,1-1,35 (9Н, м), 2,53-3,0 (4Н, м), 2,77 и 2,84 (ЗН, с), 3,2-3,7 (2Н, м), 4,5-4,7 (1Н,м), 7,05-7,95 (13Н,м). 1 (4) ИКС (СНСІз). 3320, 1705, 1640, 1595 (см ). ЯМР (DMCO-de, 5): 1,15-1,4 (9Н, м): 2,75-3,2 (5Н, м), 4,3-4,85 (ЗН, м), 6,8-7,65 (8Н, м), 7,7-7,9 (4Н, м). (5) ИКС (СНСІз): 3450, 3320, 1710, 1640, 1590, 1 1365 (см ) ЯМР (DMCO-de. 5): 1,1-1,4 (9Н, м), 2,79 и 2,94 (ЗН, с), 2,8-3,15 (2Н, м), 4,45-4,85 (ЗН, м), 6,8-7,6 (8Н, м), 7,65-7,95 (4Н, м). (6)Тпл. 122-123°С. ИКС (Nujol): 3350, 1690, 1650, 1525, 1320, 1270 (см"1). ЯМР (DMCO-de, 5): 1,26 (9Н, с), 2,66 (2Н, т. J = 7,0 Гц), 2,8-3,1 (2Н, м), 3,2-3,4 (2Н, м), 4,15-4,3 (1Н, м), 6,92 (1Н, д, J = 8,48 Гц), 7,15-7,35 (5Н, м), 7,47,5 (ЗН, м), 7,7-7,9 (4Н, м), 7,95-8,1
ДивитисяДодаткова інформація
Назва патенту англійськоюDipeptide compounds and processes for preparation thereof
Автори англійськоюMasaaki Matsuo, Dajdziro Khagivara, Khirosi Miyake
Назва патенту російськоюПроизводные дипептидов и способ их получения
Автори російськоюМасааки Матсуо, Дайдзиро Хагивара, Хироси Мияке
МПК / Мітки
МПК: A61P 27/02, C07K 5/02, A61P 29/00, C07K 5/078, C07K 1/113, C07K 5/06, A61P 11/00, C07K 5/097, A61P 17/00, A61K 38/00
Мітки: дипептидів, спосіб, похідні, отримання
Код посилання
<a href="https://ua.patents.su/42-27254-pokhidni-dipeptidiv-ta-sposib-kh-otrimannya.html" target="_blank" rel="follow" title="База патентів України">Похідні дипептидів та спосіб їх отримання</a>