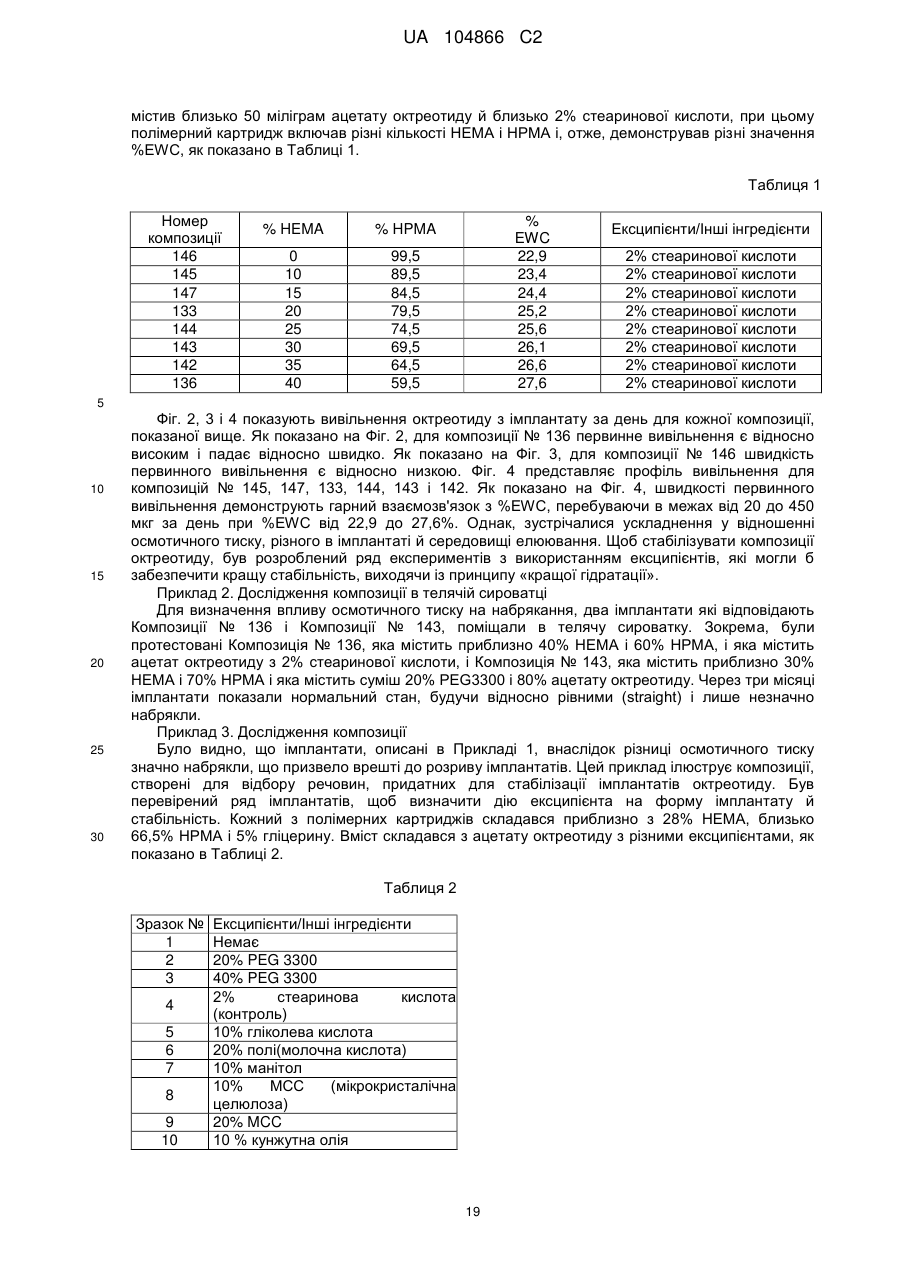
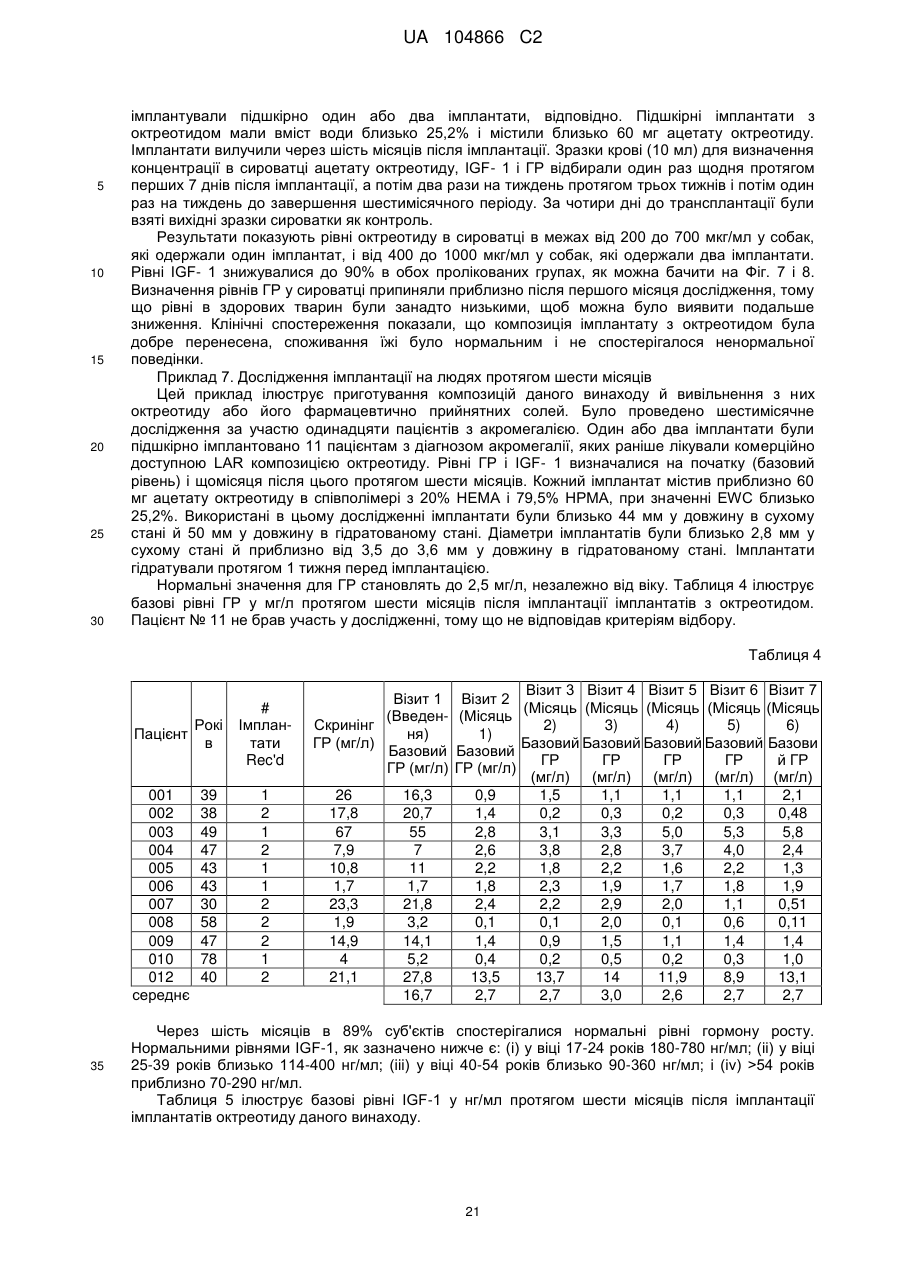
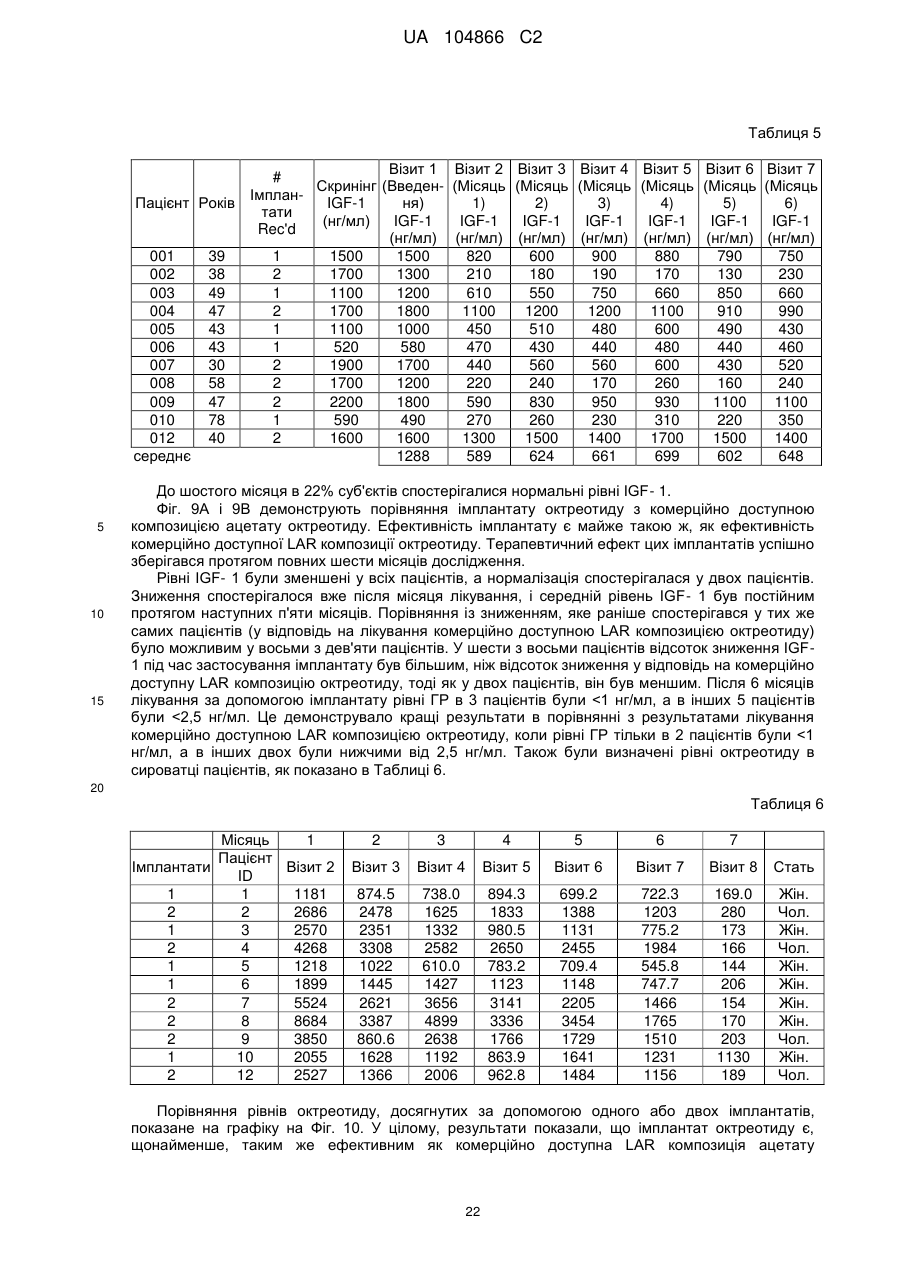
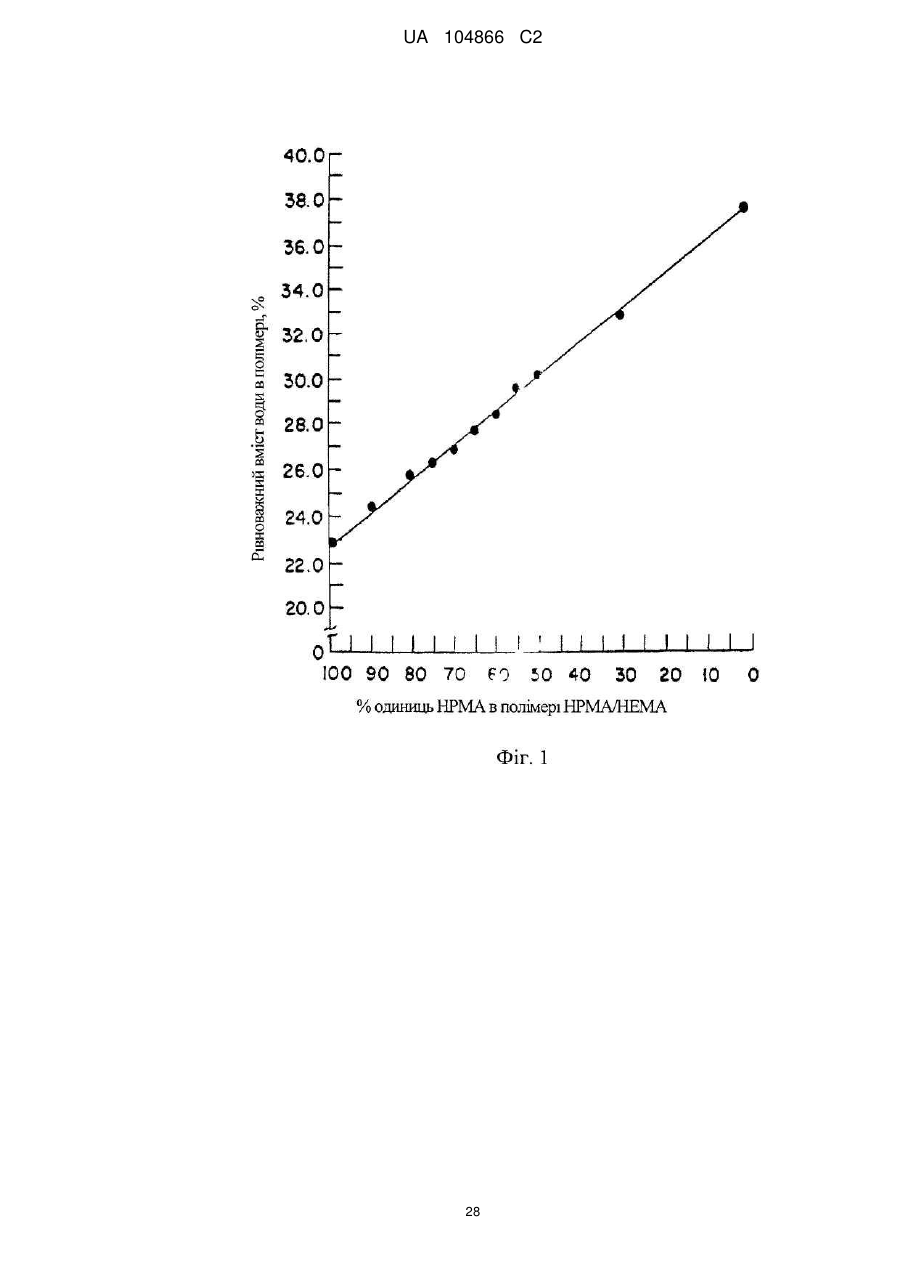
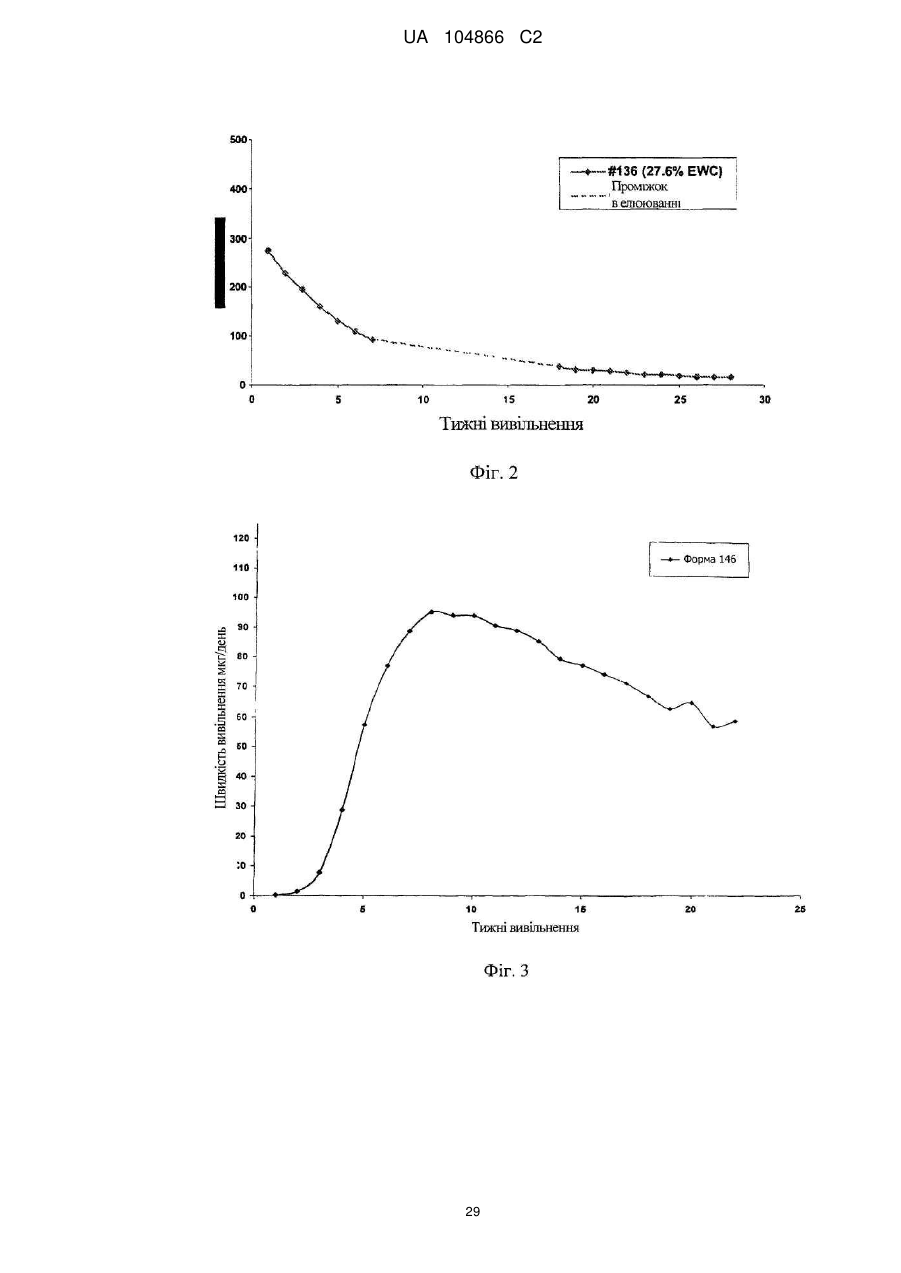
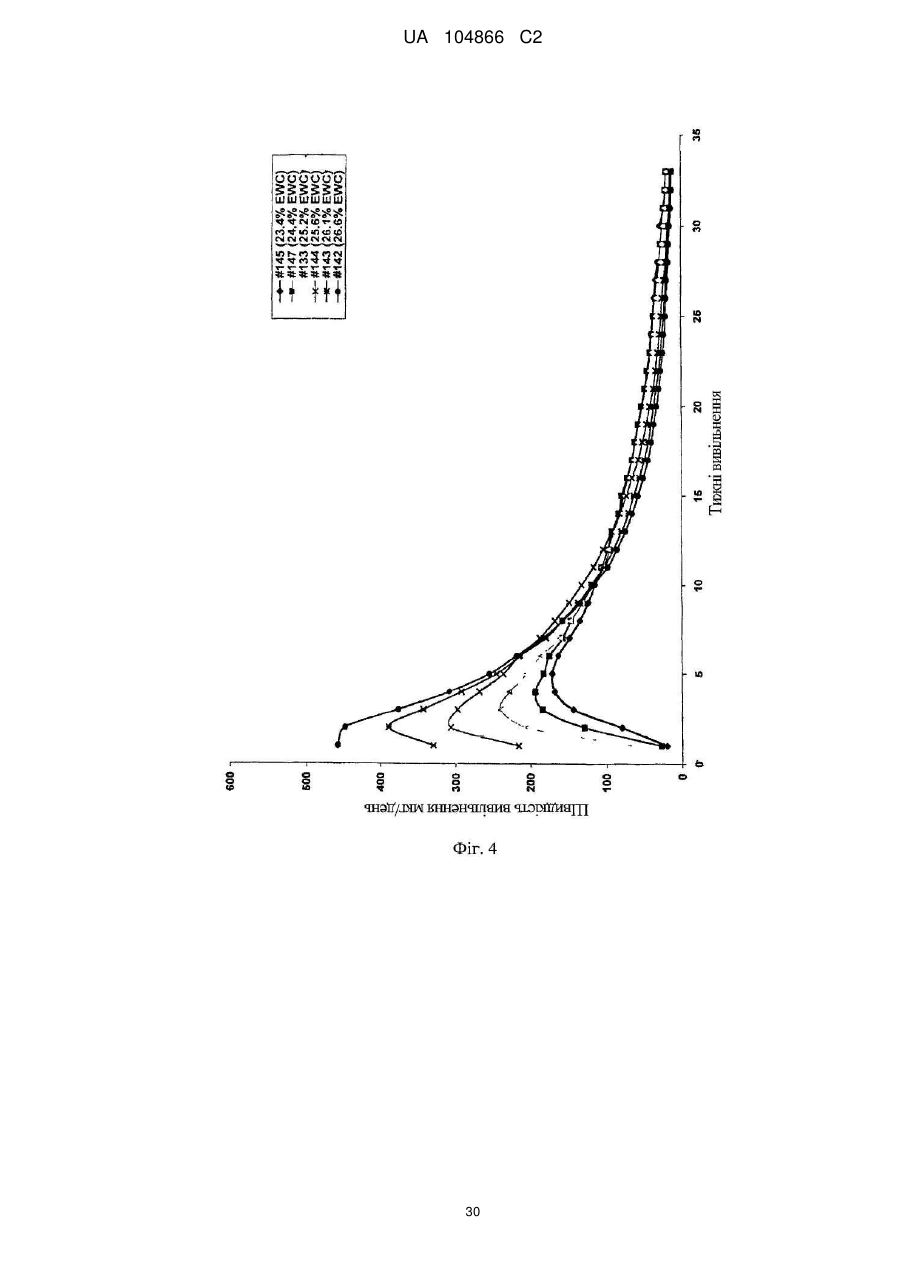
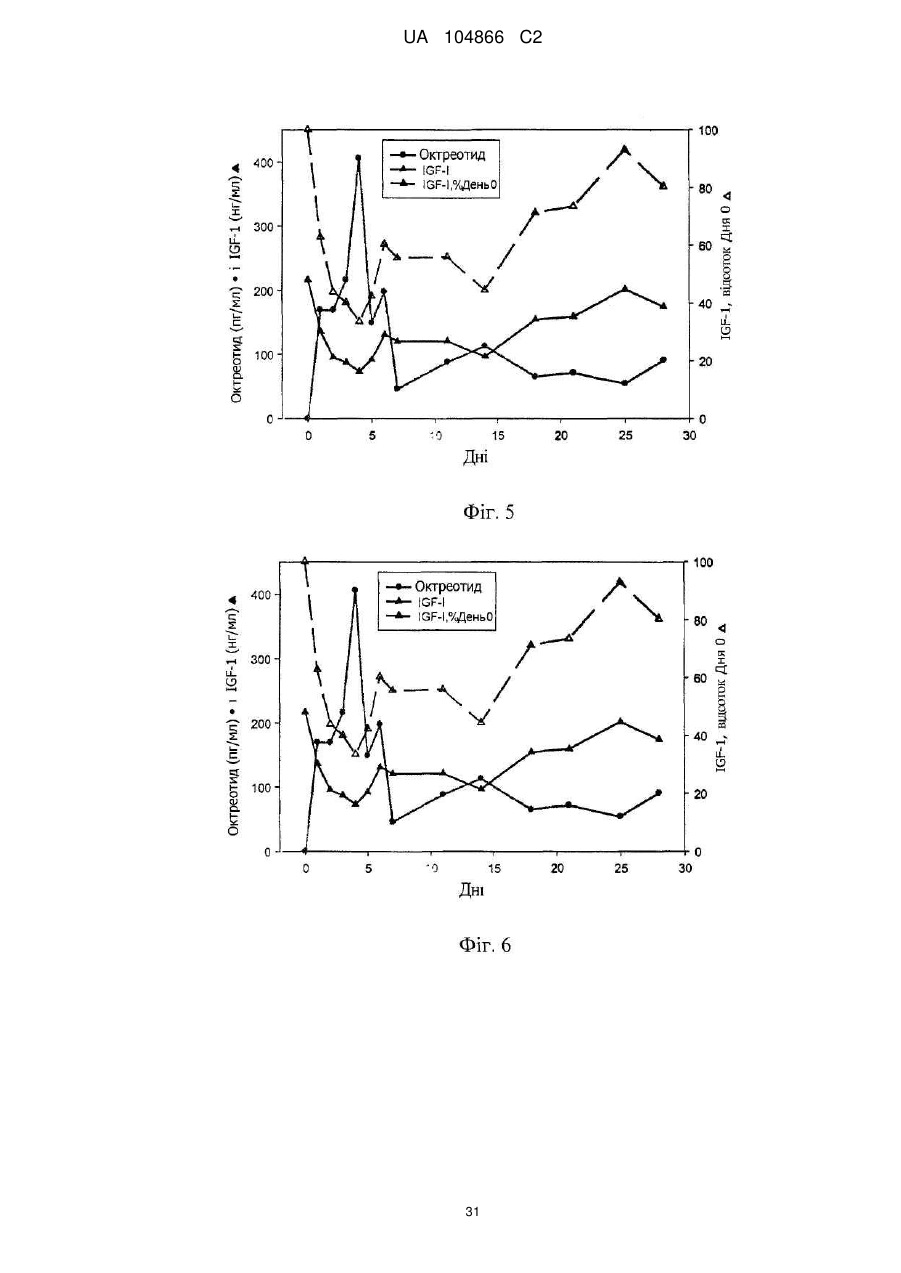
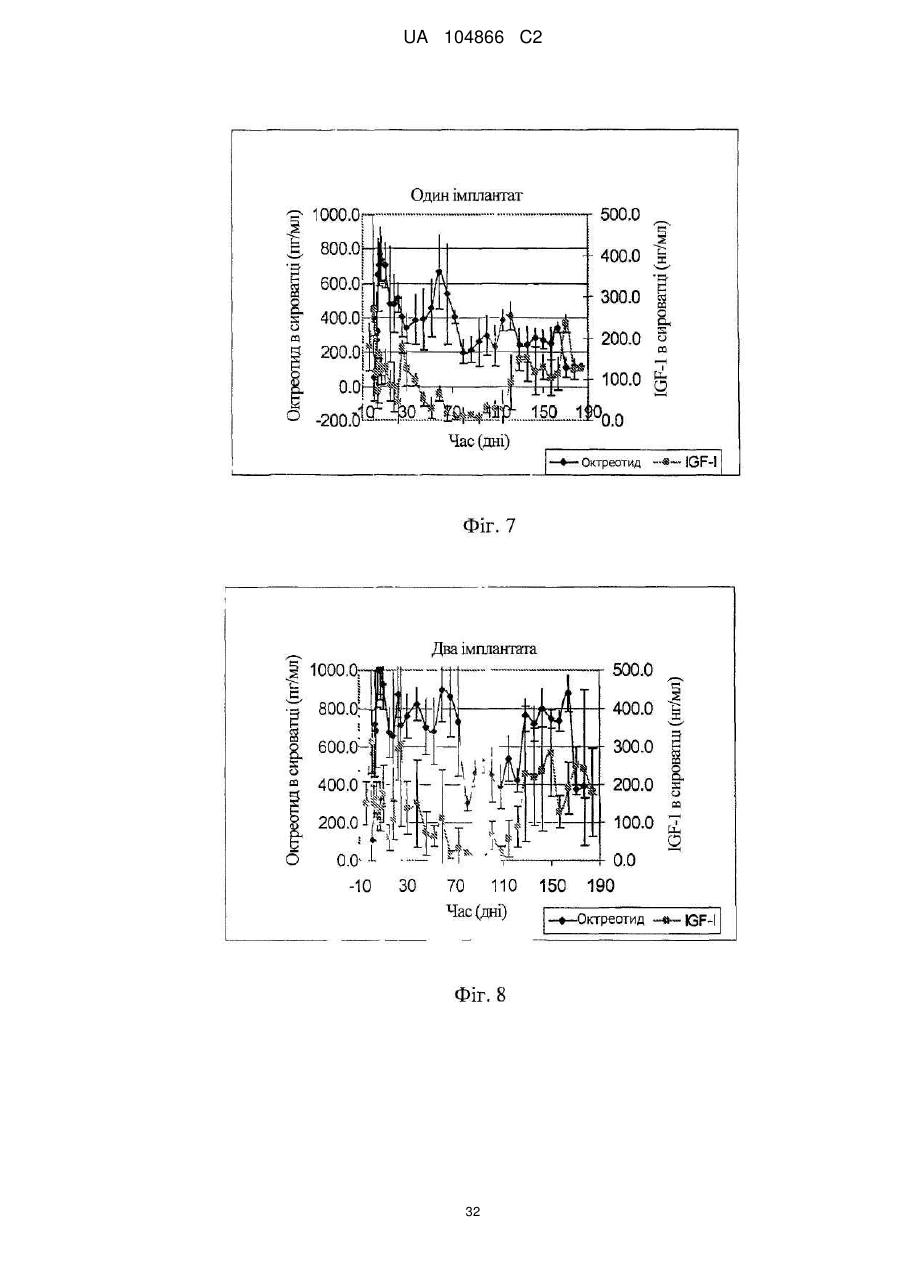
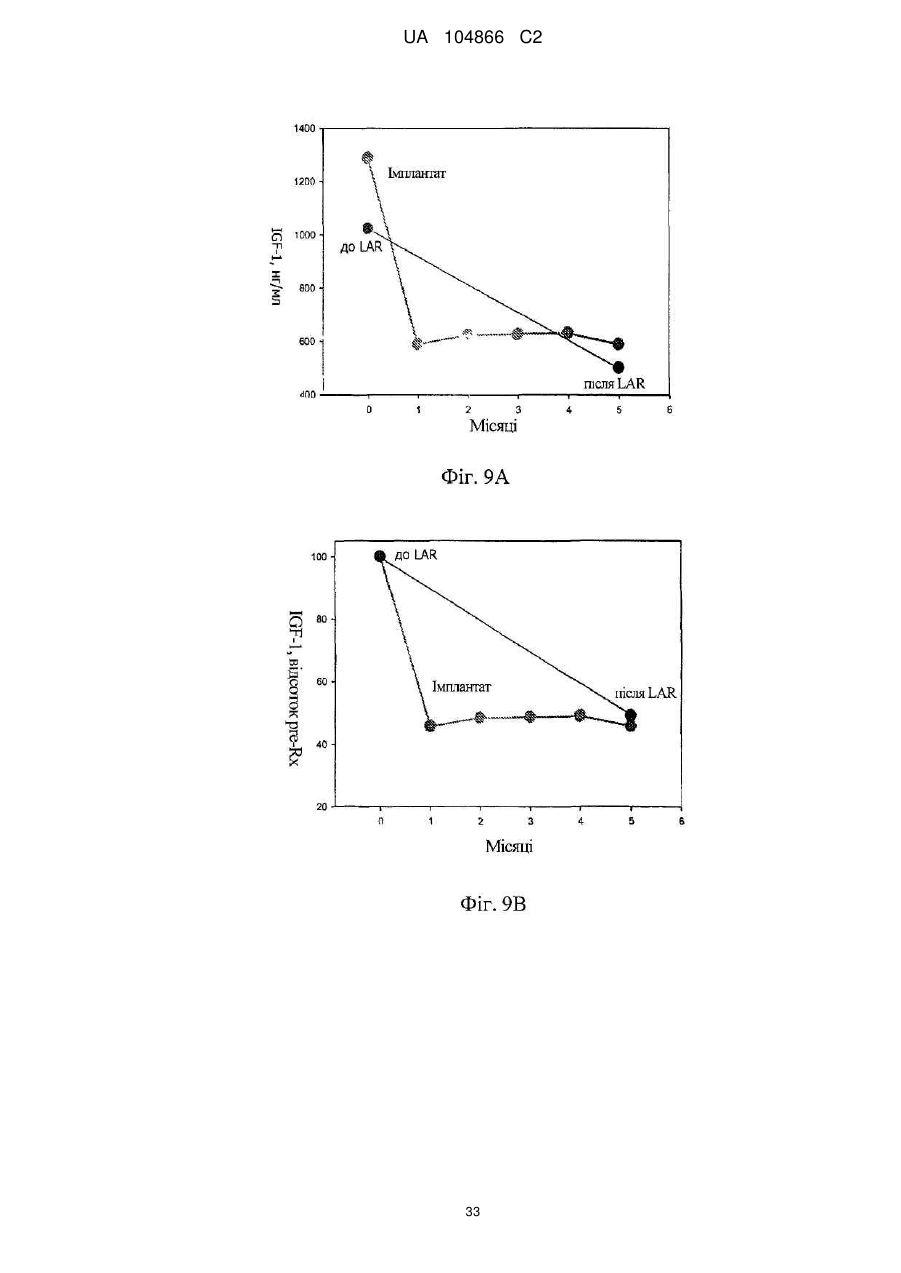
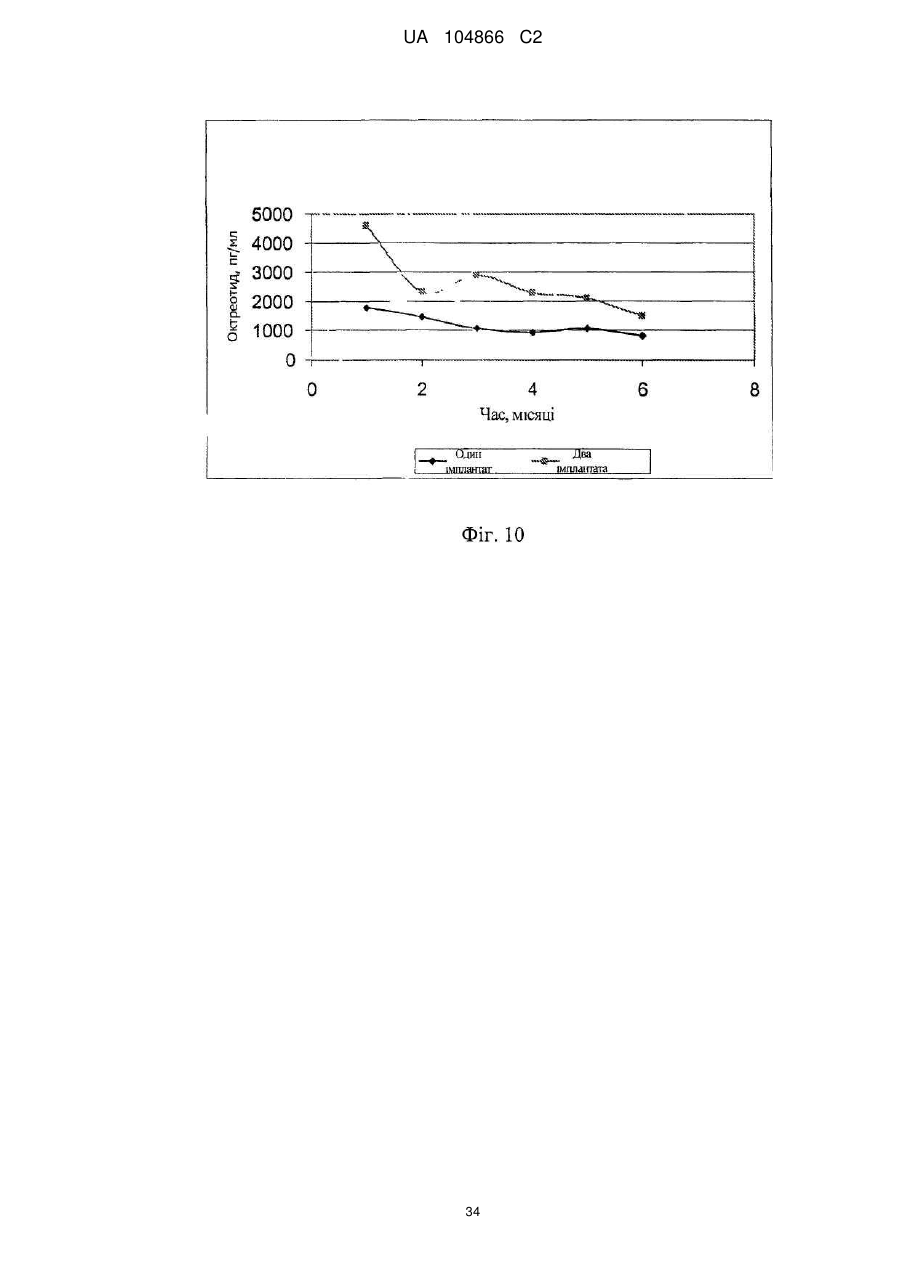
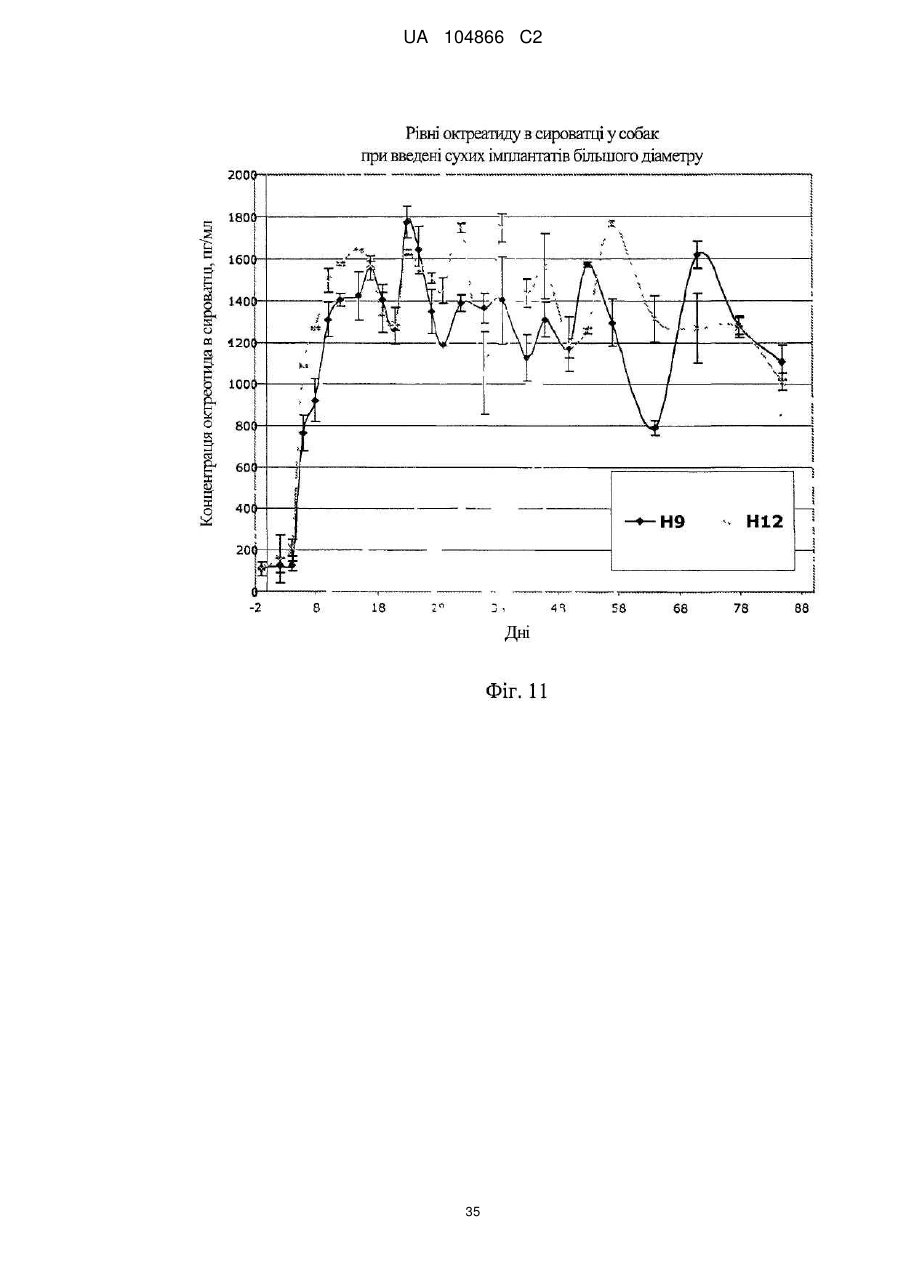
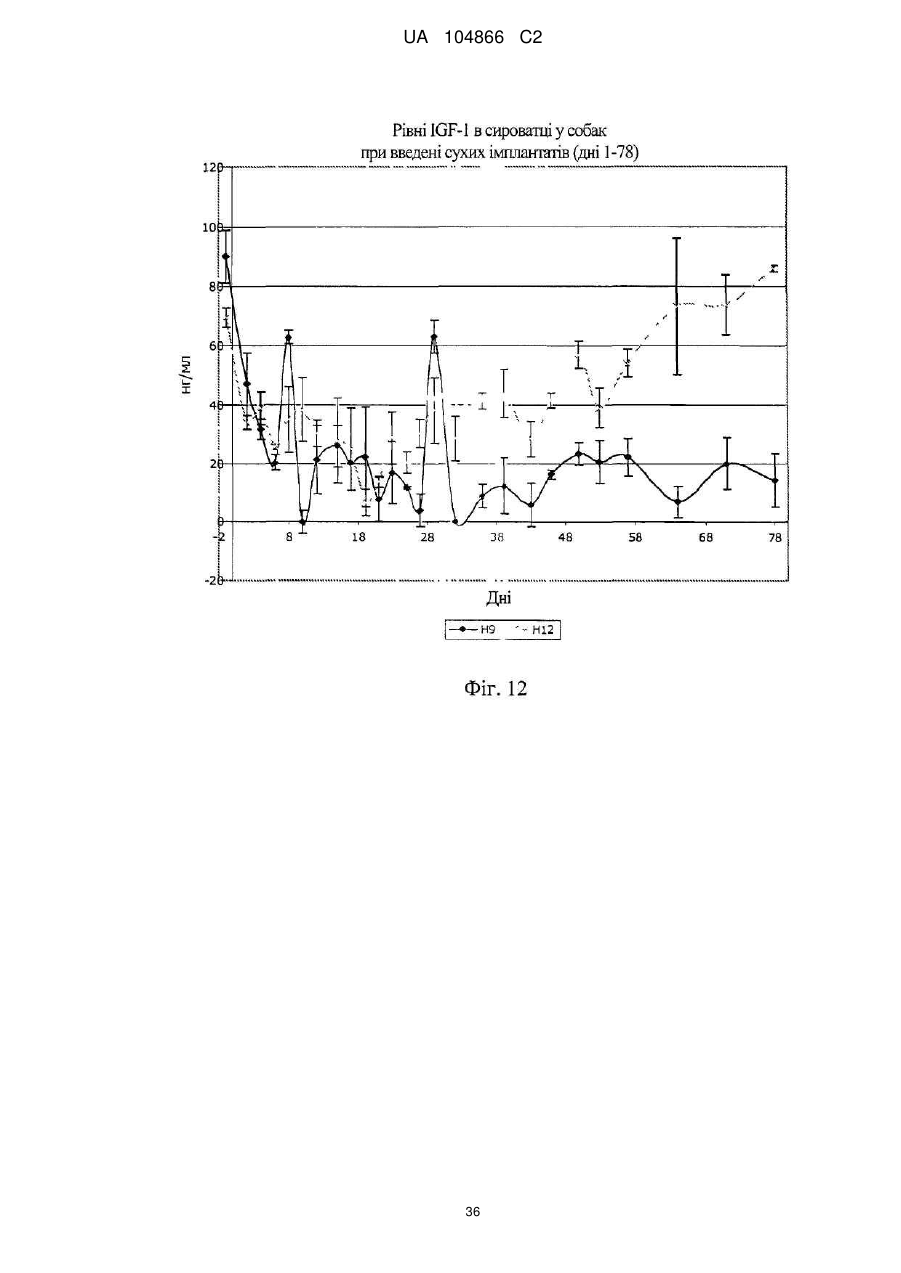
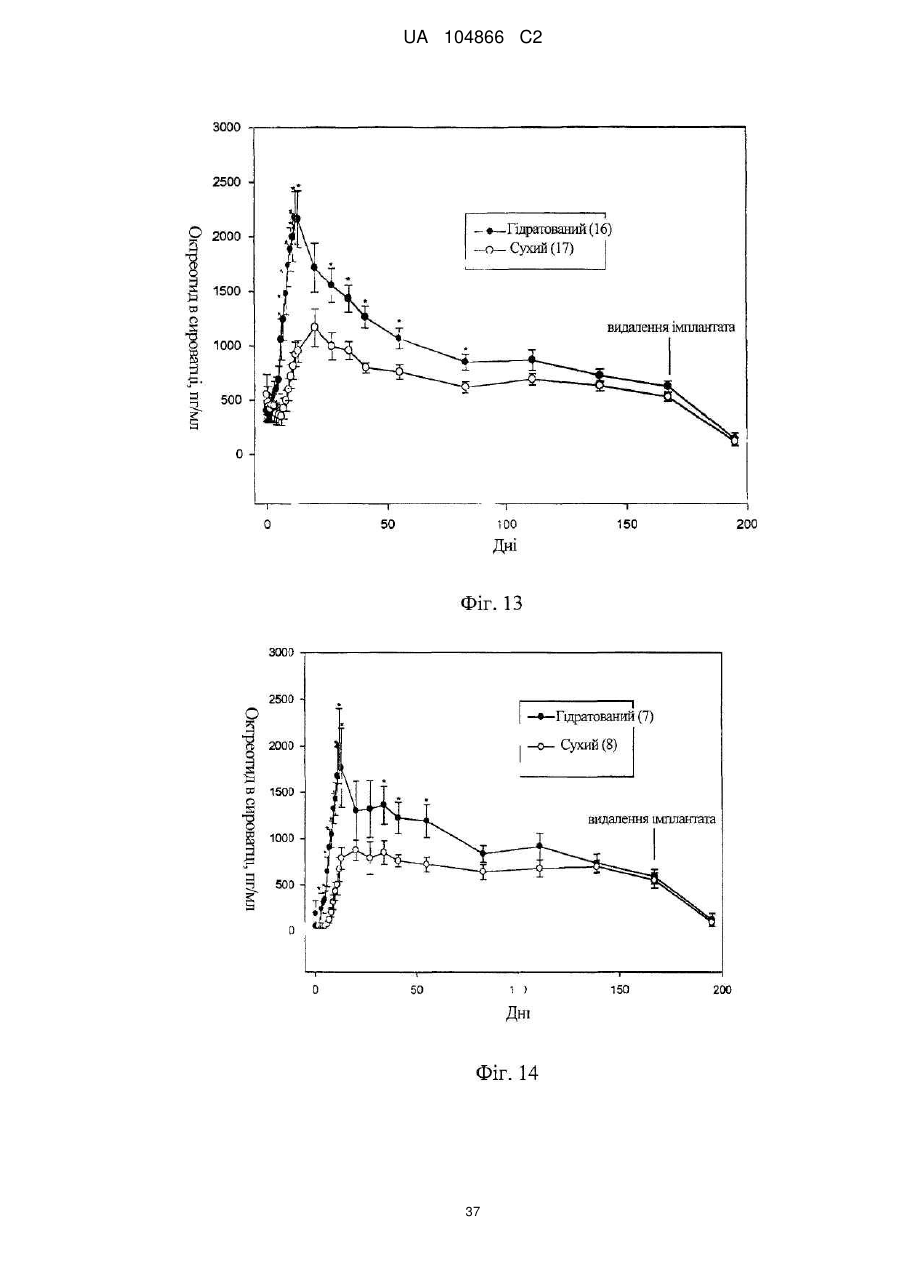
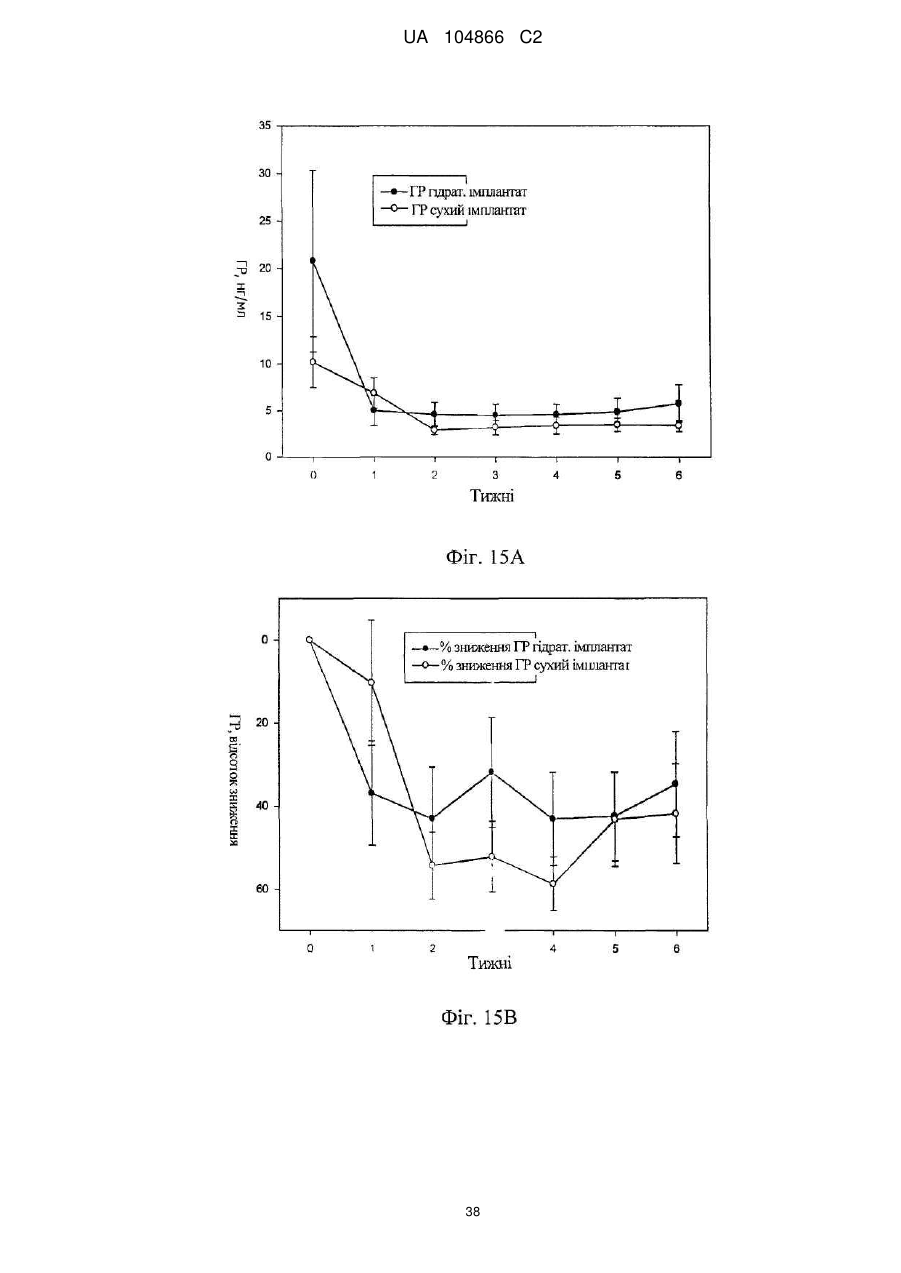
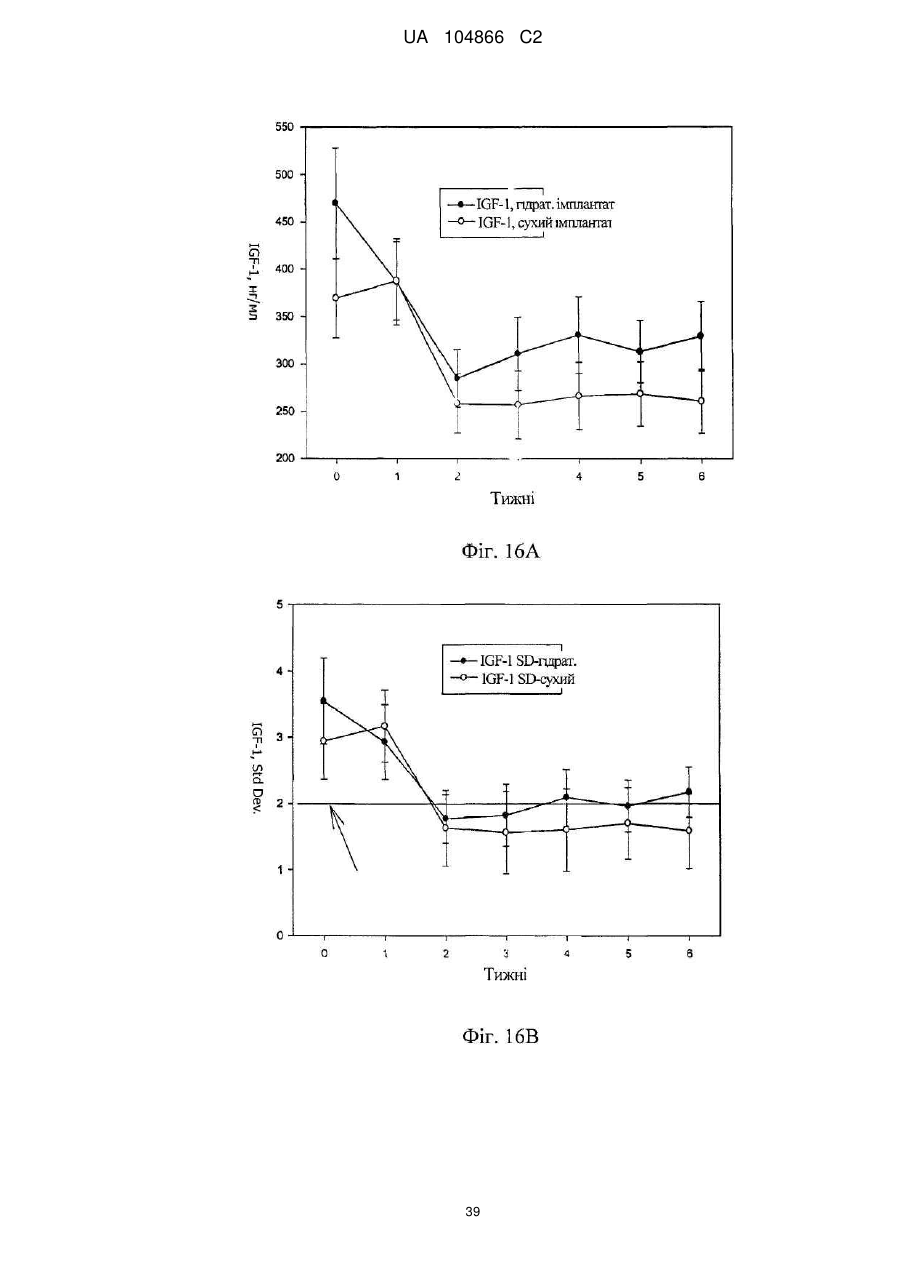
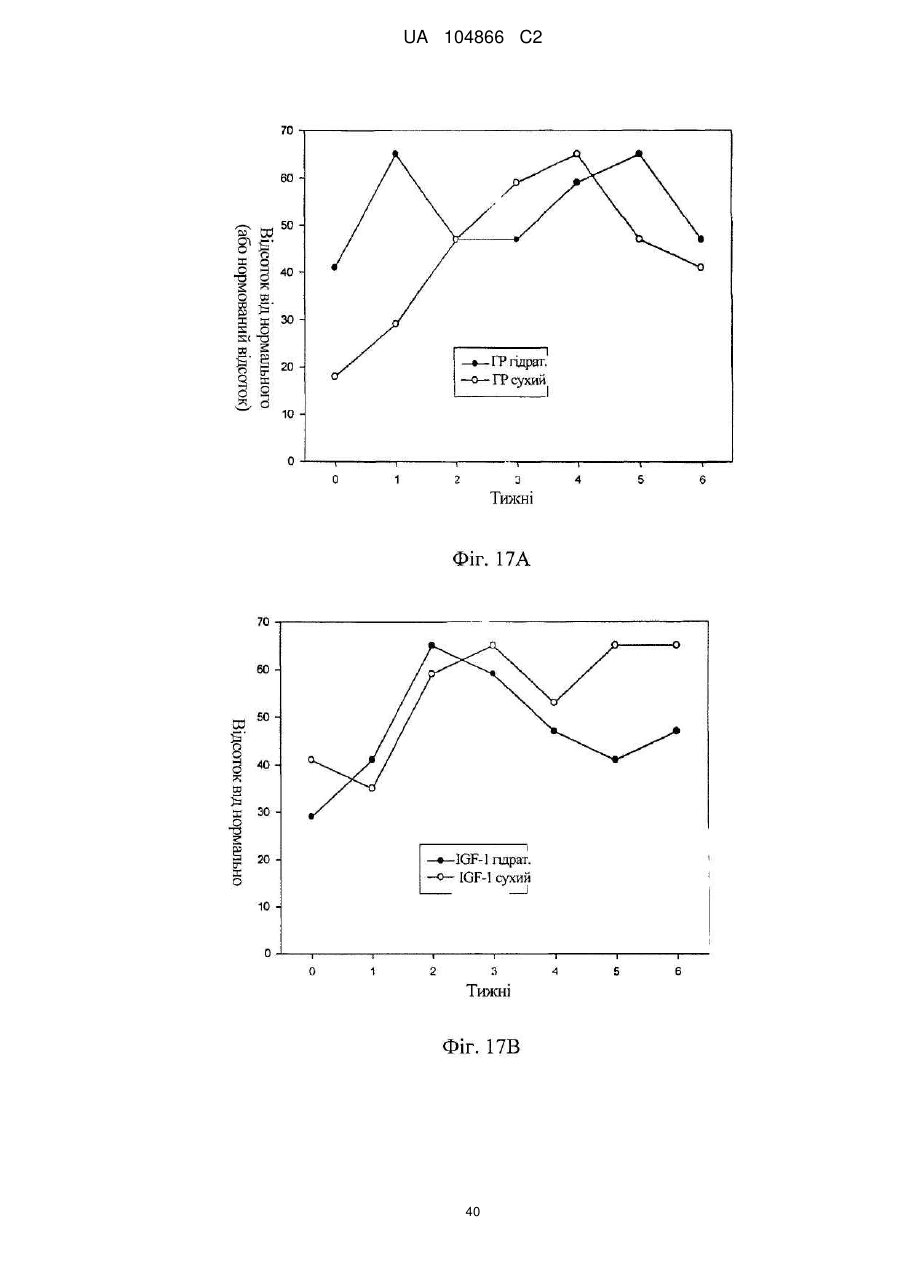
Імплантат октреотиду, який містить вивільняючу речовину
Формула / Реферат
1. Композиція для контрольованого вивільнення октреотиду після імплантації суб'єктові, яка включає препарат, який містить октреотид, в основному включений у гідрофільний полімер, вибраний з поміж полімерів на основі поліуретану й полімерів на основі метакрилату, яка є ефективною для забезпечення вивільнення октреотиду зі швидкістю приблизно від 30 мкг до 800 мкг на день протягом шести місяців in vivo, у якій гідрофільний полімер, але не препарат, додатково містить вивільняючу речовину з молекулярною вагою щонайменше близько 1000 дальтон, в якій препарат містить від 40 мг до 120 мг октреотиду, та вивільняючу речовину вибирають із групи, яка складається з Brij 35 (поліоксіетиленлауриловий ефір), поліоксіетилен (20) сорбітан триолеату, Твіну 20, Твіну 80, вітаміну Ε TPGS і їх суміші з будь-яких двох або більше.
2. Композиція за п. 1, яка відрізняється тим, що вивільняюча речовина, є неіоногенною поверхнево-активною речовиною.
3. Композиція за п. 2, яка відрізняється тим, що неіоногенна поверхнево-активна речовина містить гідрофільний "хвіст" поліетиленгліколю й ліпофільну "голову".
4. Композиція за п. 1, яка відрізняється тим, що вивільняюча речовина, має молекулярну вагу щонайменше близько 1200 дальтон.
5. Композиція за п. 1, яка відрізняється тим, що гідрофільний полімер має зовнішню площу поверхні близько 350 мм2 або більше.
6. Композиція за п. 5, яка відрізняється тим, що гідрофільний полімер має зовнішню площу поверхні в межах приблизно від 350 мм2 до 1500 мм2.
7. Композиція за п. 1, яка відрізняється тим, що композиція забезпечує вивільнення октреотиду із середньою швидкістю в межах приблизно від 75 мкг на день до 300 мкг на день in vivo.
8. Композиція за п. 1, яка відрізняється тим, що октреотид є ацетатом октреотиду.
9. Композиція за п. 1, яка відрізняється тим, що гідрофільний полімер містить суміш із 2-гідроксіетилметакрилату й гідроксипропілметакрилату.
10. Композиція за п. 7, яка відрізняється тим, що композиція забезпечує in vivo середню величину Css від 0,1 нг/мл до 9 нг/мл октреотиду в суб'єкта.
11. Композиція за п. 10, яка відрізняється тим, що композиція забезпечує in vivo середню величину Css приблизно від 1 нг/мл до 4 нг/мл октреотиду в суб'єкта.
12. Композиція за п. 1, яка відрізняється тим, що препарат містить близько 50 мг октреотиду ацетату.
13. Композиція за п. 1, яка відрізняється тим, що препарат містить близько 85 мг октреотиду ацетату.
14. Композиція за п. 9, яка відрізняється тим, що гідрофільний полімер містить суміш приблизно з 20 % 2-гідроксіетилметакрилату та близько 80 % гідроксипропілметакрилату.
15. Композиція за п. 9, яка відрізняється тим, що гідрофільний полімер містить суміш приблизно з 40 % 2-гідроксіетилметакрилату та близько 60 % гідроксипропілметакрилату.
16. Композиція за п. 1, яка відрізняється тим, що препарат додатково містить ексципієнт, вибраний із групи, яка складається зі стеарату магнію, стеаринової кислоти, рослинного стеарину, тальку й діоксиду кремнію.
17. Композиція за п. 1, яка відрізняється тим, що препарат додатково містить сполуку, вибрану із групи, яка складається з гідроксипропілцелюлози, гідроксіетилцелюлози, метилцелюлози, натрійкарбоксиметилцелюлози, модифікованого крохмалю та зшитого полівінілпіролідону.
18. Спосіб зменшення рівнів ГР або рівнів IGF-1 у суб'єкта та/або лікування хвороби, яка є чутливою до октреотиду, розладу або симптому, який передбачає підшкірну імплантацію, принаймні одного сухого імплантованого пристрою, який включає препарат, що містить композицію за будь-яким з пп. 1-17.
19. Спосіб за п. 18, який відрізняється тим, що підшкірно розміщають два імплантованих пристрої.
20. Спосіб за п. 18, який відрізняється тим, що імплантований пристрій залишається імплантованим пацієнту протягом тривалого періоду часу в межах від шести місяців до двох років.
21. Спосіб за п. 18, який відрізняється тим, що імплантований пристрій залишається імплантованим пацієнту протягом тривалого періоду часу в межах від шести місяців до одного року.
22. Спосіб за п. 18, який відрізняється тим, що імплантований пристрій стерилізують опроміненням.
23. Спосіб за п. 18, який відрізняється тим, що хвороба, яка є чутливою до октреотиду, розлад або симптом вибирають із переліку, який складається з акромегалії або симптомів, пов'язаних з акромегалією, симптому, пов'язаного з карциноїдною пухлиною, ВІПомою або нейроендокринною пухлиною, карциноїдного синдрому, проліферативної діабетичної ретинопатії, рожевих вугрів, панкреатиту, шлунково-кишкових кровотеч, панкреатичних і кишкових свищів, офтальмопатії Граве-Базедова, глаукоми та/або корнеальної хвороби, пов'язаної з васкуляризацією.
24. Спосіб за п. 23, який відрізняється тим, що симптом, пов'язаний з карциноїдною пухлиною, ВІПомою або нейроендокринною пухлиною, вибирають із переліку, який складається з важкої діареї, розріджених випорожнень або випадків гіперемії.
25. Набір для зменшення рівнів гормону росту (ГР) або рівнів інсуліноподібного фактора росту 1 (IGF-1) в суб'єкта, який включає:
а) композицію за будь-яким з пп. 1-17,
б) інструкцію з застосування.
Текст
Реферат: Винахід належить до фармацевтики та медицини і стосується композиції для контрольованого вивільнення октреотиду після імплантації суб'єктові, яка включає препарат, що містить октреотид, включений у гідрофільний полімер, де гідрофільний полімер, але не препарат, додатково містить вивільняючу речовину з молекулярною вагою щонайменше близько 1000 дальтон. Винахід також стосується способу зменшення рівнів ГР або рівнів IGF-1 у суб'єкта та/або лікування хвороби, яка є чутливою до октреотиду, розладу або симптому, який передбачає підшкірну імплантацію принаймні одного сухого імплантованого пристрою, та набору для нього. UA 104866 C2 (12) UA 104866 C2 UA 104866 C2 5 10 15 20 25 30 35 40 45 50 55 60 Споріднені заявки Дана заявка заявляє пріоритет попередньої заявки США 61/075625, поданої 25 червня 2008, і попередньої заявки США 61/080144, поданої 11 липня 2008. Зміст кожної із цих заявок повністю включено до опису шляхом посилання. Попередній рівень техніки Акромегалія є гормональним розладом, який відбувається в результаті того, що гіпофіз виробляє надлишкову кількість гормону росту (ГР). Найчастіше цей розлад вражає дорослих людей середнього віку й може приводити до серйозних хвороб і передчасної смерті. Коли акромегалія діагностована, вона піддається лікуванню в більшості пацієнтів, але оскільки хвороба розвивається повільно, і початок захворювання нерідко протікає без видимих симптомів, часто її неправильно діагностують. Найбільш серйозними наслідками акромегалії для здоров'я є цукровий діабет, гіпертонія та підвищений ризик розвитку серцево-судинних захворювань. Також пацієнти з акромегалією мають підвищений ризик розвитку поліпів товстої кишки, які можуть розвитися в ракове захворювання. Коли пухлини, які продукують ГР, з'являються в дитячому віці хвороба, що розвивається, називається гігантизмом, а не акромегалією. Злиття зон росту довгих кісток відбувається після статевого дозрівання (пубертатного періоду), так що розвиток надлишкового синтезу ГР у дорослих не призводить до збільшеного росту. Тривалий вплив надлишку ГР до злиття зон росту є причиною посиленого росту довгих кісток і збільшеного росту людину. Акромегалія викликається тривалим підвищеним виробленням гормону росту (ГР) гіпофізом. Гіпофіз – це невелика залоза в основі мозку, яка виробляє кілька важливих гормонів для контролю функцій організму, наприклад, росту й розвитку, розмноження й метаболізму. ГР є частиною каскаду гормонів, який, як видно з назви, регулює фізичний ріст організму. Цей каскад починається в області мозку, яка називається гіпоталамусом, у якій виробляються гормони, які регулюють роботу гіпофіза. Один з них рилізинг-фактор гормону росту (GHRH) стимулює виділення ГР у гіпофізі. Інший гіпоталамічний гормон, соматостатин, пригнічує виділення й виділення ГР. Виділення гіпофізом ГР у кров'яне русло викликає в печінці виділення іншого гормону, який називається інсуліноподібним фактором росту 1 (IGF- 1). IGF- 1 є чинником, який викликає ріст кісток і інших тканин в організмі. У свою чергу IGF- 1 подає сигнал гіпофізу знизити виділення ГР. Рівні GHRH, соматостатину, ГР і IGF- 1 в організмі тісно регулюють синтез один одного, при цьому їх рівні перебувають під впливом зовнішніх стимулів, таких як сон, фізичне навантаження, стрес, споживання їжі й рівень цукру в крові. Якщо гіпофіз виробляє ГР незалежно від нормальних регуляторних механізмів, рівень IGF- 1 підвищується, приводячи до росту кісток і збільшенню органів. Надлишок ГР також викликає зміни в метаболізмі цукру й ліпідів і може бути причиною діабету. Більш ніж в 90% пацієнтів з акромегалією збільшене виділення ГР викликається доброякісною пухлиною гіпофіза, яку називають аденомою. Ці пухлини виробляють надлишок ГР і, оскільки вони збільшуються, здавлюють навколишні тканини мозку, наприклад, зорові нерви. Збільшення пухлини викликає головний біль і зорові розлади, які часто є симптомами акромегалії. Крім того, здавлювання нормальної тканини гіпофіза може змінювати виділення інших гормонів, приводячи до змін у менструальному циклі та виділенням з молочних залоз у жінок та імпотенції в чоловіків. У деяких пацієнтів акромегалія викликається не пухлинами гіпофіза, а пухлинами підшлункової залози, легенів і надниркової залози. Ці пухлини призводять до надлишку ГР або тому, що вони самі виробляють ГР, або, частіше, тому що вони виробляють GHRH, гормон, який стимулює виділення ГР у гіпофізі. У таких пацієнтів у крові можна виявити надлишок GHRH і встановити, що причиною акромегалії не є дефект гіпофіза. Якщо ці негіпофізарні пухлини вилучити хірургічним шляхом, рівні ГР знижуються, а симптоми акромегалії послабляються. Схеми лікування акромегалії включають зниження виділення ГР до нормальних рівнів з метою ослаблення тиску, з яким зростаюча пухлина гіпофіза тисне на найближчі області мозку, з метою збереження нормальної функції гіпофіза й для того, щоб анулювати або поліпшити симптоми акромегалії. Методи лікування включають хірургічне видалення пухлини, лікування лікарськими засобами й променеву терапію гіпофіза. Показано, що октреотид є ефективним при лікуванні акромегалії. Звичайно рівні ГР знижуються в межах двох годин після підшкірної ін'єкції октреотиду. Октреотид викликає зниження рівнів ГР і IGF-1 у більшості пацієнтів, при нормалізації рівнів IGF- 1 приблизно в 60% пацієнтів, включаючи поліпшення біохімічних симптомів (біохімічну ремісію). Незабаром після початку лікування октреотидом більшість пацієнтів відзначає явне полегшення симптомів акромегалії, включаючи головний біль, болі в суглобах і потовиділення. Октреотид у цей час ® існує у вигляді препарату Сандостатин LAR Depot, який після розчинення є суспензію 1 UA 104866 C2 ® 5 10 15 20 25 30 35 40 45 50 55 60 мікросфер, що містить ацетат октреотиду. Сандостатин LAR Depot є єдиним препаратом, рекомендованим для тривалої підтримуючої терапії пацієнтів з акромегалією. Він також показаний для тривалого лікування важкої діареї й випадків гіперемії, пов'язаних з метастазуючими карциноїдними пухлинами, і рясної водної діареї, пов'язаної з VIP® секретуючими пухлинами (Vip-вазоактивний інтестинальний пептид). Сандостатин LAR Depot вводять шляхом внутрішньом'язових ін'єкцій кожні чотири тижні після періоду титрування. Октреотиду ацетат також існує у вигляді композиції зі швидким вивільненням, розчину для ® ін'єкцій Сандостатин , який необхідно вводити три рази на день. У пацієнтів, у яких не виникає значного зниження рівнів ГР у відповідь на періодичні ін'єкції октреотиду, більш часте дозування октреотиду може давати в результаті сильнішу клінічну відповідь. Октреотид можна вводити пацієнтам зі стійкою акромегалією безперервно за допомогою підшкірної помпи, щоб запобігти виділенню ГР між ін'єкціями. Враховуючи ефективність октреотиду для лікування акромегалії й відсутність композиції октреотиду й способу лікування з контрольованим вивільненням, існує необхідність у композиціях і способах доставки, які можуть доставляти октреотид протягом деякого періоду часу з контрольованою швидкістю, щоб уникнути труднощів, які мають пацієнти, наприклад, багаторазових періодичних ін'єкцій. Існує також очевидна необхідність у композиціях і способах доставки, які можуть доставляти октреотид протягом деякого періоду часу з контрольованою швидкістю для ефективного лікування інших розладів і станів і/або пов'язаних з ними симптомів, включаючи стани й розлади, які характеризуються або пов'язані з підвищеними рівнями ГР і IGF-1. Розкриття винаходу Даний винахід у цілому відноситься до октреотидних фармацевтичних композицій, які можна застосовувати для лікування індивідуумів, уражених гормональними порушеннями. Описані тут композиції передбачають контрольоване вивільнення одного або більше активних речовин, наприклад, октреотиду. Варіанти здійснення, описані тут, ґрунтуються на несподіваному відкритті, що октреотид може вивільнятися з контрольованою швидкістю при використанні імплантованого пристрою. Композиції й способи, описані тут, пропонують терапевтично ефективну кількість октреотиду протягом тривалого періоду часу, наприклад, близько двох місяців, близько шести місяців і аж до двох років. Один варіант здійснення відноситься до композиції для контрольованого вивільнення октреотиду після імплантації суб'єктові, яка містить препарат, в основному зв'язаний з гідрофільним полімером, обраним з поміж полімерів на основі поліуретану й полімерів на основі метакрилату, у якій препарат містить октреотид, при цьому композиція є ефективною для забезпечення вивільнення октреотиду зі швидкістю приблизно від 30 мкг до близько 800 мкг на день протягом приблизно шести місяців in vivo, і в якій гідрофільний полімер, але не препарат, додатково містить вивільняючу речовину (речовину, яка сприяє вивільненню) з молекулярною вагою, щонайменше, близько 1000 Дальтон. У наступному варіанті здійснення вивільняюча речовина, є неіоногенною поверхнево-активною речовиною, наприклад, гідрофільним «хвостом» поліетиленгліколю й ліпофільною «головою». В іншому варіанті здійснення, вивільняючу речовину вибирають із групи, яка складається з Brij 35 (поліоксиетиленлауриловий ефір), поліоксиетилен(20)сорбітантриолеату, Твіну 20, Твіну 80, вітаміну E TPGS і суміші будьяких двох або більше з поміж них. В іншому варіанті здійснення вивільняюча речовина має молекулярну вагу, щонайменше, близько 1200 Дальтон. У наступному варіанті здійснення 2 гідрофільний полімер має зовнішню площу поверхні близько 350 мм або більше, наприклад, 2 2 приблизно від 350 мм до 1500 мм . У наступному варіанті здійснення композиція забезпечує вивільнення октреотиду із середньою швидкістю в межах приблизно від 75 мкг на день до 300 мкг на день in vivo. У наступному варіанті здійснення октреотид є ацетатом октреотиду. У наступному варіанті здійснення гідрофільний полімер містить суміш 2- гідроксиетилметакрилату й гідроксипропілметакрилату. У наступному варіанті здійснення композиція забезпечує in vivo середню величину Css приблизно від 0,1 нг/мл до 9 нг/мл октреотиду в суб'єкта. У наступному варіанті здійснення композиція забезпечує in vivo середню величину Css приблизно від 1 нг/мл до 4 нг/мл октреотиду в суб'єкта. У наступному варіанті здійснення препарат містить приблизно від 40 мг до 120 мг октреотиду, наприклад, близько 50 мг ацетату октреотиду, близько 85 мг ацетату октреотиду. У наступному варіанті здійснення гідрофільний полімер містить суміш приблизно 20% 2- гідроксиетилметакрилату й близько 80% гідроксипропілметакрилату. У наступному варіанті здійснення гідрофільний полімер містить суміш приблизно 40% 2гідроксиетилметакрилату й близько 60% гідроксипропілметакрилату. У наступному варіанті здійснення препарат додатково включає ексципієнт, обраний із групи, яка складається зі стеарату магнію, стеаринової кислоти, рослинного стеарину, тальку й двоокису кремнію. У 2 UA 104866 C2 5 10 15 20 25 30 35 40 45 50 55 60 наступному варіанті здійснення препарат додатково включає сполуку, обрану із групи, яка складається з гідроксипропілцелюлози, гідроксиетилцелюлози, метилцелюлози, натрій карбоксиметилцелюлози, модифікованого крохмалю й зшитого полівініл-піролідону. У наступному варіанті здійснення гідрофільний полімер містить полімер на основі поліуретану. Інший варіант здійснення відноситься до способу зниження рівнів ГР або рівнів IGF- 1 у суб'єкта й/або лікування хвороби, чутливої до октреотиду, розладу або симптому, наприклад, акромегалії або симптомів, пов'язаних з акромегалією, симптомів, пов'язаних з карциноїдною пухлиною, ВІПоми або нейроендокринної пухлини, карциноїдного синдрому, проліферативної діабетичної ретинопатії, рожевих вугрів (розацеа), панкреатиту, шлунково-кишкової кровотечі, панкреатичних і кишкових свищів, офтальмопатії Граве-Базедова, глаукоми й/або хвороби роговиці, пов'язаної з васкуляризацією, спосіб, який передбачає підшкірне імплантування, щонайменше, одного сухого імплантованого пристрою, який містить препарат, укладений у гідрофільний полімер, при цьому препарат містить октреотид, і в якому гідрофільний полімер, але не препарат, додатково містить вивільняючу речовину, має молекулярну вагу, щонайменше, 1000, наприклад, вітамін E TPGS. У наступному варіанті здійснення препарат містить приблизно від 40 мг до 120 мг октреотиду ацетату. У наступному варіанті здійснення підшкірно розміщають два імплантованих пристрої. У наступному варіанті здійснення імплантований пристрій залишається імплантованим у пацієнта протягом безперервного періоду часу, у межах приблизно від шести місяців до двох років. У наступному варіанті здійснення імплантований пристрій залишається імплантованим у пацієнта протягом безперервного періоду часу, у межах приблизно від шести місяців до одного року. У наступному варіанті здійснення імплантований пристрій стерилізують опроміненням. В окремих варіантах здійснення композиції й способи використовуються для лікування, наприклад, важкої діареї, розріджених випорожнень, випадків гіперемії й/або астми. Ще один варіант здійснення відноситься до набору, який містить кожну з описаних тут композицій. Набір може додатково містити матеріали й інструкції, необхідні для імплантації й застосування композиції. Короткий опис креслень Фіг. 1 - графік, який демонструє лінійну залежність між рівноважною вологістю (EWC) і масовим процентним вмістом одиниць гідроксипропілметакрилату (HPMA) у поперечно зв'язаних HEMA/HPMA полімерах при максимальному стані гідратації. Фіг. 2 - графік, який демонструє вивільнення октреотиду з імплантованої композиції. Фіг. 3 - графік, який демонструє вивільнення октреотиду з імплантованої композиції. Фіг. 4 - графік, який демонструє вивільнення октреотиду із шести різних імплантованих композицій. Фіг. 5 - графік, який демонструє вивільнення октреотиду з різних імплантованих композицій. Фіг. 6 - графік, який ілюструє рівні октреотиду й IGF- 1 у сироватці у здорового собаки з імплантованою октреотидною композицією. Фіг. 7 - графік, який ілюструє рівні октреотиду й IGF-1 у сироватці в групі із трьох здорових собак з імплантованою октреотидною композицією протягом шестимісячного періоду. Фіг. 8 - графік, який ілюструє рівні октреотиду в сироватці й IGF- 1 у сироватці в групі із трьох здорових собак із двома імплантованими октреотидними композиціями протягом шестимісячного періоду. Фіг. 9A і 9B - графіки, які ілюструють рівні IGF- 1 у сироватці й відсоток зміни в одинадцяти людей з акромегалією з імплантованої октреотидної композицією протягом шести місяців. Фіг. 10 - графік, який ілюструє рівні октреотиду в сироватці в одинадцяти людей з акромегалією з імплантованої октреотидної композицією протягом шести місяців. Фіг. 11 - графік, який ілюструє рівні октреотиду в сироватці у двох собак з імплантованої октреотидної композицією протягом шести місяців. Фіг. 12 - графік, який ілюструє рівні IGF- 1 у сироватці у двох собак з імплантованою октреотидною композицією протягом шести місяців. Фіг. 13 - графік, який показує рівні октреотиду в сироватці після доставки гідратованим імплантатом і сухим імплантатом (див. також Таблицю 6). Фіг. 14 - графік, який показує рівні октреотиду після доставки гідратованим імплантатом і сухим імплантатом (див. також Таблицю 6). Фіг. 15A і 15B - графіки, які показують рівень гормону росту після доставки октреотиду гідратованим і сухим імплантатами (ГР концентрація, верхня панель; % ГР зниження, нижня панель). Фіг. 16A і 16B - графіки, які демонструють рівень IGF- 1 після доставки октреотиду гідратованим і сухим імплантатами (IGF- 1 концентрація, верхня панель; середнє квадратичне 3 UA 104866 C2 5 10 15 20 25 30 35 40 45 50 55 60 відхилення, нижня панель). Фіг. 17A і 17B - графіки, які демонструють рівень IGF- 1 після доставки октреотиду гідратованим і сухим імплантатами (обидві панелі показують значення даних дослідження, виражені як відсоток від нормальних рівнів IGF- 1). Докладний опис винаходу Перед тем як будуть описані дані композиції й способи, слід уточнити, що вони не обмежуються конкретними описаними молекулами, композиціями, методиками або протоколами, оскільки вони можуть варіювати. Також повинно бути зрозумілим, що термінологія, яка використовується в описі, служить тільки з метою опису окремих варіантів або способів здійснення й не покликана обмежувати рамки даного винаходу, які будуть обмежуватися тільки прикладеними пунктами формули винаходу. Терміни, які використовуються у описі, мають загальновизнані й відомі фахівцям у даній галузі техніки значення, однак для зручності й повноти конкретні терміни і їх значення викладені нижче. Форми однини включають також форми множини, якщо контекст явно не передбачає іншого. Якщо не зазначено інакше, усі технічні й наукові терміни, які використовуються у описі, мають ті ж самі значення, які звичайно є зрозумілими пересічному фахівцеві в даній галузі техніки. Хоча будь-які способи й матеріали, подібні або еквівалентні до описаних тут, можуть бути використані на практиці або при випробуванні варіантів здійснення, описаних тут, кращими способами, пристроями й матеріалами є описані в даному описі. Усі публікації, які згадуються в описі, включені як посилання, за умови, що вони підтверджують даний винахід. У цьому документі ніщо не слід розглядати як визнання, що винахід є таким, що не має права передбачати таке розкриття виходячи із попереднього винаходу. При використанні в описі терміну «близько (приблизно)», він означає плюс або мінус 10% числового значення числа, разом з яким термін використовується. Наприклад, близько 50% означає в межах 40%-60%. «Композиція з контрольованим вивільненням» відноситься до композиції, створеної для того, щоб постійно вивільняти заздалегідь установлену, терапевтично ефективну кількість лікарського засобу або активної речовини, такої як поліпептид або синтетична сполука, протягом тривалого періоду часу, при цьому результатом буде зменшення числа впливів, необхідних для досягнення бажаного терапевтичного ефекту. Як описано в цьому документі, контрольована композиція зменшує число впливів, необхідних для досягнення бажаного ефекту щодо знижених рівнів гормону росту (ГР) або знижених рівнів IGF-1, або полегшення симптомів, пов'язаних з акромегалією, включаючи, але не обмежуючись цим, анормальний ріст. Композиції з контрольованим вивільненням забезпечують бажаний фармакокінетичний профіль у суб'єкта, при цьому бажано вивільнення активної речовини починається практично безпосередньо після розміщення в навколишнє середовище для доставки, з наступним стабільним, тривалим, бажано нульового порядку, практично нульового порядку або майже нульового порядку вивільненням активної речовини. При використанні в описі терміну «контрольоване вивільнення», він включає заздалегідь установлене, постійне вивільнення активної речовини з лікарської форми з такою швидкістю, що в крові зберігається терапевтично доцільний рівень активної речовини нижчий від токсичних рівнів протягом періоду часу, наприклад, щонайменше, близько двох місяців, близько шести місяців або більше (наприклад, приблизно до двох років). Терміни «пацієнт» і «суб'єкт» позначають усіх тварин, включаючи людей. Приклади пацієнтів або суб'єктів включають людей, корів, собак, кішок, кіз, овець і свиней. Термін «фармацевтично прийнятні солі, складні ефіри, аміди й проліки» при використанні в описі відносяться до тих карбоксилатних солей, солей приєднання амінокислоти, складних ефірів, амідів і проліків сполук даного винаходу, які, за результатами ретельної клінічної перевірки, є придатним для застосування в контакті із тканинами пацієнтів без надмірної токсичності, подразнення, алергійної відповіді й тому подібного. Їхнє застосування відповідає прийнятному співвідношенню користь/ризик і є ефективним для передбаченого використання. Цвіттеріонні форми також можуть бути використаними в міру можливості. Сполуки, описані тут, можуть існувати, наприклад, у несольватованій і сольватованій формах з фармацевтично прийнятними розчинниками, такими як, наприклад, вода, етанол і таке інше. Загалом, сольватовані форми вважаються еквівалентними несольватованим формам для цілей даного винаходу. Термін «проліки» відноситься до сполук, які швидко трансформуються in vivo з одержанням споріднених сполук вищенаведеної формули, наприклад, шляхом гідролізу в крові. Обговорення надане в роботах T. Higuchi and V. Stella, “Pro-drugs as Novel Delivery Systems,” Vol. 14 °F the A.C.S. Symposium Series, and in Bioreversible Carriers in Drug Design, ed. Edward B. Roche, 4 UA 104866 C2 5 10 15 20 25 30 35 40 American Pharmaceutical Association and Pergamon Press, 1987, які повністю включено до опису як посилання. Термін «солі» відноситься до відносно нетоксичних неорганічних і органічних солей приєднання кислоти сполук даного винаходу. Ці солі можна одержати in situ під час остаточного виділення й очищення сполук або за допомогою окремої реакції очищеної сполуки у формі її вільної основи з придатною органічною або неорганічною кислотою й виділення солі, утвореної в такий спосіб. Типові приклади солей включають ацетат, гідробромід, гідрохлорид, сульфат, бісульфат, нітрат, ацетат, оксалат, валерат, олеат, пальмітат, стеарат, лаурат, борат, бензоат, лактат, фосфат, тозилат, цитрат, малеат, фумарат, сукцинат, тартрат, нафтилат, мезилат, глюкогептонат, лактобіонат і лаурилсульфонат і тому подібні солі. Вони можуть включати катіони на базі лужних і луго-земельних металів, такі як натрій, літій, калій, кальцій, магній і тому подібні, а також нетоксичний амоній, тетраметиламоній, тетраетиламоній, метиламін, диметиламін, триметиламін, триетиламін, етиламін і тому подібні (дивися, наприклад, S. M. Barge et al., «Pharmaceutical Salts,» J. Pharm. Sci., 1977, 66:1-19, яку повністю включено до опису як посилання). «Лікування» відноситься до введення лікарського засобу або виконання медичних процедур відносно пацієнта або з метою профілактики (запобігання) або для лікування хвороби або розладу у випадку, коли пацієнт хворий. «Терапевтично ефективна кількість» є кількістю, достатньою для зниження, запобігання або полегшення симптомів, пов'язаних з медичним станом. У контексті гормональної терапії це також може означати кількість, достатню для нормалізації функцій організму або рівнів гормонів при хворобах або розладах. Наприклад, терапевтично ефективна кількість композиції октреотиду з контрольованим вивільненням – це заздалегідь визначена кількість, розрахована для досягнення бажаного ефекту, наприклад, для ефективного зниження рівнів ГР або IGF- 1 у пацієнта. Даний винахід може використовуватися для лікування різних гормональних порушень, включаючи, наприклад, акромегалію й гігантизм, або інших хвороб або розладів, які ефективно лікуються, наприклад, за допомогою октреотиду. Акромегалія характеризується цілим рядом клінічних ознак, включаючи збільшення кистей рук і стоп, змін обличчя, включаючи виступаючі лобові бугри, збільшену щелепу й збільшені зубні проміжки, артралгію, підвищене потовиділення, апное під час сну, гіпертонію, цукровий діабет і гіпертрофічну кардіоміопатію. Пухлини, які викликають акромегалію, часто є причиною місцевого анатомічного здавлювання, приводячи, наприклад, до порушення полів зору, головного болю, гіпопітуітаризму й паралічу черепно-мозкових нервів. У пацієнтів з акромегалією спостерігається збільшення рівня смертності у два-п'ять разів, головним чином внаслідок серцево-судинних хвороб і порушень мозкового кровообігу. Також спостерігається підвищений рівень утворення злоякісних пухлин, пов'язаних з акромегалією, при цьому рак товстої кишки є самим типовим. Октреотид є октапептид з наступної амінокислотною послідовністю: L-цистеїнамід, Dфенілаланіл-L-цистеініл–L-фенілаланіл-D-триптофіл-L-лізил-L-треоніл-N-[2-гідрокси-1(гідроксиметил)пропіл]-, циклічний (2 → 7)-дисульфід; [R--(R*,R*)]. Структура октреотиду показана нижче. NH2 S H N N H O O O O H N H2 N H N N H O O S N 45 50 H N N H OH H3 C OH O OH H3 C Octreotide Октреотид Октреотид інгібує ГР, глюкагон і інсулін. Він також пригнічує LН-відповідь на GnRH, інгібує вивільнення гастрину, зменшує вісцеральний струмінь крові й інгібує вивільнення серотоніну, секретину, мотиліну, вазоактивного інтестинального пептиду й панкреатичного поліпептиду. Октреотид також інгібує TSH (тиреотропний гормон). Внаслідок цього, октреотид можна застосовувати для лікування цілого ряду станів і симптомів, включаючи, наприклад, акромегалію, діабет, важку діарею й випадки гіперемії, пов'язані з карциноїдними пухлинами, ВІПоми (аденоми, які секретують вазоактивний інтестинальний пептид) і нейроендокринні 5 UA 104866 C2 5 10 15 20 25 30 35 40 45 50 55 пухлини, зокрема, рідкі випорожнення, пов'язані з ВІПомами, і крім того, його можна використовувати при лікуванні симптомів, пов'язаних з хіміотерапією й СНІДом. Октреотид також використовується для лікування цілого ряду інших станів, таких як, наприклад, проліферативна діабетична ретинопатія (Palii, S. et al., Expert Opin. Investig. Drugs, 16:73-82, 2007), рожеві вугри (Piérard-Franchimont, C. et al., Dermatology, 206:249-251, 2003), панкреатит, шлунково-кишкові кровотечі, панкреатичні й кишкові свищі, офтальмопатія Граве-Базедова, глаукома й корнеальна хвороба, пов'язана з васкуляризацією (Pawlikowski, M. and MelenMucha, G., Neuro. Endocrinol. Lett., 24:21-27, 2003). Хімічна формула - C49H66N10O10S2, а його молекулярна вага становить 1019,3 Да. Його терапевтичний клас - шлунковий антисекреторний засіб. Октреотид відповідно до даного винаходу може існувати, наприклад, у вільній формі, у формі солі або у формі комплексів. Солі приєднання кислоти можуть утворюватися, наприклад, з органічними кислотами, полімерними кислотами й неорганічними кислотами. Наприклад, солі приєднання кислоти включають гідрохлориди й ацетати. Наприклад, комплекси утворюються з октреотиду після додавання неорганічних речовин, наприклад, неорганічних солей або гідроксидів, таких як, наприклад, Ca, Zn і ацетатні солі й/або після додавання полімерних органічних речовин. Варіанти здійснення пропонують пристрої для доставки лікарського засобу, який може досягати наступних цілей: вивільнення з контрольованою швидкістю (швидкість вивільнення нульового або практично нульового порядку) з метою максимально збільшити терапевтичні ефекти й звести до мінімуму небажані побічні явища; зручний спосіб видалення пристрою, якщо необхідно закінчити лікування; і збільшення біодосяжності при меншій зміні абсорбції й без пресистемного метаболізму. Фармацевтична композиція з контрольованим вивільненням, яка містить ацетат октреотиду може бути частиною пристрою для контрольованого вивільнення з гідрогелем або пристрою з гідрофільним полімером. Композиція запропонована даним винаходом здатна забезпечити після введення пацієнтові профіль вивільнення октреотиду, яке триває протягом, щонайменше, близько двох місяців, бажано, щонайменше, близько шести місяців або більше, наприклад, приблизно до одного року, або приблизно до двох років. Октреотид може утримуватися в гідрогелі, наприклад, при цьому композиція вивільняє терапевтично ефективну кількість октреотиду протягом тривалого періоду часу. Гідрогель може містити гідрофільний полімер, такий як, наприклад, полімери на основі метакрилату, полімери на основі поліуретану та їх комбінації. Терапевтично ефективна кількість – це кількість октреотиду, бажано ацетату октреотиду, яка при введенні пацієнтові або суб'єктові, поліпшує один або більш симптомів акромегалії. Композиція може додатково включати фармацевтично прийнятні ексципієнти (допоміжні засоби). При введенні пацієнтові композицій запронованих даним винаходом вивільнення октреотиду, яке, наприклад, визначається як концентрація октреотиду в плазмі пацієнта протягом часу (профіль вивільнення), може тривати протягом періоду часу, щонайменше, близько двох місяців, близько шести місяців, приблизно до одного року, щонайменше, близько 12 місяців або одного року й/або приблизно до двох років. Композиції забезпечують середнє значення концентрації ( при стані рівноваги) октреотиду в плазмі в пацієнта (людини) від близько 0,1 нг/мл до близько 9 нг/мл, від близько 0,5 нг/мл до близько 1 нг/мл, від близько 1 до близько 2 нг/мл, від близько 0,5 нг/мл до близько 2 нг/мл, від близько 1,2 до близько 1,6 нг/мл або від близько 0,8 нг/мл до близько 1,8 нг/мл. Стан рівноваги – це положення, при якому кількість лікарського засобу, уведеного протягом інтервалу дозування дорівнює кількості лікарського засобу, який видаляється (з організму) протягом того ж самого проміжку часу. Гідрофільний імплантат, який містить октреотидну композицію, може бути сформований з такого ксерогелю, який легко абсорбує воду. У гідратованому стані ксерогель називається гідрогелем. У будь-якій формі, гідратованій або негідратованій, він є біосумісним і нетоксичним для хазяїна й небіодеградує. Він набрякає у воді, при цьому не розчиняється у воді. Коли гідрогель досягає максимального рівня гідратації, вміст води в гідрогелі називається «рівноважною вологістю» (EWC). Відсоток вмісту води в гідрогелі (будь-який стан гідратації) визначається, як зазначено далі: вага гідрогелю вага сухого полімеру (ксерогелю ) 100 вагагідрог елю Гідрогель може бути гомогенним гомополімером або співполімером, які мають визначене значення EWC, утвореним шляхом полімеризації суміші етиленненасиченого мономера A і етиленненасиченого мономера B, наприклад, 2-гідроксиетилметакрилату (HEMA) і гідроксипропілметакрилату (HPMA). Визначене значення EWC можна обчислити шляхом визначення значень EWC гомополімера гідрогелю гідрофільного мономера A (гомополімер A) і 6 UA 104866 C2 5 10 15 20 гомополімера гідрогелю гідрофільного мономера B (гомополімер B); установлення залежності значень EWC гомогенних співполімерів AB від хімічної композиції зазначених співполімерів AB; підбору наміченого значення EWC і визначення хімічної композиції співполімеру AB, який має намічене значення EWC; утворення здатної до полімеризації суміші мономера A і мономера B у кількостях, достатніх для одержання співполімеру AB, який має намічене значення EWC; і впливу реакції полімеризації на вихід співполімеру AB, який характеризується наміченим значенням EWC. При використанні в описі терміну «співполімер AB» або «співполімер AB, який складається в основному з одиниць мономера A і одиниць мономера B», він означає, що додаткова співполімеризація мономера A і мономера B була здійснена за рахунок полімеризованого етиленового зв'язку мономерів. У порядку ілюстрації, якщо мономер A є 2гідроксиетилметакрилатом, а мономер B є N- метилакриламідом, співполімер AB містить повторювані одиниці мономера A і повторювані одиниці мономера B. Якщо контекст не вказує інакше, термін «співполімер» включає полімери, отримані шляхом полімеризації суміші, щонайменше, двох етиленненасичених мономерів. При використанні в описі терміну «HEMA одиниця(і)», він відноситься до структури, яка повторюється в полімері, отриманому шляхом полімеризації гідрофільного матеріалу, який містить 2-гідроксиетилметакрилат («HEMA»). Під терміном «HEMA одиниця(і)» мають на увазі структуру: При використанні в описі терміну «HPMA одиниця(і)», він відноситься до структури, отриманої шляхом полімеризації гідрофільного матеріалу, який містить гідроксипропілметакрилат («HPMA»). Під терміном «HPMA одиниця(і)» мають на увазі структуру: CH3 C CH2 C= O O 25 30 35 40 C3H6OH Рідкий полімеризований матеріал, придатний для гідрофільних продуктів включає цілий ряд полімеризованих гідрофільних, етилен ненасичених сполук, зокрема, гідрофільних мономерів, таких як, наприклад, складний моноефір акрилової кислоти або метакрилової кислоти з полігідроксисполукою, що мають здатну до етерифікації гідроксильну групу й, щонайменше, одну додаткову гідроксильну групу, такі як, наприклад, моноалкилен і поліалкиленполіолі метакрилової кислоти й акрилової кислоти, наприклад, 2-гідроксиетилметакрилат і акрилат, диетиленглікольметакрилат і акрилат, пропіленглікольметакрилат і акрилат, дипропіленглікольметакрилат і акрилат, гліцидилметакрилат і акрилат, гліцерилметакрилат і акрилат тощо; 2-алкенаміди, наприклад, акриламід, метакриламід тощо; N-алкіл і N, N-диалкіл-заміщені акриламіди й метакриламіди, такі як N-метилметакриламід, N, N-диметилметакриламід і таке інше; N-вінілпіролідон; алкіл-заміщені N-вінілпіролідони, наприклад, метил-заміщений Nвінілпіролідон; N-вінілкапролактам; алкіл-заміщений N-вінілкапролактам, наприклад, N-вініл-2метилкапролактам, N-вініл-3,5-диметилкапролактам тощо. Акрилову й метакрилову кислоту також можна використовувати в цих композиціях. У реакції полімеризації використовують суміші гідрофільних мономерів. Тип і співвідношення мономерів підбирають, так, щоб одержати гомогенний полімер, бажано зшитий гомогенний полімер, який після гідратації має потрібне значення EWC для передбаченого застосування або використання. Це значення може бути заздалегідь установлене шляхом одержання ряду співполімерів з використанням різних співвідношень мономерів, наприклад, сумішей HEMA і 7 UA 104866 C2 5 10 15 20 25 30 35 40 45 50 55 60 HPMA у різних кількісних співвідношеннях, установлення значення EWC співполімерів, і побудови залежності %HPMA (або %HEMA) одиниць у співполімерах HPMA/HEMA від вагового відсотка EWC співполімерів (Фіг. 1). У деяких випадках полімеризація певної гідрофільної суміші мономерів дає в результаті гомогенні гідрофільні співполімери, які розчиняються ( у різному ступені) у водному середовищі. У таких випадках невелика кількість, наприклад, до трьох відсотків, співполімеризованого поліетиленненасиченого зшиваючого агента, може бути включеною в мономерну суміш, щоб одержати гомогенні зшиті співполімери, які є нерозчинними у воді, а також набрякають воді. Слабко зшиті гомополімери HEMA можуть мати значення EWC, наприклад, близько 38%. Зшиті співполімери HEMA і HPMA мають значення EWC нижче приблизно 38%. З іншого боку, зшиті співполімери HEMA і акриламіду показують значення EWC вище 38% (вага/об'єм), наприклад, починаючи приблизно з 75 % і вище. Отже, залежно від придатної або ефективної швидкості виділення (елюювання) активної сполуки, наприклад, лікарського засобу, яка потрібна від системи доставки з гідрогелем для конкретного застосування, фахівець у даній галузі техніки, дотримуючись ідей, розкритих в описі, може створювати співполімерні гідрогелеві мембрани, які б вивільняли лікарський засіб з бажаною швидкістю. Співполімери наприклад, можуть містити, приблизно від 15% до 70% (ваги) одиниць HEMA і приблизно від 85 до 30 % (ваги) одиниць другого етиленового мономера й мати визначені значення EWC у межах приблизно від 20% до 75%, бажано близько 25%. Гомогенні співполімери можуть включати співполімери, зроблені з гідрофільних мономерних сумішей, які містять приблизно від 60% HPMA ( за вагою) і приблизно від 20% HEMA ( за вагою). Наприклад, гомогенні співполімери можуть включати співполімери, зроблені з гідрофільних мономерних сумішей, які містять близько 60% HPMA ( за вагою) і близько 40 % HEMA ( за вагою), або які утримують близько 80 % HPMA ( за вагою) і близько 20 % HEMA ( за вагою). У додаткових варіантах здійснення суміш може додатково містити невелика кількість поліетиленненасиченого зшиваючого агента, наприклад, триметилолпропан триметакрилату («TMPTMA»). Деякі варіанти здійснення включають гомогенні гідрофільні співполімери з гомогенною полімерною структурою, утвореною шляхом полімеризації суміші гідрофільних мономерів; і пристрій для доставки лікарського засобу, який використовує в системі доставки гомогенні полімерні картриджі. Полімеризація суміші гідрофільних мономерів і гідрофобних мономерів дає гетерогенні полімери. Коли в полімері присутні гідрофобні сегменти, міжфазна вільна енергія збільшується, таким чином, збільшуючи адсорбцію протеїнів і мінералізацію після імплантації у тварини. Наприклад, було визначено, що гідрогелі поліHEMA мають міжфазну вільну енергію близьку до нуля. Згідно з інтерпретацією міжфазної вільної енергії, гідрогелі строго гідрофільних компонентів є біосумісними із тканинами організму. Слабко зшитий поліHEMA є гомогенним гідрофільний «гомополімером» (не беручи до уваги відносно невеликі кількості полімеризованого зшиваючого агента, у ньому) з відносно постійними характеристиками або значеннями. Методи зміни «гомополімера» поліHEMA для надання йому додаткових характеристик або властивостей є важкими, трудомісткими й нерідко приводять до мінливих властивостей. З іншого боку, суміші HEMA з різними кількостями іншого полімеризованого гідрофільного співполімеру(ів) можна полімеризувати із одержанням визначених гомогенних гідрофільних співполімерів, які мають (заздалегідь визначені) задані властивості. Придатні зшиваючі агенти, які можна вводити в полімеризоване реакційне середовище, включають, наприклад, поліетиленненасичені сполуки, які мають щонайменше два місця полімеризації етилену, такі як ди-, три- і тетра-етиленненасичені сполуки, зокрема триненасичені зшиваючі агенти, з/ без ди-ненасиченими зшиваючими сполуками, наприклад, дивінілбензол, етиленгліколь диметакрилат і диакрилат, пропіленгліколь диметакрилат і диакрилат; і складні ефіри ди-, три- і тетра-акрилату або метакрилату наступних поліолів: триетаноламіну, гліцеролу, пентаеритритолу, 1,1,1триметилолпропану та інших. Реакція полімеризації може бути проведена в масі (in bulk) або з інертним розчинником. Придатні розчинники включають, наприклад, воду; органічні розчинники (наприклад, водорозчинні нижчі аліфатичні одноатомні спирти, а також багатоатомні спирти, наприклад, гліколь, гліцерин, диоксан і т.ін.; та їх суміші). Сполуки, придатні для каталізу полімеризованих етиленненасичених сполук, включають вільнорадикальні сполуки й/або каталізатори типу, який широко використовується в полімеризації вінілу, такі як органічні перекиси, перкарбонати, перекиси водню й сульфати лужних металів. Наочні приклади включають, але не обмежуються цим, гідроперекис кумолу, тбутил-гідропероксид, перекис бензоілу, біс(4-т-бутилциклогексил)-пероксидикарбонат, перекис водню, 2,4- дихлорбензоїл-пероксид, ацетил-пероксид, ди-н-пропіл-пероксидикарбонат, ди-тбутилпероксид, ди-втор-бутил-пероксидкарбонат, сульфат амонію, сульфат калію й сульфат 8 UA 104866 C2 5 10 15 20 25 30 35 40 45 50 55 60 натрію. В одному варіанті здійснення каталізатор є ефективним за помірно низької температури, такої як, наприклад, близько 20-80ºC (наприклад, трет-бутил-пероктоат, перекис бензоїлу й ди(втор-бутил)пероксидикарбонат). Також можна застосовувати традиційний каталізатор окисно-відновної полімеризації. Полімеризацію етиленових сполук можна здійснити за допомогою опромінення, наприклад, ультрафіолетом, рентгенівськими променями, гама-випромінюванням, мікрохвильовими або іншими відомими видами радіації. Прикладом каталізатора для обробки ультрафіолетом є метиловий ефір бензоїну. Каталізатори й/або ініціатори й/або опромінення використовуються в каталітично ефективній кількості для оптимізації реакції полімеризації. Деякі варіанти здійснення фокусуються на застосуванні полімерів на основі поліуретану, термопластиків або термозатвердіваючих (термореактивних) пластиків, для створення імплантованих пристроїв для доставки біологічно активних сполук з контрольованою швидкістю вивільнення протягом тривалого періоду часу. Поліуретанові полімери можуть бути перетворені на циліндричні порожні трубки з одним або двома відкритими кінцями за допомогою екструзії, (реакційно)-литого формування, формування пресуванням або відцентровим литтям (Патенти США № 5,266,325 і 5,292,515, повністю включені до опису як посилання), залежно від типу поліуретану, який використовується. Термопластичний поліуретан може бути оброблений за допомогою екструзії, литого пресування або формування пресуванням. Термозатвердіваючий поліуретан може бути оброблений за допомогою реакційно-литого формування, формування пресуванням або відцентровим литтям. Розміри циліндричної порожньої трубки задаються й можуть бути точно відрегульованими. Полімери на основі поліуретану синтезують із багатофункціональних поліолів, ізоціанатів і подовжувачів ланцюгів. Характеристики кожного поліуретану можуть бути пояснені його структурою. Термопластичні поліуретани виготовляють із макродиолів, диізоціанатів і дифункціональних подовжувачів ланцюгів (Патенти США № 4,523,005 і 5,254,662, повністю включені до опису як посилання). Макродіоли складають м'які домени. Диізоціанати й подовжувачі ланцюгів складають тверді домени. Тверді домени служать фізичними місцями зшивання для полімерів. Зміна співвідношення цих двох доменів може змінити фізичні характеристики поліуретанів. Термозатвердіваючі поліуретани можна зробити з багатофункціональних (більше, ніж дифункціональних) поліолів і/або ізоціанатів і/або подовжувачів ланцюгів (Патенти США № 4,386,039 і 4,131,604, повністю включені до опису як посилання). Термозатвердіваючі поліуретани також можна отримати шляхом уведення ненасичених зв'язків до полімерних ланцюгів та відповідних крос-лінкерів (зшивачів) і/або ініціаторів, щоб одержати хімічну «зшивку» (Патент США № 4,751,133, повністю включений до опису як посилання). За допомогою контролювання кількостімісць зшивання й того, як вони розподіляються, можна контролювати швидкості вивільнення активних речовин. У поліуретанові полімерні ланцюги можуть бути введені різні функціональні групи за допомогою модифікації кістяків поліолів залежно від бажаних властивостей. Коли пристрій використовується для доставки водорозчинних лікарських засобів, у поліоли вводять гідрофільні бічні групи, такі як іонна, карбоксильна, ефірна й гідроксигрупа, щоб збільшити гідрофільність полімеру (патенти США № 4,743,673 і 5,354,835, повністю включені до опису як посилання). Коли пристрій використовується для доставки гідрофобних лікарських засобів, у поліолі вводять гідрофобні бічні групи, такі як алкільні, силоксанові групи, щоб збільшити гідрофобність полімеру (патент США № 6,313,254, повністю включений до опису як посилання). Швидкості вивільнення активних речовин також можна контролювати за допомогою гідрофільності / гідрофобності полімерів поліуретану. У полімер імплантованого пристрою, описаного тут, необов'язково включають одну або більше вивільняючих речовин. Для варіантів здійснення, у яких картридж виготовляється за допомогою пресування, наприклад, один або більше вивільняючих засобів необов'язково присутні в полімерній матриці картриджа, щоб сприяти видаленню картриджа із прес-форми. Вивільняючі речовини, загалом, є сполуками, здатними забезпечити ефективне вивільнення формованого виробу із прес-форми. Для пристроїв, описаних тут, вивільняючу речовину зазвичай поєднують із полімеризованим реакційним середовищем до введення полімеризованого матеріалу в прес-форму. Вивільняючі речовини, придатні для використання в імплантованих пристроях, безпечні для введення пацієнтові, не реагують несприятливо з полімером формованого виробу, наприклад, викликаючи ослаблення структури виробу, і необов'язково захищають полімерний картридж від несприятливих ефектів стерилізації. Не зв'язуючи себе теорією, уважаємо, що вивільняючі 9 UA 104866 C2 5 10 15 20 25 30 речовини високомолекулярної ваги забезпечують поліпшені характеристики вивільнення у порівнянні з характеристиками, наданими вивільняючими засобами з більш низькою молекулярною вагою. Вивільняючі речовини відповідно можуть мати молекулярну вагу (МВ) більшу, ніж близько 1000. В інших варіантах здійснення вивільняючі речовини, мають МВ більшу, чим близько 1200, від близько 1000 до близько 2000, або приблизно між 1200 і 1800. Придатні вивільняючі речовини, включають неіоногенні поверхнево-активні речовини. У деяких варіантах здійснення, наприклад вивільняюча речовина, є вітаміном E TPGS. Вітамін E TPGS – це скорочення, яке позначає D-токоферил (Вітамін E)-поліетиленгліколь(1000)сукцинат. Неіоногенні поверхнево-активні вивільняючі речовини, забезпечують відмінні характеристики вивільнення й не реагують із формованим виробом, забезпечуючи профіль безпеки, тобто придатні для імплантатів. Ці, вивільняючі речовини додатково можуть діяти як антиоксиданти або «уловлювачі» вільних радикалів і, отже, запобігати або знижувати несприятливі впливи на формований виріб, пов'язані зі стерилізацією формованого виробу, особливо методів стерилізації, які можуть генерувати вільні радикали, включаючи методи опромінення. В окремих варіантах здійснення вивільняюча речовина, розчиняється в бажаній суміші мономерів. Гідрофільний мономерний матеріал, такий як, наприклад комбінації HEMA, HPMA і HBMA, може бути використаний у комбінації з амфифільною вивільняючою речовиною, такою як, наприклад, вітамін E TPGS, протягом процесу пресування. Неіоногенні поверхнево-активні речовини є відомими в даній галузі техніки й, як правило, можуть складатися з гідрофільного «хвоста» поліетиленгліколю й ліпофільної «голови». Для вітаміну E TPGS, наприклад, ліпофільною «головою» є токоферол сукцинат, а для Тритону X100 – це ізооктилфенільна група. Неіоногенні поверхнево-активні речовини можна охарактеризувати за допомогою декількох параметрів, таких як, наприклад, гідрофільноліпофільний баланс (HLB), який співвідносить розмір «хвоста» поліетиленгліколю з ліпофільною «головою»; критична концентрація міцел (CMC), яка є концентрацією поверхнево-активної речовини, при якій формуються міцели; і MW, який описує розмір гідрофільних і ліпофільних частин у порівнянні з іншими поверхнево-активними речовинами зі подібними властивостями. Крім того, CMC є показником поверхневої активності поверхнево-активної речовини, при цьому низький CMC служить ознакою більш стабільних міцел внаслідок більш сильної міцності зв'язку. У таблиці нижче перелічуються деякі поверхнево-активні речовини та їх фізичні властивості. Назва Тритон X-100 Вітамін E TPGS Тритон X-114 Brij 35 Твін 20 Твін 80 Сахарози монолаурат 35 40 45 50 ~MW 625 1513 537 1200 1228 1310 525 HLB 13.5 13 12.4 16.9 16.7 15 ~8 CMC (мM) 0.2-0.9 0.1 0.2 0.05-0.1 0.06 0.012 0.2 Додаткові, вивільняючі речовини для використання в комбінації з імплантованим пристроєм включають, але не обмежуються цим, поліоксиетилен(2) стеарил-ефір, сорбітанмонолаурат, поліоксиетилен(5) нонілфеніл-ефір, поліоксиетилен (20)сорбітантриолеат, поліоксиетилен(10) ізооктилфеніл-ефір та подібні до них, або комбінації цих вивільняючих речовин. У певних варіантах здійснення вивільняюча речовина, є поліоксиетиленовими складними ефірами жирних кислот або іншими гідрофобними сполуками. Ці сполуки відомі в даній галузі техніки й включають «хвіст» поліоксиетилена й насичену або ненасичену гідрофобну «голову». Гідрофобний фрагмент різних варіантів здійснення може включати будь-яку ароматичну групу, яка містить фрагмент, або поліциклічні ароматичні фрагменти, такі як, наприклад, фенол, катехол, резорцин, гідрохінон, токоферол, вітамін E і таке інше, і може бути ізопреноїдом або не-ізопреноїдом. Бічні ланцюги, пов'язані із цими ароматичними фрагментами, можуть бути будь-якої довжини й можуть додатково включати будь-яке число подвійних зв'язків і/або заміщень. Наприклад, неіоногенні поверхнево-активні речовини, можуть включати, але, не обмежуючись цим, природні або комерційно виготовлені токофероли, включаючи будь-яку ізоформу, рацемат або хімічно модифіковане похідне, таке як, вітамін E TPGS. Токофероли можуть включати продукти окиснення токоферолів, такі як продукти окиснення α- токоферолу, токоферол хінони, токоферол гідрохінони, епокситокофероли й нітротокофероли. Невеликі імплантати циліндричної форми можуть містити усередині своєї серцевини октреотид, наприклад, ацетат октреотиду, і необов'язково фармацевтично прийнятний носій. Товщина мембрани ( між внутрішньою й зовнішньою поверхнями) імплантату в основному є 10 UA 104866 C2 5 10 15 20 25 30 35 40 45 50 55 однаковою й служить бар'єром, який обмежує швидкість вивільнення утримуваного засобу. Такі імплантати можуть бути пластифікованими або гідратованими і їх можна перетворити на вироби іншої геометричної форми для різних медичних застосувань. У виробництві композиції для імплантації враховується декілька факторів. Визначається профіль вивільнення (час затримки, швидкість вивільнення й тривалість); визначається гідрофільний полімерний матеріал; і вимірюється здатність активної речовини дифундувати крізь нього ( як мембрана, яка обмежує швидкість). Профіль гідратації мембрани, яка обмежує швидкість, для даної активної речовини може бути легко визначений шляхом виготовлення плівки обраного полімеру й проведення на ній дослідження дифузії з використанням двокамерного вертикального скляного гнізда, яке відоме в даній галузі техніки. Визначаються коефіцієнт дифузії та вміст води, при яких починається дифузія (нижче яких, як правило, дифузії не відбувається - надалі «% Hd»). З різних полімерів виготовляють партію мембран. Потім мембрани гідратують відповідно до їхньої ємності й вимірюють значення EWC. Повністю гідратовані мембрани поміщають у двокамерні, вертикальні скляні гнізда для вимірювання, і будують графік дифузії макромолекулярної композиції через матеріали мембран за різних значень EWC. EWC найбільше гідратованої мембрани, крізь яку дифузія не відбувається (наприклад, ніяка кількість активної речовини не дифундує в приймаюче гніздо), є % Hd для системи, що перевіряється. При цьому можна побудувати графік кривої проникності проти EWC. Результати проникності (коефіцієнти дифузії) одержують відповідно до першого закону дифузії Фіка за допомогою рівняння: dQ APC d dt 1 у якому dQ/dt - це потік крізь матеріал мембрани (мкг/годину, виміряється як нахил лінійної 2 частини кривої сукупного переносу проти часу; у якому A - площа мембрани (см ); у якому P 2 коефіцієнт проникності мембрани (см /годину), або DКd, де D - дифузійна здатність мембрани 2 (см /годину), і Kd - коефіцієнт розділення для системи мембрана/донорний розчин; у якому 1 товщина мембрани, при вимірюванні наприкінці експерименту (см); і де Cd - концентрація 3 донорного розчину (мкг/см ). Потім може бути визначений профіль затримки вивільнення. Можна виготовити іншу партію полімерних мембран, знову змінюючи кількості крос-лінкерів і мономерів. Потім ці мембрани гідратують, але тільки частково, наприклад, до вмісту води меншого ніж або рівного % Hd. Частково гідратовані мембрани поміщають у двокамерні вертикальні скляні кювети для того, щоб провести вимірювання й побудувати графіки переносу активної сполуки крізь мембрани залежно від часу. Буферні розчини для донорної, та приймаючої кювети можна підібрати так, щоб вони контактували із частково гідратованими мембранами й додатково гідратували їх, приблизно з тією ж самою швидкістю, з якою вони будуть гідратуватися за умов навколишнього середовища для доставки. Час між початком дослідження дифузії, тобто, додаванням активної речовини в донорну кювету, і визначенням фармацевтично ефективної концентрації активної речовини в приймаючій кюветі є часом затримки вивільнення для цієї комбінації полімеру й вихідного відсотка гідратації. Щоб установити фізичні розміри пристрою циліндричної форми, визначають загальну кількість активної речовини, яка повинна доставлялися. Ця кількість визначається бажаним щоденним дозуванням і тривалістю доставки. У кращих варіантах здійснення тривалість доставки становить, щонайменше, близько 2 місяців, щонайменше, близько 6 місяців, або приблизно до двох років. Бажане щоденне дозування, наприклад, може становити приблизно від 10 до 1000 мкг октреотиду на день, приблизно від 20 до 800 мкг октреотиду на день, приблизно від 75 до 300 мкг октреотиду на день або приблизно від 30 до 300 мкг октреотиду на день. 2 Об'єм циліндричного резервуара (серцевини) пристрою циліндричної форми дорівнює Πri h, де ri - радіус резервуара, а h - його висота. Формула для рівноважного стану вивільнення із циліндра: [dQ/dt]=[2ΠhDKdСd]/[In (ro/ri)] де ro - зовнішній радіус циліндричного пристрою; і де C d - концентрація лікарського засобу в донорному розчині, тобто носії. Рівноважний стан вивільнення виходить, коли C d зберігається при насиченні. Товщина мембрани, необхідна для бажаного уповільненого вивільнення становить, отже, ro - ri. Використовувана кількість активної речовини залежить не тільки від бажаної щоденної дози, але також від числа днів, щоб рівень дози зберігався. Незважаючи на те, що ця кількість може бути обчислена емпірично, дійсна доставлена доза залежить від будь-якої взаємодії з 11 UA 104866 C2 5 10 15 20 25 30 35 40 45 50 55 60 матеріалами й носієм, якщо він застосовується в пристрої. Як тільки придатний полімер поліуретану обраний, фахівець у даній галузі техніки може визначити найкращий метод виготовлення імплантатів циліндричної форми, щоб досягтися придатних характеристик доставки, як описано тут. Для термопластичних поліуретанів, прецизійну екструзію й лите пресування можна використовувати для виготовлення порожніх трубок із двома відкритими кінцями відповідно до фізичних розмірів. Резервуар може бути завантажений без обмежень придатними композиціями, які містять активні речовини й носії, або наповнений готовими драже, щоб збільшити до межі «завантаження» активних речовин. Для закупорювання двох відкритих кінців можна використовувати дві готові кінцеві пробки. Стадію запаювання можна виконати шляхом нагрівання або застосування розчинника або будь-якими іншими способами, щоб запаяти кінці, бажано перманентно. Для термозатвердіваючих поліуретанів можна використовувати прецизійне реакційно-лите формування або відцентрове лиття, залежно від механізму затвердівання (curing mechanism). Реакційно-лите формування використовується, якщо затвердівання здійснюється шляхом нагрівання, а відцентрове лиття використовується, якщо затвердівання здійснюється за допомогою світла й/або нагрівання. Наприклад, порожні трубки з одним відкритим кінцем можна виготовити за допомогою відцентрового лиття. Порожні трубки із двома відкритими кінцями можна виготовити, наприклад, за допомогою реакційно-литого формування. Резервуар може бути завантажений тим же самим способом, як у випадку з термопластичними поліуретанами. Придатні композиції ініційованих світлом і/або ініційованих нагріванням термозатвердіваючих поліуретанів можна використовувати, щоб запломбувати відкритий кінець (to fill the open). Його обробляють світлом і/або нагріванням, у такий спосіб запечатуючи колись відкритий кінець. Заздалегідь виготовлену кінцеву пробку також можна використовувати для закупорювання відкритого кінця шляхом нанесення придатної ініційованої світлом і/або ініційованої нагріванням термозатвердіваючої композиції поліуретану на поверхню між готовою кінцевою пробкою й відкритим кінцем; пробку можна обробити світлом і/або нагріванням або будь-якими іншими способами, щоб запаяти кінці, бажано перманентно. Тверда активна речовина (і необов'язково носії) може бути спресованою у формі кульок для того, щоб збільшити до межі «завантаження» активних речовин. Зовнішня площа поверхні імплантату, наприклад, зовнішня площа поверхні полімерного картриджа або полої трубки, може змінюватися. У деяких варіантах здійснення площа поверхні 2 2 полімерного картриджа може становити приблизно від 350 мм до 1500 мм . Гідратовані імплантати й ксерогелеві (наприклад, негідратовані або сухі) імплантати мають різні розміри й, отже, різні площі поверхні. У деяких варіантах здійснення вивільняючі речовини, використовуються в ході підготовки більших пристроїв для імплантації. Ксерогелевий, 2 негідратований, або сухий імплантат, може мати площу поверхні, наприклад, близько 350 мм або більше. Альтернативно, ксерогелевий, негідратований, або сухий імплантат може мати 2 2 2 2 площу поверхні приблизно від 350 мм до 1500 мм або приблизно від 350 мм до 600 мм . 2 2 Сухий імплантат, наприклад, може мати площу поверхні від 378 мм до 660 мм . Крім того, 2 гідратований імплантат може мати площу поверхні близько 500 мм або більше. Гідратований 2 2 імплантат альтернативно може мати площу поверхні від близько 600 мм до близько 1500 мм 2 2 або від близько 600 мм до близько 800 мм . При використанні в описі термін «гідратований імплантат» відноситься до імплантатів, які мають вміст води 5% ( за вагою) або більше й, відповідно, вони є м'якими й гнучкими. При використанні в описі «сухий імплантат» відноситься до імплантатів, які є твердими й негнучкими, маючи вміст води менший, ніж 5% ( за вагою), у деяких варіантах здійснення, і менший, ніж 1% ( за вагою), в інших варіантах здійснення. Імплантовані пристрої можуть бути вставлені підшкірно людині або іншій тварині будь-якими придатними способами, відомими в даній галузі техніки, наприклад, за допомогою перфорації (для підшкірної імплантації) або за допомогою інших способів, наприклад, відкритого оперативного втручання (патент США № 5,266,325, який розкриває приклади способів і пристроїв, які можна використовувати для імплантації; повний зміст патенту США № 5,266,325 включений до опису як посилання). Імплантовані пристрої, можна вставити підшкірно людині або тварині, наприклад, за допомогою перфорації (створення отвору). Крім того, людині або тварині можна імплантувати більше, ніж один пристрій одночасно, наприклад, практично одночасно, так що кілька пристроїв є присутнім у якості імплантатів у людини або тварини. Таким чином, у деяких варіантах здійснення, щонайменше, один пристрій імплантується людині або тварині. Альтернативно, кілька пристроїв можуть бути імплантовані послідовно, так що тільки один пристрій присутній в людині або тварині в будь-який момент. Перед імплантацією, композиції, вживляння яких відбувається можна необов'язково 12 UA 104866 C2 5 10 15 20 25 30 35 40 45 50 55 60 гідратувати (насичувати водою) або «заповнювати (prime)» протягом заздалегідь встановленого періоду часу. «Заповнення» може сприяти тому, що активний інгредієнт починає проникати й просочувати стінки гідрогелю й потенційно починає вимивати гідрогель до імплантації залежно від кількості часу, протягом якого імплантат заповнюється. Заповнений імплантат починає вивільняти активний інгредієнт в основному після імплантації, і може забезпечити максимальне вивільнення лікарського засобу незабаром після імплантації. На відміну від цього, невелике «заповнення» або відсутність «заповнення» може приводити практично до відсутності вивільнення активного інгредієнта після імплантації протягом періоду часу, поки імплантат не стане гідратованим, і при цьому активний інгредієнт почне вивільнятися. Ці характеристики заповнення залежать від конкретних композицій, які використовуються. Придатні середовища для кондиціювання (зволоження) і «заповнення» вибирають залежно від типу активного інгредієнта, гідрофільного або гідрофобного. Середовища на водній основі є кращими для гідрофільних активних речовин, а середовища на олійній основі є кращими для гідрофобних активних речовин. Альтернативно, певні трансплантати не потребують «заповнення» до трансплантації. У деяких випадках «заповнення» поліпшує доставку активної речовини контрольованим способом, але в інших випадках «заповнення» до імплантації суб'єктові не впливає на доставку настільки, щоб виправдовувати додатковий час, необхідний для «заповнення» імплантату. Гідратуюча рідина, придатна для здійснення на практиці винаходу, як правило, є рідиною, яка нагадує навколишнє середовище, у яке буде вивільнятися активна сполука, наприклад, рідину організму, стерильну вода, слізну рідина, фізіологічний розчин, розчин фосфатного буфера й таке інше. Коли рідини, які відрізняються від води є придатними як гідратуючі рідини, ступінь, до якого гідратується гідрофільна мембрана, називається «вмістом води». «Заповнення» і кондиціювання пристроїв для доставки лікарських засобів стосується «завантаження» активних речовин (ліків) у полімер, який оточує резервуар, і в такий спосіб запобігає втраті активної речовини до фактичного використання імплантату. Умови, які використовуються для стадії «заповнення» і кондиціювання залежать від активної речовини, температури й середовища, у якому вони здійснюються. Умови для «заповнення» і кондиціювання можуть бути однаковими в деяких випадках. Стадія кондиціювання й «заповнення» у процесі підготовки пристроїв для доставки лікарських засобів проводиться для одержання певної швидкості вивільнення конкретного лікарського засобу. Стадія кондиціювання й «заповнення» імплантату, який містить гідрофільний лікарський засіб, може здійснюватися у водному середовищі, наприклад, у фізіологічному розчині. Для гідрофобних лікарських засобів середовище може бути середовищем, подібним до плазми, включаючи, наприклад, циклодекстрин. Стадії кондиціювання й «заповнення» здійснюють за допомогою регулювання трьох конкретні факторів, а саме температури, середовища й проміжку часу. Фахівцеві в даній галузі техніки зрозуміло, що стадія кондиціювання й «заповнення» пристрою для доставки лікарського засобу визначається середовищем, у якому міститься пристрій. Температура, яка використовується для кондиціювання й «заповнення» пристрою для доставки лікарського засобу, може змінюватися в широкому діапазоні температур, однак, у деяких варіантах здійснення використовується температура 37ºC. Період часу, який використовується для кондиціювання й «заповнення» пристроїв для доставки лікарських засобів, може змінюватися від близько години, приблизно, від 1 до 12 годин, приблизно, від 2 до 24 годин, близько, одного дня, або до декількох тижнів, наприклад, 6 тижнів, залежно від бажаної швидкості вивільнення для конкретного імплантату або лікарського засобу. Фахівцеві в даній галузі техніки буде зрозуміло, що стадії кондиціювання й «заповнення» імплантатів, коли це доречно або необхідно, існують для того, щоб оптимізувати швидкість вивільнення лікарського препарату, який утримується в імплантаті. Відповідно, більш короткий період часу, використаний на кондиціювання й «заповнення» пристрою для доставки лікарського засобу може приводити, наприклад, до більш низької швидкості вивільнення лікарського засобу в порівнянні зі схожим пристроєм для доставки лікарського засобу, який піддався більш довгій стадії кондиціювання й «заповнення». Однак, несподівано було виявлено, що без «заповнення» ефективне вивільнення відбувається протягом більш тривалого періоду часу (наприклад, 28 тижнів і більше), і було виявлено, що більш низькі концентрації активного інгредієнта в сироватці дають сприятливі ефекти. Температура на стадії кондиціювання й «заповнення» також може впливати на швидкість вивільнення, у тому розумінні, що більш низька температура приводить до більш низької 13 UA 104866 C2 5 10 15 20 25 30 35 40 45 50 55 60 швидкості вивільнення лікарського засобу, який міститься в пристрої для доставки лікарського засобу в порівнянні зі схожим пристроєм для доставки лікарського засобу, який піддався обробці за більш високої температури. Подібним чином, у випадку водних розчинів, наприклад, сольових розчинів, вміст натрію хлориду в розчині визначає швидкість вивільнення у відношенні пристрою для доставки лікарського засобу. Конкретніше, більш низький вміст натрію хлориду може приводити до більш високої швидкості вивільнення лікарського засобу у порівнянні з пристроєм для доставки лікарського засобу, який зазнав стадії кондиціювання й «заповнення», коли вміст натрію хлориду був більш високим. Для встановлення місця розташування імплантату в пристрої для доставки може бути включений рентгеноконтрастний матеріал шляхом вставляння його в резервуар або шляхом введення його в кінцеву пробку, яка буде використовуватися для запечатування картриджа. Композиція даного винаходу може містити фармацевтично прийнятний носій, який може включати, наприклад, суспендуючі середовища, розчинники, водні системи й тверді субстрати або матриці. Суспендуючі середовища й розчинники, придатні як носії, включають, наприклад, олії, такі як, наприклад, силіконова олія ( зокрема, для використання в медицині), кукурудзяна олія, касторова олія, арахісова олія й кунжутна олія; продукти конденсації касторової олії й етиленоксид; рідкі триефіри гліцерину й жирних кислот з низькою молекулярною вагою; нижчі аліфатичні спирти (алканоли); гліколі; і поліалкіленгліколі. Водні системи включають, наприклад, стерильну воду, сольовий розчин, декстрозу, декстрозу у воді або сольовому розчині й таке інше. Присутність електролітів у водних системах може сприяти зниженню розчинності макромолекулярних лікарських засобів у них. Тверді субстрати або матриці включають, наприклад, крохмаль, желатин, цукри (наприклад, глюкозу), природні камеді (наприклад, гуміарабік, альгінат натрію), модифіковані целюлози (наприклад, гідроксипропілцелюлозу, гідроксиетилцелюлозу, метилцелюлозу, натрій карбоксиметилцелюлозу), модифікований крохмаль, зшитий полівінілпіролідон і таке інше. У деяких варіантах здійснення фармацевтична композиція додатково містить приблизно від 2 % до 20 % (наприклад, близько 10%) гідроксипропілцелюлози. Носій також може містити допоміжні засоби; консервуючі, стабілізуючі, зволожуючі і емульгуючі речовини і таке інше; або інші ексципієнти, такі як, наприклад, речовини, які сприяють ковзанню (гліданти), розчинники, поверхнево-активні речовини, розріджувачі, зв'язуючі речовини, розпушувачі й/або змащувальні речовини. Наприклад, у деяких варіантах здійснення носій містить ексципієнт, такий як стеарат магнію, стеаринова кислота, рослинний стеарин, тальк або діоксид кремнію. У деяких варіантах здійснення фармацевтична композиція містить композицію ацетату октреотиду в суміші HEMA і HPMA співполімеру, наприклад, близько 20% HEMA і близько 80% HPMA. Фармацевтична композиція може містити, наприклад, приблизно від 20 до 150 міліграм октреотиду, приблизно від 40 до 120 міліграм, або приблизно від 40 до 90 міліграм октреотиду. У деяких варіантах здійснення, наприклад, фармацевтична композиція містить близько 50 міліграм октреотиду або близько 85 міліграм октреотиду. Композиція може додатково містити приблизно від 2% до близько 20% ексципієнтів. Композиція також може містити близько 10% гідроксипропілцелюлози й/або близько 2% стеарату магнію. Фармацевтична сполука може містити, наприклад, композицію приблизно з 83 мг октреотиду із сумішшю HEMA і HPMA співполімеру, наприклад, близько 40% HEMA і близько 60% HPMA. У додатковому варіанті здійснення композиція додатково містить близько 10% гідроксипропілцелюлози й 2% стеарату магнію з ацетатом октреотиду. Фармацевтична композиція також може містити композицію приблизно від 20 міліграм до 150 міліграм, приблизно від 40 до 120 міліграм або приблизно від 40 міліграм до 90 міліграм октреотиду в полімері на основі поліуретану. Пропонується спосіб лікування хвороби або розладу, або полегшення його симптомів, наприклад, спосіб лікування хвороби, пов'язаної з гормональними порушеннями, такими як гормональні порушення ГР або GF- 1, або її симптомів. Спосіб може передбачати введення октреотиду суб'єктові, який цього потребує, так що доза октреотиду, отримана суб'єктом, забезпечує рівні октреотиду в сироватці в межах від близько 0,8 нг/мл до близько 1,8 нг/мл, або при якій доза октреотиду, отримана суб'єктом, забезпечує такі рівні октреотиду в сироватці, коли показник Cmax падає нижче приблизно 1,3 нг/мл, або забезпечує рівні октреотиду в сироватці, коли показник Cmax знижується нижче приблизно 1,0 нг/мл. У деяких варіантах здійснення, щонайменше, один імплантований пристрій, описаний тут, імплантують суб'єктові, який цього потребує, при цьому пристрій доставляє октреотид суб'єктові із профілем вивільнення практично нульового порядку й протягом тривалого періоду часу, наприклад, не менше шести місяців. Пристрій може бути імплантованим підшкірно в гідратованому або сухому 14 UA 104866 C2 5 10 15 20 25 30 35 40 45 50 55 60 стані. Пристрій також може включати октреотид-вмісний препарат, розміщений у гідрофільному полімері, який може містити один або більше полімерів на основі поліуретану, або один або більш полімерів на основі метакрилату. У деяких варіантах здійснення, спостерігається затримка у вивільненні октреотиду, яка триває приблизно одного або більше днів від дати імплантації. У деяких варіантах здійснення пропонується спосіб доставки октреотиду суб'єктові, який цього потребує, із профілем вивільнення практично нульового порядку й протягом тривалого періоду часу, але не меншим, ніж близько шести місяців, спосіб, який передбачає імплантацію суб'єктові, який цього потребує, підшкірно й у сухому стані, щонайменше, одного імплантованого пристрою, який містить октреотид-вмісний препарат, розміщений у гідрофільному полімері, так що суб'єкт одержує щодня протягом, щонайменше, шестимісячного періоду, дозу октреотиду, яка є ефективною для лікування розладу або полегшує його симптоми. Дані способи також можуть передбачати введення октреотиду, за допомогою цього, наприклад, знижуючи ГР і/або IGF- 1, і зберігаючи концентрацію октреотиду в плазмі в стійкому стані між близько 0,1 нг/мл і близько 9 нг/мл протягом тривалого періоду часу, наприклад, щонайменше, близько двох місяців, близько шести місяців, приблизно до одного року, щонайменше, протягом періоду близько 12 місяців або одного року, і/або приблизно до двох років. Концентрація октреотиду в плазмі в стійкому стані може зберігатися, наприклад, приблизно, між 1 нг/мл і близько 4 нг/мл, близько 1 нг/мл і близько 2 нг/мл або від, приблизно, 1,2 нг/мл до, приблизно, 1,6 нг/мл протягом тривалого періоду часу, наприклад, щонайменше, близько двох місяців і близько шести місяців і приблизно до двох років. Гормональні розлади включають, наприклад, акромегалію. Винахід додатково відноситься до способів лікування акромегалії, які передбачають введення, щонайменше, одного імплантату, двох імплантатів, або двох або більше імплантатів, як описано тут. Кожний введений імплантат може містити приблизно від 20 до 150 міліграм октреотиду, приблизно від 40 до 90 міліграм октреотиду або близько 50 міліграм октреотиду, і вивільняти терапевтично ефективну кількість октреотиду протягом періоду, щонайменше, двох місяців, приблизно шести місяців або приблизно до двох років. Винахід додатково відноситься до способів лікування симптомів, пов'язаних з карциноїдними пухлинами, ВІПомами й нейроендокринними пухлинами, такими як, наприклад, важка діарея, рідкі випорожнення і гіперемія, і до способів лікування карциноїдного синдрому. Винахід додатково спрямований на лікування симптомів, пов'язаних з хіміотерапією й СНІДом. Карциноїдні пухлини звичайно з'являються в апендиксі, у бронхіолах, товстій кишці або тонкому кишечнику й секретують хімічні речовини, які викликають розширення кровоносних судин, такі як серотонін. Розширення кровоносних судин може обумовлювати симптоми, які звичайно спостерігаються при карциноїдних пухлинах, такі як діарея, гіперемія й астма. Залежно від гормонів і біохімічних речовин, які секретуються пухлинами, може бути присутньою деяка кількість симптомів, у сукупності відомих як карциноїдний синдром. Біохімічно, у людей з карциноїдними пухлинами є тенденція до більшого виділення серотоніну, з використанням амінокислоти триптофану як основи. Потім серотонін розщеплюється в організмі до 5гідроксиіндол-оцтової кислоти (5-HIAA), яка спостерігається в сечі таких пацієнтів. Винахід також відноситься до способів лікування розріджених випорожнень, важкої діареї й випадків гіперемії, пов'язаних з карциноїдними пухлинами, шляхом уведення імплантованої композиції октреотиду, яка вивільняє терапевтично ефективну кількість октреотиду протягом, щонайменше, близько двох місяців, близько шести місяців і приблизно до двох років. Винахід також відноситься до способів лікування стану, обраного із переліку, який складається із проліферативної діабетичної ретинопатії, рожевих вугрів, панкреатиту, шлунково-кишкової кровотечі, панкреатичних і кишкових свищів, офтальмопатії Граве-Базедова, глаукоми й хвороби роговиці, пов'язаної з васкуляризацією, спосіб, який передбачає підшкірне імплантування в сухому стані, щонайменше, одного імплантованого пристрою, який містить октреотид-вмісний препарат, розміщений у гідрофільному полімері, при цьому гідрофільний полімер, а не октреотид-вмісний препарат, додатково містить вітамін E TPGS. Композиції, описані тут, демонструють специфічний бажаний профіль вивільнення, який збільшує до максимуму терапевтичний ефект, при цьому зменшуючи до мінімуму шкідливі побічні дії імплантату. Бажаний профіль вивільнення можна описати в термінах максимальної концентрації в плазмі лікарського засобу або активної речовини (Cmax) і концентрації в плазмі лікарського засобу або активної речовини в рівноважному стані (Css). Наприклад, уведення композицій, може приводити до одержання суб'єктом дози октреотиду, яка дає в результаті такі рівні октреотиду в сироватці в суб'єкта, коли показник Cmax знижується нижче приблизно 1,3 15 UA 104866 C2 5 10 15 20 25 30 35 40 45 50 55 60 нг/мл, або дає в результаті такі рівні октреотиду в сироватці, коли Cmax знижується нижче приблизно 1,0 нг/мл. Даний винахід також відноситься до терапевтичнихкомпозицій гідрогелю й октреотиду, при яких (після імплантації) октреотид вивільняється зі швидкістю, яка забезпечує й/або підтримує значення Css приблизно від 0,1 нг/мл до 9 нг/мл, від близько 0,5 нг/мл до близько 1 нг/мл, близько 1 нг/мл і близько 4 нг/мл, від близько 1 нг/мл до близько 2 нг/мл або від близько 1,2 нг/мл до близько 1,6 нг/мл. Додатковий варіант здійснення представлений терапевтичною композицією гідрогелю й октреотиду, при якій (після імплантації) октреотид вивільняється зі швидкістю приблизно від 10 мкг до 1000 мкг на день протягом тривалого періоду часу, наприклад, приблизно від 20 мкг до 800 мкг, приблизно від 30 мкг до 800 мкг, приблизно від 75 мкг до 300 мкг на день або приблизно від 30 мкг до 300 мкг на день. Октреотид може вивільнятися протягом періоду, щонайменше, близько двох місяців, близько шести місяців, щонайменше, близько 12 місяців або одного року, або приблизно до двох років. Гідрогель може містити полімери на основі метакрилату або полімери на основі поліуретану. Інший варіант здійснення представлений композицією з контрольованим вивільненням, яка містить октреотид і гідрофільний полімер (наприклад, композиція з контрольованим вивільненням, яка містить октреотид-вмісний препарат, розміщений у гідрофільному полімері), при цьому композиція з контрольованим вивільненням є ефективною для забезпечення вивільнення октреотиду зі швидкістю приблизно від 30 мкг до близько 800 мкг на день протягом, щонайменше, близько двох місяців, близько шести місяців, близько одного року, щонайменше, 12 місяців або року, або близько двох років in vitro. У деяких варіантах здійснення доставка становить приблизно від 100 мкг до 250 мкг на день або приблизно від 100 мкг до 130 мкг на день. У додатковому варіанті здійснення гідрофільний полімер композиції забезпечує вивільнення октреотиду із середньою швидкістю близько 100 мкг на день in vitro. У деяких варіантах здійснення композиція з контрольованим вивільненням додатково містить вивільняючу речовину, має молекулярну вагу (MW), щонайменше, 1000. Гідрофільний полімер можна вибрати з поміж полімерів на основі поліуретану й полімерів на основі метакрилату. Додатковий варіант здійснення даного винаходу відноситься до композиції з контрольованим вивільненням для імплантації, яка містить октреотид-вмісний препарат, розміщений у гідрофільному полімері, такий як, наприклад, полімери на основі поліуретану й полімери на основі метакрилату, при цьому зазначена композиція з контрольованим вивільненням є ефективною для забезпечення вивільнення октреотиду зі швидкістю приблизно від 30 мкг до 800 мкг на день протягом приблизно шести місяців in vivo, при цьому гідрофільний полімер, а не октреотид-вмісний препарат, додатково містить вивільняючу речовину, має молекулярну вагу (MW), щонайменше, 1000. Ще одним варіантом здійснення даного винаходу є композиція з контрольованим вивільненням для імплантації, яка містить октреотид, при цьому композиція містить октреотид у гідрофільному полімері, і є ефективною для забезпечення вивільнення in vitro не більш, ніж приблизно 20% октреотиду з композиції після приблизно шести тижнів; і близько 60% октреотиду з композиції після приблизно шести місяців. Кількість фармацевтично прийнятного октреотиду (наприклад, різних солей, станів сольватації або його проліків), включеного у фармацевтичну композицію даного винаходу, змінюється залежно від ряду факторів, включаючи, наприклад, конкретний використаний октреотид, бажаний рівень дозування, тип і кількість використаного гідрогелю й присутності, типів і кількостей додаткових матеріалів, включених до композиції. Кількість октреотиду, або його похідних, у композиції змінюється залежно від бажаної дози для ефективної доставки лікарського засобу, молекулярної ваги й активності сполуки. Фактична кількість використаного лікарського засобу може залежати від віку пацієнта, ваги, статі, медичного стану, хвороби або будь-яких інших медичних критеріїв. Фактична кількість лікарського засобу визначається відповідно до передбачуваного медичного застосування, за допомогою методів, відомих у даній галузі техніки. Лікарську форму, створену згідно з винаходом, можна вводити, наприклад, приблизно один раз кожні шість місяців, що встановлює лікар. Октреотид може бути уведений до складу імплантату або іншої фармацевтичної композиції в кількостях приблизно від 20 міліграм до 150 міліграм, наприклад, приблизно від 40 до 120 міліграм октреотиду, приблизно від 40 до 90 міліграм октреотиду або приблизно від 50 до 85 міліграм. Для дорослих денна доза для лікування акромегалії, як правило, становить приблизно від 300 мкг до 600 мкг октреотиду зі швидким вивільненням на день (100 мкг або 200 мкг ® Сандостатину ). Кількість октреотиду в композиції може бути підібрана так, наприклад, щоб вивільнялося приблизно від 10 мкг до 1000 мкг на день протягом тривалого періоду часу, приблизно від 20 мкг до 800 мкг на день або приблизно від 30 мкг до 300 мкг на день. Такі 16 UA 104866 C2 5 10 15 20 25 30 35 40 45 50 55 60 швидкості вивільнення підтримують бажані терапевтичні рівні в крові пацієнта приблизно від 0,1 до 9 нг/мл протягом тривалого періоду часу. Пристрій з гідрогелем, у якому міститься октреотид, забезпечує контрольоване вивільнення октреотиду в плазму пацієнта. Гідрогелі, які є придатними для контролювання швидкості вивільнення октреотиду для застосування у фармацевтичних композиціях даного винаходу, включають полімери гідрофільних мономерів, включаючи, але не обмежуючись цим, HPMA, HEMA і тому подібні. Такі гідрогелі також здатні запобігати деградації або втраті октреотиду з композиції. Фармацевтична композиція може містити ацетат октреотиду в гідрофільному співполімері 2гідроксиетилметакрилату й гідроксипропілметакрилату. Співполімер фармацевтичної композиції може містити, наприклад, близько 20 % HEMA і близько 80% HPMA. Співполімер фармацевтичної композиції може альтернативно містити, наприклад, близько 40% HEMA і близько 60% HPMA. Розмір, форма й площа поверхні імплантату може бути модифікована для збільшення або зменшення швидкості вивільнення октреотиду з імплантату. Фармацевтична композиція також може включати допоміжні речовини або ексципієнти, наприклад, гліданти, розчинники, поверхнево-активні речовини, розріджувачі, зв'язувальні речовини, включаючи зв'язувальні речовини, які плавляться за низької температури, розпушувачі й/або змащувальні речовини. Розчинники збільшують швидкість розчинення октреотиду з лікарської форми й можуть працювати, збільшуючи розчинність октреотиду. Придатні розчинники включають, наприклад, органічні кислоти, такі як лимонна кислота, фумарова кислота, винна кислота, бурштинова кислота, аскорбінова кислота, оцтова кислота, яблучна кислота, глутарова кислота й адипінова кислота, які можна використовувати окремо або в комбінації. Ці речовини також можна комбінувати із солями цих кислот, наприклад, цитрат натрію з оцтовою кислотою, щоб одержати буферну систему. Інші засоби, які можуть змінювати pН мікросередовища, виходячи з розчинення й створення терапевтично ефективного профілю концентрації октреотиду в плазмі, включають солі неорганічних кислот і гідроксид магнію. Іншими речовинами, які можуть використовуватися, є поверхнево-активні речовини й інші матеріали, які підвищують розчинність. Поверхнево-активні речовини, які придатні для застосування у фармацевтичній композиції даного винаходу, включають, наприклад, лаурилсульфат натрію, поліетилен стеарати, ефіри поліетиленсорбіту й жирних кислот, поліоксиетиленові похідні касторової олії, поліоксиетилен алкілефіри, бензилбензоат, цетримід, цетиловий спирт, докузат натрію, гліцерилмоноолеат, гліцерилмоностеарат, гліцерилпальмітостеарат, лецитин, тригліцериди середнього ланцюга, моноетаноламін, олеїнову кислоту, полоксамери, полівініловий спирт і ефіри сорбіту й жирних кислот. Придатні для застосування у фармацевтичних композиціях, описаних тут, розріджувачі включають, наприклад, фармацевтично прийнятні інертні наповнювачі, такі як, наприклад, мікрокристалічна целюлоза, лактоза, сахароза, фруктоза, глюкоза, декстроза або інші цукри, двохосновний фосфат кальцію, сульфат кальцію, целюлоза, етилцелюлоза, похідні целюлози, каолін, манітол, лактитол, мальтит, ксиліт, сорбіт або інші цукрові спирти, сухий крохмаль, сахариди, декстрин, мальтодекстрин або інші полісахариди, інозитол або їх суміші. Розріджувач може бути водорозчинним розріджувачем. Приклади розріджувачів включають, наприклад: мікрокристалічну целюлозу, таку як Avicel PH112, Avicel PH101 і Avicel PH102, доступні від компанії FMC Corporation; лактозу, таку як моногідрат лактози, безводну лактозу й Фарматозу DCL 21; двохосновний фосфат кальцію, такий як Emcompress, доступний від компанії Penwest Pharmaceuticals; манітол; крохмаль; сорбітол; сахарозу; і глюкозу. Розріджувачі ретельно вибирають, щоб вони підходили для окремої композиції, звертаючи увагу на властивості стискання. Розчинник можна використовувати в кількості приблизно від 2% до 80% за вагою, наприклад, приблизно від 20 % до 50% за вагою композиції з контрольованим вивільненням. Гліданти використовуються для поліпшення плинності й пружності інгредієнтів під час обробки. Придатні гліданти включають, наприклад, колоїдний діоксид кремнію, високодисперсний оксид кремнію, який можна приготувати, наприклад, за допомогою парофазного гідролізу кремнієвої сполуки, такої як, наприклад, чотирихлористий кремній. Колоїдний діоксид кремнію є надтонким аморфним порошком, який є комерційно доступним із цілого ряду ® джерел, включаючи Cabot Corporation (під торговельної маркою Cab-O-Sil ); Degussa, Inc. (під ® торговельної маркою Aerosil ); і E.I. Dupont & Co. Колоїдний діоксид кремнію також відомий як колоїдний кремнезем, пірогенний кремнезем, слабка безводна кремнієва кислота, кремнієвий ангідрид і високодисперсний діоксид кремнію, у числі інших. В одному варіанті здійснення ® глідант містить Aerosil 200. 17 UA 104866 C2 5 10 15 20 25 30 35 40 45 50 55 60 Придатні для застосування у фармацевтичній композиції даного винаходу розпушувачі включають, наприклад, крохмалі, карбоксиметилкрохмаль натрію, кросповідон, кроскармелозу, мікрокристалічну целюлозу, гідроксипропіл целюлозу з низьким ступенем заміщення, пектини, співполімер калій метакрилату й дивінілбензолу, полі(вініловий спирт), тиламід, бікарбонат натрію, карбонат натрію, похідні крохмалю, декстрин, бета-циклодекстрин, похідні декстрину, оксид магнію, глини, бентоніт та їх суміші. Активний інгредієнт, наприклад, октреотид або його солі, можна змішувати з ексципієнтами, які є фармацевтично придатними й сумісними з активним інгредієнтом і в кількостях, придатних для застосування в терапевтичних способах, описаних тут. Як відомо фахівцям у даній галузі техніки, різні ексципієнти можна гомогенно змішати з октреотидом. Октреотид, наприклад, можна змішувати або комбінувати з ексципієнтами, такими як, але, не обмежуючись цим, мікрокристалічна целюлоза, колоїдний діоксид кремнію, лактоза, крохмаль, сорбіт, циклодекстрин та їх комбінації. Придатні для застосування у фармацевтичних композиціях даного винаходу змащувальні речовини включають речовини, які впливають на плинність порошку, який буде зазнавати стискання, включають, але не обмежуються названим, діоксид кремнію, такий як, наприклад, ® Aerosil 200, тальк, кремнезем, стеаринова кислота, стеарат магнію, стеарат кальцію, рослинний стеарин, гідрогенізовані рослинні олії, бензоат натрію, хлорид натрію, лейцин карбовакс, лаурилсульфат магнію й гліцерилмоностеарат. Додатково винахід відноситься до імплантованої лікарської форми з контрольованим вивільненням, яка включає ефективну кількість октреотиду в гідрогелі, і яка після введення пацієнтові, або як частина курсу лікування, забезпечує профіль вивільнення (терапевтично ефективного рівня октреотиду в плазмі крові), який триває протягом періоду, щонайменше, близько двох місяців, близько шести місяців або приблизно до двох років. Лікарська форма може містити один або більше фармацевтично прийнятних ексципієнтів. Лікарська форма, наприклад, може містити розріджувачі й змащувальні речовини на додачу до стандартної дози октреотиду й полімеру, що контролює швидкість. Для цієї мети придатним ексципієнтом є стеарат магнію. При використанні цих матеріалів стеарат магнію може становити приблизно від 0,5 до 5% вага/вага лікарської форми (наприклад, близько 2%), при цьому гідрогель і октреотид становлять іншу частину композиції. Іншим придатним ексципієнтом є гідроксипропілцелюлоза. При використанні гідроксипропілцелюлози вона може становити приблизно від 0,5 до 20% вага/вага лікарської форми (наприклад, близько 10%), при цьому гідрогель і октреотид становлять іншу частину композиції. В одному варіанті здійснення композиція містить і стеарат магнію й гідроксипропілцелюлозу, наприклад, близько 2% стеарату магнію й близько 10% гідроксипропілцелюлози, при цьому гідрогель і октреотид становлять іншу частину композиції. Композиції, описані тут, можна застосовувати для лікування гормональних хвороб, які характеризуються підвищеними рівнями ГР і IGF- 1, наприклад, акромегалії, шляхом уведення пацієнтові імплантованої композиції даного винаходу. Імплантат може бути введений, наприклад, приблизно кожні шість місяців, і може вивільняти терапевтично ефективну кількість октреотиду. Імплантована композиція вивільняє октреотид у пацієнта в концентрації близько мінімального терапевтично ефективного рівня, ще відносно низкою в порівнянні з максимальною концентрацією, щоб полегшити гормональний розлад і збільшити «спокійні» періоди для пацієнта протягом дня. Композиції можна вводити суб'єктові в дозі й протягом періоду, достатніх для того, щоб суб'єкт переносив дозу без прояву побічних ефектів, і згодом збільшуючи дозу активної речовини, якщо необхідно, через підібрані інтервали часу доти, поки не буде досягнута терапевтична доза для суб'єкта. Активну речовину, наприклад, можна вводити в дозі приблизно від 10 мкг до 1000 мкг, приблизно від 20 мкг до 800 мкг або приблизно від 30 мкг до 300 мкг октреотиду щодня протягом періоду, щонайменше, близько двох місяців, близько шести місяців або приблизно до двох років. Ацетат октреотиду відповідно до винаходу також є придатним для лікування симптомів, пов'язаних з карциноїдним синдромом і ВІПомами. Додаткові ознаки й варіанти здійснення даного винаходу ілюструються за допомогою наступних необмежуючих прикладів. Відомості, які підтверджують можливість здійснення винаходу Приклад 1. Швидкості вивільнення октреотиду in vitro Цей приклад ілюструє приготування імплантованих композицій октреотиду даного винаходу й вивільнення з них октреотиду in vitro. Був випробуваний ряд імплантатів для визначення стабільності й характеристик вивільнення октреотиду in vitro з гідрогелевих композицій протягом близько 22 тижнів (№ 146), 28 тижнів (№ 136) і 33 тижнів (усі інші композиції). Кожний імплантат 18 UA 104866 C2 містив близько 50 міліграм ацетату октреотиду й близько 2% стеаринової кислоти, при цьому полімерний картридж включав різні кількості HEMA і HPMA і, отже, демонстрував різні значення %EWC, як показано в Таблиці 1. Таблиця 1 Номер композиції 146 145 147 133 144 143 142 136 % HEMA 0 10 15 20 25 30 35 40 % EWC 22,9 23,4 24,4 25,2 25,6 26,1 26,6 27,6 % HPMA 99,5 89,5 84,5 79,5 74,5 69,5 64,5 59,5 Ексципієнти/Інші інгредієнти 2% стеаринової кислоти 2% стеаринової кислоти 2% стеаринової кислоти 2% стеаринової кислоти 2% стеаринової кислоти 2% стеаринової кислоти 2% стеаринової кислоти 2% стеаринової кислоти 5 10 15 20 25 30 Фіг. 2, 3 і 4 показують вивільнення октреотиду з імплантату за день для кожної композиції, показаної вище. Як показано на Фіг. 2, для композиції № 136 первинне вивільнення є відносно високим і падає відносно швидко. Як показано на Фіг. 3, для композиції № 146 швидкість первинного вивільнення є відносно низкою. Фіг. 4 представляє профіль вивільнення для композицій № 145, 147, 133, 144, 143 і 142. Як показано на Фіг. 4, швидкості первинного вивільнення демонструють гарний взаємозв'язок з %EWC, перебуваючи в межах від 20 до 450 мкг за день при %EWC від 22,9 до 27,6%. Однак, зустрічалися ускладнення у відношенні осмотичного тиску, різного в імплантаті й середовищі елюювання. Щоб стабілізувати композиції октреотиду, був розроблений ряд експериментів з використанням ексципієнтів, які могли б забезпечити кращу стабільність, виходячи із принципу «кращої гідратації». Приклад 2. Дослідження композиції в телячій сироватці Для визначення впливу осмотичного тиску на набрякання, два імплантати які відповідають Композиції № 136 і Композиції № 143, поміщали в телячу сироватку. Зокрема, були протестовані Композиція № 136, яка містить приблизно 40% HEMA і 60% HPMA, і яка містить ацетат октреотиду з 2% стеаринової кислоти, і Композиція № 143, яка містить приблизно 30% HEMA і 70% HPMA і яка містить суміш 20% PEG3300 і 80% ацетату октреотиду. Через три місяці імплантати показали нормальний стан, будучи відносно рівними (straight) і лише незначно набрякли. Приклад 3. Дослідження композиції Було видно, що імплантати, описані в Прикладі 1, внаслідок різниці осмотичного тиску значно набрякли, що призвело врешті до розриву імплантатів. Цей приклад ілюструє композиції, створені для відбору речовин, придатних для стабілізації імплантатів октреотиду. Був перевірений ряд імплантатів, щоб визначити дію ексципієнта на форму імплантату й стабільність. Кожний з полімерних картриджів складався приблизно з 28% HEMA, близько 66,5% HPMA і 5% гліцерину. Вміст складався з ацетату октреотиду з різними ексципієнтами, як показано в Таблиці 2. Таблиця 2 Зразок № 1 2 3 4 5 6 7 8 9 10 Ексципієнти/Інші інгредієнти Немає 20% PEG 3300 40% PEG 3300 2% стеаринова кислота (контроль) 10% гліколева кислота 20% полі(молочна кислота) 10% манітол 10% MCC (мікрокристалічна целюлоза) 20% MCC 10 % кунжутна олія 19 UA 104866 C2 5 10 Гідрофобні речовини, такі як кунжутна олія й MCC, відділялися в композиції й не забезпечували «кращої гідратації». Гідрофільні речовини, подібні до PEG 3300, підвищували різницю осмотичного тиску й збільшували набрякання. Добавки з низькою молекулярною вагою, подібні до манітолу й гліколевої кислоти, не забезпечували стабілізуючої дії й приводили до зменшення цілісності. Жодна із цих речовин не забезпечувала задовільної стабілізації композицій октреотиду. Приклад 4. Дослідження композиції й швидкості вивільнення октреотиду in vitro Це дослідження було проведено для оцінки стабільності октреотиду в гідрогелевих імплантатах з використанням різних ексципієнтів, як показано в Таблиці 3. Були обрані ексципієнти, які мають високу молекулярну вагу й деяку гідрофільність. Кожний імплантат був зроблений з полімерних картриджів, які складаються із 20% HEMA і близько 80% HPMA. Стежили за зовнішнім виглядом імплантатів у фізіологічному розчині й оцінювали його протягом дев'яти тижнів. Результати показано в Таблиці 3. 15 Таблиця 3 Композиція № 133 133 133 133 133 133 133 133 133 20 25 30 35 40 Ексципієнти/Інші інгердієнти 20% декстран 20% TPGS (похідне вітаміну E) 20% HEC (гідроксиетил целюлоза) 20%HPC (гідроксипропіл целюлоза) 20% альбумін 20% пектин 20% Acdisol (кроскармелоза натрію) 20% карбопол 2% SA (стеаринова кислота) - контроль Зовнішній вигляд імплантатів на 9 тижні (див. ключ нижче) 3 2 3 2 2 2 1,5 1 4 Як показано на Фіг. 5, композиція, яка містить декстран, мала найвищу швидкість елюювання. Композиції, які містять пектин, Acdisol і карбопол показали менше, чим задовільне вивільнення, після двох тижнів гідратації й дев'яти тижнів елюювання. Відповідно, бажані характеристики, включаючи, наприклад, кращий стабілізуючий ефект, комбінацію гарного елюювання й зовнішнього вигляду, були досягнуті при використанні гідроксипропілцелюлози. Приклад 5. Дослідження імплантації на здоровому собаці протягом одного місяця Цей приклад ілюструє приготування композицій даного винаходу й вивільнення з них октреотиду або його фармацевтично прийнятної солі. Здоровому собаці імплантували підшкірно один імплантат октреотиду. Композиція підшкірного імплантату з октреотидом мала вміст води 26,6% і містила 44 мг ацетату октреотиду. Швидкості вивільнення були оцінені in vitro і становили близько 500 мкг/день протягом 1 тижня, знижуючись приблизно до 300 мкг/день до 4 тижня, що стосується загального вивільнення, то воно становило близько 10 мг октреотиду протягом періоду дослідження. Імплантат вилучили через 28 днів після імплантації. Використаний у даному дослідженні імплантат мав близько 3,5 см у довжину. Зразки крові (1,5 мл) для визначення концентрації в сироватці ацетату октреотиду, IGF- 1 і ГР відбирали на 0, 17, 11, 14, 18, 21, 25 і 28 дні за допомогою пункції яремної вени без анестезії й не натще. Композиції імплантату з октреотидом були добре перенесені, споживання їжі було нормальним і не спостерігалося ненормальної поведінки. Аналіз сироватки показав пік ацетату октреотиду на 4 день і зафіксовані кількості ацетату октреотиду у всіх обмірюваних інтервалах. Концентрації IGF- 1 знижувалися після імплантації до 4 дня, потім верталися до пре-дозових рівнів до 25 дня. Рівні IGF- 1 опускалися з 40 до 90% відносно рівнів до імплантації, як видно на Фіг. 6. Приклад 6. Дослідження імплантації на шести здорових собаках протягом шести місяців Цей приклад ілюструє приготування композицій даного винаходу й вивільнення з них октреотиду або його фармацевтично прийнятних солей. Шість собак розділили на дві групи й 20 UA 104866 C2 5 10 15 20 25 30 імплантували підшкірно один або два імплантати, відповідно. Підшкірні імплантати з октреотидом мали вміст води близько 25,2% і містили близько 60 мг ацетату октреотиду. Імплантати вилучили через шість місяців після імплантації. Зразки крові (10 мл) для визначення концентрації в сироватці ацетату октреотиду, IGF- 1 і ГР відбирали один раз щодня протягом перших 7 днів після імплантації, а потім два рази на тиждень протягом трьох тижнів і потім один раз на тиждень до завершення шестимісячного періоду. За чотири дні до трансплантації були взяті вихідні зразки сироватки як контроль. Результати показують рівні октреотиду в сироватці в межах від 200 до 700 мкг/мл у собак, які одержали один імплантат, і від 400 до 1000 мкг/мл у собак, які одержали два імплантати. Рівні IGF- 1 знижувалися до 90% в обох пролікованих групах, як можна бачити на Фіг. 7 і 8. Визначення рівнів ГР у сироватці припиняли приблизно після першого місяця дослідження, тому що рівні в здорових тварин були занадто низькими, щоб можна було виявити подальше зниження. Клінічні спостереження показали, що композиція імплантату з октреотидом була добре перенесена, споживання їжі було нормальним і не спостерігалося ненормальної поведінки. Приклад 7. Дослідження імплантації на людях протягом шести місяців Цей приклад ілюструє приготування композицій даного винаходу й вивільнення з них октреотиду або його фармацевтично прийнятних солей. Було проведено шестимісячне дослідження за участю одинадцяти пацієнтів з акромегалією. Один або два імплантати були підшкірно імплантовано 11 пацієнтам з діагнозом акромегалії, яких раніше лікували комерційно доступною LAR композицією октреотиду. Рівні ГР і IGF- 1 визначалися на початку (базовий рівень) і щомісяця після цього протягом шести місяців. Кожний імплантат містив приблизно 60 мг ацетату октреотиду в співполімері з 20% HEMA і 79,5% HPMA, при значенні EWC близько 25,2%. Використані в цьому дослідженні імплантати були близько 44 мм у довжину в сухому стані й 50 мм у довжину в гідратованому стані. Діаметри імплантатів були близько 2,8 мм у сухому стані й приблизно від 3,5 до 3,6 мм у довжину в гідратованому стані. Імплантати гідратували протягом 1 тижня перед імплантацією. Нормальні значення для ГР становлять до 2,5 мг/л, незалежно від віку. Таблиця 4 ілюструє базові рівні ГР у мг/л протягом шести місяців після імплантації імплантатів з октреотидом. Пацієнт № 11 не брав участь у дослідженні, тому що не відповідав критеріям відбору. Таблиця 4 Пацієнт 001 002 003 004 005 006 007 008 009 010 012 середнє 35 Рокі в # Імплантати Rec'd 39 38 49 47 43 43 30 58 47 78 40 1 2 1 2 1 1 2 2 2 1 2 Візит 1 (ВведенСкринінг ня) ГР (мг/л) Базовий ГР (мг/л) 26 17,8 67 7,9 10,8 1,7 23,3 1,9 14,9 4 21,1 16,3 20,7 55 7 11 1,7 21,8 3,2 14,1 5,2 27,8 16,7 Візит 3 Візит 4 Візит 5 Візит 6 Візит 7 Візит 2 (Місяць (Місяць (Місяць (Місяць (Місяць (Місяць 2) 3) 4) 5) 6) 1) Базовий Базовий Базовий Базовий Базови Базовий ГР ГР ГР ГР й ГР ГР (мг/л) (мг/л) (мг/л) (мг/л) (мг/л) (мг/л) 0,9 1,5 1,1 1,1 1,1 2,1 1,4 0,2 0,3 0,2 0,3 0,48 2,8 3,1 3,3 5,0 5,3 5,8 2,6 3,8 2,8 3,7 4,0 2,4 2,2 1,8 2,2 1,6 2,2 1,3 1,8 2,3 1,9 1,7 1,8 1,9 2,4 2,2 2,9 2,0 1,1 0,51 0,1 0,1 2,0 0,1 0,6 0,11 1,4 0,9 1,5 1,1 1,4 1,4 0,4 0,2 0,5 0,2 0,3 1,0 13,5 13,7 14 11,9 8,9 13,1 2,7 2,7 3,0 2,6 2,7 2,7 Через шість місяців в 89% суб'єктів спостерігалися нормальні рівні гормону росту. Нормальними рівнями IGF-1, як зазначено нижче є: (i) у віці 17-24 років 180-780 нг/мл; (ii) у віці 25-39 років близько 114-400 нг/мл; (iii) у віці 40-54 років близько 90-360 нг/мл; і (iv) >54 років приблизно 70-290 нг/мл. Таблиця 5 ілюструє базові рівні IGF-1 у нг/мл протягом шести місяців після імплантації імплантатів октреотиду даного винаходу. 21 UA 104866 C2 Таблиця 5 Пацієнт Років 001 002 003 004 005 006 007 008 009 010 012 середнє 5 10 15 39 38 49 47 43 43 30 58 47 78 40 Візит 1 Візит 2 Візит 3 Візит 4 Візит 5 Візит 6 Візит 7 # Скринінг (Введен- (Місяць (Місяць (Місяць (Місяць (Місяць (Місяць ІмпланIGF-1 ня) 1) 2) 3) 4) 5) 6) тати (нг/мл) IGF-1 IGF-1 IGF-1 IGF-1 IGF-1 IGF-1 IGF-1 Rec'd (нг/мл) (нг/мл) (нг/мл) (нг/мл) (нг/мл) (нг/мл) (нг/мл) 1 1500 1500 820 600 900 880 790 750 2 1700 1300 210 180 190 170 130 230 1 1100 1200 610 550 750 660 850 660 2 1700 1800 1100 1200 1200 1100 910 990 1 1100 1000 450 510 480 600 490 430 1 520 580 470 430 440 480 440 460 2 1900 1700 440 560 560 600 430 520 2 1700 1200 220 240 170 260 160 240 2 2200 1800 590 830 950 930 1100 1100 1 590 490 270 260 230 310 220 350 2 1600 1600 1300 1500 1400 1700 1500 1400 1288 589 624 661 699 602 648 До шостого місяця в 22% суб'єктів спостерігалися нормальні рівні IGF- 1. Фіг. 9A і 9B демонструють порівняння імплантату октреотиду з комерційно доступною композицією ацетату октреотиду. Ефективність імплантату є майже такою ж, як ефективність комерційно доступної LAR композиції октреотиду. Терапевтичний ефект цих імплантатів успішно зберігався протягом повних шести місяців дослідження. Рівні IGF- 1 були зменшені у всіх пацієнтів, а нормалізація спостерігалася у двох пацієнтів. Зниження спостерігалося вже після місяця лікування, і середній рівень IGF- 1 був постійним протягом наступних п'яти місяців. Порівняння із зниженням, яке раніше спостерігався у тих же самих пацієнтів (у відповідь на лікування комерційно доступною LAR композицією октреотиду) було можливим у восьми з дев'яти пацієнтів. У шести з восьми пацієнтів відсоток зниження IGF1 під час застосування імплантату був більшим, ніж відсоток зниження у відповідь на комерційно доступну LAR композицію октреотиду, тоді як у двох пацієнтів, він був меншим. Після 6 місяців лікування за допомогою імплантату рівні ГР в 3 пацієнтів були 2×нормальний), лужної фосфатази (рівень >2×нормальний) або прямого білірубіну (рівень >1,5×нормальний); 4. Інші дані лабораторних аналізів, які розглядаються дослідником або спонсором як клінічно значимі; 5. Пацієнти з нестабільною стенокардією, стійкою аритмією шлуночка, серцевою недостатністю (NYHA III і IV) або гострим інфарктом міокарда в анамнезі в межах 3 місяців відбору; 25 UA 104866 C2 5 10 15 6. Пацієнти із симптоматичною жовчнокам'яною хворобою; 7. Пацієнти з лікарською або алкогольною залежністю в анамнезі в межах 6 місяців відбору; 8. Пацієнти, які одержували будь-який лікарський препарат, який проходить клінічні випробування в межах 1 місяця відбору; 9. Пацієнти, які одержували радіотерапію із приводу пухлини гіпофіза в будь-який час до відбору; 10. Пацієнти, які перервали лікування октреотидом через перенесення або ефективність протікання. Рівні октреотиду в сироватці визначаються для кожного пацієнта. Під час лікування кожного пацієнта перевіряли на зменшення випадків гіперемії й інших симптомів, характерних для кардиноїдного синдрому, які проявлялися в пацієнта до лікування, і обстежили на предмет зменшення середньої величини 24 годинних рівнів 5- HIAA у сечі. Незважаючи на те, що даний винахід описаний дуже докладно із посиланням на певні варіанти його здійснення, можливі інші варіанти. Тому сутність і обсяг прикладених пунктів формули винаходу не повинні обмежуватися описом і кращими варіантами, які приведені в цьому описі винаходу. ФОРМУЛА ВИНАХОДУ 20 25 30 35 40 45 50 55 1. Композиція для контрольованого вивільнення октреотиду після імплантації суб'єктові, яка включає препарат, який містить октреотид, в основному включений у гідрофільний полімер, вибраний з поміж полімерів на основі поліуретану й полімерів на основі метакрилату, яка є ефективною для забезпечення вивільнення октреотиду зі швидкістю приблизно від 30 мкг до 800 мкг на день протягом шести місяців in vivo, у якій гідрофільний полімер, але не препарат, додатково містить вивільняючу речовину з молекулярною вагою щонайменше близько 1000 дальтон, в якій препарат містить від 40 мг до 120 мг октреотиду, та вивільняючу речовину вибирають із групи, яка складається з Brij 35 (поліоксіетиленлауриловий ефір), поліоксіетилен (20) сорбітан триолеату, Твіну 20, Твіну 80, вітаміну Ε TPGS і їх суміші з будь-яких двох або більше. 2. Композиція за п. 1, яка відрізняється тим, що вивільняюча речовина, є неіоногенною поверхнево-активною речовиною. 3. Композиція за п. 2, яка відрізняється тим, що неіоногенна поверхнево-активна речовина містить гідрофільний "хвіст" поліетиленгліколю й ліпофільну "голову". 4. Композиція за п. 1, яка відрізняється тим, що вивільняюча речовина, має молекулярну вагу щонайменше близько 1200 дальтон. 5. Композиція за п. 1, яка відрізняється тим, що гідрофільний полімер має зовнішню площу 2 поверхні близько 350 мм або більше. 6. Композиція за п. 5, яка відрізняється тим, що гідрофільний полімер має зовнішню площу 2 2 поверхні в межах приблизно від 350 мм до 1500 мм . 7. Композиція за п. 1, яка відрізняється тим, що композиція забезпечує вивільнення октреотиду із середньою швидкістю в межах приблизно від 75 мкг на день до 300 мкг на день in vivo. 8. Композиція за п. 1, яка відрізняється тим, що октреотид є ацетатом октреотиду. 9. Композиція за п. 1, яка відрізняється тим, що гідрофільний полімер містить суміш із 2гідроксіетилметакрилату й гідроксипропілметакрилату. 10. Композиція за п. 7, яка відрізняється тим, що композиція забезпечує in vivo середню величину Css від 0,1 нг/мл до 9 нг/мл октреотиду в суб'єкта. 11. Композиція за п. 10, яка відрізняється тим, що композиція забезпечує in vivo середню величину Css приблизно від 1 нг/мл до 4 нг/мл октреотиду в суб'єкта. 12. Композиція за п. 1, яка відрізняється тим, що препарат містить близько 50 мг октреотиду ацетату. 13. Композиція за п. 1, яка відрізняється тим, що препарат містить близько 85 мг октреотиду ацетату. 14. Композиція за п. 9, яка відрізняється тим, що гідрофільний полімер містить суміш приблизно з 20 % 2-гідроксіетилметакрилату та близько 80 % гідроксипропілметакрилату. 15. Композиція за п. 9, яка відрізняється тим, що гідрофільний полімер містить суміш приблизно з 40 % 2-гідроксіетилметакрилату та близько 60 % гідроксипропілметакрилату. 16. Композиція за п. 1, яка відрізняється тим, що препарат додатково містить ексципієнт, вибраний із групи, яка складається зі стеарату магнію, стеаринової кислоти, рослинного стеарину, тальку й діоксиду кремнію. 26 UA 104866 C2 5 10 15 20 25 30 17. Композиція за п. 1, яка відрізняється тим, що препарат додатково містить сполуку, вибрану із групи, яка складається з гідроксипропілцелюлози, гідроксіетилцелюлози, метилцелюлози, натрійкарбоксиметилцелюлози, модифікованого крохмалю та зшитого полівінілпіролідону. 18. Спосіб зменшення рівнів ГР або рівнів IGF-1 у суб'єкта та/або лікування хвороби, яка є чутливою до октреотиду, розладу або симптому, який передбачає підшкірну імплантацію, принаймні одного сухого імплантованого пристрою, який включає препарат, що містить композицію за будь-яким з пп. 1-17. 19. Спосіб за п. 18, який відрізняється тим, що підшкірно розміщають два імплантованих пристрої. 20. Спосіб за п. 18, який відрізняється тим, що імплантований пристрій залишається імплантованим пацієнту протягом тривалого періоду часу в межах від шести місяців до двох років. 21. Спосіб за п. 18, який відрізняється тим, що імплантований пристрій залишається імплантованим пацієнту протягом тривалого періоду часу в межах від шести місяців до одного року. 22. Спосіб за п. 18, який відрізняється тим, що імплантований пристрій стерилізують опроміненням. 23. Спосіб за п. 18, який відрізняється тим, що хвороба, яка є чутливою до октреотиду, розлад або симптом вибирають із переліку, який складається з акромегалії або симптомів, пов'язаних з акромегалією, симптому, пов'язаного з карциноїдною пухлиною, ВІПомою або нейроендокринною пухлиною, карциноїдного синдрому, проліферативної діабетичної ретинопатії, рожевих вугрів, панкреатиту, шлунково-кишкових кровотеч, панкреатичних і кишкових свищів, офтальмопатії Граве-Базедова, глаукоми та/або корнеальної хвороби, пов'язаної з васкуляризацією. 24. Спосіб за п. 23, який відрізняється тим, що симптом, пов'язаний з карциноїдною пухлиною, ВІПомою або нейроендокринною пухлиною, вибирають із переліку, який складається з важкої діареї, розріджених випорожнень або випадків гіперемії. 25. Набір для зменшення рівнів гормону росту (ГР) або рівнів інсуліноподібного фактора росту 1 (IGF-1) в суб'єкта, який включає: а) композицію за будь-яким з пп. 1-17, б) інструкцію з застосування. 27 UA 104866 C2 28
ДивитисяДодаткова інформація
Назва патенту англійськоюOctreotide implant having a release agent
Автори англійськоюKuzma, Petr, Decker, Stefanie, Quandt, Harry
Автори російськоюКузма Петр
МПК / Мітки
МПК: A61M 31/00, A61P 5/08, A61K 9/00, A61K 47/34, A61K 38/08, A61K 47/32, A61K 38/31
Мітки: речовину, вивільняючу, містить, імплантат, октреотиду
Код посилання
<a href="https://ua.patents.su/43-104866-implantat-oktreotidu-yakijj-mistit-vivilnyayuchu-rechovinu.html" target="_blank" rel="follow" title="База патентів України">Імплантат октреотиду, який містить вивільняючу речовину</a>
Попередній патент: Спосіб видалення поліциклічних ароматичних вуглеводнів
Наступний патент: Похідні феноксихроманкарбонової кислоти, заміщені в 6-ому положенні
Випадковий патент: Апарат для охолодження конвертерних газів з одержанням гарячого м'якообпаленого вапна