Фармацевтична композиція, що містить як активну речовину платиновий комплекс, і спосіб її виготовлення
Формула / Реферат
1. Фармацевтична композиція, яка містить платиновий комплекс за формулою (І) як активну речовину
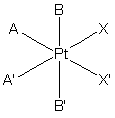 (I),
(I),
де
А і А', незалежно один від одного, являють собою NН3 групу або аміно- чи діаміногрупу, які включають від 1 до 18 атомів вуглецю,
В і В', незалежно один від одного, є атом галогену, гідроксильна група або -O-C(O)-R або -O-C(O)-R' група, де R і R', незалежно один від одного, є атом водню або атом алкілу, алкенілу, арилу, аралкілу, алкіламіну або алкоксигрупа, яка включає від 1 до 10 атомів вуглецю або функціональних похідних зазначених груп, і
Х і X', незалежно один від одного, є атом галогену або монокарбоксильна група, що містить від 1 до 20 атомів вуглецю, або
Х і X' разом утворюють дикарбоксильну групу, що містить від 2 до 20 атомів вуглецю, в суміші з щонайменше одним фармацевтично прийнятним наповнювачем, яка відрізняється тим, що утворює гранули, розмір яких не перевищує 0,5 мм, виготовлені за допомогою вологої грануляції суміші комплексної сполуки чотиривалентної платини за формулою (І), яка змочується водою, з щонайменше одним нейтральним сахаридом і щонайменше одним природним і/або модифікованим полісахаридом.
2. Фармацевтична композиція за п. 1, яка відрізняється тим, що її формують з гранул, виготовлених шляхом вологої грануляції суміші платинового комплексу за формулою (І) щонайменше одного нейтрального сахариду, вміст якого становить щонайменше 5% від ваги, і щонайменше одного природного і/або модифікованого полісахариду, вміст якого становить щонайменше 2% від ваги; завжди йдеться про загальну вагу гранул.
3. Фармацевтична композиція за п. 1 або п. 2, яка відрізняється тим, що вона містить щонайменше один фармацевтично прийнятний антиадгезивний засіб і/або щонайменше один фармацевтично прийнятний мастильний засіб.
4. Фармацевтична композиція за пп. 1-3, яка відрізняється тим, що вона містить (ОС-6-43)-біс(ацетато)-(1-адамантиламін)-амінодихлороплатиновий комплекс як активну речовину.
5. Фармацевтична композиція за одним з пп. 1-4, яка відрізняється тим, що суміш, призначена для вологої грануляції, містить лактозу, маннітол, сорбітол, фруктозу, глюкозу і/або сахарозу як нейтральний сахарид.
6. Фармацевтична композиція за одним з пп. 1-5, яка відрізняється тим, що суміш, призначена для вологої грануляції, містить кукурудзяний, пшеничний і/або картопляний крохмаль як природний і/або модифікований полісахарид.
7. Фармацевтична композиція за одним з пп. 1-6, яка відрізняється тим, що вона вміщена в капсулу або мішечок чи спресована у вигляді таблетки.
8. Фармацевтична композиція за одним з пп. 1-7, яка відрізняється тим, що поверхня гранул, капсул чи таблеток покрита шаром щонайменше однієї фармацевтично прийнятної речовини, що робить можливим ентеросольвентне розчинення активної речовини лише в кишечнику, і/або шаром щонайменше однієї фармацевтично прийнятної речовини, що робить можливим контрольоване вивільнення активної речовини.
9. Фармацевтична композиція з п. 8, яка відрізняється тим, що поверхня гранул чи таблеток ізолюється від шару щонайменше однієї фармацевтично прийнятної речовини, що робить можливим ентеросольвентне розчинення активної речовини лише в кишечнику, і/або від шару щонайменше однієї фармацевтично прийнятної речовини, що робить можливим контрольоване вивільнення активної речовини, за допомогою інертного покривного шару, що складається з щонайменше одного нейтрального сахариду, наприклад, сахарози, і/або щонайменше одного природного і/або модифікованого полісахариду, наприклад, природного або модифікованого кукурудзяного, пшеничного або картопляного крохмалю чи желатину або гуміарабіку, причому вага інертного покривного шару не перевищує 15% від ваги, стосовно загальної ваги гранули чи таблетки.
10. Фармацевтична композиція за пп. 8 або 9, яка відрізняється тим, що шар щонайменше однієї фармацевтично прийнятної речовини, яка робить можливим контрольоване вивільнення активної речовини, утворений етилцелюлозою і/або метакриловою кислотою і/або її сполуками, переважно полімерами і/або співполімерами метакрилової кислоти, причому вага зазначеного шару становить не більше ніж 40% від ваги, якщо йдеться про вагу гранули, капсули чи таблетки.
11. Фармацевтична композиція за одним з пп. 8-10, яка відрізняється тим, що шар щонайменше однієї фармацевтично прийнятної речовини, яка забезпечує ентеросольвентне розчинення активної речовини лише в кишечнику, утворений ацетатцелюлозою і/або ацетилфталатцелюлозою, і/або ацетосукцинатцелюлозою, і/або гідроксипропілметилфталатцелюлозою, і/або гідроксипропілметилсукцинатцелюлозою, і/або фталатом полівінілового спирту, і/або бензофенілсаліцилатом, і/або співполімером стиролу з малеїновою кислотою, і/або шелаком, і/або метакриловою кислотою і/або її сполуками, переважно полімерами або співполімерами метакрилової кислоти, причому вага вказаного шару не перевищує 15% за вагою, стосовно ваги гранули, капсули чи таблетки.
12. Спосіб виготовлення фармацевтичної композиції за одним з пп. 1-11, який відрізняється тим, що суміш платинового комплексу за формулою (І), яку змочують водою щонайменше одного нейтрального сахариду і щонайменше одного природного і/або модифікованого полісахариду, гранулюють за вологих умов з отриманням гранул, які складаються з частинок, розмір яких менший ніж 0,5 мм.
13. Спосіб за п. 12, який відрізняється тим, що вологу грануляцію виконують для отримання гранул, що мають такий розподіл розмірів часточок, що 90 % з них менші, ніж 2,0 мм у діаметрі, і не більше 20 % часточок менші, ніж 0,09 мм.
14. Спосіб за пп. 12 або 13, який відрізняється тим, що вологу грануляцію виконують на устаткуванні, поверхні якого при контакті з гранулами суміші є інертними відносно вказаної суміші.
15. Спосіб за одним з пп. 12-14, який характеризується тим, що гранули поміщують в капсулу або мішечок або після додавання до гранул щонайменше одного антиадгезивного засобу і/або щонайменше одного мастильного засобу, пресують в таблетки.
16. Спосіб за п. 15, який характеризується тим, що поміщення в капсули або мішечки або виготовлення таблеток здійснюють на устаткуванні, поверхні якого при контакті з сумішшю, якою наповнюють капсули або мішечки, чи з сумішшю, призначеною для виготовлення таблеток, є інертними відносно вказаної суміші.
17. Спосіб за одним з пп. 12-16, який відрізняється тим, що поверхня гранул, поверхня гранул, якими заповнюють мішечки, поверхня таблеток і поверхня гранул, якими заповнюють капсули, і/або поверхня згаданих капсул, покриваються шаром з щонайменше однієї фармацевтично прийнятної речовини, яка забезпечує ентеросольвентне розчинення активної речовини лише в кишечнику, і/або шаром щонайменше однієї фармацевтично прийнятної речовини, що робить можливим контрольоване вивільнення активної речовини.
18. Спосіб за п. 17, який відрізняється тим, що поверхня гранул, поверхня гранул, якими заповнюють мішечки, поверхня гранул, якими заповнюють капсули, і поверхня таблетки, перед покриттям шаром щонайменше однієї фармацевтично прийнятної речовини, яка забезпечує ентеросольвентне розчинення активної речовини лише в кишечнику, і/або шаром щонайменше однієї фармацевтично прийнятної речовини, яка забезпечує контрольоване вивільнення активної речовини, покриваються інертним покривним шаром, утвореним щонайменше одним нейтральним сахаридом, наприклад сахарозою, і/або щонайменше одним природним і/або модифікованим полісахаридом, наприклад природним або модифікованим кукурудзяним, пшеничним або картопляним крохмалем або желатиною чи гуміарабіком.
19. Спосіб за п. 17 або п. 18, який відрізняється тим, що покриття оболонкою гранул і таблеток за допомогою інертного покривного шару, шару, утвореного щонайменше однією фармацевтично прийнятною речовиною, робить можливим ентеросольвентне розчинення активної речовини лише в кишечнику, або шару, утвореного щонайменше однією фармацевтично прийнятною речовиною, робить можливим контрольоване вивільнення активної речовин, виконують за допомогою устаткування, поверхню якого, при контакті з гранулами чи таблетками попередньо покривають матеріалом, що утворює інертний покривний шар.
Текст
1. Фармацевтична композиція, яка містить платиновий комплекс за формулою (І) як активну речовину B A X 2 (19) 1 3 80872 4 таблеток ізолюється від шару щонайменше однієї устаткуванні, поверхні якого при контакті з фармацевтично прийнятної речовини, що робить гранулами суміші є інертними відносно вказаної можливим ентеросольвентне розчинення активної суміші. речовини лише в кишечнику, і/або від шару 15. Спосіб за одним з пп. 12-14, який щонайменше однієї фармацевтично прийнятної характеризується тим, що гранули поміщують в речовини, що робить можливим контрольоване капсулу або мішечок або після додавання до вивільнення активної речовини, за допомогою гранул щонайменше одного антиадгезивного інертного покривного шару, що складається з засобу і/або щонайменше одного мастильного щонайменше одного нейтрального сахариду, засобу, пресують в таблетки. наприклад, сахарози, і/або щонайменше одного 16. Спосіб за п. 15, який характеризується тим, що природного і/або модифікованого полісахариду, поміщення в капсули або мішечки або наприклад, природного або модифікованого виготовлення таблеток здійснюють на кукурудзяного, пшеничного або картопляного устаткуванні, поверхні якого при контакті з крохмалю чи желатину або гуміарабіку, причому сумішшю, якою наповнюють капсули або мішечки, вага інертного покривного шару не перевищує 15% чи з сумішшю, призначеною для виготовлення від ваги, стосовно загальної ваги гранули чи таблеток, є інертними відносно вказаної суміші. таблетки. 17. Спосіб за одним з пп. 12-16, який 10. Фармацевтична композиція за пп. 8 або 9, яка відрізняється тим, що поверхня гранул, поверхня відрізняється тим, що шар щонайменше однієї гранул, якими заповнюють мішечки, поверхня фармацевтично прийнятної речовини, яка робить таблеток і поверхня гранул, якими заповнюють можливим контрольоване вивільнення активної капсули, і/або поверхня згаданих капсул, речовини, утворений етилцелюлозою і/або покриваються шаром з щонайменше однієї метакриловою кислотою і/або її сполуками, фармацевтично прийнятної речовини, яка переважно полімерами і/або співполімерами забезпечує ентеросольвентне розчинення метакрилової кислоти, причому вага зазначеного активної речовини лише в кишечнику, і/або шаром шару становить не більше ніж 40% від ваги, якщо щонайменше однієї фармацевтично прийнятної йдеться про вагу гранули, капсули чи таблетки. речовини, що робить можливим контрольоване 11. Фармацевтична композиція за одним з пп. 8вивільнення активної речовини. 10, яка відрізняється тим, що шар щонайменше 18. Спосіб за п. 17, який відрізняється тим, що однієї фармацевтично прийнятної речовини, яка поверхня гранул, поверхня гранул, якими забезпечує ентеросольвентне розчинення заповнюють мішечки, поверхня гранул, якими активної речовини лише в кишечнику, утворений заповнюють капсули, і поверхня таблетки, перед ацетатцелюлозою і/або ацетилфталатцелюлозою, покриттям шаром щонайменше однієї і/або ацетосукцинатцелюлозою, і/або фармацевтично прийнятної речовини, яка гідроксипропілметилфталатцелюлозою, і/або забезпечує ентеросольвентне розчинення гідроксипропілметилсукцинатцелюлозою, і/або активної речовини лише в кишечнику, і/або шаром фталатом полівінілового спирту, і/або щонайменше однієї фармацевтично прийнятної бензофенілсаліцилатом, і/або співполімером речовини, яка забезпечує контрольоване стиролу з малеїновою кислотою, і/або шелаком, вивільнення активної речовини, покриваються і/або метакриловою кислотою і/або її сполуками, інертним покривним шаром, утвореним переважно полімерами або співполімерами щонайменше одним нейтральним сахаридом, метакрилової кислоти, причому вага вказаного наприклад сахарозою, і/або щонайменше одним шару не перевищує 15% за вагою, стосовно ваги природним і/або модифікованим полісахаридом, гранули, капсули чи таблетки. наприклад природним або модифікованим 12. Спосіб виготовлення фармацевтичної кукурудзяним, пшеничним або картопляним композиції за одним з пп. 1-11, який відрізняється крохмалем або желатиною чи гуміарабіком. тим, що суміш платинового комплексу за 19. Спосіб за п. 17 або п. 18, який відрізняється формулою (І), яку змочують водою щонайменше тим, що покриття оболонкою гранул і таблеток за одного нейтрального сахариду і щонайменше допомогою інертного покривного шару, шару, одного природного і/або модифікованого утвореного щонайменше однією фармацевтично полісахариду, гранулюють за вологих умов з прийнятною речовиною, робить можливим отриманням гранул, які складаються з частинок, ентеросольвентне розчинення активної речовини розмір яких менший ніж 0,5 мм. лише в кишечнику, або шару, утвореного 13. Спосіб за п. 12, який відрізняється тим, що щонайменше однією фармацевтично прийнятною вологу грануляцію виконують для отримання речовиною, робить можливим контрольоване гранул, що мають такий розподіл розмірів вивільнення активної речовин, виконують за часточок, що 90 % з них менші, ніж 2,0 мм у допомогою устаткування, поверхню якого, при діаметрі, і не більше 20 % часточок менші, ніж 0,09 контакті з гранулами чи таблетками попередньо мм. покривають матеріалом, що утворює інертний 14. Спосіб за пп. 12 або 13, який відрізняється покривний шар. тим, що вологу грануляцію виконують на Цей винахід стосується твердої фармацевтичної композиції, яка може бути використана для лікування пухлин і містить комплексну сполуку чотирьохвалентної платини як активну речовину. Ця фармацевтична композиція забезпечує високу стійкість активної речовини і її ентеросольвентне і/або контрольоване вивільнення. Цей винахід також стосується способу виготовлення вказаної фармацевтичної композиції. Загальновідомо, що комплексні сполуки платини мають широку протипухлинну дію, яка використовується для лікування багатьох пухлинних захворювань. Комплексні сполуки двохвалентної платини, особливо цис-платина, карбоплатина або оксиплатина, використовувались до теперішнього часу в терапевтичній практиці. Ці комплексні сполуки двохвалентної платини нестійкі в кишковошлунковому тракті і/або їх абсорбція пов'язана з труднощами. Цей факт робить використання комплексних сполук двохвалентної платини в лікарській формі для перорального застосування (що є більш прийнятним для пацієнта) неможливим. Пізніше було встановлено, що деякі комплексні сполуки чотирьохвалентної платини позбавлені зазначених недоліків і зберігають свою протипухлинну активність навіть при пероральному застосуванні. Ці комплексні сполуки чотирьохвалентної платини були описані як нові хімічні сполуки для перорального застосування в [патентних документах, а саме RP 0328274, ЕР 0423707 і PCT/CZ99/00015]. Однак, комплексні сполуки чотирьохвалентної платини, як правило, майже нерозчинні у воді (близько 0.03г/100г), мають низьку насипну щільність (bulk density), що становить 0.2г/мл, низьку наливну щільність (tap density), приблизно 0.4г/мл, і надзвичайно високий електростатичний заряд. Ці фізичні властивості є істотною проблемою при виготовленні твердої фармацевтичної композиції. Крім того, комплексні сполуки чотирьохвалентної платини є хімічно нестійкими при контакті з металами або багатьма фармацевтичними наповнювачами, які зазвичай використовуються; цей факт зменшує стійкість активної речовини у фармацевтичній композиції. Ці проблеми, вказані вище, частково успішно вирішені в [патентному документі PCT/CZ99/00015], де описується приготування твердої фармацевтичної композиції комплексної сполуки чотирьохвалентної платини у формі її розчинного адукту з циклодекстринами, з наступною ліофілізацією. Тим не менше, її виготовлення є досить складним та дорогим. Крім того, вміст циклодекстрину істотно зменшує вміст платинового комплексу в аддукті, описаному вище. Є очевидним з попереднього рівня техніки, що питання виготовлення твердих фармацевтичних композицій комплексних сполук чотирьохвалентної платини, які мають хорошу стійкість і достатній вміст активних речовин, ще не було вирішено успішно. Зазначений винахід забезпечує фармацевтичну композицію, що містить комплексну сполуку платини за формулою (І) як активну речовину де А і А', незалежно один від одного, являть собою NH3 групу або аміно- чи диаміногрупу, які включають від 1 до 18 атомів вуглецю, В і В', незалежно один від одного, являють собою атом галогену, гідроксильну групу або -OC(O)-R чи -O-C(O)-R' групу, де R і R', незалежно один від одного, являють собою атом водню або алкіл, алкеніл, арил, аралкіл, алкіламін або алкоксильну групу, яка включає від 1 до 10 атомів вуглецю, або функціональні похідні згаданих груп, і X і X', незалежно один від одного, являють собою атом галогену або монокарбоксильну групу, яка включає від 1 до 20 атомів вуглецю, або X і X' разом утворюють дикарбоксильну групу, що включає від 2 до 20 атомів вуглецю, в суміші з, щонайменше, одним фармацевтично прийнятним наповнювачем, яка характеризується тим, що має вигляд грануляту з частинками, розмір яких менший, ніж 0.5мм, приготовленого шляхом вологої грануляції суміші платинового комплексу чотирьохвалентної платини за формулою (І), яка змочується водою, з, щонайменше, одним нейтральним сахаридом і, щонайменше, одним природним і/або модифікованим полісахаридом. Фармацевтична композиція відповідно до винаходу, переважно, має вигляд гранул, виготовлених шляхом вологої грануляції суміші комплексної сполуки платини за формулою (І), яка змочується водою, щонайменше, одного нейтрального сахариду, частка якого становить, принаймні, 5% від ваги, і принаймні одного природного і/або модифікованого полісахариду, частка якого становить, принаймні 2% від ваги, завжди йдеться про загальну вагу гранул. Фармацевтична композиція відповідно до винаходу, переважно, включає щонайменше один фармацевтично прийнятний антиадгезивний засіб і/або, щонайменше один, фармацевтично прийнятний мастильний засіб. Фармацевтична композиція відповідно до винаходу, переважно, включає (ОС-6-43)біс(ацетато)-(l-адамантиламін)-аміндихлорплатиновий комплекс як активну речовину. Суміш, призначена для вологої грануляції, переважно, включає лактозу, маннітол, сорбітол, фруктозу, глюкозу і /або сахарозу як нейтральний сахарид. Суміш, призначена для вологої грануляції, переважно, включає кукурудзяний, пшеничний і/або картопляний крохмаль як природний і/або модифікований полісахарид. Фармацевтична композиція відповідно до винаходу, переважно, поміщується в капсулу чи мішечок або пресується у вигляді таблеток. Поверхня гранули, капсули або таблетки, переважно, вкрита шаром щонайменше однієї фармацевтично прийнятної речовини, що 7 80872 8 забезпечує ентеросольвентне розчинення контактуванні з гранульованою сумішшю, є активної речовини лише в кишково-шлунковому інертною щодо вказаної суміші. тракті, і/або з шаром, щонайменше, однієї Гранули, переважно, вміщують в капсули або фармацевтично прийнятної речовини, що мішкоподібні структури або, після додавання забезпечує контрольоване вивільнення активної щонайменше одного антиадгезивного засобу і/або, речовини. щонайменше, одного мастильного засобу до Поверхня гранули або таблетки, переважно, гранул, пресуються в таблетки. відокремлена від шару, щонайменше, однієї Технологічну операцію наповнення капсул та фармацевтично прийнятної речовини, що мішечків і виготовлення таблеток виконують забезпечує ентеросольвентне розчинення переважно на устаткуванні, поверхні якого, активної речовини лише в кишково-шлунковому приходячи в контакт з сумішшю, призначеною для тракті і/або від шару, щонайменше, однієї наповнення капсул або мішечків, або з сумішшю, фармацевтично прийнятної речовини, що призначеною для виготовлення таблеток, є забезпечує контрольоване вивільнення активної інертними щодо вказаних сумішей. речовини, інертним покриваючим шаром, що Поверхня грануляту, поверхня гранул, якими складається, щонайменше, з одного нейтрального заповнюються мішечки, поверхня таблеток і сахариду, наприклад, сахарози, і/або, поверхня гранул, які поміщують в капсулу, і/або щонайменше, одного нативного і/або поверхня вказаної капсули, переважно модифікованого полісахариду, наприклад, покривається шаром щонайменше однієї природного або модифікованого кукурудзяного, фармацевтично прийнятної речовини, яка робить пшеничного або картопляного крохмалю, можливим ентеросольвентне розчинення активної желатину або гуміарабіку, так щоб за вагою речовини лише в кишечнику і/або шаром інертний покриваючий шар не перевищував 15%, щонайменше однієї фармацевтично прийнятної стосовно загальної ваги гранули чи таблетки. речовини, що робить можливим контрольоване Шар, щонайменше, однієї фармацевтично вивільнення активної речовини. прийнятної речовини, яка забезпечує Поверхня грануляту, поверхня гранул, якими контрольоване вивільнення активної речовини, заповнюються мішечки, поверхня гранул, які переважно, утворений етилцелюлозою і/або поміщують в капсулу, і поверхня таблетки, перед метакриловою кислотою і/або їх сполуками, покриттям шаром щонайменше однієї переважно полімерами і/або співполімерами фармацевтично прийнятної речовини, що робить метакрилової кислоти, причому вага зазначеного можливим ентеросольвентне розчинення активної шару становить не більше, ніж 40% за вагою; речовини лише в кишечнику, і/або шаром йдеться про вагу гранули, капсули чи таблетки. щонайменше однієї фармацевтично прийнятної Шар щонайменше однієї фармацевтично речовини, що робить можливим контрольоване прийнятної речовини, який забезпечує вивільнення активної речовини, переважно покриті ентеросольвентне розчинення активної речовини інертним покривним шаром, що складається лише в кишково-шлунковому тракті, переважно щонайменше з одного нейтрального сахариду, утворений ацетатцелюлозою і/або наприклад, сахарози, і/або щонайменше одного ацетилфталатцелюлозою і/або природного і/або модифікованого полісахариду, ацетосукцинатцелюлозою і/або наприклад, природного або модифікованого гідроксипропілметилфталатцелюлозою і/або кукурудзяного, пшеничного або картопляного гідроксипропілметилсукцинатцелюлозою і/або крохмалю або желатину чи гуміарабіку. фталатом полівінілового спирту і/або Покриття гранул і таблеток інертним бензофенілсаліцилатом і/або співполімером покривним шаром, шаром щонайменше з однієї стиролу з малеїновою кислотою і/або шеллаком фармацевтично прийнятної речовини робить і/або метакриловою кислотою і/або її сполуками, можливим ентеросольвентне розчинення активної переважно полімерами або співполімерами речовини лише в кишечнику, або шаром метакрилової кислоти, причому вага вказаного щонайменше однієї фармацевтично прийнятної шару не перевищує 15% від ваги, стосовно ваги речовини, що робить можливим контрольоване гранули, капсули або таблетки. вивільнення активної речовини, переважно Цей винахід стосується також способу виконується за допомогою обладнання, поверхні виготовлення фармацевтичної композиції якого, приходячи в контакт з гранулами чи відповідно до винаходу, який полягає в тому, що таблетками, попередньо покривається суміш платинового комплексу за формулою (І), що матеріалом, що утворює інертний покривний шар. змочується водою, щонайменше одного Прикладом чотирьохвалентної платини за нейтрального сахариду і щонайменше одного формулою (І) є (ОС-6-43)-біс(ацетато)-(Іприродного і/або модифікованого полісахариду адамантиламін)-амін-дихлорплатиновий комплекс гранулюється у вологих умовах з метою формули (II) отримання гранул, що мають частинки, менші, ніж 0.5мм у розмірі. Вологу грануляцію, переважно, виконують для отримання гранул, 90% яких мають розмір, менший, ніж 2.0мм, і не більше, ніж 20% яких менші, ніж 0.09мм у розмірі. Вологу грануляцію, переважно, виконують за допомогою обладнання, поверхня якого, при 9 80872 10 потребує такого захисту, тому що власне матеріал капсули ефективно захищає активну речовину від несприятливого впливу речовини, яка утворює плівку. Для того щоб захистити активну речовину від сильного кислотного середовища в шлунку і/або для того щоб перемістити зону абсорбції активної речовини нижче в кишково-шлунковому тракті і, таким чином, досягти зростання значення Тmах, гранули покривають інертним ущільнюючим шаром, і таблетки покривають інертним ущільнюючим шаром або, можливо, капсули описаний в [Заявці на патент покривають стійким до дії кислот, тобто, PCT/CZ99/00015]. ентеросольвентним покриттям, що забезпечує Було з'ясовано в рамках винаходу, що вивільнення активної речовини лише в тонкому платиновий комплекс за формулою (І) є нестійким кишечнику, тобто, в середовищі, значення рН при контакті з багатьма наповнювачами, що якого знаходиться в межах 4.5-8 відповідно до утворюють масу, такими як, наприклад, фосфати, складу ентеросольвентного покриття. сульфати- або карбонати, стандартні суспендуючі Фармацевтична композиція, виготовлена за засоби, зв'язуючі речовини і речовини, що допомогою такого способу, задовільняє вимогам утворюють плівку, наприклад, естери акрилової щодо тестування дозування лікарських форм для кислоти і їх співполімери, целюлозні похідні етерів, внутрішнього застосування, згідно з Європейською естери або низка співполімерів чи вінілових Фармакопеєю і/або Фармакопеєю США, з естерів. Було встановлено, що нейтральні внесеними поправками або змінами. сахариди, які використовуються як наповнювачі; Ацетатцелюлоза (АЦ), ацетилфталатцелюлоза природні і/або модифіковані полісахариди, які (АФЦ), ацетосукцинатцелюлоза (АСЦ), використовуються як зв'язуючі речовини, або, гідроксипропілметилфталатцелюлоза (ГПМФЦ), можливо, стеарат магнію, що використовується як гідроксипропілметилсукцинатцелюлоза (ГПМСЦ), мастильний засіб, і природні і/або модифіковані фталат полівінілового спирту (ФПС), полісахариди, що використовуються як бензофенілсаліцилат (БФС), співполімер стиролу з екстрагранулятні антиадгезивні засоби, є такими малеїновою кислотою, шелак або співполімери наповнювачами, які не порушують структуру, та з метакрилової кислоти, наприклад, Eudragit L, якими платиновий комплекс за формулою (І) є Eudragit L-55 і Eudragit S, тобто, як у вигляді їх сумісний і за їх присутності вказаний комплекс є пластифікованих водних дисперсій - Eudragit L 30 стійким. D або L-55 30 D, так і Eudragid S 30 D - або у Після цього гранули, таблетки чи капсули, які вигляді органічних або водно-спиртових розчинів було отримано, переважно, покривають Eudragit L 12.5 і Eudragit S 12.5 - чи, можливо, їх щонайменше одним шаром речовини, яка утворює суміші у різних співвідношеннях можуть бути, плівку, що забезпечує ентеросольвентне наприклад, використані як речовини, що розчинення і/або контрольоване вивільнення утворюють плівку, причому суха вага активної речовини. Через несумісність активної ентеросольвентного шару не перевищує 15% від речовини з багатьма речовинами, що утворюють ваги, переважно вона становить 8-10% від ваги, плівку, які найчастіше використовуються, гранули і йдеться про вагу гранули, капсули або таблетки. таблетки - перед покриттям вказаною речовиною, Гранули, покриті інертним ущільнюючим шаром, що утворює плівку, - переважно захищають або таблетки, покриті інертним покривним шаром, покриттям, що складається з інертного можуть також бути виготовлені в капсулах, які вже ущільнюючого шару, який захищає активну готові для внутрішнього застосування. речовину від її розкладення і дає змогу уникнути Внаслідок досліджень, проведених на собаках переміщення утворюючої плівку речовини та свинях, було встановлено, що нетривала всередину гранули або таблетки. Як матеріал для висока концентрація активної речовини в плазмі інертного ущільнюючого шару може бути спостерігається приблизно через годину після використаний нейтральний сахарид, наприклад, одноразового застосування фармацевтичної сахароза, і/або природний і/або модифікований композиції, після чого наступає її швидке полісахарид, наприклад, природний або зниження. Для того щоб досягти більш стабільних модифікований кукурудзяний, пшеничний або рівнів активної речовини в плазмі, що дає змогу картопляний крохмаль, або желатин чи гуміарабік, збільшити інтервал між окремими застосуваннями або, можливо, їх суміші у різних співвідношеннях, фармацевтичної композиції, і, у такий спосіб які можуть бути у вигляді водного або воднозменшує побічні ефекти, що виникають внаслідок спиртового гідрогелю. Цей ущільнюючий шар відносно високих і короткоефективних рівнів забезпечує захист активної речовини від активної речовини в плазмі, які мають місце після ентеросольвентного покриття і/або покриття, що застосування фармацевтичної композиції з забезпечує контрольоване вивільнення активної миттєвим вивільненням, гранули, захищені речовини. Суха вага інертного ущільнюючого шару інертним ущільнюючим шаром або таблетки, не перевищує 15% від ваги, переважно, становить захищені інертним ущільнюючим шаром або 4-12% від ваги, до уваги беруть загальну вагу капсули, можуть бути, крім того, покриті шаром, що гранули чи таблетки. Желатинова капсула не робить можливим контрольоване вивільнення 11 80872 12 активної речовини. Вивільнення активної речовини покривний шар, призначений для захисту активної з фармацевтичної композиції, що застосовується, речовини, що знаходиться в гранулі чи таблетці, як було описано вище, відбувається з двома від впливу матеріалів шарів, що забезпечують межами, А і В, що узгоджується з кількістю ентеросольвентне і/або контрольоване активної речовини, яка вивільняється протягом вивільнення активної речовини, пошкоджується часу, встановленого за допомогою аналізу протягом технологічного процесу, коли гранула чи розчинення за наступних умов, які визначені за таблетка покривається шарами, що забезпечують допомогою лопатевої мішалки згідно з ентеросольвентне або контрольоване Фармакопеєю США: Середовище розчинення: вивільнення, тоді активна речовина контактує з 0.1Μ НСІ; об'єм середовища розчинення: 900мл; металами, якщо використовується звичайне швидкість обертання лопатей: 100об./хв.; устаткування з металевими поверхнями, температура середовища розчинення: 37°С. "А" наприклад, барабанне покривне устаткування, межа в даному випадку становить 5%-25% флуїдизаційні сушарки з верхньою подачею протягом 30 хвилин, 15%-65% протягом 60 хвилин, матеріалу, вустери (wusters) або ротопроцесори. 40%- 85% протягом 120 хвилин і, щонайменше, Тим не менше, цього можна уникнути за рахунок 85% протягом 180 хвилин, в той час як "В" межа того, що поверхня устаткування, яка контактує з становить 5%-25% протягом 60 хвилин, 15%-65% фармацевтичною композицією, що протягом 180 хвилин, 40%-85% протягом 360 переробляється, покривається шаром інертного хвилин і, щонайменше, 85% протягом 720 хвилин. матеріалу, що утворює, в той же час, матеріал Етилцелюлоза (ЕЦ) або її водні дисперсії інертного ущільнюючого шару. У тому випадку, Surrelease або Aquacoat - або акрилатні якщо покриття інертним шаром, співполімери, наприклад, Eudragit NE або Eudragit ентеросольвентним шаром і/або шаром, RL або Eudragit RS, як у вигляді їх призначеним забезпечувати контрольоване пластифікованих водних дисперсій - Eudragit NE вивільнення, виконується на тому ж самому 30 D, Eudragit RD 30 D, Eudragit RL 30 D -, так і у устаткуванні, тоді поверхня вказаного вигляді їх органічних розчинів - Eudragit RS 12.5 і устаткування може бути покрита вже перед Eudragit RL 12.5 - або, можливо, їх сумішей у нанесенням інертного ущільнюючого шару. різних співвідношеннях можуть бути, наприклад, Спосіб, який застосовується для виготовлення використані як речовини, що утворюють плівку, гранул, що є основою фармацевтичної композиції для формування шару, що забезпечує згідно з винаходом, полягає у вологій грануляції, контрольоване вивільнення активної речовини, протягом якої суміш платинового комплексу за причому суха вага цього шару, що забезпечує формулою (І), разом з, щонайменше, одним контрольоване вивільнення активної речовини, не нейтральним сахаридом і, щонайменше, одним перевищує 40% від ваги, переважно вона природним і/або модифікованим полісахаридом становить 8-30% від ваги, стосовно загальної ваги змочуються водою і перемішуються у прийнятному гранули, капсули чи таблетки. міксері при прийнятній швидкості та протягом Гранули, покриті шаром для контрольованого прийнятного часу. Гранулят, який отримують вивільнення активної речовини, або таблетки, внаслідок цього, висушують або у вакуумі, або при покриті шаром для контрольованого вивільнення атмосферному тиску. Було з'ясовано, що активної речовини, можуть також бути виготовлені швидкість розчинення грануляту опосередковано безпосередньо в капсулах, які вже готові для пропорційна розміру окремих гранул, і, таким внутрішнього застосування або можуть бути чином, гранули, переважно, подрібнюють, для того додатково покриті ентеросольвентним шаром. щоб досягти такого розподілу розмірів часточок, Неочікувано виявилось, що протягом приготування щоб 90% з них були меншими, ніж 2.0мм, і не вологого грануляту фармацевтичної композиції більше, ніж 20% часточок біли меншими, ніж згідно з винаходом було встановлено, що на 0.09мм. Подрібнення, як вказано вище, виконують, поверхні металів, з яких, як правило, виготовлене наприклад, за допомогою кульового млинка або фармацевтичне технологічне устаткування, вручну чи автоматизованим розтиранням в призначене для переробки і виробництва твердих порошок у прийнятних пристроях. фармацевтичних композицій, відбуваються Устаткування, призначене для виготовлення зворотні хімічні реакції. Цей факт робить гранул в капсулах, або прес для виготовлення неможливим використання стандартних технологій таблеток, призначений для пресування гранул в виробництва, таких як, наприклад, пресування в таблетки, повинні бути інертними щодо гранул, процесі виробництва гранул або виготовлення згаданих вище, при контакті з поверхнями, як вже таблеток, без необхідної обробки поверхні форм. було згадано вище. У зв'язку з цим, вологі гранули фармацевтичної Фармацевтична композиція згідно винаходу композиції, згідно з винаходом, повинні, відрізняється тим, що вона має хорошу стійкість переважно, бути виготовлені за допомогою при температурі 40°С і відносній вологості 75%; устаткування, поверхні якого, приходячи в контакт підтвердженням цього є той факт, що протягом 6 із гранульованою сумішшю, є інертними щодо місяців не було відмічено відносне зростання вказаної суміші. Скло, фарфор, тефлон або емаль домішок, яке б перевищувало 2% від ваги, і що зарекомендували себе як прийнятні інертні вміст будь-якої невідомої конкретної домішки не матеріали. перевищував 0.1% від ваги, якщо йдеться про вагу Якщо гранула чи таблетка не покрита вихідного платинового комплексу за формулою інертним ущільнюючим шаром, або якщо гранула (II), після закінчення вказаного часу. Не було чи таблетка, покрита вказаним шаром, а інертний відмічено зростання вмісту відомої домішки 13 80872 14 платинового комплексу за формулою (II), який є Спосіб заповнення грануляту фармацевтичної (ацетато)-(І-адамантиламін)-амінкомпозиції платинового комплексу за формулою трихлорплатиновий комплекс, що має формулу (II), виготовленої відповідно до Прикладу 1. [PtCI3 (ас) (am) (NH3)]. - гранулятом, отриманим відповідно до Винахід буде пояснений більш детально на Прикладу 1, що має насипну і наливну (tap прикладах дійсного втілення винаходу, однак density), щільність, яка варіює від 0.4г/мл до згадані приклади є лише ілюстративними і не 0.6г/мл і від 0.5г/мл до 0.7г/мл, відповідно, обмежують межі цього винаходу, що однозначно заповнюють вручну або автоматично тверді, визначені в формулі винаходу та в його описі. нормальні або ентеросольвентні желатинові Приклади капсули або капсули з Приклад 1: гідроксипропілметилцелюлози (ГПМЦ), розмір яких Композиція і спосіб виготовлення гранул, які становить 00 або 0, або спресовують у вигляді включають фармацевтичну композицію таблеток. Вага заповненої гранули становить платинового комплексу за формулою (II) 466.20мг, що відповідає 200мг активної сполуки. Вага в Прикладах наведена як частина від Приклад 5: ваги. Спосіб заповнення грануляту фармацевтичної композиції платинового комплексу за формулою (II), виготовленого відповідно до Прикладу 1. 1. Платиновий комплекс за формулою (II) 200.00 - гранулятом, отриманим відповідно до 2. Модифікований кукурудзяний крохмаль 20.00 Прикладу 1, що має насипну і наливну щільність, 3. Лактоза, моногідрат 200.00 яка варіює від 0.4г/мл до 0.6г/мл і від 0.5г/мл до 4. Модифікований кукурудзяний крохмаль 42.00 0.7г/мл, відповідно, заповнюють вручну або 5. Стеарат магнію 4.20 автоматично тверді, нормальні або ентеросольвентні желатинові капсули або капсули Методика з гідроксипропілметилцелюлози (ГПМЦ), розмір - Змішують сполуки №1-3 у високошвидкісному яких становить 0 або 1, або спресовують у вигляді міксері. таблеток. Вага заповненої гранули становить - Додають 72-84 вагових частин води. 349.65мг, що відповідає 150мг активної сполуки. - Перемішують суміш у високошвидкісному Приклад 6і міксері протягом 2 хвилин. Спосіб заповнення грануляту фармацевтичної - Висушують гранули при температурі 70°С до композиції платинового комплексу за формулою того часу, поки вміст води не становитиме 2%-4%. (II), виготовленого відповідно до Прикладу 1. - Розмелюють сухі гранули, наприклад, у - гранулятом, отриманим відповідно до вібраційному млинку до тих пір, поки 100% Прикладу 1, що має насипну і наливну щільність, частинок будуть меншими, ніж 0.5мм у розмірі. яка варіює від 0.4г/мл до 0.6г/мл ι від 0.5г/мл до - Додають сполуки №4 і 5 і перемішують в 0.7г/мл, відповідно, заповнюють вручну або кубічному міксері протягом 15 хвилин. автоматично тверді, нормальні або Приклад 2: ентеросольвентні желатинові капсули або капсули Спосіб заповнення грануляту фармацевтичної з гідроксипропілметилцелюлози (ГПМЦ), розмір композиції платинового комплексу за формулою яких становить 1 або 2, або спресовують у вигляді (II), виготовленої відповідно до Прикладу 1. таблеток. Вага заповненої гранули становить - гранулятом, отриманим відповідно до 233.10мг, що відповідає 100мг активної сполуки. Прикладу 1, що має насипну і наливну щільність Приклад 7: (tap density), яка варіює від 0.4г/мл до 0.6г/мл і від Спосіб заповнення грануляту фармацевтичної 0.5г/мл до 0.7г/мл, відповідно, заповнюють вручну композиції платинового комплексу за формулою або автоматично тверді, нормальні або (II), виготовленого відповідно до Прикладу 1. ентеросольвентні желатинові капсули або капсули - гранулятом, отриманим відповідно до з гідроксипропілметилцелюлози (ГПМЦ), розмір Прикладу 1, що має об'ємну і нас щільність, яка яких становить 000. Вага заповненої гранули варіює від 0.4г/мл до 0.6г/мл і від 0.5г/мл до становить 815.85мг, що відповідає 350мг активної 0.7г/мл, відповідно, вручну або автоматично сполуки. заповнюють тверді, нормальні або Приклад 3: ентеросольвентні желатинові капсули або капсули Спосіб заповнення грануляту фармацевтичної з гідроксипропілметилцелюлози (ГПМЦ), розмір композиції платинового комплексу за формулою яких становить 2 або 3, або спресуйте у вигляді (II), виготовленої відповідно до Прикладу 1. таблеток. Вага заповненої гранули становить - гранулятом, отриманим відповідно до 174.825мг, що відповідає 75мг активної сполуки. Прикладу 1, що має насипну і наливну щільність, Приклад 8: яка варіює від 0.4г/мл до 0.6г/мл і від 0.5г/мл до Спосіб заповнення грануляту фармацевтичної 0.7г/мл, відповідно, заповнюють вручну або композиції платинового комплексу за формулою автоматично тверді, нормальні або (II), виготовленого відповідно до Прикладу 1. ентеросольвентні желатинові капсули або капсули - гранулятом, отриманим відповідно до з гідроксипропілметилцелюлози (ГПМЦ), розмір Прикладу 1, що має насипну і наливну щільність, яких становить 00 або 000, або спресовують у яка варіює від 0.4г/мл до 0.6г/мл і від 0.5г/мл до вигляді таблеток. Вага заповненої гранули 0.7г/мл, відповідно, вручну або автоматично становить 582.75мг, що відповідає 250мг активної заповнюють тверді, нормальні або сполуки. ентеросольвентні желатинові капсули або капсули Приклад 4: 15 80872 16 з гідроксипропілметилцелюлози (ГПМЦ), розмір ентеросольвентні желатинові капсули або капсули яких становить 3 або 4, або спресовують у вигляді з гідроксипропілметилцелюлози (ГПМЦ), розмір таблеток. Вага наповнених гранул становить яких становить 00 або 0, або спресуйте в 116.55мг, що відповідає 50мг активної сполуки. таблетки. Вага наповнених гранул становить Приклад 9: 466.20мг, що відповідає 200мг активної сполуки. Композиція і спосіб виготовлення грануляту, Приклад 13: що включає фармацевтичну композицію Спосіб заповнення грануляту фармацевтичної платинового комплексу за формулою (II) композиції платинового комплексу за формулою Вага у Прикладах наведена як частини від (II), виготовленого відповідно до Прикладу 9. ваги. - гранулятом, отриманим відповідно до Прикладу 9, що має насипну і наливну щільність, яка варіює від 0.4г/мл до 0.7г/мл і від 0.5г/мл до 1 Платиновий комплекс за формулою (II) 20000 0.8г/мл, відповідно, заповнюють вручну або 2. Модифікований кукурудзяний крохмаль 62.00 автоматично тверді, нормальні або 3. Моногідрат лактози 200.00 ентеросольвентні желатинові капсули або капсули 4. Модифікований кукурудзяний крохмаль 4.20 з гідроксипропілметилцелюлози (ГПМЦ), розмір яких становить від 0 до 2 або пресують в таблетки. Методика Вага наповнених гранул становить 349.65мг, що - Змішують сполуки №1-3 у високошвидкісному відповідає 150мг активної сполуки. міксері. Приклад 14: - Додають 80-120 вагових частин води. Спосіб заповнення грануляту фармацевтичної - Перемішують суміш у високошвидкісному композиції платинового комплексу за формулою міксері протягом 2 хвилин. (II), виготовленого відповідно до Прикладу 9. - Висушують гранули при температурі 70°С до - гранулятом, отриманим відповідно до того часу, поки вміст води не становитиме 2%-4%. Прикладу 9, що має насипну і наливну щільність, - Розмелюють сухі гранули, наприклад, у яка варіює від 0.4г/мл до 0.7г/мл і від 0.5г/мл до вібраційному млинку до тих пір, поки 90% частинок 0.8г/мл, відповідно, вручну або автоматично будуть меншими, ніж 2.00мм у розмірі і не більше заповнюють в тверді, нормальні або 20% з них меншими, ніж 0.09мм в розмірі. ентеросольвентні желатинові капсули або капсули - Додають сполуку №4 і перемішують у з гідроксипропілметилцелюлози (ГПМЦ), розмір кубічній мішалці протягом 15 хвилин. яких становить від 1 до 3 або спресовують в Приклад 10: таблетки. Вага наповнених гранул становить Спосіб заповнення грануляту фармацевтичної 233.10мг, що відповідає 100мг активної сполуки. композиції платинового комплексу за формулою Приклад 15: (II), виготовленого відповідно до Прикладу 9. Спосіб заповнення грануляту фармацевтичної - гранулятом, отриманим відповідно до композиції платинового комплексу за формулою Прикладу 9, що має насипну і наливну щільність (II), виготовленого відповідно до Прикладу 9. (tap density), яка варіює від 0.4г/мл до 0.7г/мл і від - гранулятом, отриманим відповідно до 0.5г/мл до 0.8г/мл, відповідно, заповнюють вручну Прикладу 9, що має насипну і наливну щільність, або автоматично тверді, нормальні або яка варіює від 0.4г/мл до 0.7г/мл і від 0.5г/мл до ентеросольвентні желатинові капсули або капсули 0.8г/мл, відповідно, вручну або автоматично з ГПМЦ, розмір яких становить 000 або 00. Вага заповнюють тверді, нормальні або наповнених гранул становить 815.85мг, що ентеросольвентні желатинові капсули або капсули відповідає 350мг активної сполуки. з гідроксипропілметилцелюлози (ГПМЦ), розмір Приклади: яких становить від 2 до 4, або спресуйте в Спосіб заповнення грануляту фармацевтичної таблетки. Вага наповнених гранул становить композиції платинового комплексу за формулою 174.825мг, що відповідає 75мг активної сполуки. (II), виготовленого відповідно до Прикладу 9. Приклад 16: - гранулятом, отриманим відповідно до Спосіб заповнення грануляту фармацевтичної Прикладу 9, що має насипну і наливну щільність композиції платинового комплексу за формулою (tap density), яка варіює від 0.4г/мл до 0.7г/мл і від (II), виготовленого відповідно до Прикладу 9. 0.5г/мл до 0.8г/мл, відповідно, заповнюють вручну Заповнюють гранулятом, отриманим або автоматично тверді, нормальні або відповідно до Прикладу 9, що має насипну і ентеросольвентні желатинові капсули або капсули наливну щільність, яка варіює від 0.4г/мл до з ГПМЦ, розмір яких становить від 000 до 0, або 0.7г/мл і від 0. г/мл до 0.8г/мл, відповідно, вручну пресують в таблетки. Вага наповнених гранул або автоматично тверді, нормальні або становить 582.75мг, що відповідає 250мг активної ентеросольвентні желатинові капсули або капсули сполуки. з гідроксипропілметилцелюлози (ГПМЦ), розмір Прикладів яких становить від 3 до 5 або пресують в таблетки. Спосіб заповнення грануляту фармацевтичної Вага наповнених гранул становить 116.55мг, що композиції платинового комплексу за формулою відповідає 50мг активної сполуки. (II), виготовленого відповідно до Прикладу 9. Приклад 17: - гранулятом, отриманим відповідно до Спосіб нанесення покривного шару на гранули Прикладу 9, що має насипну і наливну щільність, фармацевтичної композиції платинового яка варіює від 0.4г/мл до 0.7г/мл і від 0.5/мл до комплексу за формулою (II), виготовленого 0.8г/мл, відповідно, вручну або автоматично заповнюють тверді, нормальні або 17 80872 18 відповідно до Прикладу 9 у псевдорозрідженому Швидкість інжекції: 6-25г/хвилину шарі. Діаметр сопла: 0.8мм Тип устаткування: Вурстер (Wurster) Вага покривного шару 8-12% від ваги Завантаження грануляту: 0.50 кг Здійснювати інжекцію до тих пір, доки задана Температура вхідного вага гранул, що відповідає бажаній вазі покривного шару, буде досягнута. повітря: 50°С-70°С Температура вихідного Використовувати 20% від ваги водної повітря: 30°С-50°С дисперсії Eudradit L або 10% від ваги водної Швидкість інжекції: 6-25г/хвилина дисперсії гідроксипропілметилфталатцелюлози Діаметр сопла: 0.8мм (ГПМФЦ) Вага покривного шару: 4-20% від ваги Стандартне барабанне покривне устаткування Здійснюйте подачу до тих пір, доки буде також може бути використане для речовини, що досягнута вага гранул, що відповідає бажаній вазі вказана вище. покривного шару. Приклад 20: Використовують 64% від ваги розчину Спосіб нанесення ентеросольвентного шару сахарози або 8% від ваги гідрогелю крохмалю, на таблетки і капсули, що містять фармацевтичну приготовленого з модифікованого кукурудзяного композицію платинового комплексу за формулою крохмалю, розчиненого на холоді, або з (II), здійснений згідно з Прикладом 18 (таблетки) і природного кукурудзяного крохмалю, розчиненого згідно з Прикладами від 2 до 16 (капсули) у при температурі 70°С. Альтернативно, псевдорозрідженому шарі. використовують водний пдрогель суміші 4% від Тип устаткування: Вурстер (Wurster) ваги гуміарабіку і 5% від ваги желатину А або В. Завантаження грануляту: 0.50кг Температура вхідного Стандартне барабанне покривне устаткування також може бути використане для виготовлення повітря: 50°С-70°С суміші, як вказано вище. Температура вихідного Приклад 18: повітря: 25°С-60°С Спосіб нанесення покривного шару на Швидкість інжекції: 6-18г/хвилину таблетки фармацевтичної композиції платинового Діаметр сопла: 0.8мм комплексу за формулою (II), виготовленого Вага покривного шару: 8-10% від ваги відповідно до Прикладів 2-16 у Здійснювати подачу до тих пір, доки задана псевдорозрідженому шарі. вага гранул, що відповідає бажаній вазі Тип устаткування: Вурстер (Wurster) покривного шару, буде досягнута. Завантаження грануляту: 0.50кг Використовувати 20% від ваги водної дисперсії Eudradit L або 10% від ваги водної Температура вхідного дисперсії гідроксипропілметилфталатцелюлози повітря: 50°С-70°С (ГПМЦФ). Температура вихідного повітря: 40°С-60°С Стандартне барабанне покривне устаткування Швидкість інжекції: 6-18г/хвилину також може бути використане для речовини, що Діаметр сопла: 0.8мм вказана вище. Вага покривного шару: 4-8% від ваги Приклад 21: Здійснювати інжекцію до тих пір, доки задана Спосіб нанесення шару, призначеного для вага гранул, що відповідає бажаній вазі контрольованого вивільнення, на гранули, що покривного шару, буде досягнута. містять фармацевтичну композицію платинового Використовувати 64% від ваги розчину комплексу за формулою (II), здійснений відповідно сахарози або 8% від ваги гідрогелю крохмалю, до Прикладу 17, у псевдорозрідженому шарі. приготовленого з модифікованого кукурудзяного Тип устаткування: Вурстер (Wurster) крохмалю, розчиненого на холоді або з Завантаження грануляту: 0.50кг природного кукурудзяного крохмалю, розчиненого Температура вхідного при температурі 70°С. Альтернативно, повітря: 50°С-70°С використовують водний гідрогель суміші 4% від Температура вихідного ваги гуміарабіку і 5% від ваги желатину А або В. повітря: 24°С-50°С Стандартне барабанне покривне устаткування Швидкість інжекції: 6-25г/хвилина також може бути використане для виготовлення Діаметр сопла: 0.8мм суміші, як вказано вище. Вага покривного шар: 10-30% від ваги Приклад 19: Здійснювати інжекцію до тих пір, доки задана Спосіб нанесення ентеросольвентного шару вага гранул, що відповідає бажаній вазі на гранули, що містять фармацевтичну покривного шару, буде досягнута. композицію платинового комплексу за формулою Використовувати 15% від ваги водної (II), виготовленого відповідно до Прикладу 17 у дисперсії етилцелюлози (Surrelease) для псевдорозрідженому шарі. нанесення. Альтернативно, 20% (вага/вага) Тип устаткування: Вурстер (Wurster) пластифікованого Eudragit RS або RP або лакова Завантаження грануляту: 0.50кг дисперсія чи їх суміш у прийнятному співвідношенні можуть бути використані. Температура вхідного 50°С-70°С повітря: Стандартне барабанне покривне устаткування також може бути використане для речовини, що Температура вихідного повітря: 24°С-50°С вказана вище. 19 80872 20 Приклад 22: відповідно до Фармакопеї США, спосіб мішалки з Спосіб нанесення шару, призначеного для лопатями контрольованого вивільнення, на таблетки і Середовище: 0.1М НСІ, 900мл капсули, що містять фармацевтичну композицію Швидкість: 100об./хв. платинового комплексу за формулою (II), Середня температура: 37°С здійснений відповідно до Прикладу 18 (таблетки) і Кількість активної речовини, вивільненої відповідно до Прикладів 2-16 (капсули) у представлена як % від ваги псевдорозрідженому шарі. Тип устаткування: Wurster % вивільненої % вивільненої Загрузка активної зони: 0.50кг Час речовини Вміст речовини Вміст Температура вхідного повітря: 50°С-70°С (хвилини) капсул, що капсул, що вихідного Температура включають 50 включають 200мг повітря: 24°С-50°С 2 0.7 0.3 Швидкість інжекції: 4-18г/хвилина 4 12.6 4.9 Діаметр сопла: 0.8мм 6 44.6 24.5 Вага покривного шару: 8-20% від ваги 8 57.6 44.7 Здійснювати інжекцію до тих пір, доки задана 10 65.0 54.3 вага гранул, що відповідає бажаній вазі 12 69 9 60.5 покривного шару, буде досягнута. 15 74.9 66.0 Використовувати 15% від ваги водної 20 80.4 72 3 дисперсії етилцелюлози (Surrelease) для 30 86.6 79.5 нанесення. Альтернативно 20% (вага/вага) 40 90.5 84.3 пластифікованого Eudragit RS або водної дисперсії 50 93.1 87.4 чи їх суміш у прийнятному співвідношенні можуть 60 95.1 89 5 бути використані. Стандартне барабанне покривне устаткування також може бути використане для речовини, що Приклад 28: вказана вище. Межі часу, А і В, для вивільнення активної Приклад 23: речовини з фармацевтичної композиції, що має Гранули і таблетки, виготовлені відповідно до форму гранул, твердих желатинових капсул і таблеток, виготовлених відповідно до Прикладів Прикладів 21 і 22, можуть бути поміщені в тверді 21 і 22, призначених для контрольованого желатинові капсули, призначені для вивільнення в вивільнення лікарського препарату Умови кишечнику. Приклад 24: проведення дослідження на розчинення, Гранули, покриті шаром, призначеним для відповідно до Фармакопеї США, спосіб мішалки з контрольованого вивільнення, виготовлені лопатями відповідно до Прикладу 21, можуть, до того ж, бути Середовище: 0.1М НСІ, 900мл покриті шаром, призначеним для вивільнення в Швидкість: 100об./хв. кишечнику, відповідно до Прикладу 19. Середня температура: 37 °С Приклад 25: Таблетки, покриті шаром, призначеним для Межа "А": % Межа "В": % контрольованого вивільнення, виготовлені згідно з Час вивільнення вивільнення Прикладом 22, можуть до того ж бути покриті (хвилин) лікарського лікарського шаром, призначеним для ентеросольвентного препарату препарату вивільнення, відповідно до Прикладу 20. 30 5-25 Приклад 26: 60 15-65 5-25 Дослідження стійкості гранул фармацевтичної 120 40-85 композиції платинового комплексу за формулою 180 щонайменше 85 15-65 (II), виготовленої відповідно до Прикладу 1. 240 Капсули, виготовлені за допомогою методики 360 40-85 відповідно до Прикладу 4 і Прикладу 8, поміщують 720 щонайменше 85 в контейнери, виготовлені з поліетилену високої щільності (ПЕВЩ), які зберігали при температурі 40°С і відносній вологості 75% протягом 6 місяців для вивчення стійкості. Сумарна кількість невідомих домішок не перевищувала 2% від ваги протягом вказаного періоду, і жодна невідома конкретна домішка не перевищувала 0.1% від ваги, йдеться про початкову вагу платинового комплексу за формулою (II). Приклад 27: Час вивільнення активної речовини з фармацевтичної композиції, що має форму твердих желатинових капсул, виготовлених відповідно до Прикладу 4 і Прикладу 8. Умови проведення дослідження на розчинення,
ДивитисяДодаткова інформація
Назва патенту англійськоюPharmaceutical composition containing platinum complex as active substance and method of manufacturing thereof
Автори англійськоюFranc Ales, Sova Peter
Назва патенту російськоюФармацевтическая композиция, которая содержит как активное вещество платиновый комплекс, и способ ее изготовления
Автори російськоюФранк Алес, Сова Питер
МПК / Мітки
МПК: A61K 31/282
Мітки: платиновий, комплекс, виготовлення, речовину, містить, активну, спосіб, фармацевтична, композиція
Код посилання
<a href="https://ua.patents.su/10-80872-farmacevtichna-kompoziciya-shho-mistit-yak-aktivnu-rechovinu-platinovijj-kompleks-i-sposib-vigotovlennya.html" target="_blank" rel="follow" title="База патентів України">Фармацевтична композиція, що містить як активну речовину платиновий комплекс, і спосіб її виготовлення</a>
Попередній патент: 5,7-діамінопіразоло[4,3-d]піримідини корисні при лікуванні гіпертензії
Наступний патент: Спосіб з’єднання рейок шляхом зварювання тертям
Випадковий патент: Міні-гідроелектростанція












