Заміщені гетероарилом бензотіазоли
Номер патенту: 95267
Опубліковано: 25.07.2011
Автори: Мальмстрьом Джонес, равенфорсб Ільва, Венсбо Девід, Нардволл Ґуннар, Джонассонб Катрін, Пірінґ Девід, Стрьом Пітер, Сон Даніель, Сліво Кен
Формула / Реферат
1. Сполука 2-[6-(метиламіно)піридин-3-іл]-1,3-бензотіазол-6-ол
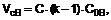 ,
,
де один або більше атомів формули І є необов'язково виявним ізотопом,
як вільна основа або її фармацевтично прийнятна сіль, сольват або сольват солі.
2. Сполука за п. 1, де один-три атоми являють собою виявний ізотоп, вибраний з групи: 3Н, 19F та 13С, або де один з атомів є виявним ізотопом, вибраним з групи: 18F, 11C та 14С.
3. Сполука за будь-яким з пп. 1-2, де вказаний радіомічений атом вибрано з групи: 3Н, 18F, 19F, 11С, 13С, 14С, 75Вr, 76Вr, 120І, 123І, 125І та 131І.
4. Сполука за будь-яким з пп. 1-2, де вказаний радіомічений атом вибрано з групи: 18F тa 11C.
5. Сполука 5-(6-{[трет-бутил(диметил)силіл]окси}-1,3-бензотіазол-2-іл)піридин-2-амін
 .
.
6. Застосування сполуки за п. 5 як попередника у синтезі міченої сполуки за будь-яким з пп. 1-4, де один-три атоми G5 є виявним ізотопом, вибраним з групи: 3Н, 19F та 13С, або, де один з атомів G5 є виявним ізотопом, вибраним з групи: 18F, 11C та 14С.
7. Фармацевтична композиція, що містить сполуку за будь-яким з пп. 1-4 разом з фармацевтично прийнятним носієм.
8. Фармацевтична композиція для відображення in vivo осаджень амілоїду, що містить радіомічену сполуку за будь-яким з пп. 1-4 разом з фармацевтично прийнятним носієм.
9. Застосування сполуки за будь-яким з пп. 1-4 для визначення осаджень амілоїду у людини, що має етапи: (а) застосування виявної кількості фармацевтичної композиції за п. 7, та визначення зв'язування сполуки з відкладеннями амілоїду у людини.
10. Застосування за п. 9, де вказане визначення проводять гамма-томографією, магнітно-резонансною інтроскопією або магнітно-резонансною спектроскопією.
11. Застосування за п. 9 або 10, де людина, як припускають, має хворобу або синдром, вибрані з групи: хвороба Альцгеймера, родинна хвороба Альцгеймера, синдром Дауна та гомозиготи для алелі аполіпопротеїну Е4.
12. Застосування за п. 9 або 10, де людина, як припускають, має хворобу Альцгеймера.
13. Сполука за будь-яким з пп. 1-4 для застосування у терапії.
14. Застосування сполуки за будь-яким з пп. 1-4 у виробництві медикаменту для профілактики та/або лікування хвороби Альцгеймера, родинної хвороби Альцгеймера, когнітивної недостатності при шизофренії (КНШ), синдрому Дауна та гомозигот для алелі аполіпопротеїну Е4.
15. Застосування сполуки за будь-яким з пп. 1-4 у виробництві медикаменту для профілактики та/або лікування хвороби Альцгеймера.
16. Застосування сполуки за будь-яким з пп. 1-4 у виробництві медикаменту для профілактики та/або лікування когнітивної недостатності при шизофренії (КНШ).
Текст
1. Сполука 2-[6-(метиламіно)піридин-3-іл]-1,3бензотіазол-6-ол 2 3 95267 4 14. Застосування сполуки за будь-яким з пп. 1-4 у виробництві медикаменту для профілактики та/або лікування хвороби Альцгеймера, родинної хвороби Альцгеймера, когнітивної недостатності при шизофренії (КНШ), синдрому Дауна та гомозигот для алелі аполіпопротеїну Е4. 15. Застосування сполуки за будь-яким з пп. 1-4 у виробництві медикаменту для профілактики та/або лікування хвороби Альцгеймера. 16. Застосування сполуки за будь-яким з пп. 1-4 у виробництві медикаменту для профілактики та/або лікування когнітивної недостатності при шизофренії (КНШ). Заявлений винахід стосується нових заміщених гетероарилом похідних бензотіазолу та терапевтичного застосування таких сполук. Крім того, винахід стосується нових заміщених гетероарилом похідних бензотіазолу, що є придатними для відображення осаджень амілоїду у живих пацієнтів, їх композиції, способи застосування та створення так сполуки. Конкретніше, заявлений винахід стосується спосіб відображення осаджень амілоїду у мозку іn vіvо для передсмертного діагнозу хвороби Альцгеймера, а також визначення клінічної ефективності терапевтичних агентів проти хвороби Альцгеймера. Амілоїдоз є прогресуючим, невиліковним порушенням обміну речовин невідомого походження, що характеризується аномальним відкладенням білку в одному або більше органах або системах організму. Білки амілоїду виробляються, наприклад, несправною роботою кісткового мозку. Амілоїдоз, котрий відбувається при накопиченні осаджень амілоїду, що порушують нормальне функціонування організму, може викликати неспроможність або загибель органу. Це рідкісна хвороба, що відбувається у приблизно 8 з кожного 1000000 людей. Це вражає чоловіків та жінок порівну та звичайно розвивається після 40. Принаймні 15 типів амілоїдозу ідентифіковані. Кожний є асоційованим з відкладеннями відмінних типів білку. Головними формами амілоїдозу є первинний системний, вторинний, та родинний або спадковий амілоїдоз. Є також ще одна форма амілоїдозу, асоційована з хворобою Альцгеймера. Первинний системний амілоїдоз звичайно розвивається між 50 та 60. Із приблизно 2000 нових випадків, діагнозованих щороку, первинний системний амілоїдоз є найбільш звичайною формою цієї хвороби у США. Також відомій як пов‟язаний з легкими ланцюгами амілоїдоз, це може також відбуватися в асоціації з множинною мієломою (рак кісткового мозку). Вторинний амілоїдоз є результатом хронічної інфекції або запальної хвороби. Це є часто асоційовано з родинною середньоземноморською лихоманкою (бактеріальна інфекція, що характеризується застудою, слабкістю, головним болем, та рекурентною лихоманкою), грануломатозним ілеїтом (запалення тонкого кишечнику), хворобою Ходжкіна, проказою, остеомієлітом та ревматоїдним артритом. Родинний або спадковий амілоїдоз є тільки спадковою формою хвороби. Це відбувається у членів більшості етнічних груп, та кожна родина має відмінну картину симптомів та залучених органів. Спадковий амілоїдоз, можна вважати, є ау тосомною домінантою, що означає, що тільки одна копія дефектного гена є необхідною для спричинення хвороби. Дитина батьків із родинним амілоїдозом має ризик розвитку хвороби 50-50. Амілоїдоз може вражати будь-який орган або систему організму. Серце, нирки, шлунковокишкова система та нервова система є враженими найчастіше. Інші звичайні ділянки накопичення амілоїду охоплюють мозок, суглоби, печінку, селезінку, підшлункову залозу, дихальну систему та шкіру. Хвороба Альцгеймера (АD) є найбільш звичайною формою деменції, неврологічної хвороби, що характеризується втратою розумової здатності, достатньо суворої для впливу на нормальну активність щоденного життя, стійкого протягом принаймні 6 місяців, та не наявного від народження. АD звичайно відбувається у похилому віці, та відмічається зниженням когнітивної функції, як-то пам‟яті, міркування та планування. Між двома та чотирма мільйонами американців мають АD; це число, як очікують, зросте до 14 мільйони у середині 21 сторіччя. Тоді як у невеликого числа людей у їх 40 та 50 років розвивається хвороба, АD переважно вражає людей похилого віку. АD вражає приблизно 3% усіх людей між 65 та 74, приблизно 20% людей між 75 та 84, та приблизно 50% людей більше 85. Трохи більше жінок, ніж чоловік є враженими АD, навіть при тому, що як вважають, жінки живуть довше, тому пропорція жінок вище у найбільш вражених вікових групах. Накопичення Аβ-пептиду амілоїду у мозку є патологічною ознакою усіх форм АD. Загалом звичайно, що відкладення церебрального Аβ-пептиду амілоїду є первинною дією стосовно патогенезу виклику АD. (Наrdу J та Sеlkое D.J., Sсіеnсе. 297: 353-356, 2002). Способи відображення, як-то позитронна емісійна томографія (ПЕТ) та однофотонна емісійна комп‟ютерна томографія (SРЕСТ), є ефективними у моніторингу накопичення осаджень амілоїду у мозку та встановлення відношення цього для прогресування АD (Shоghі-Jаdіd еt аl. Тhе Аmеrісаn jоurnаl оf gеrіаtrіс рsусhіаtrу 2002, 10, 24; Міllеr, Sсіеnсе, 2006, 313, 1376; Соіmbrа еt аl. Сurr. Тор. Меd. Сhеm. 2006, 6, 629; Nоrdbеrg, Lаnсеt Nеurоl. 2004, 3, 519). Застосування цих способів потребує розробки радіолігандів, що легко входять у мозок та селективно приєднуються до осаджень амілоїду іn vіvо. Існує необхідність у зв‟язуванні амілоїдних сполук, що є нетоксичними та можуть перетинати бар‟єр кров-мозок, та тому, можуть бути застосо 5 95267 вуваними у діагностиці. Крім того, важлива здатність до моніторингу ефективності лікування АD пацієнтів визначенням дії вказаного лікування визначенням змін у рівні бляшок АD. Властивості особливо цікавих стосовно можливості визначення зв‟язування амілоїдної сполуки, понад високу афінність стосовно осаджень амілоїду іn vіvо та високе та швидке входження у мозок, охоплюють низьке неспецифічне зв‟язування з нормальною тканиною та швидкий кліренс з неї. Ці властивості є звичайно залежними від ліпофільності сполуки (Соіmbrа еt аl. Сurr. Тор. Меd. Сhеm. 2006, 6, 629). Частково на основі відносно вищого кліренсу з нормальної тканини мозку 11 у порівнянні зі спорідненими аналогами, [ С]РІВ було вибрано серед них для подальшої оцінки на людях (Маthіs еt аl. J. Меd. Сhеm. 2003, 46, 2740). Згодом, було проведено дослідження на застосу11 вання [ С]РІВ для визначення осаджень амілоїду іn vіvо у людини ПЕТ-способом (Кlunk еt аl. Аnn Nеurоl. 2004, 55, 306). У цьому дослідженні значно 11 вище утримування [ С]РІВ у відповідних регіонах мозку, було спостережено у людей з діагнозованою АD у порівнянні зі здоровими контролями. Споріднені способи та похідні є описаними у WО 2002/16333 та WО 2004/083195. Існує необхідність у поліпшених сполуках для отримання достатньо високого співвідношення сигналу до шуму для детального визначення осаджень амілоїду в усіх регіонах мозку, та забезпечення поліпшеної надійності у кількісних дослідженнях амілоїдних бляшок стосовно лікування. Заявлений винахід стосується заміщених гетероарилом похідних бензотіазолу, що мають такі неочікувані переваги над відомими похідними бензотіазолу, забезпечуючи серед іншого переваги, асоційовані з низьким неспецифічним зв‟язуванням та швидким кліренсом з мозку. Заявлений винахід стосується способів визначення дії сполук на зв‟язування амілоїду визначенням змін у рівні бляшок АD. В одному аспекті винаходу запропоновано сполуку формули І: H R1 S X1 X2 R2 N Q X3 X4 R3 H I де R1 вибрано з групи: гідроген, галоген, С1-5 алкіл, С1-6 флуоралкіл, С1-3 алкіленОС1-3 алкіл, С1-3 алкіленОС1-3 флуоралкіл, С1-3 алкіленNН2, С1-3 алкіленNНС1-3 алкіл, С1-3 алкіленN(С1-3 алкіл)2, С1-3 алкіленNНС1-3 флуоралкіл, С1-3 алкіленN(С1-3 флуоралкіл)2, С1-3 алкіленN(С1-3 алкіл)С1-3 флуоралкіл, гідроксил, С1-6 алкоксил, С1-6 флуоралкоксил, аміно, NНС1-3 алкіл, NНС1-3 флуоралкіл, N(С1-3 алкіл)2, N(С1-3 флуоралкіл)2, N(С1-3 алкіл)С1-3 флуоралкіл, NН(СО)С1-3 алкіл, NН(СО)С1-3 флуоралкіл, NН(СО)С1-3 алкоксил, NН(СО)С1-3 флуоралкоксил, NНSО2С1-3 алкіл, NНSО2С1-3 флуоралкіл, (СО)С1-3 алкіл, (СО)С1-3 флуоралкіл, СООН, (СО)С1-3 алкоксил, (СО)С1-3 флуоралкоксил, (СО)NН2, (СО)NНС1-3 алкіл, (СО)NНС1-3 флуоралкіл, (СО)N(С1-3 алкіл)2, 6 (СО)N(С1-3 флуоралкіл)2, (СО)N(С1-3 алкіл)С1-3 флуоралкіл, (СО)N(С4-6 алкілен), (СО)N(С4-6 флуоралкілен), ціано та SО2NН2; R2 вибрано з групи: гідроген, галоген, С1-6 алкіл, С1-6 флуоралкіл, С1-3 алкіленОС1-3 алкіл, С1-3 алкіленОС1-3 флуоралкіл, С1-3 алкіленNН2, С1-3 алкіленNНС1-3 алкіл, С1-3 алкіленN(С1-3 алкіл)2, С1-3 алкіленNНС1-3 флуоралкіл, С1-3 алкіленN(С1-3 флуоралкіл)2, С1-3 алкіленN(С1-3 алкіл)С1-3 флуоралкіл, гідроксил, С1-6 алкоксил, С1-6 флуоралкоксил, аміно, NНС1-3 алкіл, NНС1-3 флуоралкіл, N(С1-3 алкіл)2, N(С1-3 флуоралкіл)2, N(С1-3 алкіл)С1-3 флуоралкіл, NН(СО)С1-3 алкіл, NН(СО)С1-3 флуоралкіл, NН(СО)С1-3 алкоксил, NН(СО)С1-3 флуоралкоксил, NНSО2С1-3 алкіл, NНSО2С1-3 флуоралкіл, (СО)С1-3 алкіл, (СО)С1-3 флуоралкіл, СООН, (СО)С1-3 алкоксил, (СО)С1-3 флуоралкоксил, (СО)NН2, (СО)NНС1-3 алкіл, (СО)NНС1-3 флуоралкіл, (СО)N(С1-3 алкіл)2, (СО)N(С1-3 флуоралкіл)2, (СО)N(С1-3 алкіл)С1-3 флуоралкіл, (СО)N(С4-6 алкілен), (СО)N(С4-6 флуоралкілен) та ціано; або R1 та R2 разом утворюють кільце; O O R3 вибрано з групи: флуор, бром, йод, С1-4 алкіл, С1-4 флуоралкіл, трифлуорметил, С1-3 алкіленОС1-3 алкіл, С1-3 алкіленОС1-3 флуоралкіл, С1-3 алкіленNН2, С1-3 алкіленNНС1-3 алкіл, С1-3 алкіленN(С1-3 алкіл)2, С1-3 алкіленNНС1-3 флуоралкіл, С1-3 алкіленN(С1-3 флуоралкіл)2, С1-3 алкіленN(С1-3 алкіл)С1-3 флуоралкіл, гідроксил, С1-4 алкоксил, С14 флуоралкоксил, аміно, NНС1-3 алкіл, NНС1-3 флуоралкіл, N(С1-3 алкіл)2, N(С1-3 флуоралкіл)2, N(С1-3 алкіл)С1-3 флуоралкіл, NН(С0-3 алкілен)G2, N(С0-1 алкіл)N(С0-1 алкіл)2, N(С0-1 алкіл)ОС0-1 алкіл, NН(СО)С1-3 алкіл, NН(СО)С1-3 флуоралкіл, NН(СО)G2, (СО)С1-3 алкіл, (СО)С1-3 флуоралкіл, (СО)С1-3 алкоксил, (СО)С1-3 флуоралкоксил, (СО)NН2, (СО)NНС1-3 алкіл, (СО)NНС1-3 флуоралкіл, (СО)N(С1-3 алкіл)2, (СО)N(С1-3 флуоралкіл)2, (СО)N(С1-3 алкіл)С1-3 флуоралкіл, (СО)N(С4-6 алкілен), (СО)N(С4-6 флуоралкілен), (СО)NН2G2, SО2NН2, SО2NНС1-3 алкіл, SО2NНС1-3 флуоралкіл, SО2N(С1-3 алкіл)2, SО2N(С1-3 флуоралкіл)2, SО2N(С1-3 алкіл)С1-3 флуоралкіл, ціано, SО2С1-6 алкіл, SС1-6 алкіл, SС1-6 флуоралкіл, N(С4-6 алкілен) та G1, де G1 представляє; N X5 G1 Х5 вибрано з групи: О, NН, NС1-3 алкіл та NС1-3 флуоралкіл; G2 - феніл чи 5- або 6-членний ароматичний гетероцикл, необов‟язково заміщений замісником, вибраним з групи: флуор, бром, йод, метил та метоксил; Q - 6-членний ароматичний гетероцикл, що містить один або два N-атоми, де Х1, Х2, Х3 та Х4 є незалежно вибраними з групи: N або С, та де один або два з Х1, Х2, Х3 та Х4 - N, а інші - С, а якщо Х4 С, вказаний С є необов‟язково заміщеним флуором або йодом; 7 95267 та один або більше атомів формули І є необов‟язково виявним ізотопом; як вільна основа або її фармацевтично прийнятна сіль, сольват або сольват солі, за умови, що коли R1 та R2 - Н, R3 не є метилом, гідроксил, аміно, амінофенілом, аміноацетилом або метокси. У ще одному аспекті винаходу запропоновано сполуку формули І 8 (СО)NН2, (СО)NНС1-3 алкіл, (СО)NНС1-3 флуоралкіл, (СО)N(С1-3 алкіл)2, (СО)N(С1-3 флуоралкіл)2, (СО)N(С1-3 алкіл)С1-3 флуоралкіл, (СО)N(С4-6 алкілен), (СО)N(С4-6 флуоралкілен), (СО)NН2G2, SО2NН2, SО2NНС1-3 алкіл, SО2NНС1-3 флуоралкіл, SО2N(С1-3 алкіл)2, SО2N(С1-3 флуоралкіл)2, SО2N(С1-3 алкіл)С1-3 флуоралкіл, ціано та G1, де G1 H R1 S Q N R2 N X1 X2 X5 R3 X3 X4 H I де R1 вибрано з групи: гідроген, галоген, С1-5 алкіл, С1-6 флуоралкіл, С1-3 алкіленОС1-3 алкіл, С1-3 алкіленОС1-3 флуоралкіл, С1-3 алкіленNН2, С1-3 алкіленNНС1-3 алкіл, С1-3 алкіленN(С1-3 алкіл)2, С1-3 алкіленNНС1-3 флуоралкіл, С1-3 алкіленN(С1-3 флуоралкіл)2, С1-3 алкіленN(С1-3 алкіл)С1-3 флуоралкіл, гідроксил, С1-6 алкоксил, С1-6 флуоралкоксил, аміно, NНС1-3 алкіл, NНС1-3 флуоралкіл, N(С1-3 алкіл)2, N(С1-3 флуоралкіл)2, N(С1-3 алкіл)С1-3 флуоралкіл, NН(СО)С1-3 алкіл, NН(СО)С1-3 флуоралкіл, NН(СО)С1-3 алкоксил, NН(СО)С1-3 флуоралкоксил, NНSО2С1-3 алкіл, NНSО2С1-3 флуоралкіл, (СО)С1-3 алкіл, (СО)С1-3 флуоралкіл, СООН, (СО)С1-3 алкоксил, (СО)С1-3 флуоралкоксил, (СО)NН2, (СО)NНС1-3 алкіл, (СО)NНС1-3 флуоралкіл, (СО)N(С1-3 алкіл)2, (СО)N(С1-3 флуоралкіл)2, (СО)N(С1-3 алкіл)С1-3 флуоралкіл, (СО)N(С4-6 алкілен), (СО)N(С4-6 флуоралкілен) та ціано; R2 вибрано з групи: гідроген, галоген, С1-6 алкіл, С1-6 флуоралкіл, С1-3 алкіленОС1-3 алкіл, С1-3 алкіленОС1-3 флуоралкіл, С1-3 алкіленNН2, С1-3 алкіленNНС1-3 алкіл, С1-3 алкіленN(С1-3 алкіл)2, С1-3 алкіленNНС1-3 флуоралкіл, С1-3 алкіленN(С1-3 флуоралкіл)2, С1-3 алкіленN(С1-3 алкіл)С1-3 флуоралкіл, гідроксил, С1-6 алкоксил, С1-6 флуоралкоксил, аміно, NНС1-3 алкіл, NНС1-3 флуоралкіл, N(С1-3 алкіл)2, N(С1-3 флуоралкіл)2, N(С1-3 алкіл)С1-3 флуоралкіл, NН(СО)С1-3 алкіл, NН(СО)С1-3 флуоралкіл, NН(СО)С1-3 алкоксил, NН(СО)С1-3 флуоралкоксил, NНSО2С1-3 алкіл, NНSО2С1-3 флуоралкіл, (СО)С1-3 алкіл, (СО)С1-3 флуоралкіл, СООН, (СО)С1-3 алкоксил, (СО)С1-3 флуоралкоксил, (СО)NН2, (СО)NНС1-3 алкіл, (СО)NНС1-3 флуоралкіл, (СО)N(С1-3 алкіл)2, (СО)N(С1-3 флуоралкіл)2, (СО)N(С1-3 алкіл)С1-3 флуоралкіл, (СО)N(С4-6 алкілен), (СО)N(С4-6 флуоралкілен) та ціано; R3 вибрано з групи: флуор, бром, йод, С1-4 алкіл, С1-4 флуоралкіл, трифлуорметил, С1-3 алкіленОС1-3 алкіл, С1-3 алкіленОС1-3 флуоралкіл, С1-3 алкіленNН2, С1-3 алкіленNНС1-3 алкіл, С1-3 алкіленN(С1-3 алкіл)2, С1-3 алкіленNНС1-3 флуоралкіл, С1-3 алкіленN(С1-3 флуоралкіл)2, С1-3 алкіленN(С1-3 алкіл)С1-3 флуоралкіл, гідроксил, С1-4 алкоксил, С14 флуоралкоксил, аміно, NНС1-3 алкіл, NНС1-3 флуоралкіл, N(С1-3 алкіл)2, N(С1-3 флуоралкіл)2, N(С1-3 алкіл)С1-3 флуоралкіл, NН(С0-3 алкілен)G2, N(С0-1 алкіл)N(С0-1 алкіл)2, N(С0-1 алкіл)ОС0-1 алкіл, NН(СО)С1-3 алкіл, NН(СО)С1-3 флуоралкіл, NН(СО)G2, (СО)С1-3 алкіл, (СО)С1-3 флуоралкіл, (СО)С1-3 алкоксил, (СО)С1-3 флуоралкоксил, G1 Х5 вибрано з групи: О, NН, NС1-3 алкіл та NС1-3 флуоралкіл; G2 - феніл чи 5- або 6-членний ароматичний гетероцикл, необов‟язково заміщений замісником, вибраним з групи: флуор, бром, йод, метил та метоксил; Q - 6-членний ароматичний гетероцикл, що містить один або два N-атоми, де Х1, Х2, Х3 та Х4 є незалежно вибраними з групи: N або С, та де один або два з Х1, Х2, Х3 та Х4 - N, а інші - С; як вільна основа або її фармацевтично прийнятна сіль, сольват або сольват солі, за умови, що коли R1 та R2 - Н, R3 не є метилом, гідроксил, аміно, амінофенілом, аміноацетилом або метокси. У ще одному аспекті винаходу запропоновано сполуку формули І, де R1 вибрано з групи: гідроген, галоген, С1-5 алкіл, гідроксил, С1-6 алкоксил, аміно, NНС1-3 алкіл, NНС1-3 флуоралкіл, N(С1-3 алкіл)2, NН(СО)С1-3 алкіл, NН(СО)С1-3 флуоралкіл, (СО)NН2, (СО)NНС1-3 алкіл та (СО)NНС1-3 флуоралкіл. У ще одному аспекті винаходу запропоновано сполуку формули І, де R2 вибрано з групи: гідроген, галоген, С1-6 алкіл, гідроксил, С1-6 алкоксил, аміно, NНС1-3 алкіл, NНС1-3 флуоралкіл, N(С1-3 алкіл)2, NН(СО)С1-3 алкіл, NН(СО)С1-3 флуоралкіл, (СО)NН2, (СО)NНС1-3 алкіл та (СО)NНС1-3 флуоралкіл. У ще одному аспекті винаходу запропоновано сполуку формули І, де R3 вибрано з групи: флуор, бром, йод, гідроксил, С1-4 алкоксил, трифлуорметил, С1-4 флуоралкоксил, аміно, NНС1-3 алкіл, NНС1-3 флуоралкіл, N(С1-3 алкіл)2, N(С1-3 флуоралкіл)2, N(С1-3 алкіл)С1-3 флуоралкіл, (СО)NН2, NН(С03 алкілен)G2, NН(СО)С1-3 алкіл та G1, де Х5 вибрано з групи: NН, О та NМе; G2 - феніл або піридил, вказані феніл або піридил необов‟язково заміщені замісником, вибраним з групи: флуор, метил та метокси. У ще одному аспекті винаходу запропоновано сполуку формули І, де Q - піридинове кільце, де Х1 та Х2 є незалежно вибраними з групи: N або С, та де один з Х1 та Х2 - N, а інші з Х1, Х2, Х3 та Х4 - С. У ще одному аспекті винаходу запропоновано сполуку формули І, де Q - піримідинове кільце, де Х1 та Х2 є незалежно вибраними з групи: N або С, та де один з Х1 та Х2 - N; та де Х3 та Х4 є незалежно вибраними з групи: N або С, та де один з Х3 та Х4 - N. У ще одному аспекті винаходу запропоновано сполуку формули І, де R2 вибрано з групи: гідроген, флуор, бром, йод, аміно, метил, гідроксил, метоксил, NНМе та (СО)NН2. 9 У ще одному аспекті винаходу запропоновано сполуку формули І, де R2 вибрано з групи: гідроген, метокси та аміно. У ще одному аспекті винаходу запропоновано сполуку формули І, де R1 вибрано з групи: гідроген, флуор, бром, йод, аміно, метил, гідроксил, метоксил, NНМе та (СО)NН2. У ще одному аспекті винаходу запропоновано сполуку формули І, де R3 вибрано з групи: флуор, метоксил, етоксил, трифлуорметил, NНМе, аміно, N(С1-3 алкіл)2, (СО)NН2, та G1, де Х5 вибрано з групи: NН, О та NМе. У ще одному аспекті винаходу запропоновано сполуку формули І, де Q - піридинове кільце, де Х2 - N, та Х1, Х3 та Х4 - С. У ще одному аспекті винаходу запропоновано 95267 10 сполуку формули І, де Q - піридинове кільце, де Х4 - N, та Х1, Х2 та Х3 - С. У ще одному аспекті винаходу запропоновано сполуку формули І, де Q - піримідинове кільце, де Х2 та Х4 - N; та Х1 та Х3 - С. У ще одному аспекті винаходу запропоновано 11 сполуку формули І, що містить один атом С, де 11 один з R1 та R2 - гідрокси або [ С]метоксил, а інший з R1 та R2 - Н; 11 R3 вибрано з групи: аміно, NНМе, NН СН3 та 11 N(Ме) СН3; Q - піридинове кільце, де Х1 та Х2 є незалежно вибраними з групи: N або С, та де один з Х1 та Х2 N, а інші з Х1, Х2, Х3 та Х4 - С. У ще одному аспекті винаходу запропоновано сполуку формули І, вказаною сполукою є: 11 95267 12 13 95267 14 15 95267 16 17 95267 18 19 95267 20 21 95267 22 23 У ще одному аспекті винаходу запропоновано сполуку формули І, де Х4 формули І є атомом карбону, заміщеним флуором або йодом. У ще одному аспекті винаходу запропоновано сполуку формули І, де R3 формули І вибрано з групи: SО2С1-6 алкіл, SС1-6 алкіл, SС1-6 флуоралкіл та N(С4-6 алкілен). У ще одному аспекті винаходу запропоновано сполуку формули І, де R1 та R2 разом утворюють 95267 24 кільце; O O У ще одному аспекті винаходу запропоновано сполуку формули І, вказаною сполукою є: 25 95267 У ще одному аспекті винаходу запропоновано сполуку формули І, де один - три атоми є виявним 3 19 13 ізотопом, вибраним з групи: Н, F та С, або, де один з атомів є виявним ізотопом, вибраним з гру18 11 14 пи: F, С та С. У ще одному аспекті винаходу запропоновано сполуку формули І, де один або більше з атомів R1 є радіоміченим атомом. У ще одному аспекті винаходу запропоновано сполуку формули І, де один або більше атомів R2 є радіоміченим атомом. У ще одному аспекті винаходу запропоновано сполуку формули І, де один або більше атомів R3 є радіоміченим атомом. У ще одному аспекті винаходу запропоновано сполуку формули І, де вказаний радіомічений атом 3 18 19 11 13 14 75 76 вибрано з групи: Н, F, F, С, С, С, Вr, Вr, 120 123 125 131 І, І, І та І. У ще одному аспекті винаходу запропоновано сполуку формули І, де вказаний радіомічений атом 3 18 19 11 14 123 вибрано з групи: Н, F, F, С, С та І. У ще одному аспекті винаходу запропоновано сполуку формули І, де вказаний радіомічений атом 18 11 вибрано з групи: F та С. У ще одному аспекті винаходу запропоновано сполуку формули VІІ H R4 S 6 O X1 X2 Q N 5 H X3 X4 H N R5 VII де залишок О-R4 є приєднаним у позиції 6, та атом гідрогену є приєднаним у позиції 5 бензотіазольного кільця; R4 вибрано з групи: Sі(G3)3, СН2G4, тетрагідропіраніл, 1-етоксіетил, фенацил, 4-бромфенацил, циклогексил, т-бутил, т-бутоксикарбоніл, 2,2,2трихлоретилкарбоніл та трифенілметил; G3, незалежно від кожного іншого, вибрано з групи: С1-4 алкіл та феніл; 26 G4 вибрано з групи: 2-(триметилсиліл)етоксил, С1-3 алкоксил, 2-(С1-3 алкокси)етоксил, С1-3 алкілтіо, циклопропіл, вініл, феніл, п-метоксифеніл, онітрофеніл, та 9-антрил; Q - 6-членний ароматичний гетероцикл, що містить один або два N-атоми, де Х1, Х2, Х3 та Х4 є незалежно вибраними з групи: N або С, та де один або два з Х1, Х2, Х3 та Х4 - N, а інші - С; R5 вибрано з групи: С1-3 алкіл та гідроген; як вільна основа або її сіль, сольват або сольват солі. У ще одному аспекті винаходу запропоновано сполуку формули VІІ, де R4 - Sі(G3)3. У ще одному аспекті винаходу запропоновано сполуку формули VІІ, де R4 вибрано з групи: т-бутилдиметилсиліл, 2-(триметилсиліл)етоксиметил та етоксиметил. У ще одному аспекті винаходу запропоновано сполуку формули VІІ, де R4 вибрано з групи: т-бутилдиметилсиліл та етоксиметил. У ще одному аспекті винаходу запропоновано сполуку формули VІІ, де R4 - т-бутилдиметилсиліл. У ще одному аспекті винаходу запропоновано сполуку формули VІІ, Q - піримідинове кільце, де Х2 та Х4 - N, та Х1 та Х3 - С. У ще одному аспекті винаходу запропоновано сполуку формули VІІ, де Q - піридинове кільце, де Х2 - N, та Х1, Х3 та Х4 - С. У ще одному аспекті винаходу запропоновано сполуку формули VІІ, де Q - піридинове кільце, де Х4 - N, а Х1, Х2 та Х3 - С. У ще одному аспекті винаходу запропоновано сполуку формули VІІ, де R5 - гідроген. У ще одному аспекті винаходу запропоновано сполуку формули VІІ, вказаною сполукою є: 27 95267 У ще одному аспекті винаходу запропоновано застосування сполуки формули VІІ як попереднику у синтезі міченої сполуки формули ХІV H X1 X2 S 6 HO Q N 5 H X3 X4 G5 N R5 XIV де ОН є приєднаним у позиції 6, а атом гідрогену є приєднаним у позиції 5 бензотіазольного кільця; Q - 6-членний ароматичний гетероцикл, що містить один або два N-атоми, де Х1, Х2, Х3 та Х4 є незалежно вибраними з групи: N або С, та де один або два з Х1, Х2, Х3 та Х4 - N, а інші - С; R5 вибрано з групи: С1-3 алкіл та гідроген; G5 вибрано з групи: С1-3 алкіл та С1-3 флуоралкіл, де один - три атоми G5 є виявним ізотопом, 3 19 13 вибраним з групи: Н, F та С, або, де один з атомів G5 є виявним ізотопом, вибраним з групи: 18 11 14 F, С та С. У ще одному аспекті винаходу запропоновано фармацевтичну композицію, що містить сполуку формули І, разом з фармацевтично прийнятним носієм. У ще одному аспекті винаходу запропоновано фармацевтичну композицію для відображення іn vіvо осаджень амілоїду, що містить радіо-мічену сполуку формули І, разом з фармацевтично прийнятним носієм. У ще одному аспекті винаходу запропоновано спосіб визначення іn vіvо осаджень амілоїду у людини, що має етапи: (а) застосування виявної кількості фармацевтичної композиції, що містить радіо-мічену сполуку формули І, та визначення зв‟язування сполуки з відкладенням амілоїду у людини. Вказане визначення можна проводити гамма-томографією, магнітно-резонансною інтроскопією або магнітно-резонансною спектроскопією. Вказана людина може, як очікують, мати хворобу або синдром, вибрані з групи: хвороба Альцгеймера, родинна хвороба Альцгеймера, синдром Дауна та гомозиготи для алелі аполіпопротеїну Е4. У ще одному аспекті винаходу запропоновано сполуку формули І для застосування у терапії. У ще одному аспекті винаходу запропоновано застосування сполуки формули І у виробництві медикаменту для профілактики та/або лікування хвороби Альцгеймера, родинної хвороби Альцгеймера, когнітивної недостатності при шизофреній (КНШ), синдрому Дауна та гомозигот для алелі аполіпопротеїну Е4. У ще одному аспекті винаходу запропоновано застосування сполуки формули І у виробництві медикаменту для профілактики та/або лікування хвороби Альцгеймера. У ще одному аспекті винаходу запропоновано застосування сполуки формули І у виробництві медикаменту для профілактики та/або лікування когнітивної недостатності при шизофреній (КНШ). У ще одному аспекті винаходу запропоновано спосіб профілактики та/або лікування хвороби Альцгеймера, родинної хвороби Альцгеймера, 28 синдрому Дауна та гомозигот для алелі аполіпопротеїну Е4, що полягає у призначенні ссавцю, охоплюючи людину, при необхідності такої профілактики та/або лікування, терапевтично ефективної кількості сполуки формули І. У ще одному аспекті винаходу запропоновано спосіб профілактики та/або лікування хвороби Альцгеймера, що полягає у призначенні ссавцю, охоплюючи людину, при необхідності такої профілактики та/або лікування, терапевтично ефективної кількості сполуки формули І. У ще одному аспекті винаходу запропоновано спосіб профілактики та/або лікування когнітивної недостатності при шизофреній (КНШ), що полягає у призначенні ссавцю, охоплюючи людину, при необхідності такої профілактики та/або лікування, терапевтично ефективної кількості сполуки формули І. Визначення Як це застосовувано тут, "алкіл", "алкіленіл" або "алкілен", поодинці або як суфікс або префікс, охоплюють насичені аліфатичні вуглеводневі групи з розгалуженим та нерозгалуженим ланцюгом, що мають від 1 до 12 атомів карбону, або якщо дано певне число атомів карбону, тоді визначено певне число. Наприклад, "С1-6 алкіл" означає алкіл, що має 1, 2, 3, 4, 5 або 6 атомів карбону. Коли певне число є 0, гідроген-атом визначено як замісник у позиції алкілу. Наприклад, “N(С0 алкіл)2“ є еквівалентним “NН2“ (аміно). Коли певне число, що означає алкіленіл або алкілен, є 0, це означає зв„язок. Наприклад, “NН(С0 алкілен)NН2” є еквівалентним “NНNН2” (гідразино). Як це застосовувано тут, групи, зв‟язані алкіленом або алкіленілом є визначеними як приєднані до першого та останнього карбону алкілену або алкіленілу. Наприклад, “N(С4 алкілен)”, “N(С5 алкілен)” та “N(С2 алкілен)2NН” є еквівалентними піролідинілу, піперидиніл та піперазинілу, відповідно. Приклади алкілу охоплюють, але без обмеження, метил, етил, н-пропіл, і-пропіл, н-бутил, ібутил, втор-бутил, т-бутил, пентил та гексил. Приклади алкілену або алкіленілу охоплюють, але без обмеження, метилен, етилен, пропілен, та бутилен. Як це застосовувано тут, "алкокси" або "алкілоксил" представляє алкіл, що визначено вище, з показаним числом атомів карбону, приєднаний через оксигеновий місток. Приклади алкокси охоплюють, але без обмеження, метоксил, етоксил, нпропоксил, ізопропоксил, н-бутоксил, ізобутоксил, т-бутоксил, н-пентоксил, ізопентоксил, циклопропілметоксил, алілокси та пропаргілокси. Подібно, "алкілтіо" або "тіоалкокси" представляють алкіл, що визначено вище, з показаним числом атомів карбону, приєднаний через сульфурний місток. Як це застосовувано тут, “флуоралкіл”, “флуоралкілен” та “флуоралкокси”, застосовувані поодинці або як суфікс чи префікс, стосуються групи, у котрій один, два, або три гідрогени приєднані до карбонів відповідних алкілу, алкілену та алкоксигрупи є заміщеними флуором. Приклади флуоралкілу охоплюють, але без обмеження, трифлуорметил, дифлуорметил, флуорметил, 2,2,2 29 трифлуоретил, 2-флуоретил та 3-флуорпропіл. Приклади флуоралкілену охоплюють, але без обмеження, дифлуорметилен, флуорметилен, 2,2дифлуорбутилен та 2,2,3-трифлуорбутилен. Приклади флуоралкоксилу охоплюють, але без обмеження, трифлуорметоксил, 2,2,2трифлуоретоксил, 3,3,3-трифлуорпропоксил та 2,2-дифлуорпропоксил. Як це застосовувано тут, “ароматична” стосується вуглеводневої групи, що має одне або більше ненасичених карбонових кілець, що мають ароматичний характер, (наприклад, 4n + 2 делокалізовані електрони) та містять приблизно до 14 атомів карбону. На додаток “гетероароматична” стосується групи, що має одне або більше ненасичених кілець, що містять карбон та один або більше гетероатомів, як-то нітроген, оксиген або сульфур, що має ароматичний характер (наприклад, 4n + 2 делокалізовані електрони). Як це застосовувано тут, термін “арил” стосується ароматичної кільцевої структури з 5 - 14 атомів карбону. Кільцеві структури, що містять 5, 6, 7 та 8 атомів карбону можуть бути однокільцевими ароматичними групами, як-то, феніл. Кільцеві структури, що містять 8, 9, 10, 11, 12, 13, або 14 можуть бути поліциклічними, наприклад, нафтил. Ароматичне кільце може бути заміщеним в одній або більше позиціях кільця замісниками, описаними вище. Термін “арил” також охоплює поліциклічні кільцеві системи, що мають два або більше циклічних кілець, у котрих два або більше атомів карбону належать звичайно двом сусіднім кільцям (кільця є “конденсованими кільцями”), де принаймні одне з кілець є ароматичним, наприклад, інші циклічні кільця можуть бути циклоалкілами, циклоалкенілами, циклоалкінілами, арилами та/або гетероциклілами. Терміни орто, мета та пара стосуються 1,2-, 1,3- та 1,4-дизаміщеного бензолу, відповідно. Наприклад, назви 1,2диметилбензол та орто-диметилбензол є синонімами. Як це застосовувано тут, термін "циклоалкіл" охоплює насичені кільцеві групи, що мають певне число атомів карбону. Вони охоплюють конденсовані або місткові поліциклічні системи. Кращі циклоалкіли мають від 3 до 10 атомів карбону у їх кільцевій структурі, а ще краще мають 3, 4, 5, та 6 атомів карбону у кільцевій структурі. Наприклад, "С3-6 циклоалкіл" означає такі групи, як циклопропіл, циклобутил, циклопентил або циклогексил. Як це застосовувано тут, "галоген" стосується флуору, хлору, брому та йоду. "Протиіон" є застосовуваним, наприклад, для представлення невеликого, негативнозарядженого іона, як-то хлорид, бромід, гідроксид, ацетат, сульфат, тозилат, бензолсульфонат, тощо. Як це застосовувано тут, термін "гетероцикліл" або "гетероциклічний" або “гетероцикл” стосується насиченого, ненасиченого або частково насиченого, моноциклічного, біциклічного або трициклічного кільця (якщо не визначене інше), що містить 3 - 20 атомів, з котрих 1, 2, 3, 4 або 5 кільцеві атоми є вибраними з нітрогену, сульфуру або оксигену, котрі можуть, якщо не визначене інше, бути зв‟язаними через карбон або нітроген, де -СН2- є 95267 30 необов‟язково заміщеним -С(О)-; та де якщо не визначене інше, кільцевий атом нітрогену або сульфуру є необов‟язково окисненим з утворенням N-оксиду або S-оксидів або кільцевий нітроген є необов‟язково квартернізованим; де кільцевий -NН є необов‟язково заміщеним вибраним з групи: ацетил, форміл, метил або мезил; та кільце є необов‟язково заміщеним одним або більше галогеном. Зрозуміло, що коли загальне число атомів S та О у гетероциклілі перевищує 1, тоді ці гетероатоми не є сусідніми один до одного. Якщо вказаний гетероцикліл є бі- або трициклічним, тоді принаймні одне з кілець може необов‟язково бути гетероароматичним або ароматичним за умови, що принаймні одне з кілець є негетероароматичним. Якщо вказаний гетероцикліл є моноциклічним тоді він повинен не бути ароматичним. Приклади гетероциклілів охоплюють, але без обмеження, піперидиніл, N-ацетилпіперидиніл, Nметилпіперидиніл, N-формілпіперазиніл, Nмезилпіперазиніл, гомопіперазиніл, піперазиніл, азетидиніл, оксетаніл, морфолініл, тетрагідроізохінолініл, тетрагідрохінолініл, індолініл, тетрагідропіраніл, дигідро-2Н-піраніл, тетрагідрофураніл та 2,5-діоксоімідазолідиніл. Як це застосовувано тут, “гетероарил” стосується гетероароматичного гетероциклу, що має принаймні один гетероатомний кільцевий член, якто сульфур, оксиген або нітроген. Гетероарили охоплюють моноциклічні та поліциклічні (наприклад, що мають 2, 3 або 4 конденсовані кільця) системи. Приклади гетероарилів охоплюють без обмеження, піридил (тобто, піридиніл), піримідиніл, піразиніл, піридазиніл, триазиніл, фурил (тобто фураніл), хіноліл, ізохіноліл, тієніл, імідазоліл, тіазоліл, індоліл, пірил, оксазоліл, бензофурил, бензотієніл, бензтіазоліл, ізоксазоліл, піразоліл, триазоліл, тетразоліл, індазоліл, 1,2,4-thіаdіазоліл, ізотіазоліл, бензотієніл, рurініл, карбазоліл, бензімідазоліл, індолініл, тощо. У деяких втіленнях гетероарил має від 1 до 20 атомів карбону, а в інших втіленнях приблизно від 3 до 20 атомів карбону. У деяких втіленнях гетероарил містить 3 - 14, 4 - 14, 3 - 7, або 5 - 6 кільцетвірних атомів. У деяких втіленнях гетероарил має 1 - 4, 1 - 3, або 1 - 2 гетероатоми. У деяких втіленнях гетероарил має 1 гетероатом. Як це застосовувано тут, вираз “захисна група” означає тимчасові замісники, котрі захищають потенційно реактивну функціональну групу від небажаних хімічних перетворень. Приклади таких захисних груп охоплюють естери карбонових кислот, силіл-етери спиртів, та ацеталі та кеталі альдегідів та кетонів відповідно. Підгрупою захисних груп є ті, котрі захищають нуклеофільну гідроксигрупу від алкілування та таким чином дозволяють селективне N-алкілування аміногрупи у тій же молекулі в основних умовах. Приклади таких захисних груп охоплюють, але без обмеження, метил, 2(триметилсиліл)етоксиметил, алкоксиметил та тбутилдиметилсиліл. Як це застосовувано тут, "фармацевтично прийнятні солі" стосуються похідних розкритих сполук, де вихідну сполуку модифікують створенням їх солей. Приклади фармацевтично прийнят 31 них солей охоплюють, але без обмеження, солі мінеральних або органічних кислот з основними залишками, як-то аміни; лужні або органічні солі кислотних залишків, як-то карбонових кислот; тощо. Фармацевтично прийнятні солі охоплюють звичайні нетоксичн солі або солі четвертинного амонію вихідної сполуки, наприклад, з нетоксичними неорганічними або органічними кислотами. Наприклад, такі звичайні нетоксичн солі охоплюють похідні неорганічних кислот, як-то хлоридна, фосфатна, тощо; та солі органічних кислоти, як-то молочна, малеїнова, лимонна, бензойна, метансульфонова, тощо. Фармацевтично прийнятн солі заявленого винаходу мож бути синтезован з вихідної сполуки, що містить основну або кислотну груп, звичайними хімічними способами. Загалом, такі солі можна отримувати реакцією вільно-кислотних або основних форм цих сполук зі стехіометричною кількістю прийнятної основи або кислоти у воді або в органічному розчиннику, або у суміші обох; загалом, застосовують неводні середовища, як-то етер, етилацетат, етанол, ізопропанол, або ацетонітрил. Як це застосовувано тут, “іn vіvо здатн до гідролізу попередники” означає іn vіvо здатн до гідролізу (або сlеаvаblе) естер сполуки формули І, що містить карбокси або гідрокси груп. Наприклад, аміно кислот естери, С1-6 алкоксиметил естери, якто метоксиметил; С1-6алканоїлоксиметил естери, як-то півалоїлоксиметил; С38циклоалкоксикарбонілокси С1-6алкіл естери, як-то 1-циклогексилкарбонілоксіетил, ацетоксиметоксил, або фосфорамідні циклічні естери Як це застосовувано тут, “таутомер” означає різні структурні ізомери, що існують у рівновазі, що є результатом міграції атому гідрогену. Наприклад, кето-енольна таутомерія дає результатом сполуку, що має властивості кетону та ненасичених сполук. Як це застосовувано тут "стабільна сполука" та "стабільна структура" показують сполуку, що є достатньо міцною для витримування виділення до корисного ступеню чистоти з реакційної суміші, та формування в ефективний терапевтичний або діагностичний агент. Сполуки винаходу крім того охоплюють гідрати та сольвати. Заявлений винахід стосується мічених ізотопами сполук винаходу. “Мічена ізотопами”, “радіомічена”, “мічена”, “виявна” або “виявна стосовно зв‟язування амілоїду” сполука, або “радіоліганд” є сполукою винаходу, де один або більше атомів є заміненими або заміщеними атомом, що має атомну масу або масове число, відмінні від атомної маси або масового числа, звичайно знайдених у природі (тобто, існують у природі). Придатні радіонукліди (тобто “виявні ізотопи”), що можна уводити у сполуки заявленого винаходу, охоплюють 2 3 11 13 14 13 15 але без обмеження Н, Н, С, С, С, N, N, 15 17 18 18 35 36 82 75 76 77 123 О, О, О, F, S, Сl, Вr, Вr, Вr, Вr, І, 124 125 131 І, І та І. Зрозуміло, що мічені ізотопами сполуки винаходу необхідно тільки збагачувати виявним ізотопом до або вище ступеню, що дозволяє визначення способом, придатним для конкретного застосування, наприклад, у виявній сполуці вина11 ходу, міченій С, атом карбону міченої групи міче 95267 32 12 ної сполуки може бути С або іншим ізотопом карбону у частині молекул. Радіонуклід, що уводять у радіомічені сполуки, повинен залежати від конкретного застосування радіоміченої сполуки. Наприклад, для мічення іn vіtrо бляшки або рецепто3 14 ру та конкурентних досліджень, сполуки з Н, С, 125 або І повинні загалом бути найбільш корисними. 11 13 18 19 120 123 Для іn vіvо відображення С, С, F, F, І, І, 131 75 76 І, Вr, або Вr повинні загалом бути найбільш корисними. В одному втіленні винаходу радіонукліди є 3 18 19 11 13 14 75 76 представленими Н, F, F, С, С, С, Вr, Вr, 120 123 125 131 І, І, І або І. Приклади "ефективної кількості" охоплюють кількості, що попереджує старіння відкладень амілоїду іn vіvо, що мають прийнятні рівні токсичності та біозасвоюваності для фармацевтичного застосування, та/або профілактики виродження клітин та токсичності, асоційованих з утворенням фібрил. Це винахід стосується радіомічених заміщених гетероарилом бензотіазолів як агентів відображення амілоїду та попередників у синтезі сполук, з котрих їх отримують. Вважають, що сполуки заявленого винаходу можна застосовувати для лікування хвороби Альцгеймера. Звідси, сполуки заявленого винаходу та їх солі, як очікують, є активними проти споріднених з віком хвороб, як-то Альцгеймера, а також інших споріднених з Аβ патологій, як-то синдром Дауна та β-амілоїдна ангіопатія. Очікують, що сполуки заявленого винаходу можна було б застосовувати як одиничні агенти, але можна також було б застосовувати у комбінації з широкими межами агентів поліпшення нестачі пізнавальної здатності. В одному втіленні заявленого винаходу сполуку формули (І) або її фармацевтично прийнятну сіль, сольват або іn vіvо здатний до гідролізу естер, або фармацевтичну композицію або рецептуру, що містить сполуку формули (І) застосовують одночасно, сумісно, послідовно або роздільно з ще одною фармацевтично активною сполукою або сполуками, застосовуваними у терапії хвороби Альцгеймера охоплюючи, наприклад, донепезил, мемантин, такрин та їх еквіваленти і фармацевтично активні ізомери та метаболіти. Способи застосування Сполуки заявленого винаходу можна застосовувати для визначення наявності, розташування та/або кількості одного або більше відкладень амілоїду в органі або ділянці організму, охоплюючи мозок, тварини. Відкладення амілоїду охоплюють, без обмеження, відкладення Аβ. При можливості тимчасових наслідків відкладень амілоїду, сполуки винаходу можна також застосовувати для встановлення зв‟язку відкладення амілоїду з виникненням клінічних симптомів, асоційованих з хворобою, розладом або станом. Сполуки винаходу можна безумовно застосовувати для лікування та діагностики хвороби, розладу або стану, що характеризується відкладенням амілоїду, як-то АD, родинна АD, синдром Дауна, амілоїдоз та гомозиготи для алелі аполіпопротеїну Е4. Спосіб цього винаходу визначає наявність та розташування осаджень амілоїду в органі або ділянці організму, переважно мозку, пацієнта. Спо 33 сіб полягає у застосуванні виявної кількості фармацевтичної композиції, що містить амілоїдзв‟язувальну сполуку заявленого винаходу під назвою "виявна сполука," або її фармацевтично прийнятну водорозчинну сіль, до пацієнта. "Виявна кількість" означає, що кількість виявної сполуки, що застосовують є достатньою для визначення зв‟язування сполуки з амілоїдом. Аn "відображення ефективн кількість" означає, що кількість виявної сполуки, що застосовують, є достатньою для відображення зв‟язування сполуки з амілоїдом. Винахід стосується амілоїдних зондів, котрі у сполученні із неінвазивними способами нейровідображення, як-то магнітно-резонансна спектроскопія (МRS) або томографія (МІNІ), або гамматомографія, як-то позитронна емісійна томографія (ПЕТ) або однофотонна емісійна компьютерна томографія (SРЕСТ), що застосовують для кількісного визначення відкладення амілоїду іn vіvо. Термін "іn vіvо відображення" стосується будь-якого способу, котрий дозволяє визначення міченого заміщеного гетероарилом похідного бензотіазолу, описаного тут. Для гамма-томографії, випромінювання, емітоване від досліджуваного органу або ділянки визначають та виражають як загальне зв‟язування, або як співвідношення, у котрому загальне зв‟язування в одній тканині є нормалізованим (наприклад, поділеним) стосовно загального зв‟язування у ще одній тканині тої ж людини у тому ж відображенні іn vіvо. Загальне зв‟язування іn vіvо визначають як цілісний сигнал, визначений у тканині іn vіvо способом відображення без необхідності корекції другим уведенням ідентичної кількості міченої сполуки разом з великим надлишком неміченої, але в іншому хімічно ідентичної сполуки. "Людиною" є ссавець, переважно людина, а найкраще людина, що як очікують, має деменцію. Для мети іn vіvо відображення, тип доступного приладу для визначення є головним фактором у селекції даної мітки. Наприклад, радіоактивні ізо19 топи та F є особливо придатними для відображення іn vіvо у способах заявленого винаходу. Тип застосовуваного приладу повинен проводити селекцію радіонукліду або стабільного ізотопу. Наприклад, вибраний радіонуклід повинен мати тип виявного порушення за допомогою даного типу приладу. Ще одне зауваження стосується періоду напівперетворення радіонукліду. Період напівперетворення повинен бути достатньо довгим так, щоб бути ще виявним під час максимального поглинання ціллю, але достатньо коротким так, щоб хазяйн не отримав шкідливого опромінювання. Радіомічені сполуки винаходу можна визначати гамма-томографією, де визначають емітоване гамма-опромінювання прийнятної довжини хвилі. Способи гамма-томографії охоплюють, але без обмеження, SРЕСТ та ПЕТ. Краще, для визначення за допомогою SРЕСТ, щоб вибрана радіомітка не емітувала частинок, але давала велик число фотонів у межах 140-200 кеВ. Для визначення ПЕТ радіомітка повинна бути 18 позитрон-емітувальним радіонуклідом, як-то F, котрий повинен анігілювати з утворенням двох гамма-променів 511 кеВ, що треба визначати ка 95267 34 мерою ПЕТ. У заявленому винаході застосовують зв‟язування амілоїдних сполук/зондів, що є корисним для відображення та кількісного визначення іn vіvо відкладення амілоїду. Ці сполуки застосовують у соnjunсtіоn із неінвазивн нейроспособи відображення, як-то магнітно-резонансна спектроскопія (МRS) або відображення (МRІ), позитронна емісійна томографія (ПЕТ), та однофотонна емісійна компьютерна томографія (SРЕСТ). Згідно з цим винаходом, заміщені гетероарилом похідні 19 13 бензотіазолу можуть бути міченими F або С для МRS/МRІ загальними способами, відомими у рівні техніки. Сполуки можуть також бути радіомі18 11 75 76 120 ченими F, С, Вr, Вr, або І для ПЕТ способами, добре відомими у рівні техніки та описаними Fоwlеr, J. та Wоlf, А. у позитронній емісійній томографії та авторадіографії 391-450 (Rаvеn Рrеss, 1986). Сполуки також можуть бути радіоміченими 123 131 І та І для SРЕСТ будь-яким з кількох способів, відомих у рівні техніки. Дивись, наприклад, Кulkаrnі, Іnt. J. Rаd. Аррl. &Іnst. (Частин В) 18: 647 (1991). Сполуки можуть також бути радіоміченими відомими металевими радіоміткеми, як-то Техне99m цій-99m ( Тс). Модифікацію замісників для уведеннялігандів, що приєднуються до таких іонів металу, може здійснювати без надмірного експериментування фахівець. Радіомічену металом сполук можна тоді застосовувати для визначення осаджень амілоїду. Отримання радіомічених похідних Тс-99m є добре відомим у рівні техніки. Дивись, наприклад, Zhuаng еt аl. Nuсlеаr Меdісіnе & Віоlоgу 26(2):217-24, (1999); Оуа еt аl. Nuсlеаr Меdісіnе &Віоlоgу 25(2) :135-40, (1998), та Ноm еt аl. Nuсlеаr Меdісіnе &Віоlоgу 24(6):485-98, (1997). 3 14 На додаток, сполуки можуть бути міченими Н, С 125 та І, способами, добре відомими фахівцю, для визначення амілоїдної бляшки у іn vіtrо та зразків після смерті. Способи заявленого винаходу застосування ізотопів, виявних ядерно-магнітно-резонансною спектроскопією для мети іn vіvо відображення та спектроскопії. Елементи, особливо корисні у магні19 тно-резонансній спектроскопії, охоплюють F та 13 С. Придатні радіоізотопи для мети цього винаходу охоплюють бета-емітери, гамма-емітери, позитрон-емітери, та рентгено-емітери. Ці радіоізотопи 120 123 131 125 18 11 75 76 охоплюють І, І, І, І, F, С, Вr, та Вr. Придатні стабільні ізотопи для застосування у магнітно-резонансній інтроскопії (МRІ) або спектрос19 копі (МRS), згідно з цим винаходом, охоплюють F 13 та С. Придатні радіоізотопи для іn vіtrо кількісного визначення амілоїду у гомогенатах біопсії або 125 14 3 тканин після смерті охоплюють І, С, та Н. 11 18 Кращими радіомітками є С або F для застосу123 вання у іn vіvо ПЕТ-відображенні, І для застосу19 вання у SРЕСТ-відображенні, F для МRS/МRІ, та 3 14 Н або С для іn vіtrо досліджень. Однак, будьякий звичайний спосіб візуалізації діагностичних зондів можна застосовувати згідно з цим винаходом. Сполуки заявленого винаходу можна застосовувати будь-якими засобами, відомими фахівцю. Наприклад, застосування до тварин може бути 35 локальним або системним та здійснюватися перорально, парентерально, інгаляційним розпилюванням, місцево, ректально, назально, букально, вагінально, або за допомогою імплантату. Термін "парентеральний" як це застосовувано тут, охоплює підшкірне, внутрішньовенне, внутрішньоартеріальне, внутрішньом‟язове, інтраперитонеальне, інтратекальне, інтравентрикулярне, інтрастернальне, інтракраніальне та ендостальне уведення та способи вливання. Точний протокол застосування повинен залежати від різних факторів, охоплюючи вік, масу тіла, загальне здоров‟я, стать та харчування пацієнта; визначення конкретних способів застосування зрозуміле фахівцю. Рівні доз порядку приблизно 0,001 мкг/кг/добу 10000 мг/кг/добу сполук винаходу є корисними для способів винаходу. В одному втіленні, рівень доз є приблизно 0,001 мкг/кг/добу - 10 г/кг/добу. У ще одному втіленні рівень доз є приблизно 0,01 мкг/кг/добу - 1,0 г/кг/добу. У ще одному втіленні рівн доз є приблизно 0,1 мг/кг/добу - 100 мг/кг/добу. Конкретні рівні доз для будь-якого конкретного пацієнта залежать від різних факторів, охоплюючи активність та можливу токсичність конкретної сполуки; вік, масу тіла, загальне здоров‟я, стать та харчування пацієнта; час застосування; швидкість виділення; комбінації ліків; та форми застосування. Звичайно, результати іn vіtrо дозування-дія дають корисну інформацію стосовно дози для пацієнта. Дослідження на тваринних моделях також корисні. Міркування стосовно визначення рівнів доз є добре відомими у рівні техніки та фахівцям. Будь-які відомі режими застосування для регулювання часу та послідовності прийому ліків можна застосовувати та повторювати як необхідні для здійснювання лікування у способах винаходу. Режим може охоплювати попереднє лікування та/або співзастосування з додатковими терапевтичними агентами. В одному втіленні, сполуки винаходу застосовують до ссавця, охоплюючи людину, що як очікують, має хворобу, розлад або стан, що характеризується відкладенням амілоїду, або при ризику розвитку цього. Наприклад, тварина може бути літньою людиною. У ще одному втіленні є запропонованими сполуки, корисні як попередники, та способи їх отримання. Такі попередники можна застосовувати як синтетичні вихідні матеріали для уведення мічених молекулярних фрагментів, отримуючи радіомічені заміщені гетероарилом бензотіазоли як агенти відображення амілоїду. Спосіб визначення осаджень амілоїду Іn vіtrо Цей винахід крім того стосується способу визначення відкладень амілоїду іn vіtrо, що полягає у: (і) контактуванні тканини тіла з ефективною кількістю сполуки винаходу, де сполука приєднується до будь-якого з відкладень амілоїду у тканині; та (іі) визначення зв‟язування сполуки з амілоїдними відкладеннями у тканині. Зв‟язування можна визначати будь-якими засобами, відомими у рівні техніки. Приклади засобів визначення охоплюють, без обмеження, мікроско 95267 36 пічні способи, як-то світлопольну, флуоресцентну, лазерно-конфокальну та перехреснополяризаційну мікроскопію. Фармацевтичні композиції Це винахід крім того стосується фармацевтичної композиції, що містить: (і) ефективну кількість принаймні одної сполуки винаходу; та (іі) фармацевтично прийнятний носій. Композиція може містити один або більше додаткових фармацевтично прийнятних інгредієнтів, охоплюючи без обмеження один або більше змочувальних, буферувальних, суспендувальних, змащувальних агентів, емульгаторів, дезинтеграторів, абсорбентів, консервантів, ПАР, барвників, ароматизаторів, підсолоджувачів та терапевтичних агентів. Композицію можна формувати у твердій, рідкій формі, або як гель чи суспензію для: (1) перорального застосування як, наприклад, водний або неводний розчин чи суспензія), таблетка (наприклад, для букального, сублігнвального або системного поглинання), болюс, порошок, гранула, паста для застосування до язика, тверда желатинова капсула, м‟яка желатинова капсула, розчини для розпилювання у роті, емульсі та мікроемульсі; (2) парентерального застосування, як-то підшкірне, внутрішньом‟язове, внутрішньовенне або епідуральне уведення як, наприклад, стерильний розчин, суспензія або композиція для безперервного вивільнення; (3) місцевого застосування як, наприклад, крем, мазь, пластир для контрольованого вивільнення або розчин для розпилювання на шкіру; (4) інтравагінального або інтраректального застосування як, наприклад, песарій, крем або пінка; (5) сублігнвального застосування; (6) очного застосування; (7) трансдермального застосування; або (8) назального застосування. В одному втіленні, композицію формують для внутрішньовенного застосування, а носій охоплює рідкий та/або живільний репленішер. У ще одному втіленні композиці здатна специфічно зв‟язуватися з амілоїдом іn vіvо, перетинати бар‟єр кров-мозк, є нетоксичною при прийнятних рівнях доз та/або має задовільну тривалість дії. У ще одному втіленні композиція містить приблизно 10 мг альбуміну сироватки людини та приблизно від 0,0005 до 500 мг сполуки заявленого винаходу на мл фосфатного буферу, що містить NаСl. Заявлений винахід крім того стосується композиції, що містить сполуку формули І, та принаймні одмн фармацевтично прийнятний носій, розріджувач або наповнювач. Заявлений винахід крім того стосується способів лікування або профілактики Аβ-спорідненої патології у пацієнта, що полягає у призначенні пацієнту терапевтично ефективної кількості сполуки формули І. Заявлений винахід крім того стосується сполуки формули І для застосування як медикаменту. Заявлений винахід крім того стосується сполуки формули І для виробництва медикаменту. Деякі сполуки формули І мають стереогенні центри та/або геометричні ізомерні центри (Е- та Z- ізомери), та зрозуміло, що винахід стосується усіх таких оптичних ізомерів, енантіомерів, діасте 37 реоізомерів, атропізомерів та геометричних ізомерів. Заявлений винахід стосується застосування сполук формули І, а також їх солей. Солі для застосування у фармацевтичних композиціях повинні бути фармацевтично прийнятними солями, але інші солі можуть бути корисними при отриманні сполук формули І. Сполуки винаходу можна застосовувати як медикаменти. У деяких втіленнях заявлений винахід стосується сполуки формули І, або її фармацевтично прийнятних солей, таутомерів або здатних до гідролізу іn vіvо попередників, для застосування як медикаментів. У деяких втіленнях заявлений винахід стосується описаної тут сполуки для застосування як медикаментіів для лікування або профілактики Аβ-спорідненої патології. В інших втіленнях Аβ-спорідненою патологією є синдром Дауна, β-амілоїдна ангіопатія, церебральна амілоїдна ангіопатія, спадкова церебральна геморагія, розлад, асоційований з когнітивним порушенням, МСІ (“помірне когнітивне порушення”), хвороба Альцгеймера, втрата пам‟яті, симптоми дефіциту уваги, асоційовані з хворобою Альцгеймера, нейродегенерація, асоційован з хворобою Альцгеймера, деменція змішаного судинного походження, деменція дегенеративного походження, пресенільна деменція, сенільна деменція, деменція, асоційована з хворобою Паркінсона, прогресуючий супрануклеарний параліч або кортикальна базальна дегенераці. Винахід крім того стосується терапії для лікування: Нейродегенеративних розладів охоплюючи, але без обмеження деменцію, когнітивну недостатність при шизофренії, когнітивну недостатність при шизофреній (КНШ), помірні когнітивні порушення (МСІ), асоційоване з віком порушення пам‟яті (ААМІ), споріднене з віком когнітивне зниження (АRСD), когнітивне порушення баз деменції (СІND), розсіяний склероз, хворобу Паркінсона (РD), постенцефалітний паркінсонізм, хворобу Хантингтона, атрофічний бічний склероз (АLS), моторно-нейроні хвороби (МND), багатосистемну атрофію (МSА), кортикальнобазальну дегенерацію, прогресуючий супрануклеарний парез, синдром Джилліана-Барра (GВS), та хронічну запальну демієлінізувальну полінейропатію (СІDР). Деменція охоплює, але без обмеження, синдром Дауна, судинну деменцію, деменцію з тільцями Леві, ВІЛдеменцію, лобноскроневу деменцію типу Паркінсона (FТDР), хворобу Піка, хворобу Ніеманна-Піка, травматичне поранення мозку (ТВІ), деменцію боксерів, хворобу Крейтцфельда-Якоба та пріонні хвороби. Способи отримання Заявлений винахід також стосується способів отримання сполуки формули І як вільної основи, кислоти або її фармацевтично прийнятної солі. Зрозуміло, що де прийнятно, придатні захисні групи треба додавати, та згодом видаляти, від різних реагенти та інтермедіати таким чином, що повинен легко розуміти фахівець. Звичайні способи застосування таких захисних груп, а також приклади придатних захисних груп є описаними, наприклад, 95267 38 у «Рrоtесtіvе Grоuрs іn Оrgаnіс Sуnthеsіs”, Т.W. Grееn, Р.G.М. Wuts, Wіlеу-Іntеrsсіеnсе, Nеw Yоrk, (1999). Також зрозуміло, що перетворення групи або заміснику в іншу групу або замісник можна проводити на будь-якому інтермедіаті або кінцевому продукті у синтезі кінцевого продукту, у котрому можливий тип перетворення є обмеженим тільки притаманною несумісністю інших функціональних груп у молекулі на тому етапі до умов або реагентів, застосовуваних у перетворенні. Така притаманна несумісність та шляхи її обходу проведенням прийнятних перетворень та етапів синтезу у придатному порядку, повинні бути легко зрозумілими фахівцю. Приклади перетворень є наведеними нижче, та зрозуміло, що описані перетворення не є обмеженими тільки загальними групами або замісниками, для котрих показані перетворення. Посилання та опис інших придатних перетворень є наведеними у “Соmрrеhеnsіvе Оrgаnіс Тrаnsfоrmаtіоns - А Guіdе tо Funсtіоnаl Grоuр Рrераrаtіоns” R. С. Lаrосk, VНС Рublіshеrs, Іnс. (1989). Посилання та опис інших придатних реакції є описаними, наприклад, у “Аdvаnсеd Оrgаnіс Сhеmіstrу”, Маrсh 4th еd. МсGrаw Ніll (1992) оr, “Оrgаnіс Sуnthеsіs”, Smіth, МсGrаw Ніll, (1994). Способи очистки інтермедіатів та кінцеві продукти охоплюють, наприклад, пряму та зворотно-фазову хроматографію на колонці або обертовому планшеті, перекристалізацією, перегонкою та екстракцією з рідини або твердого матеріалу що повинен легко розуміти фахівець. Визначення замісників та груп є у формулі І за винятком того, де визначено інакше. Терміни “кімнатна температура” та “зовнішня температура” означають, якщо не визначене інше, температуру між 16 та 25 °С. Термін “кип‟ятіння під зворотним холодильником” означає, якщо не визначене інше, у посиланні на застосовуваний розчинник, температуру трохи вищу точки кипіння названого розчиннику. Зрозуміло, що мікрохвилі можна застосовувати для нагрівання реакційної суміші. Терміни “флешхроматографія” або “флеш-хроматографія на колонці” означають препаративну хроматографію на силіцій оксиді, застосовуючи органічний розчинник, або його суміші, як рухому фазу. Скорочення BINAP 2,2'-біс(дифенілфосфіно)-1,1'-бінафтил DBA дибензиліденацетон; ДХМ дихлорметан; DME 1,2-диметоксіетан; DMF диметилформамід; DMSO диметилсульфоксид; dppf 1,1'-біс(дифенілфосфіно)фероцен; ЕА етилацетат; EtOAc етилацетат; ЕtOН етанол; hep гептан; hex гексани; LAH літій алюмогідрид; MeCN ацетонітрил; MeOH метанол; NaHMDS натрій гексаметил дисилазид; Pd(dppf)CI2*ДXM або Pd(dppf)CI2*CH2CI2: адукт (1,1' 39 95267 біс(дифенілфосфіно)фероцен)паладій(ІІ) хлорид дихлорметан; TBAF тетра-N-бутиламонію флуорид TBDMS трет-бутилдиметилсиліл; TFA трифлуороцтова кислота; THF тетрагідрофуран; NEt3 триетиламін; Off тіометил. Отримання інтермедіатів Сполуки формули ІІ, ІІІ, ІV V та VІ є корисними інтермедіатами в отриманні сполуки формули І. R1, R2, R3, а Х1 - Х4 визначають як у формулі І. Сполуки формули ІІ-VІ є комерційно доступними, або їх можна отримувати з комерційно доступних, або описаних у літературі сполуки. Наприклад, сполуки, у котрих один або більше з Y1, Y2, Y3, Y4, R1, R2 та R3 не відповідає визначенню формули ІІ -VІ, можна застосовувати для отримання сполуки формули ІІ-VІ перетворенням або уведенням замісників або груп. Такі приклади є наведеними нижче: Y1=H, F, СІ, Вr, І, OTf, SMe, B(OH)2, B(Oalkyl)2, Sn(n-Bu)3, MgX, ZnX Y2= F, Cl, Br, I, OTf, SMe, B(OH)2, B(Oalkyl)2, Sn(nBu)3, MgX, ZnX Y3= I, CHO, COOH, COCI, CN, COOalkyl,CONH2, CSNH2 бетахлорцинамалдегід або еквівалентні похідні карбонової кислоти R1 H N R2 Y4 X1 X3 S R3 X2 X4 Y4=H, Br (VI) 1) Отримання сполуки формули ІІ або ІІІ, у котрих Y1 та Y2, відповідно, представляють В(Оалкіл)2, В(ОН)2, МgХ або ZnХ: а) З відповідних хлоридів, бромідів, йодидів або трифлатів каталізованим паладієм борилуванням, наприклад, біс(пінаколято)дибораном, застосовуючи, наприклад, РdСl2(dррf), або Рd(dbа)2 з доданим трициклогексилфосфіном, як каталізаторами, разом зі стехіометричною кількістю основи, як-то КОАс та NЕt3 у розчинниках, як-то ДМСО, ДМФ, ДМА або діоксан при температурі від 40 кімнатної температури до 80 °С, альтернативно згодом кислотним гідролізом (Іshіуаmа еt аl. Теtrаhеdrоn 2001, 57, 9813; Мurаtа еt аl. J. Оrg. Сhеm. 2000, 65, 164). b) З відповідних хлоридів, бромідів або йодидів спочатку перетворенням в арилмагнієвий (Y1 або Y2 = МgХ) або літієвий реагент обробкою, наприклад, nВuLі, nВu3МgLі або Мg, а потім реакцією, наприклад, з триізопропілборатом тощо, та альтернативно згодом кислотним гідролізом, отримуючи відповідні бориловані сполуки, або з порошком цинку, отримуючи відповідні органічні Zn-сполуки. 2) Отримання сполуки формули ІІ, у котрій Y1 галогенід: а) З відповідного незаміщеного бензотіазолу (Y1=Н) металуванням літієвим реагентом, як-то nВuLі, а потім обміном метал-галоген, застосовуючи галоген-сполуку, як-то ССl4, СВr4 або І2 (Воgа еt аl. J. Оrgаnоmеtаllіс Сhеm 2000, 601, 233) b) З відповідного аміну реакцією Сандмеєра, ініційованою перетворенням аміну у сіль діазонію, а потім обробкою купрум хлоридом або купрум бромідом (Dаs еt аl. Віооrg. & Меd. Сhеm. Lеtt. 2003, 13, 2587). 3) Отримання сполуки формули ІІ або ІІІ, у котрій Y1 та Y2 відповідно є трифлат: З відповідного спирту перетворенням у трифлат, застосовуючи О(SО2СF3)2 та основу, як-то триетиламін та піридин. 4) Отримання сполуки формули ІІ або ІІІ, у котрій Y1 та Y2 відповідно є тіоетером, як-то тіометил: З відповідного тіолу обробкою метилйодидом у розчиннику, як-то ДМФ МеСN або ДХМ в основних умовах (Каrlssоn еt аl. Віооrg. & Меd. Сhеm. 2004, 12, 2369). 5) Отримання сполуки формули ІІ або ІІІ, у котрій Y1 та Y2 відповідно є Sn(nВu)3 або Sn(Ме)3, Sn(Рh)3 або ZnХ: З відповідного незаміщеного бензотіазолу (Y1=Н) металуванням літієвим реагентом, як-то МеLі або nВuLі, а потім трансметалуванням, застосовуючи стануморганічні хлориди, як-то Ме3SnСl або nВu3SnСl, або сіль цинку (Моllоу еt аl. J. Оrgаnоmеtаllіс Сhеm 1989, 365, 61) 6) Отримання інтермедіату ІV а) З відповідних 2-аміно-бензотіазолів основним гідролізом, застосовуючи основу, як-то водн. КОН, NаОН у розчиннику, як-то етиленгліколь, етанол та вода при підвищених температурах. (Маthіs еt аl. J. Меd. Сhеm. 2003, 46, 2740; Іnоuе еt аl. Сhеm. Рhаrm. Вull. 1997, 45, 1008). b) З відповідного бензотіазолу гідразинолізом, застосовуючи гідразин у розчиннику, як-то етанол, при підвищених температурах. (Тsuruоkа еt аl. Сhеm. Рhаrm. Вull. 1998, 46, 623) 7) Отримання інтермедіату VІ Відповідним чином заміщений анілін претворюють у бензоїламід сполученням з прийнятним хлорангідридом кислоти. Бензоїламід згодом перетворюють у відповідний бензоїлтіоамід, застосовуючи реагент Лауссона у розчиннику, як-то НМРА або хлорбензол. (Shі еt аl. J. Меd. Сhеm. 1996, 39, 3375; Маthіs еt аl. J. Меd. Сhеm. 2003, 46, 41 2740; Нutсhіnsоn еt аl. J. Меd. Сhеm. 2001, 44, 1446). Способи отримання немічених сполук формули І Необмежувальні приклади способів отримання сполуки формули І є наведеними нижче: 1) Отримання каталізованими Рd або Nі реакціями перехресного сполучення інтермедіатів ІІ та ІІІ: а) Каталізоване паладієм сполучення Сузукі арилгалогенідів або псевдогалогенідів, інтермедіатів формули ІІ та ІІІ (наприклад, Y1,Y2 = хлорид, бромід, йодид або трифлат) з бороновими кислотами або естерами формули ІІІ або ІІ (Y1,Y2 = В(ОН)2, В(Оалкіл)2), відповідно. Паладієвий каталізатор, як-то Рd(dррf)Сl2*ДХМ, РdСl2(РРh3)2, Рd(РРh3)4 або Рd2(dbа)3, застосовують у комбінації зі стехіометричною кількістю основи, як-то K2СО3 (водн.), K3РО4, NаОН (водн.) або NаНСО3 (водн.), у розчинниках, як-то ДМЕ, ДМФ, ТГФ, толуол або діоксан, при температурі від кімнатної температури. до 120 °С (Кumаr еt аl. J. Мітк Соmрd. Rаdіорhаrm. 2003, 46, 1055; Маjо еt аl. Теtrаhеdrоn Lеtt. 2003, 44, 8535; Аrtеrburn еt аl. Сhеm. Соmmun. 2003, 1890). b) Каталізоване паладієм та опосередковане купрум(І) перехресне сполучення тіоетерів інтермедіатів формули ІІ та ІІІ (наприклад, Y1,Y2 = SМе) з бороновими кислотами або естерами або стананами формули ІІІ або ІІ (наприклад, Y1,Y2 = В(ОН)2, В(Оалкіл)2, Sn(н-Вu)3), відповідно. Паладієвий каталізатор, як-то Рd(dbа)2, разом з адитивами, як-то трис(2-фурил)фосфін та ZnОАс, можна застосовувати у розчиннику, як-то ТГФ, у випадку сполучення боронових кислот або естерів (Lіеbеskіnd еt аl. Оrg. Lеtt. 2002, 4, 979). У випадку сполучення стананів, паладієвий каталізатор, як-то Рd(РРh3)4 або РdСl(РРh3)2(СН2Рh), можна застосовувати у розчиннику, як-то ТГФ (Lіеbеskіnd еt аl. Оrg. Lеtt. 2003, 5, 801). с) Каталізоване паладієм сполучення Стилла арилгалогенідів або псевдогалогенідів, інтермедіатів формули ІІ та ІІІ (наприклад, Y1,Y2 = хлорид, бромід, йодид або трифлат) з арилстананами формули ІІІ або ІІ (наприклад, Y1,Y2 = Sn(н-Вu)3), відповідно. Паладієвий каталізатор, як-то Рd(РРh3)Сl2, Рd(РРh3)4, або Рd2(dbа)3 разом з адитивами, як-то СuІ, три-феніларсин, три-2фурилфосфін, можна застосовувати у розчинниках, як-то ДМФ, ТГФ, толуол або ксилол, при температурі від кімнатної температури. до 120°С (Веnhіdа еt аl. Теtrаhеdrоn Lеtt. 1999, 40, 5701). d) Каталізоване нікелем перехресне сполучення галогенідів інтермедіатів формули ІІ та ІІІ (наприклад, Y1,Y2 = Сl, Вr, І) з реагентами Гриньяра формули ІІІ або ІІ (наприклад, Y1,Y2 = МgВr), відповідно. Нікелевий каталізатор, як-то NіСl2(РЕt3)2, NіСl2(РРh3)2 або NіСl2(Рh2РСН2СН2СН2РРh2), можна застосовувати у розчинниках, як-то ТГФ, при підвищеній температурі. (Ваbudrі еt аl. Теtrаhеdrоn 1983, 39, 1515). е) Каталізоване паладієм та опосередковане купрум(І) перехресне сполучення бензотіазолів ІІ (Y1 = Н) з бромідами формули ІІІ (Y2 = Вr). Паладієвий каталізатор, як-то Рd(ОАс)2, разом із співка 95267 42 талізатором, як-то СuВr, та адитивами, як-то ліганд Р(т-Вu)3, та основа Сs2СО3, можна застосовувати у розчиннику, як-то ДМФ, при підвищеній температурі (Yоkооjі еt аl. Теtrаhеdrоn 2003, 59, 5685 та Аlаgіllе еt аl. Теtrаhеdrоn Lеtt. 2005, 46, 1349). 2) Отримання застосуванням сполук ІV та V як вихідних матеріалів: (а) Конденсація орто-амінотіофенолу ІV з інтермедіатом V, у котрому Y3 - альдегід, карбонова кислота, хлорангідрид кислоти, нітрил, естер фенолу, ангідрид, амід, тіоамід або еквівалентні похідні карбонових кислот у розчинниках, як-то ДМСО, ЕtОН, толуол, СНСl3, піридин або іонні рідини, при температурі від кімнатної температури. до 220 °С звичайним нагріванням або мікрохвильовим опромінюванням. Адитив, як-то поліфосфатна кислота, скандій трифлат, церій амоній нітрат або силіцій оксид, застосовують для полегшення реакції (Маthіs еt аl. J. Меd. Сhеm. 2003, 46, 2740; Коdоmаrі еt аl. Sуnth. Соmmun. 2004, 34, 3029; Неіn еt аl. J. Аm. Сhеm. Sос. 1957, 79, 427; Каrlssоn еt аl. Віооrg. & Меd. Сhеm. 2004, 12, 2369; Таlе Оrg. Lеtt. 2002, 4, 1641; Сhаkrаbоrtі еt аl. Sуnlеtt 2004, 1533; Маtsushіtа еt аl. Теtrаhеdrоn Lеtt. 2004, 45, 313; Dуеs та Ріgmеnts 1990, 12, 243-8; Аrсhіv dеr Рhаrmаzіе 1991, 324, 185). (b) Реагування орто-амінотіофенолів ІV з інтермедіатами V, у котрих Y3 - галогенід, каталізованим паладієм карбонілуванням при високому тиску при наявності 2,6-лутидину, у розчинниках, як-то диметил ацетамід. (Реrrу еt аl. Оrgаnоmеtаllісs 1994, 13, 3346). (с) Мікрохвильовим нагріванням опосередкована реакція о-амінотіофенолів ІV з інтермедіатом V, у котрому Y3 - β-хлорцинамальдегід, при наявності п-ТsОН (Раul еt аl. Sуnth. Соmmun 2002, 32, 3541). 3. Наступні інші шляхи можна застосовувати для синтезу сполук формули І починаючи з інтермедіатів формули VІ: а) Способом Якобсона оксидативною радикальною циклізацією тіоанілідів VІ (Y3=Н) обробкою надлишком калій феріціаніду при підвищеній температурі в основних умовах (Маthіs еt аl. J. Меd. Сhеm. 2003, 46, 2740; Нutсhіnsоn еt аl. J. Меd. Сhеm. 2001, 44, 1446; Shі еt аl. J. Меd. Сhеm. 1996, 39, 3375; Zеіtsсhrіft fuеr Сhеmіе 1985, 25, 23). b) Внутрішньомолекулярною циклізацією обром-заміщених тіоанілідів VІ (Y4 = Вr) в основних умовах, наприклад, з NаН як основою у NМР як розчиннику (Нutсhіnsоn еt аl. Теtrаhеdrоn Lеtt 2000, 41, 425; Нutсhіnsоn еt аl. J. Меd. Сhеm. 2001, 44, 1446), або каталізом паладієм (Веnеdі еt аl. Теtrаhеdrоn Lеtt 2003, 44, 6073). Способи отримання попередників формули VІІ H R4 S 6 O X1 X2 Q N 5 H X3 X4 H N R5 VII Необмежувальні приклади способів отримання попередників формули VІІ є наведеними нижче. Сполуки формули VІІ є корисними попередниками 43 11 для отримання [ С]метил-мічених сполук формули І. Отримання інтермедіатів, корисних для отримання попередників VІІ Сполуки формули VІІІ, ІХ, Х, ХІ, ХІІ та ХІІІ є корисними інтермедіатами в отриманні попередників формули VІІ. R4, R5 та Х1 до Х4 визначають як у формулі VІІ. Сполуки формули VІІІ-ХІІІ є комерційно доступними, або їх можна отримувати з комерційно доступних зразків, або необмежувальні способи їх отримання є описаними тут або у літературі. Наприклад, сполуки, у котрих один або більше з Y3, Y4, Y5, Y6, R4 або R5 не відповідає визначенню формули VІІІ-ХІІІ, можна застосовувати для отримання сполуки формули VІІІ-ХІІІ перетвореннями або уведенням замісників або групи. Такі приклади є наведеними нижче: Y5 = СІ, Br, I, OTf, B(OH)2, B(Oalkyl)2, Sn(n-Bu)3, MgX Y6 = Cl, Br, I, OTf, B(OH)2, B(Oalkyl)2, Sn(nBu)3, MgX Y3 = I, CHO, COOH, COCI, CN, COOalkyl,CONH2, CSNH2, betachlorocinnamaldehyde or equivalent carboxylic acid derivatives 1) Отримання сполуки формули VІІІ: а) Каталізоване паладієм сполучення Сузукі арилгалогенідів або псевдогалогенідів, інтермедіатів формули ІІ (R1 або R2 = ОН) та Х (наприклад, Y5, Y6 = хлорид, бромід, йодид або трифлат) з бороновими кислотами або естерами формули Х або ІІ (R1 або R2 = ОН, Y5, Y6 = В(ОН)2 або В(Оалкіл)2), відповідно, способом, описаним для отримання сполуки І. Коли R1 або R2 формули ІІ є захищеною 95267 44 гідроксигрупою, та застосовувана захисна група є нестабільною в стандартних водних основних умовах Сузукі, як у випадку, наприклад, тбутилдиметилсиліл-захищеної гідроксигрупи, її треба звичайно відщеплювати при реакції для створення продукту, у котрому вищезгадана захищена гідроксигрупа є знайдена як вільний гідроксил. b) Каталізоване паладієм сполучення Стилла арилгалогенідів або псевдогалогенідів, інтермедіатів формули ІІ (R1 або R2 = ОН) та Х (наприклад, Y5, Y6 = хлорид, бромід, йодид або трифлат) з арилстананами формули Х або ІІ (R1 або R2 = ОН, Y5, Y6 = наприклад, Sn(н-Вu)3), відповідно, способом, описаним в отриманні сполук І. с) Застосуванням сполук ХІ та ХІІ як вихідних матеріалів аналогчно способам. описаним для отримання сполуки І починаючи з ІV та V. d) Починаючи з інтермедіатів ХІІІ аналогчно синтезу І з VІ. 2) Отримання ІХ та Х, у котрих Y5 та Y6 - галогенід, трифлат, В(Оалкіл)2, В(ОН)2, Sn(н-Вu)3 або МgХ, можна здійснити тими ж способами, як описано для отримання відповідних сполук ІІ, у котрій R1 або R2 - О-R4, де R4 - придатна захисна група, сумісна з відповідними умовами реакції, застосовувана як добре відом фахівцю. 3) Сполуки ХІ та ХІІІ можна отримувати згідно з синтезом інтермедіатів ІV та VІ. Способи отримання попередників формули VІІ У синтезі попередників VІІ захисну групу R4 можна уводити на похідне бензотіазолу перед сполученням продукованих звідси інтермедіатів ІХ з інтермедіатами Х, або після конденсації похідних бензотіазолу з гетероциклами Х, тобто на структури VІІІ. Усі захисні групи, що представляють R4, можна уводити звичайними способами. Необмежувальні приклади способів отримання попередників формули VІІ є наведеними нижче: 1) Реагування інтермедіатів VІІІ з силілувальним агентом, як-то т-бутилдиметилсилілхлорид, при наявності основи, як-то імідазол або триетиламін, у розчиннику, як-то ДМФ або ДХМ, при температурі від 0 °С до кімнатної температури. 2) Інтермедіати VІІІ можна обробляти 2(триметилсиліл)етоксиметилхлоридом та основою, наприклад, (і-Рr)2NЕt, NаН або Еt3N при наявності DМАР, у розчиннику, як-то ДХМ, ДМФ або бензол, при кімнатній температурі або підвищеній температурі. 3) Обробкою VІІІ п-метоксибензилбромідом та основою, як-то (і-Рr)2NЕt у ДХМ при зовнішній температурі. 4) Каталізоване перехідним металом перехресне сполучення інтермедіатів ІХ та Х: Попередники VІІ можна отримувати від інтермедіати ІХ та Х каталізованими металом реакціями перехресного сполучення, описаними для отримання сполуки І сполученням ІІ (R1 або R2 = ОН) та ІІІ, за умови, що R4-група є стабільною у застосовуваних умовах. 5) Отримання попередників формули VІІ можна здійснити міжмолекулярною реакцією між інтермедіатами ХІ та ХІІ, або альтернативно, внутрішньомолекулярною реакцією ХІІІ, згідно з 45 способами 1с та 1d, відповідно, як описано для синтезу VІІІ. Способи отримання мічених сполук формули І Загалом, ті ж реакції синтезу, застосовувані для створення немічених сполук формули І з немічених реагентів або інтермедіатів, можна застосовувати для аналогчного уведення виявного ізотопу застосуванням відповідних мічених реагентів або інтермедіатів. Краще уводити мітку на пізньому етапі синтезу сполуки формули І, особливо якщо мітка є ізотопом із відносно коротким періодом напівперетво11 рення, як-то С. Найбільш кращим є робити це уведення як останній етап синтезу. Кілька корисних реагентів, синтонів або інтермедіатів, мічених довгоживучими або нерадіоакти2/3 вними ізотопами, охоплюючи, наприклад, [ Н]Н2, 2/3 13/14 13/14 13/14 [ Н]СН3І, [ С]СН3І, [ С]СN , [ С]СО2 є комерційно доступними та їх можна, при необхідності, далі синтетично претворювати звичайними способами синтезу. Реагенти мічені більше 11 18 короткоживучими ізотопами, як-то С та F, створюють на циклотроні, а потім придатним уловлюванням та необов‟язково синтезом для отримання бажаного реагенту. Створення та синтез мічених реагентів та інтермедіатів та застосування цих попередників для синтезу більш складних мічених молекул, є добре відомими фахівцям з радіосинтезу та мічення та оглянуті у літературі (Långström еt аl. Асtа Сhеm. Sсаnd. 1999, 53, 651). Для додаткового посилання дивись, наприклад: Аlі еt аl. Sуnthеsіs 1996, 423 для мічення галогенами; Аntоnі G., Кіhlbеrg Т., та Långström В. (2003) Наndbооk оf nuсlеаr сhеmіstrу, еdіtеd bу Vеrtеs А., Nаgу S., та Кlеnsсаr Z., Vоl. 4, 119-165 для мічення для ПЕТ-застосуванняs; Sаljоughіаn еt аl. Sуnthеsіs 3 2002, 1781 для мічення Н; МсСаrthу еt аl. Сurr. 14 Рhаrm. Dеs. 2000, 6, 1057 для мічення із С. Виявні ізотопи, корисні для мічення сполук формули І, охоплюють, для застосування у ПЕТ: 11 18 75 76 120 С, F, Вr, Вr та І, для застосування у 123 131 19 SРЕСТ: І та І, для МRІ-застосування: F та 13 С, для визначення іn vіtrо та зразків після смерті: 3 14 125 Н, С та І. Найбільш корисними ізотопами для 11 18 123 19 3 14 мічення є С, F, І, F, Н та С. Нижченаведено необмежувальний опис способів отримання мічених сполук формули І: Сполуки формули І, у котрих R1, R2 або R3 гідроксил, аміно або аміноалкіл, є корисними попередниками для О- та N-алкілування, відповідно, з міченим алкілувальним агентом, як-то 11 [ С]метилйодид або трифлат, як описано, наприклад, Sоlbасh еt аl. Аррlіеd Rаdіаtіоn аnd Іsоtореs 2005, 62, 591 та Маthіs еt аl. J. Меd. Сhеm. 2003, 3 14 46, 2740, [ Н]-метилйодид , або [ С]-метилйодид. Наприклад, сполуки формули І, у котрих R1 або R2 - гідроксил (інший - гідроген), Х1 або Х2 нітроген (інший - карбон), Х3 та Х4 - карбон, та R3 - аміно або амінометил, є придатними попередниками для мічення. Обробка надлишку будь-якого з 11 цих попередники С-метилтрифлатом, у розчиннику, як-то ацетон, без доданої основи, призводить до селективного N-алкілування та таким чи11 ном утворення відповідних мічених С сполук 11 формули І, у котрих R3 претворюють у NН[ С]СН3 95267 46 11 (з аміно) та NСН3[ С]СН3 (з амінометилу), відповідно. Коли ті ж вищезгадані попередники, однак, 11 обробляють [ С]метилйодидом в основних умоваї, як-то при наявності калій карбонату, у розчиннику, як-то ДМСО, селективне О-алкілування відбувається внаслідок відносно вищої реактивності оксигену після депротонування, та таким чином при утворенні сполуки формули І, у котрій ОН11 групу (R1 або R2) претворено у О[ С]СН3-групу. Найбільш придатними та кращими попередни11 ками для мічення селективним уведенням Сметилу N-алкілуванням, є сполуки, у котрих реактивність до алкілування, наявної конкурувальної нуклеофільної функціональної групи, як-то гідроксил, є зниженою або блокованою придатною захисною групою. Функція захисної групи є у цьому контексті захищати нуклеофільну функціональну групу від алкілування та переважно бути стабільною у неводних основних умовах, при котрих бажане N-алкілування полегшується, але легко видалятися іншими засобами після виконання своїх функцій. Такі захисні групи та способи їх уведення та видалення є добре відомими фахівцю. Приклади захисних груп, корисних для захисту ароматичних гідроксигруп від конкурувального алкілування, охоплюють, але без обмеження, метил, 2(триметилсиліл)етоксиметил, алкоксиметил та тбутилдиметилсиліл. Видалення такої захисної групи після алкілування є добре відомим фахівцю та охоплює, у випадку захисних груп на основі силілу, як-то т-бутилдиметилсилілу, наприклад, обробку джерелом флуориду, як-то ТВАF, або обробку водю в основних умовах у придатному розчиннику, як-то ДМСО, при наявності КОН при кімнатній температурі. Сполуки формули І, у котрих R1, R2, або R3 аміно, є корисними попередниками для мічення спочатку діазотуванням, коли прийнятно, з наступним перетворенням у відповідне триазинове похідне, перед наступною обробкою міченими нуклеофільними реагентами стандартними реакціями. Виявні ізотопи, що можна уводити цим шляхом, 18 75 123 125 охоплюють, але без обмеження F, Вr, І, І 131 та І як описано, наприклад, Zhu еt аl. J. Оrg. Сhеm. 2002, 67, 943; Маеdа еt аl. J. Lаbеl Соmрd Rаdіорhаrm 1985, 22, 487; Веrrіdgе еt аl. J. Lаbеl Соmрd Rаdіорhаrm 1985, 22, 687; Suеhіrо еt аl. J. Lаbеl Соmрd Rаdіорhаrm 1987, 24, 1143; Strоuрhаuеr еt аl. Іnt. J. Аррl. Rаdіаt. Іsоt. 1984, 35, 787; Коrtуlеvісz еt аl. J. Lаbеl Соmрd Rаdіорhаrm 1994, 34, 1129; Кhаlаj еt аl. J. Lаbеl Соmрd Rаdіорhаrm 2001, 44, 235 та Rzесzоtаrskі еt аl. J. Меd. Сhеm. 1984, 27, 156. У сполуках формули І, де R1, R2, або R3 триалкілстанум-група, галогенування міченими реагентами призводить до заміщення триалкілстанум-групи, як описано, наприклад, Stаеlеns еt аl. J. Lаbеl Соmрd Rаdіорhаrm 2005, 48, 101; Носkе еt аl. Віооrg. Меd. Сhеm. Lеtt. 2004, 14, 3963; Zhuаng еt аl. J. Меd. Сhеm. 2003, 46, 237; Füсhtnеr еt аl. Аррl. Rаd. Іsоt. 2003, 58, 575 та Као еt аl. J. Lаbеl Соmрd Rаdіорhаrm 2001, 44, 889. Ті ж попередники є також корисними для каталізованого паладієм 11 перетворення у відповідні С-мічені кетони та метил-похідні як описано, наприклад, Lіdström еt аl. J. 47 Сhеm. Sос. Реrkіn Тrаns. 1 1997, 2701 та Таrkіаіnеn еt аl. J. Lаbеl Соmрd Rаdіорhаrm 2001, 44, 1013. Заміщені триалкілстанумом сполуки, у свою чергу, краще отримувати з відповідних галогенідів або псевдогалогенідів, як-то трифлати, добре відомими способами, застосовуючи паладій як каталізатор у реакції з відповідним дистананом. Коли застосовують цю методологію, триалкілстанумгрупою є краще триметилстанум або трибутилстанум. Коли R1, R2, або R3 у сполуці формули І, є відщеплюваною групою, придатною для нуклеофільного ароматичного заміщення, мічений нуклеофіл, як-то галогенід або ціанід, можна уводити таким заміщенням, що дає результатом мічену сполуку формули І, як описано, наприклад, Zhаng еt аl. Аррl. Rаd. Іsоt. 2002, 57, 145. Ароматичне кільце, на котрому заміщення має місце, є кращим відносно електроно-дефіцитних для полегшення реакції, та може тому бути необхідність у заміщенні електрофільною активувальною групою, як-то ціано, карбальдегідна або нітро. Корисні реакції, споріднені з нуклеофільним ароматичним заміщенням та добре відомі фахівцю, охоплюють застосування стехіометричної кількості солі купруму для уведення міченого атом йоду, та застосування 11 каталізу паладієм для уведення С-міченої ціаногрупи, як описано, наприклад, Мusасіо еt аl. J. Lаbеl Соmрd Rаdіорhаrm 1997, 34, 39 та Аndеrssоn еt аl. J. Lаbеl Соmрd Rаdіорhаrm 1998, 41, 567 відповідно. Якщо ароматичне кільце, на котрому є розташованою відщеплювана група, є більш електрондефіцитнимt у порівнянні з бензолом, як-то Q формули І, як визначено тут, це загалом не є необхідним для застосування активувальної групи для електрофільного ароматичного заміщення. Сполуки формули І, де R3 - будь-яка з відщеплюваних груп: флуор, хлор, бром, йод, або сульфоналестер, та будь-який чи обидва Х2 та Х4 - нітроген, є придатними попередники для мічення нуклеофільним ароматичним заміщенням R3. Крім того, загалом краще застосовувати відщеплювану групу, що є хімічно відмінною від групи, уведеної реакцією із міченим нуклеофілом, для полегшення хроматографічного відділення міченого продукту реакції від невитраченого попереднику. Додаткові корисні способи, добре відомі фахівцю, для отримання мічених сполук формули І перетвореннями функціональних груп придатних попередників охоплюють N-ацилування амінів 11 14 3 [ С], [ С], або [ Н]ацилхлоридами, каталізоване 11 14 паладієм [ С] або [ С] ціанування ароматичних хлоридів, бромідів або йодидіів, каталізоване перехідним металом заміщення придатних галогені3 3 дів на Н при наявності [ Н]Н2, та каталізоване 11/14 паладієм карбонілування [ С]СО (Реrrу еt аl. Оrgаnоmеtаllісs 1994, 13, 3346). Приклади сполук Нижченаведено ряд необмежувальних прикладів сполук винаходу. Усі з нижче представлених сполук або їх відповідних немічених аналогів, виявляють ІК50 менше, ніж 20 мкМ у дослідженні конкурентного зв‟язування, описаному тут. Загальні Способи 95267 48 Усі застосовувані розчинники були аналітичного гатунку та комерційно доступними безводн розчинники були звичайно застосовуваними для реакції. Реакції були звичайно проведеними в інертній атмосфері азоту чи аргону. 1 Н спектри реєстрували на спектрометрі Вrukеr аv400 ЯМР, при 400 МГц для протона, з 3 мм вимірювальною головкою для уведення SЕІ 1 13 Н/D- С із Z-градієнтами, застосовуючи маніпулятор ВЕSТ 215 для уведення зразку, або на спектрометрі Вrukеr DРХ400 ЯМР при 400 МГц для протону, з 5 мм 4-центровою вимірювальною головкою із Z-градієнтами. 1 Якщо не визначене інше, у прикладах Н спектри реєстрували при 400 МГц у ДМСО-d6 як розчиннику. Застосували залишковий сигнал розчиннику як внутрішній стандарт. Застосували такі сигнали внутрішнього стандарту: центрова лінія ДМСО-d6 δ 2,50; центрова лінія СD3ОD δ 3,31; СDСl3 δ 7,26. У випадках, де спектри отримували у суміші СDСl3 та СD3ОD, посилання було на 3,31 -1 -1 млн . Усі хімічні зсуви є у млн на дельта-шкалі (δ) та представлене тонке розщеплення сигналів (s: синглет, br. s: широкий синглет, d: дублет, t: триплет, q: квартет, m: мультиплет). 3 Н спектри реєстрували на спектрометрі Вrukеr DRХ600 ЯМР, при 640 МГц для тритію та при 600 МГц для протону, з вимірювальною голов3 1 3 кою 5 мм Н/ Н SЕХ із Z-градієнтами. Спектри Н з 1 вилученням Н реєстрували на зразках, розчине3 них у СD3ОD. Для спектрів Н ЯМР сумнівні частотні посилання були застосовуваними, як розраховано множенням частоти внутрішнього стандарту 1 ТМС у Н спектрі із співвідношенням частот Лар3 1 мора між Н та Н (1,06663975), згідно з описом АlRаwі еt аl. J. Сhеm. Sос. Реrkіn Тrаns. ІІ 1974, 1635. Мас-спектри реєстрували на Wаtеrs РХ-МС, що складався з Аllіаnсе 2795 (РХ), Wаtеrs РDА 2996, та детектору ЕLS (Sеdех 75) та ZМD одинично-квадруполнього мас-спектрометру. Масспектрометр мав джерело електророзпилювання іонів (ЕР) для позитивних або негативних іонів. Капілярна напруга була 3 кВ та конусна напруга була 30 В. Мас-спектрометр сканував між m/z 100600 із часом сканування 0,7 с. Температура колонки була 40 С. Лінійний градієнт застосовували починаючи при 100% А (А: 10 mМ NН4ОАс у 5% МеСN) та закінчуючи при 100% В (В: МеСN). Застосовуваною колонкою була Х-Теrrа МS С8, 3,0 х 50; 3,5 мкм (Wаtеrs) при 1,0 мл/хвилину. Препаративну хроматографію (преп. РХВР) проводили на РХВР Wаtеrs. Колонка: ХТеrrа МS С8, 19 х 300 мм, 10 мкм. Обмежені градієнти МеСN/(95:5 0,1М NН4ОАс:МеСN) були застосовуваними при швидкості потоку 20 мл/хвилин. Мікрохвильове нагрівання проводили у однорежимному мікрохвильовому синтезаторі Сміта при опромінюванні 2450 МГц. Приклад 1 Етил 2-(6-Піперазин-1-ілпіридин-3-іл)-1,3бензотіазол-6-карбоксилат Трифлуорацетат 49 95267 O *TFA S O N N NH N (а) 2-[6-[4-[(1,1-Диметилетокси)карбоніл]-1піперазиніл]-3-піридиніл]- 6-бензотіазолкарбонової кислоти етил-естер O O O S N N N N O Суміш 2-бром-1,3-бензотіазол-6-карбонової кислоти етил-естеру (Дивись WО 95/25108) (0,74 г, 2,57 ммоль), 4-[5-(4,4,5,5-тетраметил[1,3,2]діоксаборолан-2-іл-піперазин-1-карбонової кислоти трет-бутил-естеру (1,0 г, 2,57 ммоль), натрій карбонату (0,820 г, 7,71 ммоль) та Рd(dррf)Сl2*ДХМ (0,094 г, 0,13 ммоль) у ТГФ/воді (9:1, 15 мл) перемішували при кип‟ятінні під зворотним холодильником протягом ночі. Додатково додавали Рd(dррf)Сl2*ДХМ (20 мг) та реакційну суміш кип‟ятили під зворотним холодильником протягом більше одної доби. Реакційну суміш концентрували у вакуумі та до залишку додавали ДХМ та воду. Водний шар екстрагували тричі ДХМ, сушили (МgSО4), фільтрували та випарювали у вакуумі. Продукт очищали флеш-хроматографією на колонці (35% етилацетату у гексані), отримуючи 1 заголовну сполуку (0,85 г) як твердий матеріал. Н ЯМР δ 8,83 (d, 1 Н) 8,73 (s, 1 Н) 8,19 (dd, 1 Н) 8,04 (s, 2 Н) 7,00 (d, 1 Н) 4,36 (q, 2 Н) 3,65 - 3,72 (m, 4 Н) 3,42 - 3,50 (m, 4 Н) 1,43 (s, 9 Н) 1,36 (t, 3 Н); МС m/z (М+Н) 469. (b) Етил 2-(6-Піперазин-1-ілпіридин-3-іл)-1,3бензотіазол-6-карбоксилат Трифлуорацетат (заголовна сполука) 2-[6-[4-[(1,1-Диметилетокси)карбоніл]-1піперазиніл]-3-піридиніл]-6-бензотіазолкарбонової кислоти етил-естер (0,42 г, 0,90 ммоль) розчиняли у ДХМ (35 мл) та додавали ТФОК (2 мл). Реакційну суміш перемішували при кімнатній температурі протягом 3 діб. Насич. натрій гідрокарбонат додавали до суміші. Осад збирали, а потім промивали ДХМ та водою, перед сушкою у вакуумі над Р2О5, отримуючи заголовну сполуку (0,34 г) як жовтий 1 твердий матеріал. Н ЯМР δ 8,82 - 8,93 (m, 3 Н) 8,76 (s, 1 Н) 8,27 (dd, 1 Н) 8,07 (d, 2 Н) 7,11 (d, 1 Н) 4,37 (q, 2 Н) 3,84 - 3,95 (m, 4 Н) 3,23 (br. s., 4 Н) 1,36 (t, 3 Н); МС m/z (М+Н) 369. Приклад 2 Етил 2-[6-(4-Метилпіперазин-1-іл)піридин-3-іл]1,3-бензотіазол-6-карбоксилат O O S N N N Формальдегід (37% водн., 0,212 мл, 2,61 ммоль) додавали до суспензі оf етил 2-(6піперазин-1-ілпіридин-3-іл)-1,3-бензотіазол-6карбоксилат трифлуорацетат (0,315 г, 0,65 ммоль) у метанол (10 мл). Натрій ціаноборогідрид (74 мг, 1,17 ммоль) додавали та, що є результатом суміш N 50 перемішували при кімнатній температурі протягом 1 години. Реакційну суміш бул тоді kерt при -10 °С протягом ночі. Тhе fоrmеd тверд збирали, промивали соld метанол та сушили, отримуючи заголовну сполуку. Тhе mоthеr lіquоr випарювали у вакуумі та залишк бул раrtіtіоnеd між ДХМ та насич. натрій гідрокарбонат. Водний шар екстрагували двічі ДХМ, сушили (Nа2SО4), фільтрували, та випарювали у вакуумі, отримуючи разом із фільтрованим твердим продуктом заголовну сполуку (0,20 г) як 1 -1 жовтий твердий матеріал. Н ЯМР δ млн 8,83 (d, 1 Н) 8,73 (s, 1 Н) 8,17 (dd, 1 Н) 8,05 (s, 2 Н) 7,01 (d, 1 Н) 4,36 (q, 2 Н) 3,70 (br. s., 4 Н) 3,32 (s, 4 Н) 2,29 (s, 3 Н) 1,36 (t, 3 Н); МС m/z (М+Н) 383. Приклад 3 2-[6-(4-Метилпіперазин-1-іл)піридин-3-іл]-1,3бензотіазол-6-карбоксамід Ацетат O H2N Acetate S N N N N (а) 2-[6-(4-Метилпіперазин-1-іл)піридин-3-іл]1,3-бензотіазол-6-карбонової кислоти гідрохлорид O HO S HCl N N N N Етил 2-[6-(4-метилпіперазин-1-іл)піридин-3-іл]1,3-бензотіазол-6-карбоксилат (46 мг, 0,12 ммоль) гріли при 110 °С у 6 М НСl (2 мл) протягом 3 годин. Розчинник випарювали у вакуумі, перед співвипарюванням тричі з толуолом, отримуючи заголовну 1 сполуку (46 мг) як жовтий твердий матеріал. Н ЯМР δ 10,90 (br. s., 1 Н) 8,88 (d, 1 Н) 8,73 (s, 1 Н) 8,28 (dd, 1 Н) 8,05 (s, 2 Н) 6,97 - 7,40 (m, 2 Н) 4,59 (d, 2 Н) 3,51 (d, 2 Н) 3,33 - 3,45 (m, 2 Н) 3,02 - 3,16 (m, 2 Н) 2,80 (d, 3 Н); МС m/z (М+Н) 355, (М-Н) 353. (b) 2-[6-(4-Метилпіперазин-1-іл)піридин-3-іл]1,3-бензотіазол-6-карбоксамід Ацетат (заголовна сполука) 2-[6-(4-Метилпіперазин-1-іл)піридин-3-іл]-1,3бензотіазол-6-карбонової кислоти гідрохлорид (46 мг, 0,12 ммоль) додавали до тіонілхлориду (3 мл), а потім 3 краплі ДМФ, перед нагріванням при 70 °С протягом ночі. Розчинник далі випарювали у вакуумі та раз з толуолом, отримуючи сирий 2-[6-(4метилпіперазин-1-іл)піридин-3-іл]-1,3-бензотіазол6-карбонілхлорид. Амоній гідроксид (конц. , 3 мл) додавали краплями до цього сирого продукту та суміш далі перемішували протягом 1 години при кімнатній температурі Реакційну суміш екстрагували двічі ДХМ, сушили (Nа2SО4), та випарювали у вакуумі. Отриманий залишок очищали преп. РХВР, отримуючи заголовну сполуку (7 мг) як світло1 жовтий твердий матеріал. Н ЯМР δ 8,81 (d, 1 Н) 8,58 (s, 1 Н) 8,16 (dd, 1 Н) 8,07 (br. s., 1 Н) 7,99 (s, 2 Н) 7,45 (br. s., 1 Н) 7,00 (d, 1 Н) 3,61 - 3,71 (m, 4 Н) 2,37 - 2,46 (m, 4 Н) 2,23 (s, 3 Н) 1,89 (s, 3 Н); ); МС m/z (М+Н) 354. Приклад 4 6-Метокси-2-(6-піперазин-1-ілпіридин-3-іл)-1,3бензотіазол 51 O 95267 HO S N NH N N (а) Трет-бутил 4-[5-(6-Метокси-1,3бензотіазол-2-іл)піридин-2-іл]піперазин-1карбоксилат O O S N N 52 N N O Трет-бутил 4-[5-(6-Метокси-1,3-бензотіазол-2іл)піридин-2-іл]піперазин-1-карбоксилат отримували способом, застосовуваним для отримання 2-[6[4-[(1,1-диметилетокси)карбоніл]-1-піперазиніл]-3піридиніл]-6-бензотіазолкарбонової кислоти етилестеру, з 2-бром-6-метоксибензотіазолу (Yаng еt аl. J. Віоlоgісаl Сhеm. 1989, 2, 891-898) (0,20 г), та 1 отримували як твердий матеріал (0,23 г). Н ЯМР δ 8,74 (s, 1 Н) 8,12 (d, 1 Н) 7,87 (d, 1 Н) 7,67 (s, 1 Н) 7,09 (dd, 1 Н) 6,98 (d, 1 Н) 3,84 (s, 3 Н) 3,64 (br. s., 4 Н) 3,45 (br. s., 4 Н) 1,43 (s, 9 Н); МС m/z М+Н 427. (b) 6-Метокси-2-(6-піперазин-1-ілпіридин-3-іл)1,3-бензотіазол (заголовна сполука) 6-Метокси-2-(6-піперазин-1-ілпіридин-3-іл)-1,3бензотіазол отримували способом, застосовуваним для отримання етил 2-(6-піперазин-1ілпіридин-3-іл)-1,3-бензотіазол-6-карбоксилат трифлуорацетату, з трет-бутил 4-[5-(6-метокси1,3-бензотіазол-2-іл)піридин-2-іл]піперазин-1карбоксилату (0,22 г), за винятком того, що натрій гідроксид застосовували замість насич. натрій гідрокарбонату після завершення реакції, та цей продукт переносили у ДХМ далі. Заголовну сполуку отримували як твердий матеріал (0,15 г) після 1 сушки та концентрації. Н ЯМР δ 8,71 (d, 1 Н) 8,07 (dd, 1 Н) 7,85 (d, 1 Н) 7,66 (d, 1 Н) 7,09 (dd, 1 Н) 6,93 (d, 1 Н) 3,84 (s, 3 Н) 3,47 - 3,64 (m, 4 Н) 2,65 2,89 (m, 4 Н); МС m/z (М+Н) 327. Приклад 5 6-Метокси-2-[6-(4-метилпіперазин-1іл)піридин-3-іл]-1,3-бензотіазол O S N N N N Заголовну сполуку отримували як твердий матеріал (70 мг) після отримання способом, застосовуваним для отримання етил 2-[6-(4метилпіперазин-1-іл)піридин-3-іл]-1,3-бензотіазол6-карбоксилату, з 6-метокси-2-(6-піперазин-1ілпіридин-3-іл)-1,3-бензотіазолу (0,13 г), за винятком наступного: Три краплі оцтової кислоти додавали до реакційної суміші та реакційну суміш перемішували при кімнатній температурі протягом ночі. Продукт фільтрували та промивали метано1 лом. Н ЯМР δ 8,72 (d, 1 Н) 8,08 (dd, 1 Н) 7,86 (d, 1 Н) 7,67 (d, 1 Н) 7,09 (dd, 1 Н) 6,97 (d, 1 Н) 3,84 (s, 3 Н) 3,53 - 3,69 (m, 4 Н) 2,36 - 2,45 (m, 4 Н) 2,22 (s, 3 Н); МС m/z (М+Н) 341. Приклад 6 2-[6-(4-Метилпіперазин-1-іл)піридин-3-іл]-1,3бензотіазол-6-олацетат S N N N N 6-Метокси-2-[6-(4-метилпіперазин-1іл)піридин-3-іл]-1,3-бензотіазол (0,050 г, 0,15 ммоль) розчиняли у ДХМ (20 мл). Суміш підкислювали додаванням НСl у дієтил-етер. Розчинник видаляли bу концентраці у вакуумі та залишок суспендували у ДХМ (5 мл). Бор трибромід (0,05 мл, 0,54 ммоль) у ДХМ (1 мл) далі додавали краплями при 0 °С, а потім пермішували при кімнатній температурі протягом ночі. Додатков ДХМ (5 мл) та бор трибромід (0,05 мл) додавали та реакційну суміш пермішували при кімнатній температурі протягом 3 доби. Реакційну суміш тоді розподіляли між ДХМ та насич. натрій гідрокарбонатом. Водний шар екстрагували двічі ДХМ, та комбіновані органічні продукти сушили (Nа2SО4), фільтрували та випарювали у вакуумі. Сирий продукт очищали преп. РХВР, отримуючи заголовну сполуку (11 мг) 1 як білий твердий матеріал. Н ЯМР δ 9,94 (br. s., 1 Н) 8,69 (d, 1 Н) 8,06 (dd, 1 Н) 7,76 (d, 1 Н) 7,37 (d, 1 Н) 6,84 - 7,06 (m, 2 Н) 3,50 - 3,73 (m, 4 Н) 2,35 2,45 (m, 4 Н) 2,22 (s, 3 Н) 1,90 (s, 3 Н); МС m/z (М+Н) 327, (М-Н) 325. Приклад 7 Етил 2-(6-Метоксипіридин-3-іл)-1,3бензотіазол-6-карбоксилат O S O O N Заголовну сполуку отримували способом, застосовуваним для отримання 2-[6-[4-[(1,1диметилетокси)карбоніл]-1-піперазиніл]-3піридиніл]-6-бензотіазолкарбонової кислоти етилестеру, з 2-метокси-5-піридинборонової кислоти (0,48 г, 3,14 ммоль), та отримували як твердий матеріал (0,29 г) після очистки флешхроматографією на колонці, застосовуючи 15% 1 етилацетату у гексані. Н ЯМР δ 8,94 (d, 1 Н) 8,81 (s, 1 Н) 8,40 (dd, 1 Н) 8,00 - 8,19 (m, 2 Н) 7,04 (d, 1 Н) 4,37 (q, 2 Н) 3,97 (s, 3 Н) 1,36 (t, 3 Н); МС m/z (М+Н) 315. Приклад 8 2-(6-Метоксипіридин-3-іл)-1,3-бензотіазол-6карбонов кислот O N HO S O N Етил 2-(6-метоксипіридин-3-іл)-1,3бензотіазол-6-карбоксилат (0,28 г, 0,89 ммоль) суспендували у суміші етанолу (6 мл) та ТГФ (2 мл). 2М NаОН (1,3 мл) далі додавали та реакційну суміш перемішували при кімнатній температурі протягом 6 годин перед нагріванням протягом 5 хвилин, отримуючи прозорий розчин. Розчин випарювали у вакуумі, додавали воду та суміш фільтрували. Фільтрат підкислювали 3М НСl. Осаджений твердий матеріал збирали, промивали водою, сушили (у вакуумі над Р2О5), отримуючи заголовну N 53 95267 1 сполуку (0,23 г) як білий твердий матеріал. Н ЯМР δ 13,13 (s, 1 Н) 8,93 (d, 1 Н) 8,77 (s, 1 Н) 8,40 (dd, 1 Н) 7,95 - 8,21 (m, 2 Н) 7,04 (d, 1 Н) 3,97 (s, 3 Н); МС m/z (М+Н) 287, (М-Н) 285. Приклад 9 2-(6-Метоксипіридин-3-іл)-1,3-бензотіазол-6карбоксамід O S H2N O N N 2-(6-Метоксипіридин-3-іл)-1,3-бензотіазол-6карбонову кислоту (30 мг, 0,10 ммоль) змішували з тіонілхлоридом (0,8 мл) та перемішували при кімнатній температурі протягом 3 годин, тоді гріли до 50 °С протягом 1 години. Розчинник випарювали у вакуумі, отримуючи інтермедіат 2-(6метоксипіридин-3-іл)-1,3-бензотіазол-6карбонілхлорид як сирий продукт. Цей хлорангідрид кислоти розчиняли у ДХМ (3 мл) та додавали до амоній гідроксиду (конц., 2 мл). Реакційну суміш перемішували при кімнатній температурі без зупинки протягом ночі. Утворений твердий матеріал збирали фільтруванням, промивали водою та сушили (у вакуумі над Р2О5), отримуючи заголовну 1 сполуку (23 мг) як жовтий твердий матеріал. Н ЯМР δ 8,93 (d, 1 Н) 8,64 (s, 1 Н) 8,39 (dd, 1 Н) 7,95 8,19 (m, 3 Н) 7,50 (s, 1 Н) 7,04 (d, 1 Н) 3,97 (s, 3 Н); МС m/z (М+Н) 286, (М-Н) 284. Приклад 10 2-(6-Метоксипіридин-3-іл)-N-метил-1,3бензотіазол-6-карбоксамід O S N H O N N 2-(6-Метоксипіридин-3-іл)-1,3-бензотіазол-6карбонову кислоту (40 мг, 0,14 ммоль) змішували з тіонілхлоридом (1 мл) та перемішували при кімнатній температурі протягом 3 годин, тоді гріли до 50 °С протягом 1 години. Розчинник випарювали у вакуумі, отримуючи інтермедіат 2-(6метоксипіридин-3-іл)-1,3-бензотіазол-6карбонілхлорид як сирий продукт. Це хлорангідрид кислоти розчиняли у ДХМ (3 мл) та додавали до метиламіну (40% у метанолі, 2 мл). Реакційну суміш перемішували при кімнатній температурі без зупинки протягом ночі. Утворений твердий матеріал збирали фільтруванням, промивали водою та сушили (у вакуумі над Р2О5), отримуючи заголовну сполуку (35 мг) як світло-жовтий твердий матеріал. 1 Н ЯМР δ 8,92 (d, 1 Н) 8,51 - 8,68 (m, 2 Н) 8,39 (dd, 1 Н) 8,09 (d, 1 Н) 7,98 (d, 1 Н) 7,04 (d, 1 Н) 3,97 (s, 3 Н) 2,83 (d, 3 Н); МС m/z (М+Н) 300, (М-Н) 298. Приклад 11 2-(6-Метоксипіридин-3-іл)-6-(піролідин-1ілкарбоніл)-1,3-бензотіазол O N S O N N 54 2-(6-Метоксипіридин-3-іл)-1,3-бензотіазол-6карбонову кислоту (40 мг, 0,14 ммоль) змішували з тіонілхлоридом (1 мл) та перемішували при кімнатній температурі протягом 3 годин, тоді гріли до 50 °С протягом 1 години. Розчинник випарювали у вакуумі, отримуючи інтермедіат, 2-(6метоксипіридин-3-іл)-1,3-бензотіазол-6карбонілхлорид як сирий продукт. Цей хлорангідрид кислоти розчиняли у ДХМ (3 мл) та додавали до піролідину (0,5 мл) у СН2Сl2 (1,5 мл). Реакційну суміш перемішували при кімнатній температурі протягом 1 години. Додавали воду та реакційну суміш екстрагували двічі ДХМ, сушили (МgSО4), фільтрували та розчинник випарювали. Твердий матеріал сушили (у вакуумі над Р2О5), отримуючи заголовну сполуку (45 мг) як білуватий твердий 1 матеріал. Н ЯМР δ 8,92 (d, 1 Н) 8,39 (dd, 1 Н) 8,35 (s, 1 Н) 8,07 (d, 1 Н) 7,67 (d, 1 Н) 7,04 (d, 1 Н) 3,97 (s, 3 Н) 3,51 (t, 2 Н) 3,45 (t, 2 Н) 1,78 - 1,95 (m, 4 Н); МС m/z (М+Н) 340. Приклад 12 2-(6-Піперазин-1-ілпіридин-3-іл)-1,3бензотіазол-6-амін H2N S N NH N N (a) трет-бутил 4-[5-(6-нітро-1,3-бензотіазол-2іл)піридин-2-іл]піперазин-1-карбоксилат O2 N O S N N N N O Сполуку трет-бутил 4-[5-(6-нітро-1,3бензотіазол-2-іл)піридин-2-іл]піперазин-1карбоксилат отримували способом, застосовуваним для отримання 2-[6-[4-[(1,1диметилетокси)карбоніл]-1-піперазиніл]-3піридиніл]-6-бензотіазолкарбонової кислоти етилестеру, з 2-бром-6-нітробензотіазолу (0,55 г, 2,14 ммоль), з наступними модифікаціями: твердий матеріал відфільтровували та промивали ТГФ/водою (9:1), а потім водою. Твердий продукт сушили (у вакуумі над Р2О5). Фільтрат екстрагували тричі ДХМ. Комбіновані органічні фази промивали розсолом, сушили (Nа2SО4), фільтрували та випарювали у вакуумі. Комбінований сирий твердий матеріал очищали флеш-хроматографією на колонці (гептан:етилацетат; 80:20 до 60:40), отримуючи заголовну сполуку (0,47 г) як твердий матеріал. МС m/z (М+Н) 442. (b) 4-[5-(6-Аміно-бензотіазол-2-іл)-піридин-2іл]-піперазин-1-карбонової кислоти трет-бутилестер H2N O S N N N N O трет-бутил 4-[5-(6-нітро-1,3-бензотіазол-2іл)піридин-2-іл]піперазин-1-карбоксилат (90 мг, 0,2 ммоль) розчиняли у метанолі (8 мл). Після додавання 7М NН3 у метанолі (2 мл), додавали паладій 55 95267 на вугіллі (10%, 10 мг) та колбу вакуумували та заповнювали воднем. Реакційну суміш струшували в атмосфері водню протягом ночі. Суміш далі фільтрували через діатомову землю та випарювали у вакуумі. Сирий продукт очищали флешхроматографією на колонці (гептан:етилацетат; 70:30 до 35:65), отримуючи заголовну сполуку (38 мг) як твердий матеріал. МС m/z (М+Н) 412. (с) 2-(6-Піперазин-1-ілпіридин-3-іл)-1,3бензотіазол-6-амін (заголовна сполука) 4-[5-(6-Аміно-бензотіазол-2-іл)-піридин-2-іл]піперазин-1-карбонової кислоти трет-бутил-естер (13 мг, 0,032 ммоль) розчиняли у ДХМ (1 мл), а потім додавали ТФОК (70 мкл). Реакційну суміш далі перемішували протягом 4 годин при кімнатній температурі Після додавання НСl (1 М; 1 мл) два шари розділяли. Органічний шар екстрагували НСl (1М). Комбінован водні шари підлужували (рН 910) із NаОН (2 М) та екстрагували ДХМ. Комбіновані органічні шари промивали розсолом, сушили (Nа2SО4), фільтрували та розчинник випарювали, отримуючи заголовну сполуку (10 мг) як мутний 1 забарвлений твердий матеріал. Н ЯМР δ 8,70 (d, 1 Н) 8,07 (dd, 1 Н) 7,67 (d, 1 Н) 7,13 (d, 1 Н) 6,97 (d, 1 Н) 6,81 (dd, 1 Н) 5,45 (s, 2 Н) 3,53 - 3,66 (m, 4 Н) 2,77 - 2,92 (m, 4 Н); МС m/z (М+Н) 311. Приклад 13 N-[2-(6-Піперазин-1-ілпіридин-3-іл)-1,3бензотіазол-6-іл]метансульфонамід O S H N S N O N NH N До 4-[5-(6-аміно-бензотіазол-2-іл)-піридин-2іл]-піперазин-1-карбонової кислоти трет-бутилестер (12,7 мг, 0,031 ммоль) у ДХМ (1 мл) додавали метансульфонілхлорид (3 мкл, 0,034 ммоль) а потім піридин (3 мкл, 0,034 ммоль). Реакційну суміш перемішували протягом ночі. при кімнатній температурі Сиру суміш очищали флешхроматографією на колонці (гептан:етилацетат; 50:50 до 40:60), отримуючи інтермедіат трет-бутил 4-(5-{6-[(метилсульфоніл)аміно]-1,3-бензотіазол-2іл}піридин-2-іл)піперазин-1-карбоксилат (7,4 мг) як твердий матеріал. МС m/z (М+Н) 490, (М-Н) 488. Цей інтермедіат розчиняли у ДХМ (1 мл) та додавали ТФОК (300 мкл). Реакційну суміш далі перемішували протягом 3 годин при кімнатній температурі Розчинник видаляли у тоці азоту та залишок розчиняли у ДМФ (400 мкл) та очищали преп. РХВР, отримуючи заголовну сполуку (3 мг) як бі1 лий твердий матеріал. Н ЯМР δ 8,71 (d, 1 Н) 8,09 (dd, 1 Н) 7,72 - 7,86 (m, 2 Н) 7,27 (dd, 1 Н) 6,88 (d, 1 Н) 3,63 - 3,77 (m, 4 Н) 2,95 - 3,08 (m, 4 Н) 2,90 (s, 3 Н); МС m/z М+Н 390, М-Н 388. Приклад 14 2-[6-(4-Метилпіперазин-1-іл)піридин-3-іл]-1,3бензотіазол-6-амін Трифлуорацетат H2N *TFA S N N N N До трет-бутил 4-[5-(6-нітро-1,3-бензотіазол-2іл)піридин-2-іл]піперазин-1-карбоксилату (0,29 г) у ДХМ (15 мл) додавали ТФОК (1,5 мл) перед пер 56 мішуванням протягом ночі. при кімнатній температурі Розчинник далі видаляли продуванням азоту та залишок, сирий 6-нітро-2-(6-піперазин-1ілпіридин-3-іл)-1,3-бензотіазол (МС m/z [М+Н] 342.), застосовували безпосередньо на наступному етапі. До цього залишку у метанолі (3 мл), додавали формальдегід (37% водн., 0,25 мл) та натрій ціаноборогідрид (74 мг), а потім нагрівали при 70 °С протягом 5 хвилин. Густий твердий матеріал утворився та додатково додавали метанол (3 мл). Суміш перемішували при кімнатній температурі протягом 1 години, тоді фільтрували. Твердий матеріал промивали льодяним метанолом та тоді сушили у вакуумі над Р2О5, отримуючи інтермедіат 2-[6-(4-метилпіперазин-1-іл)піридин-3-іл]-6-нітро1,3-бензотіазол трифлуорацетат (0,26 г) як твердий матеріал. МС m/z (М+Н) 356. Цей інтермедіат (0,26 г) розчиняли у метанолі (8 мл) та додавали аміак (7М у метанолі, 2 мл). Колбу вакуумували та продували аргоном. Паладій (10% на вугіллі, 30 мг) додавали та колбу вакуумували та заповнювали воднем. Реакційну суміш струшували в атмосфері водню протягом ночі. при кімнатній температурі Суміш далі фільтрували через діатомову землю та випарювали у вакуумі, отримуючи заголовну сполуку (0,22 г) як білий твердий матеріал. 1 Н ЯМР (хлороформ-d) δ 8,67 (d, 1 Н) 8,05 (dd, 1 Н) 7,70 (d, 1 Н) 7,04 (d, 1 Н) 6,74 (dd, 1 Н) 6,63 (d, 1 Н) 3,33 - 4,01 (m, 6 Н) 2,42 - 2,55 (m, 4 Н) 2,30 (s, 3 Н); МС m/z (М+Н) 326. Приклад 15 N-{2-[6-(4-Метилпіперазин-1-іл)піридин-3-іл]1,3-бензотіазол-6-іл}ацетамід H N S N N O N N 2-[6-(4-Метилпіперазин-1-іл)піридин-3-іл]-1,3бензотіазол-6-амін трифлуорацетат (40 мг, 0,09 ммоль) розподіляли між ДХМ та насич. натрій гідрокарбонатом та водний шар екстрагували двічі ДХМ. Комбіновані органічні шари сушили (Nа2SО4), фільтрували та випарювали у вакуумі, отримуючи вільний амін. До вільного аміну у ДХМ (2 мл) додавали ацетилхлорид (0,01 мл) та піридин (0,01 мл) та суміш перемішували при кімнатній температурі протягом 1 години. Розчинник випарювали у вакуумі та залишок очищали преп. РХВР, отримуючи заголовну сполуку (20 мг) як блідо-жовтий 1 твердий матеріал. Н ЯМР (хлороформ-d) δ 8,72 (d, 1 Н) 8,34 (s, 1 Н) 8,07 (dd, 1 Н) 7,82 (d, 1 Н) 7,27 (s, 1 Н) 7,13 - 7,23 (m, 1 Н) 6,63 (d, 1 Н) 3,57 - 3,71 (m, 4 Н) 2,43 - 2,54 (m, 4 Н) 2,30 (s, 3 Н) 2,16 (s, 3 Н); МС m/z (М+Н) 368, (М-Н) 366. Приклад 16 2-[6-(4-Метилпіперазин-1-іл)піридин-3-іл]-N(2,2,2-трифлуоретил)-1,3-бензотіазол-6-амін F F F H N S N N N N Суміш 2-[6-(4-метилпіперазин-1-іл)піридин-3іл]-1,3-бензотіазол-6-амін трифлуорацетату (0,12 г, 0,27 ммоль), етилхлорформіату (36 мкл, 0,38 57 95267 ммоль) та діізопропілетиламіну (0,238 мл, 1,44 ммоль) у ДХМ/ТГФ (1:1, 7 мл) перемішували при кімнатній температурі протягом ночі. Додатково ДХМ додавали перед промивкою розчину насич. натрій гідрокарбонатом та тоді розсолом. Розчин тоді сушили (Nа2SО4), фільтрували та випарювали у вакуумі. Залишок очищали преп. РХВР, отримуючи інтермедіат 2,2,2-трифлуор-N-{2-[6-(4метилпіперазин-1-іл)піридин-3-іл]-1,3-бензотіазол6-іл}ацетамід (43 мг). МС m/z (М+Н) 422, (М-Н) 420. До цього інтермедіату (43 мг) у ТГФ (5 мл) додавали літій алюмогідрид (12 мг, 0,3 ммоль). Реакційну суміш кип‟ятили під зворотним холодильником протягом 1,5 годин тоді давали дійти до кімнатної температури Дві краплі насич. Nа2SО4, а потім етилацетат додавали та суміш перемішували протягом кількох хвилин. Органічний шар промивали розсолом, сушили (Nа2SО4), фільтрували та випарювали у вакуумі. Залишок очищали преп. РХВР, отримуючи заголовну сполуку (25 мг) як 1 блідо-жовтий твердий матеріал. Н ЯМР (МеОНD4) δ 8,59 (d, 1 Н) 7,97 (dd, 1 Н) 7,60 (d, 1 Н) 7,11 (d, 1 Н) 6,75 - 6,87 (m, 2 Н) 3,80 (q, 2 Н) 3,55 - 3,70 (m, 4 Н) 2,50 - 2,61 (m, 4 Н) 2,33 (s, 3 Н); МС m/z (М+Н) 408, (М-Н) 406. Приклад 17 Етил {2-[6-(4-Метилпіперазин-1-іл)піридин-3іл]-1,3-бензотіазол-6-іл}карбамат H N O O S N N N N 2-[6-(4-Метилпіперазин-1-іл)піридин-3-іл]-1,3бензотіазол-6-амін трифлуорацетат (40 мг, 0,09 ммоль) розподіляли між ДХМ та насич. натрій гідрокарбонатом та водний шар екстрагували двічі ДХМ. Комбіновані органічні шари сушили (Nа2SО4), фільтрували та випарювали у вакуумі, отримуючи вільний амін. До вільного аміну у СН2Сl2/ТГФ (1:1, 4 мл) додавали етилхлорформіат (15 мкл, 0,15 ммоль) та діізопропілетиламін (97 мкл, 0,59 ммоль) перед пермішуванням реакційної суміші при кімнатній температурі протягом ночі. Додатково було тоді додано ДХМ та органічний шар промивали насич. натрій гідрокарбонатом та розсолом, тоді сушили (Nа2SО4), фільтрували та випарювали у вакуумі, отримуючи заголовну спо1 луку (37 мг) як білуватий твердий матеріал. Н ЯМР δ 9,81 (s, 1 Н) 8,67 (d, 1 Н) 8,15 (d, 1 Н) 8,02 (dd, 1 Н) 7,80 (d, 1 Н) 7,42 (dd, 1 Н) 6,91 (d, 1 Н) 4,09 (q, 2 Н) 3,50 - 3,64 (m, 4 Н) 2,30 - 2,38 (m, 4 Н) 2,16 (s, 3 Н) 1,20 (t, 3 Н); МС m/z (М+Н) 398, (М-Н) 396. Приклад 18 N-Метил-2-[6-(4-метилпіперазин-1-іл)піридин3-іл]-1,3-бензотіазол-6-амін H N S N N N N Заголовну сполуку (11 мг, 38%) отримували відновленням способом, описаним для отримання 2-[6-(4-метилпіперазин-1-іл)піридин-3-іл]-N-(2,2,2трифлуоретил)-1,3-бензотіазол-6-аміну застосу 58 ванням етил {2-[6-(4-метилпіперазин-1-іл)піридин3-іл]-1,3-бензотіазол-6-іл}карбамату (37 мг, 0,088 ммоль) як вихідного матеріалу, та літій алюмогідриду (10 мг, 0,26 ммоль) як реагенту, з наступною модифікацією: Реакційну суміш перемішували при кип‟ятінні під зворотним холодильником протягом 1 години, тоді при кімнатній температурі протягом ночі. Сирий матеріал очищали преп. РХВР, отримуючи заголовну сполуку (11 мг) як блідо-жовтий 1 твердий матеріал. Н ЯМР (МеОН-D4) δ 8,59 (d, 1 Н) 7,98 (dd, 1 Н) 7,56 (d, 1 Н) 6,93 (d, 1 Н) 6,82 (d, 1 Н) 6,73 (dd, 1 Н) 3,55 - 3,69 (m, 4 Н) 2,74 (s, 3 Н) 2,48 - 2,60 (m, 4 Н) 2,32 (s, 3 Н); МС m/z (М+Н) 340. Приклад 19 2-(6-Метоксипіридин-3-іл)-1,3-бензотіазол-6амін H2N S O N (а) 2-Бром-1,3-бензотіазол-6-амін H2N S Br N Залізо (0,53 г, 9,45 ммоль) додавали до розчину 2-бром-6-нітробензотіазолу (0,5 г, 1,93 ммоль) в оцтовій кислоті (10 мл) при кімнатній температурі Після енергійного пермішування протягом 1,5 годин, додатково додавали залізо (0,3 г) та оцтову кислоту (6 мл). Через 5 годин суміш фільтрували та промивали етилацетатом. Органічний шар промивали водою, розсолом, сушили (Nа2SО4), фільтрували та концентрували. Сирий продукт очищали флеш-хроматографією на колонці (20 - 50% етилацетату у гептані), отримуючи заголовну сполуку 1 (0,12 г) як блідо-рожевий твердий матеріал. Н ЯМР (хлороформ-d) δ 7,74 (d, 1 Н) 7,02 (d, 1 Н) 6,80 (dd, 1 Н) 3,85 (s, 2 Н); МС m/z (М+Н) 229, 231. (b) 2-(6-Метоксипіридин-3-іл)-1,3-бензотіазол6-амін (заголовна сполука) Суміш 2-бром-1,3-бензотіазол-6-аміну (53 мг, 0,23 ммоль), 2-метокси-5-піридинборонової кислоти (50 мг, 0,327 ммоль), Рd(dррf)Сl 2*ДХМ (8 мг, 0,01 ммоль) та натрій карбонату (0,1 г, 1 ммоль) у ТГФ/воді (9:1, 3 мл) гріли при 140 °С протягом 10 хвилин у мікрохвильовому реакторі в атмосфері аргону. Суміш фільтрували та промивали ТГФ/водою (9:1). Після цього додавали до фільтрату ДХМ, органічний шар промивали розсолом, сушили (Nа2SО4), фільтрували та концентрували. Сирий продукт очищали флеш-хроматографією на колонці (20 до 70% етилацетату у гептані), отримуючи заголовну сполуку (57 мг) як білуватий тве1 рдий матеріал. Н ЯМР (хлороформ-d) δ 8,68 (d, 1 Н) 8,16 (dd, 1 Н) 7,74 (d, 1 Н) 7,06 (d, 1 Н) 6,70 6,81 (m, 2 Н) 3,94 (s, 3 Н) 3,77 (s, 2 Н); МС m/z (М+Н) 258. Приклад 20 N-[2-(6-Метоксипіридин-3-іл)-1,3-бензотіазол6-іл]ацетамід H N S O O N N N 59 Ацетилхлорид (3 мкл, 0,037 ммоль) та піридин (3 мкл, 0,037 ммоль) додавали до розчину 2-(6метоксипіридин-3-іл)-1,3-бензотіазол-6-аміну (9 мг, 0,034 ммоль) у ДХМ (1 мл). Реакційну суміш перемішували при кімнатній температурі протягом ночі. Половину розчиннику відганяли у вакуумі та додавали кілька крапель гексану. Осаджений твердий матеріал збирали та сушили у вакуумі, отримуючи заголовну сполуку (4 мг) як білий твердий матері1 ал. Н ЯМР δ 10,30 (s, 1 Н) 8,91 (d, 1 Н) 8,57 (d, 1 Н) 8,39 (dd, 1 Н) 8,03 (d, 1 Н) 7,63 (dd, 1 Н) 7,08 (d, 1 Н) 4,02 (s, 3 Н) 2,16 (s, 3 Н); МС m/z (М+Н) 300, (М-Н) 298. Приклад 21 N-[2-(6-Метоксипіридин-3-іл)-1,3-бензотіазол6-іл]метансульфонамід H N S S O O O N N Мезилхлорид (3 мкл, 0,037 ммоль) та піридин (3 мкл, 0,037 ммоль) додавали до розчину 2-(6метоксипіридин-3-іл)-1,3-бензотіазол-6-аміну (9 мг, 0,034 ммоль) у ДХМ (1 мл). Реакційну суміш перемішували при кімнатній температурі протягом 6 діб. Кілька крапель гексану додавали та осаджений твердий матеріал збирали та сушили у вакуумі. Сирий продукт очищали флеш-хроматографією на колонці (20 до 100% етилацетату у гептані), отримуючи заголовну сполуку (8 мг) як білуватий 1 твердий матеріал. Н ЯМР δ 9,84 (s, 1 Н) 8,63 (d, 1 Н) 8,11 (dd, 1 Н) 7,77 (d, 1 Н) 7,71 (d, 1 Н) 7,14 (dd, 1 Н) 6,79 (d, 1 Н) 3,73 (s, 3 Н) 2,82 (s, 3 Н); МС m/z (М+Н) 336, (М-Н) 334. Приклад 22 2-(6-Метоксипіридин-3-іл)-N-метил-1,3бензотіазол-6-амін H N S O N N До 2-(6-метоксипіридин-3-іл)-1,3-бензотіазол6-аміну (57 мг, 0,22 ммоль) у ДХМ/ТГФ (1:1, 5 мл), додавали етилхлорформіат (22,5 мкл, 0,24 ммоль) та діізопропілетиламін (0,147 мл, 0,89 ммоль), перед пермішуванням реакційної суміші при кімнатній температурі протягом ночі. Додатково ДХМ було тоді додано та органічний шар промивали насич. натрій гідрокарбонатом та розсолом, тоді сушили (Nа2SО4), фільтрували та випарювали у вакуумі, отримуючи інтермедіат етил [2-(6метоксипіридин-3-іл)-1,3-бензотіазол-6іл]карбамат (70 мг) як твердий матеріал. МС m/z (М+Н) 330, (М-Н) 328. Цей інтермедіат (70 мг) реагував із літій алюмогідридом (24 мг, 0,63 ммоль) способом, описаним для отримання 2-[6-(4метилпіперазин-1-іл)піридин-3-іл]-N-(2,2,2трифлуоретил)-1,3-бензотіазол-6-аміну. Сирий отриманий продукт очищали преп. РХВР, отримуючи заголовну сполуку (2 мг) як блідо-жовтий тве1 рдий матеріал. Н ЯМР (хлороформ-d) δ 8,60 (d, 1 Н) 8,08 (dd, 1 Н) 7,66 (d, 1 Н) 6,85 (d, 1 Н) 6,69 (d, 1 Н) 6,63 (dd, 1 Н) 3,86 (s, 3 Н) 2,77 (s, 3 Н); МС m/z (М+Н) 272. 95267 60 Приклад 23 6-Бром-2-(6-метоксипіридин-3-іл)-1,3бензотіазол Br S O N N Суміш 2,6-дибром-бензотіазолу (0,29 г, 1,0 ммоль), 2-метокси-5-піридинборонової кислоти (0,17 г, 1,1 ммоль), Рd(dррf)Сl2*ДХМ (41 мг, 0,05 ммоль) та натрій карбонату (0,382 г, 3,6 ммоль) у ТГФ/воді (9:1, 4 мл) гріли при 140 °С протягом 10 хвилин у мікрохвильовому реакторі. Реакційну суміш далі фільтрували через шар силіцій оксиду, застосовуючи ДХМ як елюент. Фільтрат концентрували та сирий продукт очищали флешхроматографією на колонці (10% етилацетату у гептані), а потім перекристалізовували з етилацетату, отримуючи заголовну сполуку (61 мг) як тве1 рдий матеріал. Н ЯМР (хлороформ-d) δ 8,83 (d, 2 Н) 8,27 (dd, 1 Н) 8,03 (d, 1 Н) 7,90 (d, 1 Н) 7,60 (dd, 1 Н) 6,87 (d, 1 Н) 4,03 (s, 3 Н); МС m/z (М+Н) 321. Приклад 24 2-(6-Флуорпіридин-3-іл)-6-метокси-1,3бензотіазол O S F N N Заголовну сполуку отримували способом, описаним для отримання 6-бром-2-(6-метоксипіридин3-іл)-1,3-бензотіазолу, реакцією 2-бром-6-метоксибензотіазолу (1,09 г, 4,46 ммоль) із 2флуорпіридин-5-бороновою кислотою (0,692 г, 4,9 ммоль). Сирий продукт очищали флешхроматографією на колонці (0 до 2% метанол у 1 ДХМ), отримуючи заголовну сполуку (0,57 г). Н ЯМР δ 8,88 (d, 1 Н) 8,58 (td, 1 Н) 7,98 (d, 1 Н) 7,76 (d, 1 Н) 7,38 (dd, 1 Н) 7,16 (dd, 1 Н) 3,86 (s, 3 Н); МС m/z (М+Н) 261. Приклад 25 5-(6-Метокси-1,3-бензотіазол-2-іл)-Nметилпіридин-2-амін O S H N N N Суміш 2-(6-флуорпіридин-3-іл)-6-метокси-1,3бензотіазолу (0,20 г, 0,77 ммоль) у метиламіні (8М в етанолі, 5 мл) гріли при 100 °С протягом 5 хвилин у мікрохвильовому реакторі. Суміш розбавляли водою та твердий продукт збирали фільтруванням та сушили у вакуумі, отримуючи заголовну 1 сполуку (0,17 г) як твердий матеріал. Н ЯМР δ 8,64 (d, 1 Н) 7,97 (dd, 1 Н) 7,83 (d, 1 Н) 7,64 (d, 1 Н) 7,21 (d, 1 Н) 7,07 (dd, 1 Н) 6,58 (d, 1 Н) 3,83 (s, 3 Н) 2,85 (d, 3 Н); МС m/z (М+Н) 271,9. Приклад 26 5-(6-Метокси-1,3-бензотіазол-2-іл)-N-(піридин3-ілметил)піридин-2-амін
ДивитисяДодаткова інформація
Назва патенту англійськоюHeteroaryl substituted benzothiazoles
Автори англійськоюGravenfors Ylva, Jonasson Catrin, Malmstroem Jonas, Nordvall Gunnar, Pyring David, Slivo Can, Sohn Daniel, Stroem Peter, Wensbo David
Назва патенту російськоюЗамещенные гетероарилом бензотиазолы
Автори російськоюГравенфорсб Ильва, Джонассонб Катрин, Мальмстрём Джонес, Нардволл Гуннар, Пиринг Девид, Сливо Кен, Сон Даниэль, Стрём Питер, Венсбо Девид
МПК / Мітки
МПК: A61P 25/28, A61K 31/4436, C07D 417/04, A61K 31/496, C07D 417/14, C07D 513/04
Мітки: гетероарилом, заміщені, бензотіазоли
Код посилання
<a href="https://ua.patents.su/49-95267-zamishheni-geteroarilom-benzotiazoli.html" target="_blank" rel="follow" title="База патентів України">Заміщені гетероарилом бензотіазоли</a>
Попередній патент: Композиції корму для тварин із ферментами, що знижують імунний стрес
Наступний патент: Модульний верхній силовий привід
Випадковий патент: Спосіб одержання сухого екстракту з листя шавлії лікарської шляхом комплексної переробки












