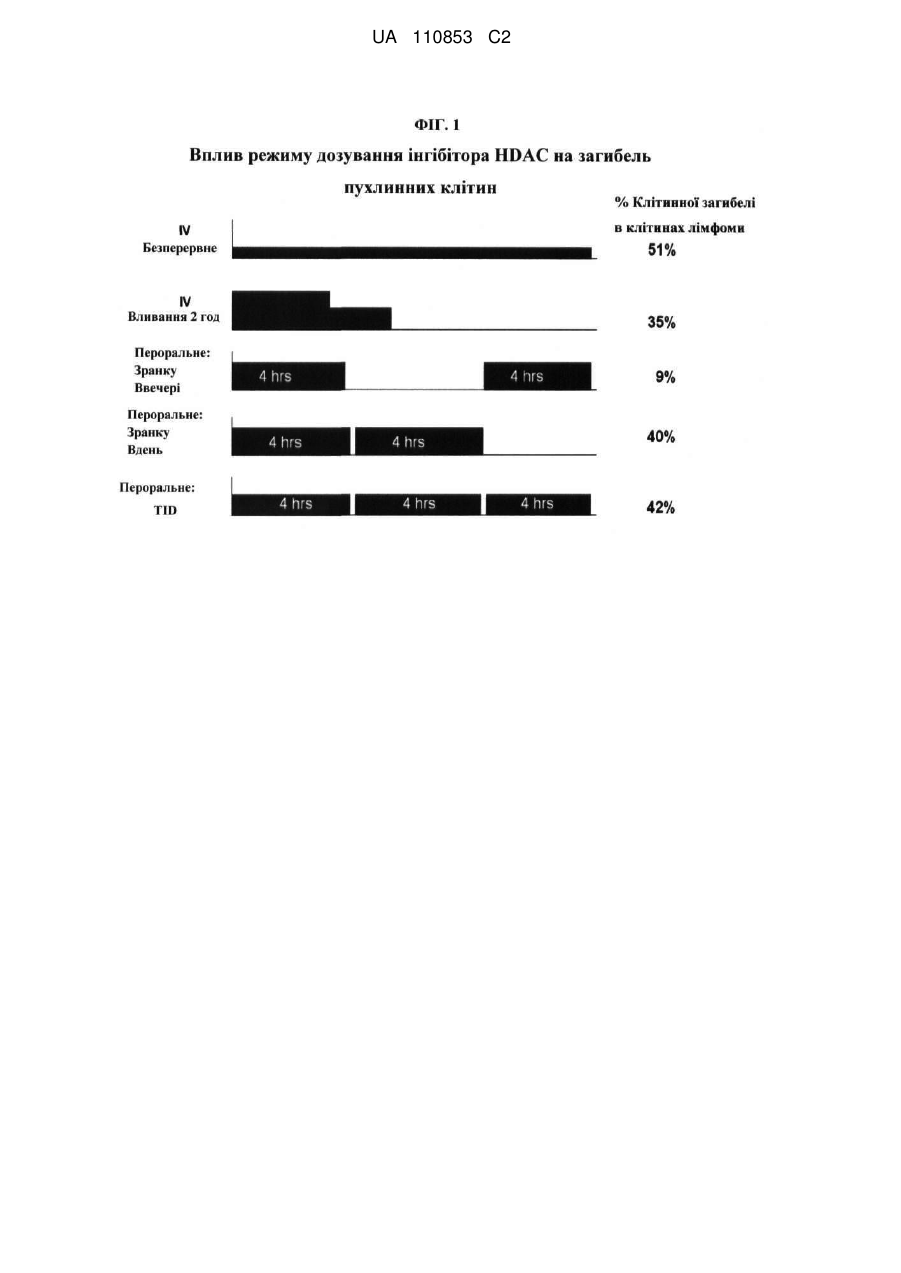
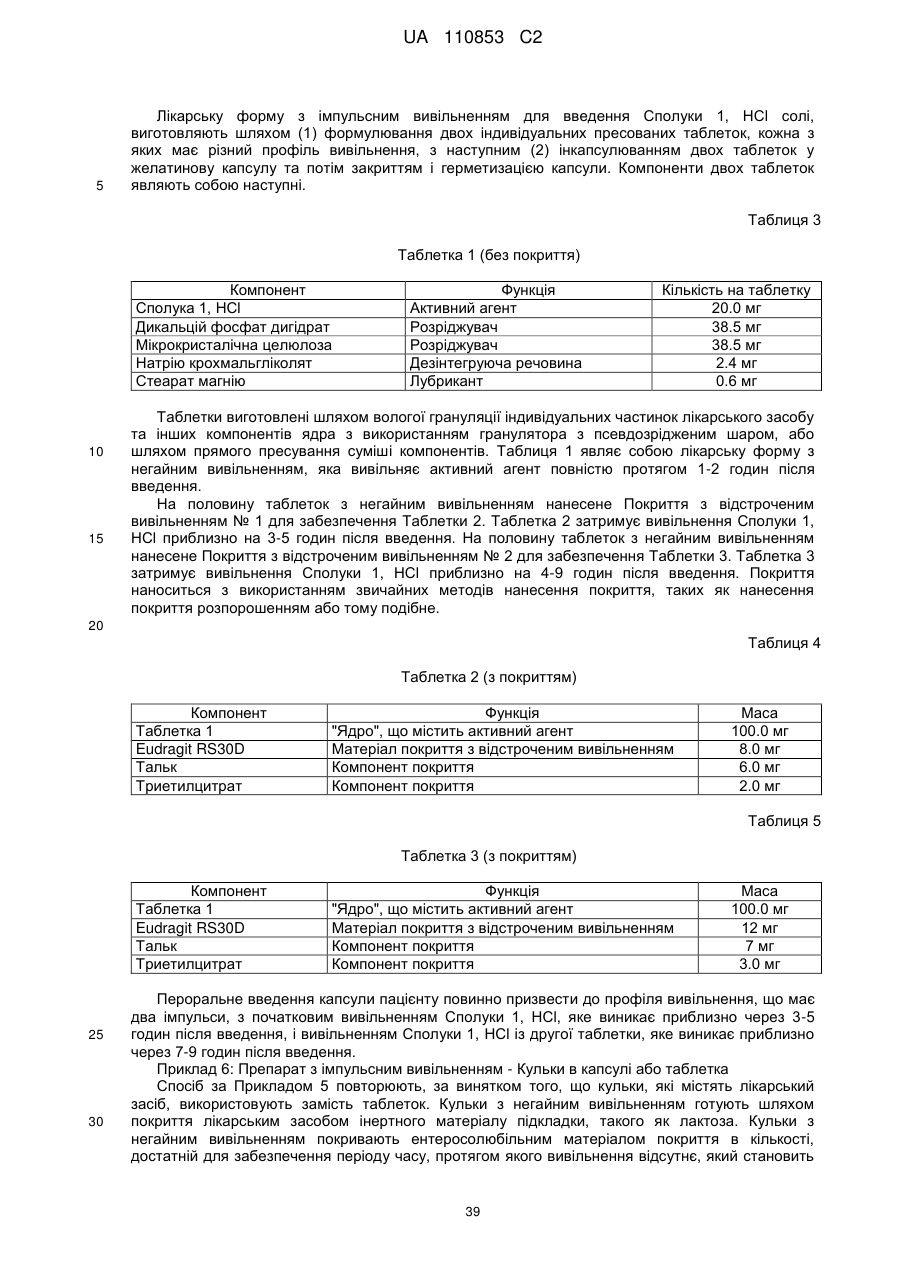
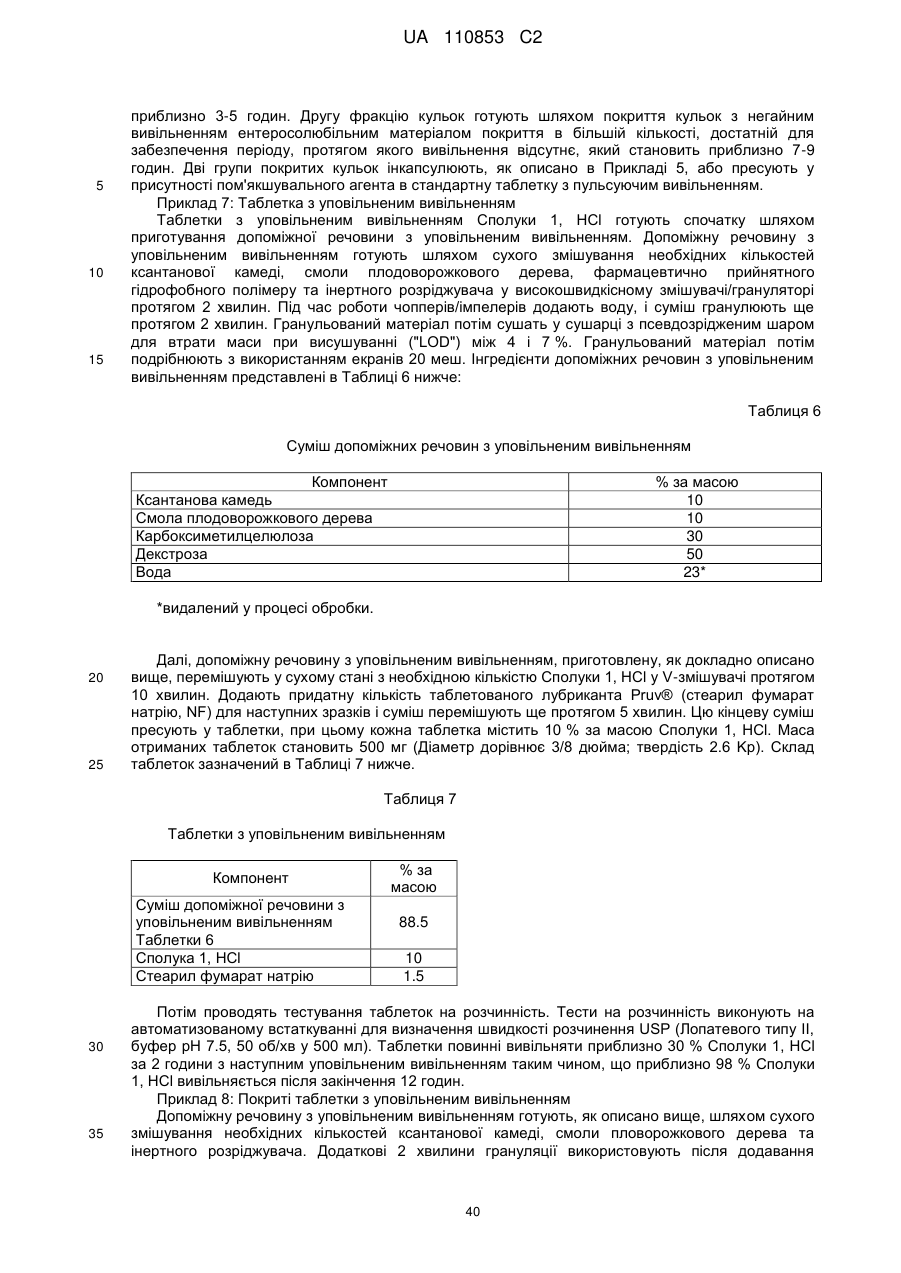
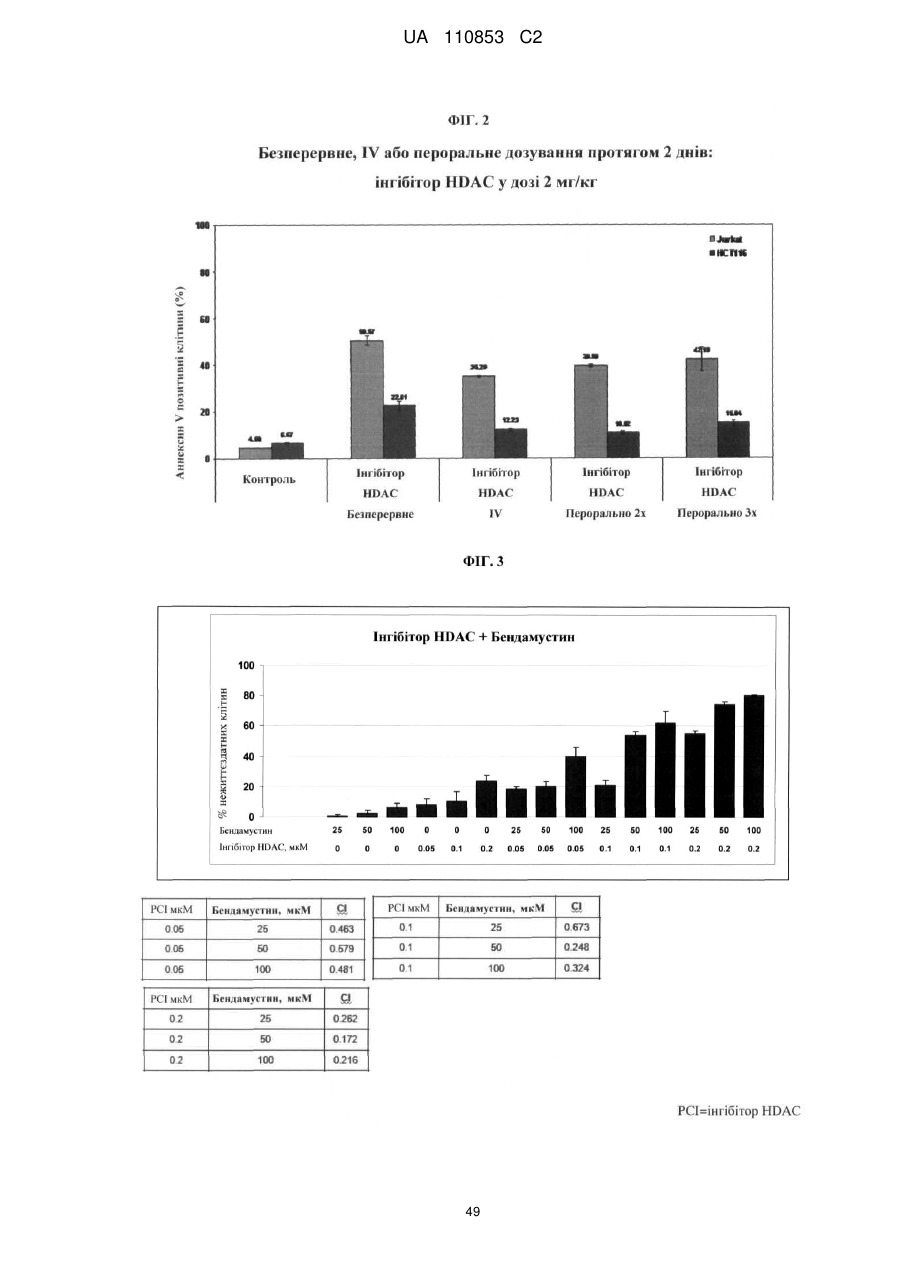
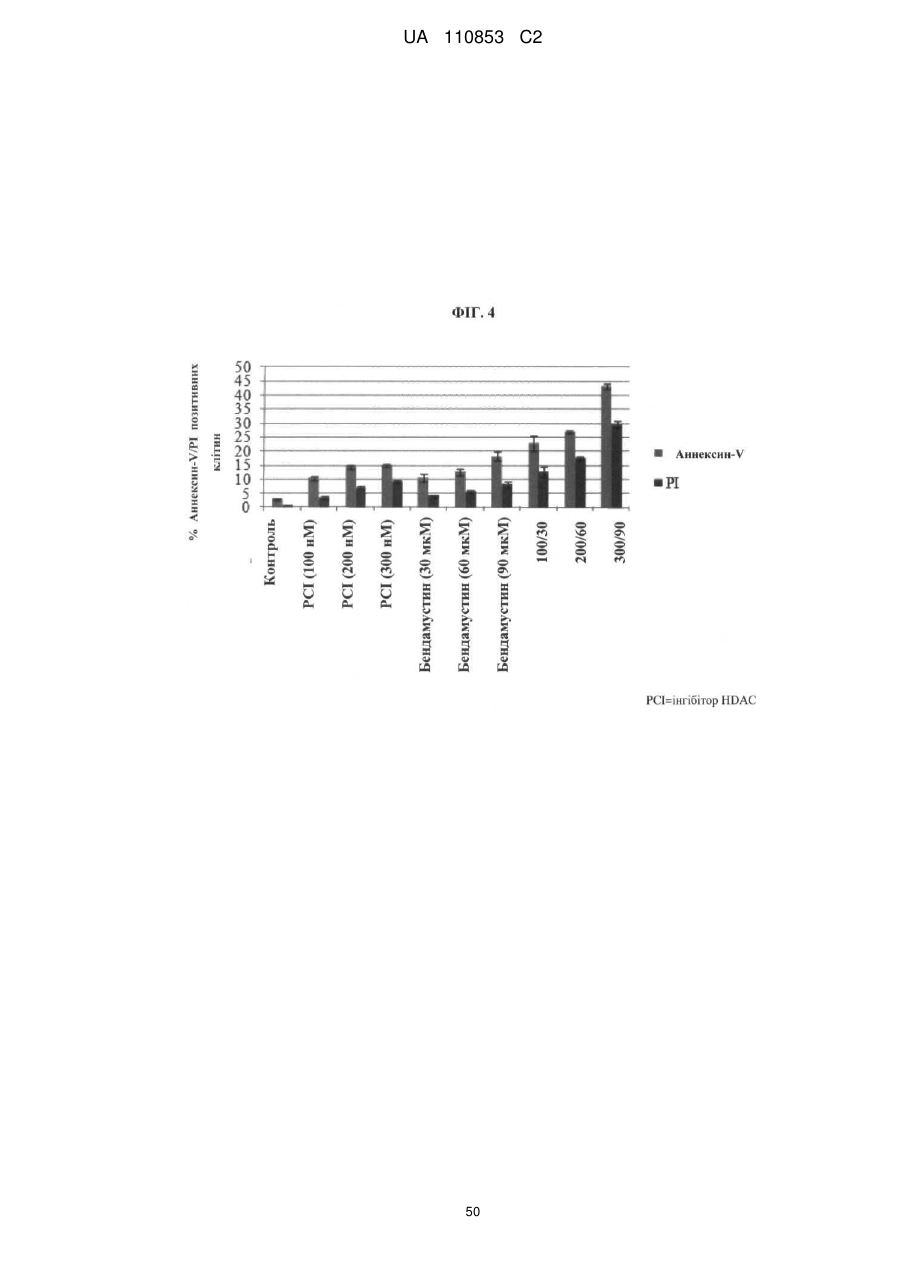
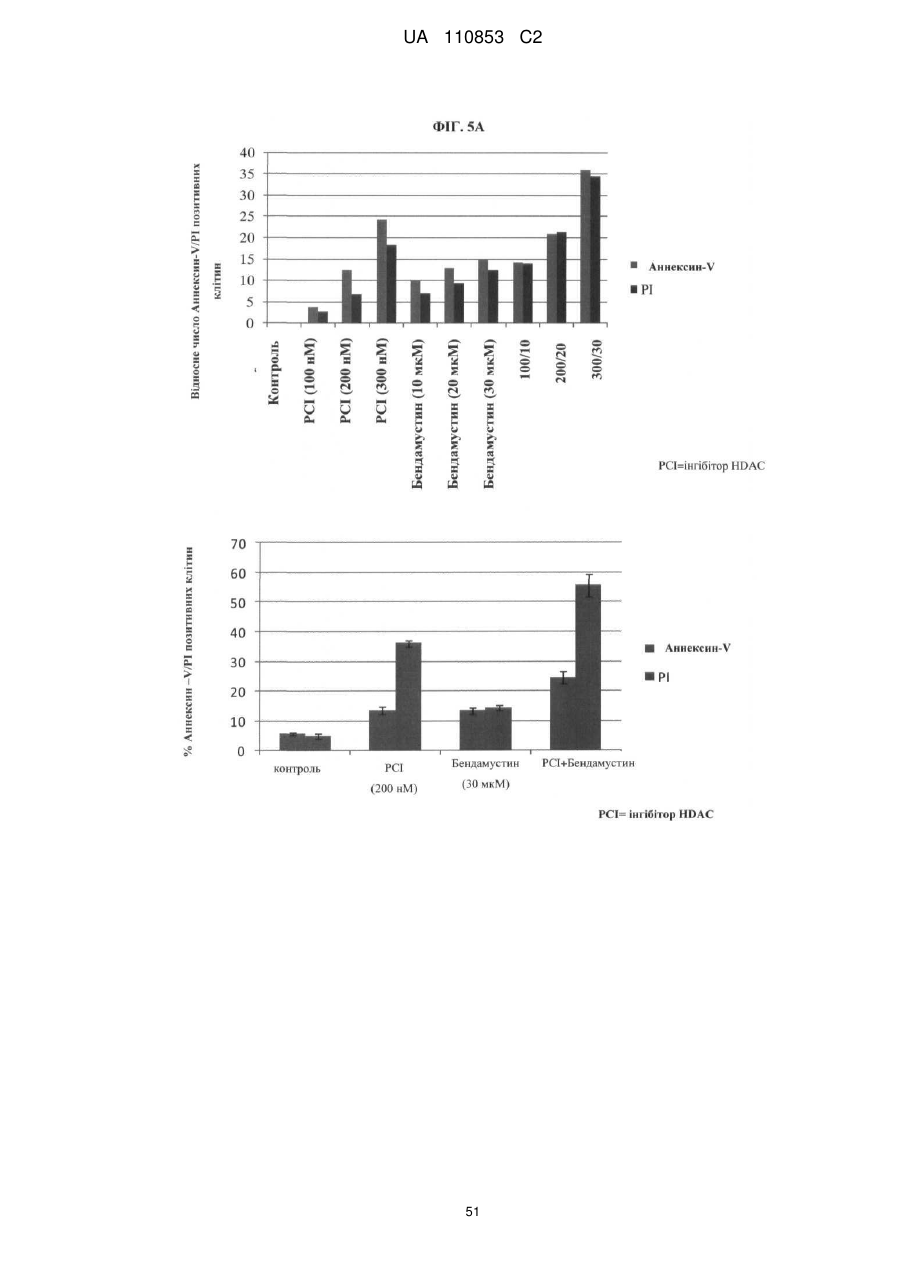
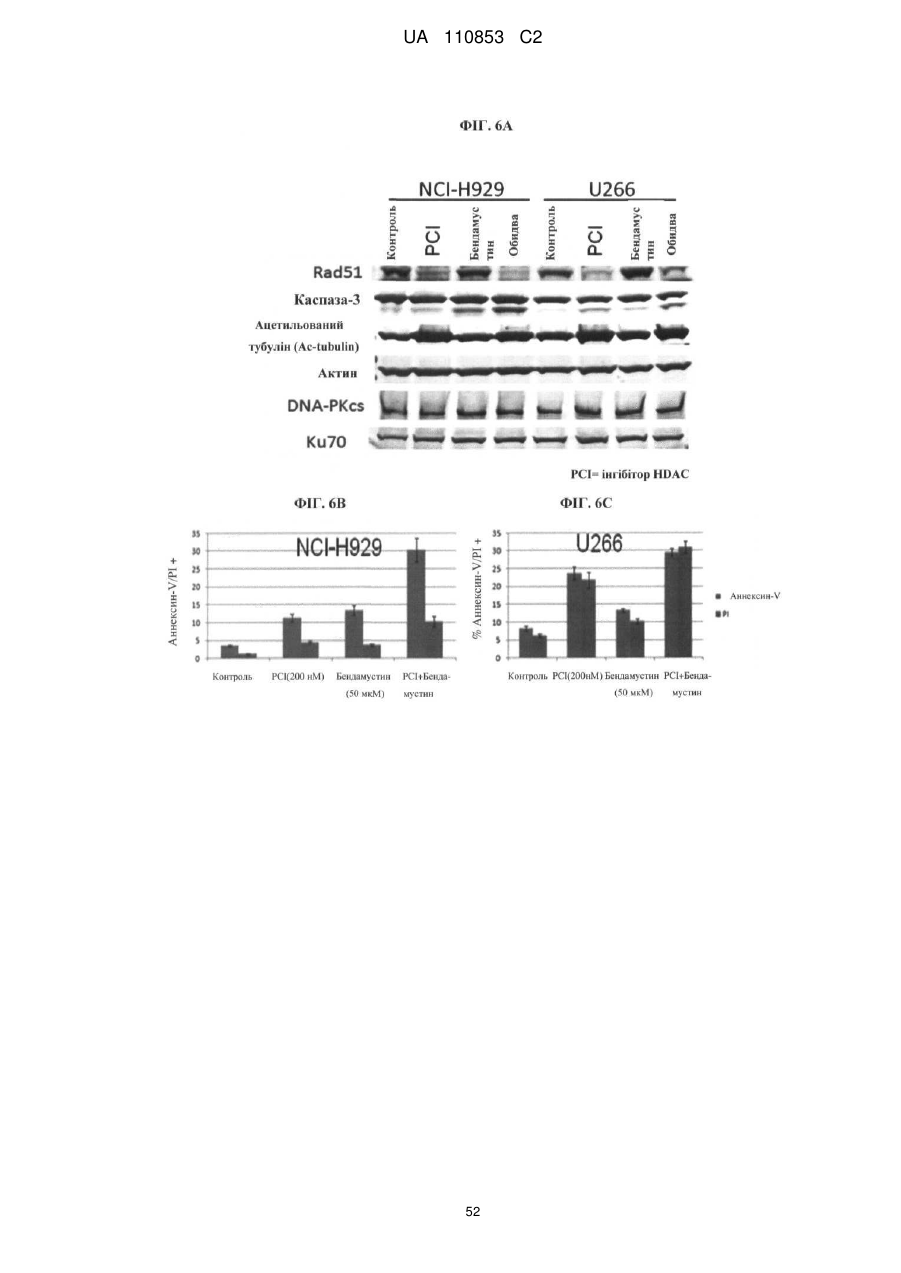
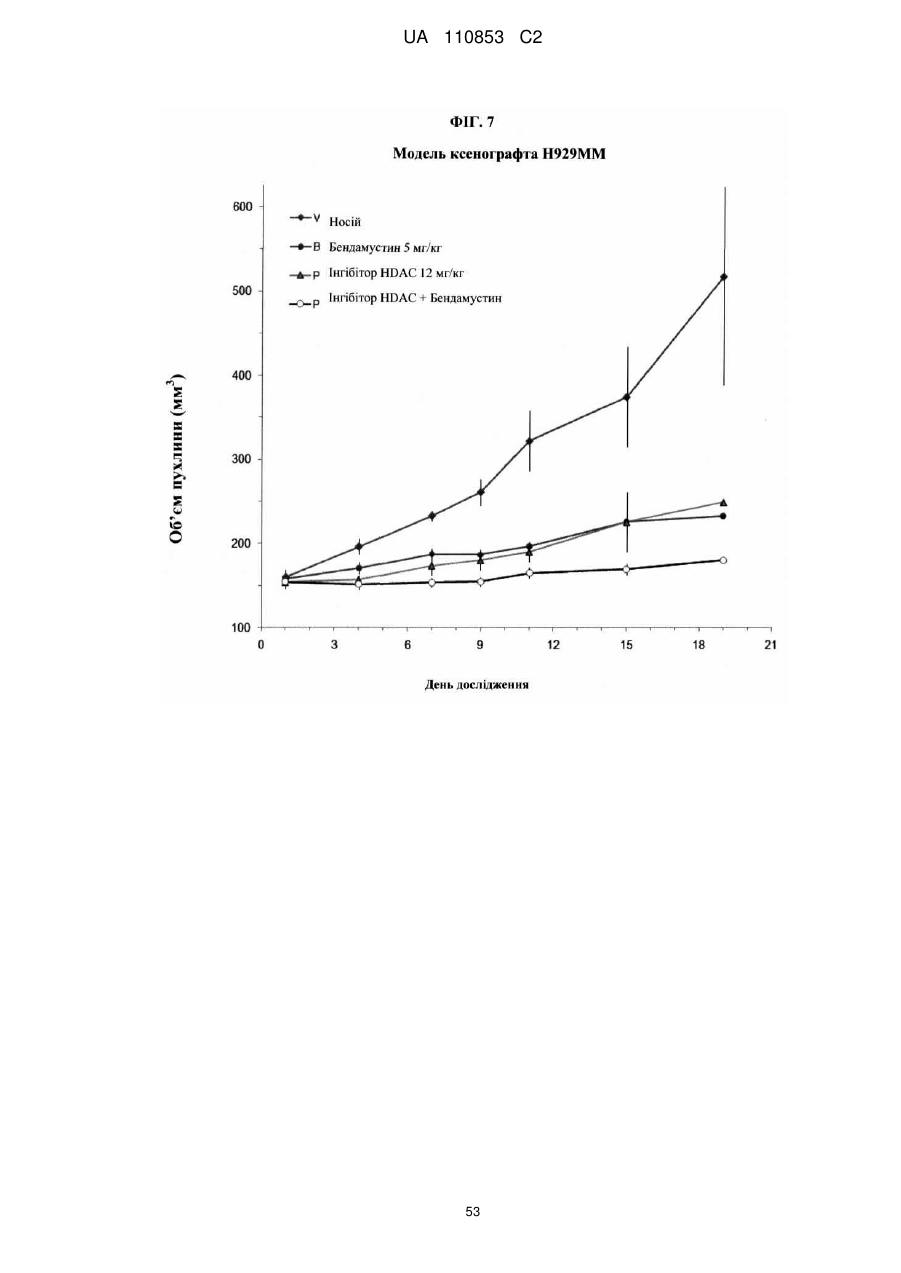
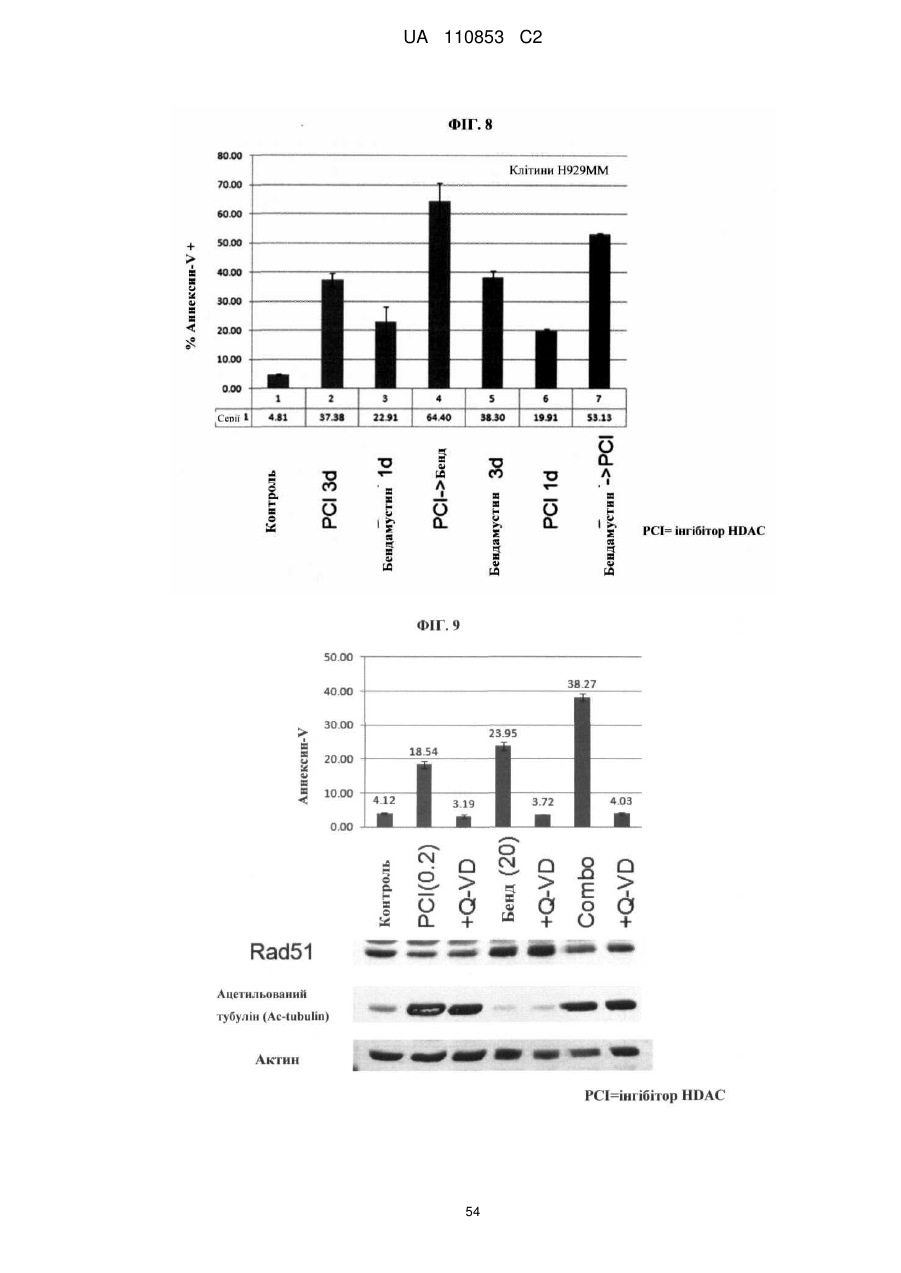
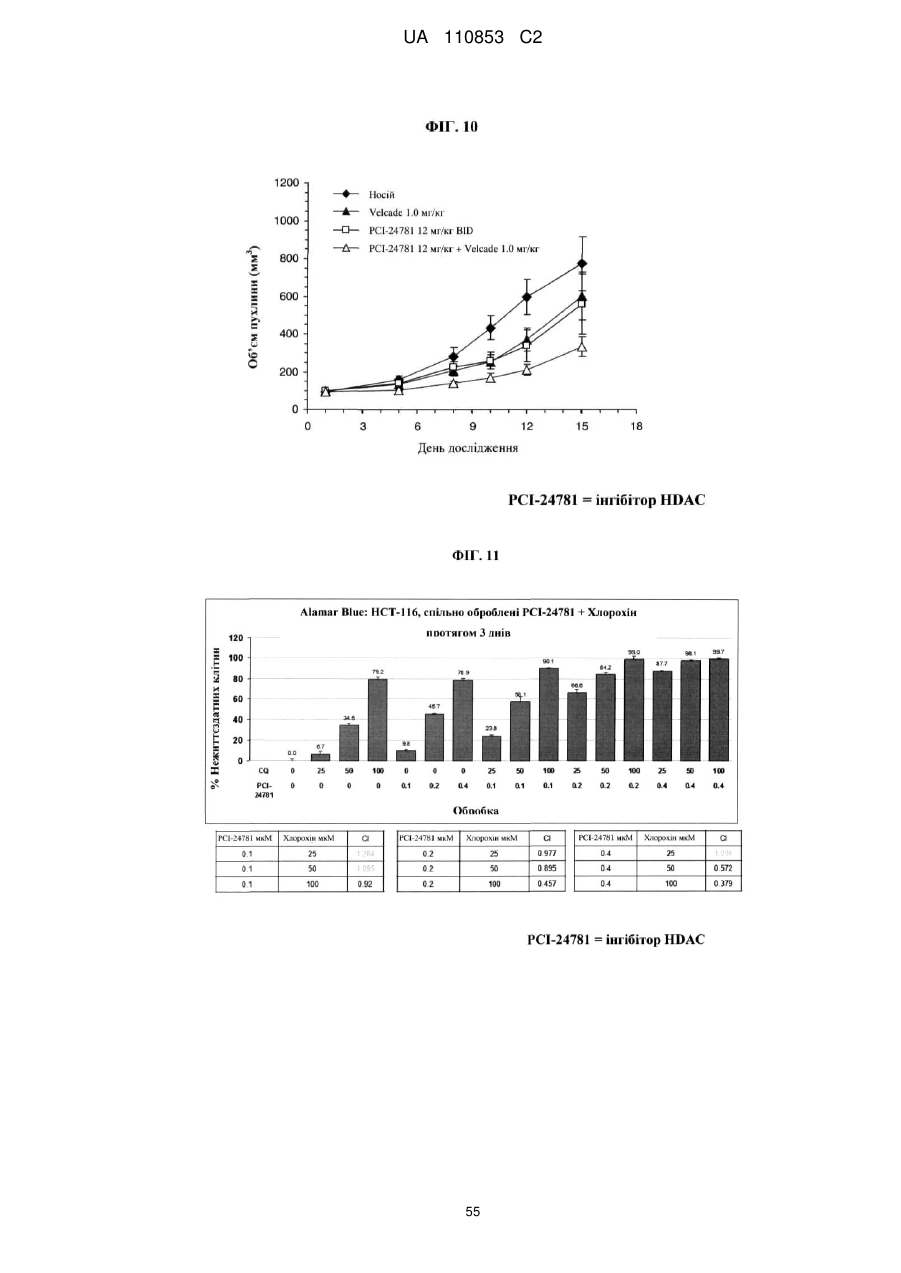
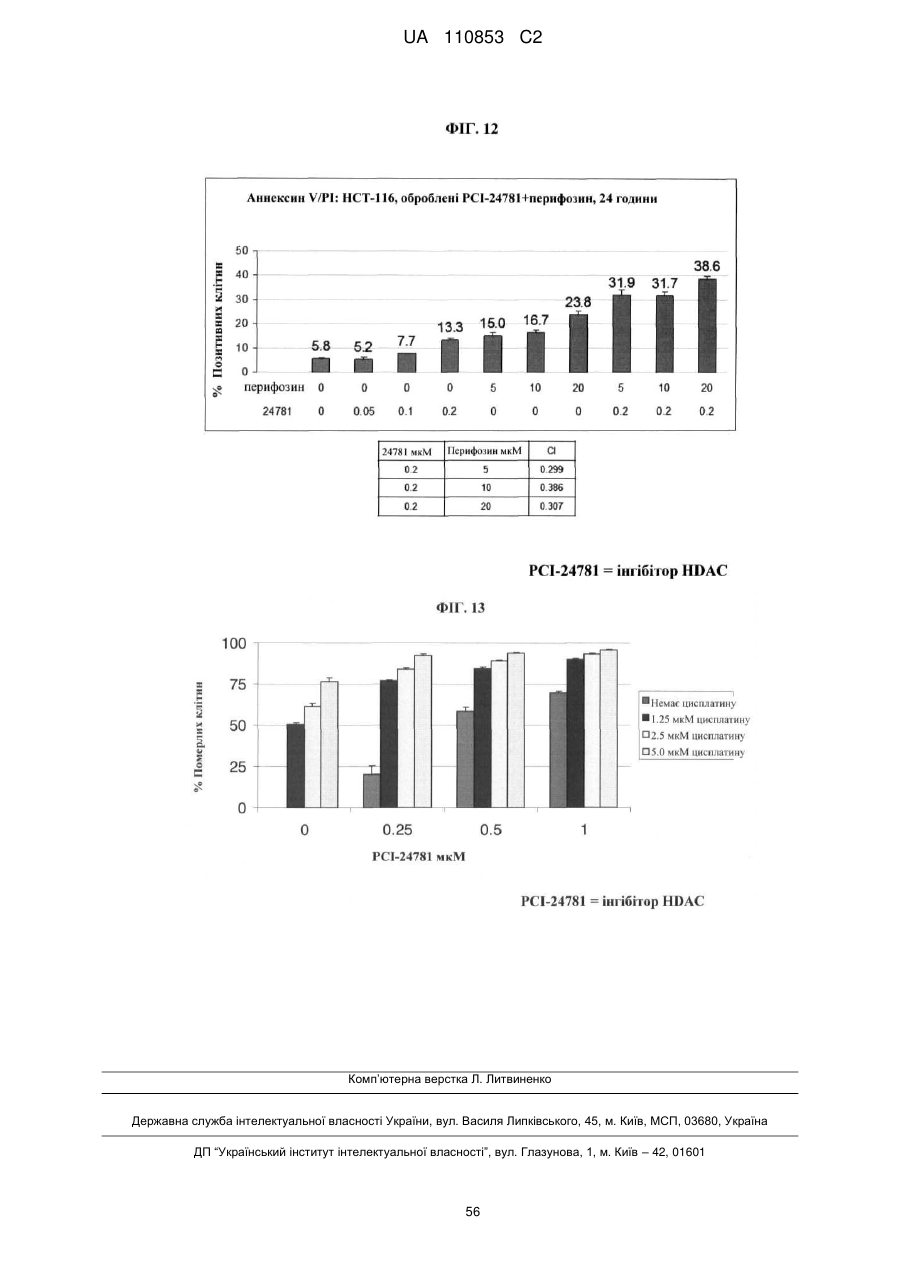
Лікарські форми інгібітора гістондеацетилази у комбінації з бендамустином та їхнє застосування
Номер патенту: 110853
Опубліковано: 25.02.2016
Автори: Депіл Стефан, Баггі Джозеф Джей., Клус Іоана, Лурі Девід Джей., Баласубраманіан Срірам, Пурро Норберт, Моді Тарак Ді., Вернер Ерік Джей.
Формула / Реферат
1. Фармацевтична композиція, яка містить:
(a) Сполуку 1

Сполука 1
або її фармацевтично прийнятну сіль;
(b) бендамустин або його фармацевтично прийнятний складний ефір, сіль або сольват; і
(c) щонайменше одну фармацевтично прийнятну допоміжну речовину.
2. Фармацевтична композиція за пунктом 1, при цьому зазначена композиція являє собою фармацевтичну композицію з контрольованим вивільненням.
3. Фармацевтична композиція за пунктом 2, в якій фармацевтична композиція повністю вивільняє зазначений активний інгредієнт(и): (і) з постійною швидкістю протягом періоду від приблизно 6 годин до приблизно 10 годин після перорального введення людині; (іі) зі зменшуваною швидкістю протягом періоду від приблизно 6 годин до приблизно 10 годин після перорального введення людині; або (ііі) у вигляді імпульсів протягом періоду від приблизно 6 годин до приблизно 10 годин після перорального введення людині.
4. Фармацевтична композиція за пунктом 2, при цьому фармацевтична композиція вивільняє менше ніж приблизно 10 % активних інгредієнтів у шлунку після перорального введення людині.
5. Фармацевтична композиція за пунктом 1, при цьому композиція є придатною для роздільного, послідовного та/або одночасного введення бендамустину та Сполуки 1.
6. Фармацевтична композиція за пунктом 1, при цьому фармацевтична композиція представлена у формі пероральної твердої дозованої лікарської форми.
7. Фармацевтична композиція за пунктом 1, при цьому Сполука 1 є інгібітором HDAC.
8. Фармацевтична композиція за пунктом 7, при цьому НСl сіль Сполуки 1 є інгібітором HDAC.
9. Комбінація бендамустину або його фармацевтично прийнятного складного ефіру, солі або сольвату та інгібітора HDAC, при цьому інгібітор HDAC являє собою Сполуку 1:

Сполука 1
або її фармацевтично прийнятну сіль.
10. Комбінація за пунктом 9, при цьому бендамустин або його фармацевтично прийнятний складний ефір, сіль або сольват та інгібітор HDAC сформульовані в стандартну лікарську форму.
11. Комбінація за пунктом 9, при цьому бендамустин або його фармацевтично прийнятний складний ефір, сіль або сольват та інгібітор HDAC сформульовані в дозовані лікарські форми.
12. Комбінація за пунктом 9, при цьому інгібітор HDAC є НСl сіллю Сполуки 1.
13. Застосування комбінації (а) бендамустину або його фармацевтично прийнятного складного ефіру, солі або сольвату; і (b) Сполуки 1
 ,
,
Сполука 1
або її фармацевтично прийнятної солі,
для лікування раку у пацієнта, що потребує цього.
14. Застосування за пунктом 13, при цьому рак являє собою карциному, пухлину, новоутворення, лімфому, меланому, гліому, саркому та бластому.
15. Застосування за пунктом 13, при цьому рак являє собою лімфому з клітин мантійної зони, дифузійну В-великоклітинну лімфому, множинну мієлому, рак товстої кишки та неходжкінську лімфому.
16. Застосування за пунктом 13, при цьому введення бендамустину та Сполуки 1 або її фармацевтично прийнятної солі є одночасним.
17. Застосування за пунктом 13, при цьому бендамустин та Сполуку 1 або її фармацевтично прийнятну сіль вводять послідовно, при цьому бендамустин вводять в першу чергу.
18. Застосування за пунктом 13, при цьому бендамустин та Сполуку 1 або її фармацевтично прийнятну сіль вводять послідовно, при цьому Сполуку 1 або її фармацевтично прийнятну сіль вводять в першу чергу.
19. Застосування за пунктом 13, при цьому введення бендамустину та Сполуки 1 або її фармацевтично прийнятної солі є почерговим.
20. Застосування за пунктом 13, при цьому фармацевтично прийнятна сіль Сполуки 1 являє собою НСl сіль Сполуки 1.
Текст
Реферат: Винахід стосується фармацевтичної композиції, містить інгібітор гістодеацетилази (HDAC), бендамустин і фармацевтично прийнятну допоміжну речовину, комбінації бендамустину або його фармацевтично прийнятного складного ефіру, солі або сольвату та інгібітора HDAC і застосування такої комбінації для лікування раку у пацієнта, який цього потребує. UA 110853 C2 (12) UA 110853 C2 UA 110853 C2 5 10 15 20 25 30 35 40 45 50 55 60 Область техніки, до якої відноситься винахід Описані фармацевтичні композиції, які включають комбінації сполуки інгібітора гістондеацетилази (HDAC) і бендамустину для лікування раку. Крім того, описані способи лікування з використанням фармацевтичних композицій та режими дозування. Відомості про попередній рівень техніки Ацетильований стан нуклеосомальних гістонів відіграє важливу роль у регуляції експресії генів. Деацетилування нуклеосомальних гістонів каталізується групою ферментів, відомих як гістондеацетилази (HDAC), серед яких є одинадцять відомих ізоформ. Деацетилування гістонів призводить до конденсації хроматину, викликаючи репресію транскрипції, тоді як ацетилування індукує локалізовану релаксацію в специфічних ділянках хромосом для забезпечення більше широкого доступу до транскрипційного механізму для полегшення транскрипції. У пухлинних клітинах селективні інгібітори ферментів HDAC викликають гіперацетилування гістонів. Це змінює регуляцію транскрипції піднабору генів, у тому числі багатьох пухлинних супресорів, генів, які беруть участь у контролі клітинного циклу, клітинному розподілі й апоптозі. Крім того, інгібітори HDAC, як повідомлялося, інгібують ріст пухлини in vivo. Інгібування росту пухлини супроводжується гіперацетилуванням гістонів і тубуліну, і може включати множину механізмів. Інгібітори HDAC блокують проліферацію ракових клітин in vitro та in vivo. N-Гідрокси-4-{2-[3(N,N-диметиламінометил)бензофуран-2-ілкарбоніламіно]етокси}-бензамід (Сполука 1) являє собою інгібітор HDAC на основі гідроксамату, призначений для лікування раку в людини. Короткий опис винаходу Розкриті фармацевтичні композиції, способи лікування раку, режими дозування та комбіновані терапії. Представлений спосіб лікування або попередження раку в пацієнта, який включає стадію введення зазначеному пацієнту бендамустину та інгібітора гістондеацетилази (HDAC). У деяких варіантах здійснення рак являє собою карциному, пухлину, новоутворення, лімфому, меланому, гліому, саркому і бластому. У певних варіантах здійснення карцинома вибрана з групи, що складається з: карциноми, аденокарциноми, аденокістозної карциноми, аденосквамозної карциноми, адренокортикальної карциноми, високодиференційованої карциноми, плоскоклітинної карциноми, серозної карциноми, дрібноклітинної карциноми, інвазивної плоскоклітинної карциноми, великоклітинної карциноми, карциноми острівцевих клітин, вівсяно-клітинної карциноми, плоскоклітинної карциноми, недиференційованої карциноми, бородавчастої карциноми, нирково-клітинної карциноми, серозної папілярної аденокарциноми, карциноми із клітин Меркеля, гепатоцелюлярної карциноми, карциноми м'яких тканин, карциноми бронхіальних залоз, капілярної карциноми, карциноми бартолінової залози, базальноклітинної карциноми, карциносаркоми, папіломи/карциноми, світлоклітинної карциноми, ендометріоїдної аденокарциноми, мезотеліальної, метастатичної карциноми, мукоепідермоїдної карциноми, холангіокарциноми, старечого кератозу, цистаденоми і гепатичного аденоматозу. У певних інших варіантах здійснення пухлина вибрана з групи, що складається з: астроцитарних пухлин, злоякісних мезотеліальних пухлин, герміногенних пухлин яєчників, супратенторіальних примітивних нейроектодермальних пухлин, пухлин Вільмса, пухлин гіпофізу, внегонадних герміногенних пухлин, гастриноми, герміногенних пухлин, гестаціозної трофобластичної пухлини, пухлин мозку, пінеальних і супратенторіальних примітивних нейроектодермальних пухлин, пухлини гіпофізу, соматостатин-секретуючої пухлини, пухлини ендодермального синуса, нейроендокринних пухлин, центральної церебральної астроцитоми, глюкагономи, гепатичної аденоми, інсуліноми, медулоепітеліоми, плазмацитоми, віпоми і феохромоцитоми. У певних варіантах здійснення новоутворення вибране з групи, що складається з інтраепітеліальної неоплазії, множинної мієломи/неоплазми плазматичних клітин, неоплазми плазматичних клітин, плоскоклітинної інтраепітеліальної неоплазії, ендометріальної гіперплазії, фокальної нодулярної гіперплазії, гемангіоендотеліоми і злоякісної тимоми. У певних інших варіантах здійснення лімфома вибрана з групи, що складається з: лімфоми нервової системи, СНІД-асоційованої лімфоми, шкірної Т-клітинної лімфоми, неходжкінської лімфоми, лімфоми і макроглобулінемії Вальденстрема. У певних варіантах здійснення лімфома являє собою індолентну лімфому. У конкретних варіантах здійснення індолентна лімфома являє собою одну або декілька з фолікулярної лімфоми, хронічного лімфоцитарного лейкозу/дрібноклітинної лімфоцитарної лімфоми (CLL/SLL), екстранодальної лімфоми маргінальної зони (MALT), лімфоми маргінальної зони (MZL) і макроглобулінемії Вальденстрема. У певних переважних варіантах здійснення меланома вибрана з групи, що складається з: акральної лентігінозної меланоми, поверхневої меланоми, що поширюється, 1 UA 110853 C2 5 10 15 20 25 30 35 40 45 50 55 60 увеальної меланоми, злоякісної меланоми лентіго, меланоми, внутрішньоочної меланоми, аденокарциноми нодулярної меланоми і гемангіоми. У певних варіантах здійснення саркома вибрана з групи, що складається з: аденоми, аденосаркоми, хондосаркоми, ендометріальної стромальної саркоми, саркоми Юінга, саркоми Капоші, лейоміосаркоми, рабдоміосаркоми, саркоми, саркоми матки, остеосаркоми, нейрофібросаркоми, злоякісної пухлини оболонок периферичних нервів (MPNST) і псевдосаркоми. У деяких варіантах здійснення в способі за пунктом 3 гліома вибрана з групи, що складається з: гліоми, гліоми стовбура головного мозку і гліоми гіпоталамічної області та зорового шляху. У деяких інших варіантах здійснення бластома вибрана з групи, що складається з: пульмональної бластоми, плевропульмональної бластоми, ретинобластоми, нейробластоми, медулобластоми, гліобластоми і гемангліобластоми. В одному варіанті здійснення представлений спосіб лікування або попередження раку в пацієнта, який включає стадію введення зазначеному пацієнту бендамустину та інгібітора гістондеацетилази (HDAC), при цьому рак являє собою лімфому з клітин мантійної зони, дифузійну В-великоклітинну лімфому, індолентну лімфому, множинну мієлому або рак товстої кишки. У певних варіантах здійснення введення бендамустину та інгібітора гістондеацетилази (HDAC) є одночасним. У певних інших варіантах здійснення введення бендамустину та інгібітора гістондеацетилази (HDAC) є послідовним, при цьому бендамустин уводять в першу чергу. У певних варіантах здійснення введення бендамустину та інгібітора гістондеацетилази (HDAC) є послідовним, при цьому інгібітор HDAC уводять в першу чергу. У деяких інших варіантах здійснення введення бендамустину та інгібітора HDAC здійснюють почергово. У певних варіантах здійснення пропонується спосіб лікування або попередження раку в пацієнта, який включає стадію введення зазначеному пацієнту бендамустину та інгібітора гістондеацетилази (HDAC), при цьому інгібітор HDAC являє собою: N-гідрокси-4-[2-(4метоксихінолін-2-ілкарбоніламіно)етокси]бензамід; N-гідрокси-4-[2S-(трансциннамоїламіно)бутокси]бензамід; N-гідрокси-4-[2R-(транс-циннамоїламіно)бутокси]бензамід; Nгідрокси-4-{2-[4-(2-метоксіетокси)хінолін-2-ілкарбоніламіно]етокси}бензамід; N-гідрокси-4-[2S(бензотіофен-2-ілкарбоніламіно)-бутокси]бензамід; N-гідрокси-4-{2S-[бензофуран-2ілкарбоніламіно]бутокси}бензамід; N-гідрокси-4-{2-[3-(метоксиметил)бензофуран-2ілкарбоніламіно]етокси}бензамід; N-гідрокси-4-{2-[3-(N,N-диметиламінометил)бензофуран-2ілкарбоніламіно]етокси}-бензамід; N-гідрокси-4-{2-[3-(i-пропоксиметил)бензофуран-2ілкарбоніламіно]етокси}-бензамід; N-гідрокси-4-{2-[3-(3-гідроксипропоксиметил)бензофуран-2ілкарбоніламіно]етокси}бензамід; N-гідрокси-4-{2-[3-(2-метоксіетилоксиметил)-бензофуран-2ілкарбоніламіно]етокси}бензамід; N-гідрокси-4-{2-[3-(піролідин-1-ілметил)бензофуран-2ілкарбоніламіно]етокси}бензамід; N-гідрокси-4-{2-[3-(піперидин-1-ілметил)бензофуран-2ілкарбоніламіно]етокси}бензамід; N-гідрокси-4-{2-[3-(4-метилпіперазин-1-ілметил)бензофуран-2ілкарбоніламіно]етокси}бензамід; N-гідрокси-4-{2-[5-(тетрагідропіран-4-ілокси)бензофуран-2ілкарбоніламіно]етокси}-бензамід; N-гідрокси-4-{2-[5-(2-піролідин-1-ілетилокси)бензофуран-2ілкарбоніламіно]етокси}бензамід; N-гідрокси-4-{2S-[5-(2-піролідин-1-ілетилокси)бензофуран-2ілкарбоніламіно]бутокси}бензамід; N-гідрокси-4-{2-[5-(2-піролідин-1-ілетилокси)-бензофуран-2ілкарбоніламіно]-1R-метилетокси}бензамід; N-гідрокси-4-{2-[(3-(бензофуран-2-іл)-4(диметиламіно)-бут-2-еноїл)аміно]етокси}бензамід, або його фармацевтично прийнятну сіль. У деяких варіантах здійснення інгібітор HDAC являє собою HCl сіль N-гідрокси-4-{2-[3-(N,Nдиметиламінометил)бензофуран-2-ілкарбоніламіно]етокси}бензаміду. У певних варіантах здійснення винахід забезпечує фармацевтичні композиції, які містять бендамустин та інгібітор HDAC, при цьому комбінація бендамустину та інгібітора HDAC є придатною для роздільного, послідовного та/або одночасного введення. У певних варіантах здійснення пацієнт попередньо оброблений інгібітором HDAC до введення бендамустину. У деяких варіантах здійснення ефективну дозу інгібітора HDAC вводять протягом періоду до одного тижня перед терапією бендамустином. У деяких варіантах здійснення ефективну дозу інгібітора HDAC вводять протягом періоду до п'яти днів перед введенням ефективної кількості бендамустину. У деяких варіантах здійснення ефективну дозу інгібітора HDAC вводять протягом періоду від одного до трьох днів перед введенням ефективної кількості бендамустину. У деяких варіантах здійснення ефективну дозу інгібітора HDAC вводять протягом періоду від одного до двох тижнів перед введенням ефективної кількості бендамустину. В одному варіанті здійснення ефективну дозу інгібітора HDAC вводять за двадцять чотири години до введення ефективної кількості бендамустину. В одному варіанті здійснення пропонується спосіб інгібування росту пухлини, який включає приведення в контакт пухлини з бендамустином та інгібітором гістондеацетилази (HDAC) у кількості, ефективній для інгібування росту пухлини. 2 UA 110853 C2 В іншому варіанті здійснення пропонується фармацевтична композиція у твердій лікарській формі, придатній для перорального введення, при цьому композиція містить: активний інгредієнт, який являє собою Сполуку 1: H3C CH3 N O OH H N O 5 10 15 20 25 30 35 40 45 50 N H O O Сполука 1 або її фармацевтично прийнятну сіль; і другий активний інгредієнт, який являє собою бендамустин або його фармацевтично прийнятний складний ефір, сіль або сольват; і, щонайменше, одну фармацевтично прийнятну допоміжну речовину. У певних варіантах здійснення сіль являє собою тозилатну сіль. У певних варіантах здійснення зазначена композиція являє собою пероральну тверду фармацевтичну композицію з контрольованим вивільненням. У певних варіантах здійснення цієї твердої дозованої фармацевтичної композиції, один або більше ніж один активний інгредієнт присутній у вигляді солі та фармацевтична композиція повністю вивільняє зазначений активний інгредієнт(и): (i) з постійною швидкістю протягом періоду від приблизно 6 годин до приблизно 10 годин після перорального введення людині; (ii) зі зменшуваною швидкістю протягом періоду від приблизно 6 годин до приблизно 10 годин після перорального введення людині; або (iii) у вигляді імпульсів протягом періоду від приблизно 6 годин до приблизно 10 годин після перорального введення людині. У певних варіантах здійснення сіль являє собою тозилатну сіль. У певних інших варіантах здійснення пероральна тверда дозована фармацевтична композиція з контрольованим вивільненням являє собою композицію, яка вивільняє менше ніж приблизно 10 % активних інгредієнтів у шлунку після перорального введення людині. У певних варіантах здійснення пероральна тверда дозована фармацевтична композиція з контрольованим вивільненням містить активні інгредієнти у матриці контрольованого вивільнення. У певних інших варіантах здійснення фармацевтична композиція представлена у формі таблетки з ентеросолюбільним покриттям. В інших варіантах здійснення фармацевтична композиція містить частинки активних інгредієнтів. В інших варіантах здійснення фармацевтична композиція містить від приблизно 10 до приблизно 1000 мг, від приблизно 25 до приблизно 600 мг, від приблизно 50 до приблизно 200 мг і приблизно 100 мг кожного активного інгредієнта. У наступних варіантах здійснення фармацевтична композиція є придатною для роздільного, послідовного та/або одночасного введення бендамустину та інгібітора HDAC. В одному аспекті описаний спосіб лікування раку в людини, який включає: введення людині фармацевтичної композиції, що містить інгібітор гістондеацетилази (HDAC), циклами, які складаються з щоденного введення фармацевтичної композиції, що містить інгібітор HDAC, протягом від 5 до 9 послідовних днів з наступною відсутністю введення фармацевтичної композиції, що містить інгібітор HDAC, протягом від 2 до 7 послідовних днів. У деяких варіантах здійснення спосіб лікування раку в людини включає: введення людині фармацевтичної композиції, що містить інгібітор гістондеацетилази (HDAC), циклами, які складаються з щоденного введення фармацевтичної композиції, що містить інгібітор HDAC, протягом від 5 до 9 послідовних днів з наступною відсутністю введення фармацевтичної композиції, що містить інгібітор HDAC, протягом від 5 до 7 послідовних днів. У деяких варіантах здійснення щоденне введення фармацевтичної композиції, що містить інгібітор HDAC, протягом від 5 до 9 послідовних днів включає: щоденне введення двох фармацевтичних композицій з негайним вивільненням, що містять інгібітор HDAC, при цьому дві фармацевтичні композиції з негайним вивільненням уводять послідовно, при цьому другу фармацевтичну композицію з негайним вивільненням уводять з інтервалом від приблизно 4 до приблизно 6 годин після введення першої фармацевтичної композиції з негайним вивільненням; або щоденне введення однієї пероральної твердої дозованої фармацевтичної композиції з контрольованим вивільненням, що містить інгібітор HDAC. У деяких варіантах здійснення щоденне введення фармацевтичної композиції, що містить інгібітор HDAC, протягом від 5 до 9 послідовних днів включає щоденне введення інгібітора HDAC у кількості, достатній для підтримки ефективних концентрацій у плазмі крові інгібітора 3 UA 110853 C2 5 10 15 20 25 30 35 40 45 50 55 60 HDAC у людини протягом, щонайменше, приблизно 6 послідовних годин у дні дозування. У деяких варіантах здійснення щоденне введення фармацевтичної композиції, що містить інгібітор HDAC, протягом від 5 до 9 послідовних днів включає щоденне введення інгібітора HDAC у кількості, достатній для підтримки ефективних концентрацій у плазмі крові інгібітора HDAC у людини протягом, щонайменше, приблизно 6 послідовних годин у дні дозування, але не більше 14 послідовних годин. У деяких варіантах здійснення щоденне введення фармацевтичної композиції, що містить інгібітор HDAC, протягом від 5 до 9 послідовних днів включає щоденне введення інгібітора HDAC у кількості, достатній для підтримки ефективних концентрацій у плазмі крові інгібітора HDAC у людини протягом від приблизно 6 послідовних годин до приблизно 8 послідовних годин у дні дозування. У деяких варіантах здійснення щоденне введення фармацевтичної композиції, що містить інгібітор HDAC, протягом від 5 до 9 послідовних днів включає: щоденне введення двох фармацевтичних композицій з негайним вивільненням, що містять інгібітор HDAC, при цьому дві фармацевтичні композиції з негайним вивільненням уводять послідовно з інтервалом від 4 до 6 годин; або щоденне введення однієї пероральної твердої дозованої фармацевтичної композиції з контрольованим вивільненням, що містить інгібітор HDAC. У деяких варіантах здійснення одна пероральна тверда дозована фармацевтична композиція з контрольованим вивільненням, що містить інгібітор HDAC, забезпечує по суті таке саме вивільнення in vivo у людини, як і дві фармацевтичні композиції з негайним вивільненням, що містять інгібітор HDAC, які вводять послідовно з інтервалом від 4 до 6 годин. У деяких варіантах здійснення інгібітор HDAC являє собою: N-гідрокси-4-[2-(4метоксихінолін-2-ілкарбоніламіно)етокси]бензамід; N-гідрокси-4-[2S-(трансциннамоїламіно)бутокси]бензамід; N-гідрокси-4-[2R-(транс-циннамоїламіно)бутокси]-бензамід; N-гідрокси-4-{2-[4-(2-метоксіетокси)хінолін-2-ілкарбоніламіно]етокси}-бензамід; N-гідрокси-4-[2S(бензотіофен-2-ілкарбоніламіно)бутокси]бензамід; N-гідрокси-4-{2S-[бензофуран-2ілкарбоніламіно]бутокси}бензамід; N-гідрокси-4-{2-[3-(метоксиметил)бензофуран-2ілкарбоніламіно]етокси}бензамід; N-гідрокси-4-{2-[3-(N,N-диметиламінометил)бензофуран-2ілкарбоніламіно]етокси}бензамід; N-гідрокси-4-{2-[3-(i-пропоксиметил)бензофуран-2ілкарбоніламіно]етокси}бензамід; N-гідрокси-4-{2-[3-(3-гідроксипропоксиметил)бензофуран-2ілкарбоніламіно]етокси}бензамід; N-гідрокси-4-{2-[3-(2-метоксіетилоксиметил)бензофуран-2ілкарбоніламіно]етокси}-бензамід; N-гідрокси-4-{2-[3-(піролідин-1-ілметил)бензофуран-2ілкарбоніламіно]-етокси}бензамід; N-гідрокси-4-{2-[3-(піперидин-1-ілметил)бензофуран-2ілкарбоніламіно]етокси}бензамід; N-гідрокси-4-{2-[3-(4-метилпіперазин-1-ілметил)бензофуран-2ілкарбоніламіно]етокси}бензамід; N-гідрокси-4-{2-[5-(тетрагідропіран-4-ілокси)бензофуран-2ілкарбоніламіно]етокси}бензамід; N-гідрокси-4-{2-[5-(2-піролідин-1-ілетилокси)бензофуран-2ілкарбоніламіно]етокси}бензамід; N-гідрокси-4-{2S-[5-(2-піролідин-1-ілетилокси)бензофуран-2ілкарбоніламіно]бутокси}-бензамід; N-гідрокси-4-{2-[5-(2-піролідин-1-ілетилокси)бензофуран-2ілкарбоніламіно]-1R-метилетокси}бензамід; N-гідрокси-4-{2-[(3-(бензофуран-2-іл)-4(диметиламіно)-бут-2-еноїл)аміно]етокси}бензамід, або його фармацевтично прийнятну сіль. У деяких варіантах здійснення інгібітор HDAC являє собою HCl сіль N-гідрокси-4-{2-[3-(N,Nдиметиламінометил)бензофуран-2-ілкарбоніламіно]етокси}-бензаміду. У деяких варіантах здійснення інгібітор HDAC являє собою тозилатну сіль N-гідрокси-4-{2-[3(N,N-диметиламінометил)бензофуран-2-ілкарбоніламіно]етокси}-бензаміду. У деяких варіантах здійснення щоденне введення фармацевтичної композиції, що містить HCl сіль N-гідрокси-4-{2-[3-(N,N-диметиламінометил)бензофуран-2ілкарбоніламіно]етокси}бензаміду, протягом від 5 до 9 послідовних днів включає: щоденне введення двох фармацевтичних композицій з негайним вивільненням, що містять HCl сіль Сполуки 1, при цьому дві фармацевтичні композиції з негайним вивільненням уводять з інтервалом від 4 до 6 годин; або щоденне введення однієї пероральної твердої дозованої фармацевтичної композиції з контрольованим вивільненням. У деяких варіантах здійснення щоденне введення фармацевтичної композиції, що містить HCl сіль N-гідрокси-4-{2-[3-(N,N-диметиламінометил)бензофуран-2ілкарбоніламіно]етокси}бензаміду, протягом від 5 до 9 послідовних днів включає щоденне введення від приблизно 10 мг до приблизно 300 мг HCl солі N-гідрокси-4-{2-[3-(N,Nдиметиламінометил)бензофуран-2-ілкарбоніламіно]етокси}бензаміду. У деяких варіантах здійснення рак являє собою гематологічний рак, солідну пухлину або саркому. У деяких варіантах здійснення рак являє собою рак молочної залози, рак товстої кишки, колоректальну карциному, недрібноклітинний рак легенів, дрібноклітинний рак легенів, рак печінки, рак яєчників, рак передміхурової залози, рак шийки матки, рак сечового міхура, 4 UA 110853 C2 5 10 15 20 25 30 35 40 45 50 55 карциному шлунка, гастроінтестинальну стромальну пухлину, рак підшлункової залози, герміногенні пухлини, мастоцитому, нейробластому, мастоцитоз, рак яєчка, гліобластому, астроцитому, В-клітинну лімфому, Т-клітинну лімфому, лімфому Ходжкіна, неходжкінську лімфому, індолентну лімфому, меланому, мієлому, гострий мієлоцитарний лейкоз (AML), гострий лімфобластний лейкоз (ALL), мієлодиспластичний синдром і хронічну мієлогенну лейкемію. У деяких варіантах здійснення спосіб додатково включає введення людині, щонайменше, одного додаткового терапевтичного агента, вибраного з ДНК-ушкоджуючих агентів; інгібіторів топоізомерази I або II; алкілуючих агентів; інгібіторів PARP; інгібіторів протеосом; антиметаболітів РНК/ДНК; антимітотичних агентів; імуномодулюючих засобів; антиангіогенних препаратів; інгібіторів ароматази; гормономодулюючих препаратів; апоптоз-індукуючих агентів; інгібіторів кінази; моноклональних антитіл; абареліксу; АВТ-888; алдеслейкіну; алдеслейкіну; алемтузумабу; алітретиноїну; алопуринолу; альтретаміну; аміфостину; анастрозолу; триоксиду миш'яку; аспарагінази; азацитидину; AZD-2281; бендамустину; перифозину; леналіноміду; хлорохіну; бевацизумабу; бексаротену; блеоміцину; бортезомібу; BSI-201; бусульфану; калустерону; капецитабіну; карбоплатину; карфілозибу; кармустину; целекоксибу; цетуксимабу; хлорамбуцилу; цисплатину; кладрибіну; клофарабіну; циклофосфаміду; цитарабіну; ліпосомальної форми цитарабіну; дакарбазину; дактиноміцину; дарбепоетину альфа; дазатинібу; ліпосомальної форми даунорубіцину; даунорубіцину; децитабіну; денілейкіну; дексразоксану; доцетакселу; доксорубіцину; ліпосомальної форми доксорубіцину; дромостанолону пропіонату; епірубіцину; епоетину альфа; ерлотинібу; естрамустину; етопозиду фосфату; етопозиду; екземестану; філграстиму; флоксуридину; флударабіну; фторурацилу; фулвестранту; гефітинібу; гемцитабіну; гемтузумабу озогаміцину; гозереліну ацетату; гістреліну ацетату; гідроксисечовини; ібритумомабу тіуксетану; ідарубіцину; іфосфаміду; іматинібу мезилату; інтерферону альфа-2а; інтерферону альфа-2b; іринотекану; леналідоміду; летрозолу; лейковорину; леупроліду ацетату; левамізолу; ломустину; меклоретаміну; мегестеролу ацетату; мелфалану; меркаптопурину; метотрексату; метоксалену; мітоміцину-С; мітотану; мітоксантрону; нандролону фенпропіонату; неларабіну; NPI-0052; нофетумомабу; опрелвекіну; оксаліплатину; паклітакселу; пов'язаних з білком частинок паклітакселу; паліферміну; памідронату; панітумумабу; пегадемази; пегаспаргази; пегфілграстиму; пеметрекседу динатрію; пентостатину; піпоброману; плікаміцину; мітраміцину; порфімеру натрію; прокарбазину; квінакрину; RAD001; расбурикази; ритуксимабу; сарграмостиму; сарграмостиму; сорафенібу; стрептозоцину; сунітинібу малату; тамоксифену; темозоломіду; теніпозиду; тестолактону; талідоміду; тіогуаніну; тіотепи; топотекану; тореміфену; тозитумомабу; тозитумомабу/I-131 тозитумомабу; трастузумабу; третиноїну; урацилового іприту; валрубіцину; вінбластину; вінкристину; вінорелбіну; вориностату; золедронату; і золедронової кислоти. У певних варіантах здійснення інгібітор HDAC (напр., Сполуку 1) уводять людині в комбінації з бендамустином і ритуксимабом. У деяких варіантах здійснення спосіб додатково включає променеву терапію. В одному варіанті здійснення спосіб включає введення людині алкілуючого агента в комбінації з інгібітором HDAC, розкритим у даному документі. В одному варіанті здійснення алкілуючий агент являє собою бендамустин. В іншому варіанті здійснення спосіб включає введення людині бендамустину, також відомого як Рибомустин або Треанда, у комбінації з інгібітором HDAC. В одному аспекті, описаному тут, пропонується спосіб лікування раку в людини, який включає введення людині фармацевтичної композиції, що містить HCl сіль N-гідрокси-4-{2-[3(N,N-диметиламінометил)бензофуран-2-ілкарбоніламіно]етокси}-бензаміду (Сполука 1) і, щонайменше, одну фармацевтично прийнятну допоміжну речовину, циклами, які складаються з щоденного введення фармацевтичної композиції, що містить HCl сіль Сполуки 1, протягом від 5 до 9 послідовних днів з наступною відсутністю введення фармацевтичної композиції, що містить HCl сіль Сполуки 1, протягом від 5 до 7 послідовних днів. У деяких варіантах здійснення щоденне введення фармацевтичної композиції, що містить HCl сіль Сполуки 1, протягом від 5 до 9 послідовних днів включає щоденне введення двох доз фармацевтичної композиції з негайним вивільненням, що містять HCl сіль Сполуки 1, при цьому дві дози з негайним вивільненням уводять з інтервалом від 4 до 6 годин. У деяких варіантах здійснення щоденне введення фармацевтичної композиції, що містить HCl сіль Сполуки 1, протягом від 5 до 9 послідовних днів включає введення однієї пероральної твердої дозованої фармацевтичної композиції з контрольованим вивільненням, як описано в даному документі. 5 UA 110853 C2 5 10 15 У деяких варіантах здійснення щоденне введення фармацевтичної композиції, що містить HCl сіль Сполуки 1, протягом від 5 до 9 послідовних днів включає від приблизно 10 мг до приблизно 300 мг HCl солі Сполуки 1. В одному аспекті спосіб лікування раку за допомогою інгібітора HDAC, як описано тут, зменшує випадки розвитку тромбоцитопенії 4 ступеня в людини, що має рак. В одному аспекті пропонується застосування HCl солі Сполуки 1 для виготовлення фармацевтичної композиції з контрольованим вивільненням для перорального введення людині, що має рак. В одному аспекті пропонується застосування фармацевтичної композиції HCl солі Сполуки 1 з контрольованим вивільненням для лікування раку в людини. В одному аспекті пропонується режим дозування фармацевтичної композиції для застосування в лікуванні раку в людини, при цьому фармацевтична композиція включає Сполуку 1 або її фармацевтично прийнятну сіль, і режим дозування зменшує число випадків розвитку тромбоцитопенії 4 ступеня в людини, що має рак. В одному аспекті в даному документі розкрита пероральна тверда дозована фармацевтична композиція з контрольованим вивільненням, що містить Сполуку 1: H3C CH3 N O OH N H H N O O O Сполука 1 20 25 30 35 40 45 50 або її фармацевтично прийнятну сіль і, щонайменше, одну фармацевтично прийнятну допоміжну речовину, при цьому фармацевтична композиція повністю вивільняє Сполуку 1 або її фармацевтично прийнятну сіль протягом від приблизно 6 годин до приблизно 10 годин після перорального введення людині. В одному аспекті Сполука 1 є присутньою у фармацевтичних композиціях у вигляді HCl солі (Сполука 1, HCl). У деяких варіантах здійснення Сполука 1 є присутньою у фармацевтичних композиціях у вигляді тозилатної солі. У деяких варіантах здійснення фармацевтична композиція повністю вивільняє Сполуку 1, HCl: (i) з постійною швидкістю протягом періоду від приблизно 6 годин до приблизно 10 годин після перорального введення людині; (ii) зі зменшуваною швидкістю протягом періоду від приблизно 6 годин до приблизно 10 годин після перорального введення людині; або (iii) у вигляді імпульсів протягом періоду від приблизно від 6 годин до приблизно 10 годин після перорального введення людині. У деяких варіантах здійснення фармацевтична композиція повністю вивільняє Сполуку 1, HCl протягом 10 годин після перорального введення людині. У деяких варіантах здійснення фармацевтична композиція вивільняє менше ніж близько 10 % Сполуки 1, HCl у шлунку після перорального введення людині. У деяких варіантах здійснення фармацевтична композиція не вивільняє Сполуку 1, HCl у шлунку після перорального введення людині. У деяких варіантах здійснення фармацевтична композиція містить Сполуку 1, HCl у матриці контрольованого вивільнення. У деяких варіантах здійснення фармацевтична композиція представлена у формі таблетки з ентеросолюбільним покриттям. У деяких варіантах здійснення ентеросолюбільне покриття містить: гідроксипропілцелюлозу, гідроксіетилцелюлозу, гідроксипропілметилцелюлозу, метилцелюлозу, етилцелюлозу, ацетат целюлози, ацетат-фталат целюлози, ацетат-тримелітат целюлози, фталат гідроксипропілметилцелюлози, фталат складного-простого ефіру целюлози, фталат гідроксипропілцелюлози, лужні солі ацетат-фталату целюлози, лужноземельні солі ацетатфталату целюлози, фталат гідроксипропілметилцелюлози, ацетат-фталат целюлози, натрійкарбоксиметилцелюлозу, полімери і співполімери акрилової кислоти, терполімер етилакрилату/метилметакрилату/триметиламоній хлорид етилметакрилату, співполімер метакрилової кислоти/етилакрилату, співполімер метакрилової кислоти/метилметакрилату, полівінілпіролідон, полівінілацетат, фталат полівінілацетату, співполімер вінілацетату та 6 UA 110853 C2 5 10 15 20 25 30 35 40 45 50 55 60 кротонової кислоти, шелак, амонізований шелак, шелак-цетиловий спирт або шелак-нбутилстеарат. У деяких варіантах здійснення фармацевтична композиція містить частинки Сполуки 1, HCl. У деяких варіантах здійснення фармацевтична композиція повністю вивільняє Сполуку 1, HCl у вигляді імпульсів протягом періоду від приблизно 6 годин до приблизно 10 годин. У деяких варіантах здійснення фармацевтична композиція містить, щонайменше, дві різні групи частинок Сполуки 1, HCl. У деяких варіантах здійснення фармацевтична композиція містить першу групу частинок Сполуки 1, HCl з відстроченим вивільненням і другу групу частинок Сполуки 1, HCl з відстроченим вивільненням. У деяких варіантах здійснення, частинки Сполуки 1, HCl з відстроченим вивільненням представлені у формі кульок, пелет, гранул або міні-таблеток. У деяких варіантах здійснення перша група частинок Сполуки 1, HCl з відстроченим вивільненням затримує вивільнення Сполуки 1, HCl, щонайменше, на 1-2 години після перорального введення людині. У деяких варіантах здійснення друга група частинок Сполуки 1, HCl з відстроченим вивільненням затримує вивільнення Сполуки 1, HCl, щонайменше, на 3-6 годин після перорального введення людині. У деяких варіантах здійснення вивільнення Сполуки 1, HCl з другої групи частинок з відстроченим вивільненням відбувається через 2-6 годин після вивільнення, щонайменше, половини кількості Сполуки 1, HCl з першої групи частинок з відстроченим вивільненням після введення людині. У деяких варіантах здійснення фармацевтична композиція вивільняє Сполуку 1, HCl у вигляді двох імпульсів, при цьому друге імпульсне вивільнення Сполуки 1, HCl відбувається через 2-6 годин після першого імпульсного вивільнення Сполуки 1, HCl після перорального введення людині. У деяких варіантах здійснення кількість Сполуки 1, HCl є однаковою у двох групах частинок. У деяких варіантах здійснення покриття з відстроченим вивільненням на першій групі частинок з відстроченим вивільненням відрізняється від покриття з відстроченим вивільненням на другій групі частинок з відстроченим вивільненням. У деяких варіантах здійснення покриття з відстроченим вивільненням включають чутливе до рН покриття або нечутливе до рН покриття. У деяких варіантах здійснення фармацевтична композиція представлена у формі пелет, кульок, гранул або міні-таблеток у капсулі. У деяких варіантах здійснення фармацевтична композиція представлена у формі пелет, кульок або гранул, які пресовані в одну таблетку. У деяких варіантах здійснення фармацевтична композиція містить приблизно від 10 мг до 300 мг Сполуки 1, HCl. У деяких варіантах здійснення фармацевтична композиція забезпечує нормалізоване за 2 дозою середнє значення AUC0-8h від приблизно 0.0035 до приблизно 0.0124 (мкМ·год.)/(мг/м ) при пероральному введенні людині. В одному аспекті фармацевтична композиція призначена для застосування в лікуванні раку в людини. У деяких варіантах здійснення рак являє собою гематологічний рак, солідну пухлину або саркому. У деяких варіантах здійснення рак являє собою рак молочної залози, рак товстої кишки, колоректальний рак, недрібноклітинний рак легені, дрібноклітинний рак легені, рак печінки, рак яєчника, рак передміхурової залози, рак матки, рак шийки матки, рак сечового міхура, рак шлунка, гастроінтестинальну стромальну пухлину, рак підшлункової залози, герміногенні пухлини, мастоцитому, нейробластому, мастоцитоз, рак яєчка, гліобластому, астроцитому, лімфому, меланому, мієлому, гострий мієлоцитарний лейкоз (AML), гостру лімфоцитарну лейкемію (ALL), мієлодиспластичний синдром і хронічну мієлогенну лейкемію. В одному аспекті рак являє собою лімфому або лейкоз. В одному аспекті рак являє собою Вклітинну лімфому, Т-клітинну лімфому, індолентну лімфому, лімфому Ходжкіна або неходжкінську лімфому. В одному аспекті рак являє собою неходжкінську лімфому. У деяких варіантах здійснення фармацевтична композиція застосовується разом із променевою терапією. У деяких варіантах здійснення фармацевтична композиція застосовується в комбінації, щонайменше, з одним додатковим терапевтичним агентом, вибраним із ДНК-ушкоджуючих агентів; інгібіторів топоізомерази I або II; алкілуючих агентів; інгібіторів PARP; інгібіторів протеосом; антиметаболітів РНК/ДНК; антимітотичних агентів; імуномодулюючих засобів; антиангіогенних препаратів; інгібіторів ароматази; гормономодулюючих препаратів; апоптоз 7 UA 110853 C2 5 10 15 20 25 30 35 40 45 50 55 індукуючих агентів; інгібіторів кінази; моноклональних антитіл; абареліксу; АВТ-888; алдеслейкіну; алдеслейкіну; алемтузумабу; алітретиноїну; алопуринолу; альтретаміну; аміфостину; анастрозолу; триоксиду миш'яку; аспарагінази; азацитидину; AZD-2281; бендамустину; перифозину; леналіноміду; хлорохіну; бевацизумабу; бексаротену; блеоміцину; бортезомібу; BSI-201; бусульфану; калустерону; капецитабіну; карбоплатину; карфілозибу; кармустину; целекоксибу; цетуксимабу; хлорамбуцилу; цисплатину; кладрибіну; клофарабіну; циклофосфаміду; цитарабіну; ліпосомальної форми цитарабіну; дакарбазину; дактиноміцину; дарбепоетину альфа; дазатинібу; ліпосомальної форми даунорубіцину; даунорубіцину; децитабіну; денілейкіну; дексразоксану; доцетакселу; доксорубіцину; ліпосомальної форми доксорубіцину; дромостанолону пропіонату; епірубіцину; епоетину альфа; ерлотинібу; естрамустину; етопозиду фосфату; етопозиду; екземестану; філграстиму; флоксуридину; флударабіну; фторурацилу; фулвестранту; гефітинібу; гемцитабіну; гемтузумабу озогаміцину; гозереліну ацетату; гістреліну ацетату; гідроксисечовини; ібритумомабу тіуксетану; ідарубіцину; іфосфаміду; іматинібу мезилату; інтерферону альфа-2а; інтерферону альфа-2b; іринотекану; леналідоміду; летрозолу; лейковорину; леупроліду ацетату; левамізолу; ломустину; меклоретаміну; мегестеролу ацетату; мелфалану; меркаптопурину; метотрексату; метоксалену; мітоміцину-С; мітотану; мітоксантрону; нандролону фенпропіонату; неларабіну; NPI-0052; нофетумомабу; опрелвекіну; оксаліплатину; паклітакселу; пов'язаних з білком частинок паклітакселу; паліферміну; памідронату; панітумумабу; пегадемази; пегаспаргази; пегфілграстиму; пеметрекседу динатрію; пентостатину; піпоброману; плікаміцину; мітраміцину; порфімеру натрію; прокарбазину; квінакрину; RAD001; расбурикази; ритуксимабу; сарграмостиму; сарграмостиму; сорафенібу; стрептозоцину; сунітинібу малату; тамоксифену; темозоломіду; теніпозиду; тестолактону; талідоміду; тіогуаніну; тіотепи; топотекану; тореміфену; тозитумомабу; тозитумомабу/I-131 тозитумомабу; трастузумабу; третиноїну; урацилового іприту; валрубіцину; вінбластину; вінкристину; вінорелбіну; вориностату; золедронату; і золедронової кислоти. Пропонуються готові вироби, які включають пакувальний матеріал, сполуку інгібітора HDAC, описану в даному документі, яка є ефективною для селективного інгібування активності гістондеацетилази, всередині пакувального матеріалу, і етикетку, на якій зазначено, що сполука або композиція, або її фармацевтично прийнятна сіль, фармацевтично прийнятний N-оксид, фармацевтично активний метаболіт, фармацевтично прийнятні проліки, або фармацевтично прийнятний сольват використовується для інгібування активності гістондеацетилази, або для лікування, попередження або зменшення інтенсивності одного або більше симптомів захворювання або стану, на які буде робити сприятливий вплив інгібування активності гістондеацетилази. У деяких варіантах здійснення фармацевтичні композиції, описані в даному документі, які включають інгібітор HDAC, формульовані таким чином, щоб бути придатними для перорального введення людині. У деяких варіантах здійснення фармацевтичні композиції, описані в даному документі, які включають інгібітор HDAC, формульовані таким чином, щоб бути придатними для внутрішньовенного введення людині. Інші завдання, ознаки і переваги способів, сполук і композицій, описаних у даному документі, стануть очевидними з наступного докладного опису. Проте, варто розуміти, що докладний опис і конкретні приклади, які показують конкретні варіанти здійснення, представлені тільки як ілюстрація, оскільки різні зміни і модифікації в межах сутності й обсягу винаходу стануть очевидними для фахівців у даній області з даного докладного опису. Короткий опис фігур На фігурі 1 представлені результати in vitro досліджень режимів дозування. Показаний вплив режиму дозування інгібітора HDAC (тобто Сполуки 1) на загибель пухлинних клітин. На фігурі 2 представлені результати моделювання режимів дозування Сполуки 1 та ефекти на клітинні лінії Jurkat і HCT116. На фігурі 3 представлені результати терапії бендамустином та інгібітором HDAC (тобто Сполукою 1) солідних пухлин, зокрема злоякісних пухлин товстої кишки HCT-116. Показані ефекти різних рівнів доз кожного активного агента, а також комбінації бендамустину та інгібітора HDAC (тобто Сполуки 1). На фігурі 4 представлені результати терапії бендамустином та інгібітором HDAC (тобто Сполукою 1) клітин множинної мієломи U266 за даними моніторингу апоптозу за допомогою проточної цитометрії. Показані ефекти різних рівнів доз кожного активного агента, а також комбінації бендамустину та інгібітора HDAC (тобто Сполуки 1). 8 UA 110853 C2 5 10 15 20 25 30 35 40 45 50 55 60 На фігурах 5А-5В показані результати терапії бендамустином та інгібітором HDAC (тобто Сполукою 1) клітин лімфоми DLCL2 за даними моніторингу апоптозу за допомогою проточної цитометрії. На Фіг. 5А показані ефекти різних рівнів доз кожного активного агента, а також комбінації бендамустину та інгібітора HDAC (тобто Сполуки 1). На Фіг. 5В показані ефекти різних рівнів доз кожного активного агента, а також комбінації бендамустину та інгібітора HDAC (тобто Сполуки 1), при цьому клітини лімфоми попередньо оброблені інгібітором HDAC (тобто Сполукою 1) за день до одноденного лікування комбінацією бендамустину та інгібітора HDAC (тобто Сполуки 1). На фігурах 6А, 6В і 6С показана роль RAD51 у синергічній протираковій активності бендамустину та інгібітора HDAC (тобто Сполуки 1). На Фіг. 6А показані результати вестернблоттингу, які вказують на супресію експресії RAD51 у двох клітинних лініях множинної мієломи, оброблених інгібітором HDAC (тобто Сполукою 1), а також комбінацією інгібітора HDAC (тобто Сполуки 1) і бендамустину. На Фіг. 6В - 6С показаний ефект комбінації бендамустину та інгібітора HDAC (тобто Сполуки 1) у двох клітинних лініях множинної мієломи за даними моніторингу апоптозу за допомогою проточної цитометрії. На фігурі 7 показана зміна об'ємів пухлин у мишачих самок SCID при терапії індивідуально інгібітором HDAC (тобто Сполукою 1), бендамустином, а також комбінацією бендамустину та інгібітора HDAC (тобто Сполуки 1). На фігурі 8 показані клітини множинної мієломи H929, оброблені інгібітором HDAC (тобто Сполукою 1), описаним у даному документі, (200 нМ) та/або бендамустином (50 мкМ) протягом 1 або 3 днів. Послідовність додавання тестували шляхом додавання в першу чергу бендамустину або інгібітора HDAC (тобто Сполуки 1), потім додавання другого через 24 год. Додавання інгібітора HDAC (тобто Сполуки 1) з наступним бендамустином через 24 год. викликало найбільшу загибель клітин у цих серіях. На фігурі 9 показано, що попередня обробка інгібітором HDAC (тобто Сполукою 1), описаним у даному документі, придушує індуковане бендамустином підвищення експресії RAD51, інгібуючи, таким чином, відновлення ушкодження ДНК і підсилюючи дію бендамустину. На фігурі 10 показана ефективна синергічна дія інгібітора HDAC (тобто Сполуки 1), описаного в даному документі, з бортезомібом у нейробластомі. На фігурі 11 показана синергічна дія інгібітора HDAC (тобто Сполуки 1), описаного в даному документі, з хлорохіном, який є інгібітором аутофагії. На фігурі 12 показано, що перифозин є синергічним з інгібітором HDAC (тобто Сполукою 1) у пухлинних клітинах товстої кишки. На фігурі 13 показано, що інгібітор HDAC (тобто Сполука 1), описаний у даному документі, є синергічним із цисплатином при всіх концентраціях у резистентній до платини клітинній лінії пухлини яєчників. Докладний опис винаходу Рак вважається захворюванням, обумовленим генетичними дефектами, такими як мутації та делеції в генах, а також хромосомними порушеннями, які призводять до втрати функції генівсупресорів пухлин і/або придбанню функції або гіперактивації онкогенів. Рак характеризується змінами експресії генів у масштабі геному в пухлині. Ці зміни сприяють здатності пухлини прогресувати протягом клітинного циклу, уникати апоптозу або ставати резистентною до хіміотерапії. Інгібітори HDAC можуть поміняти розвиток деяких із цих змін у зворотному напрямку та відновити паттерн, подібний з паттерном нормальної клітини. Геном людини складається зі складної мережі генів, які включаються або виключаються залежно від потреб клітини. Одним із шляхів, за допомогою яких гени включаються або виключаються, є хімічна модифікація гістонових білків. Гістонові білки являють собою структурні компоненти хромосом і формують кістяк, на підставі якого організується ДНК, генетичний матеріал. Добре вивченою модифікацією гістонів є ацетилування та деацетилування, модифікації, які каталізуються сімейством ферментів, відомих як гістон-ацетилтрансферази і гістондеацетилази. Інгібування ферментів HDAC Сполукою 1 порушує баланс убік ацетильованого стану, тобто стану, який забезпечує старт транскрипції, що може розглядатися як включення гена "on". У випадку, коли клітина оброблена Сполукою 1, спочатку включаються хвилі раніше "мовчазних" генів. Деякі з цих генів самі по собі є регуляторами і будуть активувати або придушувати експресію ще інших генів. Результатом є набір змін в експресії генів: окремі гени є включеними, тоді як інші перебувають у виключеному стані. Після хіміотерапії та/або променевої терапії деякі пухлини пацієнтів можуть "включати" певні гени як стратегію пухлини адаптуватися до терапії та стати резистентною до загибелі клітин. Одним прикладом генетичної зміни, яка виникає в багатьох видах раку, є активація гена RAD51 9 UA 110853 C2 5 10 15 20 25 30 35 40 45 50 55 60 репарації ДНК. У відповідь на обробку ДНК-ушкоджуючою хіміотерапією або променевою терапією, пухлини будуть часто "включати" гени репарації ДНК (у тому числі RAD51) як стратегію адаптації для того, щоб допомогти пухлині відновити ушкодження ДНК, зроблене цими агентами. У доклінічних моделях Сполука 1 була здатна "виключати" RAD51 (та інші гени репарації ДНК), ефективно блокуючи здатність пухлини відновлювати свою ушкоджену ДНК, сенсибілізуючи пухлину до хіміотерапії та променевої терапії. Доклінічні дослідження активностей інгібітора HDAC У доклінічних дослідженнях було виявлено, що інгібітори HDAC, такі як Сполука 1, мають специфічні відносно пухлин протиракові активності. Ці дослідження забезпечили важливу інформацію про активності in vitro та in vivo інгібіторів HDAC, таких як Сполука 1, і визначили молекулярний механізм, який лежить в основі протиракових ефектів. In vitro: Сполука 1 є активною відносно багатьох ліній пухлинних клітин і є ефективною у мишачих моделях пухлин легенів, товстої кишки, передміхурової залози, підшлункової залози і головного мозку. Ex vivo: Сполука 1 є активною у первинних пухлинах людини від пацієнтів з раком товстої кишки, яєчника, легенів і багатьма гематологічними злоякісними пухлинами. Широкі дослідження на безпеку та токсикологічні дослідження були проведені на багатьох видах тварин. Був вивчений механізм дії Сполуки 1, який включає комплексний підхід до пухлинних клітин: підвищувальна регуляція р21 та інших супресорів пухлини, і генів клітинного циклу; індукція утворення активних форм кисню та зменшення активності антиоксидантних шляхів; зміна гомеостазу кальцію та збільшений стрес ендоплазматичного ретикулума (ER); понижуюча регуляція шляхів ДНК-репарації та збільшене ушкодження ДНК; пряма індукція апоптозу за допомогою загибелі рецепторів й активації каспаз. Сполука 1 являє собою інгібітор HDAC на основі гідроксамату. У даному документі описані фармацевтичні композиції, які включають Сполуку 1, а також фармакокінетичні та фармакодинамічні стратегії, режими дозування, а також способи лікування злоякісних пухлин у людини у вигляді монотерапії або комбінованої терапії. Терапевтичний і фармакодинамічний ефект Сполуки 1 У клінічних випробуваннях, у яких брали участь пацієнти, що мають рак, Сполуку 1 у формі розчину вводили у дозі 2 мг/кг у вигляді однократної пероральної дози та у вигляді багаторазових доз шляхом 2-годинного IV вливання. Системний вплив, виміряний як AUC0-∞ для IV і перорального дозування, склав, відповідно, 5.9 мкМ·год. і 1.45 мкМ·год., що вказує на те, що біодоступність при пероральному введенні становить приблизно 27 % у людини. Терапевтичний ефект інгібітора HDAC (напр., Сполуки 1) досягається в людей, що мають рак, шляхом введення інгібітора HDAC перорально двічі на добу (при цьому дві дози вводять послідовно з інтервалом від приблизно 4 до приблизно 6 годин), перорально три рази на добу (при цьому дози вводять послідовно з інтервалом від приблизно 4 до приблизно 6 годин), внутрішньовенно або безперервно. Зазначені вище режими дозування дозволяють підтримувати ефективні концентрації інгібітора HDAC у плазмі крові в людини протягом, щонайменше, 6 послідовних годин. Терапевтичний ефект Сполуки 1 досягається в людей, що мають рак, шляхом введення Сполуки 1 (пероральних капсул з негайним вивільненням) двічі на добу, при цьому дві дози вводять з інтервалом від приблизно 4 до приблизно 6 годин. У деяких варіантах здійснення дозування двічі на добу зменшує випадки розвитку тромбоцитопенії у порівнянні з дозуванням три рази на добу. Для терапевтичного ефекту ефективні концентрації Сполуки 1 у плазмі крові в людей повинні підтримуватися протягом, щонайменше, 6 послідовних годин, щонайменше, 7 послідовних годин або, щонайменше, 8 послідовних годин щодня в дні дозування. Для терапевтичного ефекту ефективні концентрації Сполуки 1 у плазмі крові в людей повинні підтримуватися протягом, щонайменше, 6 послідовних годин щодня в дні дозування. Для терапевтичного ефекту ефективні концентрації Сполуки 1 у плазмі крові в людей повинні підтримуватися протягом, щонайменше, 7 послідовних годин щодня в дні дозування. У деяких варіантах здійснення для терапевтичного ефекту ефективні концентрації Сполуки 1 у плазмі крові в людей повинні підтримуватися протягом від приблизно 6 послідовних годин до приблизно 8 послідовних годин щодня в дні дозування. У деяких варіантах здійснення ефективні концентрації Сполуки 1 у плазмі крові в людей повинні підтримуватися протягом, щонайменше, 6 послідовних годин, але не більше 12, 13 або 14 послідовних годин у дні дозування. У деяких варіантах здійснення підтримка ефективної концентрації Сполуки 1 у плазмі крові протягом, щонайменше, 6 послідовних годин, але не більше 14 послідовних годин у дні дозування підвищує ефективність інгібування росту клітин пухлини і зводить до мінімуму 10 UA 110853 C2 5 10 15 20 25 30 35 40 45 50 55 60 випадки розвитку тромбоцитопенії. У деяких варіантах здійснення підтримка ефективних концентрацій Сполуки 1 у плазмі крові протягом від приблизно 6 послідовних годин до приблизно 8 послідовних годин у дні дозування підвищує ефективність інгібування росту клітин пухлини і зводить до мінімуму випадки розвитку тромбоцитопенії. Пероральна біодоступність у людей Сполуки 1, введеної у вигляді капсул з негайним вивільненням або пероральним розчином, була визначена рівною приблизно 27 %. Розходження у фармакокінетиці спостерігалося у лабораторних тварин між станом натще і станом після прийому їжі. Виявилося, що Сполука 1 переважно абсорбується в кишечнику. В одному аспекті представлені способи забезпечення терапевтичного та фармакодинамічного ефекту інгібітора HDAC, такого як Сполука 1, або його фармацевтично прийнятної солі, які включають введення інгібітора HDAC або його фармацевтично прийнятної солі у вигляді лікарської форми з контрольованим вивільненням. Лікарські форми з контрольованим вивільненням допускають дозування один раз на добу. Лікарські форми з контрольованим вивільненням також допускають вивільнення активного агента (тобто інгібітора HDAC, такого як Сполука 1, або його фармацевтично прийнятну сіль) скоріше в кишечнику, а не в шлунку. В одному аспекті лікарська форма з контрольованим вивільненням являє собою систему доставки лікарського засобу, що містить множину частинок. Системи доставки лікарського засобу, що містять множину частинок, являють собою пероральні лікарські форми, які складаються з множини малих дискретних одиниць, кожна з яких проявляє деякі бажані характеристики. У цих системах доза активних речовин розділена на множину субодиниць, які зазвичай складаються з множини сферичних частинок із діаметром 0.05-2.00 мм. Лікарські форми, що містять множину частинок, являють собою фармацевтичні лікарські форми, в яких активна речовина присутня у вигляді деякої кількості маленьких незалежних субодиниць. Для доставки рекомендованої загальної дози ці субодиниці наповнюють у капсули або пресують в таблетки. Множина частинок у меншому ступені залежить від евакуації вмісту шлунка, що призводить до меншої інтер- та інтра-індивідуальної мінливості часу транзиту їжі за шлунковокишковим трактом. Вони також краще розподіляються та рідше викликають місцеве подразнення або випробовують вплив від присутності їжі. Лікарські форми, що містять множину частинок, забезпечують переваги, такі як збільшена біодоступність, зменшений ризик місцевого подразнення та передбачуване спорожнювання шлунка. У деяких варіантах здійснення системи, що містять множину частинок, показують краще відтворене фармакокінетичне поводження, ніж звичайні лікарські форми. Після розпаду лікарської форми з контрольованим вивільненням (напр., таблетки або капсули), який відбувається протягом декількох хвилин, окремі частинки субодиниць швидко проходять через ШК тракт. Якщо ці субодиниці мають діаметр менше, ніж 2 мм, вони можуть залишати шлунок безперервно, навіть якщо воротар шлунка закритий. Це призводить до більш низької інтра- та інтер-індивідуальної мінливості в рівнях у плазмі та біодоступності. Інші пероральні лікарські форми з контрольованим вивільненням можуть забезпечити ті самі переваги, які спостерігаються в системах доставки лікарського засобу, що містять множину частинок. Лікарські канікули Тромбоцитопенія являє собою побічний ефект, що спостерігається у людей, які одержують лікування сполукою інгібітора HDAC. Тромбоцитопенія являє собою стан, при якому число тромбоцитів у крові нижче нормального рівня. Це може призвести до більш легкого утворення синців і рясній кровотечі з ран або кровотечі слизових оболонок та інших тканин. Тромбоцитопенію зазвичай згладжують шляхом зменшення добової дози сполуки інгібітора HDAC, яка вводиться людині. Однак зменшення добової дози сполуки інгібітора HDAC може не забезпечити терапевтичний та фармакодинамічний ефект сполуки інгібітора HDAC. У даному документі представлені режими дозування для досягнення терапевтичного та фармакодинамічного ефекту інгібітора HDAC з обмеженими випадками розвитку тромбоцитопенії 4 ступеня, які включають 5-9 послідовних днів щоденного дозування інгібітора HDAC у кількості, достатній для підтримки ефективних концентрацій у плазмі крові інгібітора HDAC протягом, щонайменше, 6 послідовних годин у кожний день дозування, з наступними 5-9 послідовними днями відсутності дозування інгібітора HDAC. У деяких варіантах здійснення в дні дозування ефективні концентрації в плазмі крові інгібітора HDAC підтримуються протягом, щонайменше 6, щонайменше 7 або щонайменше 8 послідовних годин, але не більше 12, 13 або 14 послідовних годин. У деяких варіантах здійснення в дні дозування інгібітор HDAC уводять в кількості, достатній для підтримки ефективних концентрацій у плазмі крові інгібітора HDAC протягом від приблизно 6 послідовних годин до приблизно 8 послідовних годин. У деяких 11 UA 110853 C2 5 10 15 20 25 варіантах здійснення інгібітор HDAC уводять перорально. У деяких варіантах здійснення в дні дозування ефективні концентрації в плазмі крові інгібітора HDAC підтримуються протягом не більше ніж 12, 13 або 14 послідовних годин. В інших варіантах здійснення інгібітор HDAC уводять парентерально. У даному документі представлені режими дозування для досягнення терапевтичного та фармакодинамічного ефекту інгібітора HDAC з обмеженими випадками розвитку тромбоцитопенії 4 ступеня, які включають: (а) пероральне дозування інгібітора HDAC двічі на добу (пероральної фармацевтичної композиції з негайним вивільненням) протягом 7 послідовних днів, з наступними 7 послідовними днями відсутності дозування інгібітора HDAC; або (b) дозування інгібітора HDAC один раз на добу (пероральної фармацевтичної композиції з контрольованим вивільненням) протягом 7 послідовних днів, з наступними 7 послідовними днями відсутності дозування інгібітора HDAC. Вищевказаний режим дозування також включає 59 послідовних днів дозування інгібітора HDAC, з наступними 2-9 послідовними днями відсутності дозування інгібітора HDAC. У даному документі представлені режими дозування для досягнення терапевтичного та фармакодинамічного ефекту Сполуки 1 з обмеженими випадками розвитку тромбоцитопенії 4 ступеня, які включають: (а) пероральне дозування Сполуки 1 (пероральної фармацевтичної композиції з негайним вивільненням) двічі на добу протягом 7 послідовних днів, з наступними 7 послідовними днями відсутності дозування Сполуки 1; (b) дозування Сполуки 1 (пероральної фармацевтичної композиції з контрольованим вивільненням) один раз на добу протягом 7 послідовних днів, з наступними 7 послідовними днями відсутності дозування Сполуки 1. Вищевказаний режим дозування також включає 5-9 послідовних днів дозування Сполуки 1, з наступними 2-9 послідовними днями відсутності дозування Сполуки 1. Вищевказаний режим дозування також включає 5-9 послідовних днів дозування Сполуки 1, з наступними 2-9 послідовними днями відсутності дозування Сполуки 1. Сполуки інгібітора HDAC N-гідрокси-4-{2-[3-(N,N-диметиламінометил)бензофуран-2-ілкарбоніламіно]етокси}бензамід (Сполука 1) має наступну структуру: H3C CH3 N O OH H N O 30 35 40 45 50 N H O O Сполука 1 В одному аспекті Сполука 1 використовується у фармацевтичних композиціях і способах, розкритих тут, у вигляді фармацевтично прийнятної солі. В одному аспекті Сполука 1 використовується у вигляді хлористоводневої солі. В одному аспекті Сполука 1 використовується у вигляді тозилатної солі. Додаткові фармацевтично прийнятні солі Сполуки 1 включають: (а) солі, утворені або при заміщенні кислотного протону Сполуки 1 іоном металу, таким як, наприклад, іон лужного металу (напр., літію, натрію, калію), іон лужноземельного металу (напр., магнію або кальцію) або іон + алюмінію, або при заміщенні катіоном амонію (NH4 ); (b) солі, утворені при взаємодії Сполуки 1 з фармацевтично прийнятною органічною основою, яка включає алкіламіни, такі як етаноламін, діетаноламін, триетаноламін, трометамін, N-метилглюкамін, дициклогексиламін, трис(гідроксиметил)метиламін, і солі з амінокислотами, такими як аргінін, лізин і тому подібне; (с) солі, утворені при взаємодії Сполуки 1 з фармацевтично прийнятною кислотою, що забезпечує солі приєднання кислоти. Фармацевтично прийнятні кислоти включають хлористоводневу кислоту, бромистоводневу кислоту, сірчану кислоту, азотну кислоту, фосфорну кислоту, метафосфорну кислоту і тому подібне; або органічну кислоту, таку як, наприклад, оцтова кислота, пропіонова кислота, капронова кислота, циклопентапропіонова кислота, глікоєва кислота, піровиноградна кислота, молочна кислота, малонова кислота, бурштинова кислота, яблучна кислота, малеїнова кислота, фумарова кислота, трифтороцтова кислота, винна кислота, лимонна кислота, бензойна кислота, 3-(4-гідроксибензоїл)бензойна кислота, корична кислота, мигдальна кислота, метансульфонова кислота, етансульфонова кислота, 1,2-етандисульфонова кислота, 2-гідроксіетансульфонова кислота, бензолсульфонова кислота, толуолсульфонова кислота, 2-нафталінсульфонова кислота, 4-метилбіцикло-[2.2.2]окт 12 UA 110853 C2 5 10 15 20 25 2-ен-1-карбонова кислота, глюкогептонова кислота, 4,4'-метиленбіс-(3-гідроксі-2-ен-1-карбонова кислота), 3-фенілпропіонова кислота, триметилоцтова кислота, третинна капронова кислота, лаурилсірчана кислота, глюконова кислота, глютамінова кислота, оксинафтойна кислота, саліцилова кислота, стеаринова кислота, муконова кислота, і тому подібне. Додаткові фармацевтично прийнятні солі включають солі, описані у Berge зі співавт., J. Pharm. Sci. 1977, 66, 1-19; і "Handbook of Pharmaceutical Salts, Properties, and Use", Stah and Wermuth, Ed.; Wiley-VCH and VHCA, Zurich, 2002. У деяких варіантах здійснення сайти на ароматичній кільцевій частині сполук, описаних у даному документі, які чутливі до різних метаболічних реакцій, модифіковані таким чином, щоб знижувати, мінімізувати або усувати різні метаболічні реакції. Такі модифікації включають введення придатних замісників в ароматичні кільцеві структури, такі як, як приклад тільки, галогени, дейтерій і тому подібне. В одному аспекті сполуки інгібіторів HDAC, описаних у даному документі, є дейтерованими на ділянках, які піддані метаболічним реакціям. Сполуки, описані в даному документі, включають мічені ізотопами сполуки, які ідентичні сполукам, зазначеним у різних формулах і структурах, представлених у даному документі, за винятком того, що один або більше атомів замінений атомом, що має атомну масу або масове число, яке відмінне від атомної маси або масового числа, що характерне для природної форми сполуки. Приклади ізотопів, які можуть бути включені в сполуки за даним винаходом, включають 2 3 13 14 15 18 ізотопи водню, вуглецю, азоту, кисню, фтору і хлору, такі як, наприклад, H, H, C, C, N, O, 17 35 18 36 O, S, F, Cl, відповідно. Певні мічені ізотопами сполуки, описані в даному документі, 3 14 наприклад сполуки, в які введені радіоактивні ізотопи, такі як H і C, застосовні для аналізів розподілу лікарських засобів і/або субстрату в тканинах. Крім того, заміна такими ізотопами, як 2 дейтерій, тобто Н, може забезпечувати деякі терапевтичні переваги, обумовлені більш високою метаболічною стабільністю, наприклад, збільшенням періоду напіврозпаду in vivo або зниженням необхідного дозування. Інші сполуки інгібітора HDAC для використання у фармацевтичних композиціях, фармакокінетичних стратегіях, режимах дозування, способах лікування та комбінованих терапіях, описані в даному документі, включають сполуки, що мають структуру Формули (1): O OH O Ar 30 35 40 45 50 55 N R3 Y N H X Формула (I) в якій 2 2 Х являє собою –O-, -NR - або –S(O)n, де n дорівнює 0, 1 або 2 і R являє собою водень, – CH3, -CH2CH3; Y являє собою етилен, пропілен, 1-метилпропілен, 2-метилпропілен, -CH(C2H5)CH2-, CH(CH(CH3)2) CH2- і -CH(CH3)CH2-; 3 R являє собою водень, -CH3 або -CH2CH3; Ar являє собою феніл, нафтил, хінолініл, бензофураніл, бензотієніл, транс феніл СН=СНабо транс (бензофуран-2-іл)СН=СН-, де Ar є необов'язково заміщеним одним або двома замісниками, незалежно вибраними з хлору, фтору, трифторметилу, метилу, етилу, метокси, етокси, метилендіокси, -ОН, 1-циклопропілпіперидин-4-ілокси, 1-(2,2,2-трифторетил)піперидин4-ілокси, N,N-диметиламінометилу, N,N-діетиламінометилу, 2-метоксіетоксиметилу, феноксиметилу, 2-метоксіетокси, 2-морфолін-4-ілетокси, піридин-3-ілметокси, 2-гідроксіетокси, 2-N,N-диметиламіноетокси, метоксиметилу, 3-i-пропоксиметилу, морфолін-4-ілметилу, 3гідроксипропілоксиметилу, 2-фторфеноксиметилу, 3-фторфеноксиметилу, 4фторфеноксиметилу, 3-метоксипропілоксиметилу, піридин-4-ілоксиметилу, 2,4,6трифторфеноксиметилу, 2-оксопіридин-1-ілметилу, 2,2,2-трифторетоксиметилу, 4-імідазол-1ілфеноксиметилу, 4-[1.2.4-триазин-1-іл-феноксиметилу, 2-фенілетилу, піролідин-1-ілметилу, піперидин-1-ілметилу, 4-трифторметилпіперидин-1-ілметилу, 4-метилпіперазин-1-ілметилу, 3,3,3-трифторпропілоксиметилу, 4-фторфенілтіометилу, 4-фторфенілсульфінілметилу, 4фторфенілсульфонілметилу, піридин-3-ілметилоксиметилу, тетрагідропіран-4-ілокси, 2,2,2трифторетилокси, 2-піролідин-1-ілетилокси, піперидин-4-ілокси, N-метил-N-бензиламінометилу, N-метил-N-2-фенілетиламінометилу, 3-гідроксипропілтіометилу, 3гідроксипропілсульфінілметилу, 3-гідроксипропілсульфонілметилу, N-метил-N-2-індол-3 13 UA 110853 C2 5 10 15 20 25 30 35 40 45 ілетиламінометилу, 2-(4-трифторметилфеніл)етилу, 2-(3-трифторметоксифеніл)етилу, Nгідроксіамінокарбоніл-метиламінометилу або 3-(2-карбоксіетиламінометилу); або його фармацевтично прийнятну сіль. У деяких варіантах здійснення Ar являє собою бензофуран-2-іл і є монозаміщеним у 3положенні бензофуран-2-ільного кільця N,N-диметиламінометилом, N,N-діетиламінометилом, 2фторфеноксиметилом, 3-фторфеноксиметилом, 4-фторфеноксиметилом, гідроксил-4ілоксиметилом, 2,4,6-трифторфеноксиметилом, 2-оксопіридин-1-ілметилом, 2,2,2трифторетоксиметилом, 4-імідазол-1-ілфеноксиметилом, 4-[1.2.4-триазин-1-ілфеноксиметилом, 2-фенілетилом, 3-гідроксипропілоксиметилом, 2-метоксіетилоксиметилом, піролідин-1ілметилом, піперидин-1-ілметилом, 4-трифторметилпіперидин-1-ілметилом, 4-метилпіперазин1-ілметилом, 3,3,3-трифторпропілоксиметилом, 4-фторфенілтіометилом, 4фторфенілсульфінілметилом, 4-фторфенілсульфонілметилом, 2-(3трифторметоксифенілетилом), N-метил-N-бензиламінометилом, N-метил-N-2фенілетиламінометилом, 3-гідроксипропілтіометилом, 3-гідроксипропілсульфініл-метилом, 3гідроксипропілсульфонілметилом, N-метил-N-2-індол-3-ілетиламінометилом, 2-(4трифторметилфеніл)етилом, N-гідроксіамінокарбоніл-метиламінометилом або 2карбоксіетиламінометилом. У деяких варіантах здійснення Ar являє собою бензофуран-2-іл і є монозаміщеним у 3положенні бензофуран-2-ільного кільця N,N-диметиламінометилом, N,N-діетиламінометилом, 2метоксіетоксиметилом, метоксиметилом, 3-i-пропоксиметилом, морфолін-4-ілметилом, 3гідроксипропілоксиметилом, 3-метоксипропілоксиметилом, піролідин-1-ілметилом або піперидин-1-ілметилом. У деяких варіантах здійснення Ar являє собою бензофуран-2-іл і є заміщеним в 5-положенні бензофуран-2-ільного кільця 1-циклопропілпіперидин-4-ілокси, піперидин-4-ілокси, тетрагідропіран-4-ілокси, 2,2,2-трифторетокси, 2-піролідин-1-ілетилокси або 1-(2,2,2трифторетил)піперидин-4-ілокси. У деяких варіантах здійснення Ar являє собою транс феніл СН=СН-, де феніл необов'язково заміщений одним або двома замісниками, незалежно вибраними з метилу, етилу, метокси, етокси, метилендіокси або -ОН. В окремих варіантах здійснення Ar являє собою транс феніл СН=СН-. У деяких варіантах здійснення Ar являє собою нафтил, при цьому нафтил необов'язково заміщений одним або двома замісниками. У деяких варіантах здійснення Ar являє собою хінолініл, при цьому хінолініл необов'язково заміщений одним або двома замісниками. У деяких варіантах здійснення Ar являє собою хінолініл, при цьому хінолініл необов'язково заміщений одним або двома замісниками, незалежно вибраними з хлору, фтору, трифторметилу, метилу, етилу, метокси, етокси, метилендіокси, -ОН, 2-метоксіетокси, 2гідроксіетокси, метоксиметилу, 3-i-пропоксиметилу, 3-гідроксипропілоксиметилу, 3метоксипропілоксиметилу або 3,3,3-трифторпропілоксиметилу. 3 У деяких варіантах здійснення Х являє собою -О- і R являє собою водень. 3 У деяких варіантах здійснення Х являє собою -S(O)n і R являє собою водень. У деяких варіантах здійснення Y являє собою етилен. В окремих варіантах здійснення Y являє собою етилен або -CH(C2H5)CH2-. В окремих варіантах здійснення Y являє собою CH(C2H5)CH2-. 3 У деяких варіантах здійснення Х являє собою -О-; R являє собою водень; і Y являє собою етилен або -CH(C2H5)CH2-. Ще інші сполуки інгібітора HDAC, які передбачаються для застосування у фармацевтичних композиціях, фармакокінетичних стратегіях, режимах дозування, способах лікування та комбінованих терапіях, включають сполуки, що мають структуру Формули (II): 50 O R5 Ar OH O N R 55 Y N H O 3 Формула (II) в якій 2 2 X являє собою –O-, -NR - або –S(O)n, де n дорівнює 0, 1 або 2 і R являє собою водень, – CH3, -CH2CH3; 14 UA 110853 C2 5 10 15 20 25 30 35 40 45 50 55 60 Y являє собою етилен, пропілен, 1-метилпропілен, 2-метилпропілен, -CH(C2H5)CH2-, CH(CH(CH3)2)CH2- і -CH(CH3)CH2-; 3 R являє собою водень, -CH3 або -CH2CH3; Ar являє собою феніл, нафтил, хінолініл, бензофураніл або бензотієніл, при цьому Ar необов'язково заміщений одним або двома замісниками, незалежно вибраними з хлору, фтору, трифторметилу, метилу, етилу, метокси, етокси, метилендіокси, -ОН; 5 R являє собою трифторметил, метил, етил, N,N-диметиламінометил, N,Nдіетиламінометил, 2-метоксіетоксиметил, феноксиметил, метоксиметил, 3-i-пропоксиметил, морфолін-4-ілметил, 3-гідроксипропілоксиметил, 2-фторфеноксиметил, 3-фторфеноксиметил, 4-фторфеноксиметил, 3-метоксипропілоксиметил, піридин-4-ілоксиметил, 2,4,6трифторфеноксиметил, 2-оксопіридин-1-ілметил, 2,2,2-трифторетоксиметил, 4-імідазол-1ілфеноксиметил, 2-фенілетил, піролідин-1-ілметил, піперидин-1-ілметил, 3трифторметилпіперидин-1-ілметил, 4-метилпіперазин-1-ілметил, 3,3,3трифторпропілоксиметил, 4-фторфенілтіометил, 4-фторфенілсульфінілметил, 4фторфенілсульфонілметил, піридин-3-ілметилоксиметил, N-метил-N-бензиламінометил, Nметил-N-2-фенілетиламінометил, 3-гідроксипропілтіометил, 3-гідроксипропілсульфінілметил, 3гідроксипропілсульфонілметил, N-метил-N-2-індол-3-ілетиламінометил, 2-(4трифторметилфеніл)етил, 2-(3-трифторметоксифеніл)етил, N-гідроксіамінокарбонілметиламінометил або 3-(2-карбоксіетиламінометил); або його фармацевтично прийнятну сіль. У деяких варіантах здійснення Ar являє собою бензофураніл. 5 У деяких варіантах здійснення R являє собою N,N-диметиламінометил, N,Nдіетиламінометил, піролідин-1-ілметил або піперидин-1-ілметил. У деяких варіантах здійснення інгібітор HDAC вибраний з: N-гідрокси-4-[2-(4-метоксихінолін2-ілкарбоніламіно)етокси]бензаміду; N-гідрокси-4-[2S-(транс-циннамоїламіно)бутокси]бензаміду; N-гідрокси-4-[2R-(транс-циннамоїламіно)-бутокси]бензаміду; N-гідрокси-4-{2-[4-(2метоксіетокси)хінолін-2-ілкарбоніламіно]-етокси}бензаміду; N-гідрокси-4-[2S-(бензотіофен-2ілкарбоніламіно)бутокси]-бензаміду; N-гідрокси-4-{2S-[бунзофуран-2ілкарбоніламіно]бутокси}бензаміду; N-гідрокси-4-{2-[3-(метоксиметил)бензофуран-2ілкарбоніламіно]етокси}бензаміду; N-гідрокси-4-{2-[3-(N,N-диметиламінометил)бензофуран-2ілкарбоніламіно]етокси}-бензаміду; N-гідрокси-4-{2-[3-(i-пропоксиметил)бензофуран-2ілкарбоніламіно]етокси}бензаміду; N-гідрокси-4-{2-[3-(3-гідроксипропоксиметил)бензофуран-2ілкарбоніламіно]етокси}бензаміду; N-гідрокси-4-{2-[3-(2-метоксіетилоксиметил)- бензофуран-2ілкарбоніламіно]етокси}бензаміду; N-гідрокси-4-{2-[3-(піролідин-1-ілметил)бензофуран-2ілкарбоніламіно]етокси}бензаміду; N-гідрокси-4-{2-[3-(піперидин-1-ілметил)бензофуран-2ілкарбоніламіно]етокси}бензаміду; N-гідрокси-4-{2-[3-(4-метилпіперазин-1-ілметил)бензофуран2-ілкарбоніламіно]етокси}бензаміду; N-гідрокси-4-{2-[5-(тетрагідропіран-4-ілокси)бензофуран-2ілкарбоніламіно]етокси}-бензаміду; N-гідрокси-4-{2-[5-(2-піролідин-1-ілетокси)бензофуран-2ілкарбоніламіно]-етокси}бензаміду; N-гідрокси-4-{2S-[5-(2-піролідин-1-ілетилокси)бензофуран-2ілкарбоніламіно]бутокси}бензаміду; N-гідрокси-4-{2-[5-(2-піролідин-1-ілетилокси)-бензофуран-2ілкарбоніламіно]-1R-метилетокси}бензаміду; і N-гідрокси-4-{2-[(3-(бензофуран-2-іл)-4(диметиламіно)-бут-2-еноїл)аміно]етокси}бензаміду; або його фармацевтично прийнятної солі. У деяких варіантах здійснення інгібітор HDAC вибраний з інгібіторів HDAC, розкритих у WO 2004/092115 або WO 2005/097770, обидві з яких включені в даний документ шляхом посилання. Форми і вираження Інгібітори HDAC (напр., Сполука 1), у тому числі їх фармацевтично прийнятні солі та фармацевтично прийнятні сольвати, представлені в різних формах, включаючи, але без обмеження, аморфну фазу, частково кристалічні форми, кристалічні форми, подрібнені форми і форми наночастинок. Кристалічні форми відомі як поліморфи. Поліморфи включають різні конфігурації укладання кристалів одного і того самого елементного складу сполуки. Такі конфігурації можуть істотно впливати на фізико-хімічні властивості, параметри технології виготовлення й обробки, а також строк придатності або стабільність активної речовини і допоміжних речовин. Поліморфи зазвичай характеризуються різними картинами дифракції рентгенівських променів, інфрачервоними спектрами, температурами плавлення, щільністю, твердістю, формою кристалів, оптичними та електричними властивостями, стабільністю та розчинністю. Різні фактори, такі як розчинник для перекристалізації, швидкість кристалізації та температура зберігання, можуть призвести до переважання однієї кристалічної форми. В одному аспекті кристалічна форма інгібітора HDAC (напр., Сполуки 1) використовується у фармацевтичних композиціях, розкритих у даному документі. В одному аспекті кристалічна форма HCl солі Сполуки 1 використовується у фармацевтичній композиції, розкритій в даному документі. В одному аспекті аморфна Сполука 1 використовується у фармацевтичних 15 UA 110853 C2 5 10 15 20 25 30 35 40 45 50 55 60 композиціях, розкритих у даному документі. В одному аспекті аморфна HCl сіль Сполуки 1 використовується у фармацевтичній композиції, розкритій в даному документі. Термінологія "Біодоступність" відноситься до процентної частки маси введеного інгібітора HDAC (напр., Сполуки 1) або фармацевтично прийнятної солі, яка доставляється в загальний кровотік досліджуваної тварини або людини. Загальну дозу (AUC (0-∞)) лікарського засобу при внутрішньовенному введенні зазвичай визначають як 100 % біодоступність (F%). "Біодоступність при пероральному введенні" відноситься до ступеня, в якому інгібітор HDAC (напр., Сполука 1) або фармацевтично прийнятна сіль всмоктується в загальний кровотік при пероральному застосуванні фармацевтичної композиції, у порівнянні з внутрішньовенною ін'єкцією. "Концентрація в плазмі крові" відноситься до концентрації інгібітора HDAC (напр., Сполуки 1) або фармацевтично прийнятної солі в плазменному компоненті крові суб'єкта. Варто розуміти, що концентрація в плазмі інгібітора HDAC (напр., Сполуки 1) або фармацевтично прийнятної солі може значно варіюватися в суб'єктів внаслідок мінливості метаболізму та/або взаємодій з іншими терапевтичними агентами. В одному аспекті концентрація в плазмі інгібітора HDAC (напр., Сполуки 1) або фармацевтично прийнятної солі варіюється від суб'єкта до суб'єкта. Подібним чином, такі величини, як максимальна концентрація в плазмі (C max) або час, необхідний для досягнення максимальної концентрації в плазмі (T max), або загальна площа під кривою зміни концентрації в плазмі залежно від часу (AUC (0-∞)), варіюються від суб'єкта до суб'єкта. Внаслідок цієї мінливості, в одному варіанті здійснення, кількість, необхідна для отримання "терапевтично ефективної кількості" інгібітора HDAC (напр., Сполуки 1) або фармацевтично прийнятної солі, варіюється від суб'єкта до суб'єкта. "Ефективні концентрації в плазмі крові" інгібітора HDAC відносяться до кількостей інгібітора HDAC у плазмі крові, які призводять до рівнів впливу, що є ефективними для лікування раку. "Абсорбція лікарського засобу" або "абсорбція", як правило, відноситься до процесу переміщення лікарського засобу з ділянки введення лікарського засобу через бар'єр у кровоносну судину або ділянку дії, наприклад, лікарський засіб переміщається зі шлунковокишкового тракту в портальну вену або лімфатичну систему. "Вимірювана концентрація в сироватці крові" або "вимірювана концентрація в плазмі крові" описує концентрацію в сироватці крові або плазмі крові, яка зазвичай вимірюється в мг, мкг або нг терапевтичного агента на мл, дл або л сироватки крові, абсорбованого в загальний кровотік після введення. Використовувані в даному документі вимірювані концентрації в плазмі зазвичай вимірюють у нг/мл або мкг/мл. "Фармакодинаміка" відноситься до факторів, які визначають біологічну відповідь, що спостерігається відносно концентрації лікарського засобу в ділянці дії. "Фармакокінетика" відноситься до факторів, які визначають досягнення та підтримання належної концентрації лікарського засобу в ділянці дії. Фармацевтичні композиції В одному варіанті здійснення пероральні фармацевтичні композиції формульовані звичайним способом з використанням одного або більше фізіологічно прийнятних носіїв (тобто неактивних інгредієнтів), включаючи допоміжні речовини і добавки, які полегшують переробку активних сполук у препарати, що використовуються фармацевтично. Придатні методики, носії та допоміжні речовини включають такі, які описані, наприклад, у Remington: The Science and Practice of Pharmacy, Nineteenth Ed (Easton, Pa.: Mack Publishing Company, 1995); Hoover, John E., Remington's Pharmaceutical Sciences, Mack Publishing Co., Easton, Pennsylvania 1975; Liberman, H.A. and Lachman, L., Eds., Pharmaceutical Dosage Forms, Marcel Decker, New York, N.Y., 1980; і Pharmaceutical Dosage Forms and Drug Delivery Systems, Seventh Ed. (Lippincott Williams & Wilkins1999), повний зміст яких включений в даний документ шляхом посилання. Термін "фармацевтична композиція" відноситься до суміші активного агента (або інгредієнта) з іншими неактивними хімічними компонентами, такими як носії, стабілізатори, розріджувачі, диспергуючі речовини, суспендуючі речовини, загусники, покриття та/або допоміжні речовини. Фармацевтична композиція полегшує введення сполуки в організм людини. В одному аспекті активний агент являє собою інгібітор HDAC (напр., Сполуку 1). В одному аспекті активний агент являє собою HCl сіль Сполуки 1. "Контрольоване вивільнення", яке використовується в даному документі, відноситься до будь-якого профілю вивільнення, що не повністю являє собою негайне вивільнення. Для перорального введення інгібітор HDAC (напр., Сполуку 1) або його фармацевтично прийнятну сіль, таку як HCl сіль, формулюють шляхом об'єднання активної сполуки з фармацевтично прийнятними носіями або допоміжними речовинами. Такі носії дозволяють 16 UA 110853 C2 5 10 15 20 25 30 35 40 45 50 55 60 формулювати інгібітор HDAC (напр., Сполуку 1) або його фармацевтично прийнятну сіль у вигляді таблеток, порошків, пігулок, капсул і тому подібного, для перорального прийому пацієнтом, що підлягає лікуванню. Фармацевтичні композиції будуть включати, щонайменше, один фармацевтично прийнятний носій, розріджувач або допоміжну речовину, та інгібітор HDAC (напр., Сполуку 1) або його фармацевтично прийнятну сіль як активний інгредієнт. В інших варіантах здійснення фармацевтичні композиції включають, щонайменше, один фармацевтично прийнятний носій, розріджувач або допоміжну речовину, та інгібітор HDAC або його фармацевтично прийнятну сіль у комбінації з бендамустином. Пероральні тверді дозовані лікарські форми, описані в даному документі, включають частинки інгібітора HDAC (напр., Сполуки 1) або його фармацевтично прийнятної солі, що знаходяться у кристалічній формі, аморфній фазі, напівкристалічній формі, напіваморфній фазі, або їхніх сумішей. В одному аспекті фармацевтичні композиції, описані в даному документі, представлені у формі пероральної твердої дозованої лікарської форми. Пероральні тверді дозовані лікарські форми включають: таблетки, пігулки, капсули, порошки, міні-таблетки, частинки, кульки, пелети і тому подібне. Фармацевтичні композиції, описані тут, включають інгібітор HDAC (напр., Сполуку 1) або його фармацевтично прийнятну сіль, і одне або більше з наступного: (а) сполучні речовини; (b) покриття; (с) дезінтегруючі агенти; (d) наповнювачі (розріджувачі); (е) лубриканти; (f) гліданти (підсилювачі ковзання); (g) добавки для пресування; (h) барвники; (i) підсолоджувачі; (j) консерванти; (k) суспендуючі/диспергуючі агенти; (l) плівкоутворювачі/покриття; (m) речовини, які поліпшують смак і запах (коригенти); (n) друкарські фарби; (o) желюючі речовини; (p) другий терапевтично активний агент. В одному аспекті фармацевтичні композиції, описані тут, додатково до інгібітора HDAC (напр., Сполуки 1) або його фармацевтично прийнятної солі включають одне або більше з наступного: (а) стеарат магнію; (b) лактозу; (с) мікрокристалічну целюлозу; (d) силікатовану мікрокристалічну целюлозу; (е) маніт; (f) крохмаль (кукурудзяний); (g) діоксид кремнію; (h) діоксид титану; (i) стеаринову кислоту; (j) гліколят крохмалю натрію; (k) желатин; (l) тальк; (m) сахарозу; (n) аспартам; (о) стеарат кальцію; (p) повідон; (q) прежелатинізований крохмаль; (r) гідроксипропілметилцелюлозу; (s) OPA продукти (покриття та чорнило); (t) кроскармелозу; (u) гідроксипропілцелюлозу; (v) етилцелюлозу; (w) фосфат кальцію (двоосновний); (х) кросповідон; (y) шелак (і глазур); (z) карбонат натрію. Крім того, у даному документі забезпечені фармацевтичні композиції, що містять активний інгредієнт або його фармацевтично прийнятну сіль, сольват або проліки у фармацевтично прийнятному наповнювачі, носії, розріджувачі або допоміжній речовині, або їхній суміші, та одну або більше контролюючих вивільнення допоміжних речовин, як описано в даному документі. Придатні наповнювачі для лікарської форми з модифікованим вивільненням включають, але без обмеження, гідрофільні або гідрофобні матричні пристрої, розчинні у воді покриття розділяючого шару, ентеросолюбільні покриття, осмотичні пристрої, пристрої, які складаються з множини частинок, та їхні комбінації. Фармацевтичні композиції можуть також містити не контролюючі вивільнення допоміжні речовини. У даному документі забезпечені фармацевтичні композиції в дозованих лікарських формах із плівковим покриттям, які містять комбінацію активного інгредієнта або його фармацевтично прийнятної солі, сольвату або проліків; і одну або більше допоміжних речовин, які використовуються у виробництві таблеток, для формування ядра таблетки звичайними способами виготовлення таблеток і наступного покриття ядра. Ядра таблеток можуть бути виготовлені з використанням звичайних методів грануляції, наприклад, вологої або сухої грануляції, необов'язково з подрібнюванням гранул, і наступним пресуванням і нанесенням покриття. Способи грануляції описані, наприклад, у Voigt, сторінки 156-69. Придатні допоміжні речовини для виготовлення гранул являють собою, наприклад, порошкоподібні наповнювачі, які необов'язково мають властивості поліпшувати текучість, наприклад тальк, діоксид кремнію, наприклад синтетична аморфна безводна кремнієва кислота типу Syloid® (фірма Grace), наприклад SYLOID 244 FP, мікрокристалічна целюлоза, наприклад типу Avicel® (фірма FMC Corp.), наприклад типів AVICEL PH101, 102, 105, RC581 або RC 591, типу Emcocel® (фірма Mendell Corp.) або типу Elcema® (фірма Degussa); вуглеводи, такі як цукри, цукрові спирти, крохмалі або похідні крохмалю, наприклад лактоза, декстроза, сахароза, глюкоза, сорбіт, маніт, ксиліт, картопляний крохмаль, маїсовий крохмаль, рисовий крохмаль, пшеничний крохмаль або амілопектин, трикальційфосфат, двозаміщений кальцію фосфат або трисилікат магнію; сполучні речовини, такі як желатин, трагакант, агар, альгінова кислота, прості 17 UA 110853 C2 5 10 15 20 25 30 35 40 45 50 55 60 ефіри целюлози, наприклад метилцелюлоза, карбоксиметилцелюлоза або гідроксипропілметилцелюлоза, поліетиленгліколі або гомополімери етиленоксиду, що зокрема 3 5 мають ступінь полімеризації приблизно від 2.0×10 до 1.0×10 і молекулярну масу приблизно від 5 6 1.0×10 до 5.0×10 , наприклад, допоміжні речовини, відомі під торговельною маркою Polyox® (фірма Union Carbide), полівінілпіролідон або повідони, що зокрема мають середню молекулярну масу приблизно 1000 і ступінь полімеризації приблизно від 500 до 2500, а також агар або желатин; поверхнево-активні речовини, наприклад аніоногенні поверхнево-активні речовини типу алкілсульфатів, наприклад, н-додецилсульфат, н-тетрадецилсульфат, нгексадецилсульфат або н-октадецилсульфат натрію, калію або магнію, або типу алкілефірсульфату, наприклад н-додецилоксіетилсульфат, н-тетрадецилоксіетилсульфат, нгексадецилоксіетилсульфат або н-октадецилоксіетилсульфат натрію, калію або магнію, або типу алкілсульфонатів, наприклад н-додекансульфонат, н-тетрадекансульфонат, нгексадекансульфонат або н-октадекансульфонат натрію, калію або магнію, або неіоногенні поверхнево-активні речовини типу ефіру багатоатомного спирту та жирної кислоти, такі як сорбітан монолаурат, моноолеат, моностеарат або монопальмітат, сорбітан тристеарат або триолеат, поліоксіетиленові аддукти ефірів багатоатомного спирту та жирної кислоти, такі як поліоксіетиленсорбітан монолаурат, моноолеат, моностеарат, монопальмітат, тристеарат або триолеат, поліетиленгліколеві ефіри жирної кислоти, такі як поліоксіетилстеарат, стеарат поліетиленгліколя 400, стеарат поліетиленгліколя 2000, зокрема блок-полімери етиленоксиду/пропіленоксиду типу Pluronics® (фірма BWC) або Synperonic® (фірма ICI). Крім того, в даному документі забезпечені фармацевтичні композиції в дозованих лікарських формах з ентеросолюбільним покриттям, які містять комбінацію активного інгредієнта або його фармацевтично прийнятної солі, сольвату або проліків, і одну або декілька контролюючих вивільнення допоміжних речовин, що застосовуються в дозованій лікарській формі з ентеросолюбільним покриттям. Фармацевтичні композиції можуть також містити не контролюючі вивільнення допоміжні речовини. Додатково забезпечені фармацевтичні композиції в дозованій лікарській формі, яка містить компонент із миттєвим вивільненням і, щонайменше, один компонент із відстроченим вивільненням, і може забезпечити переривчасте вивільнення сполуки у вигляді, щонайменше, двох послідовних імпульсів з інтервалом від 0.5 години до 8 годин. Фармацевтичні композиції містять комбінацію активного інгредієнта й одну або декілька контролюючих вивільнення та не контролюючих вивільнення допоміжних речовин, таких як допоміжні речовини, придатні для напівпроникної мембрани, що розривається, і як набухаючі речовини. До того ж, у даному документі забезпечені фармацевтичні композиції в дозованій лікарській формі для перорального введення суб'єкту, яка містить комбінацію активного інгредієнта або його фармацевтично прийнятної солі, сольвату або проліків; і одну/один або більше фармацевтично прийнятних допоміжних речовин або носіїв, укладену в проміжний реакційноздатний шар, що містить стійкий до дії шлункового соку полімерний шаруватий матеріал, частково нейтралізований лугом, і має катіонообмінну ємність, та стійкий до дії шлункового соку зовнішній шар. У даному документі забезпечені фармацевтичні композиції, які містять активний інгредієнт у формі гранул з ентеросолюбільним покриттям, у вигляді капсул з відстроченим вивільненням для перорального введення. Фармацевтичні композиції, забезпечені в даному документі, можуть бути забезпечені в стандартних лікарських формах або лікарських формах, які містять декілька доз. Стандартні лікарські форми, які використовуються в даному документі, відносяться до фізично дискретних одиниць, придатних для введення людському та тваринному суб'єктам, і впаковані окремо, як відомо в даній області. Кожна разова доза містить попередньо визначену кількість активного інгредієнта(ів), достатню для одержання бажаного терапевтичного ефекту, у сполученні з необхідними фармацевтичними носіями або допоміжними речовинами. Приклади стандартних лікарських форм включають індивідуально впаковані таблетки і капсули. Стандартні лікарські форми можна вводити частинами або декілька. Лікарська форма, яка містить декілька доз, являє собою сукупність ідентичних стандартних лікарських форм, упакованих в один контейнер і призначених для введення у вигляді окремих стандартних лікарських форм. Приклади лікарських форм, які містять декілька доз, включають бутлі з таблетками або капсулами. Фармацевтичні лікарські форми можуть бути формульовані різними способами і можуть забезпечити різноманітні профілі вивільнення лікарського засобу, в тому числі негайне вивільнення, вповільнене вивільнення та відстрочене вивільнення. У деяких випадках може бути бажаним запобігти вивільненню лікарського засобу після введення лікарського засобу доти, поки не пройде деяка кількість часу (тобто регульоване за часом вивільнення), 18 UA 110853 C2 5 10 15 20 25 30 35 40 45 50 55 60 забезпечити в основному безперервне вивільнення протягом попередньо встановленого періоду часу (тобто вповільнене вивільнення) або забезпечити вивільнення відразу ж після введення лікарського засобу (тобто негайне вивільнення). Пероральні лікарські форми, які включають інгібітор HDAC (напр., Сполуку 1) або його фармацевтично прийнятну сіль, представлені у формі таблеток, капсул, пігулок, пелет, кульок, гранул, порошків. Капсули містять суміші активної сполуки(к) з інертними наповнювачами і/або розріджувачами, такими як фармацевтично прийнятні крохмалі (напр., кукурудзяний, картопляний або маніоковий крохмаль), цукри, штучні підсолоджувачі, порошкоподібні целюлози, такі як кристалічна та мікрокристалічна целюлози, борошно, желатини, камеді і т.п. Лікарські форми у вигляді таблеток виготовлені звичайними методами пресування, вологої грануляції або сухої грануляції та з використанням фармацевтично прийнятних розріджувачів, сполучних речовин, лубрикантів, дезінтегруючих агентів, модифікуючих поверхню агентів (включаючи поверхнево-активні речовини), суспендуючих або стабілізуючих агентів, включаючи, але без обмеження, стеарат магнію, стеаринову кислоту, тальк, лаурилсульфат натрію, мікрокристалічну целюлозу, кальцій-карбоксиметилцелюлозу, полівінілпіролідон, желатин, альгінову кислоту, аравійську камедь, ксантанову камедь, цитрат натрію, комплексні силікати, карбонат кальцію, гліцин, декстрин, сахарозу, сорбіт, дикальційфосфат, сульфат кальцію, лактозу, каолін, маніт, хлорид натрію, тальк, сухі крахми і цукрову пудру. У деяких варіантах здійснення представлені модифікуючі поверхню агенти, які включають неіоногенні й аніоногенні модифікуючі поверхню агенти. Наприклад, модифікуючі поверхню агенти включають, але без обмеження, полоксамер 188, хлорид бензалконію, стеарат кальцію, цетостеариловий спирт, емульгуючий віск цетомакрогол, складні ефіри сорбіту, колоїдний діоксид кремнію, фосфати, додецилсульфат натрію, алюмосилікат магнію та триетаноламін. В одному аспекті пероральні лікарські форми, описані в даному документі, використовують стандартні лікарські форми із затриманим або відстроченим вивільненням для зміни абсорбції активної сполуки(к). Сполучні речовини або агенти, що гранулюють, надають когезійну здатність таблетці для забезпечення інтактного стану таблетки після спресовування. Придатні сполучні речовини або агенти, що гранулюють, включають, але без обмеження, крохмалі, такі як кукурудзяний крохмаль, картопляний крохмаль і прежелатинізований крохмаль (напр., STARCH 1500); желатин; цукри, такі як сахароза, глюкоза, декстроза, меляса та лактоза; природні та синтетичні смоли, такі як аравійська камедь, альгінова кислота, альгінати, екстракти ірландського моху, Panwar камедь, гхатті камедь, екстракт слизу лушпиння насіння подорожника, карбоксиметилцелюлоза, метилцелюлоза, полівінілпіролідон (PVP), вігум, арабіногалактани модрини, порошок трагаканту і гуарова камедь; целюлози, такі як етилцелюлоза, ацетат целюлози, кальцій-карбоксиметилцелюлоза, натрій-карбоксиметилцелюлоза, метилцелюлоза, гідроксіетилцелюлоза (HEC), гідроксипропілцелюлоза (HPC), гідроксипропілметилцелюлоза (HPMC); мікрокристалічні целюлози, такі як AVICEL®-PH-101, AVICEL®-PH-103, AVICEL® RC581, AVICEL®-PH-105 (FMC Corp., Marcus Hook, PA); та їхні суміші. Придатні наповнювачі включають, але без обмеження, тальк, карбонат кальцію, мікрокристалічну целюлозу, порошкоподібну целюлозу, декстрати, каолін, маніт, кремнієву кислоту, сорбіт, крохмаль, прежелатинізований крохмаль та їхні суміші. Вміст сполучних речовин становить приблизно від 50 % до 99 % за масою у фармацевтичних композиціях, забезпечених у даному документі. Придатні розріджувачі включають, але без обмеження, дикальційфосфат, сульфат кальцію, лактозу, сорбіт, сахарозу, інозитол, целюлозу, каолін, маніт, хлорид натрію, сухий крохмаль і цукрову пудру. Придатні дезінтегруючі агенти включають, але без обмеження, агар; бентоніт; целюлози, такі як метилцелюлоза та карбоксиметилцелюлоза; продукти лісу; натуральну губку; катіонообмінні смоли; альгінову кислоту; камеді, такі як гуарова камедь та вігум HV; цитрусову пульпу; зшиті целюлози, такі як кроскармелоза; зшиті полімери, такі як кросповідон; зшиті крохмалі; карбонат кальцію; мікрокристалічну целюлозу, таку як натрію гліколят крохмалю; поліакрилін калію; крохмалі, такі як кукурудзяний крохмаль, картопляний крохмаль, тапіоковий крохмаль та прежелатинізований крохмаль; глини; альгіни; та їхні суміші. Кількість дезінтегруючого агента у фармацевтичних композиціях, забезпечених у даному документі, змінюється залежно від типу лікарської форми і легко визначається фахівцями в даній області. В одному аспекті фармацевтичні композиції, забезпечені в даному документі, можуть містити приблизно від 0.5 до 15 %, або приблизно від 1 до 5 % за масою дезінтегруючого агента. Придатні лубриканти включають, але без обмеження, стеарат кальцію; стеарат магнію; мінеральне масло; легке мінеральне масло; гліцерин; сорбіт; маніт; гліколі, такі як гліцерину бегенат і поліетиленгліколь (PEG); стеаринову кислоту; лаурилсульфат натрію; тальк; 19 UA 110853 C2 5 10 15 20 25 30 35 40 45 50 55 гідрогенізоване рослинне масло, у тому числі арахісове масло, бавовняне масло, соняшникове масло, кунжутне масло, маслинове масло, кукурудзяне масло та соєве масло; стеарат цинку; етилолеат; етиллауреат; агар; крохмаль; лікоподій; діоксид кремнію або силікагелі, такі як AEROSIL® 200 (W.R. Grace Co., Baltimore, MD) і CAB-O-SIL® (Cabot Co. of Boston, MA); та їхні суміші. В одному аспекті фармацевтичні композиції, забезпечені в даному документі, містять приблизно від 0.1 до 5 % за масою лубриканта. Придатні речовини, які сприяють ковзанню, включають колоїдний діоксид кремнію, CAB-OSIL® (Cabot Co. of Boston, MA) і безазбестовий тальк. Барвники включають будь-які зі схвалених, сертифікованих, водорозчинних барвників для харчової та хімічної промисловості (FD&C) і водонерозчинних барвників для харчової та хімічної промисловості (FD&C), які суспендовані у гідроокисі алюмінію, а також кольорові лаки та їхні суміші. Кольоровий лак являє собою комбінацію, отриману шляхом адсорбції водорозчинного барвника на гідроокисі важкого металу, що призводить до утворення нерозчинної форми барвника. Варто розуміти, що багато носіїв і допоміжних речовин можуть виконувати декілька функцій, навіть в одній і тій самій лікарській формі. У наступних варіантах здійснення фармацевтичні композиції, забезпечені тут, можуть бути представлені у вигляді спресованих таблеток, тритураційних таблеток, швидкорозчинних таблеток, багаторазово пресованих таблеток або таблеток з ентеросолюбільним покриттям, таблеток із цукровим покриттям або таблеток із плівковим покриттям. Ентеросолюбільні покриття являють собою покриття, які протистоять дії шлункової кислоти, але розчиняються або руйнуються в кишечнику. В одному аспекті пероральна тверда дозована лікарська форма, розкрита в даному документі, включає ентеросолюбільне покриття. Ентеросолюбільні покриття включають одне або більше з наступного: ацетат-фталат целюлози; співполімери метилметакрилату та метакрилової кислоти; ацетат сукцинат целюлози; фталат-гідроксипропілметилцелюлози; ацетат-сукцинат гідроксипропілметилцелюлози (гіпромелози ацетату сукцинат); фталат полівінілацетату (PVAP); співполімери метилметакрилату та метакрилової кислоти; співполімери метакрилової кислоти; ацетат целюлози (та його сукцинатний і фталатний варіант); співполімеристиролу та малеїнової кислоти; співполімер поліметакрилової кислоти й акрилової кислоти; гідроксіетил етилцелюлози фталат; ацетат-сукцинат гідроксипропілметилцелюлози; ацетат тетрагідрофталат целюлози; акрилова смола; шелак. Ентеросолюбільне покриття являє собою покриття, нанесене на таблетку, пігулку, капсулу, пелету, кульку, гранулу, частинку тощо таким чином, що воно не розчиняється доти, поки не досягне тонкого кишечнику. Таблетки із цукровим покриттям являють собою спресовані таблетки, оточені цукровим покриттям, яке може бути корисним для маскування неприємних смаків і запахів, а також для захисту таблеток від окислення. Таблетки із плівковим покриттям являють собою спресовані таблетки, які покриті тонким шаром або плівкою водорозчинного матеріалу. Плівкові покриття включають, але без обмеження, гідроксіетилцелюлозу, натрій- карбоксиметилцелюлозу, поліетиленгліколь 4000 й ацетат-фталат целюлози. Плівкові покриття надають ті ж самі загальні властивості, що і цукрове покриття. Багаторазово пресовані таблетки являють собою пресовані таблетки, виготовлені шляхом більше ніж одного циклу пресування, включаючи багатошарові таблетки, а також таблетки, покриті шляхом пресування або сушіння. Лікарські форми у вигляді таблеток можуть бути виготовлені з активного інгредієнта в порошкоподібних, кристалічних або гранульованих формах, узятого окремо або в сполученні з одним або більше носіями або допоміжними речовинами, описаними у даному документі, включаючи сполучні речовини, дезінтегруючі агенти, полімери з контрольованим вивільненням, лубриканти, розріджувачі та/або барвники. Ароматизатори і підсолоджувачі є особливо корисними при виготовленні жувальних таблеток і таблеток для розсмоктування. Фармацевтичні композиції, забезпечені в даному документі, можуть бути представлені у вигляді м'яких або твердих капсул, які можуть бути виготовлені з желатину, метилцелюлози, крохмалю або альгінату кальцію. Тверда желатинова капсула, також відома як капсула з сухим наповнювачем (DFC), складається з двох частин, одна з яких насаджується на іншу, повністю закриваючи, таким чином, активний інгредієнт. М'яка еластична капсула (SEC) являє собою м'яку, глобулярну оболонку, таку як желатинова оболонка, яку пластифікують шляхом додавання гліцерину, сорбіту або подібного поліолу. Капсули також можуть мати покриття, відоме фахівцям у даній області, що дозволяє модифікувати або сповільнити розчинення активного інгредієнта. 20 UA 110853 C2 5 10 15 20 25 30 35 40 45 50 55 60 Барвники і смакові добавки можуть бути використані у всіх зазначених вище лікарських формах. Фармацевтичні композиції, забезпечені в даному документі, можуть бути формульовані у вигляді дозованих лікарських форм із негайним або модифікованим вивільненням, включаючи форми з відстроченим, уповільненим, імпульсним, контрольованим, націленим і програмувальним вивільненням. Фармацевтичні композиції, забезпечені в даному документі, представлені у вигляді дозованих лікарських форм із негайним або модифікованим вивільненням, включаючи форми з відстроченим, уповільненим, імпульсним, контрольованим, націленим і програмувальним вивільненням. Контрольоване вивільнення В одному аспекті фармацевтичні композиції, забезпечені в даному документі, представлені у вигляді дозованої лікарської форми з контрольованим вивільненням. Термін "контрольоване вивільнення", який використовується в даному документі, відноситься до дозованої лікарської форми, яка характеризується іншою швидкістю або іншою ділянкою вивільнення активного інгредієнта(ів), ніж дозована лікарська форма з негайним вивільненням при пероральному введенні. Дозовані лікарські форми з контрольованим вивільненням включають відстрочене, продовжене, пролонговане, уповільнене, імпульсне, модифіковане, таргетне, програмувальне вивільнення. Фармацевтичні композиції, які входять до складу дозованих лікарських форм із контрольованим вивільненням, виготовлені з використанням ряду пристроїв і способів модифікованого вивільнення, відомих фахівцям у даній області, які включають, але без обмеження, матриксні пристрої контрольованого вивільнення, пристрої з осмотичним контролем вивільнення, пристрої контрольованого вивільнення, які складаються з множини частинок, іонообмінні смоли, ентеросолюбільні покриття, багатошарові покриття та їхні комбінації. Швидкість вивільнення активного інгредієнта(ів) також можна модифікувати шляхом варіювання розмірів частинок. Фармацевтичні пероральні тверді дозовані лікарські форми, у тому числі лікарські форми, описані тут, які включають інгібітор HDAC (напр., Сполуку 1) або його фармацевтично прийнятну сіль, формульовані для забезпечення контрольованого вивільнення інгібітора HDAC (напр., Сполуки 1) або його фармацевтично прийнятної солі. На противагу композиціям з негайним вивільненням, композиції з контрольованим вивільненням уможливлюють доставку агента в організм людини протягом тривалого періоду часу відповідно до заданого профілю. Такі швидкості вивільнення можуть забезпечити терапевтично ефективні рівні агента протягом тривалого періоду часу і, таким чином, забезпечити більш тривалий період фармакологічної відповіді. Такі більш тривалі періоди відповіді забезпечують багато внутрішніх переваг, які не досягаються за допомогою відповідних препаратів короткої дії з негайним вивільненням. В одному аспекті композиції з контрольованим вивільненням інгібітора HDAC (напр., Сполуки 1) або його фармацевтично прийнятної солі забезпечують терапевтично ефективні рівні інгібітора HDAC (напр., Сполуки 1) протягом тривалого періоду часу і, таким чином, забезпечують більш тривалий період фармакологічної відповіді. У деяких варіантах здійснення тверді дозовані лікарські форми, описані тут, можуть бути формульовані у вигляді пероральних дозованих лікарських форм із відстроченим вивільненням, покритих ентеросолюбільною оболонкою, тобто у вигляді пероральної дозованої лікарської форми фармацевтичної композиції, описаної тут, яка використовує ентеросолюбільне покриття для досягнення вивільнення в тонкому кишечнику шлунково-кишкового тракту. Дозована лікарська форма з ентеросолюбільним покриттям являє собою пресовану або формовану, або екструдовану таблетку/форму (покриту або непокриту), яка містить гранули, порошок, пелети, кульки або частинки активного інгредієнта та/або інші компоненти композиції, які самі по собі є покритими або непокритими. В одному аспекті пероральна дозована лікарська форма з ентеросолюбільним покриттям може являти собою капсулу (покриту або непокриту), яка містить пелети, кульки або гранули твердого носія або композиції, які самі по собі є покритими або непокритими. Термін "відстрочене вивільнення", який використовується в даному документі, відноситься до такої доставки, при якій вивільнення може бути здійснене в якомусь у більшості випадків передбачуваному місці кишечнику, дистальніше, ніж воно могло б бути здійснене при відсутності змін, які викликані відстроченим вивільненням. У деяких варіантах здійснення способом відстрочки вивільнення є покриття. Будь-які покриття повинні наноситися з товщиною, достатньою для того, щоб не все покриття розчинялося в шлунково-кишкових рідинах при рН нижче близько 5, але при цьому розчинялося при рН близько 5 і вище. Передбачається, що 21 UA 110853 C2 5 10 15 20 25 30 35 40 45 50 55 60 будь-який аніонний полімер, який проявляє рН-залежний профіль розчинності, можна використовувати як ентеросолюбільне покриття при практичному здійсненні даного винаходу для досягнення доставки у нижній відділ шлунково-кишкового тракту. У деяких варіантах здійснення полімери, призначені для використання в даному винаході, являють собою аніонні карбоксилвмісні полімери. В інших варіантах здійснення полімери та їхні сумісні суміші, а також деякі з їхніх властивостей включають, але без обмеження, наступне: Шелак, який також називається як очищений сирий шелак. Це покриття розчиняється в середовищі при рН ˃7; Акрилові полімери. Властивості акрилових полімерів (у першу чергу їхня розчинність у біологічних рідинах) можуть змінюватися залежно від ступеня та типу заміщення. Приклади придатних акрилових полімерів включають співполімери метакрилової кислоти і співполімери метакрилату амонію. Доступні серії Eudragit E, L, R, S, RL, RS і NE (Rohm Pharma) у вигляді солюбілізованих в органічному розчиннику, водної дисперсії або сухих порошків. Серії Eudragit RL, NE і RS нерозчинні в шлунково-кишковому тракті, але є проникними і використовуються головним чином для доставки у товсту кишку. Серія Eudragit Е розчиняється в шлунку. Серії Eudragit L, L-30D і S нерозчинні в шлунку та розчиняються в кишечнику; Похідні целюлози. Прикладами придатних похідних целюлози є: етилцелюлоза; реакційні суміші неповних оцтовокислих ефірів целюлози й ангідриду фталевої кислоти. Властивості можуть змінюватися залежно від ступеня та типу заміщення. Ацетат-фталат целюлози (САР) розчиняється при рН ˃6. Aquateric (FMC) є водною системою та являє собою висушений розпиленням САР-псевдолатекс із частинками ˂1 мкм. Інші компоненти в Aquateric можуть включати плюроніки (pluronics), різновиди Tween й ацетильовані моногліцериди. Інші придатні похідні целюлози включають: ацетат-тримелітат целюлози (Eastman); метилцелюлозу (Pharmacoat, Methocel); фталат гідроксипропілметилцелюлози (HPMCP); сукцинат гідроксипропілметилцелюлози (HPMCS); й ацетат-сукцинат гідроксипропілметилцелюлози (напр., AQOAT (Shin Etsu)). Властивості можуть змінюватися залежно від ступеня та типу заміщення. Наприклад, HPMCP, такий як марки HP-50, HP-55, HP-55S, HP-55F, є придатним. Властивості можуть змінюватися залежно від ступеня та типу заміщення. Наприклад, придатні марки ацетату сукцинату гідроксипропілметилцелюлози включають, але без обмеження, AS-LG (LF), який розчиняється при pН 5, AS-MG (MF), який розчиняється при рН 5.5, й AS-HG (HF), який розчиняється при більш високому рН. Ці полімери пропонуються у вигляді гранул або тонкоподрібнених порошків для водних дисперсій; Фталат полівінілацетату (PVAP). PVAP розчиняється при рН ˃5 та є значно менш проникним для водяної пари і шлункового соку. У деяких варіантах здійснення покриття може містити і, як правило, містить пластифікатор, і можливо інші допоміжні речовини покриття, такі як барвники, тальк і/або стеарат магнію, які добре відомі в даній області. Придатні пластифікатори включають триетилцитрат (Citroflex 2), триацетин (гліцеринтриацетат), ацетилтриетилцитрат (Citroflec А2), Carbowax 400 (поліетиленгліколь 400), діетилфталат, трибутилцитрат, ацетильовані моногліцериди, гліцерин, складні ефіри жирних кислот, пропіленгліколь та дибутилфталат. Зокрема, аніонні карбоксилвмісні акрилові полімери зазвичай містять 10-25 % за масою пластифікатора, головним чином, дибутилфталату, поліетиленгліколя, триетилцитрату та триацетину. Для нанесення покриттів використовують звичайні методи нанесення покриття, такі як покриття розпорошенням або нанесення оболонки. Товщина покриття повинна бути достатньою для гарантії того, що пероральна лікарська форма залишається інтактною до досягнення бажаної області місцевої доставки у кишечнику. Крім пластифікаторів у покриття можуть бути додані барвники, засоби для усунення клейкості, поверхнево-активні речовини, протиспінюючі агенти, лубриканти (напр., карнаубський віск або PEG) для солюбілізації або диспергування матеріалу покриття, а також для поліпшення властивостей покриття та покритого продукту. Особливо придатним метакриловим співполімером є Eudragit L®, особливо L-30D® та Eudragit 100-55®, виготовлені фірмою Rohm Pharma, Німеччина. В Eudragit L-30D® співвідношення вільних карбоксильних груп до груп складного ефіру становить приблизно 1:1. Крім того, відомо, що співполімер не розчинний в шлунково-кишкових рідинах, які мають рН нижче 5.5, зазвичай 1.5-5.5, тобто значенні рН, яке зазвичай є присутнім у рідині верхнього відділу шлунково-кишкового тракту, але легко розчиняється або частково розчиняється при рН вище 5.5, тобто значенні рН, яке присутнє в тонкому кишечнику. У деяких варіантах здійснення матеріали включають шелак, акрилові полімери, похідні целюлози, полівінілацетатфталат та їхні суміші. В інших варіантах здійснення матеріали включають серії Eudragit® E, L, RL, RS, NE, L, L300, S, 100-55, ацетат-фталат целюлози, 22 UA 110853 C2 5 10 15 20 25 30 35 40 45 50 55 60 Aquateric, ацетат-тримелітат целюлози, етилцелюлозу, фталат гідроксипропілметилцелюлози, ацетат-сукцинат гідроксипропілметилцелюлози, полівінілацетатфталат і Cotteric. Для деяких типів лікарських засобів переважним є вивільнення лікарського засобу "імпульсами", при цьому одинична дозована лікарська форма забезпечує початкову дозу лікарського засобу з наступним інтервалом відсутності вивільнення, після якого вивільняється друга доза лікарського засобу з наступним одним або більше додатковими інтервалами відсутності вивільнення та вивільненням лікарського засобу "імпульсами". Альтернативно, вивільнення лікарського засобу не відбувається протягом деякого періоду часу після введення дозованої лікарської форми, після чого доза лікарського засобу вивільняється, з наступним одним або декількома додатковими інтервалами відсутності вивільнення та вивільненням лікарського засобу "імпульсами". Імпульсна доставка лікарського засобу є корисною, наприклад, з активними агентами, які мають короткий період напіврозпаду, що вводять два або три рази на добу, з активними агентами, які інтенсивно пресистемно метаболізуються, і з активними агентами, які повинні зберігати певні рівні в плазмі крові для того, щоб мати оптимальні фармакодинамічні ефекти. Дозована лікарська форма з імпульсним вивільненням може забезпечити один або більше імпульсів негайного вивільнення в задані моменти часу після контрольованого часу затримки або в певних місцях. Дозовані лікарські форми з імпульсним вивільненням, включаючи лікарські форми, описані в даному документі, які включають інгібітор HDAC (напр., Сполуку 1) або його фармацевтично прийнятну сіль, вводять з використанням різноманітних лікарських форм із імпульсним вивільненням, які були описані. Наприклад, такі лікарські форми включають, але без обмеження, описані в патентах США №№ 5011692, 5017381, 5229135, 5840329, 4871549, 5260068, 5260069, 5508040, 5567441 і 5837284. В одному варіанті здійснення дозована лікарська форма з контрольованим вивільненням являє собою пероральну тверду дозовану лікарську форму з імпульсним вивільненням, яка включає, щонайменше, дві групи частинок (тобто множину частинок), кожна з яких містить композицію, описану в даному документі. Перша група частинок забезпечує дозу інгібітора HDAC (напр., Сполуки 1) або його фармацевтично прийнятної солі по суті з негайним вивільненням при прийомі всередину ссавцем. Перша група частинок може бути непокритою, або мати покриття та/або герметизуючу речовину. Друга група частинок включає покриті частинки, які включають приблизно від 2 % до 75 %, переважно приблизно від 2.5 % до 70 %, і більш переважно приблизно від 40 % до 70 % за масою загальної дози інгібітора HDAC (напр., Сполуки 1) або його фармацевтично прийнятної солі в зазначеній лікарській формі в суміші з однією або більше сполучними речовинами. Покриття включає фармацевтично прийнятний інгредієнт у кількості, достатній для забезпечення затримки приблизно від 2 годин до 7 годин після прийому всередину перед вивільненням другої дози. Придатні покриття включають одне або більше диференційовано розкладаних покриттів, таких як, як приклад тільки, рН-чутливі покриття (ентеросолюбільні покриття), такі як акрилові смоли (напр., Eudragit® EPO, Eudragit® L30D-55, Eudragit® FS 30D, Eudragit® L100-55, Eudragit® L100, ® Eudragit® S100, Eudragit® RD100, Eudragit® E100, Eudragit® L12.5, Eudragit S12.5 та Eudragit® NE30D, Eudragit® NE 40D), взяті окремо або змішані з похідними целюлози, напр., етилцелюлозою, або неентеросолюбільні покриття, що мають змінну товщину для забезпечення диференційованого вивільнення препарату, який включає інгібітор HDAC (напр., Сполуку 1) або його фармацевтично прийнятну сіль. Пристрої контрольованого вивільнення, які складаються з множини частинок У деяких варіантах здійснення фармацевтичні композиції, описані тут, являють собою пристрій контрольованого вивільнення, який складається з множини частинок, що містить сукупність частинок, гранул або пелет з діаметром в інтервалі приблизно від 10 мкм до 3 мм, приблизно від 50 мкм до 2.5 мм, або приблизно від 100 мкм до 1 мм. Така множина частинок виготовлена шляхом вологої грануляції, сухої грануляції, екструзії/сферонізації, валикового пресування, плавлення-заморожування, покриття ядер розпорошенням та їхніми комбінаціями. Дивися, наприклад, Multiparticulate Oral Drug Delivery; Marcel Dekker: 1994; і Pharmaceutical Pelletization Technology; Marcel Dekker: 1989. Інші допоміжні речовини або носії, описані тут, можуть бути змішані з фармацевтичними композиціями, щоб полегшити обробку й утворення множини частинок. Отримані частинки самі по собі можуть становити пристрій з множини частинок, або вони можуть бути покриті різними плівкоутворювальними речовинами, такими як ентеросолюбільні полімери, полімери, які набухають у воді, та водорозчинні полімери. Множина частинок може бути додатково оброблена з отриманням капсул або таблеток. Кишкова захисна система всмоктування лікарського засобу (IPDAS) являє собою технологію виготовлення таблеток, які складаються з множини частинок, що включають кульки високої 23 UA 110853 C2 5 10 15 20 25 30 35 40 45 50 55 60 щільності з контрольованим вивільненням, які пресують у форму таблеток. Кульки можуть бути виготовлені такими методами, як екструзійна сферонізація, та контрольоване вивільнення може бути досягнуте шляхом використання різних полімерних систем для покриття отриманих кульок. Альтернативно, лікарський засіб також може бути нанесений на інертний носій, такий як зерно нонпарель для отримання множини частинок з миттєвим вивільненням. Контрольоване вивільнення може бути досягнуте шляхом формування полімерної мембрани на цих множинах частинок з миттєвим вивільненням. Після прийому всередину таблетки IPDAS, вона швидко розпадається та поширює кульки, що містять лікарський засіб, у шлунку, які потім проходять у дванадцятипалу кишку й уздовж шлунково-кишкового тракту контрольованим і ступінчастим чином, незалежно від прийому їжі. Вивільнення активного інгредієнта з множини частинок виникає за допомогою процесу дифузії через полімерну мембрану та/або мікроматрицю полімерного/активного інгредієнта, утворену в екструдованих/сферонізованих множинах частинок. Шлунково-кишковий захист IPDAS здійснюється за рахунок природи множини частинок лікарської форми, що забезпечує широке поширення лікарського засобу за всім шлунково-кишковим трактом. Система абсорбції перорального сфероїдального лікарського засобу (SODAS) являє собою технологію виготовлення множини частинок, яка забезпечує виготовлення споживчих лікарських форм і відповідає прямо індивідуальним потребам кандидатних лікарських засобів. Це може забезпечити ряд спеціалізованих профілів вивільнення лікарського засобу, в тому числі негайного вивільнення лікарського засобу з наступним уповільненим вивільненням для того, щоб викликати швидкий початок дії, який зберігається протягом, щонайменше, 12 годин. Альтернативно, протилежний сценарій може бути досягнутий, коли вивільнення лікарського засобу відстрочене на декілька годин. Програмована система абсорбції перорального лікарського засобу (PRODAS) представлена у вигляді деякої кількості міні-таблеток, які містяться у твердій желатиновій капсулі. Система, таким чином, поєднує переваги технології таблетування з капсулою. Можливе введення багатьох різних міні-таблеток, при цьому кожна формульована індивідуально та запрограмована на вивільнення лікарського засобу в різних ділянках шлунково-кишкового тракту. Ці комбінації можуть включати міні-таблетки з негайним вивільненням, відстроченим вивільненням і/або контрольованим вивільненням. Також, можливе введення міні-таблеток з різними розмірами таким чином, щоб було можливе високе навантаження лікарського засобу. Їхній розмір змінюється, як правило, в діапазоні 1.5-4 мм у діаметрі. Багато інших типів систем із контрольованим вивільненням відомі фахівцям у даній області та є придатними для застосування з лікарськими формами, описаними у даному документі. Приклади таких систем доставки включають, наприклад, системи на основі полімерів, таких як полімолочна та полігліколева кислоти, поліангідриди і полікапролактон; пористі матриці, системи, не засновані на полімерах, які являють собою ліпіди, включаючи стерини, такі як холестерин, складні ефіри холестерину та жирні кислоти, або нейтральні жири, такі як моно-, ди- і тригліцериди; гідрогелеві системи вивільнення; силіконові системи; системи на основі пептидів; воскові покриття, лікарські форми, які піддані біологічному руйнуванню, пресовані таблетки із застосуванням звичайних сполучних речовин і тому подібне. Дивися, напр., Liberman із співавт., Pharmaceutical Dosage Forms, 2 Ed., Vol. 1, pp. 209-214 (1990); Singh із співавт., nd Encyclopedia of Pharmaceutical Technology, 2 Ed., pp. 751-753 (2002); патенти США №№ 4327725, 4624848, 4968509, 5461140, 5456923, 5516527, 5622721, 5686105, 5700410, 5977175, 6465014 і 6932983. Матриксні пристрої контрольованого вивільнення У деяких варіантах здійснення фармацевтичні композиції, забезпечені тут, представлені в дозованій лікарській формі з модифікованим вивільненням, яка виготовлена з використанням матриксного пристрою контрольованого вивільнення, відомого фахівцям у даній області (див. Takada зі співавт. в "Encyclopedia of Controlled Drug Delivery", Vol. 2, Mathiowitz ed., Wiley, 1999). В одному варіанті здійснення фармацевтичні композиції, забезпечені тут у дозованій лікарській формі з модифікованим вивільненням, формульовані з використанням еродованого матриксного пристрою, який містить полімери, що набухають у воді, еродовані або розчинні полімери, у тому числі синтетичні полімери і полімери природного походження, та їхні похідні, такі як полісахариди і білки. Матеріали, які придатні для отримання еродованої матриці, включають, але без обмеження, хітин, хітозан, декстран і пулулан; агарову камедь, гуміарабік, камедь карайя, камедь плодоворожкового дерева, трагакант, каррагінани, гхатті-камедь, гуарову камедь, ксантанову камедь та склероглюкан; крохмалі, такі як декстрин і мальтодекстрин; гідрофільні колоїди, такі як пектин; фосфатиди, такі як лецитин; альгінати; альгінат пропіленгліколя; желатин; колаген; і 24 UA 110853 C2 5 10 15 20 25 30 35 40 45 50 55 60 целюлозні полімери, такі як етилцелюлоза (ЕС), метилетилцелюлоза (МЕС), карбоксиметилцелюлоза (СМС), СМЕС, гідроксіетилцелюлоза (НЕС), гідроксипропілцелюлоза (НРС), ацетат целюлози (СА), пропіонат целюлози (СР), бутират целюлози (СВ), ацетат-бутират целюлози (САВ), САР, САТ, гідроксипропілметилцелюлоза (НРМС), HPMCP, HPMCAS, ацетаттримелітат гідроксипропілметилцелюлози (HPMCAT) та етилгідроксіетилцелюлоза (EHEC); полівінілпіролідон; полівініловий спирт; полівінілацетат; складні ефіри гліцерину та жирних кислот; поліакриламід; поліакрилова кислота; співполімери етакрилової кислоти або метакрилової кислоти (EUDRAGIT®, Rohm America, Inc., Piscataway, NJ); полі(2гідроксіетилметакрилат); полілактиди; співполімери L-глютамінової кислоти та етил-L-глютамат; розкладані співполімери молочної кислоти і гліколевої кислоти; полі-D-(-)-3-гідроксимасляна кислота; та інші похідні акрилової кислоти, такі як гомополімери і співполімери бутилметакрилату, метилметакрилат, етилметакрилат, етилакрилат, (2диметиламіноетил)метакрилат і хлорид (триметиламіноетил)метакрилату. У деяких варіантах здійснення фармацевтичні композиції формульовані з пристроєм, який являє собою нееродовану матрицю. Активний інгредієнт(и) розчинений або диспергований в інертній матриці та вивільняється переважно за рахунок дифузії через інертну матрицю після введення. Матеріали, які придатні для використання як матриця, що не піддається ерозії, включають, але без обмеження, нерозчинні пластики, такі як поліетилен, поліпропілен, поліізопрен, поліізобутилен, полібутадієн, поліметилметакрилат, полібутилметакрилат, хлорований поліетилен, полівінілхлорид, співполімери метилакрилату та метилметакрилату, співполімери етилену та вінілацетату, співполімери етилену та пропілену, співполімери етилену та етилакрилату, вінілхлориду співполімери з вінілацетатом, вініліденхлоридом, етиленом і пропіленом, іономер поліетилентерефталату, бутилкаучук, епіхлоргідринові каучуки, співполімер етилену та вінілового спирту, терполімер етилену/вінілацетату/вінілового спирту і співполімер етилену та вінілоксіетанолу, полівінілхлорид, пластифікований нейлон, пластифікований поліетилентерефталат, натуральний каучук, силіконові каучуки, полідиметилсилоксани, співполімери карбонату кремнію та; гідрофільні полімери, такі як етилцелюлоза, ацетат целюлози, кросповідон і зшитий частково гідролізований полівінілацетат; і жирні сполуки, такі як карнаубський віск, мікрокристалічний віск і тригліцериди. У матриксній системі з контрольованим вивільненням необхідну кінетику вивільнення можна контролювати, наприклад, шляхом варіювання типу полімеру, який використовується, в'язкості полімеру, розміру частинок полімеру й/або активного інгредієнта(ів), відношення активного інгредієнта(ів) до полімеру та інших допоміжних речовин композицій. В одному аспекті дозовані лікарські форми з модифікованим вивільненням виготовлені способами, відомими фахівцям у даній області, в тому числі пресуванням, сухою або вологою грануляцією з наступним пресуванням, грануляцією з розплаву з наступним пресуванням. У деяких варіантах здійснення матриксна система з контрольованим вивільненням включає ентеросолюбільне покриття таким чином, що вивільнення лікарського засобу здійснюється в шлунку. Пристрої з осмотичним контролем вивільнення У деяких варіантах здійснення фармацевтичні композиції, забезпечені тут у дозованій лікарській формі з модифікованим вивільненням, виготовлені з використанням пристрою з осмотичним контролем вивільнення, включаючи однокамерну систему, двокамерну систему, технологію асиметричних мембран (AMT) і витісняючу ядерну систему (ECS). Як правило, такі пристрої містять, щонайменше, два компоненти: (а) ядро, яке містить активний інгредієнт(и); і (b) напівпроникну мембрану, щонайменше, з одним каналом доставки, яка огортає ядро. Напівпроникна мембрана контролює надходження води в ядро з водного середовища, яке використовується, викликаючи вивільнення лікарського засобу в результаті витиснення через канал(и) доставки. На додаток до активного інгредієнта(ів) ядро осмотичного пристрою необов'язково містить засіб, що змінює осмотичний тиск, який створює рушійну силу, що забезпечує перенесення води з середовища, яке використовується, в ядро пристрою. Один клас засобів, що змінюють осмотичний тиск, являє собою гідрофільні полімери, що набухають у воді, які також називають "осмополімери" і "гідрогелі", які включають, але без обмеження, гідрофільні вінілові й акрилові полімери, полісахариди, такі як альгінат кальцію, поліетиленоксид (РЕО), поліетиленгліколь (PEG), поліпропіленгліколь (PPG), полі(2-гідроксіетилметакрилат), полі(акрилова) кислота, полі(метакрилова) кислота, полівінілпіролідон (PVP), поперечнозшитий PVP, полівініловий спирт (PVA), співполімери PVA/PVP, співполімери PVA/PVP, які містять гідрофобні мономери, такі як метилметакрилат і вінілацетат, гідрофільні поліуретани, які містять великі блоки РЕО, кроскармелоза натрію, каррагенан, гідроксіетилцелюлоза (HEC), гідроксипропілцелюлоза 25 UA 110853 C2 5 10 15 20 25 30 35 40 45 50 55 (НРС), гідроксипропілметилцелюлоза (HPMC), карбоксиметилцелюлоза (СМС) і карбоксіетилцелюлоза (СЕС), альгінат натрію, полікарбофіл, желатин, ксантанова камедь та натрієва сіль гліколяту крохмалю. Інший клас осмотичних засобів, що змінюють осмотичний тиск, являють собою осмогени, які можуть поглинати воду, впливаючи на градієнт осмотичного тиску на межі навколишнього покриття. Придатні осмогени включають, але без обмеження, неорганічні солі, такі як сульфат магнію, хлорид магнію, хлорид кальцію, хлорид натрію, хлорид літію, сульфат калію, фосфати калію, карбонат натрію, сульфіт натрію, сульфат літію, хлорид калію та сульфат натрію; цукри, такі як декстроза, фруктоза, глюкоза, інозитол, лактоза, мальтоза, маніт, рафіноза, сорбіт, сахароза, трегалоза та ксиліт; органічні кислоти, такі як аскорбінова кислота, бензойна кислота, фумарова кислота, лимонна кислота, малеїнова кислота, себацинова кислота, сорбінова кислота, адипінова кислота, едетова кислота, глутамова кислота, п-толуолсульфонова кислота, бурштинова кислота та винна кислота; сечовина; а також їхні суміші. Щоб змінити швидкість початкової доставки активного інгредієнта(ів) з дозованої лікарської форми, можна використовувати засоби, що змінюють осмотичний тиск, які мають різні швидкості розчинення. Наприклад, аморфні цукри, такі як Mannogeme EZ (SPI Pharma, Lewes, DE), можна використовувати для забезпечення більше швидкої доставки протягом першої пари годин для швидкого одержання бажаного терапевтичного ефекту, і поступового та безперервного вивільнення іншої кількості для підтримання бажаного рівня терапевтичного або профілактичного ефекту протягом тривалого періоду часу. У цьому випадку активний інгредієнт(и) вивільняється з такою швидкістю, яка дозволяє компенсувати кількість метаболізованого та виведеного активного інгредієнта. Ядро також може містити широкий ряд інших допоміжних речовин і носіїв, як описано тут, для підвищення ефективності дозованої лікарської форми або сприяння стабільності або обробці. Матеріали, які використовуються для отримання напівпроникної мембрани, включають різні сорти акрилових полімерів, вініли, складні ефіри, поліаміди, складні поліефіри і похідні целюлози, які є водопроникними і нерозчинними у воді при фізіологічно значимих рН або які можна зробити нерозчинними у воді шляхом хімічної зміни, такої як зшивання. Приклади полімерів, які придатні для отримання покриття, включають пластифіковані, непластифіковані та зміцнені ацетат целюлози (СА), діацетат целюлози, триацетат целюлози, пропіонат СА, нітрат целюлози, ацетат-бутират целюлози (САВ), етилкарбамат СА, САР, метилкарбамат СА, сукцинат СА, ацетат-тримелітат целюлози (САТ), диметиламіноацетат СА, етилкарбонат СА, хлорацетат СА, етилоксалат СА, метилсульфонат СА, бутилсульфонат СА, п-толуолсульфонат СА, ацетат агару, триацетат амілози, ацетат бета-глюкану, триацетат бета-глюкану, диметилацетат ацетальдегіду, триацетат камеді плодоворожкового дерева, гідроксильований етилен-вінілацетат, EC, PEG, PPG, співполімери PEG/PPG, PVP, HEC, HPC, CMC, CMEC, HPMC, HPMCP, HPMCAS, HPMCAT, полі(акрилові) кислоти і складні ефіри, а також полі(метакрилові) кислоти і складні ефіри та їхні співполімери, крохмаль, декстран, декстрин, хітозан, колаген, желатин, поліалкени, прості поліефіри, полісульфони, поліефірсульфони, полістироли, полівінілгалогеніди, полівінілові складні та прості ефіри, природні та синтетичні воски. Напівпроникна мембрана також може являти собою гідрофобну мікропористу мембрану, в якій пори в основному заповнені газом і не змочуються водним середовищем, але є проникними для водяної пари, як описано в патенті США № 5798119. Така гідрофобна, але проникна для водяної пари мембрана зазвичай складається з гідрофобних полімерів, таких як поліалкени, поліетилен, поліпропілен, політетрафторетилен, похідні поліакрилової кислоти, прості поліефіри, полісульфони, поліефірсульфони, полістироли, полівінілгалогеніди, полівініліденфторид, полівінілові складні та прості ефіри, природні та синтетичні воски. Канал(и) доставки на напівпроникній мембрані можна одержати після нанесення покриття шляхом механічного або лазерного висвердлювання. Канал(и) доставки також можуть бути формовані in situ шляхом ерозії пробки водорозчинного матеріалу або шляхом перфорації більш тонкої частини мембрани над поглибленням в ядрі. Крім того, канали доставки можуть бути формовані в процесі нанесення покриття, наприклад, як у випадку асиметричних мембранних покриттів, які відносяться до типу, розкритому в патентах США №№ 5612059 і 5698220. Загальну кількість активного інгредієнта(ів), що вивільняється, і швидкість вивільнення, найчастіше можна модулювати, варіюючи товщину та пористість напівпроникної мембрани, склад ядра, а також число, розмір і положення каналів доставки. 26 UA 110853 C2 5 10 15 20 25 30 35 40 45 50 55 60 Фармацевтичні композиції в дозованій лікарській формі з осмотичним контролем вивільнення можуть, крім того, містити додаткові звичайні допоміжні речовини або носії, описані тут, для поліпшення характеристик або обробки лікарської форми. Дозовані лікарські форми з осмотичним контролем вивільнення можуть бути виготовлені відповідно до звичайних способів і методів, відомих фахівцям у даній області (дивися Remington: The Science and Practice of Pharmacy, вище; Santus і Baker, J. Controlled Release 1995, 35, 1-21; Verma зі співавт., Drug Development and Industrial Pharmacy 2000, 26, 695-708; Verma зі співавт., J. Controlled Release 2002, 79, 7-27). В інших варіантах здійснення фармацевтичні композиції, забезпечені тут, формульовані у вигляді дозованої лікарської форми АМТ з контрольованим вивільненням, яка містить асиметричну осмотичну мембрану, що покриває ядро, до складу якої входить активний інгредієнт(и) та інші фармацевтично прийнятні допоміжні речовини. Дивися патент США № 5612059 і WO 2002/17918. Дозовані лікарські форми АМТ з контрольованим вивільненням можуть бути виготовлені відповідно до звичайних способів і методів, відомих фахівцям у даній області, включаючи пряме пресування, суху грануляцію, вологу грануляцію та нанесення покриття зануренням. У деяких варіантах здійснення фармацевтичні композиції, забезпечені тут, формульовані у вигляді дозованої лікарської форми ESC з контрольованим вивільненням, яка містить осмотичну мембрану, що покриває ядро, до складу якої входить активний інгредієнт(и), гідроксіетилцелюлоза та інші фармацевтично прийнятні допоміжні речовини або носії. Багатошарові таблетки В одному аспекті лікарська форма з контрольованим вивільненням представлена у формі багатошарової таблетки. Багатошарові таблетки включають інертне ядро, на яке шарами нанесений лікарський засіб (плюс необов'язково допоміжні речовини) з наступним ентеросолюбільним покриттям. Другий шар лікарського засобу нанесений на перше ентеросолюбільне покриття з наступним другим ентеросолюбільним покриттям, нанесеним на другий шар лікарського засобу. Ентеросолюбільні покриття повинні гарантувати вивільнення лікарського засобу з кожного шару з інтервалом, щонайменше, 3-6 годин. Негайне вивільнення У деяких варіантах здійснення фармацевтичні композиції, забезпечені тут у дозованій лікарській формі з негайним вивільненням, забезпечують вивільнення не менше 75 % терапевтично активного інгредієнта або комбінації, та/або відповідають вимогам за розпаданням або розчиненням для таблеток із негайним вивільненням конкретних терапевтичних агентів або комбінації, що міститься в ядрі таблетки, як зазначено в USP XXII, 1990 (The United States Pharmacopeia.) Фармацевтичні композиції з негайним вивільненням включають капсули, таблетки, пероральні розчини, порошки, кульки, пелети, частинки і тому подібне. Парентеральне введення У деяких варіантах здійснення фармацевтичні композиції для місцевого або системного введення, забезпечені тут, можна вводити парентерально шляхом ін'єкції, інфузії або імплантації. Парентеральне введення в даному описі включає внутрішньовенне, внутрішньоартеріальне, внутрішньочеревинне, внутрішньооболонкове, внутрішньошлуночкове, внутрішньоуретральне, надчеревне, внутрішньочерепне, внутрішньом'язове, внутрішньосуглобне та підшкірне введення. В інших варіантах здійснення фармацевтичні композиції, забезпечені тут, можуть бути формульовані в будь-які дозовані лікарські форми, придатні для парентерального введення, включаючи розчини, суспензії, емульсії, міцели, ліпосоми, мікросфери, наносистеми і тверді форми, які придатні для приготування розчинів або суспензій у рідині перед ін'єкцією. Такі дозовані лікарські форми можуть бути виготовлені за допомогою звичайних способів, відомих фахівцям в області фармацевтики (дивися Remington: The Science and Practice of Pharmacy, вище). Фармацевтичні композиції, які передбачаються для парентерального введення, можуть включати один/одну або більше фармацевтично прийнятних носіїв і допоміжних речовин, включаючи, але без обмеження, водні середовища, які змішуються з водою середовища, неводні середовища, протимікробні засоби або консерванти, які захищають від росту мікроорганізмів, стабілізатори, засоби, які підвищують розчинність, засоби, які регулюють тонічність, забуферувальні засоби, антиоксиданти, місцеві знеболюючі засоби, суспендуючі та диспергуючі засоби, зволожуючі або емульгуючі засоби, комплексоутворюючі засоби, сполучні або хелатуючі засоби, кріопротектори, ліопротектори, загущаючі засоби, регулятори рН та інертні гази. 27 UA 110853 C2 5 10 15 20 25 30 35 40 45 50 55 60 Придатні водні середовища включають, але без обмеження, воду, сольовий розчин, фізіологічний розчин або фосфатний буферний розчин (PBS), ін'єкційний розчин хлориду натрію, ін'єкційний розчин Рінгера, ізотонічний розчин декстрози для ін'єкцій, стерильну воду для ін'єкцій, розчин декстрози і лактатовмісний розчин Рінгера для ін'єкцій. Неводні середовища включають, але без обмеження, нелетучі масла рослинного походження, касторове масло, кукурудзяне масло, бавовняне масло, маслинове масло, арахісове масло, масло м'яти перцевої, сафлорове масло, кунжутне масло, соєве масло, гідрогенезовані рослинні масла, гідрогенезоване соєве масло та середньоланцюгові тригліцериди кокосового масла та масла пальмових насінин. Середовища, які змішуються з водою, включають, але без обмеження, етанол, 1,3-бутандіол, рідкий поліетиленгліколь (наприклад, поліетиленгліколь 300 і поліетиленгліколь 400), пропіленгліколь, гліцерин, N-метил-2-піролідон, диметилацетамід і диметилсульфоксид. Придатні протимікробні засоби або консерванти включають, але без обмеження, феноли, крезоли, ртутні препарати, бензиловий спирт, хлорбутанол, метил- і пропіл-п-гідроксибензоати, тимеросал, бензалконію хлорид, бензетонію хлорид, метил- і пропілпарабени і сорбінову кислоту. Придатні засоби для регуляції тонічності включають, але без обмеження, хлорид натрію, гліцерин і декстрозу. Придатні забуферувальні засоби включають, але без обмеження, фосфати і цитрати. Придатні антиоксиданти включають антиоксиданти, описані в даному документі, в тому числі бісульфіт і метабісульфіт натрію. Придатні місцеві знеболюючі включають, але без обмеження, гідрохлорид прокаїну. Придатні суспендуючі та диспергуючі засоби включають суспендуючі та диспергуючі речовини, описані в даному документі, в тому числі карбоксиметилцелюлозу натрію, гідроксипропілметилцелюлозу та полівінілпіролідон. Придатні емульгуючі засоби включають засоби, описані в даному описі, в тому числі поліоксіетиленсорбіту монолаурат, поліоксіетиленсорбіту моноолеат 80 і триетаноламіну олеат. Придатні сполучні або хелатуючі засоби включають, але без обмеження, EDTA. Придатні засоби, які регулюють рН, включають, але без обмеження, гідроксид натрію, соляну кислоту, лимонну кислоту та молочну кислоту. Придатні комплексоутворюючі засоби включають, але без обмеження, циклодекстрини, у тому числі альфа-циклодекстрин, бета-циклодекстрин, гідроксипропіл-бета-циклодекстрин, сульфобутиловий ефір-бета-циклодекстрин, і сульфобутиловий ефір 7-бета-циклодекстрин (CAPTISOL®, CyDex, Lenexa, KS). У деяких варіантах здійснення фармацевтичні композиції, забезпечені тут, можуть бути формульовані для введення однієї або множини доз. Лікарські форми, які містять разову дозу, впаковані в ампулу, флакон або шприц. Лікарські форми для парентерального введення, які містять множину доз, повинні містити протимікробний засіб у бактеріостатичних або фунгістатичних концентраціях. Всі парентеральні лікарські форми повинні бути стерильними, як відомо і прийнято в даній області. В одному варіанті здійснення фармацевтичні композиції забезпечені у вигляді готових до використання стерильних розчинів. В іншому варіанті здійснення фармацевтичні композиції забезпечені у вигляді стерильних сухих розчинних продуктів, які включають ліофілізовані порошки і гіподермальні таблетки, призначені для відновлення середовищем перед застосуванням. У ще іншому варіанті здійснення фармацевтичні композиції забезпечені у вигляді готових до використання стерильних суспензій. У ще іншому варіанті здійснення фармацевтичні композиції забезпечені у вигляді стерильних сухих нерозчинних продуктів, призначених для відновлення середовищем перед застосуванням. У ще іншому варіанті здійснення фармацевтичні композиції забезпечені у вигляді готових до використання стерильних емульсій. Фармакокінетичний аналіз В одному варіанті здійснення будь-який стандартний протокол фармакокінетичної оцінки застосовується для визначення профілю концентрації у плазмі крові в людей після введення лікарської форми, описаної в даному документі, яка включає інгібітор HDAC (напр., Сполуку 1), і, таким чином, установлення, чи відповідає дана лікарська форма фармакокінетичним і фармакодинамічним критеріям, викладеним у даному документі. Наприклад, рандомізоване перехресне дослідження однократної дози проводили з використанням групи здорових дорослих суб'єктів-людей. Кількість суб'єктів повинна бути достатньою для забезпечення адекватного контролю відхилення в статистичному аналізі та зазвичай становить близько 10 або більше, хоча для деяких цілей менша група є достатньою. Кожний суб'єкт одержує введення в нульовий момент часу одноразової дози (напр., дози, що містить приблизно від 10 мг до 300 мг Сполуки 1). Зразки крові збирають від кожного суб'єкта перед введенням (напр., за 15 хвилин) і через декілька інтервалів часу після введення. У деяких випадках декілька зразків беруть протягом першої години і після цього беруть рідше. Наприклад, зразки крові збирають у 28
ДивитисяДодаткова інформація
Назва патенту англійськоюFormulations of histone deacetylase inhibitor in combination with bendamustine and uses thereof
Автори англійськоюLoury, David, J., Buggy, Joseph, J., Mody, Tarak, D., Verner, Erik, J., Purro, Norbert, Balasubramanian, Sriram, Kloos, Ioana, Depil, Stephane
Автори російськоюЛури Дэвид Джэй., Багги Джозеф Джэй., Моди Тарак Ди., Вернер Эрик Джэй., Пурро Норберт, Баласубраманиан Срирам, Клус Иоана, Дэпил Стэфан
МПК / Мітки
МПК: A61K 31/343, A61K 31/16, C07D 213/68, A61K 31/166, C07D 307/78, A61P 35/00, C07D 491/10
Мітки: їхнє, гістондеацетилази, лікарські, форми, комбінації, бендамустином, застосування, інгібітора
Код посилання
<a href="https://ua.patents.su/58-110853-likarski-formi-ingibitora-gistondeacetilazi-u-kombinaci-z-bendamustinom-ta-khneh-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Лікарські форми інгібітора гістондеацетилази у комбінації з бендамустином та їхнє застосування</a>
Попередній патент: Аерозольний інгалятор
Наступний патент: Пристрій для зменшення тертя між двома дисками ротаційного фільтра і застосування його для фільтрації
Випадковий патент: Пристрій для приготування цитологічного препарату фіксованого розміру з пухкої тканини