Спосіб одержання біологічно активної речовини, що має регенераторну та модулюючу дію
Номер патенту: 10180
Опубліковано: 15.05.2001
Автори: КАТРУШОВ ОЛЕКСАНДР ВАСИЛЬОВИЧ, Кайдашев Ігор Петрович
Формула / Реферат
Спосіб одержання біологічно активної речовини, що має регенераторну та модулюючу дію, який включає зневоднення роздрібненого тканинного матеріалу в органічному розчиннику при температурі 4°С протягом 12 годин, висушування, кислотну екстракцію в присутності 0,1% хлориду цинку при температурі 4°С, фільтрацію реакційної суміші, осадження із фільтрату органічним розчинником, обробку одержанного осаду сумішшю ацетоне з ефіром та виділення кінцевого продукту, який відрізняється тим, що в ролі тканинного матеріалу використовують коркову речовину нирки, як органічний розчинник - суміш ацетону та етанолу у співвідношенні 1:1, екстракцію ведуть протягом 48 годин 0,1%-ною трифтороoцтовою кислотою з додатковим введенням 0,1% хлориду магнію, а виділення продукту здійснюють фільтрацією розчиненого в дистильованій воді осаду після обробки ефіром на мембранах, що пропускають молекули з масою менше 10 kD.
Текст
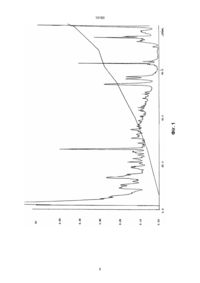
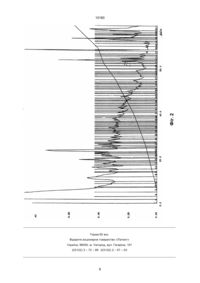
Спосiб одержання бiологiчно активної речовини, що має регенераторну та модулюючу дiю, який включає зневоднення роздрiбненого тканинного матерiалу в органiчному розчиннику при температурi 4оС протягом 12 годин, висушування, кислотну екстракцiю в присутностi 0,1% хлориду цинку при температурi 4оС, фiльтрацiю реакцiйної сумiшi, осадження iз фiльтрату органiчним розчинником, обробку одержаного осаду сумiшшю ацетону з ефiром та видiлення кiнцевого продукту, який вiдрiзняється тим, що в ролi тканинного матерiалу використовують коркову речовину нирки, як органiчний розчинник – сумiш ацетону та етанолу у спiввiдношеннi 1:1, екстракцiю ведуть протягом 48 годин 0,1%-ною трифторооцтовою кислотою з додатковим введенням 0,1% хлориду магнiю, а видiлення продукту здiйснюють фiльтрацiєю розчиненого в дистильованiй водi осаду пiсля обробки ефiром на мембранах, що пропускають молекули з масою менше 10 кD. В.Ш. (13) 10180 (11) UA Але, даний препарат не володiє органоспецифiчнiстю при лiкуваннi патологiй конкретних органiв, зокрема, нирок, а лише коррегує неспецифiчнi порушення в системах iмунiтету, гемостазу та неспецифiчної резистентностi органiзму. В основу винаходу поставлено задачу удосконалення способу одержання бiологiчно активної речовини, у якому за рахунок використання нового тканинного матерiалу та умов проведення дiй, одержана речовина володiє органоспецифiчною регенераторною дiєю на спецiалiзованi тканини нирок, що забезпечує вiдновлення порушених структур та функцiй нирок. Поставлена задача вирiшується тим, що у способi одержання бiологiчно активної речовини, що вмiщує зневоднення роздрiбненого тканинного матерiалу в органiчному розчиннику при +4oC на протязi 12 годин, екстракцiю, фiльтрацiю реакцiйної сумiшi, осадження iз фiльтрату органiчним розчинником, обробку одержаного осаду ефiром з послiдуючим видiленням препарату згiдно винаходу, в якостi тканинного матерiалу використовують коркову речовину нирки, в якостi органiчного розчинника для зневоднення матерiалу та осадження використовують сумiш ацетону та етанолу у спiввiдношеннi 1:1, екстракцiю ведуть 0,1% трифтороцтовою кислотою з введенням додатково 0,1% хлориду магнiю, а бiологiчно активну речовину ви (19) Винахiд стосується галузi медицини та може бути використаний у бiотехнологiї добування бiологiчно активної речовини (БАР) полiпептидної природи, яка володiє органоспецифiчною регенераторною та модулюючою дiєю для лiкування ниркової патологiї. В теперiшнiй час гостро стоїть проблема лiкування ниркової патологiї (нефрити, нефрози). Iснуючi препарати для лiкування подiбної патологiї не володiють властивiстю регенерувати структурнi елементи нирки. Найбiльш близьким до способу, що описується, є спосiб одержання бiологiчно активної речовини, яка володiє регенераторною та модулюючою дiєю, зокрема тималiну, що складається з зневодження, роздрiблення до розмiрiв 2х2х2мм тимусу, попередньо очищеного вiд жиру, судин та iн., в ацетонi, у спiввiдношеннi 1:8, при +4оС на протязi 12 годин, висушування обробленого тимусу, його екстракцiю 3% розчином оцтової кислоти (рН 4,5) в присутностi 0,1% хлориду цинку при +4oC на протязi 72 годин, фiльтрацiю реакцiйної сумiші, осадження iз фiльтрату ацетоном, взятим в спiввiдношеннi 1:10 при +4oC на протязi 12 годин, обробку одержаного осадка сумiшшю ацетону з ефiром, сушiння та лiофiлiзацiю продукту. Тималiн, одержаний за вiдомим способом знаходить використання при лiкуваннi хронiчних гломерулонефритiв. C2 ____________________ 10180 ацетон-етанол при спiввiдношеннi (1:10) при +4oC 12 годин. Осад збирають та вiдмивають ефiром для видалення залишкiв трифтороцтової кислоти. Пiсля цього осад розчиняють в дистильованiй водi при рН 5,0 та проводять фiльтрацiю на патронах "Centricon-10", що забезпечує отримання речовин з вагою < 10 kD. Пiсля цього екстракт ниркової тканини лiофiлiзують з одержанням чистого продукту. Вивчення фiзико-хiмiчних властивостей речовини продемонструвало наявнiсть позитивної бiуретової реакцiї, що свiдчить про її пептидну природу в отриманому екстрактi. Нами методом високоефективної рiдинної хроматографiї з оберненими фазами було порiвняно хроматографiчний спектр тiмалiну та речовини, отриманої за заявляємим способом. дiляють фiльтрацiєю розчиненого в дистильованiй водi осаду пiсля обробки ефiром на мембранах, пропускаючих молекули з масою нижче 10 кD. Спосiб здiйснюється слiдуючим чином. Коркова частина тканин нирки роздрiбнюється до розмiрiв 2х2х2 мм, пiсля чого зневоджується у сумiшi ацетон-етанол (1:1) на протязi 12 годин при +4oC. Змiна спiввiдношення ацетон-етанол, як в бiльший, так i в менший бiк приводить до зменшення виходу продукту та зниженню його специфiчної дiї. Пiсля чого проводиться екстракцiя 0,1% розчином трифтороцтової кислоти з 0,1% хлориду цинку i 0,1% хлориду магнiя (рН 2,5). Таким чином, бiльш кисла реакцiя реакцiйної сумiшi та присутнiсть катiонiв магнiю забезпечують бiльшу екстракцiйну силу сумiшi. Екстракцiя триває 48 годин при +4oC при постiйному перемiшуваннi. В цей час 0,1% розчин трифтороцтової кислоти не тiльки екстрагує полiпептиднi речовини, але й осаджує великi бiлки, що засорюють екстракт. Пiсля фiльтрування реакцiйної сумiшi її обробляють сумiшшю тiєю ж Дослiдження виконано на хроматографi SMART tm SYSTEM "Pharmacia" Sweeden. Режим дослiдження: колонка mRPS C2/C8 – SC 2.1/10; градiєнтна подача елюєнту: час, хв 6 26 39,5 54,5 61,5 68,5 78,5 79,5 %, "В" 0 10 20 35 45 50 70 75 розчин "А" – 0,1 трифтороцтова кислота; розчин "В" – 0,085% трифтороцтова кислота в 80% ацетонiтрилi. Детектування проводили при 214 нм. На фiг. 1 надано хроматографiчний спектр полiпептидiв тiмусу в препаратi "тiмалiн". Звертає увагу наявнiсть хроматографiчних фракцiй iз значною питомою вагою з часом утримання 15 – 27 – 52 – 56 i 57 хвилин. На фiг. 2 надано хроматографiчний спектр полiпептидної речовини, отриманої запропонованим способом. На вiдмiну вiд "тiмалiну" речовина мiстить фракцiї з часом утримання 11 – 19 – 23 – 67 хвилин. Крiм того, було вивчено вмiст амiнокислот в отриманiй речовинi. Таблиця 1 Порiвняння вмiсту окремих амiнокислот у препаратi "тiмалiн" та заявляємiй БАР Назва амiнокислот Амінокислотний склад поліпептидів тимусу, % Амінокислотний склад поліпептидів нирок, % Цистеiн 3,4 – Аспарагiн 5,8 2,19 Треонiн 5,7 2,43 Серiн 5,7 2,05 Глутамiн 6,2 3,76 Пролiн 10,1 8,16 Глiцин 8,6 8,31 Аланiн 10,7 4,97 Валiн 8,8 7,62 Метiонiн – 1,17 Iзолейцiн 3,9 5,92 Лейцiн 6,7 3,29 Тирозiн 2,4 3,89 Фенiлаланiн 3,2 2,92 Гiстидiн 2,9 3,19 Лiзiн 7,0 15,33 Аргинiн 8,5 8,45 Триптофан сліди 0,61 Лiзiн/Аргiнiн 0,8 1,82 2 10180 Таблиця 1 демонструє суттєвi вiдмiни амiнокислотного складу тималiну i отриманої речовини. Для вивчення її органоспецифiчної дiї було проведено експерименти з органiчною нирковою патологiєю. В дослiдах не виявлено токсичностi препарату. Експеримент був проведений на 40 бiлих щурах лiнiї "Wistar" обох статей, середньої маси 200 г. Експериментальний нефрит Хейманна викликали по методицi [Kment A. et al., 1976]. Про його виникнення судили на основi морфологiчних змiн в тканинах нирки (гiстологiчнi зрiзи фарбували гематоксилин-еозином згiдно загальноприйнятим методам). Гiстологiчнi спостереження проводили при об'єктивi 10-кратного збiльшення та подальшому мiкрофотографуваннi. Смертностi тварин не вiдмiчалося. Для вивчення впливу БАР на стан деяких захисних систем були проведенi дослiди in vitro з кров'ю iнтактних морських свинок. У тварин вiдбирали до 20 мл кровi, яку стабiлiзували 3,8% розчином цитрату натрiю. Кров, не змiшуючи, подiляли на 6 проб по 10 мл в кожнiй. Подалi кожна проба була знов подiлена на двi частини по 5 мл, з яких одна мала бути контрольною, а друга – дослiдною. В контрольнi проби (К) вносили по 0,1 мл 0,15 М розчину NaCl, а в дослiднi (Д) – по 0,1 мл такого ж розчину, який мав 0,1 мг сухого препарату (з розрахунку 0,02 мг препарату на 1 мл кровi). Кров з вказаними домiшками iнкубували на протязi 30 хвилин при 37оС. В плазмi кровi визначали час ре кальцiфiкацiї, каолiновий, тромбiновий, протромбiновий час, активований частковий тромбiновий час (АЧТЧ), концентрацiю ТБК-реагуючих продуктiв в еритроцитах до та пiсля iнкубацiї в прооксидантному буферному розчинi (при цьому утворюється малоновий диальдегiд – МДА – показник рiвня пероксидацiї), спонтанний гемолiз еритроцитiв (ПРЕ), активнiсть супероксиддисмутази (СОД), згiдно загально прийнятим методам. Статистична обробка результатiв проводилась по програмi для обчислення критерiя Ст'юдента для вибiрок з попарнозв'язаними варiантами. Оцiнка ефективностi впливу БАР базується на дослiдних результатах, якi поданi в таблицях 1– 2 та на мiкрофото. Гiстологiчнi дослiдження показали, що у щурiв другої групи розвиваються ексудативно-пролiферативнi процеси з вираженими дистрофiчними i некротичними змiнами канальцiв нирок, що характеризують пiдгостре протiкання гломерулонефриту (мiкрофото 1). У тварин третьої групи пiд впливом введення полiпептидного препарата гiстологiчно вiдмiчалось значне покращення (мiкрофото 2): бiльша частина дiлянок тканини без видимих змiн, збережений малюнок клубочкiв та iзвитих канальцiв, але не дивлячись на це зустрiчаються дiлянки з дистрофiєю проксимальних канальцiв. Пiсля моделювання аутоiмунного нефриту Хеймана у щурiв спостерiгали явнi порушення процесiв перекисного окислення гемокоагуляцiї, мiкроциркуляторного гемостазу (таблиця 2). Таблиця 2 Показники зсiдання кровi i перекисного окислення лiпiдiв у iнтактних щурiв та у тварин з нефритом Хеймана з введенням фiзiологiчного розчину (контроль) та БАР, що заявляється Показник Групи тварин 1-a 2-а 3-я інтактні контрольні дослідні Зсідання крові Час рекальцифiкацiї плазми, (с) 86+2 125,4+2,4* 97,4+2,2* 21,5+0,9 22,48+1,10 20,2+1,1 Тромбiновий час, (с) 22,75+0,78 35,8+1,2** 27,7+0,8* Активований частковий тромбопластиновий час, (с) 23,75+2,00 25,0+2,0 28,0+2,0 23,5+0,5 14,8+0,6* 25,2+0,8* 237,25+10,30 75,6+3,1* 206,6+8,3* Протромбiновий час, (с) Активнiсть антитромбiну, (с) Час фiбринолiзу, (хв) Тромбоцитарний гемостаз Швидкiсть агрегацiї тромбоцитiв, (град) 62,0+0,62 67,13+0,66*** 60,20+0,34*** Ступiнь агрегацiї (Е, мм) 29,87+0,34 30,40+0,34 28,67+0,34** Час агрегацiї, (хв) 12,07+0,24 6,53+0,19*** 10,27+0,20*** 2,39+0,01 2,52+0,02* 2,43+0,07* 135 109 130 371,5+16,1 518,9+25,3* 584,0+30,0* Антиоксидантний статус Вмiст МДА (кров), (мкмоль/л) Прирiст МДА за 1,5 години iнкубацiї, (%) Вмiст церулоплазмина сиворотки, (мг/л) 3 10180 Продовження табл. 2 Показник Групи тварин 1-a 2-а 3-я інтактні контрольні дослідні каталаза 1,18+0,06 2,44+0,12** 47+0,16** СОД 0,68+0,02 2,46+0,09* 1,84+0,03* Вмiст МДА в тканинах нирки, (мкмоль/кг) 2,57+0,11 3,57+0,17** 2,98+0,15* 157 139 149 2,01+0,20 3,35+0,19* 2,79+0,15* Активнiсть ферментiв кровi (ОД): Прирiст за 1,5 години iнкубацiї, (%) Активнiсть СОД (нирки), (ОД) Знайдено збiльшення часу рекальцифiкацiї плазми, тромбiнового часу, значне зниження активностi антитромбiну III, поява в усiх випадках позитивних результатiв етанолового i b-нафтолового тестiв. Розвиток патологiчних процесiв в паренхімi нирки як правило приводять до змiн фiбрiнолiтичних властивостей кровi. Як видно з таблицi нефрит Хеймана викликав прискорення еуглобулiнового лiзiсу. В 2 групi тварин пiд впливом ниркової тканини збiльшувалась швидкiсть (кут агрегацiї) i час агрегацiї тромбоцитiв субстратної плазми. Вмiст кiнцевого продукту перекисного окислення лiпiдiв – малонового дiальдегiда (МДА) в мембранах еритроцитiв i тканинах нирки при розвитку патологiї пiдвищувалась. Зросли активностi антиоксидантних ферментiв каталази та субстратiндуцiбельної супероксиддiсмутази (СОД), а також концентрацiя "реактанта гострої фази" – церулоплазмiну. Пiд дiєю препарату знижувався вмiст активних ТБК-реагуючих продуктiв в мембранах еритроцитiв, вiдновлювався прирiст МДА за час iнкубацiї. Як представлено в таблицi, активнiсть антиоксидантних ферментiв змiнювалася рiзнонаправлено: активнiсть церулоплазмiну ще бiльше пiдвищувалася, а СОД, хоч i знижувалася в порiвняннi з аналогiчним показником у щурiв 2 групи, але залишалося на високому рiвнi, активнiсть каталази нез начно пiдвищувалась, в тканинах нирки активнiсть СОД знижувалась одночасно iз зменшенням рiвня МДА. Пептиди у тварин з нефритом Хеймана наближали до нормальних значень час рекальцифiкацiї плазми, тромбiновий час, рiвень антитромбiну III, час лiзiсу еуглобулiнiв. Паракоагуляцiйнi тести давали негативнi результати. Вплив ниркової тканини на агрегацiю тромбоцитiв вiдновлювався – зменшувалась швидкiсть та збiльшувався час агрегацiї (див. таблицю 2). Таким чином, iндукцiя нефриту Хеймана викликає гiпокоагуляцiю, прискорення фiбрiнолiзу з накопиченням в кровотоцi патологiчних типiв фiбрину, зниження антиагрегацiйної активностi ниркової тканини. Вказанi змiни були оцiненi як прояв синдрому диссемiнiрованого внутрiшньосудинного зсiдання кровi в стадiї коагулопатiї споживання, цi реакцiї протiкали одночасно з активацiєю процесiв пероксидацiї на фонi адекватного антиоксидантного захисту. Введення речовини, одержаної даним способом, викликало зниження рiвню пероксидацiї в кровi i тканинах, вiдновлення антиагрегацiйної активностi нирки, зникнення продуктiв паракоагуляцiї, нормалiзацiю фiбринолiзу. Таким чином, БАР проявляє виражену модулюючу дiю при гострiй нирковiй патологiї. Мікрофото 1 Мікрофото 2 4 Фіг. 1 10180 5 Фіг. 2 10180 Тираж 50 екз. Відкрите акціонерне товариство «Патент» Україна, 88000, м. Ужгород, вул. Гагаріна, 101 (03122) 3 – 72 – 89 (03122) 2 – 57 – 03 6
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for obtaining biologically active substance possessing regenerating and modulating activities
Автори англійськоюKardashiev Ihor Petrovych, Katrushov Oleksandr Vasyliovych
Назва патенту російськоюСпособ получения биологически активного вещества, обладающего регенераторным и модулирующим действием
Автори російськоюКайдашев Игорь Петрович, Катрушов Александр Васильевич
МПК / Мітки
МПК: A61K 35/23
Мітки: має, речовини, активної, регенераторну, модулюючу, одержання, дію, біологічно, спосіб
Код посилання
<a href="https://ua.patents.su/6-10180-sposib-oderzhannya-biologichno-aktivno-rechovini-shho-maeh-regeneratornu-ta-modulyuyuchu-diyu.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання біологічно активної речовини, що має регенераторну та модулюючу дію</a>
Попередній патент: Вібраційний пристрій для визначення фізичних властивостей речовин
Наступний патент: Спосіб одержaння плівки розплаву гранулята на поверхні
Випадковий патент: Стаціонарна установка для прогрівання систем тепловозів та дизель-поїздів