Спосіб пригнічення розвитку контамінуючих бактерій при розмноженні рослин in vitro
Номер патенту: 112377
Опубліковано: 25.08.2016
Автори: Харіна Алла Володимирівна, Корнієнко Наталія Олегівна, Поліщук Валерій Петрович, Заіка Сергій Анатолійович
Формула / Реферат
Спосіб пригнічення розвитку контамінуючих бактерій при розмноженні рослин in vitro, який включає поверхневу стерилізацією рослинних експлантів або насіння за допомогою бактерицидних сполук з їх відмиванням стерильною дистильованою водою після обробки, висадження рослинних експлантів або насіння на поживні середовища, який відрізняються тим, що в процесі їх приготування перед застиганням у культуральне середовище додається суміш бактеріофагів у концентрації 105-8 БУО/мл, бактеріофаги наносяться також на середовище перед безпосереднім внесенням експлантів, при цьому використовують бактеріофаги, специфічні до фітопагенних та епіфітних бактерій рослин, що попередньо виділені зі зразків води, ґрунту або рослинного матеріалу шляхом їх інкубації з бактеріальною тест-культурою протягом 8-14 годин, та позбавлення отриманої суміші від супутньої мікрофлори центифугуванням при 3000-5000 об/хв. 20-30 хв., додаванням розчину хлороформу та фільтрації супернатанту крізь бактеріальний фільтр dпоp=0,2 mм, причому виділені бактеріофаги накопичуються і концентруються.
Текст
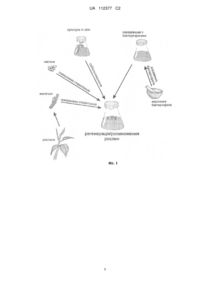
Реферат: Винахід стосується способу пригнічення розвитку сторонньої мікрофлори при розмноженні рослин in vitro за рахунок додавання бактеріофагів, і належить до галузі біотехнології рослин, зокрема до мікроклонального розмноження in vitro. Спосіб включає виділення бактеріофагів, здатних лізувати контамінуючі бактерії на всіх стадіях мікроклонального розмноження рослин. Для отримання препаратів бактеріофагів оброблені зразки (вода, ґрунт, рослинний матеріал) інкубують з бактеріальною культурою протягом 8-14 год. за умов сприятливих для росту вибраної тест-культури. Надалі отриману суміш позбавляють від супутньої мікрофлори центифугуванням при 3000-5000 об/хв. 20-30 хв., додаванням розчину хлороформу та фільтрації супернатанту крізь бактеріальний фільтр 5-8 dпор=0,2 м. Виділені віруси накопичують і концентрують. Бактеріофаги у концентрації 10 БУО/мл додають у культуральне середовище перед його застиганням і наносять на поверхню середовища перед безпосереднім висадженням експлантів, насіння, асептичних тканин або регенерантів. Винахід дозволяє підвищити ефективність ініціації асептичних культур (як декоративних, так і цінних сільськогосподарських рослин), збільшити відсоток виходу рослинного матеріалу, вільного від патогенів. UA 112377 C2 (12) UA 112377 C2 UA 112377 C2 5 10 15 20 25 30 35 40 45 50 55 60 Винахід належить до галузі біотехнології рослин, зокрема до мікроклонального розмноження in vitro з подальшим застосування у сільськогосподарській практиці з метою підвищення врожайності рослин. Проблемою при роботі з культурами рослин in vitro є контамінація поживних середовищ бактеріями, які колонізують рослинні організми та насіння. Контамінуючі бактерії можуть бути внесені при первинній інтродукції експлантів або насіння у культуру in vitro або в результаті субкультивування рослинної тканини чи регенерованих рослин на свіжі поживні середовища. Контамінація рослинної тканини бактеріями призводить до розвитку бактеріозів рослинрегенерантів зумовлюючи псування культурального середовища токсичними продуктами метаболізму бактерій, що завершується загибеллю рослин і унеможливлює отримання здорового посадкового матеріалу, безвірусних рослин та модифікацію рослин. Захистити культури in vitro можна за допомогою бактеріофагів, які зарекомендували себе як дієві протимікробні агенти [Jones J.B., Jackson L.E., Balogh В. et al. Bacteriophages for Plant Disease Control // Annu. Rev. Phytopathol. - 2007. - Vol. 45. – P. 245-262]. Відомий спосіб проведення жорсткої стерилізації експлантів рослин або насіння перед введенням в культуру in vitro із застосуванням декількох бактерицидних сполук таких як етанол, гіпохлорит натрію, сулема, пероксид водню [М.Д. Мельничук, Т.В. Новак, В.А. Кунах / Біотехнологія рослин. За ред. професора В.Д. Мельничука. - К.: Вища освіта, 2003. - 520 с.]. Головним недоліком цього способу є високий відсоток відмирання експлантів. Розроблений спосіб проведення термотерапії з метою позбавлення експлантів рослин від контамінуючих мікроорганізмів [Robert N. Trigiano, Dennis J. Gray. Plant Tissue Culture, Development, and Biotechnology / 2005. - CRC Press LLC-358 p.]. Цей спосіб має ряд недоліків, а саме: тривалість обробки, недостатня ефективність, негативний вплив на процес регенерації рослин. Крім того методика є більш ефективною при елімінації патогенів вірусної природи, в той час як її ефективність відносно бактеріальних контамінантів є значно нижчою. Інший відомий спосіб як прототип запропонованого винаходу передбачає додавання у середовище для культивування рослин антибіотики [С. Leifert, A. Cassells. Microbial hazards in plant tissue and cell cultures /Tin Vitro Cellular & Developmental Biology-Plant Volume. - 2001, 37, Issue 2, pp. 133-138]. Серед недоліків цього способу слід відмітити низьку ефективність препаратів у зв'язку з циркуляцією резистентних штамів контамінуючих бактерій та токсичний вплив на рослинну тканину. Технічною задачею винаходу є збільшення ефективності препаратів, підвищення відсотка розмноження вільних від інфекцій рослин в умовах in vitro, що сприяє підвищенню врожайності сільськогосподарських культур. Поставлена задача вирішується шляхом внесення у живильні середовища, на яких відбувається або регенерація або культивування рослин in vitro, суміші літичних ізолятів фагів. Бактеріофаги вносять шляхом додавання 5 мл фагової суміші в 200 мл застигаючого поживного середовища MS і накапування на готове середовище безпосередньо перед внесенням рослинних об'єктів. Ефективність запропонованого способу підтверджується експериментальними даними. Суть винаходу додатково пояснюється ілюстраціями: Фіг. 1 - Схематичний механізм способу розвитку сторонньої мікрофлори при розмноженні рослин in vitro за рахунок додавання бактеріофагів для пригнічення; Фіг. 2 - Порівняння рослин у колбі без додавання фагової суміші (А) та у колбі з додаванням бактеріофагів у культуральне середовище (Б). Приклад реалізації Асептичні рослини томатів отримують шляхом поверхневої стерилізації насіння за загально прийнятою методикою [Мусієнко М.М., Панюта О.О. Культура ізольованих клітин, тканин і органів рослин. - К.: Фітосоціоцентр, 2001. - С. 13-22] з наступним їх пророщенням на стерильному безгормональному середовищі MS [Murashige Т., Skoog F. A revised medium for rapid growth and bio-assays with tobacco tissue cultures // Physiol. Plant. - 1962. - Vol. 15, Is. 3. – P. 473-497]. Після утворення у рослин 4 справжніх листків проводять їх субкультивування з імітацією можливого зараження бактерією. Ізоляти бактеріофагів виділяють з рослинного матеріалу методом збагачення. Зразки відбирають за наявністю симптомів бактеріального ураження у вигляді локальних та системних м'яких бурих гнилей, некрозів стебел та коренів, виділення ексудату з плодів. При виділенні бактеріофагів методом збагачення ділянки із м'якою мацерацією рослинних тканин поверхнево знезаражують промиванням у стерильній дистильованій воді з наступною обробкою кутикул 75 % р-м етилового спирту. Надалі бактеріальною петлею переносять вміст зони ураження у пробірку із рідким літичним середовищем і залишають її в термостаті за температури 27 °C на 1 UA 112377 C2 5 10 48 годин. Далі поживне середовище центрифугують у режимі 3000-5000 об/хв. протягом 20-30 хв. Отримані надосади відбирають у пробірки, додають хлороформ. Надосади висівають на газон тест-культури методом подвійних агарових шарів. При утворені негативних колоній одиничні колонії сколюють і переносять у стерильні епендорфи з фізіологічним розчином. Після -6 інкубації за Т=4 °C протягом 12 годин зразки розводять до 10 ступеню і повторно висівають методом подвійних агарових шарів. Виділення чистих ліній фагів проводять після щонайменше 3-х кратного ласування вірусу з окремої одиничної колонії. Стебло асептичних рослин томатів занурюють на декілька секунд в суспензію бактерії. Далі оброблені рослини субкультивують на середовище з бактеріофагами. При цьому бактеріофаги 5-8 додають в середовище перед його застиганням концентрації 10 БУО/мл і наносять декілька краплин на поверхню середовища безпосередньо перед висадженням експланту. Таблиця 1 Інгібування розвитку бактеріозу, спричиненого Pseudomonas syringae pt. Tomato після додавання ізолятів фагів φΨ1 та φΨ2. Тривалість експерименту 1-й тиждень 2-й тиждень 3-й тиждень Середовище + Нормальна вегетація рослин, розростання кореневої системи, фаг/бактерії формування нових листків Середовище + Нормальна вегетація рослин, розростання кореневої системи, бактерії/обробка фагом формування нових листків Хлоротична реакція на листі Суцільний ріст бактерій на культуральному Середовище + бактерії та стеблах, ріст бактерій на середовищі, некрози стебел і листків, культуральному середовищі загибель молодих рослин Нормальна вегетація рослин, розростання кореневої системи, Контроль формування нових листків Умови експерименту 15 20 25 Отримані результати свідчать, що ізоляти бактеріофагів φΨ1 та φΨ2 при додаванні в культуральне середовище для вирощування рослин та при обробці рослин сумішшю бактеріофагів унеможливлюють розвиток хвороби, викликаної Pseudomonas syringae pt. tomato, натомість при додаванні суспензії бактерій без подальшої обробки бактеріофагами рослини швидко гинуть (Фіг. 2). 7 Отже, внесення суміші ізолятів бактеріофагів у концентрації 10 БУО/мл в культуральне середовище захищає рослини від розвитку фіто бактеріозу, а бактеріофаги можна застосувати для захисту рослин від контамінації бактеріями in vitro. Без додавання бактеріофагів рослини гинули від розвитку фітопатогенного мікроорганізму через 2 тижні від початку експерименту. Запропонований спосіб дозволяє досягти заявленого технічного завдання і захистити рослини від контамінації, спричиненої бактеріями в умовах in vitro і дозволить оптимізувати вирощування рослин в умовах біотехнологічних підприємств, на яких отримують оздоровлений посадковий матеріал та меристематичні культури клітин рослин. ФОРМУЛА ВИНАХОДУ 30 35 40 Спосіб пригнічення розвитку контамінуючих бактерій при розмноженні рослин in vitro, який включає поверхневу стерилізацію рослинних експлантів або насіння за допомогою бактерицидних сполук з їх відмиванням стерильною дистильованою водою після обробки, висадження рослинних експлантів або насіння на поживні середовища, який відрізняється тим, що в процесі їх приготування перед застиганням у культуральне середовище додається суміш 5-8 бактеріофагів у концентрації 10 БУО/мл, бактеріофаги наносяться також на середовище перед безпосереднім внесенням експлантів, при цьому використовують бактеріофаги, специфічні до фітопагенних та епіфітних бактерій рослин, що попередньо виділені зі зразків води, ґрунту або рослинного матеріалу шляхом їх інкубації з бактеріальною тест-культурою протягом 8-14 годин, та позбавлення отриманої суміші від супутньої мікрофлори центифугуванням при 3000-5000 об/хв. 20-30 хв., додаванням розчину хлороформу та фільтрації супернатанту крізь бактеріальний фільтр d поp=0,2 м, причому виділені бактеріофаги накопичуються і концентруються. 2 UA 112377 C2 3 UA 112377 C2 Комп’ютерна верстка О. Рябко Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 4
ДивитисяДодаткова інформація
МПК / Мітки
МПК: C12N 7/02, C12Q 1/70, A01H 4/00, A01N 63/00
Мітки: спосіб, розмноженні, пригнічення, контамінуючих, рослин, бактерій, розвитку, vitro
Код посилання
<a href="https://ua.patents.su/6-112377-sposib-prignichennya-rozvitku-kontaminuyuchikh-bakterijj-pri-rozmnozhenni-roslin-in-vitro.html" target="_blank" rel="follow" title="База патентів України">Спосіб пригнічення розвитку контамінуючих бактерій при розмноженні рослин in vitro</a>
Попередній патент: Спосіб отримання рисового солоду
Наступний патент: Спосіб хімічного нанесення кобальту
Випадковий патент: Спосіб визначення внутрішніх дефектів в стінах приміщень