Спосіб одержання днк з біологічних об`єктів
Номер патенту: 16192
Опубліковано: 17.07.2006
Автори: Бруяка Ольга Петрівна, Бруяка Петро Пилипович, Мартиненко Олена Іванівна, Алхімова Олена Георгіївна, Кириленко Тамара Костянтинівна
Формула / Реферат
Спосіб одержання ДНК з біологічних об'єктів, що включає руйнування клітин, одночасний лізис клітин, екстракцію препаратів ДНК та їхнє очищення від клітинного дебрису, що проводять комплексною дією хлороформу та буферу, до складу якого входить сахароза, тритон Х-100, Tris-НСІ (рН 7,5-8), EDTA та вода, який відрізняється тим, що лізис клітинної стінки, екстракцію і очищення ДНК від клітинного дебрису здійснюють одноетапно не менше однієї години при температурі +20°С...+70°С та буферу, до складу якого додатково входить ацетат натрію та комплекс неіонних поверхнево-активних речовин (ПАР) з гідратованим пероксидом, а компоненти буферу містять такі сполуки, у мас. %:
сахароза
6-8
EDTA
0,4-0,9
Tris-HCI, pH8
0,1-0,5
ацетат натрію
2-4
тритон X-100
4-5
комплекс неіонних ПАР з гідратованим пероксидом
0,25-3
вода
до 100.
Текст
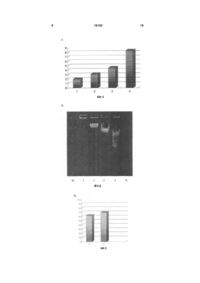
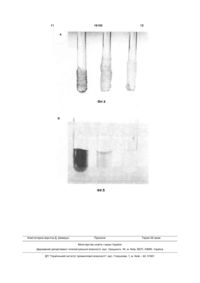
Спосіб одержання ДНК з біологічних об'єктів, що включає руйнування клітин, одночасний лізис клітин, екстракцію препаратів ДНК та їхнє очищення від клітинного дебрису, що проводять комплексною дією хлороформу та буферу, до складу якого входить сахароза, тритон Х-100, Tris-НСІ (рН 7,58), EDTA та вода, який відрізняється тим, що лі 3 Методологія майже всіх існуючих способів отримання сумарних, ядерних та пластомних (хлоропластних, мітохондріальних) препаратів ДНК складається з наступних операцій. Спочатку проводять руйнацію клітинних стінок шляхом, наприклад, розтирання рослинного зразка у рідкому азоті або гомогенізації у відповідному буфері. Лізис клітин або окремо виділених клітинних органел та екстракцію ДНК при максимально можливому інгібуванні нуклеазної активності здійснюють за допомогою композиційного складу буферів. Для цього з успіхом використовують різні детергенти (SDS, TritonX-100, СТАВ, саркозил тощо), хелатуючі агенти (EDTA), протектори НК (поліаміни, рібонуклеозід-ванаділові комплекси, ауринтрикарбонова кислота тощо), ферменти і т.ін. Ефективне очищення препаратів ДНК від клітинного дебрису та білка забезпечують за рахунок застосування протеаз, високих концентрацій солей, агресивних хімічних депротеінізаторів (фенол, хлороформ, формамід тощо), або проведення ультрацентрифугування у градієнтах щільності CsCI/EtBr, електрофільтрації лізату ядер через мембрану (ХМ 300), ГАП-хроматографії тощо [3, 9, 19]. Недоліками відомих способів одержання ДНК є порівняно невеликий вихід, використання токсичних хімічних агентів, потреба коштовних реактивів та обладнання, необхідність тривалого часу. Найбільш близьким до запропонованої корисної моделі за науково-технічною сутністю є спосіб одержання ДНК з біологічних об'єктів, що включає руйнування клітин, одночасний лізис клітин, екстракцію препаратів ДНК, їхнє очищення від клітинного дебрису, що проводять комплексною дією хлороформу та буферу, до складу якого входить сахароза, тритон Х-100, трис - НСІ (рН 7,5-8), EDTA та вода [Деклараційний патент на корисну модель №3694, МПК 7 C12N15/10, С07Н21/00; Бюл. №12, 2004р.]. Описаний спосіб ґрунтується на поєднані у часі процесів лізису клітин, екстракції та очищення препаратів ДНК за допомогою комплексної дії хлороформу та багатокомпонентного буфера при температурі +20°...+60°С протягом 2 годин. Суттєвим недоліком відомого способу є те, що у багатьох випадках комплексна дія хлороформу і склад буферу при зазначеному температурному режимі не забезпечують отримання максимально можливого виходу препаратів ДНК з більш високим ступенем безруйнівного очищення молекул ДНК від білків, пігментів, фенолів, вуглеводів та інших агентів, присутніх у великій кількості в рослинних клітинах, а виділені таким чином тотальні препарати ДНК здебільшого потребують додаткових операцій очищення. Фактично це означає, що для отримання високоочищенної і полімерної ДНК потрібно додатково застосовувати традиційні способи очищення (фенол, хроматографію, електрофорез, ультрацентрифугування в градієнтах щільності солей тощо), що негативно впливають на вихід та полімерність препаратів ДНК, потребують значного часу і роблять цей процес нерентабельним. У основу пропонованої корисної моделі поставлено задачу створення такого способу одержання 16192 4 ДНК з біологічних об'єктів, який дозволить одноетапно комплексною дією хлороформу і нового складу буферу та температурного режиму збільшити вихід препаратів ДНК з більш високим ступенем безруйнівного очищення молекул ДНК від білків, пігментів, фенолів, вуглеводів та інших агентів, присутніх у великій кількості в рослинних клітинах при мінімальних витратах часу, коштів і вихідного матеріалу, а виділені таким чином тотальні препарати ДНК не будуть потребувати додаткових операцій очищення. Поставлена задача вирішується пропонованим способом, який, як і відомий спосіб одержання ДНК з біологічних об'єктів включає руйнування клітин, одночасний лізис клітин, екстракцію препаратів ДНК та їхнє очищення від клітинного дебрису, що проводять комплексною дією хлороформу та буферу, до складу якого входить сахароза, тритон Х-100, Tris - НСІ (рН 7,5-8), EDTA та вода, а відповідно до пропозиції лізис клітинної стінки, екстракцію і очищення ДНК від клітинного дебрису здійснюють одноетапно не менше однієї години при температурі +20°C...+70°С та буферу, до складу якого додатково входить Na ацетат та комплекс неіонних ПАР (поверхнево-активні речовини) з гідратованим пероксидом, а компоненти буферу містять такі сполуки у мас %: сахароза;6-8 % EDTA; 0,4-0,9 % Tris-HCI, pH8; 0,1-0,5 % Na ацетат; 2-4 % Triton X-100; 4-5 % комплекс неіонних ПАР з гідратованим пероксидом 0,25-3 % Вода до 100 Поставлена задача вирішується за рахунок створення умов, що передбачають використання в буфері комплексу неіонних поверхнево активних речовин з гідратованим пероксидом та Na ацетату при підвищеній температурі, що дозволило значно оптимізувати процес виділення високоякісних препаратів ДНК у великій кількості. Суть корисної моделі пояснюється графічними матеріалами. На Фіг.1, 2 - показано структурний стан ДНК в різних органах P.somniferum. Кількісний показник співвідношення вмісту одно- та дволанцюгових нуклеїнових кислот в різних органах P.somniferum : 1 - коробочка; 2 - корінь; 3 - стебло; 4 - лист (Фіг.1). Порівняльна електрофореграма препаратів сумарної ДНК з різних органів цілої рослини P.somniferum: 1 - коробочка; 2 - корінь; 3 - стебло; 4 - лист; М - ДНК X (Фіг.2). На Фіг.3 - показано вихід препаратів тотальної ДНК з листя P.nudicaule за умов двох незалежних способів: 1 - відомим; 2 - запропонованим авторами. На Фіг.4, 5 - показано ефективність очищення препаратів ДНК P.nvdicaule за відомим способом (1) та запропонованим авторами при кімнатній температурі (2) і підвищеній (3). Приклад. В експериментах використовували цілі рослини маку Papaver (P.nudicaule, P.somniferum). Кількісний вміст одно- та двохланцюгових ДНК 5 в рослинних тканинах визначали модифікованим методом Шмідта-Таннгаузера [13], який грунтується на здатності одноланцюгових НК повністю гідролізуватися протягом години 0,5 М КОН при 67°С, а двохланцюгових - 30хв 0,5М НСІО4 при 90°С. Розділення молекул за структурним статусом проводили центрифугуванням 20хв при швидкості обертання ротора 8000об/хв. Вміст НК у відповідних надосадових рідинах вимірювали за допомогою спектрофотометра Specord M-40 (Carl Ziess, Німеччина). Лізис рослинних протопластів, екстракцію та очищення препаратів ДНК проводили спеціально розробленим нами буфером: 6-8 % сахароза; 0,40,9 % -EDTA; 0,1-0,5 % Трис-НСІ, (рН 8); 2-4 % - Na ацетат; 4-5% Triton X-100; 0,25 -3% комплекс неіонних ПАР з гідратованим пероксидом. Виділення ДНК зводилося до наступних операцій. Зразок рослинної тканини (1 г) ретельно розтирали у рідкому азоті, швидко переносили у суспензію, що містила по 5 мл буфера та хлороформу, інкубували гомогенну суміш 30 хв. на водяній бані за підвищеної температури і центрифугували (10000 g - 5000 g 15-20 хв.) до повного розділення фаз. При необхідності відібрану водну фазу додатково депротеінізували рівним об'ємом хлороформу і повторювали цю процедуру до повного зникнення інтерфази на межі водної фази і хлороформу. ДНК осаджували 2,5 об'ємами етанолу, промивали 70 %-м спиртом і зберігали при температурі -20°С. Розділення молекул ДНК і РНК здійснювали у ТЕ буфері за допомогою LiCI [4] або РНК-зи і ДНК-зи відповідно. Для порівняння виходу отриманих препаратів виділяли ДНК відомим способом [19] з використанням буферу STTEN ( 6 - 8% сахароза; 4-5% Triton X-100; 0,5-0,6 %Tris - НСІ, рН 7,5-8; 0,9-1,5 % EDTA; 5,2-5,8 % NaCI). Концентрацію ДНК та їхні спектрофотометричні характеристики визначали за допомогою спектрофотометра Specord M-40 відомим методом [14]. Електрофорез сумарних препаратів ДНК у 0,50,8 % агарозному гелі в буфері ТВЕ, рН 8,0 здійснювали відповідно рекомендаціям [15]. З метою оцінки ефективності запропонованого способу, а також оптимізації умов селекції рослин як потенційних джерел широкомасштабного отримання ДНК, ми застосували досить інформативний кількісний критерій [20]. Він відображає числове значення співвідношення вмісту одно- та двохланцюгових молекул нуклеїнових кислот безпосередньо у рослинних зразках. Зручною моделлю для вивчення тенденції зміни цього числового показника на різних етапах онтогенезу послугували окремі органи цілої рослини маку. Експериментально було доведено існування зворотної кореляції між цим кількісним показником та цілісністю сумарних препаратів ДНК, виділених пропонованим способом з коробочки, кореня, стебла та листя Papaver (Фіг.1). Такий підхід дозволяє, по-перше, ідентифікувати ступінь полімерності ДНК у процесі розвитку та старіння біологічних об'єктів, а, подруге, діагностувати наявність в них деструктивних процесів та давати прогнозну оцінку можливості їхнього виникнення. В нашому випадку вказана 16192 6 процедура дозволила відібрати найбільш проблемний вихідний рослинний матеріал для опрацювання пропонованого способу виділення ДНК. Серед всього спектру досліджених рослин маку лише листя P.nudiccttde з числовим показником, що становив 3,5-4,7 використовували у подальшій роботі. Дані експерименту показали, що відібрані рослинні тканини P.vwdicaule характеризувалися з одного боку ще значним вмістом нативної, хоча і частково деградованої ДНК (Фіг.1, В), а з другого - присутністю в рослинних екстрактах великої кількості клітинних агентів, здатних специфічно модифікувати молекули ДНК і тим самим значно ускладнювати процес виділення і очищення цих біополімерів. Авторами експериментально винайдено унікальний склад буфера, що у комбінації з хлороформом та підвищеною температурою розчину дозволили значно оптимізувати процес виділення та безруйнівного очищення якісних препаратів ДНК. Згідно з даними літератури [3] наявність в буфері 6-8 % сахарози дозволяє при лізисі рослинних протопластів запобігти миттєвій внутрішньоклітинній механічній деградації молекул ДНК (НК) і активації ендогенних нуклеаз. Розроблений буфер містить хелати, зокрема ЕДТА. Застосована концентрація цієї сполуки в межах (0,4-0,9 %) цілком придатна для пригнічення нуклеазної активності і не створює подальших ускладнень при осаджені нуклеїнової кислоти етанолом. Присутність у буфері експериментальне підібраної нової комбінації детергентів (4-5 % - Triton X100 та 0,25-3 % - комплекс неіонних ПАР) забезпечує досить ефективний лізис клітин. Про це свідчить порівняльний аналіз виходу нативнихп репаратів ДНК з листя P.nudicaule за умов відомого способу [19] та пропонованого способу, що виявив переваги пропонованої корисної моделі. Відповідно до (Фіг.2) кількісний вихід ДНК, забезпечений пропонованим способом, перевищував цей показник, отриманий за умов відомого способу, і становив близько 70 % від вмісту ДНК у рослинному матеріалі. До речі, запропонований авторами спосіб, крім ДНК, гарантував також і стабільне отримання високополімерних і очищених препаратів РНК з одного рослинного зразка. Крім того, експериментальні дані щодо сумісної дії у складі пропонованого буфера зазначених детергентів, солей (зокрема, нової речовини Na ацетат - 2-4 %), антиоксиданта (гідротований пероксид) і хлороформу вказують на значну інтенсифікацію процесу неруйнівного (Фіг.3, А) позбавлення молекул ДНК різних клітинних забруднювачів. Температурні режими теж визначені авторами експериментальне. Так, при роботі з досить проблемними біоб'єктами (багатими на пігменти, вуглеводи, феноли, білки тощо) суттєво підсилює хімічну активність компонентів пропонованого буфера підвищення температурного режиму максимум до +70°С (Фіг.3, В). Підвищення температури буфера дозволило прискорити тривалий процес очищення препаратів ДНК від білків, пігментів і інших модифікуючих ДНК клітинних агентів і звести загальні витрати часу на 7 виділення та очищення ДНК з рослинного об'єкта до однієї години. Однак, подальше підвищення температури пропонованого буфера за 70°С недоцільно, оскільки воно зумовлює денатурацію молекул ДНК. Введення в буфер комплексу неіонних ПАР з гідротованим пероксидом та Na ацетату при підвищеній температурі дозволило отримати тотальну високополімерну рослинну ДНК з високим ступенем чистоти про що свідчить також і спектрофотометричний коефіцієнт А260/А280, що становив не нижче 1,95-2,0. Цей результат досягається без додаткових традиційних операцій очищення за мінімальних витрат часу, коштів і вихідного матеріалу. Одноетапне здійснення лізису клітинної стінки, екстракції і очищення ДНК від клітинного дебрису при температурі +20°С...+70°С та новому складі буферу забезпечують отримання великої кількості полімерних високоочищених препаратів ДНК не менше однієї години. Виконання цих процесів більше однієї години економічно не обґрунтоване, оскільки не збільшує ефект виходу полімерних високоочищених препаратів ДНК. Таким чином, пропонований спосіб одержання високоочищенних полімерних препаратів рослинної ДНК, дозволив значно оптимізувати процес виділення і безруйнівного очищення якісних препаратів ДНК. Він простий і ефективний (вихід становить близько 70 % від кількості, що міститься у вихідному матеріалі). Придатний для одержання ДНК і НК з обмежених кількостей досліджуваного матеріалу, а також використання його у промислових масштабах. Мінімальна кількість маніпуляцій зі зразками та істотна економія часу роблять цей спосіб рентабельним особливо в умовах експресаналізу великої кількості досліджуваних біологічних зразків. Відсутність необхідності у коштовних реактивах і обладнанні надають способові загальнодоступності. Література: 1. Simkova H., Cihalikova J., Vrana J., Lysak M., Dolezel J. Preparation of high molecular weight DNA from plant nuclei and chromosomes isolated from root tips // Biol. Plantarum. - 2003. - 46, No 3. - P. 369373. 2. Черевченко Т.М., Заименко Н.В., Мартыненко Е.И. Биохимические особенности видов орхидных различных экотипов // Физиол. биохим. культури, раст. - 2000. - 32, № 2. - С. 121-127. 3. Клонирование ДНК. Методы. / Под ред. Д. Гловера. M.: Мир, 1988. - 538 с. 4. Verwoerd T.C., Dekker M.M., Hoekema A. A small- scale procedure for the rapid isolation of plant RNAs // Nucleic Acids Res. - 1989. - 17., No 6. - P. 2362-2364. 5. Raha S., Merante F., Proteau G., Reed J.K. Simultaneous isolation of total cellular RNA and DNA from tissue culture cells using phenol and lithium chloride // Genetic Analysis. - 1990. - 7, No 7. - P. 173-177. 6. Wadsworth G.J., Redinbaugh M.G., Scandalios I.G. A procedure for the small-scale 16192 8 isolation of plant RNA suitable for RNA blot analysis // Analytic. Biochem. - 1988. - 172, No 1. - P. 279-283. 7. Лях Л.А., Хилько С.Н., Аспетов Р.Д., Носик Д.Н., Новохатский А.С., Тихоненко Т.Н. Очистка и идентификация информационной РНК иммунного (гамма) интерферона из спленоцитов человека // Биохимия. - 1983. - 48, вып. 10. - С. 1739-1746. 8. Berger S.L, Birkenmeier C.S. Inhibition of intractable nucleases with ribonucleoside-vanadyl complexes: isolation of messenger ribonucleic acid from resting lymphocytes // Biochemistry. - 1979. - 18, No 23. - P. 5143-5149. 9. Черепенко Е.И., Мартиненко Е.И. Простой метод получения ДНК бакуловирусов // Молекул, биол. - 1985. - 19, вып. 6 - С. 1519-1524. 10. Skinner D.M., Triplett L.L. The selective loss of DNA satellites on deproteinization with phenol // Biochem. Biophys. Res. Communs. - 1967. - 28, No 6. - P. 892-897. 11. Черепенко Е.И., Галкин А.П., Лебедев В.Р., Кок И.П. Щадящий метод выделения ДНК из ядер клеток насекомых // Укр. биох. журн. - 1982. - 54, №3. - С. 316-321. 12. Мартыненко Е.И., Негребецкая Э.Н., Степанюгин А.В., Самойленко С.А., Говорун Д.Н. РНК, в отличие от ДНК, ковалентно связывается с ауринтрикарбоновой кислотой: молекулярнобиологические и спектроскопические доказательства // Укр. биохим. журнал. - 2002. - 74, №6. - С. 68-73. 13. Schmidt G., Thannhauser S.I. A method for the determination of deoxyribonucleic acid, ribonucleic acid, and phosphoproteins in animal tissues // J. Biol. Chem. - 1945. - 161, Nol. - P. 83-89. 14. Henderson J.T., Benight A.S., Hanlon S. A semi-micromethod for the determination of the extrinction coefficients of the duplex and singlestranded DNA // Analytic. Biochem. - 1992. - 201, No 1. - P. 17-29. 15. Maniatis Т., Fritsch E.F., Sambrook C.S. Molecular cloning. A Laboratory Manual: Cold Spring Harbor, New York, 1982. - 394 p. 16. Материалы международной конференции "Биотехнология и бизнес", 21-22 апреля 2003. Москва. 17. І.І. Гринюк, Г.М. Корнійчук, О.О. Капралов, О.П. Матишевська. Зміни структурного стану хроматину в тимоцитах на ранньому етапі апоптозу за індукції пероксидом водню і радіацією // Укр. біохім. журн., 2004, т. 76, №5, c. 90-95. 18. Топчій Н.М. Деградація ДНК у процесі старіння листків цукрового буряка (Beta vulgaris L) // Укр. біохім. журн. 2001, т. 73, №3, с. 116-120. 19. Мартиненко O.I., Кириленко Т.К., Степанюгін А.В., Говорун Д.М., Алхімова О.Г. Спосіб одержання нуклеїнових кислот (НК) з біологічних об'єктів. Деклараційний патент. 15.12.2004, Бюл. №12. 2004. 20. Martynenko O.I., Kyrylenko Т.К., Gorai A.A., Alkhimova O.G. Quantitative RNA/DNA ratio as criterion for functional state of plant genomic DNА // Український біохімічний журнал, 2005, т. 77, №2, c. 209. 9 16192 10 11 Комп’ютерна верстка Д. Шеверун 16192 Підписне 12 Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for obtaining dna from biological objects
Автори англійськоюAlkhimova Olena Heorhiivna
Назва патенту російськоюСпособ получения днк из биологических обьектов
Автори російськоюАлхимова Елена Георгиевна
МПК / Мітки
МПК: C07H 21/00, C12N 15/10
Мітки: біологічних, днк, спосіб, об'єктів, одержання
Код посилання
<a href="https://ua.patents.su/6-16192-sposib-oderzhannya-dnk-z-biologichnikh-obehktiv.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання днк з біологічних об`єктів</a>