Спосіб одержання нуклеїнових кислот з біологічних об’єктів
Номер патенту: 3694
Опубліковано: 15.12.2004
Автори: Мартиненко Олена Іванівна, Кириленко Тамара Констянтинівна, Степанюгін Андрій Васильович, Говорун Дмитро Миколайович, Алхімова Олена Георгіївна
Формула / Реферат
Спосіб одержання нуклеїнових кислот (НК) з біологічних об'єктів, що включає операції руйнування та лізису клітин, екстракції препаратів ДНК і РНК, їх очищення від клітинного дебрису, який відрізняється тим, що лізис, екстракцію і очищення НК проводять одночасно протягом близько 2 годин при температурі +20°C...+60°C комплексною дією хлороформу та буфера такого складу, мас.%:
сахароза
6 – 8
тритон Х-100
4 – 5
трис-HCl (pH 7,5 - 8)
0,5 – 0,6
EDTA
0,9 – 1,5
NaCl
5,2 – 5,8
вода
до 100.
Текст
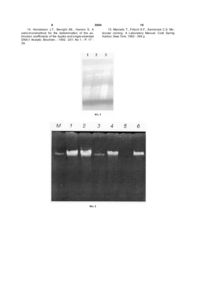
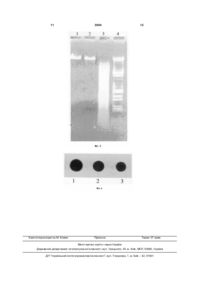
Спосіб одержання нуклеїнових кислот (НК) з біологічних об'єктів, що включає операції руйну 3 3694 4 Для цього використовують різні детергенти втрату певних класів нуклеотидних послідовностей (8В8,саркозил, TritonX-100, СТАВ тощо), хелатуючі ДНК, а також значно знижувати вихід цих агенти (наприклад, ЕДТА), висококонцентровані біополімерів. Більш того, у більшості країн Європи сольові розчини, в яких НК залишаються у розвикористання фенолу в лабораторних умовах зачинній формі, а білки випадають в осад, або розборонено з огляду на його високу токсичність. Почини протеаз, які гідролізують білкові компоненти. друге, застосування протекторів не виключає Ці операції або їхні комбінації потребують викориможливості специфічної модифікації цими сполустання хлороформу і фенолу - агентів, котрі сильками молекул НК в умовах виділення. Як наслідок, но денатурують білки. Додаткове очищення НК подальше використання таких препаратів НК стає передбачає проведення ультрацентрифугування у ускладненим або ж зовсім неможливим у молекуградієнтах щільності CsCl/EtBr, зокрема для ДНКлярно-біологічних дослідженнях [Лях Л.А., Хилько ГАП-хроматографії то що. С.Н., Аспетов Р.Д., Носик Д.Н., Новохатский А.С., Недоліками відомих способів, що вже стали Тихоненко Т.Н. Очистка и идентификация инфоркласичними [Клонирование ДНК. Методы./ Под мационной РНК иммунного (гамма) интерферона ред. Д.Гловера. М.: Мир, 1988. - 538 с.; Verwoerd из спленоцитов человека // Биохимия. -1983. - 48, T.C., Dekker М.М., Hoekema A. A small- scale proвып. 10. - С. 1739 -1746; Мартыненко Е.И., Негреcedure for the rapid isolation of plant RNAs // Nucleic бецкая Э.Н., Степанюгин А.В., Самойленко С.А., Acids Res. - 1989 - 17., No 6. - P. 2362 - 2364], є Говорун Д.Н. РНК, в отличие от ДНК, ковалентне порівняно невисокий вихід НК, громіздкість, несвязывается с ауринтрикарбоновой кислотой: мообхідність тривалого часу та значної кількості лекулярно-биологические и спектроскопические вихідного матеріалу, потреба коштовних реактивів доказательства //Укр. биохим. журнал. -2002.-74, та обладнання. Крім того, серед існуючого арсе№6.-С. 68-73]. налу способів виділення ДНК і РНК немає жодного У основу пропонованої корисної моделі поуніверсального, який би задовольнив основні виставлено задачу створення такого способу одермоги щодо одержання якісної кількості НК з широжання НК з широкого кола біологічних об'єктів, кого кола біологічних об'єктів різного походження. який би забезпечив високий вихід чисти х високоНайбільш близьким до пропонованої корисної полімерних препаратів ДНК і РНК, придатних для моделі за науково-технічною суттю є спосіб одермолекулярно-біологічного використання з обмежежання НК з біологічних об'єктів, який включає опеної кількості вихідного матеріалу та за мінімальних рації руйнації та лізису клітин, екстракції препавитрат часу і коштів. Згадана задача вирішується ратів ДНК і РНК, їхнього очищення від клітинного за рахунок створення умов для виключення з продебрису [Raha S., Merante F., Proteau G., Reed J.K. цесу застосування фенолу і протекторів. Simultaneous isolation of total cellular RNA and DNA Поставлена задача вирішується у пропоноfrom tissue culture cells using phenol and lithium ваній корисній моделі , яка, як і відомий спосіб chloride // Genetic Analysis. - 1990. - 7, No 7. - P. 173 одержання НК з біологічних об'єктів, включає опе- 177]. Описаний спосіб грунтується на поєднанні рації руйнації та лізису клітин, екстракції препапроцесів лізису клітин і одночасного очищення НК ратів ДНК і РНК, їхнього очищення від клітинного за рахунок присутності у складі екстрагуючого будебрису, а, відповідно до пропозиції, екстракцію і феру фенолу При цьому, використання у процесі очищення НК проводять одночасно протягом виділення відомих і ефективних інгібіторів нуклеаз близько 2 годин при температурі +20°С - +60°С значно підвищує ви хід високополімерних препакомплексною дією хлороформу та буферу такого ратів ДНК і РНК [Wadsworth G.J., Redinbaugh M.G., складу 6 - 8% сахароза; 4-5% тритон Х - 100; 40 Scandalios I.G. A procedure for the small-scale isola50 мМ трис - НСІ, рН 7,5 - 8; 25 - 40 мМ EDTA; 0,9 tion of plant RNA suitable for RNA blot analysis // 1 M NaCI. Analytic. Biochem. - 1988. - 172, No 1. - P. 279 -283; Суть корисної моделі пояснюється графічними Лях Л.А., Хилько С.Н., Аспетов Р.Д., Носик Д.Н., матеріалами. На Фіг.1 - Показана електрофореНовохатский А.С., Ти хоненко Т.Н. Очистка и иденграма сумарних препаратів НК, одержаних з Paтификация информационной РНК иммунного paver двома незалежними способами: А - 1; 2 (гамма) интерферона из спленоцитов человека // відомим способом [Raha S., Merante F., Proteau G., Биохимия. - 1983. - 48, вып. 10. - С. 1739 -1746; Reed J.K. Simultaneous isolation of total cellular RNA Berger S.L., Birkenmeier C.S. Inhibition of intractable and DNA from tissue culture cells using phenol and nucleases with ribonucleoside-vanadyl complexes: lithium chloride //Genetic Analysis.-1990. - 7, No 7. isolation of messenger ribonucleic acid from resting P. 173 - 177]; 3 - пропонованим способом автораlymphocytes // Biochemistry. - 1979. -18, No 23. - P. ми. 5143 - 5149; Черепенко Е.И., Мартиненко Е.И. На Фіг.2 наведена порівняльна електрофореПростой метод получения ДНК бакуловирусов // грама препаратів ДНК ( 1; 2 - мак; 3; 4 - банан; 5; 6 Молекул. биол. - 1985. - 19, вып.6 - С.1519 - 1524]. - каланхое), одержаних двома різними способами: Недоліками зазначеного способу є те, що, по1; 3; 5 -відомим; 2; 4,6- пропонованим авторами. М перше, згідно [Skinner D.M., Triplett L.L. The selec- ДНК фага l . tive loss of DNA satellites on deproteinization with На Фіг. 3 показана електрофореграма в 0,8 % phenol // Biochem.Biophys. Res. Communs. - 1967. агарозному гелі: 28, No 6. - P. 892 - 897; Черепенко Е.И., Галкин ДНК фага l - 1; ДНК банана, отримана запроА.П., Лебедев В.Р., Кок И.П. Щадящий метод выпонованим способом - 2; деления ДНК из ядер клеток насекомых // Укр. ДНК банана, отримана запропонованим спобиох. журн. - 1982. - 54, № 3. - С. 316 -321] застособом / EcoRl - 3; сування фенолу для еукаріот може провокувати 5 ДНК фага l /EcoR1 + Hind III - 4. На Фіг.4 наведені Dot - гібридизація ДНК банана (1), РНК ферули (2) і РНК каланхое (3), отриманих запропонованим способом, з міченою дігоксигенином 45S рибосомною ДНК. Приклад. В експериментах використовували рослини з різним вмістом НК: листя ферули (Ferula), проростки маку (Papaver) - багаті на НК; листя - банана (Musa) і особливо каланхое ( Kalanchoe) з низьким сумарним вмістом ДНК і РНК. Кількісний вміст НК у рослинних тканинах оцінювали модифікованим методом Шмідта [ Schmidt G., Thannhauser S.I. A method for the determination of deoxyribonucleic acid, ribonucleic acid, and phosphoproteins in animal tissues // J. Biol.Chem. - 1945. - 161, No 1. - P. 83 - 89], який ґрунтується на здатності РНК гідролізуватися 0,5 М КОН при 67°С, а ДНК - 0,5М НСІ04 при 90 "С. Розділення молекул РНК і ДНК проводили центрифугуванням протягом 20хв. при швидкості обертання ротора 8000 об/хв. Вміст НК у відповідних надосадових рідинах вимірювали за допомогою спектрофотометра Specord M-40 (Carl Ziess, Jena, Німеччина). Лізис клітин і екстракцію препаратів НК проводили спеціально розробленим нами буфером ( 6% сахароза; 40 мМ трис - НСІ, рН 8; 4%тритон Х 100; 25 мМ EDTA, ЇМ NaCI), який ми назвали STTEN. Одержання НК зводилося до наступних операцій. Зразок рослинної тканини ( 1г) заморожували і ретельно розтирали у рідкому азоті. Потім його швидко переносили у суспензію, що містила по 5 мл буфера STTEN і хлороформу. С уміш гомогенізували протягом 20 хв. за кімнатної температури, після цього центрифугували до повного розділення фаз. Відібрану водну фазу додатково депротеінізували рівним об'ємом хлороформу. При необхідності цю процедуру повторювали до зникнення інтерфази на межі водної фази і хлороформу. НК осаджували 2,5 об'ємами етанолу , розчиняли у буфері ТЕ і зберігали при температурі - 20°С. Подальше розділення молекул ДНК і РНК здійснювали стандартно - за допомогою LiCI [Verwoerd T.C., Dekker M.M., Hoekema A. A small- scale procedure for the rapid isolation of plant RNAs// Nucleic Acids Res. - 1989- 17., No 6. - P. 2362 - 2364] або РНК-зи і ДНК-зи відповідно. Для порівняння виділяли НК способомпрототипом [Raha S., Merante F., Proteau G., Reed J.K. Simultaneous isolation of total cellular RNA and DNA from tissue culture cells using phenol and lithium chloride // Genetic Analysis. - 1990. - 7, No 7. -P. 173 - 177] з використанням лізуючого розчину STEL ( 0,2% SDS; 10 мМ трис -НСІ, рН7,5; 10 мМ EDTA, 100 мМ LiCI). Концентрацію ДНК і РНК та їхні спектрофотометричні характеристики визначали за допомогою спектрофотометра SPECORD M40 відомим методом [Henderson J.T., Benight A.S., Hanlon S. A semi-micromethod for the determination of the extrinction coefficients of the duplex and single-stranded DNA // Analytic. Biochem.-1992.-201, No l.-P. 17-29]. Електрофорез препаратів НК у 0,8% агарозному гелі в буфері ТВЕ, рН 8,0; обробку молекул ДНК рестриктазами (EcoRl, Barn НІ); температурну 3694 6 денатурацію і подальше нанесення аліквот сумарного препарату ДНК і РИК на нейлонові фільтри Hybond N ( Amersham, Англія) проводили відповідно рекомендаціям [Maniatis Т., Fritsch E.F., Sambrook C.S. Molecular cloning. A Laboratory Manual: Cold Spring Harbor, New York, 1982 - 394 p.]. Мічення 45S rДНК (фрагмент гену 5,8S - 18S 26S рибосомної РНК банана) дігоксігенином, ДНК ДНК і РНК - ДНК dot - гібридизацію та подальшу хемілюмінесцентну детекцію здійснювали згідно протоколу Roche ( Roche Molecular Biochemicals, Німечина). Для оцінки якості використаних рослинних зразків, а також ефективності запропонованого способу важливо знати кількість НК в рослинних тканинах на момент одержання НК. Експериментальні дані (див. табл.) вказують на великі варіації вмісту НК у листя х рослин різних видів. Так, особливо багатими на ДНК і РНК виявилися види Papaver ( 0,630 мг фосфата (Р) / г сирої речовини (сир. реч.) і 2,34 мг Р/ г сир. реч. відповідно) та Ferula (0,580 мг Р/ г сир. реч. і 0,970 мг Р/ г сир. реч.), в той час як банан Musa ( 0,112 мг Р/ г сир. реч. і 1,73 мг Р/ г сир. реч.) і Kalanchoe (0,049 мг Р/ г сир. реч. і 0,710 мг Р/ г сир. реч.), особливо за рівнем ДНК, слід віднести до рослинних об'єктів з дуже низьким їхнім сумарним вмістом. Запропонований спосіб одержання НК застосували для всього спектру відібраних рослин: у всіх випадках вихід нативних молекул НК склав не менше 60% від кількості, що містилася у рослинному матеріалі. На Фіг.1 наведена електрофореграма очищених препаратів ДНК і РНК з Papaver, одержаних відомим [Raha S., Merante F., Proteau G., Reed J.K. Simultaneous isolation of total cellular RNA and DNA from tissue culture cells using phenol and lithium chloride // Genetic Analysis. - 1990. - 7, No 7. - P. 173 - 177] і запропонованим способом. Про високу якість і ступінь чистоти отриманих запропонованим способом препаратів НК свідчить їхня рухливість в агарозному гелі, яка характерна для інтактних молекул, а також спектрофотометричний коефіцієнт А2бо/А280> що становить 1,89 - 1,95. Крім того, електрофоретичний аналіз в 0,8% агарозному гелі препаратів сумарної ДНК, одержаних з однакових кількостей рослинної тканини ферули, маку, банана і каланхое двома незалежними способами, виявив значні переваги запропонованого нами способу у порівнянні з прототипом (Фіг.2). Використовуючи його, ми завжди отримували рекордно високі на сьогоднішній день кількості ДНК з різних рослин (див. табл.), у той час як спосіб-прототип забезпечував одержання ДНК лише з рослинних клітин , багатих на її сумарний вміст ( мак, ферула тощо). У випадку банана і особливо каланхое відомий спосіб виявився неефективним. Серія одержань НК з каланхое за допомогою STTEN-буфера у присутності хлороформу і фенолу засвідчила негативний вплив фенолу на вихід ДНК. Це вказує на те, що спосібпрототип є надзвичайно "жорстким" і неефективним для багатьох біологічних об'єктів. Пропоновані авторами умови отримання рослинних НК є значно м'я кшими. На нашу думку, це пов'язано з тим, що запропонований склад гіпертонічного буфера забезпечує ефективну р уй 7 3694 8 націю клітин рослин і водночас запобігає Таким чином, пропонований спосіб одночасномиттєвому осмотичному лізисові протопластів, го одержання ДНК і РНК з одного зразка із різних захищаючи тим самим молекули ДНК і РНК від біологічних об'єктів має цілу низку переваг у внутрішньоклітинної механічної деградації і дії порівнянні з відомими способами. Він простий, ендогенних нуклеаз. Крім того, одночасна приуніверсальний, ефективний (вихід становить не сутність у екстрагуючому розчині ЇМ NaCI і хлороменше 60% від кількості, що міститься у вихідному форму сприяє ефективній, але більш м'якій у об'єкті). Це робить доцільним подальшу адаптацію порівнянні з фенолом депротеінізації, що також пропонованого способу для одержання НК з обпризводить до інактивації нуклеаз і швидкої очистмежених кількостей досліджуваного матеріалу, а ки НК від білкових компонентів. також використання його у промислових масштаПрепарати НК, отримані пропонованим способах. Мінімальна кількість маніпуляцій зі зразками бом, тестували щодо придатності їх використання та істотна економія часу (спосіб одержання НК у молекулярно-біологічних експериментах. Пропозаймає близько 2 годин) дозволяють проводити нований спосіб дозволяє одержувати тотальну експрес-аналіз великої кількості досліджуваних рослинну ДНК, що є придатною для аналізу за об'єктів. Відсутність необхідності у коштовни х редопомогою ферментів рестрикції (Фіг.3), а також активах і обладнанні надають способові загальноНК для Саузерн і Нозерн dot-гібридизації. Рівні доступності, а придатність НК для молекулярногібридизації 45S rДНК банана з ДНК банана, РНК біологічних експериментів значно розширюють ферули і РНК каланхое, отриманих запропоновасфери його використання. ним способом, показано на Фіг.4. Таблиця Кількісний вихід нуклеїнових кислот з рослин, що його забезпечує запропонований авторами спосіб їх одержання з біологічних об'єктів Рослина Вміст НК в рослинних тканинах мг фосфа та (Р)/г сирої речовини (сир. реч.) ДНК Papaver Ferula Musa Kalanchoe РНК 0,63±0,04 0,58±0,04 0,11±0,04 0,05±0,03 2,36±0,03 0,97±0,08 1,73±0,03 0,71±0,07 Література 1. Simkova H., Cihalikova J., Vrana J., Lysak M., Dolezel J. Preparation of high molecular weight DNA from plant nuclei and chromosomes isolated from root tips// BioLPlantarum. - 2003. - 46, No 3. - P. 369 373. 2. Черевченко Т.М., Заименко Н.В., Мартыненко Е.И. Биохимические особенности видов орхидных различных экотипов // Физиол. биохим. культури, раст. - 2000. -32, №2.-С. 121-127. 3. Клонирование ДНК. Методы./ Под ред. Д.Гловера. M.: Мир, 1988. - 538 с. 4. Venvoerd T.C., Dekker M.M., Hoekema A. A small- scale procedure for the rapid isolation of plant RNAs // Nucleic Acids Res. - 1989- 17., No 6. - P. 2362 - 2364. 5. Raha S., Merante F., Proteau G., Reed J.K. Simultaneous isolation of total cellular RNA and DNA from tissue culture cells using phenol and lithium chloride // Genetic Analysis. - 1990. - 7, No 7. - P. 173 - 177. 6. Wadsworth G.J., Redinbaugh M.G., Scandalios I.G. A procedure for the small-scale isolation of plant RNA suitable for RNA blot analysis // Analytic. Biochem. - 1988. -172, Nol.-P.279-283 7. Лях Л.А, Хилько С.Н., Аспетов Р.Д., Носик Д.Н., Ново хатский АС., Ти хоненко Т.Н. Очистка и идентификация информационной РНК иммунного Вихід НК ДНК РНК мг/г сир. реч. % від вмісту у росл. тканині мг/ г сир. реч 0,40±0,01 0,36±0,08 0,08 ±0,005 0,03±0,003 63±0,2 62±0,5 67±0,8 61±0,3 1,60±0,05 0,61 ±0,04 1,21 ±0,03 0,43±0,03 % від вмісту у росл. тканині 68±0,4 63±0,4 65±0,5 60±0,1 (гамма) интерферона из спленоцитов человека // Биохимия. - 1983. - 48, вып. 10. -С. 1739-1746. 8. Berger S.L., Birkenmeier C.S. Inhibition of intractable nucleases with ribonucleoside-vanadyl complexes: isolation of messenger ribonucleic acid from resting lymphocytes // Biochemistry. - 1979. -18, No 23. - P. 5143 - 5149. 9. Черепенко Е.И., Мартиненко Е.И. Простой метод получения ДНК бакуловирусов // Молекул, биол. - 1985. -19, вып.б - С.1519 - 1524. 10. Skinner D.M., Triplett L.L. The selective loss of DNA satellites on deproteinization with phenol // Biochem.Biophys. Res. Communs. - 1967. - 28, No 6. - P. 892 - 897. 11. Черепенко Е.И., Галкин АП., Лебедев В.Р., Кок И.П. Щадящий метод выделения ДНК из ядер клеток насекомых // Укр. биох. жури. - 1982. - 54, № 3. - С. 316 - 321. 12. Мартыненко Е.И., Негребецкая Э.Н., Степанюгин А.В., Самойленко С.А, Говорун Д.Н. РНК, в отличие от ДНК, ковалентне связывается с ауринтрикарбоновой кислотой: молекулярнобиологические и спектроскопические доказательства // Укр.биохим.журнал. - 2002. -74, №6. - С. 68 - 73. 13. Schmidt G., Thannhauser S.I. A method for the determination of deoxyribonucleic acid, ribonucleic acid, and phosphoproteins in animal tissues // J. Biol.Chem. - 1945. - 161, No 1.-P. 83-89. 9 3694 10 14. Henderson J.T., Benight AS., Hanlon S. A 15. Maniatis Т., Fritsch E.F., Sambrook C.S. Mosemi-micromethod for the determination of the exlecular cloning. A Laboratory Manual: Cold Spring trinction coefficients of the duplex and single-stranded Harbor, New York, 1982 - 394 p. DNA // Analytic. Biochem. - 1992. -201, No 1. - P. 17 29. 11 Комп’ютерна в ерстка М. Клюкін 3694 Підписне 12 Тираж 37 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститупромислов ої в ласності”, вул. Глазунов а, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Автори англійськоюAlkhimova Olena Heorhiivna
Автори російськоюАлхимова Елена Георгиевна
МПК / Мітки
МПК: C12N 15/10, C07H 21/00
Мітки: нуклеїнових, кислот, одержання, біологічних, об'єктів, спосіб
Код посилання
<a href="https://ua.patents.su/6-3694-sposib-oderzhannya-nuklenovikh-kislot-z-biologichnikh-obehktiv.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання нуклеїнових кислот з біологічних об’єктів</a>
Попередній патент: Пристрій для визначення флюенса теплових нейтронів
Наступний патент: Спосіб переробки відходів вольфрамо-кобальтових композиційних матеріалів
Випадковий патент: Спосіб вимірювання азимуту повітряних цілей