Електрохімічна комірка для амперометричного визначення аміаку в газах
Номер патенту: 25267
Опубліковано: 17.12.2001
Автори: Чвірук Олександр Володимирович, Лінючева Ольга Володимирівна, Чвірук Володимир Петрович
Формула / Реферат
1. Электрохимическая ячейка для амперометрического определения аммиака в газах, содержащая по крайней мере индикаторный и вспомогательный электроды, которые разделены сепаратором, фоновый раствор электролита, и размещенная в корпусе с проницаемой для аммиака мембраной, отличающаяся тем, что вспомогательный электрод содержит нерастворимое катионообменное вещество в H+ - форме, которое за счет обмена между ионами H+ и поступающими от индикаторного электрода при работе ячейки катионами аммония NH4+ стабилизирует фоновый раствор электролита в области вспомогательного электрода при pH 1 - 7.
2. Электрохимическая ячейка по п.1, отличающаяся тем, что индикаторный электрод выполнен из пористого титана, активированного диоксидом рутения, диоксидом марганца, оксидами кобальта или композициями из этих оксидов и совмещен со слоем сепаратора из смеси полимерного связующего и гидрофилизирующей добавки из порошка диоксида кремния или диоксида циркония.
3. Электрохимическая ячейка по пп.1 и 2, отличающаяся тем, что вспомогательный электрод содержит смесь порошков активных диоксида марганца или диоксида свинца, электропроводящей добавки из графита или титана и катионообменного вещества из фосфата циркония или гидрата сурьмяной кислоты.
4. Электрохимическая ячейка по пп.1 - 3, отличающаяся тем, что между сепаратором, прилегающим к индикаторному электроду, и вторым сепаратором, прилегающим к вспомогательному электроду содержится хлорсеребряный электрод сравнения, а в качестве фонового электролита используют раствор хлорида лития.
5. Электрохимическая ячейка по пп.2 и 4, отличающаяся тем, что вспомогательный электрод состоит из смеси порошков графита или титана и катионообменного вещества в H+ - форме.
6. Электрохимическая ячейка по пп.1 - 5, отличающаяся тем, что она выполнена в виде таблетки прессованием составляющих ее слоев.
Текст
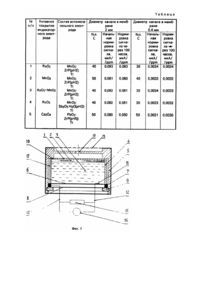
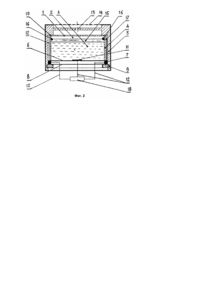
Изобретение относится к области газовых сенсоров, представляющих собой электрохимические ячейки, которые применяют в приборах газового анализа. Изобретение может быть использовано для определения концентрации аммиака при мониторинге воздуха, контроле технологических процессов промышленных и сельскохозяйственных производств, для обнаружения утечек аммиака и других целей. Известен сенсор потенциометрического типа, в котором под воздействием аммиака между индикаторным электродом и электродом сравнения элетрохимической ячейки возникает разность потенциалов, которая является мерой концентрации аммиака в воздухе [1]. Недостатками этого сенсора является логарифмический вид зависимости концентрации аммиака от разности потенциалов, что снижает точность определения, и длительность процесса измерения, обусловленная медленным установлением разности потенциалов между электродами ячейки. Известна электрохимическая ячейка для определения концентрации аммиака в воздухе, основанная на снятии циклических вольтамперограмм в буферных карбонатных растворах со скоростью изменения потенциала 1В/мин [2]. Недостатком этой ячейки является нестабильность во времени карбонатных буферных растворов и сложная техника процедуры измерения. Известны сенсоры аммиака амперометрического типа [3, 4], в которых сила тока, протекающая между индикаторным и вспомогательным электродами, прямо пропорциональна концентрации аммиака в воздухе. В качестве сенсора аммиака [3] использована электрохимическая ячейка, в которой на индикаторном электроде происходит окисление аммиака, абсорбируемого из газа раствором 6М CsOH. Недостатком этой ячейки является практическая невозможность использования ее для определения концентрации аммиака в воздухе, так как присутствующая в атмосферном воздухе углекислота приводит к карбонизации щелочного электролита, что выводит ячейку из строя. Этот же недостаток присущ и электрохимической ячейке, выполненной по принципу топливного элемента со щелочным электролитом [4]. Наиболее близкой к заявляемому изобретению является электрохимическая ячейка для амперометрического определения концентрации аммиака в воздухе, основанная на том, что фоновый электролит ячейки содержит растворимый неокисляемый на аноде реактив, который реагирует с аммиаком с образованием окисляемого продукта [5]. При анодном окислении этого продукта между индикаторным и вспомогательным электродами ячейки протекает ток, а в электролите накапливаются электрохимически инертные дочерние продукты. Недостатком этого сенсора является то, что его эксплуатация сопровождается снижением во времени концентрации исходного реактива в электролите, что приводит к снижению силы тока и увеличению длительности установления выходного сигнала. Ячейка является миниатюрным устройством с ограниченным объемом электролита, вследствие чего количество исходного реактива ограничивает ресурс ячейки, что также относится к ее недостаткам. В основу изобретения поставлена задача создания электрохимической ячейки для амперометрического определения концентрации аммиака в воздухе с постоянным во времени значением выходного сигнала, высоким быстродействием и длительным сроком службы путем поддержания стабильного состава электролита в процессе работы ячейки и применения газодиффузионного индикаторного электрода с низким перенапряжением выделения кислорода. Поставленная цель в части поддержания стабильного состава электролита в процессе работы ячейки достигается тем, что ячейка содержит нерастворимое катионообменное вещество в H+-форме, которое способно в фоновом растворе электролита к селективному обмену ионов H+ на поступающие от индикаторного электрода при работе ячейки катионы аммония NH4+, вследствие чего поддерживается стабильное значение pH электролита при катодной поляризации вспомогательного электрода в области pH 1 - 7. Поставленная цель вчасти применения газодиффузнонного индикаторного электрода с низким перенапряжением выделения кислорода при анодном разложении воды в процессе работы ячейки достигается тем, что индикаторный электрод выполнен из пористого титана, активированного диоксидом рутения, диоксидом марганца, оксидами кобальта или композициями этих оксидов и совмещен прессованием со слоем сепаратора из смеси порошков полимерного связующего и гидрофилизирующей добавки из порошка диоксида кремния или диоксида циркония. Ячейка может быть выполнена в двух- и трехэлектродном варианте. В двухэлектродной ячейке вспомогательный электрод содержит смесь порошка электрохимически активных диоксида марганца или диоксида свинца, электропроводящей добавки из порошков графита или титана и порошка катионообменного вещества в H+форме. В качестве последнего могут быть использованы катионообменники из неорганических материалов или синтетических ионообменных смол в H+-форме, которые способны в растворе фонового электролита осуществлять обмен ионов H+ на катионы NH4+. Установлено, что при использовании в качестве фонового электролита 4-7М раствора хлорида лития в области pH 1 - 7 к обмену указанными ионами способны фосфат циркония и гидрат сурьмяной кислоты. Предпочтительная область pH фонового раствора электролита двухэлектродного варианта ячейки является pH 2 - 5. Трехэлектродная ячейка отличается от двухэлектродной тем, что она содержит хлорсеребряный электрод сравнения между сепаратором, прилегающим к индикаторному электроду, и вторым сепаратором, прилегающим к вспомогательному электроду. Наряду со вспомогательным электродом того же состава, что и в двухэлектродной ячейке, в трехэлектродной ячейке вспомогательный электрод может содержать смесь порошка графита или порошка титана и порошка катионообменного вещества в H+-форме. При этом диапазон использования pH фонового электролита составляет pH 1 - 7. Двух- и трехэлектродные ячейки могут быть выполнены в виде таблеток прессованием составляющих их слоев с последующей пропиткой фоновым электролитом. Таким образом, в отличие от прототипа [5], в котором в процессе работы ячейки в фоновом электролите снижается концентрация растворенного вещества, способного к окислению в присутствии аммиака, и возрастает концентрация окисленных продуктов реакции, в изобретении состав фонового раствора электролита ячейки в пределах обменной емкости нерастворимого катионообменного вещества в H+-форме остается постоянным. В отличие от ячеек амперометрического типа [3, 4] в предлагаемой ячейке содержится фоновый раствор электролита при pH 1 - 7, что исключает накопление в нем карбонатов при контакте с атмосферным воздухом. На фиг.1 представлена схема двухэлектродной ячейки. Ячейка содержит индикаторный электрод (1), сепаратор (2), - вспомогательный электрод (3) и смонтирована в обечайке из диэлектрика (4). Обечайка (4) фиксируется в корпусе (5) с помощью крышки из диэлектрика (6), герметизирующей прокладки (7), второй крышки (8) и стопорного кольца (9). Токоподвод (10) к индикаторному электроду (1) прижат выступом корпуса (5), а токоподвод (11) к вспомогательному электроду (3) прижат крышкой (6). Токоподводы (10) и (11) в месте контакта с электродами могут быть выполнены из коррозионностойкого в среде электролита ячейки материала, например, из титана, и через крышку (8) из диэлектрика внешними проводами (12) замкнуты на нагрузочный резистор (15), падение напряжения на котором измеряют высокоомным вольтметром (16). Аммиак из окружающего газа поступает на индикаторный электрод (1) через канал в мембране (13), перед которым установлена пылезащитная диафрагма из пористого гидрофобного материала (14). На фиг.2 представлена схема трехэлектродной ячейки. В этой ячейке позиции (1) - (14) обозначают те же элементы, что и в двухэлектродной ячейке (фиг.1). В трехэлектродной ячейке между сепаратором (2) и вторым сепаратором (15) содержится хлорсеребряный электрод сравнения (16). Токоподвод (17) от электрода сравнения (16) через обечайку (4) и крышку (8) подсоединен к потенциостатирующему устройству (18), выполненному по известным решениям. К устройству (18) также подсоединены токоподводы от индикаторного электрода (1) и вспомогательного электрода (3). Потенциостатирующее устройство (18) предназначено для поддержания заданного потенциала на индикаторном электроде (1) относительно электрода сравнения (16) и измерения силы тока, протекающей между индикаторным (1) и вспомогательным (3) электродами. Газодиффузионный индикаторный электрод (1) двух- и трехэлектродной ячеек из активированного пористого титана совмещен со слоем сепаратора (2) прессованием. Активирование пористого титана диоксидом рутения, диоксидом марганца, оксидами кобальта или композициями этих оксидов осуществляют термическим разложением соответствующих соединений. При этом 3 - 50мг активирующего компонента на 1г титана образует на поверхности пористого индикаторного электрода слой активного компонента толщиной порядка нескольких микрон. Содержание газовых пор в напрессованном на слой сепаратора титане составляет около 30%, что придает ему свойства газодиффузионного электрода. Пассивирующие оксидные слои пористого титана и активирующие компоненты по своей природе являются гидрофильными, вследствие чего индикаторный электрод (1) с высокой истинной поверхностью оказывается смоченным тонкой пленкой фонового раствора электролита. Контакт индикаторного электрода (1) с полимерным сепаратором с гидрофилизирующими добавками (2) исключает затопление газовых пор индикаторного электрода. Сепаратор содержит полимерное связующее в виде порошка фторопласта или полиэтилена и гидрофилизирующую добавку - диоксид кремния в виде порошка силикагеля или аэросила или порошка диоксида циркония, обладающих высокой химической стойкостью в кислых растворах фонового электролита. Хлорсеребряный электрод сравнения (16) в трехэлектродной ячейке расположен между сепаратором (2) и того же состава вторым сепаратором (15) и представляет собой серебряную проволоку, покрытую слоем хлорида серебра известным методом. Поскольку концентрация ионов хлора в фоновом электролите, в качестве которого используют раствор хлорида лития, во времени практически не изменяется, потенциал хлорсеребряного электрода сравнения во времени остается постоянным. Вспомогательные электроды (3) обоих типов ячеек содержат 30 - 80% электропроводящей добавки из порошков титана или графита, 10 - 30% диоксида марганца или диоксида свинца и 10 - 40% фосфата циркония или гидрата сурьмяной кислоты. Вспомогательный электрод (3) трехэлектродной ячейки может содержать 30 - 80% порошка графита или титана, остальное - фосфат циркония или гидрат сурьмяной кислоты. Ячейки, представленные на фиг.1 и 2, могут быть выполнены прессованием в виде таблеток, что упрощает их монтаж в корпусе. Крупные поры вспомогательных электродов (3) ячеек обоих типов заполнены 4 - 7М раствором LiCl лишь частично. При увеличении влажности окружающего газа за счет абсорбции индикаторным электродом (1) паров воды и увеличения объема электролита в ячейке степень заполнения крупных пор вспомогательного электрода возрастает. Соответственно при снижении влажности окружающего газа степень заполнения крупных пор вспомогательного электрода снижается. Стабильное значение pH фонового раствора электролита ячейки поддерживается реакцией ионного обмена между ионами H+ катионообменника и катионами лития Li+ где R-H - фосфат циркония или гидрат сурьмяной кислоты в H+-форме. Обменная емкость этих ионообменников составляет около 1мг-экв на 1г ионообменника при изменении pH на единицу. Требуемое исходное значение pH фонового электролита в ячейках создается предварительной обработкой ионообменника известным методом. Принцип работы ячеек состоит в следующем. В отсутствие аммиака в окружающем газе потенциал индикаторного электрода (1) двухэлектродной ячейки равен потенциалу вспомогательного электрода (3), а потенциал индикаторного электрода (1) трехэлектродной ячейки - задается относительно электрода сравнения (16) с помощью устройства (18). Значение pH фонового электролита - раствора хлорида лития - в индикаторном и вспомогательном электродах двухэлектродной ячейки устанавливаются близкими и стабилизируются реакцией ионного обмена (1). При этом между индикаторным (1) и вспомогательным (2) электродами двухэлектродной ячейки ток не протекает или протекает незначительный фоновый ток. В трехэлектродной ячейке потенциалы индикаторного (1) и вспомогательного (3) электродов могут отличаться, вследствие чего pH фонового электролита в этих электродах также будет различным. При этом между фоновым электролитом индикаторного (1) и вспомогательного (3) электродов возникает градиент концентрации ионов H+, под воздействием которого между электродами будет протекать фоновый ток. Поскольку реальные коэффициенты активности ионов H+ в 4 - 7М растворе хлорида лития намного больше 1, то градиент концентрации ионов H+ в интервале pH 1 - 7 невелик, и фоновым током по сравнению с током, возникающим в ячейке под воздействием аммиака, можно пренебречь. Равновесные потенциалы индикаторных электродов (1) обоих типов ячеек E по отношению к реакции анодного разложения воды с выделением кислорода отвечает уравнению в котором P02 отвечает парциальному давлению кислорода в газе. Здесь и в дальнейшем электрохимические реакции и равновесное значения потенциалов для них приведены при 25°C в форме, принятой в [6]. При поступлении аммиака из окружающего газа в ячейки обоих типов через канал в мембране (13) в пленке электролита индикаторного электрода (1) протекает реакция результатом которой является увеличение pH электролита, например, до значения pHNH3. Согласно реакции (2) значению pHNH3 будет отвечать равновесный потенциал ENH3. Поскольку на индикаторных электродах (1) поддерживается постоянное значение E, то возникает перенапряжение реакции анодного выделения кислорода h02 , численно равное разности E и ENH3, т.е. Под воздействием перенапряжения выделения кислорода на каталитически активном покрытии индикаторных электродов (1) будет протекать электрохимическая реакция (2), а между индикаторными (1) и вспомогательными (3) электродами через внешнюю цепь будет протекать сила тока, отвечающая скорости поступления аммиака на индикаторные электроды (1). Реакции (2) и (3) дают общую реакцию на индикаторных электродах (1) Катионы аммония NH4+ через сепараторы ячеек (фиг.1 и 2) будут диффундировать в электролит вспомогательных электродов. Протекание общей реакции (5) в пленке электролита индикаторного электрода (1) эффективно при pH меньше 7. При pH больше 7 растворяющийся в фоновом электролите аммиак образует буферные растворы, не вызывая соответствующего изменения pH электролита. При pH меньше 1 над растворами фонового электролита возникает заметное давление хлороводорода, который через канал в мембране (13) удаляется в окружающий газ, что приводит к потере электролита в ячейке. В присутствии диоксида марганца на вспомогательных электродах (3) при работе ячеек обоих типов протекают катодные реакции: Катодные реакции (6) и (7) протекают с потреблением ионов H+, что приводит к нарушению равновесия реакции (1) и протеканию последней слева направо с генерацией ионов H+. Если катионообменное вещество R-H способно селективно обменивать ионы H+ на катионы NH4 и Mn2+, как это имеет место при использовании фосфата циркония и гидрата сурьмяной кислоты, то во вспомогательных электродах (3) при работе ячеек протекают следующие ионообменные реакции При работе ячеек обоих типов с диоксидом марганца во вспомогательных электродах с электролитом при pH 1 4 анодной реакции (5) на индикаторных электродах (1), катодной реакции (6) на вспомогательных электродах (3) и ионообменных реакциях (8) и (9) во вспомогательных электродах отвечает суммарный процесс Соответственно протекание на индикаторных электродах (1) реакции (5) и на вспомогательных электродах (3) электродной реакции (7) в электролите pH 4 - 7 и ионообменной реакции (8) отвечает суммарному процессу При работе ячейки во вспомогательном электроде (3) которой содержится диоксид свинца, в фоновом электролите при pH 5 - 7 преимущественно протекают электродная реакция и ионообменная реакция (8). Реакциям (5), (12) и (8) при работе ячеек обоих типов отвечает суммарный процесс В трехэлектродной ячейке, содержащей во вспомогательном электроде (3) ионообменное вещество и порошок графита или порошок титана, будут протекать катодные реакции: в случае графита - восстановление кислорода а в случае титана - образование гидрида титана Суммарные процессы при работе трехэлектродной ячейки, отвечающие электродным реакциям (5), (14) и ионообменной реакции (8), описываются уравнением а суммарные процессы, отвечающие реакциям (5), (15) и (8) - уравнением Как следует из суммарных процессов, протекающих при работе ячеек, их ресурс определяется обменной емкостью катионообменного вещества в H+-форме и количеством оксидов во вспомогательном электроде (3), а при использовании графита в трехэлектродной ячейке - только обменной емкостью катионообменного вещества. Для последнего случая 1г фосфата циркония или гидрата сурьмяной кислоты во вспомогательном электроде объемом не более 1см3 при эксплуатации трехэлектродной ячейки от начального значения pH 1 до конечного pH 6 исходя из обменной емкости этих катионообменников 1мг-экв/на единицу pH дает расчетное значение ресурса 26,8 × 10-3 × 5 = 0,134А × ч, где 26,8 - постоянная Фарадея. Этот ресурс эквивалентен сроку непрерывной эксплуатации ячейки при силе тока 10мкА более 1,5 лет. В отсутствие катионообменного вещества работа этой ячейки также ограничивалась бы диапазоном изменения pH электролита от 1 до 6, что при объеме электролита в ячейке около 0,5см3 отвечало бы количеству прореагировавших H+ ионов 10-2 × 0,5 × 10-3 = 5 × 10-6мг-экв, где 10-2 - аналитическая концентрация ионов H+ в 6М растворе хлорида лития при pH 1. Этому количеству ионов H+ отвечает ресурс ячейки 5 × 10-6 × 26,8 = 0,134мА × ч, что на три порядка ниже ресурса предложенной ячейки. Таким образом, предложенные решения позволяют создавать электрохимические ячейки с высокими ресурсными характеристиками. Показатели работы предложенных электрохимических ячеек приведены в следующих примерах. Пример 1. Двухэлектродная ячейка согласно фиг.1 выполнена в виде спрессованной таблетки (диаметром 18 и высотой 8мм) в составе индикаторного электрода (1), сепаратора (2) и вспомогательного электрода (3), установлена в обечайке (4) и смонтирована в корпусе (5). Индикаторный электрод (1) представляет собой 0,3г пористого титана, активированного 1 - 10мг диоксида рутения. Сепаратор (2) состоит из смеси порошков фторопласта (0,4г) и силикагеля или диоксида циркония (0,15г). Вспомогательный электрод (3) содержит смесь порошков диоксида марганца (0,3г), порошка титана (5г) и фосфата циркония (0,85г). Таблетка пропитана фоновым раствором электролита - 6M LiCl. Предварительная подготовка используемого во вспомогательном электроде фосфата циркония обеспечивала стабилизацию электролита в ячейке при pH 2. Четыре другие ячейки отличались от описанной активирующим компонентом индикаторного электрода (1) или компонентами вспомогательного электрода (2) при том же их массовом содержании. Ячейки подключали к резистору (15) и высокоомному вольтметру (16). Испытания ячеек проводили в корпусах с мембранами (13) толщиной 1,5мм, в которых выполнены каналы диаметром 2 или 0,4мм. В ходе испытаний вольтметром (16) измеряли падение напряжения на резисторе (15) сопротивлением 100Ом, по величине которого определяли силу тока, протекающую через ячейку под воздействием заданной концентрации аммиака. Например, в присутствии в окружающем газе 100ppm аммиака на ячейке с диаметром канала в мембране 2мм на резисторе устанавливается падение напряжения 0,83иВ, что отвечает силе тока 8,3мкА или нормировке сигнала 0,083мкА/ppm. Аналогично при 2500ppm аммиака на ячейке с диаметром канала в мембране 0,4мм на резисторе устанавливается падение напряжения 0,85мВ, что отвечает силе тока 8,5мкА или нормировке сигнала 0,0034мкА/ppm. При испытаниях определяли быстродействие ячеек t0,9 (время, в течение которого при подаче аммиака достигается 90% от установившегося значения силы тока при заданной концентрации аммиака), диапазон концентрации аммиака, в котором соблюдалась линейность зависимости силы тока от его концентрации, и нормировку сигнала после изготовления ячеек и через 100 часов их эксплуатации при силе тока 10мкА. Последняя величина характеризует ресурсные возможности ячеек. Результаты испытаний пяти ячеек с предложенными составами индикаторных (1) и вспомогательных электродов (2) приведены в таблице. В таблице символом ZrP обозначен фосфат циркония, a Sb2O5 × nН2O - химическая формула гидрата сурьмяной кислоты, а в скобках указаны значения pH фонового электролита ячеек в присутствии этих ионообменников. Как видно из таблицы, год для испытанных ячеек составляло менее 60с, а нормировка сигнала после пробега ячеек в течение 100ч при средней силе тока 10мкА практически не изменялась. Зависимость силы тока от концентрации аммиака в диапазоне 0 - 500ppm и 0 - 12000ppm соответственно для ячеек с диаметром каналов в мембранах (13) 2 и 0,4мм имели линейный характер. Пример 2. Двухэлектродная ячейка согласно фиг.1 представляет собой совмещенные прессованием индикаторный электрод (1) и сепаратор (2), а вспомогательный электрод (3) содержит уплотненную в обечайке (4) смесь порошков фосфата циркония (2г), диоксида марганца (1г) и порошка графита (0,6г). Эта сборка пропитана раствором 6М LiCl при pH 2. Предложенная ячейка при тех же габаритных размерах, что и ячейки примера 1, содержит больше диоксида марганца и фосфата циркония и, следовательно, обладает большим ресурсом и способна работать в более широком диапазоне концентраций аммиака. Величина t0,9 и нормировка сигналов этой ячейки в пределах ошибки опытов совпадали с данными, приведенными в таблице. Зависимости силы тока от концентрации аммиака имели линейный характер в диапазоне 0 - 1200ppm и 0 - 25000ppm соответственно для ячеек с диаметрами каналов в мембране (13) 2 и 0,4мм. Пример 3. Трехэлектродная ячейка согласно фиг.2 представляет собой спрессованную таблетку в составе индикаторного электрода (1), сепаратора (2), электрода сравнения (16) в виде серебряной проволоки, покрытой хлоридом серебра, второго сепаратора (15) и вспомогательного электрода (3), пропитана 6М раствором хлорида лития, помещена в обечайке (4) смонтирована в корпусе (5) и подключена к потенциостатирующему устройству (18). С помощью потенциостатирующего устройства задавали анодный потенциал индикаторному электроду (1) 0,8В относительно электрода сравнения (16) и определяли силу тока между индикаторным (1) и вспомогательным (2) электродами при подаче аммиака. Количество и состав компонентов в индикаторных (1) и вспомогательных (3) электродах ячеек были те же, что и для ячеек 1 - 5 в таблице примера 1. Состав второго сепаратора (16) отвечал составу сепаратора (1). Величины t0,9 и нормировка сигналов всех ячеек в пределах ошибки опытов совпадали с данными, приведенными в таблице. Зависимость силы тока от концентрации аммиака имела линейный характер в диапазоне 0 - 1500ppm и 0 - 30000ppm соответственно для ячеек с диаметром каналов в мембране (13) 2 и 0,4мм. Пример 4. Трехэлектродная ячейка согласно фиг.2 представляет совмещенные прессованием индикаторный электрод (1) в виде пористого титана, активированного диоксидом рутения, сепаратор (2), хлорсеребряный электрод сравнения (16) и второй сепаратор (15), а вспомогательный электрод (3) содержит уплотненную в обечайке (4) смесь порошков фосфата циркония (3г) и порошка графита (1г). Эта сборка пропитана 6М хлоридом лития при pH 6. Испытания ячейки проводили при условиях, оговоренных в примере 3. Величина t0,9 и нормировка сигнала этой ячейки совпадала с данными таблицы. Зависимость силы тока от концентрации аммиака имела линейный характер в диапазоне 0 - 1600 и 0 - 31000ppm соответственно для ячеек с диаметром каналов в мембране (13) 2 и 0,4мм. Аналогичные данные получены в ячейке, вспомогательный электрод (3) которой содержал 3г гидрата сурьмяной кислоты (pH 3) и 2г порошка титана.
ДивитисяДодаткова інформація
Назва патенту англійськоюElectrochemical cell for amperometric estimation of ammonia in gases
Автори англійськоюChviruk Volodymyr Petrovych, Liniucheva Olha Volodymyrivna, Chviruk Oleksandr Volodymyrovych
Назва патенту російськоюЭлектрохимическая ячейка для амперометрического определения аммиака в газах
Автори російськоюЧвирук Владимир Петрович, Линючева Ольга Владимировна, Чвирук Александр Владимирович
МПК / Мітки
МПК: G01N 27/403
Мітки: газах, амперометричного, комірка, електрохімічна, визначення, аміаку
Код посилання
<a href="https://ua.patents.su/6-25267-elektrokhimichna-komirka-dlya-amperometrichnogo-viznachennya-amiaku-v-gazakh.html" target="_blank" rel="follow" title="База патентів України">Електрохімічна комірка для амперометричного визначення аміаку в газах</a>
Попередній патент: Композиція водних чорнил та покриття, що вміщують воду та модифіковані вуглецеві продукти
Наступний патент: Пристрій для конденсації питної води з атмосфери
Випадковий патент: Застосування повністю людського анти-vap-1-антитіла для лікування фіброзних станів