Гербіцидна композиція та спосіб приглушення бур’янів
Номер патенту: 26972
Опубліковано: 28.02.2000
Автори: БУЛО Жан-Пол, Робертс Девід Алан, Кремп Сусан Мері, Уолліс Дерек Ян
Формула / Реферат
1. Гербицидная композиция, содержащая производное изоксазола и целевые добавки, отличающаяся тем, что в качестве производного изоксазола она содержит соединение формулы (I)
где R1 – С1-С4 - алкил, фенил, незамещенный или замещенный хлором, фтором, нитро, метокси, С3-С5 - циклоалкил, циклопропил, замещенный метилом или этоксикарбонилом, аминогруппа, 1-этоксикарбонил-1-метилэтил, R2 - С1-С4 - алкил, галоген, нитро, циано, трифторметил, пентафторэтил, С1-С2 -алкокси, С1-С2 - алкилсульфонил, метилтио, метилэтокси, метоксикарбонил, 1-метилэтоксикарбонил, n составляет 1 - 3 в количестве 0,05 - 90%мас.
2. Способ подавления сорных растений путем их довсходовой и послевсходовой обработки композицией, содержащей производное изоксазола и целевые добавки, отличающийся тем, что в качестве производного изоксазола используют соединение формулы (I)
где R1 - С1-С4 - алкил, фенил, незамещенный или замещенный хлором, фтором, нитро, метокси, С3-С5 - циклоалкил, циклопропил, замещенный метилом или этоксикарбонилом, аминогруппа, 1-этоксикарбонил-1-метилэтил, R2 - С1-С4 - алкил, галоген, нитро, циано, трифторметил, пентафторэтил, С1-С2 -алкокси, С1-С2 - алкилсульфонил, метилтио, метилэтокси, метоксикарбонил, 1-метилэтоксикарбонил, n составляет 1 - 3 в количестве 0,05 - 90%мас., целевые добавки - остальное при дозе расхода соединения формулы (I), равной 62 - 4000г/га.
Текст
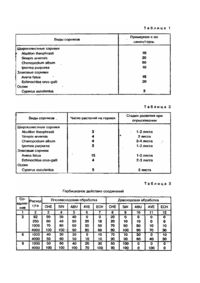
Изобретение относится к химическим средствам защиты растений, конкретно, к гербицидной композиции и способу подавления сорных растений с использованием композиции. Уже известно использование замещенных производных изоксазола, в частности 4-бензоил-5-метилизоксазола в качестве биологически активных соединений. Однако известные соединения проявляют недостаточное биологическое действие. Задачей изобретения является подбор компонентов композиции и режимов способа, в результате чего достигается усиление гербицидного действия. Указанная задача достигается использованием гербицидной композиции, включающей производное изоксазола общей формулы (I): где R1 – С1-С4 - алкил, фенил, незамещенный или замещенный хлором, фтором, нитро, метокси, С3-С5 циклоалкил, циклопропил, замещенный метилом или этоксикарбонилом, аминогруппа, 1-этоксикарбонил-1 метилэтил, R2 – С1-С4 - алкил, галоген, нитро, циано, трифторметил, пентафторэтил, С1-С2 - алкокси, С1-С2 алкилсульфонил, метилтио, метилэтокси, метоксикарбонил, 1-метилэтоксикарбонил, n составляет 1 - 3, в количестве 0,05 - 90%масс, оптимальное - целевые добавки, а также способом подавления сорных растений путем довсходовой и послевсходовой обработки сорных растений указанной выше композицией при дозе расхода активного вещества формулы (I) 62 - 4000 г/га. В настоящем изобретении были использованы следующие соединения формулы (I). Соединения формулы (I) и их температуры плавления, и ЯМР-спектры указаны ниже: 1. 5-Метил-4-(2-нитро-4-трифторметил-бензоил)-изоксазол, t пл. 85 – 86°С. 2. 5-Метил-4-(2-нитробензоил)-изоксазол, t пл. 104,5 - 105,5°С. 3. 4-(2-Нитро-4-трифторметилбензоил)-5-фенилизоксазол, t пл. 149,5 - 150,5°С. 4. 4-(2,4-Динитробензоил)-5-метили-зоксазол, t пл. 133 – 135°С. 5. 5-(4-Хлорфенил)-4-(2-нитро-4-трифторметилбензоил)-изоксазол, t пл. 159 – 160°С. 6. 4-(2-Хлорбензоил)-5-метилизоксазол. Спектр ЯМР: 2,62 (3Н, С), 7,4 (2Н, М), 7,49 (2Н, М), 8,29 (1Н, С). 7. 5-Метил-4-(2-нитро-4-метилсульфонилбензоил)-изоксазол, t пл. 159 – 160°С. 8. 5-(1-Метилэтил)-4-(2-нитро-4-трифторметилбензоил)-изоксазол, t пл. 138 - 139°С. 9. 4-(4-Хлорбензоил)-5-метилизоксазол, t пл. 65 – 66°С. 10. 4-(4-Метилбензоил)-5-метилизоксазол, t пл. 67°С. 11. 5-(4-Фторфенил)-4-(2-нитро-4-фторметилбензоил)-изоксазол, t пл. 150 – 151°C. 12. 5-Этил-4-(2-нитро-4-трифторметилбензоил)-изоксазол, t пл. 86 – 87°С. 13. 4-(4-Хлор-2-нитробензоил)-5-метилизоксазол, t пл. 98 - 99°С. 14. 4-(2-Нитро-4-трифторметилбензоил)-5-пропилизоксазол, t пл. 102 – 103°С. 15. 5-Циклопропил-4-(2-нитро-4-трифторметилбензоил)-изоксазол, t пл. 124,5 – 125°C. 16. 4-(2,3-Дихлор-4-метилсульфонилбензоил)-5-метилизоксазол, t пл. 120 – 129°С. 17. 5-(1,1 -Диметилэтил)-4-(2-нитро-4-трифторметилбензоил)-изоксазол, t пл. 169 – 170°С. 18. 4-(4-Метоксибензоил)-5-метилизоксазол, t пл. 78 - 79°С. 19. 5-Метил-4-(4-метил-2-нитробензоил)-изоксазол, t пл. 69 – 70°С. 20. 4-(2,3-Дихлор-4-метилсульфонилбензоил)-5-(1-метилэтил)-изоксазол, t пл. 104 - 106°С. 21. 5-Циклопропил-4-(2,3-дихлор-4-метилсульфонилбензоил)-изоксазол, t пл. 127,6 - 128,8°С. 22. 4-(2-Нитро-4-трифторметилбензоил)-5-фенилметилизоксазол, t пл. 86,5 - 87,5°С. 23. 4-(2-Хлор-4-трифторметилбензоил)-5-циклопропилизоксазол, t пл. 39 – 40°С. 24. 5-Метил-4-(2-нитро-4-пентафторэтилбензоил)-изоксазол, t пл. 128 – 129°С. 25. 5-Циклопропил-3-[4-(1,1-диметилэтил)-2-нитробензоил]-изоксазол, t пл. 87 - 89°С. 26. 4-[4-(1,1-диметилэтил)-2-нитробензоил-]5-метилизоксазол, t пл. 124,8 – 125°С. 27. 5-Циклопентил-4-(2-нитро-4-трифторметилбензоил)-изоксазол, t пл. 136,8°С. 28. 4-(2,4-Дихлорбензоил)-5-метилизоксазол. Спектр ЯМР 2,6 (3Н, С), 7,8 (2Н, М) 7,4 (1Н, С), 8,2 (1Н, С). 29. 4-(2-Хлор-4-метилсульфонилбензоил)-5-метилизоксазол, t пл. 113,8°С. 30. 4-(2-Хлор-4-трифторметилбензоил)-5-метилизоксазол, t пл. 52,1°С. 31. 5-Метил-4-(2-трифторметилбензоил)-изоксазол. Спектр ЯМР: 2,5 (3Н, С), 7,4 (1Н, М), 7,6 (2Н, М), 7,7 (1Н, М), 8,15 (1Н, С). 32. 5-Метил-4-(2,4-трифторметилбензоил)-изоксазол. Спектр ЯМР: 2,6 (3Н, С), 7,5 (1Н, С), 7,9 (1Н, о), 8,0 (1Н, С), 33. 4-(2-Хлор-4-метилсульфонилбензоил)-5-циклопропилизоксазол, t пл. 115 – 117°С. 34. 5-Циклопропил-4-(2-трифторметилбензоил)-изоксазол. Спектр ЯМР: 1,2 (2Н, М), 1,3 (2Н, М), 2,55 (1Н, М), 7,5 (1Н, М), 7,7 (2Н, М), 7,8 (1Н, М), 8,15 (1Н, С) 35. 5-Циклопропил-4(2,4-дихлорбензоил)-изоксазол. Спектр ЯМР: 1,15 (М, 2Н), 1,25 (2Н, М), 2,6 (1Н, М), 7,3 (2Н, С), 7,4 (1Н, С), 8,15 (1Н, С). 36. 4-[2,3-Дихлор-4-(метилтио)-бензоил]-5-метилизоксазол, t пл. 126 – 128°С. 37. 5-Циклопропил-4-(2,4-бис-трифторметилбензоил)-изоксазол, t пл. 74 – 75°С. 38. 4-(4-Хлор-2-трифторметилбензоил)-5-метилизоксазол, t пл. 89 - 89,5С. 39. 4-(4-Циано-2-нитробензоил)-5-метилизоксазол, t пл. 155 – 156°С. 40. 5-Амино-4-(2-нитро-4-трифторметилбензоил)-изоксазол, t пл. 165 – 166°С. 41. 4-(4-Хлор-2-трифторметилбензоил)-5-циклопропил-изоксазол. Спектр ЯМР: 1,2 (2Н, М), 1,4 (2Н, М), 2,6 (3Н, М), 7,4 (1Н, С), 7,7 (1Н, о), 7,8 (С, 1Н), 8,1 (1Н, С). 42. 5-(1-Метилэтил)-4-(2-нитро-4-пентафторэтилбензоил)-изоксазол, t пл. 139 - 140,5°С. 43. 4-(2-Хлор-4-метилсульфонилбензоил)-5-(1-метилэтил)-изоксазол, t пл. 126 – 127°С. 44. 5-Циклопропил-4-(4-фтор-2-нитробензоил)-изоксазол, t пл. 113,8 - 114,2°С. 45. 5-Циклопропил-4-(2-нитро-4-пентафторэтилбензоил)-изоксазол, t пл. 108,6 – 110°С. 46. 4-(2,3-Дихлор-4-метилсульфонилбензоил)-5-метилизоксазол, t пл. 125 - 126,4°С. 47. 5-Циклобутил-4-(2-нитро-4-трифторметилбензоил)-изоксазол, t пл. 147 – 148°С. 48. 4-(4-Фтор-2-нитробензоил)-5-метилизоксазол, t пл. 85 – 87°С. 49. 5-(1 -Метилциклопропил)-4-(2-нитро-4-трифторметилбензоил)-изоксазол, t пл. 150 – 152°С. 50. 5-(4-Нитрофенил)-4-(2-нитро-4-трифторметилбензоил)-изоксазол, t пл. 170 – 171°С. 51. 5-(4-Метоксифенил)-4-(2-нитро-4-трифторметилбензоил)-изоксазол, t пл. 154 – 155°С. 52. 4-(2-Хлор-3-этокси-4-метилсульфонилбензоил)-5-метилизоксазол, t пл. 104 – 106°С. 53. 4-(3-Цианобензоил)-5-метилизоксазол, t пл. 93,8 - 94,4°С. 54. 5-(Циклопропил-4-(4-метилсульфонил-2-трифторбензоил)-изоксазол, t пл. 145,6 - 146,6°С. 55. 5-Циклопропил-4-(2-нитро-4-метилсульфонилбензоил)-изоксазол, t пл. 154,6 - 155,2°С. 56. 4-(2-Хлор-3-этокси-4-метилсульфонилбензоил)-5-циклопропилизоксазол, t пл. 119 - 120,2°С. 57. 4-(2-Хлор-3-этокси-4-этилсульфонилбензоил)-5-метилизоксазол, t пл. 108,4 – 109°С. 58. 4-(2-Хлор-3-этокси-4-метилсульфонилбензоил)-5-(1-метилэтил)-изоксазол, t пл. 82,5 - 84,3°С. 59. 4-(2-Хлор-3-этокси-4-этилсульфонилбензоил)-5-циклопропилизоксазол t пл. 127,4 - 128,2°С. 60. 5-(1-Этоксикарбонилциклопропил)-4-(2-нитро-4-трифторметилбензоил)-изоксазол. Спектр ЯМР: 1,1 (Т, 3Н), 7,6 (1Н, с), 1,4 (2Н, м), 8,0 (1Н, с), 1,6 (2Н, м), 8,1 (1Н, с), 4,0 (1Н, д), 8,4 (1Н, с). 61. 4-(3-Метоксикарбонил-2-метил-4-метилсульфонилбензоил)-5-метилизоксазол, t пл. 54 - 57°С. 62. 5-(2-Метилциклопропил)-4-(2-нитро-4-трифторметилбензоил)-изоксазол, t пл. 106 - 107,5°С. 63. 4-[2-Хлор-3-(1-метилэтокси)-4-метилсульфонилбензоил)-5-метилизоксазол, t пл. 119 - 120,2°С. 64 5-Метил-4-[3-метил-3-(1-метилэтоксикарбонил)-4-метилсульфонилбензоил]-изоксазол, t пл. 131 – 135°С. 65. 5-Циклопропил-4-[2-метил-3-(1-метилэтоксикарбонил)-4-метилсульфонилбензоил)-изоксазол, t пл. 164 – 166°С. 66. 5-(1-Этоксикарбонил-1-метилэтил)-4-(2-нитро-4-фторметилбензоил)-изоксазол, t пл. 108 – 109°С. 67. 5-Циклопропил-4-(2,3,4-трихлорбензоил)-изоксазол, t пл. 105 – 107°С. Соединение 1 получают по способу указанному в примере 1. Пример 1. Смесь неочищенного 2-этоксиметилен-1-(2-нитро-4-трифторметилфенил)-бутан-1,3-диона (13,25г) и гидрохлорида гидроксиламима (3,7г) в этаноле (80мл) перемешивали 5 часов. Раствор выпаривали почти досуха и полученный остаток разбавляли этилацетатом (100мл). Раствор промывали водой (три раза по 40мл), сушили (безводным сульфатом натрия) и фильтровали. Фильтрат выпаривали досуха. Остаток растирали со смесью эфира и уайт-спирта (точка кипения 60 – 80°С) в отношении 1:1 и полученное твердое вещество цвета буйволовой кожи отфильтровывали. Твердое вещество растворяли в дихлорметане (100мл) и фильтровали через двуокись кремния. Двуокись кремния промывали дихлорметаном (200мл), объединенные фильтраты выпаривали досуха и получали 4(2-нитро-4-трифторметилбензоил)-5-метилизоксазол (4,5г) в виде не совсем белого твердого вещества. Точка плавления 85 – 86°С. Способом, аналогичным описанному выше, получали также соединения 5, 8, 11, 12, 14, 15, 17, 22, 24, 27, 39, 40, 42, 45, 60, 62, 66. Соединение 2 получают по способу, указанному в примере 2. Пример 2. Соединение 2. Триэтиламин (1,9г) добавляли к смеси 2-этоксиметилен-1-(2-нитрофенил)-бутан-1,3-диона (4,9г) и гидрохлорида гидроксиамина (1,3г) в ацетонитриле (100мл) при перемешивании. Смесь перемешивали в течение двух часов и оставляли на ночь. Смесь выпаривали почти досуха и добавляли воду (100мл). Смесь экстрагировали этилацетатом (два раза по 75мл), сушили, (безводным сульфатом магния) и фильтровали. Фильтрат выпаривали досуха и получали 4-(2-нитробензоил)-5-метилизоксазол (2,4г) в виде коричневого твердого вещества, точка плавления 104,5 – 105,5°С. Способом, аналогичным описанному, получают также соединения 2, 4, 6, 7, 13, 16, 19 - 21, 23, 25 - 38, 41, 43, 44, .47 - 67. В примерах 3, 4, 5 описаны способы получения соединений 46, 9, 18. Пример 3. 3-Хлорнадбензойную кислоту (85%, 0,99г) по частям добавляли к перемешиваемому раствору 4-[2,3дихлор-4-(метилтио)-бензоил]-5-метилизоксазола (1,5г) в дихлорметане (50мл), поддерживая температуру ниже 20°С. Смесь перемешивали при –20°С один час. Добавляли дихлорметан (50мл) и твердое вещество удаляли фильтрацией. Фильтрат выпаривали досуха и остаток хроматографировали на кремнеземе, элюированном смесью этилацетатциклогексан в отношении 1:5 и получали 4-(2,3-дихлор-4-метилсульфинилбензоил)-5-метилизоксазол (0,8г) в виде твердого белого вещества, точка пл. 125 - 126,4°С. Пример 4. Смесь хлористого алюминия (16г) и хлористого 5-метилизоксазол-4-карбонила (5,0г) в сухом хлорбензоле (50мл) перемешивали в атмосфере азота 16 часов. Смесь нагревали до 80°С за полтора часа. Охлажденную смесь резко охлаждали избытком льда и экстрагировали этилацетатом (три раза по 200мл). Объединенные органические слои промывали водой (три раза по 500мл), сушили (безводным сульфатом магния) и фильтровали. Фильтрат выпаривали досуха. Остаток очищали хроматографией на кремнеземе, элюировали смесью этилацетатциклогексан в отношении 1:20 и получали 4-(4-хлорбензоил)-5-метилизоксазол (5,2г) в виде желтого твердого вещества, точка плавления 65 – 66°С. Аналогичным образом получают следующее соединение: 4-(4-метилбензоил)-5-метилизоксазол. Спектр ЯМР (CDCI3): 2,36 (3Н, с), 2,59 (3Н, с), 7,2 - 7,7 (4Н, м), 8,36 (1Н, с), начиная с толуола. Пример 5. Смесь хлористого алюминия (10г) и хлористого 5-метилизоксазол-4-карбонила (2,7г) в метоксибензоле (50мл) перемешивали при комнатной температуре 16 часов. Реакцию прекращали избытком льда и экстрагировали эфиром (три раза по 200мл). Объединенные органические слои промывали водой (три раза по 500мл), сушили (безводным сульфатом магния) и фильтровали. Фильтрат выпаривали досуха. Остаток очищали хроматографией на кремнеземе, элюированном смесью метилацетат-циклогексан в отношении 1:10 с последующей высоко производительной жидкостной хроматографией на двуокиси кремния, элюированной смесью этилацетат-гексан в отношении 1:20 и получали 4-(4-метоксибензоил)-5-метилизоксазол (0,35г) в виде белого твердого вещества, точка плавления 78 – 79°С. Настощяее изобретение предусматривает использование композиций, пригодных для гербицидного использования, содержащих одно производное изоксазола общей формулы (І) в сочетании с и предпочтительно гомогенно диспергированных в одном или более совместимых гербицидно приемлемых разбавителях или носителях, и/или поверхностно-активных веществах того типа, которые обычно приемлемы в данной области, и пригодны для использования в гербицидных композициях с соединениями общей формулы (III). Использованный выше термин "гомогенно диспергированные" включает композиции, в которых соединения общей формулы (III) растворены в других компонентах. Термин "гербицидные композиции" использован в широком смысле и включает не только композиции, готовые к употреблению в качестве гербицидов, но также и концентраты, которые должны быть разбавлены перед употреблением. Предпочтительно композиции содержат от 0,05 до 90 весовых процентов одного или более соединений общей формулы (IІІ). Гербицидные композиции могут содержать как разбавитель или носитель, так и поверхностно-активное вещество (т.е. смачивающее средство, диспергирующее или эмульгирующее средство). Поверхностно-активные вещества, которые могут присутствовать в гербицидных композициях согласно настоящему изобретению, могут быть ионоактивными или неионогенными типами, например, сульфорицинолеаты, производные четвертичного аммония, продукты, основанные на конденсатах окиси этилена с алкил- и полиарилфенолами, т.е. нонил- или октил фенолами, или сложными эфирами карбоновых кислот ангидросорбитов, которые становятся растворимыми при этерификации свободных оксигрупп конденсацией с окисью этилена, сложных эфиров серной кислоты, соли щелочного и щелочноземельного металла и сульфоновых кислот, такие как динонил- и диоктил-натрий-сульфосукцинаты и соли щелочного и щелочноземельного металла производных высокомолекулярных сульфокислот, такие как лигносульфонаты натрия и кальция и алкилбензолсульфонаты натрия и калия. Примерами подходящих твердых разбавителей или носителей являются алюмосиликаты, тальк, окись магния, кизельгур, трикальцийфосфат, порошкообразное пробковое вещество, адсорбированная газовая сажа, и глины, такие как каолин и бентонит. Твердые композиции, которые могут иметь форму дустов, гранул или смачивающихся порошков, предпочтительно получают помолом соединений общей формулы (III) с твердыми разбавителями или пропиткой твердых разбавителей или носителей растворами соединений общей формулы (III) в летучих растворителях, испарением растворителей и, если необходимо, помолом продуктов для получения порошков. Гранулированные формы препаратов могут быть получены абсорбцией соединений общей формулы (III), (растворенных в подходящих растворителях, которые могут быть, если желают, летучими) в твердые разбавители или носители в гранулированной форме и, если желают, выпариванием растворителя, или гранулированием композиций в порошкообразной форме, полученных как описано выше. Твердые гербицидные композиции, в частности, смачивающиеся порошки и гранулы могут содержать смачивающие или диспергирующие средства (например, описанных выше Типов), которые могут, будучи твердыми веществами, также служить в качестве разбавителей или носителей. Жидкие композиции согласно изобретению могут иметь форму водных, органических или смешанных водноорганических растворов, суспензий и эмульсий, которые могут содержать поверхностно-активное вещество. Подходящие жидкие разбавители для введения в жидкие композиции включают воду, гликоли, тетрагидрофурфуриловый спирт, ацетофенон, циклогексанон, изофорон, толуол, ксилол, минеральное, животное и растительное масла и легкие ароматические и нефтеновые фракции нефти (или смеси этих разбавителей). Поверхностно-активные вещества, которые могут присутствовать в жидких композициях, могут быть ионогенного или неионогенного типа (например, описанного выше) и, будучи жидкостями, могут также служить в качестве разбавителей или носителей. Следующие примеры иллюстрируют конкретные примеры составов композиций. Пример 6. Смачивающийся порошок был приготовлен из, вес.%: Активный ингредиент (соединение 1) 50 Этилен ВСР (конденсат нонилфенола и этилен-оксида, содержащий 9моль этиленоксида на моль фенола) 5 Аэросил (тонкодисперсная двуокись кремния с микронными размерами частиц) 5 Целит PF (носитель из синтетического силиката магния) 40 Пример 7. Водный суспензионный концентрат получали из, вес.%/объем: 50 Активный ингредиент (соединение 1) Этилен ВСР 1,0 Сопропон Т36 (натриевая соль поликарбоновой кислоты) 40 Этиленгликоль 5,0 Родигель 23 (загуститель из полисахаридной ксантановой смолы) 0,15 До 100 Дистиллированная вода объем. % Пример 8. Соответствующие количества испытываемых соединений растворили в ацетоне для получения растворов, эквивалентных дозам применения 1000, 2000 или 4000г испытываемого соединения на гектар (г-га). Эти растворы наносили из стандартного лабораторного распылителя гербицидов, используя нагнетаемую горизонтально струю при перемещении со скоростью 2,9км/ч и привнося эквивалент 540л распыляемой жидкости на гектар. Прием обработки: применение в предвсходовый период. Семена сорняков высевали на поверхности горшечного компоста в пластмассовых горшках, глубиной 75мм. Количества семян на горшок были следующие (табл.1). Соединения наносят на непокрытые почвой семена, соблюдая вышеуказанные условия, и семена засыпали 25мл просеянного песка после опрыскивания. Отдельный горшок каждого вида семян сорняков резервировали от обработки и необработанные контрольные горшки опрыскивали только ацетоном. После обработки горшки хранили в теплице и поливали дождеванием. Визуальную оценку активности в борьбе с сорняками проводили через 17 - 20 дней после опрыскивания. Результаты выражены в процентах роста или гибели сорняков в сравнении с растениями в контрольных горшках. Приемы обработки: применение в послевсходовый период. Семена сорных видов растений проращивали и затем пересаживали в стадии рассады в горшечный компост в пластиковые горшки, глубиной 75мм, за исключением Avena fatua, которую высевали непосредственно в экспериментальные горшки и не пересаживали. Затем растения выращивали в теплице до того времени, когда растения были готовы к опрыскиванию, испытываемыми соединениями. Число растений на горшках и рост растений при опрыскивании были следующие (табл.2). Испытываемые соединения наносили на растения как описано выше. Отдельный горшок каждого вида сорняков резервировали от обработки и предназначали для контроля, которые опрыскивали только ацетоном. После опрыскивания горшки поливали дождеванием спустя 24 часа после опрыскивания. Визуальную оценку регулирования роста сорняков проводили через 17 - 20 дней после опрыскивания. Результаты выражены в процентах снижения роста или гибели сорняков в сравнении с растениями в контрольных горшках. Будучи применены в довсходовый период в количестве 4000г/га, соединения 1, 2, 4, 5, 6, 7, 8, 9, 11, 12, 13, 15, 16, 19, 22, 27, 28, 29, 30, 31, 32, 35, 39, 40, 42 и 49 дали, по меньшей мере, 90% снижение роста одного или более видов сорных растений. Будучи применены в послевсходовый период в количестве 4000г/га соединения 1, 2, 4, 7, 8, 9, 10, 11, 12, 13, 15, 16, 19, 22, 28, 29, 30, 31, 32, 35, 39, 40, 42, 44, 49 и 53 дали, по меньшей мере, 70%-ое снижение роста одного или более видов сорных растений. При применении в количестве 2000г/га в довсходовом периоде соединения 3, 14, 18, 20, 21, 23, 24, 25, 33, 34, 36, 37, 38, 41, 43, 45, 46, 47, 48, 51 и 52 дали, по меньшей мере, 90% снижение роста одного или более видов сорных растений. При применении в послевсходовом периоде в количестве 2000 г/га соединения 3, 14, 17, 18, 20, 21, 23, 25, 26, 33, 34, 36, 37, 38, 41, 43, 45, 46, 48, 50 и 52 дали, по меньшей мере, 70% снижение роста одного или более видов сорных растений. При применении в довсходовом периоде в количестве 1000г/га соединения 54, 55, 56, 57, 58, 59, 60, 61, 63, 64, 65, 66 и 67 дают, по меньшей мере, 80% снижение роста одного или более видов сорных растений. При применении в послевсходовом периоде в количестве 1000г/га соединения 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65 и 67 дают, по меньшей мере, 70%-е снижение роста одного или более видов сорных растений. Ниже приведена табл.3, в которой в условиях эксперимента указаны сведения о гербицидном действии для заявленных и известного соединения А-(4-бензоил-5-метилизоксазола).
ДивитисяДодаткова інформація
Назва патенту англійськоюHerbicidal composition and method to inhibit weeds
Автори англійськоюROBERTS David Alan, Cramp Susane Mary, Wallis Derek Jan
Назва патенту російськоюГербицидная композиция и способ угнетения сорняков
Автори російськоюРобертс Дэвид Алан, Крэмп Сусан Мэри, Уоллис Дерек Ян
МПК / Мітки
МПК: C07D 261/00, A01P 13/00, A01N 43/80
Мітки: бур'янів, спосіб, приглушення, композиція, гербіцидна
Код посилання
<a href="https://ua.patents.su/6-26972-gerbicidna-kompoziciya-ta-sposib-priglushennya-buryaniv.html" target="_blank" rel="follow" title="База патентів України">Гербіцидна композиція та спосіб приглушення бур’янів</a>
Попередній патент: Спосіб одержання стимулятора росту рослин “росток” із бурого вугілля
Наступний патент: Піч для опалювання
Випадковий патент: Світильник