Склоподібний неорганічний твердий електроліт і спосіб його одержання
Номер патенту: 67973
Опубліковано: 25.04.2007
Автори: Новак Петро Якович, Кваша Андрій Михайлович, Носенко Олександр Васильович, Шембель Олена Мойсеївна
Формула / Реферат
1. Склоподібний неорганічний твердий електроліт, що містить компоненти Li2O, Li2SО4, В2О3, з шихти на основі карбонату літію, який відрізняється тим, що додатково містить МоО3 при наступному співвідношенні зазначених компонентів, мол. %: 59,55-65 Li2O, 10-20 Li2SО4, 19,85-25 В2О3, до 0,75 МоО3, і характеризується величиною іонної провідності при температурі 25 °С (1,4-4,3)·10-6 См·см-1 і температурним коефіцієнтом лінійного розширення (210±20)·10-7 град-1, при цьому шихту для його синтезу складають з карбонату літію, сульфату амонію, борної кислоти і МоО3.
2. Спосіб одержання склоподібного неорганічного твердого електроліту з шихти, що включає карбонат літію, сульфат амонію і борну кислоту, який включає температурну обробку шихти із наступним охолодженням на повітрі, який відрізняється тим, що температурну обробку шихти проводять у два етапи: попередньо витримують при температурі 140-160 °С протягом 0,5-1 години, а потім при температурі 900-950 °С протягом 20-40 хвилин в умовах кавітаційного перемішування.
3. Спосіб за п. 2, який відрізняється тим, що кавітаційне перемішування здійснюють при частоті 22-44 кГц.
Текст
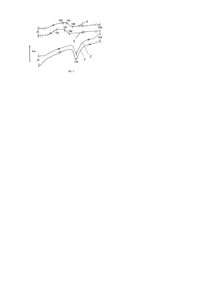
Винахід відноситься до галузі високоенергоємних хімічних джерел струму, а саме до сполук літіевмісних склоподібних матеріалів, що використовуються як тверді електроліти літієвих хімічних джерел струму (ХДС), працездатних при кімнатних температурах. Літієві ХДС мають ряд суттєвих переваг і вигідно відрізняються від традиційних джерел струму. Характеризуються підвищеними значеннями розрядної напруги (від 1,5 до 4,5В), питомих енергетичних характеристик, терміну служби, періоду схоронності і широким температурним інтервалом роботи. Питомі характеристики літієвих ХДС, розраховані термодинамічним способом, досягають більш 1000(Вт×год)×кг-1. Незважаючи на успіхи в розвитку і численні переваги літієвих ХДС назріла необхідність підвищення ефективності їхньої роботи. Зокрема, у даний момент усе ще невирішеними залишаються проблеми росту дендритів літію і втрати ємності при циклуванні літієвого електрода. Використання твердих неорганічних електролітів (ТЕЛ) дозволить створити літієві ХДС нового покоління з можливістю безпечного перезарядження, розширеним температурним інтервалом і новими типорозмірами. На даний момент велика кількість ТЕЛ визнані придатними для використання в літієвих ХДС. Літієві вторинні джерела струму з твердим електролітом мають істотні переваги в порівнянні з літієвими вторинними джерелами струму з рідким електролітом. До їхніх основних переваг можна віднести: - високі питомі характеристики внаслідок можливості використання металевого літію як аноду літійметалевих вторинних батарей; - підвищена безпека при циклуванні літій-металевих вторинних батарей унаслідок відсутності дендритоутворення і коротких замикань між катодом і анодом; - відсутність рідинної фази і, відповідно, можливість надійної герметизації джерела струму; - можливість виготовлення цілком твердофазних мікробатарей з товщиною до одиниць мікронів. Для того щоб реалізувати переваги літієвих джерел струму з твердим електролітом, останні повинні володіти наступними основними властивостями: - високою іонною провідністю по катіонах літію при кімнатних температурах; - низькою електронною провідністю для уникнення запобігання саморозряду джерела струму; - хімічною стабільністю стосовно матеріалів електродів і продуктів електрохімічних реакцій у процесі розряду-заряду джерела струму; - електрохімічною стабільністю в робочому діапазоні напруг циклування джерела струму; - можливістю одержання у виді тонких плівок (для того, щоб із склоподібних матеріалів одержувати тонкі плівки, такі матеріали повинні плавитися і потім затвердівати без деструкції). Метою даного винаходу є розробка складу твердого неорганічного електроліту, який би задовольняв пропонованим вимогам. Висока провідність по іонах літію твердих неорганічних склоподібних матеріалів визначається не тільки значним вмістом оксиду літію в їхніх сполуках, але і підвищеними значеннями вільного об'єму, характерними для склоподібних матеріалів (особливо в загартованому стані). Усі матеріали з катіонною провідністю, що можуть виконувати функцію твердого електроліту в електрохімічних комірках, можна умовно розділити на кристалічні и аморфні. Серед кристалічних матеріалів, використовуваних для вищевказаної мети, найбільшу цікавість представляє так названий β-глинозем (Li2О×5Аl2O3 чи Lі2О×11Аl2О3), електрична провідність якого складає 5×102 См×см-1 при 100°C і 5×10-1См×см-1 при 300°С. Застосування β-глинозему для зазначеної мети обмежено труднощами одержання з нього монолітних виробів у вигляді тонких плівок. У першу чергу це зв'язано з інконгруентним характером плавлення кристалічних сполук зазначеного складу, тобто з безповоротною їхньою деструкцією при нагріванні вище температури плавлення (вище 1500°С), наприклад, при випарюванні у вакуумі. Крім того, зазначені сполуки характеризуються яскраво вираженою анізотропією. Згідно літературних даних вищевказані значення провідності спостерігаються лише уздовж осі перпендикулярної головній осі кристалів, в інших напрямках β-глинозем характеризується значно меншою провідністю. Досить високими значеннями провідності по іонах літію характеризуються також такі кристалічні сполуки як Li2SO4 і Li2WO4, однак, на думку більшості дослідників, це стосується лише високотемпературних модифікацій зазначених кристалів [2]. Відомий [патент США №3911083], у якому описані оксигалогенідні кристалічні катіонні провідники з провідністю по іонах літію близькою до β-глинозему, що характеризуються при цьому набагато більш низькою температурою плавлення. Зокрема, температура плавлення сполуки, що відповідає формулі Li4В7О12СІ, складає всього 850°С, а його провідність при 300°С близька до 10-2См×см-1. Проте висока провідність пропонованих матеріалів досягається лише при високих температурах (дані щодо провідності таких матеріалів при кімнатній температурі в літературі відсутні), тоді як твердий електроліт у першу чергу повинен забезпечувати стабільну роботу в складі ХДС при кімнатній температурі. Останнім часом широко поширені склоподібні тверді електроліти [3]. Завдяки статистичному розподілу структурних елементів у сітці стекол вони характеризуються більш високим ступенем невпорядкованості і підвищеним, у порівнянні з відповідними кристалами, вільним об'ємом (особливо загартованого скла). Ці фактори сприяють збільшенню іонної провідності склоподібних матеріалів. Всі описані в літературі аморфні тверді електроліти можна умовно розділити на без-кисневі (сульфідні, галогенидні і т.д.), кисневмісні і змішані. Літієвмісне сульфідне скло характеризується винятково високими значеннями провідності по іонах літію (згідно літературних даних його провідність при кімнатній температурі досягає 10-4¸10-3См×см-1). Характерним недоліком такого скла є складна технологія його одержання, зокрема, синтез сульфідного скла можна здійснювати або в умовах вакууму, або в захисному середовищі. Загальновідома схильність сульфідів до гідролізу обумовлює їх низьку хімічну стійкість. Крім того, при збереженні на повітрі часткове окислення катіонів S2- неминуче повинно привести до збільшення електронної складової провідності стекол такого складу. Також викликає сумнів електрохімічна стабільність сульфідних ТЕЛ. Багатолітієві галогенідні й оксигалогенідні стекла досить добре досліджені. Загальноприйняте - введення солей літію в склад літієборатних стекол помітно поліпшує їхню провідність. Зокрема [в патенті США №4184015] описані стекла складу 1В2О3×(0,57-0,85)Li2O×(0,21-0,57)LiCl, провідність яких при 100°С складає 6,3×10-6 - 1,1×10-4См×см-1. Однак, з огляду на той факт, що експлуатація батарей із твердим електролітом повинна здійснюватися при більш низьких температурах, можна зробити висновок, що скло зазначеного складу має недостатньо високу іонну провідність. Найбільш широко досліджені тверді електроліти на основі оксидних стекол [2, 3]. Необхідно відзначити, що оксидні стекла в порівнянні з безкисневими мають незаперечну перевагу - хімічну й електрохімічну стабільність. Відповідно їх одержання здійснюють безпосередньо на повітрі. Більшість таких стекол у якості склоутворюючих оксидів містять В 2О3 і Р2О5, тобто базуються на склоутворюючих системах Li2O - В2О3 і Li2O P2O5. Для збільшення іонної провідності таких стекол у їх склад вводять кисневмісні солі літію [3]. У літературі описане скло складу 0,4Li2O×0,2Li2SO4×0,4B2O3 [4], що застосовували як електроліт ХДС в композиціях з полл етиленоксидом. [У патенті США №4184015] наводяться дані про провідність скла складу 0,57Li2O×0,29Li2SO4×1B2O3, що при температурі 100°С складає 2×10-5См×см-1. Однак для нормальної роботи як твердого електроліту в ХДС при кімнатній температурі провідність цих стекол по іонах літію є недостатньою. В основу даного винаходу була покладена задача одержання твердого склоподібного неорганічного електроліту в системі Li2O×Li2SO4×B2О3 з максимально можливою іонною провідністю, незначною електронною провідністю і високою технологічністю придатного для застосування в літієвих ХДС. Вирішення поставленої задачі полягало в знаходженні компромісу: з одного боку - для збільшення іонної провідності ТЕЛ необхідно максимально збільшувати сумарний вміст оксиду літію (Li2O), з іншого - для забезпечення стійкості склоподібного стану необхідно було підвищувати вміст склоутворюючого оксиду (В2О3). Склоутворення в багатолітійовій межі системи Li2O×Li2SO4×B2О3 мало вивчено. Відповідно до відомого принципу Роусона в полікомпонентних системах максимальну схильність до склоутворення виявляють сполуки, що лежать поблизу евтектичних крапок на відповідних діаграмах стану. Однак діаграма стану цієї системи також не вивчена. Для розрахунку сполуки евтектик, що лежать у багатолітієвій межі системи Li2O Li2SО4 - В2О3, і температур їхнього плавлення по формулі Шредера-Ле-Шателье були побудовані лінії ліквідусу в псевдобінарних системах «2Li2О×В2О3 - Li2SO4» і «3Li2О×В2О3 - Li2SO4». Правомірність використання псевдокомпонентів 2Li2О×В2О3 і 3Li2О×В2О3 не викликає сумніву, тому що ці кристалічні сполуки лежать поблизу єдиної в багатолітієвій межі системи Li2O - В2О3 евтектики з температурою плавлення 650°С і характеризуються низькими температурами плавлення (650 і 715°С, відповідно). Псевдокомпонент Li2SO4 був обраний на підставі проведених термодинамічних розрахунків, що показали найбільшу імовірність його утворення при термообробці трикомпонентних сумішей у системі Li2O - Li2SО4 - В2О3. Проведені розрахунки показали, що в системі «3Li2O×B2O3 - Li2SO4» присутня евтектична сполука з температурою плавлення всього 508°С, що включає 65,4мол.% 3Lі2О×В2О3 і 34,6мол.% Li2SO4. У системі «2Li2О×В2О3 - Li2SO4» температура плавлення евтектичної суміші, з 63,9мол.% 2Li2О×В2О3 і 36,1мол.% Li2SO4, складає 516°С. При перерахуванні на компоненти в потрійній системі Li2O - Li2SO4 - В2О3 евтектичні сполуки містять, мол.%: Li2O - 66,2; Li2SO4 - 11,6; В2О3 - 22,1 і Li2O - 56,1; Li2SO4 - 15,8; В2О3 - 28,1 відповідно. Виходячи з результатів проведених розрахунків, думали, що в багатолітієвій частині системи Li2O - Li2SO4 - В2О3 межа сполук, що виявляють максимальну схильність до склоутворення, обмежена усередненою сполукою евтектичних сумішей ±5 - 10мол.% по кожній компоненті, тобто Li2O - 50-60мол.%; Li2SO4 - 10-30мол.%; В2О3 20-30мол.%. Результати дослідження склоутворення (температура варіння 900-950°С, час витримки - 0,5 години) представлені на Фіг.1 і досить точно підтверджені розрахунками. Зокрема, відхилення по вмісту компонентів в експериментально встановленій межі найбільш стійкого склоутворення від розрахункових не перевищували 5мол.%. На підставі результатів, отриманих Бикенкампом при вивченні структури лужноборатних стекол методом ЯМР, можна припустити, що в стеклах з настільки низьким вмістом борного ангідриду практично всі катіони бору знаходяться в трьохкоординованому стані. При цьому аніонний каркас стекол утворять неполярні структурні групи [ВО3] і [SO4], з якими катіони літію зв'язані тільки через немісткові аніони кисню (дисоційовані катіони літію). Очевидно, що присутність катіонів літію в структурі стекол переважно в дисоційованому стані поряд з підвищеними значеннями вільного обсягу стекол з такою структурою повинні визначати високі значення провідності останніх по іонах літію. Результати виміру провідності стекол, що заявляються, методом імпедансної спектроскопії в діапазоні частот 1-100кГц підтвердили висловлені припущення (таблиця). Введення МоО3 у кількості до 2мас.% (0,75мол.%) до складу склоподібного твердого електроліту зі вмістом оксиду літію 66,7мол.%, поліпшує його зчеплення з різними підкладками. Цікаво, що при цьому помітно підвищується його ретгеноаморфність, знижується кристализаційна здатність, збільшується іонна провідність, знижується рівень електронної провідності. Близькі значення термічного коефіцієнта лінійного розширення (ТКЛР) склоподібного електроліту зазначеного складу (α=211×10-7 1/град) і алюмінію (α=220…230×10-71/град) дозволяють одержувати погоджені спаї цих матеріалів, що при використанні металевого алюмінію як несущого елементу ХДС дозволить уникнути розтріскування і сколів в тонких плівках твердого електроліту. Таблиця Хімічний склад склоподібних твердих електролітів у системі Li2O - Li2SO4 - В2О3 і їх електропровідність № п/п(*) 1 2 Хімічний склад твердого електроліту (брутто-формула) 60Li2O×15Li2SO4×25B2O3 65Li2O×10Li2SO4×25B2O3 c×106, См×см-1 (при 25°С) 1,43 2,79 3 4 5 60L2O×20Li2SO4×20B2O3 65Li2O×15Li2SO4×20B2O3 59,55L 2O×19,85Li2SO4×19,85B2O3×0,75MoO3 3,10 4,90 4,30 * Склад 1-4 відповідно до Фіг.1. Сполуки склоподібних твердих електролітів, що заявляються, являють собою оптимальний варіант вирішення задачі підвищення іонної провідності стекол у системі Li2O - Li2SO4-В2О3 при збереженні їхньої технологічності. Тобто, до складу таких стекол входить мінімальна кількість традиційного склоутворювача (В2О3 - 20-30мол.%), що забезпечує хороші їх варильні і робочі характеристики, але значною мірою знижуючого провідність стекол по іонах літію. Зміна межі вмісту компонентів для стекол, що заявляються, приводить до різкого підвищення їх кристализаційній здатності (і) погіршенню провідності по іонах літію. Результати виміру провідності склоподібного електроліту, що заявляється, методом імпедансної спектроскопії в діапазоні частот 1-100 кГц підтвердили висловлені припущення. Найближчим до запропонованого складу і способу одержання склоподібного неорганічного твердого електроліту є рішення, [описане в патенті США №4184015] та обране авторами за прототип. [В патенті США №4184015] наводяться дані про спосіб синтезу твердого електроліту (скла) складу 0,57Li2O×0,29Li2SO4×1B2O3. Для цього суміш Li2CO3 (або LiOH), В2О3 та Li2SO4 піддають термообробці у платиновому тиглі при температурі 850°С з подальшим швидким охолодженням у повітрі. Твердий електроліт складу 0,57Li2O×0,29Li2SO4×1B2O3 (у перерахунку на 100% 0,31Li2O×0,16Li2SO4×0,53B2O3), одержаний за прототипом, має недостатню провідність по іонах літію (у перерахунку на 25°С по наданим даним лише 4×10-7См/см), що пояснюється низьким вмістом оксиду літію. Задачею винаходу є одержання склоподібного неорганічного твердого електроліту зі значно більшим вмістом оксиду літію у складі (до 65мол.% [склад 59,55Lі2О×19,85Lі2SО4×19,85В2О3×0,75МоО3]), що призводить до різкого підвищення іонної електропровідності (4,3×10-6См/см при 25°С). При цьому введення до складу електролітів МоО3 дозволяє зберегти їх рентгеноаморфність. Поставлена задача вирішується тим, що склоподібний неорганічний твердий електроліт, що включає компоненти Li2O, Li2SO4, B2O3, з шихти на основі карбонату літію додатково включає МоО3 при наступному співвідношенні зазначених компонентів, мол. %: Li2О - 59,55-65; Li2SO4 - 10-20; В2О3 - 19,85-25 і МоО3 - до 0,75 і характеризується величиною іонної провідності при температурі 25°С (1,4-4,3)×10-6См×см-1 і температурним коефіцієнтом лінійного розширення (210±20)×10-7град-1, при цьому шихту для їхнього синтезу складають з карбонату літію, сульфату амонію, борної кислоти і МоО3. Поставлена задача вирішується за рахунок того, що в способі одержання склоподібного неорганічного твердого електроліту з шихти, яка включає карбонат літію, сульфат амонію і борну кислоту, який включає високотемпературну обробку шихти із подальшим швидким охолодженням у повітрі, відповідно до винаходу, температурну обробку шихти провадять у два етапи: попередньо витримують при температурі 140¸160°С на протязі 0,5¸1 годин, а потім при температурі 900¸950°С протягом 20¸40 хвилин в умовах кавітаційного перемішування. При цьому кавітаційне перемішування здійснюють при частоті 22-44кГц. Особливістю способу одержання стекол, що заявляються, є синтез сульфату літію безпосередньо при низькотемпературній (140-160°С) термообробці шихти, що включає карбонат літію, сульфат амонію і борну кислоту. Як показали проведені термографічні дослідження, у процесі нагрівання навішення (m=0,2¸0,3г), що містить еквімолярні кількості карбонату літію і сульфату амонію, утворюється матеріал, у якого відсутній виражений ендоефект плавлення при температурі 860-870°С (температура плавлення сульфату літію). При цьому стінки платинового тигля покриваються склом, тобто, у мікрокількостях така суміш навіть без борного ангідриду здатна до склоутворення. У процесі нагрівання реактивного сульфату літію будь-якої чистоти такого явища не спостерігається і на термограмі присутній виражений ендоефект плавлення Li2SO4. Стекла, що заявляються, зварені із шихти такої якісної сполуки, характеризуються меншою кристалізаційною здатністю, зниженими значеннями щільності і у 1,5-2 рази більш високою провідністю по іонах літію. В результаті визначення провідності стекол в межах найбільш стійкого склоутворення було встановлено, що їх провідність змінюється в межах 10-7¸10-6См/см. Однак, для вирішення поставленої задачі необхідно використовувати тільки скловидні тверді електроліти з провідністю не нижче 10-6См/см. Приклад 1 Скло складу 40L2O×30Li2SO4×30B2O3 (позамежний склад) При складанні шихти скла використовували карбонат літію, борну кислоту і сульфат амонію марки «ХЧ». Шихту складали з розрахунку на 20г скла і ретельно перемішували без зволоження. Варіння скла здійснювали в два етапи: попередньо тигель з шихтою витримували в сушильної шафі при температурі 150±10°С протягом 1 години, а потім переносили в муфельну піч с температурою 900-950°С і витримували протягом 0,5 години. Перемішування скломаси з метою її гомогенізації здійснювали методом кавітаційного перемішування при частоті 22-44кГц. Готову скломасу виробляли у вигляді тонких лусочок методом прокату через масивні водоохлоджуємі валки. За результатами рентгенофазового аналізу отриманий матеріал рентгеноаморфний. Електропровідність синтезованого матеріалу, при кімнатній .температурі складала (5¸6)×10-8См×см-1, ТКЛР193,3×10-7 1/град. Приклад 2 Скло складу 40L2O×40Li2SO4×20B2O3 (позамежний склад). Умови варіння і вироблення, спосіб виготовлення зразків для визначення електропровідності аналогічні приведеному в прикладі 1. Візуально структура синтезованого матеріалу грубокристалічна. За результатами рентгенофазового аналізу отриманий матеріал сильно закристалізований. Електропровідність синтезованого склокристалічного матеріалу при кімнатній температурі складала (1¸2)×10-7См×см-1. Через низьку технологічність матеріалу інші його властивості не досліджували. Приклад 3 Скло складу 50L2O×40Li2SO4×10B2O3 (позамежний склад). Умови варіння і вироблення, спосіб виготовлення зразків для визначення електропровідності аналогічні приведеному в прикладі 1. Розплав виробляється у виді грубокристалічного матеріалу практично без скляного блиску. За результатами рентгенофазового аналізу отриманий матеріал сильно закристалізований. Електропровідність синтезованого склокристалічного матеріалу при кімнатній температурі складала (3¸4)×10-7См×см-1. Через низьку технологічність матеріалу інші його властивості не досліджували. Приклад 4 Скло складу 60L2O×20Li2SO4×20B2O3. При складанні шихти скла використовували карбонат літію, борну кислоту, сульфат амонію (всі реактиви марки «ХЧ»). Шихту складали з розрахунку на 20г скла і ретельно перемішували без зволоження. Варіння скла здійснювали в два етапи: попередньо тигель з шихтою витримували в сушильної шафі при температурі 150±10°С протягом 1 години, а потім переносили в муфельну піч с температурою 900-950°С і витримували протягом 0,5 години. Перемішування скломаси з метою її гомогенізації здійснювали методом кавітаційного перемішування при частоті 22-44кГц. Готову скломасу виробляли у виді тонких лусочок методом прокату через масивні водоохлоджуємі валки. За результатами РФА лусочки отриманого матеріалу рентгеноаморфні, у той час як фазовий склад зразків товщиною 1-2мм представлений в основному склофазою з невеликими включеннями кристалів 2Li2ОВ2О3. Щільність скла вимірювали методом гідростатичного зважування лусочок у толуолі. При кімнатній температурі її значення складало ~ 2,14г/см3. Через схильність масивних зразків скла до кристалізації його теплове розширення вимірювали на зразках, приготовлених зі зволожених порошків стекол. За рахунок часткового руйнування часток скла на їхній поверхні утворювалася плівка, що міцно склеює їх у міцний зразок у процесі висушування при температурі 250°С протягом 1 години. Температурний коефіцієнт лінійного розширення - 207×10-71/град (20-200°С), дилатометрична температура початку розм'якшення скла близько 290°С. Для зразків ТЕЛ різної товщини електропровідність при кімнатній температурі, обмірювана методом імпедансної спектроскопії, складала 3,1×10-6См×см-1. Електронна провідність при 25°С склала 2,4×10-12См×см-1. Стійкість скла відносно металевого літію визначали методом дилатометричного температурного аналізу (ДТА). Зразки для дослідження являли собою запаяні в боксі ампули із сумішшю порошку скла і металевого літію. При триразовому нагріванні ампул зі швидкістю 10град./хв. форма і площа ендоефекту при 170°С на кривих ДТА, що відповідає плавленню металевого літію, не змінювалися, що свідчило про відсутність його взаємодії зі склом (Фіг.3). Таким чином, побічно можна вважати, що скло стійке відносно металевого літію. Приклад 5 Скло складу 60Li2O×15Li2SO4×25B2O3. Умови варіння і вироблення, способи виготовлення зразків і методи визначення властивостей аналогічні приведеним у прикладі 4. За результатами рентгенофазового аналізу отримане скло абсолютно рентгеноаморфні. Температурний коефіцієнт лінійного розширення матеріалу 221×10-71/град. Електропровідність твердого електроліту при 25°С - 1,43×10-6См×см-1. За результатами ДТА скло стійке відносно металевого літію (див. приклад 4). Приклад 6 Скло сполуки 65Li2O×10Li2SО4×25B2O3. Умови варіння і вироблення, способи виготовлення зразків і методи визначення властивостей аналогічні приведеним у прикладі 4. За результатами рентгенофазового аналізу отриманий твердий електроліт у цілому рентгеноаморфний. Температурний коефіцієнт лінійного розширення матеріалу 228,1×10-71/град. Електропровідність твердого електроліту при кімнатній температурі - 2,75×10-6См×см-1. За результатами ДТА скло стійке відносно металевого літію (див. приклад 4). Приклад 7 Скло складу 65L2O×15Li2SO4×20B2C3. Умови варіння і вироблення, способи виготовлення зразків і методи визначення властивостей аналогічні приведеним у прикладі 4. За результатами рентгенофазового аналізу отриманий ТЕЛ в основному рентгеноаморфний. Температурний коефіцієнт лінійного розширення матеріалу 214×10-71/град. Електропровідність такого ТЕЛ при температурі 25°С складає 4,90×10-6См×см-1. За результатами ДТА скло стійке відносно металевого літію (див. приклад 4). Приклад 8. Скло 59,55L2О×19,85Li2SО4×19,85B2О3×0,75MoО3 (склад, що заявляється). При складанні шихти скла використовували карбонат літію, борну кислоту, сульфат амонію марки і оксид молібдену (VI) «ХЧ». Шихту складали з розрахунку на 20г скла і ретельно перемішували без зволоження. Варіння скла здійснювали в два етапи: попередньо тигель з шихтою витримували в сушильної шафі при температурі 150±10°С протягом 1 години, а потім переносили в муфельну піч с температурою 900-950°С і витримували протягом 0,5 години. Перемішування скломаси з метою її гомогенізації здійснювали методом кавітаційного перемішування при частоті 22-44кГц. Готову скломасу виробляли у виді тонких лусочок методом прокату через масивні водоохлоджуємі валки. За результатами рентгенофазового аналізу і лусочка, і зразки товщиною 1-2мм рентгеноаморфні. Щільність скла вимірювали методом гідростатичного зважування лусочок у толуолі. При кімнатній температурі її значення складало ~2,17г/см3. Температурний коефіцієнт лінійного розширення скла складає 211×10-71/град, дилатометрична температура початку розм'якшення, - близько 285°С. Для зразків ТЕЛ різної товщини електропровідність при кімнатній температурі, обмірювана методом імпедансної спектроскопії, складала 4,3×10-6См×см-1. Електронна провідність при 25°С склала 3,0×10-13См×см-1. За результатами ДТА скло стійке відносно металевого літію (див. приклад 4). Результати підтверджуються приведеними графіками. Фіг.1. Склад ТЕЛ в багатолітієвій межі системи Li2О-Li2SO4-В2О3 з провідністю більше 10-6См/см. Фіг.2 Рентгенограми зразків твердих склоподібних електролітів товщиною 1-2мм в системі Li2O-Li2SO4B2O3, отриманих по розробленій схемі. Вміст оксиду літію 66,7мол.%; * - 2Li2ОВ2О3 (кр.) Фіг.3 Диференційні криві системи "Твердий електроліт (приклад 4) - металевий літій". 1, 2- перше, третє нагрівання; 3 ,4 - перше, третє охолодження. Список використаної патентної і науково-технічної літератури: 1. J. Desilvestro, O.Haas. Metal oxide cathode materials for electrochemical energy storage // J. Electrochem. Soc. - 1990. -137. - с.5С-22С. 2. Е.И.Бурмакин. Твердые электролиты с проводимостью по катионов щелочных металлов. -М.: Наука, 1992. -264с. 3. Solid-state batteries: materials design and optimization. / Под ред. Mien С. і Nazri G.A. -Kluwer Academic publishers, 1994. - 625с. 4. R.C.Acrawal, R.K.Gupta. Review supersonic solids: composite electrolyte phase - an overview // J. of Material Science. -1999. -34. – с.1131-1162. 5. Nemec L. О struktufe boritych skel. - Silikaty, 1971, sv.15, №1, s.75-97.
ДивитисяДодаткова інформація
Назва патенту англійськоюGlassy inorganic solid electrolyte and method obtaining thereof
Автори англійськоюShembel' Olena Moiseivna, Nosenko Oleksandr Vasyliovych, Novak Petro Yakovych
Назва патенту російськоюСтеклообразный неорганический твердый электролит и способ его получения
Автори російськоюШембель Елена Мойсеевна, Носенко Александр Васильевич, Новак Петр Яковлевич
МПК / Мітки
МПК: H01M 10/36, C03C 4/00, H01M 6/18, C03C 6/00
Мітки: склоподібний, твердий, одержання, електроліт, спосіб, неорганічний
Код посилання
<a href="https://ua.patents.su/6-67973-sklopodibnijj-neorganichnijj-tverdijj-elektrolit-i-sposib-jjogo-oderzhannya.html" target="_blank" rel="follow" title="База патентів України">Склоподібний неорганічний твердий електроліт і спосіб його одержання</a>