Спосіб одержання кислих солей геміфлоксацину
Номер патенту: 77070
Опубліковано: 16.10.2006
Автори: Чой Бо-Сеунг, ЧОЙ Хун, Чой Санг-Чул, Нам До-Хьюн
Формула / Реферат
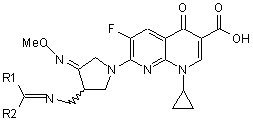
1. Спосіб одержання солей Геміфлоксацину, що описуються формулою 1, який включає у себе стадії
a) додавання сполуки за формулою 5 у нафтиридинкарбонову кислоту за формулою 2 і 3-амінометил-4-метоксіімінопіролідинову сіль за формулою 3 у воді, органічного розчинника або його розчинювальної суміші при наявності в ній органічної основи для проведення реакції сполучення, і
b) додавання кислоти за формулою НА в отриману сполуку за формулою 4 у воді, органічного розчинника або його розчинювальної суміші для проведення реакцій зняття захисту і водночас утворення солі:
 , 2
, 2
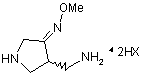 , 3
, 3
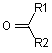 , 5
, 5
 , 4
, 4
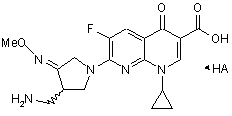 , 1
, 1
де
R є Сl, F, Вr, I, метансульфоніл або паратолуолсульфоніл,
Me є метил,
НХ є соляна кислота, бромистоводнева кислота, йодистоводнева кислота, трифтороцтова кислота, метансульфонова кислота, паратолуолсульфонова кислота, сірчана кислота,
R1 і R2 незалежно один від одного є водень, прямолінійна або розгалужена, насичена або ненасичена С1-С6 алкільна група, насичена або ненасичена С3-С6 циклоалкільна група, або ароматична група що є незаміщеною або заміщеною С1-С6 алкілом, групами С1-С6 алкокси, гідрокси, ціано або галогеном, або
R1 і R2 разом із карбонільною групою, з якою вони зв'язані, утворюють кільце, і
НА є органічна кислота або неорганічна кислота.
2. Спосіб за п. 1, який відрізняється тим, що стадію а), стадію b) або обидві стадії а) і b) здійснюють у змішаному розчиннику, що складається із органічного розчинника і води.
3. Спосіб за п. 1, який відрізняється тим, що сполуку за формулою 5 вибирають із групи, яку складають бензальдегід, 2-хлорбензальдегід, 2-оксибензальдегід, 4-метоксибензальдегід і 2-метилбензальдегід.
4. Спосіб за п. 2, який відрізняється тим, що органічним розчинником на стадії а) є ацетонітрил, а на стадії b) є ізопропанол або тетрагідрофуран (THF).
5. Спосіб за п. 1, який відрізняється тим, що органічну основу вибирають із групи, яку складають триетиламін, триметиламін, діізопропілетиламін, 1,8-діазабіцикло[5.4.0]ундец-7-ен і 1,5-діазабіцикло[4.3.0]нон-5-он.
6. Спосіб за п. 1, який відрізняється тим, що сполуку за формулу 5 використовують у кількості, що в 1-3 рази перевищує використовувану кількість сполуки за формулою 2.
7. Спосіб за п. 1, який відрізняється тим, що органічну основу на стадії а) використовують у кількості, що в 3-4 рази перевищує використовувану кількість сполуки за формулою 2, а реакцію проводять при температурі від 0 до 30°С.
8. Спосіб за п. 7, який відрізняється тим, що органічною основою є триетиламін.
9. Спосіб за п. 1, який відрізняється тим, що кислоту за формулою НА використовують у кількості від 80 мол. % до 120 мол. % відносно сполуки за формулою 4, температура при додаванні кислоти лежить у межах 40-50°С, а температура після додавання кислоти лежить у межах 0-20°С.
10. Спосіб за одним із п. 1-9, який відрізняється тим, що кислотою за формулою НА є метансульфонова кислота.
11. Проміжний продукт, описуваний наведеною нижче формулою 4, для виготовлення кислих солей Геміфлоксацину за формулою 1
 , 4
, 4
де
Me, R1 і R2 є такі, як визначено в п. 1.
Текст
1. Спосіб одержання солей Геміфлоксацину, що описуються формулою 1, який включає у себе стадії a) додавання сполуки за формулою 5 у нафтиридинкарбонову кислоту за формулою 2 і 3амінометил-4-метоксіімінопіролідинову сіль за формулою 3 у воді, органічного розчинника або його розчинювальної суміші при наявності в ній органічної основи для проведення реакції сполучення, і b) додавання кислоти за формулою НА в отриману сполуку за формулою 4 у воді, органічного розчинника або його розчинювальної суміші для проведення реакцій зняття захисту і водночас утворення солі: 2 3 77070 4 1,8-діазабіцикло[5.4.0]ундец-7-ен і 1,5лежить у межах 40-50°С, а температура після додіазабіцикло[4.3.0]нон-5-он. давання кислоти лежить у межах 0-20°С. 6. Спосіб за п. 1, який відрізняється тим, що спо10. Спосіб за одним із п. 1-9, який відрізняється луку за формулу 5 використовують у кількості, що тим, що кислотою за формулою НА є метансульв 1-3 рази перевищує використовувану кількість фонова кислота. сполуки за формулою 2. 11. Проміжний продукт, описуваний наведеною 7. Спосіб за п. 1, який відрізняється тим, що орнижче формулою 4, для виготовлення кислих соганічну основу на стадії а) використовують у кільлей Геміфлоксацину за формулою 1 O O кості, що в 3-4 рази перевищує використовувану F кількість сполуки за формулою 2, а реакцію провоOH MeO дять при температурі від 0 до 30°С. N 8. Спосіб за п. 7, який відрізняється тим, що орN N N R1 ганічною основою є триетиламін. N 9. Спосіб за п. 1, який відрізняється тим, що кисR2 лоту за формулою НА використовують у кількості ,4 від 80 мол. % до 120 мол. % відносно сполуки за де формулою 4, температура при додаванні кислоти Me, R1 і R2 є такі, як визначено в п. 1. Даний винахід стосується нового процесу виготовлення кислих солей хінолонкарбонової кислоти, тобто 7-(3-амінометил-4метоксіімінопіролідин-1-іл)-1-циклопропіл-6-фтор4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбонової кислоти (у подальшому Геміфлоксацин), що мають потужну антимікробну активність і виражаються формулою 1: де Me є метил, НА є органічна кислота або неорганічна кислота. Вищезгаданий Геміфлоксацин і його солі описані в корейському патенті №131999 тих же авторів, що й даного винаходу (Заявка №94-13604 на патент Кореї; іноземними патентами, що відповідають цьому патенту, є: ЕР 688722 А1, патент Японії №41050/1996, патент Росії №2120940, патент Канади №2151890, патент Китаю №1114959 і патенти США №№ 5962468, 5869670, 5840916, 5776944, 5698570 і 5633262). Ці сполуки мають потужну антимікробну активність і, крім того, можуть ефективно використовуватися як засоби лікування людей і тварин, інфікованих бактеріями. Авторами були одержані кислі солі Геміфлоксацину за допомогою тристадійного реакційного процесу, а саме процесу синтезу, що складається з реакцій сполучання, утворення солі і рекристалізації у відповідності з наведеною нижче Схемою 1. де: Me є метил, R є СІ, F, Вr, І, метансульфоніл або паратолуолсульфоніл, НХ є соляна кислота, бромистоводнева кислота, йодистоводнева кислота, трифтороцтова кислота, метансульфонова кислота, паратолуолсульфонова кислота, сірчана кислота, НА є органічна кислота або неорганічна кислота. Як показано на Схемі 1, сполуку (1) одержують шляхом проведення тристадійного виробничого процесу, що складається із реакції сполучання, утворення солі і рекристалізації. Застосування цього тристадійного процесу зумовлено тим, що в ході реакції сполучання в результаті побічної реакції утворюється сполука (8), що є забрудненням, кількість якого досягає 6%-12% і залишається у сполуці (6) на рівні, приблизно, 0,3%-1,0%. Для зменшення кількості забруднення, утворюваного в процесі реакції сполучання, до 0,1% і менше необхідно проводити другу стадію процесу, тобто стадію утворення солі. І нарешті, шляхом рекристалізації повинен бути видалений органічний розчинник, використовуваний у процесі утворення солі. Шляхом проведення цього тристадійного процесу була одержана кисла сіль Геміфлоксацину (1) як сирий медикаментозний засіб високої чистоти із загальним виходом, приблизно, 65%. У зв'язку з труднощами видалення забруднення (8), утворюваного як побічний продукт реакції сполучання в зазначеному вище процесі, для видалення цих забруднень у даний процес потрібно було включати стадії утворення солі і рекристалізації. 5 Авторами даного винаходу були проведенні поглиблені дослідження щодо скорочення вищеописаного тристадійного виробничого процесу до двостадійного. В результаті цих досліджень було встановлено, що описаний нижче процес одержання зазначених сполук, що складається з двох стадій, має ряд переваг у тім, що стосується спрощенняпроцесу виготовлення, підвищення його продуктивності і збільшення виходу продукту. Отже, результатом цих досліджень стало створення даного винаходу. Таким чином, даним винаходом пропонується процес одержання кислих солей Геміфлоксацину, що описуються формулою 1, який включає у себе такі стадії: a) додавання сполуки за формулою 5 у нафтаридинкарбонову кислоту за формулою 2 і 3амінометил-4-метоксіімінопіролідинову сіль за формулою 3 у воді, органічного розчинника або його розчинювальної суміші при наявності в ній органічної основи для проведення реакції сполучення і b) додавання кислоти за формулою НА в отриману сполуку за формулою 4 у воді, органічного розчинника або його розчинювальної суміші для проведення реакцій зняття захисту і водночас утворення солі: 77070 6 де R є СІ, F, Br, І, метансульфоніл або паратолуолсульфоніл, Me є метил, НХ є соляна кислота, бромистоводнева кислота, йодистоводнева кислота, трифтороцтова кислота, метансульфонова кислота, паратолуолсульфонова кислота, сірчана кислота, R1 і R2 незалежно один від одного є водень, прямолінійна або розгалужена, насичена або ненасичена С1~С6 алкільна група, насичена або ненасичена С3~С6 циклоалкільна група, або ароматична група що є незаміщеною або заміщеною С1~С6 алкілом, групами С1~С6 алкокси, гідрокси, ціано або галогеном, або R1 і R2 разом із карбонільною групою, з якою вони зв'язані, утворюють кільце, і НА є органічна кислота або неорганічна кислота. Процес виготовлення сполук за даним винаходом докладно описаний нижче з ілюстрацією на Схемі 2 проведення реакцій. де Me, R, R1, R2, HX і НА є такі, як визначено вище. Як показано на Схемі 2, для скорочення стадій утворення солі і рекристалізації до однієї стадії шляхом запобігання утворенню забруднень (8) можна в ході реакції сполучання додавати сполуку (5), що має карбонільну групу, до сполуки (3) для захисту аміногрупи в сполуці (3) сполукою (5). Завдяки цьому захисту, утворення побічного продукту (8) може бути зменшено до 0,1% і нижче. Одержувана в результаті сполука (4), що утворюється внаслідок проведення вищезазначеного процесу з виходом продукту приблизно 90% і більше, підда 7 77070 8 ється обробці кислотою за формулою НА для прозастосування стадії рекристалізації. Умови цієї ведення реакцій зняття захисту й утворення солі реакції є такими: за одну стадію. Цей процес, позбавлений стадії 1) Як розчинник використовують воду, спирт, реакції рекристалізації, дозволяє отримувати кистакий як ізопропанол, THF, метанол, етанол, буталу сіль Геміфлоксацину за формулою (1) з кориснол і под., або змішаний розчинник зі спирту і воним виходом не менше 90% при спрощенні стадій, ди. Кращим при цьому є змішаний розчинник із з якого він складається. Зазначене спрощення ізопропанолу і води з погляду на чистоту і вихід цього виробничого процесу дає такі переваги: продукту. зменшує тривалість виробничого процесу, поліп2) Як кислота можуть використовуватися різшує його продуктивність і збільшує вихід корисного номанітні кислоти, що відповідають формулі НА, продукту. такі як соляна кислота, метансульфонова кислота, Нижче докладно розглядається приклад здійссірчана кислота, фосфорна кислота, оцтова киснення процесу за даним винаходом. лота, лимонна кислота, винна кислота, перхлорисПо-перше, процес синтезу сполуки (4) (стадія товоднева кислота, пікринова кислота, (+)а) включає у себе розчинення сполуки (3), сполуки камфоросульфонова кислота, тощо. Особливо (5) і органічної основи, наприклад, триетиламіну, в кращою при цьому є метансульфонова кислота. З реакційному розчиннику, наприклад, суміші такого точки зору чистоти і виходу продукту кращою є розчинника, як ацетонітрил з водою і додавання молярна кількість кислоти, що дорівнює молярній до нього сполуки (2), а потім проведення реакцій в кількості сполуки (4), приблизно, до 20% від еквіутвореній суміші. Умови цієї реакції є такими: молярної кількості. 1) Як розчинник реакційної суміші можуть ви3) Температура реакції може встановлюватися користовуватися вода, органічний розчинник, тав широких межах від 0°С до 100°С. При цьому з кий як ацетонітрил, тетрагідрофуран (THF), метапогляду на швидкість одержання цільової сполуки нол, і етанол, або змішаний розчинник, складений (1), її чистоти і виходу кінцевого продукту кращими із органічного розчинника і води. Кращим варіанє температури реакції в межах 40~50°С при додатом є змішаний розчинник із ацетонітрилу і води, ванні кислоти і в межах 0~20°С після додавання який дозволяє досягати вищих чистоти і виходу кислоти. продукту. Описаний вище процес реакції дозволяє 2) Як сполука (5) можуть використовуватися, отримувати сполуку (4) високої чистоти і з високим кетонова або альдегідна сполука, як-от формальвиходом (більше 90%). дегід, ацетон, бензальдегід, 1-бутилальдегід, і под. Таким чином, із викладеного вище випливає, Кращими при цьому є похідні бензальдегіду, такі, що новий процес синтезу, який складається з двох як бензальдегід, 2-гідроксибензальдегід, 2стадій, дозволяє спростити виробничий процес, хлорбензальдегід і т.п., що дозволяють одержувазбільшити вихід продукту (приблизно, від 65% до, ти продукт вищої чистоти і з більшим виходом. принаймні, 80%), підвищити продуктивність, зменОсобливо кращим при цьому з точки зору економішити витрати на виробництво і т.д. шляхом скорочності і стабільності є бензальдегід. Кількість бенчення відомого тристадійного процесу синтезу до зальдегіду в молярному співвідношенні у кращому двох стадій. Особливою перевагою нового процеваріанті дорівнює або перевищує молярну кільсу є те, що він може застосовуватися для одеркість сполуки (2). жання антибіотиків типу хінолону, що мають струк3) Температура реакції може встановлюватися туру, подібну структурі Геміфлоксацину. в широких межах від 0 до 80°С. При цьому найОтже, винаходом пропонується новий процес, кращим є діапазон температур реакції 20-30°С з надзвичайно поліпшений порівняно з відомим рівпогляду на швидкість реакції, вихід і чистоту пронем техніки. дукту. Нижче суть винаходу розглядається більш де4) Як органічна основа можуть використовуватально на прикладах його практичного здійснення, тися триетиламін, триметиламін, діізопропілетищо не обмежують об'єму винаходу. ламін, DBU (1,8-діазабіцикло[5.4.0]ундец-7-ен), Приклади DBN (1,5-діазабіцикло[4.3.0]нон-5-он), а також низПриклад 1 ка інших основ. Найбільш підходящою основою Одержання 7-(3-бензиліденамінометил-4при цьому є триетиламін з погляду на економічметоксііміно-1-піролідиніл)-1-циклопропіл-6-фторність процесу і вихід продукту. Використовувана 1,4-дигідро-4-оксо-1,8-нафтиридин-3-карбонової кількість основи складає три і більше молярної кислоти кількості відносно сполуки (2). Застосування описаного вище процесу реакції дозволяє отримувати сполуку (4) високої чистоти і з високим виходом (більше 90%). По-друге, процес (стадія b) синтезу сполуки (1) зі сполуки (4) включає у себе розчинення сполуки (4) в реакційному розчиннику, наприклад, змішаному розчиннику із ізопропанолу і води, нагрівання утвореної суміші, додавання до неї кислоти за формулою НА, наприклад, метансульфонової кислоАцетонітрил (1900мл), 3-амінометил-4ти для проведення реакцій зняття захисту і воднометоксіімінопіролідиндиметансульфонат (248,0г) і час утворення солі, і після цього - охолодження воду (100мл) по черзі додали в реакційну посудину реакційної суміші для одержання сполуки (1) без 9 77070 10 й охолодили до 0~5°С. Після цього до реакційної суміші послідовно додали бензальдегід (97,6г) і триетиламін (229,1г). Після перемішування суміші протягом 0,5год. до неї додали 7-хлор-1циклопропіл-6-фтор-1,4-дигідро-4-оксо-1,8нафтиридин-3-карбонової кислоти (200,0г). Утворену реакційну суміш повільно нагріли до кімнатної температури при перемішуванні. Далі була проведена реакція в суміші при її перемішуванні протягом приблизно 3год. при кімнатній температурі. Реакційну суміш, що прийняла форму диспеАцетонітрил (100мл), 3-амінометил-4рсного розчину після утворення зазначеної в загометоксіімінопіролідиндиметансульфонат (12,5г), 2ловку сполуки, відфільтрували, промили водою й оксибензальдегід (8,6г) і триетиламін (12,2г) по ацетонітрилом, а потім просушили, одержавши черзі додали в реакційну посудину при кімнатній 320,3г цільової сполуки (вихід 94,8%). температурі. Після перемішування суміші протя1 Н ЯМР ( , CDCI3): 8,66 (s, 1Н), 8,32 (s, 1Н), гом, приблизно, 0,5год. до суміші додали 7-хлор-17,98 (d, J=12,4Гц, 1Н), 7,60 (d, J=7,0Гц, 2Н), 7,37 (t, циклопропіл-6-фтор-1,4-дигідро-4-оксо-1,8J=7,4Гц, 1Н), 7,31 (t, J=7,4Гц, 2Н), 4,58 (s, 2H), нафтиридин-3-карбонову кислоту (10,0г). Утворену 4,21-4,15 (m, 2H), 4,00 (m, 1Н), 3,93 (s, 3Н), 3,83 реакційну суміш перемішували протягом, приблиз(m, 1Н), 3,56 (m, 1Н), 3,40 (m, 1Н), 1,21 (m, 2Н), но, 15год. при кімнатній температурі, охолодили 1,00 (m, 2Н) до 0~5°С і перемішували ще протягом, приблизно, Мас-спектр. (FAB): 478 (М+Н) 3год. Зазначену в заголовку сполуку, що мала виПриклад 2 гляд твердої речовини, відфільтрували, промили Одержання 7-[3-(2ацетонітрилом і просушили, одержавши 16,0г ціхлорбензилідин)амінометил-4-метоксііміно-1льової сполуки (вихід 91,8%). 1 піролідиніл]-1-циклопропіл-6-фтор-1,4-диіїдро-4Н ЯМР ( , CDCI3): 8,68 (s, 1Н), 8,42 (s, 1Н), оксо-1,8-нафтиридин-3-карбонової кислоти 8,01 (d, J=12,4Гц, 1Н), 7,30-7,20 (m, ЗН), 6,90-6,82 (m, 2H), 4,68453 (m, 2H), 4,32-4,24 (m, 1H), 4,06 (dd, J1=11,9Гц, J2=5,5Гц, 1Н), 4,02-3,85 (m, 3Н), 3,95 (s, 3Н), 3,60 (m, 1Н), 3,40 (m, 1Н), 1,29-1,21 (m, 2Н), 1,07-1,00 (m, 2Н). Мас-спектр. (FAB): 494 (М+Н) Приклад 4 Одержання 7-[3-(4ціанобензилідин)амінометил-4-метоксііміно-1піролідиніл]-1-циклопропіл-6-фтор-1,4-дигідро-4оксо-1,8-нафтиридин-3-карбонової кислоти Ацетонітрил (100мл), 3-амінометил-4метоксіімінопіролідиндиметансульфонат (12,5г), 2хлорбензальдегід (10,0г) і триетиламін (12,2г) по черзі додали в реакційну посудину при кімнатній температурі. Після перемішування суміші протягом близько 0,5год. до неї додали 7-хлор-1циклопропіл-6-фтор-1,4-дигідро-4-оксо-1,8нафтиридин-3-карбонову кислоту (10,0г). Утворену реакційну суміш перемішували протягом, приблизно, 15год. при кімнатній температурі, охолодили до 0~5°С і перемішували протягом, приблизно, 3год. Зазначену в заголовку сполуку, що мала вигляд твердої речовини, відфільтрували, промили ацетонітрилом і просушили, одержавши 16,3г цільового продукту (вихід 90,0%). 1 Н ЯМР ( , CDCI3): 8,74 (s, 1H), 8,66 (s, 1H), 7,96 (d, J=12,4Гц, 1Н), 7,84 (d, J=7,3Гц, 1Н), 7,29 (m, 2H), 7,16 (m, 1H), 4,59 (bs, 2H), 4,18 (m, 2H), 4,02 (m, 1H), 3,94 (s, 3Н), 3,93 (m, 1H), 3,59 (m, 1H), 3,42 (m, 1H), 1,22 (m, 2H), 1,01 (m, 2H). Мас-спектр. (FAB): 512 (М+Н) Приклад 3 Одержання 7-[3-(2оксибензилідин)амінометил-4-метоксііміно-1піролідиніл]-1-циклопропіл-6-фтор-1,4-дигідро-4оксо-1,8-нафтиридин-3-карбонової кислоти У відповідності з процесом і режимами, використовуваними в Прикладах 2 і 3, було одержано 14,6г зазначеної в заголовку сполуки при використанні 4-ціанобензальдегіду (9,3г) (вихід 82,2%). 1 Н ЯМР ( , CDCI3): 8,66 (s, 1Н), 8,40 (s, 1Н), 7,99 (d, J=12,4Гц, 1Н), 7,80 (d, J=8,3Гц, 2H), 7,67 (d, J=8,3Гц, 2H), 4,59 (m, 2Н), 4,30 (m, 1Н), 4,08 (m, 2Н), 3,92 (s, 3Н), 3,90 (m, 1H), 3,61 (m, 1H), 3,45 (m, 1H), 1,24 (m, 2H), 1,05 (m. 2H). Мас-спектр. (FAB): 503 (М+Н) Приклад 5 Одержання 7-[3-(4метоксибензилідин)амінометил-4-метоксиліміно-1піролідиніл]-1-циклопропіл-6-фтор-1,4-дигідро-4оксо-1,8-нафтиридин-3-карбонової кислоти 11 У відповідності з процесом і режимами, використовуваними в Прикладах 2 і 3, було одержано 14,4г зазначеної в заголовку сполуки при використанні 4-метоксибензальдегіду (9,6г) (вихід 80,2%). 1 Н ЯМР ( , CDCI3): 8,66 (s, 1H), 8,22 (s, 1H), 7,96 (d, J=12,4Гц, 1Η), 7,52 (d, J=8,7Гц, 2H), 6,79 (d, J=8,3Гц, 2H), 4,59 (m, 2H), 4,16 (bs, 2H), 3,93 (s, 3Н), 3,92 (m, 1H), 3,83 (m, 1H), 3,79 (s, 3Н), 3,56 (m, 1H), 3,38 (m, 1H), 1,22 (m, 2H), 1,00 (m, 2H). Mac-спектр. (FAB): 508 (М+Н) Приклад 6 Одержання 7-[3-(1-нафтилідин)амінометил-4метоксііміно-1-піролідиніл]-1-циклопропіл-6-фтор1,4-дигідро-4-оксо-1,8-нафтиридин-3-карбонової кислоти Ацетонітрил (100мл), 3-амінометил-4метоксіімінопіролідиндиметансульфонат (12,5г) і 1-нафтальдегід (11,1г) по черзі додали в реакційну посудину при кімнатній температурі і охолоджували до 0~5°С. До реакційної суміші по краплях додали триетиламін (12,2г). Після перемішування суміші протягом, приблизно, 0,5год. реакційну суміш розрідили етанолом (30мл). Після цього до реакційної суміші додали 7-хлор-1-циклопропіл-6фтор-1,4-дигідро-4-оксо-1,8-нафтиридин-3карбонову кислоту (10,0г). Після повільного підвищення температури реакційної суміші до рівня кімнатної, суміш перемішували протягом, приблизно, 15год. Зазначену в заголовку сполуку, що мала вигляд твердої речовини, відфільтрували, промили водою й етанолом, і просушили, одержавши 15,7г зазначеної в заголовку сполуки (вихід 84,4%). 1 Н ЯМР ( , CDCI3): 8,86 (m, 2Н), 8,55 (s, 1Н), 7,82 (m, 3Н), 7,73 (m, 1Н), 7,40 (m, 3Н), 4,60 (m, 2Н), 4,24 (m, 2Н), 4,08 (m, 1Н), 3,99 (m, 1Н), 3,95 (s, 3Н), 3,45 (m, 2H), 1,13 (m,2H), 0,89 (m,2H). Мас-спектр. (FAB): 528 (M+H) Приклад 7 Одержання метансульфонату 7-(амінометил4-метоксііміно-1-піролідиніл)-1-циклопропіл-6Комп’ютерна верстка О. Гапоненко 77070 12 фтор-1,4-дигідро-4-оксо-1,8-нафтиридин-3карбонової кислоти Воду (60мл), сполуку, синтезовану в Прикладі 1 (30,0г), та ізопропанол (210мл) по черзі додали в реакційну посудину і нагріли 40~45°С. До реакційної суміші по краплях додали метансульфонову кислоту (6,22г). Після перемішування реакційної суміші протягом приблизно 0,5год. при температурі 40-45°С суміш охолодили до 27~35°С. Далі до реакційної суміші додали сполуку (1) (0,03г). Реакційну суміш повільно охолодили до кімнатної температури і перемішували протягом, приблизно, 17год. до випадіння в осад зазначеної в заголовку сполуки у вигляді твердої речовини. Реакційну суміш у формі дисперсійного розчину охолодили до -1~1°С, перемішували протягом приблизно 3год., відфільтрували, промили ізопропанолом, просушили й абсорбували, одержавши 29,0г цільової сполуки (Вихід 95,1%). 1 Н ЯМР ( , DMSO-d6): 8,59 (s, 1Н), 8,06 (d, J=12,4Гц, 1Н), 4,58 (bs, 2H), 4,37 (m, 1H), 3,90 (s, 3Н), 3,83 (bs, 1H), 3,71 (m, 1H), 3,40 (m, 1H), 3,243,10 (m, 2H), 2,32 (s, 3Н), 1,20-1,05 (m,2H), 1,031,02 (m,2H). Мас-спектр. (FAB): 486 (M+H) Приклад 8 Одержання метансульфонату 7-(амінометил4-метоксііміно-1-піролідиніл)-1-циклопропіл-бфтор-1,4-дигідро-4-оксо-1,8-нафтиридин-3карбонової кислоти Зазначену в заголовку сполуку було одержано з виходом 91,7% у відповідності з процесом, описаним у Прикладі 7, за винятком того, що замість ізопропанолу (210мл) використовувався THF (240мл), а метансульфонова кислота використовувалася в кількості 6,04г замість 6,22г. Новий, процес синтезу згідно з даним винаходом, завдяки скороченню кількості стадій у ньому від трьох до двох, дозволяє спростити виробничий процес, збільшити вихід продукту, підвищити продуктивність, зменшити виробничі витрати. Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюA process for preparing acid salts of gemifloxacin
Назва патенту російськоюСпособ получения кислых солей гемифлоксацина
МПК / Мітки
МПК: C07D 471/04
Мітки: одержання, солей, геміфлоксацину, кислих, спосіб
Код посилання
<a href="https://ua.patents.su/6-77070-sposib-oderzhannya-kislikh-solejj-gemifloksacinu.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання кислих солей геміфлоксацину</a>
Попередній патент: Спосіб іммобілізації пероксидази
Наступний патент: Аерозольутворюючий твердопаливний склад для гасіння пожежі (варіанти)
Випадковий патент: Дерматом з круговим механізмом для зрізування середнього, рельєфного епідермотранслокалізаційного аутодермотрансплантата










