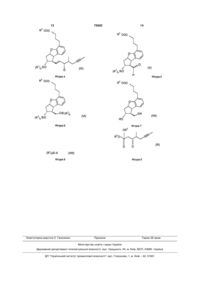
Спосіб одержання берапросту і його солей
Номер патенту: 75692
Опубліковано: 15.05.2006
Автори: Балогне Кардош Жужанна, Далмаді Дьюла, Боді Йожеф, Севереньї Зольтан, САБО Тібор
Формула / Реферат
1. Спосіб одержання сполуки формули (І)
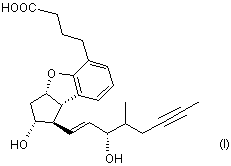
та її солей, зокрема її натрієвої солі, який характеризується тим, що сполуку загальної формули (VII)
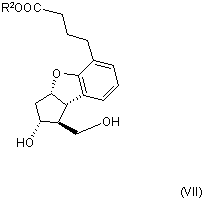 ,
,
де R2 означає нерозгалужену або розгалужену алкільну групу, що містить 1-4 атоми вуглецю, піддають реакції зі сполукою загальної формули (VIII)
(R1)3Si–X, (VIII)
де R1 означає метильну або етильну групу, Х означає атом хлору, брому або йоду, СF3SО2-О-групу, азидо-, ціано-, або групу
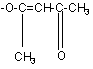 ,
,
або ацетамідо- або ацетилоксигрупу, одержуючи сполуку загальної формули (VI)
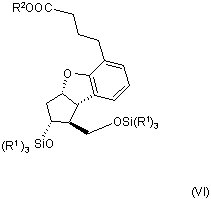 ,
,
в якій значення R1 та R2 є такими, як визначено вище, яку окиснюють до альдегіду загальної формули (V)
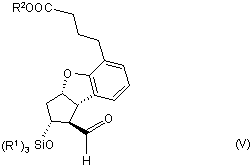 ,
,
де значення R1 та R2 є такими, як визначено вище, одержаний альдегід з виділенням або без виділення піддають реакції з фосфонатом загальної формули (IX)
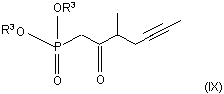 ,
,
де R3 означає нерозгалужену або розгалужену алкільну групу, що містить 1-4 атоми вуглецю, одержуючи сполуку загальної формули (IV)
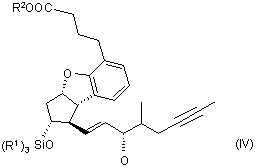 ,
,
де значення R1 та R2 є такими, як визначено вище, піддають зняттю захисту шляхом відщеплення захисної групи у положенні 11, а отриману таким чином сполуку загальної формули (III)
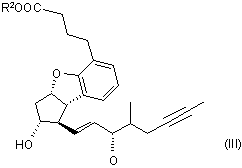 ,
,
де значення R2 є таким, як визначено вище, піддають відновленню, одержуючи сполуку загальної формули (II)
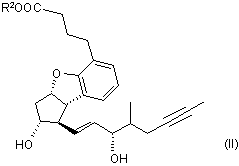 ,
,
де значення R2 є таким, як визначено вище, яку гідролізують і виділяють кислоту формули (І)
 ,
,
яку шляхом взаємодії з основою перетворюють на сіль, і сіль виділяють або одержану кислоту формули (І) без етапу виділення перетворюють на її сіль і одержану, таким чином, сіль виділяють.
2. Спосіб згідно з пунктом 1, який відрізняється тим, що використовують сполуку загальної формули (VIII), де R1 означає етил, а Х означає атом хлору, брому або йоду, ціано-, азидо-, СF3SО2-О-групу або групу
 .
.
3. Спосіб за пунктом 1, який відрізняється тим, що сполуку загальної формули (VI) піддають окисненню до сполуки загальної формули (V) при використанні суміші диметилсульфоксиду, оксалілхлориду та триетиламіну.
4. Спосіб за пунктом 1, який відрізняється тим, що альдегід загальної формули (V) та фосфонат загальної формули (IX) піддають реакції в умовах реакції Віттіга-Хорнера-Еммона.
5. Спосіб за пунктом 1, який відрізняється тим, що захисну групу гідроксильної групи у положенні 11 у випадку сполуки загальної формули (IV) відщеплюють в кислому середовищі.
6. Спосіб за пунктом 1, який відрізняється тим, що відновлення сполуки загальної формули (ІІІ) здійснюють за допомогою діізобутилалюмо-2,6-дитретбутил-4-метилфеноксиду.
7. Спосіб за пунктом 1, який відрізняється тим, що сполуку загальної формули (II) гідролізують у лужному середовищі.
8. Спосіб за пунктом 1, який відрізняється тим, що кислоту формули (І) перетворюють у натрієву сіль, а цю сіль потім виділяють.
9. Сполука загальної формули (VI)
 ,
,
в якій R1 та R2 є такими, як визначено у пункті 1.
10. Сполука загальної формули (VI) за п. 9, в якій R1 означає етильну групу, а R2 означає метильну групу.
11. Сполука загальної формули (V)
 ,
,
в якій R1 та R2 є такими, як визначено у пункті 1.
12. Сполука загальної формули (V) за п. 11, в якій R1 означає етильну групу, а R2 означає метильну групу.
13. Сполука загальної формули (IV)
 ,
,
в якій R1 та R2 є такими, як визначено у пункті 1.
14. Сполука загальної формули (IV) за п. 13, в якій R1 означає етильну групу, а R2 означає метильну групу.
Текст
1. Спосіб одержання сполуки формули (І) -O-C=CH-C-CH3 O CH3 , або ацетамідо- або ацетилоксигрупу, одержуючи сполуку загальної формули (VI) R2OOC O OSi(R1)3 HOOC (I) HO OH (VI) , в якій значення R1 та R2 є такими, як визначено вище, яку окиснюють до альдегіду загальної формули (V) (13) O C2 (R1 )3 SiO R2OOC 75692 та її солей, зокрема її натрієвої солі, який характеризується тим, що сполуку загальної формули (VII) R2OOC (11) O O O (R1 (V) )3 SiO HO 2 OR3 (VII) , де R означає нерозгалужену або розгалужену алкільну групу, що містить 1-4 атоми вуглецю, піддають реакції зі сполукою загальної формули (VIII) (R1)3Si–X, (VIII) де R1 означає метильну або етильну групу, Х означає атом хлору, брому або йоду, СF3SО2-Огрупу, азидо-, ціано-, або групу R3 O P O O (IX) , (19) , де значення R1 та R2 є такими, як визначено вище, одержаний альдегід з виділенням або без виділення піддають реакції з фосфонатом загальної формули (IX) OH UA H 3 75692 4 де R3 означає нерозгалужену або розгалужену хлору, брому або йоду, ціано-, азидо-, СF3SО2-Оалкільну групу, що містить 1-4 атоми вуглецю, групу або групу одержуючи сполуку загальної формули (IV) -O-C=CH-C-CH3 R2OOC CH3 O (IV) (R1 )3 SiO O , де значення R1 та R2 є такими, як визначено вище, піддають зняттю захисту шляхом відщеплення захисної групи у положенні 11, а отриману таким чином сполуку загальної формули (III) R2OOC O (III) HO O , де значення R2 є таким, як визначено вище, піддають відновленню, одержуючи сполуку загальної формули (II) O . 3. Спосіб за пунктом 1, який відрізняється тим, що сполуку загальної формули (VI) піддають окисненню до сполуки загальної формули (V) при використанні суміші диметилсульфоксиду, оксалілхлориду та триетиламіну. 4. Спосіб за пунктом 1, який відрізняється тим, що альдегід загальної формули (V) та фосфонат загальної формули (IX) піддають реакції в умовах реакції Віттіга-Хорнера-Еммона. 5. Спосіб за пунктом 1, який відрізняється тим, що захисну групу гідроксильної групи у положенні 11 у випадку сполуки загальної формули (IV) відщеплюють в кислому середовищі. 6. Спосіб за пунктом 1, який відрізняється тим, що відновлення сполуки загальної формули (ІІІ) здійснюють за допомогою діізобутилалюмо-2,6дитретбутил-4-метилфеноксиду. 7. Спосіб за пунктом 1, який відрізняється тим, що сполуку загальної формули (II) гідролізують у лужному середовищі. 8. Спосіб за пунктом 1, який відрізняється тим, що кислоту формули (І) перетворюють у натрієву сіль, а цю сіль потім виділяють. 9. Сполука загальної формули (VI) R2OOC R2OOC O O OSi(R1)3 (R1 )3 SiO (II) HO OH , де значення R2 є таким, як визначено вище, яку гідролізують і виділяють кислоту формули (І) HOOC (VI) , в якій R1 та R2 є такими, як визначено у пункті 1. 10. Сполука загальної формули (VI) за п. 9, в якій R1 означає етильну групу, а R2 означає метильну групу. 11. Сполука загальної формули (V) R2OOC O O (I) OH , яку шляхом взаємодії з основою перетворюють на сіль, і сіль виділяють або одержану кислоту формули (І) без етапу виділення перетворюють на її сіль і одержану, таким чином, сіль виділяють. 2. Спосіб згідно з пунктом 1, який відрізняється тим, що використовують сполуку загальної формули (VIII), де R1 означає етил, а Х означає атом HO O (V) (R1 )3 SiO H , в якій R1 та R2 є такими, як визначено у пункті 1. 12. Сполука загальної формули (V) за п. 11, в якій R1 означає етильну групу, а R2 означає метильну групу. 13. Сполука загальної формули (IV) 5 75692 6 в якій R1 та R2 є такими, як визначено у пункті 1. 14. Сполука загальної формули (IV) за п. 13, в якій R1 означає етильну групу, а R2 означає метильну групу. R2OOC O (IV) (R1 )3 SiO O , Даний винахід відноситься до нового способу синтезу берапросту формули (І) та його солей, а також до нових проміжних сполук загальних формул (IV), (V) та (VI), де R1 означає метил етильних груп, R2 означає нерозгалужену або розгалужену алкільну групу, що містить 1-4 вуглецеві атоми, які використовуються у новому способі синтезу. Солі берапросту формули (І), зокрема, натрієва сіль, є похідними простацикліну, що застосовуються перорально, вони є ефективними при лікуванні хронічного захворювання периферійної судинної системи, артеріального тромбозу та легеневої гіпертензії. Активний фармацевтичний інгредієнт формули (І) та його солі, що використовуються у комерційних фармацевтичних композиціях, представляють собою рацемічні сполуки, які містять чотири стереоізомери. Синтез сполуки формули (І) та її солей описаний у [публікації європейського патенту №084856А, в опублікованій японській патентній заявці №59-134787А та в: Tetrahedron, 55, p.2449-2474 (1999)], при цьому короткий виклад способу синтезу представлений Схемою 1. TBDMS є трет.бутилдиметилсилільною групою, Ас означає ацетильну групу, реакція В-Х-Е означає реакцію Віттіга-Хорнера-Емона у відповідності зі Схемою 1. Зі Схеми 1 та з попереднього рівня техніки можна побачити, що шлях, який відноситься до рівня техніки, є більш тривалим та забезпечує помірний вихід. Об'єкт даного винаходу полягає у забезпеченні більш швидкого синтезу з вищим виходом. Несподівано було виявлено, що захист первинної гідроксильної групи чутливою до кислот захисною групою та захист вторинної гідроксильної групи чутливою до основ захисною групою та подальше видалення захисної групи з первинної гідроксильної групи можуть бути усуненi при використанні однієї спеціально підібраної захисної групи, яка робить можливим у той самий час селективне окиснення. Видалення вказаної вище захисної групи перед відновленням оксо-групи у 15-положенні та ретельний вибір відновлювального агента підвищують стереоселективність відновлення та вихід усього процесу синтезу. Згідно з даним винаходом сполука загальної формули (VII), де R2 означає нерозгалужену або розгалужену алкільну групу, що містить 1-4 вуглецеві атоми, піддають реакції зі сполукою загальної формули (VIII), де R1 означає метильну або етильну групу, X означає атом хлору, брому або йоду, CF3SO2-O-групу, азидо, ціано або групу або іншу групу, описану у приведеному нижче джерелі інформації: ["Силілувальні агенти" Флука Хемі АГ, друге видання, під ред. доктора Герт Ван Лука (1995), ISBN 3-905617-08-0], при цьому одержану сполуку загальної формули (VI), де значення R1 та R2 є такими, як визначено вище, окислюють до альдегіду загальної формули (V), де значення 1 2 R та R є такими, як визначено вище, одержаний альдегід при ізоляції або без ізоляції піддають реакції з фосфонатом загальної формули (IX), де R3 означає нерозгалужену або розгалужену алкільну групу, що містить 1-4 вуглецеві атоми, одержану сполуку загальної формули (IV), де значення R1 та R2 є такими, як визначено вище, піддають зняттю захисту шляхом відщеплення захисної групи у положенні 11, а сполуку загальної формули (III), де значення R2 є таким, як визначено вище, при цьому одержану таким чином сполуку піддають відновленню, отриману сполуку загальної формули (II), де значення R2 є таким, як визначено вище, гідролізують та ізолюють кислоту формули (І), після цього за допомогою реакції з основою її перетворюють на сіль, ізолюють сіль або одержану кислоту формули (І) перетворюють без етапу виділення на її сіль, а одержану таким чином сіль ізолюють. Під час приведеною вище процесу сполуку загальної формули (VII) піддають реакції зі сполукою загальної формули (VIII), прийнятною для введення триетисилільної або триметилсилільної групи, де R1 означає метильну або етильну групу, X означає атом хлору, брому або йоду, CF3SO2-Oгрупу, азидо, ціано або групу або іншу групу, описану у приведеному нижче джерелі інформації: ["Силілувальні агенти", Флука Хемі АГ, друге видання, під ред. доктора Герт Ван 7 75692 8 Лука (1995), ISBN 3-905617-08-0], при цьому три[12Н; J=7,9Гц; Si(CH2CH3)3] 0,95т, 1,02т [18Н; метилсилільні або триетилсилільні галогеніди є J=7,9Гц; Si(CH2CH3)3]; 2,05м, 2,06м [3Н; 10-Н, 3переважними, зокрема, хлориди або їх специфічні Н2]; 2,16м, 2,22м, 2,25м [4Н; 12-Н, 2-Н2, 10-Н]; похідні, приведені вище. Одержані дисилільовані 2,70м [2Н; 4-Н2]; 3,32с [3Н; ОСН3]; 3,51 дд [1Н; діоли загальної формули (VI) можуть бути окиснені J=8,8, 7,0Гц; 8-Н]; 3,63м [2Н; 13-Н2]; 4,01тд [1Н; більш переважно сумішшю диметипсульфоксиду, 1=7,4, 5,8Гц; 11-Н]; 4,85ддд [1Н; 1=9,1, 7,2, 5,4Гц; оксалілхлориду та триетиламіну в альдегіди зага9-Н]; 6,85т [1Н; J=7,3Гц; 2'-Н]; 6,93д [1Н; J=7,3Гц; льної формули (V). 1'-Н]; 7,19д [1H; J=7,3Гц; 3'-Н]. 13 Альдегіди загальної формули (V) піддають реС ЯМР (100МГц, C6D6), С (м.ч.): 5,5, 5,9 акції з фосфонатами загальної формули (IX) в [Si(CH2CH3)3]; 7,7, 7,8 Si(CH2CH3)3]; 26,1 [С-3]; 30,5 умовах реакції Віттіга-Хорнера-Еммона [Chem. [C-4]; 34,3 [C-2]; 43,6 [C-10]; 47,9 [C-8]; 51,5 [OCH3]; Rev. 89 p. 863-927 (1989)] для одержання сполук 59,0 [C-12]; 63,0 [C-13]; 73,6 [C-11]; 85,9 [C-9]; загальної формули (IV). 121,4 [C-2']; 123,3 [C-3']; 124,3 [C-5]; 129,6 [C-1']; Після відщеплення триетилсилільної або три132,0 [C-7]; 158,8 [C-6]; 173,9 [C-1]. метилсилільної захисної групи вторинної гідроксиПриклад 2 групи в сполуках загальної формули (IV) в кислому Сполука загальної Формули (V), де R1 означає середовищі одержують сполуки єнонового типу етильну групу, a R2 означає метальну групу загальної формули (III). 0,27мл (3ммоля) оксалілхлориду розчиняли у Стереоселективне відновлення сполук загаль3мл дихлорметану та суміш охолоджували до теної формули (III) здійснюють переважно при викомператури -60°С. До цього розчину по краплях при ристанні діізобутилалюміній-2,6-дитрет-бутил-4температурі -60°С додавали 0,44мл (6,2ммоля) метилфеноксиду, та одержують сполуку формули диметилсульфоксиду, розчиненого у 3мл дихлор(II), гідроліз якої в основному середовищі привометану. дить до утворення берапросту формули (І). Солі Після перемішування протягом 5 хвилин додасполуки формули (І) можуть бути одержані шлявали до суміші 1,07г (2ммоля) сполуки загальної хом реакції з основами. Одержання солі можна формули (VI), що приготовлена згідно з Приклапроводити після ізоляції берапросту формули (І) з дом 1 та розчинена у 2мл дихлорметану. Реакційвиділенням або без її виділення. ну суміш залишали нагріватися до температури Для приготування натрієвої солі берапросту 35°С та перемішували протягом 30 хвилин при цій найбільш бажаним є використання гідроксиду натемпературі. Реакційну суміш охолоджували до трію як основи. 60°С та додавали 1,42 (10ммоля) триетиламіну. Сполуки загальної формули (VII) та фосфонаСуміш перемішували протягом 15 хвилин та додати загальної формули (IX), що використовуються у вали 10мл води та 7мл 10Μ водного розчину способі за даним винаходом, можуть бути пригоNaHSO4 при кімнатній температурі. Водну фазу товлені так, як описано, наприклад, в [Tetrahedron двічі екстрагували за допомогою 5мл дихлормета55 p.2449-2474 (1999)]. Сполуки загальної формуну. Поєднану органічну фазу промивали за дополи (VIII) ε комерційно доступними сполуками. могою 10мл 1М водного розчину NaHCO3, 10мл Фігури 1, 2, 3, 4, 5, 6, 7, 8 та 9 представляють насиченого розчину NaCI. Органічну фазу висушусобою загальні формули (І), (II), (III), (IV), (V), (VI), вали над Na2SO4, випарювання проводили у ваку(VII), (VIII) та (IX). умі, а вказану у назві вище сполуку одержували як Даний винахід може бути описаний більш дожовту олію, що може використовуватися на настукладно шляхом наступних прикладів, без обмепному етапі реакції з очисткою або без очистки. ження, таким чином, наших пунктів формули. Вихід: 0,83г (99%) Приклад 1 ТШХ-Rf (гексан-діізопропіловий етер 1:1)=0,44, Сполука загальної формули (VI), де R1 ознаТШХ-Rf (гексан-етилацетат 3:1)=0,52 1 чає етильну групу, а R2 означає метильну групу Н ЯМР (400МГц, C6D6), Η (м.ч.): 0,41к [6Н; 1,84г (6ммолів) діола загальної формули (VII), J=8,0Гц; Si(СН2СН3)3]; 0,84т [9Н; J=8,0Гц; де R2 означає метильну групу, розчиняли у 10мл Si(CH2CH3)3]; 1,94м, 2,02м [3Н; 10-Н, 3-Н2]; 2,17м, піридину. Розчин перемішували та додавали 2,20т [3Н; J=7,4Гц; 10-Н, 2-H2]; 2,64м [2Н; 4-Н2]; 2,35мл (14ммоля) триетилсилілхлориду. Перемі2,73т [1Н; J=6,0Гц; 12-Н]; 3,32с [3Н; ОСН3]; 3,73дд шування продовжували протягом 30 хвилин, а по[1Н; J=8,7, 6,4Гц; 8-Н]; 4,04к [1Н; J=6,0Гц; 11-Н]; тім реакційну суміш виливали у розчин 50мл води 4,69м [1Н; 9-Н]; 6,75т [1Н; J=7,4Гц; 2'-Н]; 6,88д, та 20мл гексану. Водну фазу екстрагували за до6,91 д [2Н; J=7,4Гц; 1'-Н, 3'-Н]; 9,46д [1Н; J 1Гц; помогою гексану (2 10мл) та поєднаний розчин 13-Н]] 13 гексану промивали за допомогою 30мл 1М водного С ЯМР (100МГц, С6D6), С (м.ч): 5,6 розчину NaHSO4, 30мл 1М розчину NaHCO3, [Si(СН2СН3)3] 7,5 Si(СН2СН3)3]; 26,0 [С3]; 30,4 [С-4]; 2 30мл води, а потім за допомогою насиченого 34,2 [С-2]; 43,7 [С-10]; 45,9 [С-8]; 51,6 [ОСН3]; 68,8 розчину NaCI. Розчин гексану висушували над [С-12]; 73,9 [С-11]; 85,7 [С-9]; 121,6 [С-2']; 123,2 [СNa2SO4 протягом 1 години, а потім його випарюва3']; 124,3 [С-5]; 129,9 [С-1']; 130,4 [С-7]; 158,7 [С-6]; ли. Вказану у назві вище сполуку одержували як 173,9 [С-1]; 200,6 [С-13]. безбарвну олію. Приклад 3 Вихід: 3,08г (96%). Сполука загальної Формули (IV). де R1 означає ТШХ-Rf (гексан-етилацетат 3:1)=0,60, етильну групу. R2 означає метипьну групу (ТШХ=тонкошарова хроматографія) Масляну дисперсію 92мг гідриду натрію (60%) ТШХ-Rf (гексан-етилацетат 10:1)=0,32. (2,3ммоля), суспендовану у 2мл толуолу та 0,51мл 1 Н ЯМР (400МГц, С6D6), Н (м.ч.): 0,54к, 0,63к (2,2ммоля) фосфонату загальної формули (IX), де 9 75692 10 R3 означає метильну групу, розчиняли в 1мл толу1=8,5, 7,2, 5,0Гц; 9-Н]; 6,34д [1Н, J=15,6; 14-Н]; олу та додавали до суміші при температурі 15°С в 6,78м [1Н; 2'-Н]; 6,89дд [1Н; 1=15,6, 8,8Гц; 13-Н]; атмосфері азоту. Суміш перемішували протягом 6,94м, [2Н; Т-Н, 3'-Н]. 13 20 хвилин при температурі 15°С, а потім розчин, С ЯМР (100МГц, CDCI3), С (м.ч.): 3,5 [С-20]; що містить фосфонат натрію, додавали по крап16,4 [С-21]; 22,3 [С-17]; 24,7 [С-2]; 29,1 [С-4]; 33,4 лях до 0,83г (2ммоля) сирового альдегіду загаль[С-3]; 41,8 [С-10]; 44,1 [С-16]; 50,3 [С-8]; 51,5 ної формули (V), одержаного у відповідності з [ОСН3]; 58,6 [С-12]; 76,4 [С-11]; 76,6, 77,2 [С-18, СПрикладом 2 та розчиненого у 2мл толуолу при 19]; 84,6 [С-9]; 120,7 [С-2']; 121,9 [С-3']; 123,5 [С-5]; температурі -10°С. Після перемішування протягом 129,1, 129,2 [С-14, С-1']; 129,7 [С-7]; 146,0 [С-13]; 2 годин до реакційної суміші додавали 10мл води 157,2 [С-6]; 174,1 [С-1]; 201,7 [C-15]. та 2мл 1Μ водного розчину NaHSO4 та перемішуПриклад 5 вали протягом двох хвилин. Водну фазу двічі ексСполука загальної формули (II), де R2 означає трагували за допомогою 5мл толуолу, а розчин метильну групу толуолу екстрагували за допомогою 10мл води, 5,14г (22ммоля) 2,6-дитрет-4-метилфенолу 10М водного розчину NaHCO3, 10мл води та 10мл розчиняли в 50мл дистильованого толуолу в атмонасиченого розчину NaCI. сфері азоту. 1,55г (11ммоля) діізобутилалюмогідРозчин висушували над Na2SO4, випарювали у риду розчиняли у 8мл дистильованого толуолу та вакуумі та одержували вказану у назві сполуку у додавали по краплях до вказаного вище розчину. вигляді жовтої олії, яку можна використовувати на Реакційну суміш перемішували протягом 1 години наступному етапі реакції без очистки. при температурі 0°С, а потім охолоджували до Вихід: 1,2г (>99%) температури -78°С. До цього діізобутилалюмінійТШХ-Rf (гексан-діізопропіловий етер 1:1)=0,49 2,6-дитрет-бутил-4-метилфеноксидного реагенту ТШХ-Rf (гексан-етилацетаг 3:1)=0,54 повільно по краплях при температурі -78°С дода1 Н ЯМР (400МГц, С6D6), Н (м.ч.): 0,47к, 0,48к вали 0,45г (1,1ммоля) сполуки загальної формули [6Н; J=7,8Гц; Si(СН2СН3)3]; 0,90т, 0,91т [9Н; (III), одержаної в Прикладі 4, що розчинена у 4мл J=7,8Гц; Si(СН2СН3)3]; 1,16д [3Н; J=6,9Гц; 21-Н3]; дистильованого толуолу. Реакційну суміш перемі1,54м [3Н; 20-Н3]; 2,02м [2Н, 3-H2]; 2,21т [J=7,5Гц; шували протягом ночі при температурі 50°С, а 2-Н2]; 2,67м [2Н; 4-Н2]; 3,04м [1Н; 8-Н]; 3,32с [3Н; потім гасили за допомогою 27мл 2Μ водного розОСН3]; 3,59м [1Н; 11-Н]; 4,67м [1Н; 9-Н]; 6,08дд чину соляної кислоти. Після перемішування протя[1Н; J=15,3, 2,3Гц; 14-Н]; 6,78м [2Н; 13-Н, 2'-Н]; гом 30 хвилин розділяли фази та водну фазу двічі 6,91м [2Н; 1'-Н, 3'-Н]. промивали за допомогою 15мл толуолу, поєднану 13 органічну фазу промивали 20мл насиченого розС ЯМР (100МГц, C6D6), С (м.ч.): 4,0 [С-20]; чину NaCI, 15мл 1Μ NaHCO3 та двічі за допомогою 5,7 [Si(СН2СН3)3]; 7,6 Si(СН2СН3)3]; 17,0 [С-21]; 20мл насиченого розчину NaCI. Органічну зразу 23,2, 23,3 [С-17]; 26,0 [С-3]; 30,4 [С-4]; 34,2 [С-2]; висушували над Na2SO4 та випарювали під ваку43,7 [С-10]; 45,2, 45,3 [С-16]; 50,3 [С-8]; 51,6 умом. Вказану в назві сполуку одержували при [ОСН3]; 59,6 [С-12]; 77,1 [С-11]; 77,8, 77,9, 78,0 [Сочистці залишку за допомогою хроматографії як 18, С-19]; 84,9 [С-9]; 121,6 [С-2']; 122,8 [С-3']; 124,5 безбарвну олію. [С-5]; 130,1 [С-1']; 130,4 [С-7]; 130,7 [С-14]; 146,8, Вихід: 0,25г (55%) 146,9 [С-13]; 158,6 [С-6]; 173,8 [C-1]; 200,5 [С-15]. ТШХ-Rf (діізопропіловий етер: етилацетат: Приклад 4 ацетат 50:50:1,5)=0,24 Сполука загальної Формули (III), де R2 означає ТШХ-Rf (толуол: діоксан: оцтова кислота метильну групу 20:10:1)=0,50 1,2г (2ммоля) сирового силілєнону загальної 1 формули (IV), що одержували у Прикладі 3, розчиН ЯМР (400МГц, CDCI3), Η (м.ч.): 1,021 [3Н; няли у 20мл метанолу та до розчину додавали J=6,8Гц; 21-Н3]; 1,79м [1Н; 16Н]; 1,80т, 1,8Н [3Н; 0,15мл (1,8ммоля) концентрованої соляної кислоJ=2,6Гц 20-Н3]; 1,88-2,18м [6Н; 3-Н2,10-Нb, 17-Нb, ти. Суміш перемішували протягом 5 хвилин при ОН]; 2,25м [1Н; 17-Ha]; 2,33м [1Н; 2-H2]; 2,48м [1Н; температурі 25°С, а потім до суміші додавали 12-Н]; 2,61м, [2Н; 4-Н2]; 2,66м [1Н; 10-На]; 3,46т, 0,16г (1,9ммоля) твердого NaHCO3. Суміш пере3,47т [1Н; J=8,2Гц 8-Н]; 3,66с [3Н; ОСН3]; 3,95м мішували протягом 10 хвилин при температурі [1Н; 11-Н]; 4,07т, 4,21дд [1Н; J=7,0, J=5,8, 4,9; 1525°С, а потім випарювали під вакуумом. Залишок Н]; 5,12м [1Н; 9-Н]; 5,63дд [1Н; J=15,5, J=5,8, 7,0; розчиняли в толуолі, відфільтровували неорганічні 14-Н]; 5,70дд, 5,71дд [1Н; J=15,5, 8,4, J=15,5, 8,0; солі, а фільтрат випарювали. Одержаний сировий 13-Н]; 6,77м [1Н; 2'-Н]; 6,97м [2Н; 1'-Н, 3'-Н]; продукт очищали за допомогою колонкової хромаПриклад 6 тографії, і, таким чином, одержували вказану у Берапрост формули (І) назві вище сполуку як блідо-жовту олію. 0,246г (0,6ммоля) сполуки загальної формули Вихід: 0,46г (56%) (II), що одержана у Прикладі 5, розчиняли в 1мл ТШХ-Rf (діізопропіловий етер-етилацетатметанолу та додавали до цього розчину по крапоцтова кислота 50:50:1,5)=0,50. лях 1мл 1Μ водного розчину гідроксиду натрію. 1 Після перемішування протягом однієї години меН ЯМР (400МГц, CDCI3), Η (м.ч.): 1,21д [1Н, танол відокремлювали від реакційної суміші у ваJ=7,0Гц; 21-Н3]; 1,77т [3Н; J=2,0Гц; 20-Н3]; 1,94м куумі. Водний залишок розводили 10мл метил[2Н; 3-Н2]; 2,08ддд [1Н, 1=13,6, 8,4, 5,0Гц; 10-Ha]; трет. бутилового етеру та поєднану органічну фазу 2,27м [1Н, 17-Hb]; 2,33т [2Н, J=7,5Гц; 2-Н2]; 2,46м промивали за допомогою насиченого розчину [1Н, 17-Ha]; 2,62м [2Н, 4-Н2]; 2,68м [2Н, 10-На,12-Н]; NaCI, висушували над Na2SO4, а потім випарюва2,90с [1Н, J=7,0Гц; 16-Н]; 3,58т [1Н, J=8,5; 8-Н]; ли. Залишок після випарювання кристалізували з 3,65с [3Н; ОСН3]; 4,11м [1Н; 11-Н]; 5,16ддд [1Н; 11 75692 12 суміші етилацетату та гексану, а чисту сполуку, ки Формули (I)) вказану вище у назві, одержували у вигляді безба0,199г берапросту розчиняли у 2мл метанолу, рвних кристалів. до цього розчину додавали 0,5мл 1Μ водного розВихід: 0,21г (87%) чину гідроксиду натрію та після перемішування ТШХ-Rf (толуол-діоксан-оцтова кислота випарювали розчинник у вакуумі і, таким чином, 20:10:1)=0,41 вказану у назві сполуку одержували у вигляді безТочка плавлення: 98-112°С. барвних кристалів. 1 Вихід: 0,21г (100%) Н ЯМР (400МГц, CDCI3), Η (м.ч.): 1,00д, Точка плавлення: >205°С. 1,03д [3Н; J=6,8Гц; 21-Н3]; 1,79м [1Н; 16-Н]; 1,80т, 1 1,81т [3Н, J=2,5, 2,4Гц; 20-H3]; 2,3-1,9м [5Н, 3-Н2, Н ЯМР (400МГц, ДMCO-d6), Η (м.ч.): 0,90, 10Нb, 17-H2]; 2,34т [1Н; J=7,4Гц; 2-Н2]; 2,43м [1Н; 0,92д [3Н; J=6,7Гц; 21-Н3]; 1,75-1,55м [7Н; 10Нb, 12-Н]; 2,64м [3Н; 10-На, 4-Н2]; 3,43т, 3,44т [1Н, 16-Н, 3-Н2, 20-Н3]; 1,89т [2Н, J=7,6Гц; 2-H2]; 1,94м J=8,7, 8,5Гц; 8-Н]; 3,92м [1Н; 11-H]; 4,07т, 4,17т [1Н; 17-Hb]; 2,16к [1Н, J=8,5Гц; 12-Н]; 2,25м [1Н; 17[1Н, J=7,3, 5,6Гц; 15-Н]; 4,3b [2Н; ОН]; 5,09м [1Н, 9На]; 2,44т [2Н; J=7,5Гц; 4-Н2]; 2,50 [1Н; 10-Ha]; Н]; 5,58дд, 5,61дд [1Н; J=15,3, 6,5Гц; 14-H]; 5,67дд, 3,39т [1Н, J=8,5Гц; 8-Н]; 3,72тд [1Н; J=8,5, 6,1Гц; 5,68дд [1Н; J=15,3, 8,0Гц; 13-Н]; 6,77м [1Н; 2'-Н]; 11-Н]; 3,84т, 3,96т [1Н, J=6,5, 6,0Гц; 15-Н]; 4,85ш 6,95м [2Н; 1'-Н, 3'-Н]. [2Н, ОН]; 5,01дт [1Н, 1=8,5, 6,6Гц; 9-Н]; 5,46дд, 13 5,47дд [1Н; J=15,4, 6,5Гц, J=15,4, 6,0Гц; 14-Н]; С ЯМР (100МГц, CDCI3), С (м.ч.): 3,5, 3,6 [С5,65дд, 5,66дд [1Н; J=15,4, 8,5Гц; 13-Н]; 6,71м [1Н; 20]; 14,7,15,8 [С-21]; 22,3,22,6 [С-17]; 24,6 [С-2]; 2-Н]; 6,92м [2Н; 1'-Н, 3'-Н]. 29,1 [C-4]; 33,1 [С-3]; 38,2, 38,3 [С-16]; 41,2 [С-10]; Під час вказаної вище процедури тонкошаро50,4 [С-8]; 58,8 [С-12]; 75,8, 76,3, 76,4 [С-11, С-15]; вої хроматографії (ТШХ) ми використовували пла77,2, 77,4 [С-18, С-19]; 84,5, 84,6 [С-9]; 120,6 [С-2']; стини MERCK Kieselgel 60 F254, товщиною 0,2мм та 121,9 [С-3']; 123,2 [С-5]; 129,0 [С-1']; 129,7 [С-7]; довжиною 5см. 132,3, 133,0, 133,8, 134,0 [С-13, C-14]; 157,2 [С-6]; 178,3 [С-1]. Приклад 7 Натрієва сіль берапросту (натрієва сіль сполу 13 Комп’ютерна верстка О. Гапоненко 75692 Підписне 14 Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for the production of beraprost and its salts
Назва патенту російськоюСпособ получения берапроста и его солей
Автори російськоюSzabo, Tibor, Bodi, Jozsef
МПК / Мітки
МПК: C07D 307/78, C07D 307/93
Мітки: спосіб, берапросту, одержання, солей
Код посилання
<a href="https://ua.patents.su/7-75692-sposib-oderzhannya-beraprostu-i-jjogo-solejj.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання берапросту і його солей</a>
Попередній патент: Похідні хіноліну, їх використання як протипухлинних засобів, композиція на їх основі та терапевтичний спосіб лікування раку
Наступний патент: Вимірювальний пристрій для визначення активності кисню в розплавах металів чи шлаків
Випадковий патент: Розсадні брикети із соломи з підвищеною міцністю