Спосіб одержання аргініндезімінази mycoplasma hominis із рекомбінантних штамів бактерій escherichia coli
Номер патенту: 97610
Опубліковано: 27.02.2012
Автори: Фаюра Любов Романівна, Сибірний Андрій Андрійович, Борецький Юрій Романович, Борецький Володимир Юрійович
Формула / Реферат
Спосіб одержання аргініндезімінази Mycoplasma hominis із рекомбінантних штамів бактерій Escherichia coli, який відрізняється тим, що вводять заміни нуклеотидів в гені, що кодує аргініндезіміназу, у положеннях Т4G, A603G, A606G, A789G, A792T, A813T, A816G, A819G, A822T, A882G, A1227G, культивування та індукцію експресії проводять за допомогою α-лактози 30-36 годин при 32° С в середовищі, що містить 0,75 % гліцерин, при рН 7,0-7,4; розчиняють фермент в 50 мМ К-фосфатному буфері при рН 7,2, що містить 1 мМ ЕДТА, 5М гуанідинхлорид та 5 мМ ДТТ, а ренатурацію проводять в 20 мМ К-фосфатному буфері при рН 7,2, що містить 200 мМ КCl, 1 мМ ДТТ, 1 мМ ЕДТА.
Текст
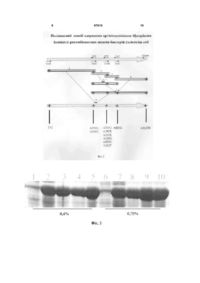
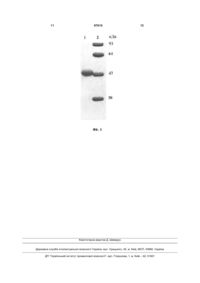
Спосіб одержання аргініндезімінази Mycoplasma hominis із рекомбінантних штамів бактерій Escherichia coli, який відрізняється тим, що вводять заміни нуклеотидів в гені, що кодує аргініндезіміназу, у положеннях Т4G, A603G, A606G, A789G, A792T, A813T, A816G, A819G, A822T, A882G, A1227G, культивування та індукцію експресії проводять за допомогою α-лактози 30-36 годин при 32° С в середовищі, що містить 0,75 % гліцерин, при рН 7,0-7,4; розчиняють фермент в 50 мМ К-фосфатному буфері при рН 7,2, що містить 1 мМ ЕДТА, 5М гуанідинхлорид та 5 мМ ДТТ, а ренатурацію проводять в 20 мМ К-фосфатному буфері при рН 7,2, що містить 200 мМ КCl, 1 мМ ДТТ, 1 мМ ЕДТА. (19) UA (11) (21) a201106264 (22) 19.05.2011 (24) 27.02.2012 (46) 27.02.2012, Бюл.№ 4, 2012 р. (72) СИБІРНИЙ АНДРІЙ АНДРІЙОВИЧ, ФАЮРА ЛЮБОВ РОМАНІВНА, БОРЕЦЬКИЙ ВОЛОДИМИР ЮРІЙОВИЧ, БОРЕЦЬКИЙ ЮРІЙ РОМАНОВИЧ (73) ІНСТИТУТ БІОЛОГІЇ КЛІТИНИ НАН УКРАЇНИ (56) US 20050129706 A1, 16.06.2005 (34 стор.) EP 1278868 B1, 02.01.2008 (27 стор.). Kozai M. et al.:”Growth inhibition of human melanoma cells by a recombinant arginine deiminase expressed in Escherichia coli”, J. Vet. Med. Sci. 71 (10): 13431347, 2009, p. 1343-1347. Miyazaki K.et al.:”Potent growth inhibition of tumor cells in culture by arginine deiminasepurified from a culture medium of a Mycoplasma-infected cell line”, Cancer Res 1990; 50:4522-4527. Sivashanmugam A. et al.:” Practical protocols for production of very high yields of recombinant proteins using Escherichia coli”, Protein science 2009, Vol. 18:936-948. William Studier F.:”Protein production by autoinduction in high-density shaking cultures”, Protein expression and purification 41 (2005) 207-234. Misawa S. Et al.:”High-level expression of Mycoplasma arginine deiminase in Escherichia coli C2 2 97610 1 3 97610 АДІ, є ефективним і перспективним методом лікування певних типів онкозахворювань [2]. У провідних онкологічних клініках світу проведено успішні доклінічні випробовування ензимотерапії за допомогою АДІ. Однак широкому практичному застосуванню АДІ в онкологічній практиці заважає дуже висока ціна очищених препаратів ферменту. В Україні взагалі відсутнє виробництво ферментів деградації аргініну. В основу винаходу поставлено задачу оптимізувати та суттєво здешевити описані у літературі [3, 4] і запатентовані [5] способи одержання АДІ. Поставлена задача вирішується тим, що у способі отримання препаратів АДІ, згідно з винаходом, використовується рекомбінантний (містить ген АДІ М. hominis з покращеною трансляцією) штам бактерій Е.соlі, оптимізуються умови індукції синтезу, денатурації і ренатурації ферменту, що призводить до підвищення його виходу та суттєвого зниження собівартості. Запропоновані нами модифікації дозволяють збільшити вихід АДІ після ренатурації відповідно в 1,4 та 4,6 рази порівняно із раніше опублікованими методиками Clark та Dillon [4, 5]. [табл. 1] Проведення денатурації АДІ за методикою патента [5], а ренатурації в описаних нами умовах веде до зростання виходу фермента в 1,8 рази порівняно із виходом при виконанні ренатурації за запатентованою методикою. Пропонується методика довго 4 тривалого зберігання препаратів ферменту без втрати питомої активності. Отриманий препарат АДІ ефективно деградує аргінін до цитруліну зі швидкістю 25 мкмоль/хв. на 1 мг ферменту. За вартістю реагентів, які необхідні для отримання одиниці активності АДІ запропонований спосіб є в 2,3-3,7 рази дешевшим порівняно до описаних раніше [4, 5]. Найбільш близькими до запропонованого є описані у літературі [3,4] та запатентований [5] способи одержання рекомбінантної АДІ із бактерій Е.соlі. Проте в цих способах для культивування бактерій використано багате середовище LB, індукція експресії ферменту проводиться за допомогою досить коштовного реактиву ізопропіл-Ртіогалактозиду (ІПТГ). Для денатурації білка АДІ використовується буфер, що містить високі концентрації гуанідинхлориду (6 М) та дитіотрейтолу (ДТТ, 10 мМ). У запропонованому способі використовуються наступні методи: полімеразна ланцюгова реакція (ПЛР), конструювання рекомбінантних плазмід, трансформація бактерій методом електропорації, виділення плазмід із бактерій, рестрикційний аналіз, електрофорез в агарозному гелі [6], електрофорез білків в поліакриламідному гелі в денатуруючи умовах, денатурація і ренатурація білка, хроматографічна очистка білка [7], колориметричний метод визначення активності АДІ [3]. Таблиця 1 Вплив умов денатурації/ренатурації на вихід активності АДІ Вихід активності АДІ, Е/мл ренатурованого розчину Умови денатурації/ренатурації Tris-HCl б-р рН 8.5, 6 М гуанідинхлорид 10 мМ ДТТ (за патентом [5]) 50 мМ фосфатний б-р рН 7.2, 5 М гуанідинхлорид (за статтею [4]) 50 мМ К-К-Н-РО4 рН 7.2, 5 М гуанідинхлорид 5 мМ ДТТ, 1 мМ ЕДТА/ 200 мМ КС1, 1 мМ ЕДТА, 1 мМ ДТТ Tris-HCl б-р рН 8.5, 6 М гуанідинхлорид 10 мМ ДТТ/ 200 мМ КС1, 1 мМ ЕДТА, 1 мМ ДТТ У кожному випадку для денатураціїренатурації були використані однакові аліквоти суспензії мікротілець. Поліпшений спосіб одержання аргініндезімінази М. hominis із рекомбінантних штамів бактерій Е.соlі ілюструється наступними графічними матеріалами: На фіг. 1 зображено послідовність нуклеотидів гена АДІ М. hominis. Заміни показано стрілкою і виділено потовщеним шрифтом. На фіг. 2 наведено схему ампліфікації гена ADI М. hominis. Ген ADI позначено великою сірою стрілкою. Праймери зображено маленькими стрілками і підписано. Порядок ампліфікації фрагментів гена вказано цифрами. Положення введених нуклеотидних замін позначено чорними зірками. На фіг. 3 показано електрофоретичний аналіз залежності продукції АДІ бактеріями Е.соlі від концентрації гліцерину - 0,4 % (1-5) і 0,75 % (6-10) в автоіндукційному середовищі та часу культиву 0,047 0,014 0,065 0,086 вання: 2 год. - № 1,6, 6 год. - № 2,7, 18 год. - № 3,8, 26 год. - № 4,9, 32 год.- № 5,10 відповідно. На фіг. 4 зображено електрофоретичний аналіз в ПААГ в денатуруючих умовах (у присутності додецилсульфату натрію) очищеного препарату рекомбінантної АДТ. 1 - препарат АДІ; 2 - маркери молекулярної маси. Поліпшений спосіб одержання аргініндезімінази М. hominis із рекомбінантних штамів бактерій Е.соlі здійснюється кількома етапами: Етап 1. Сайт специфічний мутагенез гена ADIM. hominis Враховуючи результати аналізу нуклеотидної послідовності гена ADI M. hominis (фіг. 1), програмується послідовність праймерів із замінами для ампліфікації гена. Праймери програмуються таким чином, щоб замінити внутрішні стоп кодони (котрі у клітинах М. hominis декодуються як триптофан) на універсальні триптофанові кодони, як описано, для гена АДІ Mycoplasma arginini. [3]. Додатково вво 5 97610 дяться заміни для покращення ефективності трансляції: T4G, A603G, A606G, A789G, А792Т, А813Т, A816G, A819G, А822Т, A882G, A1227G (фіг. 2). Ген ампліфікується за допомогою полімеразної ланцю 6 гової реакції із використанням вказаних праймерів (табл. 2) та комерційно доступної хромосомної ДНК М. hominis як матриці (фіг. 1.). Таблиця 2 Перелік праймерів, використаних для ампліфікації гена АДІ № 1 2 3 4 5 6 7 Праймер Did1 Did2 Did4 Did6 Dr3 Dr5 Dr7 DiBam Sequence 5'-3' ACAGCCATGGCTGTATTTGACAGTAAAT AAAACTCCGTGGTACTACGACC AACTTAATGCACCTAGATACTTGGCTGACTATGTTAGAC AAG CTGGGACTACGATTTAGTTAACGG CGTAGTACCACGGAGTTTTAAACTAGTTTAG GGTGCATTAAGTTAGTCCATTTAGGAACATTAATTG TAAATCGTAGTCCCAGAATTTGAATACATC TAGGATCCTACCACTTAACATCTTTACGTG Етап 2. Конструювання продуцента АДІ М. hominis на основі бактерій Е.соlі Отриманий фрагмент ДНК, що містить оптимізований ген АДІ М hominis (етап 1), гідролізують ендонуклеазами Ват HI і NcoI та клонують на векторі рЕТ32. Отриману плазміду, що містить оптимізований ген АДІ М. hominis, під контролем промотору Т7, вводять (трансформують) у клітини Е.соlі BL-21 методом описаним раніше [6]. Етап 3. Отримання біомаси продуцента із високим вмістом АДІ Для аутоіндукційної гетерологічної експресії АДІ використовується мінеральне середовище та методика, запропоновані Studier [8] з деякими модифікаціями, необхідними для ефективної експресії даного білка. Як індуктор експресії використовується α-лактоза. Із літератури [9] відомо, що умови досягнення максимального рівня експресії цільового гетерологічного білка (концентрація гліцерину, час та температура вирощування) підбираються у кожному конкретному випадку. Для продукції АДІ використовуються наступні умови. Для отри мання максимального рівня експресії АДІ, стартова культура бактерій вирощується до А600=1,0-1,5. Після центрифугування (1500 g х 10 хв) клітинний осад суспендують в 50 мл аутоіндукційного середовища, що містить 0,01 % α-лактозу і 0,75 % гліцерин до отримання суспензії клітин з оптичною густиною А600=0,3, яку поміщають для культивування в 300 мл колби. Клітини вирощують при оптимальній температурі, що становить 32 °С. Залежність виходу біомаси штаму-продуцента та продукції АДІ від часу культивування наведено у табл. 3. Оптимальний час вирощування становить 30-36 год. Зменшення концентрації гліцерину та інші відхилення від підібраних нами умов зменшують вихід цільового продукту (фіг. 3). Зниження рівня рН культурального середовища нижче 6,0 впродовж вирощування призводить до зменшення продукції АДІ. Тому під час вирощування проводиться контроль і дотитровування рН середовища до значень 7,0-7,4. Таблиця 3 Вплив часу вирощування штаму продуцента при температурі 32 °С на вихід біомаси і продукцію АДІ Час, год. OD600 Вихід АДІ 6 12 18 24 30 36 42 2,2 4,8 6,2 8,5 10,5 10,2 8,9 + ++ ++ ++ +++ +++ ++ Клітини осаджують (3000g x 10 хв), промивають 20 мМ К-фосфатним буфером рН=7,2, повторно осаджують і зберігають при -20 °С. Етап 4. Отримання препаратів ренатурованої АДІ Руйнування бактерійних клітин, отримання фракції мікротілець (препарат нерозчинної неактивної АДІ) і активної АДІ шляхом переведення мікротілець в розчин з наступною ренатурацією проводять, як описано [4,5] з деякими модифікаціями. Розчинення ферменту проводять в 50 мМ К фосфатному буфері, рН=7,2, що містить 1 мМ ЕДТА, 5М гуанідинхлорид та 5 мМ ДТТ. Мікротільця, отримані з 1 г бактерійних клітин, суспендують в 10 мл денатуруючого буферу. Для ренатурації використовують 20 мМ К-фосфатний буфер, рН=7,2, що містить 200 мМ КС1, 1 мМ ДТТ, 1 мМ ЕДТА. Ренатураційна суміш інкубується 96 год. при температурі 15 °С. Очистку рекомбінантної АДІ проводять за допомогою афінної та гідрофобної хроматографій як описано [7]. У результаті проведених експериментів отримують препарат 7 АДІ близький до гомогенності (фіг. 4). При 37 °С 1 мг отриманого препарату фермента розщеплює 25 мкмоль аргініну за 1 хв. Препарат ферменту зберігається без втрати активності при 4 °С у 20 мМ фосфатному буфері, рН 7,2, що містить 1 М NaCl, впродовж 20 місяців. Джерела інформації 1. Miyazaki К., Takaku H., Umeda M., Fujita Т., Huang W., Kimura Т., Yamashita J., Horio T. Potent growth inhibition of human tumor cells in culture by arginine deiminase purified from a culture medium of a Mycoplasma-infected cell line. Cancer Res. - 1990. - Vol. 50, N15. - P. 522-4527. 2. Misawa S., Aoshima M., Takaku H., Matsumoto M., Hayashi H. High-level expression of Mycoplasma arginine deiminase in Escherichia coll and its efficient renaturation as an anti-tumor enzyme. Biotechnol. - 1994. - Vol. 6, N2. - P. 145-155. 3. Dillon B.J., Holtsberg F.W., Ensor СМ., Bomalaski J.S., Clark M.A., Biochemical characterization of the arginine degrading enzymes arginase and argi 97610 8 nine deiminase and their effect on nitric oxide production. Med Sci Monit. - 2002. - Vol. 8, N7. - P. 248-253. 4. Патент США, Pub. No.: US 2005/0129706 AI, заявка від 15.01.2004, МПК A61K 39/02, C12N 9/10 // Modified arginine deiminase // Опубліковано 16.06.2005. 5. Sambrook J., Fritsh E.F., Maniatis T. Molecular Cloning: A laboratory Manual. Cold Spring Harbor Laboratory, Cold Spring Harbor, New York. 1989. 6. Kang S.W., Kang H., Park I.S., Choi S.H., Shin K.H., Chun Y.S., Chun B.G., Min B.H. Cytoprotective effect of arginine deiminase on taxol-induced apoptosis in DU145 human prostate cancer cells. Мої. Cells. - 2000. - Vol. 10, N 3. - P. 331-337. 7. Studier F.W. Protein production by autoinduction in high density shaking cultures. Protein Expr. Purif. - 2005. - Vol. 41, N1. - P. 207-234. 8. Sivashanmugam A., Murray V., Cui C, Zhang Y., Wang J., Li Q. Practical protocols for production of very high yields of recombinant proteins using Escherichia coli. Protein Sci. - 2009. - Vol.18, N5. - P. 936948. 9 97610 10 11 97610 12 Комп’ютерна верстка Д. Шеверун Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for the production of arginine deiminase of mycoplasma hominis from recombinant strains of bacteria escherichia coli
Автори англійськоюSybirnyi Andrii Andriiovych, Faiura Liubov Romanivna, Boretskyi Volodymyr Yuriiovych, Boretskyi Yurii Romanovych
Назва патенту російськоюСпособ получения аргининдезиминазы mycoplasma hominis из рекомбинантных штаммов бактерий escherichia coli
Автори російськоюСибирный Андрей Андреевич, Фаюра Любовь Романовна, Борецкий Владимир Юрьевич, Борецкий Юрий Романович
МПК / Мітки
Мітки: аргініндезимінази, штамів, рекомбінантних, спосіб, mycoplasma, бактерій, escherichia, одержання, hominis
Код посилання
<a href="https://ua.patents.su/6-97610-sposib-oderzhannya-arginindeziminazi-mycoplasma-hominis-iz-rekombinantnikh-shtamiv-bakterijj-escherichia-coli.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання аргініндезімінази mycoplasma hominis із рекомбінантних штамів бактерій escherichia coli</a>
Попередній патент: Спосіб випалу керамічних виробів і тунельна піч для його здійснення
Наступний патент: Спосіб очищення відпрацьованих газів двигуна внутрішнього згоряння від частинок сажі
Випадковий патент: Апаратура, яка маскує помилки в системі цифрової відеообробки