Антитіло проти csf-1r
Формула / Реферат
1. Антитіло або його фрагмент, що специфічно зв'язує варіант людського CSF-1R (SEQ ID NO: 15) та містить CDRH1, яка містить послідовність SYGMH (SEQ ID NO: 1), CDRH2, яка містить послідовність VIWYDGSNKYYADSVKG (SEQ ID NO: 2), CDRH3, яка містить послідовність GDYEVDYGMDV (SEQ ID NO: 3), CDRL1, яка містить послідовність RASQGISNALA (SEQ ID NO: 4), CDRL2, яка містить послідовність DASSLES (SEQ ID NO: 5), та CDRL3, яка містить послідовність QQFNSYPWT (SEQ ID NO: 6).
2. Антитіло або його фрагмент за п. 1, що містить VL, яка містить амінокислотну послідовність:
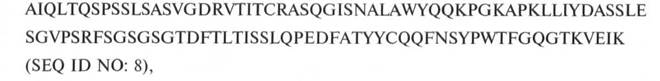
та VH, яка містить амінокислотну послідовність:

3. Антитіло або його фрагмент за будь-яким із пп. 1 або 2, що містить важкий ланцюг, який містить амінокислотну послідовність SEQ ID NO: 9, і легкий ланцюг, який містить амінокислотну послідовність SEQ ID NO: 10.
4. Антитіло або його фрагмент за будь-яким із пп. 1-3, що містить два важкі ланцюги, кожний з яких містить амінокислотну послідовність SEQ ID NO: 9, і два легкі ланцюги, кожний з яких містить амінокислотну послідовність SEQ ID NO: 10.
5. Фармацевтична композиція, яка містить антитіло або фрагмент за будь-яким із пп. 1-4 разом із фармацевтично прийнятним носієм, розріджувачем або наповнювачем.
6. Фармацевтична композиція за п. 5, яка відрізняється тим, що містить додатковий фармацевтичний засіб.
7. Застосування антитіла або його фрагмента за будь-яким із пп. 1-4 для виготовлення лікарського засобу для лікування раку.
8. Антитіло або його функціональний фрагмент за будь-яким із пп. 1-4 для застосування як лікарського засобу.
9. Антитіло або його функціональний фрагмент за будь-яким із пп. 1-4 для застосування при лікуванні раку.
10. Антитіло або його функціональний фрагмент за п. 9, причому раком є лейкоз, рак молочної залози, рак ендометрія, рак передміхурової залози, рак яєчника, рак кишечнику, гепатоцелюлярний рак, рак нирок, множинна мієлома або ходжкінська лімфома.
11. Антитіло або його функціональний фрагмент за п. 10, причому раком є лейкоз, рак молочної залози, рак ендометрія або рак передміхурової залози.
12. Антитіло або його функціональний фрагмент за п. 11, причому раком є лейкоз, рак молочної залози або рак передміхурової залози.
13. Антитіло або його функціональний фрагмент за пп. 9-12, причому згадане антитіло або його фрагмент вводять перед, під час, по суті одночасно з або після початку лікування іншим протираковим лікарським засобом.
14. Антитіло або його функціональний фрагмент за п. 13, причому згаданий протираковий лікарський засіб вибраний з групи, яку складають антиангіогенний засіб, хіміотерапевтичний засіб та антинеопластичний засіб.
15. Антитіло або його функціональний фрагмент за п. 14, причому згаданий антинеопластичний засіб вибраний з групи, яку складають доцетаксел, паклітаксел, Herceptin® і доксорубіцин.
16. Спосіб визначення того, чи є суб'єкт, що має рак, кандидатом для програми лікування раку на основі антитіла проти CSF-1R, причому згадане антитіло є антитілом за будь-яким із пп. 1-4, який включає:
ex vivo або in vitro вимірювання рівня CSF-1 або IL-34, або і того, і іншого, у зразку згаданого суб'єкта, де згаданий зразок вибирають з групи, яку складають кров, сироватка, плазма, пухлинні клітини і циркулюючі пухлинні клітини,
причому підвищення рівня CSF-1 або IL-34, або і того, і іншого, у зіставленні з рівнем CSF-1 або IL-34, або і того, і іншого, у індивідуума, що не страждає на рак, вказує на те, що згаданий суб'єкт є кандидатом для програми лікування раку на основі антитіла проти CSF-1R.
Текст
Реферат: Винахід стосується антитіла, яке зв'язує варіант людського CSF-1R (SEQ ID NO: 15) з високою спорідненістю. UA 111818 C2 (12) UA 111818 C2 UA 111818 C2 5 10 15 20 25 30 35 40 45 50 55 60 Ця заявка претендує на пріоритет за датою подання попередньої заявки на патент США а 61/319,896, яка була подана 1 квітня 2010 року. Цей винахід належить до галузі імунології та лікування раку. Більш конкретно, цей винахід стосується людських антитіл, що зв'язуються з рецептором людського колонієстимулювального фактора-1 (CSF-1R). Рецептор колонієстимулювального фактора-1 (CSF-1R), відомий також як M-CSFR або CD115, (варіант людського CSF-1R; SEQ ID NO: 15) (людський CSF-1R; SEQ ID NO: 16; номер депонування Uniprot P07333), який кодується геном c-fms, являє собою тирозинкіназний рецептор, що селективно експресується на лініях диференціювання макрофагів та гранулоцитів у нормальних індивідуумів та на пухлинних клітинах у випадку раку. Еснує два відомі ліганди, колонієстимулювальний фактор-1 (CSF-1) (людський CSF-1; SEQ ID NO: 17) (номер депонування Uniprot P09603), відомий також як M-CSF, та IL-34 (людський IL-34; SEQ ID NO: 18) (номер депонування Uniprot Q6ZMJ4), які зв'язуються з позаклітинним доменом CSF-1R. Після зв'язування CSF-1 або IL-34, CSF-1R димеризується, що призводить до трансфосфорилування згаданого рецептора, а також до фосфорилування та активування низхідних сигнальних молекул, таких як MAPK та Akt. Результатом фосфорилування CSF-1R є: (1) проліферація та диференціація макрофагів із гемопоетичних стовбурових клітин-попередників та (2) виживаність та міграція макрофагів до різних органів і тканин тіла, зокрема, до строми пухлини. CSF-1R може також бути експресований на поверхні пухлинних клітин. Антитіла проти мишачого CSF-1R не демонструють перехресної реактивності у організмі людей, і тому були б неефективними терапевтичними засобами для лікування раку людей. Людські антитіла проти CSF-1R розкриті у WO 2009/026303 (Brasel, et al.). Такі антитіла не індукують антитілозалежної клітинно-опосередкованої цитотоксичності (ADCC) проти клітин, зв'язаних згаданими антитілами. ADCC відбувається у тому разі, коли згадане антитіло зв'язується з клітиною, яка експресує антиген (клітина-мішень), що робить Fc-ділянку антитіла доступною для зв'язування з Fc-рецептором на природних клітинах-кілерах, моноцитах, нейтрофілах та дендритних клітинах (ефекторна клітина). Антитіла, розкриті у публікації на ім'я Brasel, є нездатними до зведення клітини-мішені та ефекторної клітини одна з одною для ініціювання знищення клітини-мішені. Антитіла проти згаданого ліганду не є перехресно реактивними. Таким чином, антитіла проти CSF-1 не пригнічують зв'язування IL-34 з CSF-1R, й антитіла проти IL-34 не пригнічують зв'язування CSF-1 з CSF-1R. Зв'язування ліганду з рецептором може впливати на ріст ракової пухлини. Крім того, антитіла проти згаданого ліганду не інтерналізуються, вони не індукують деградації CSF-1R і не стимулюють ADCC проти клітин. Існує потреба у мультифункціональних антитілах, які блокують зв'язування лігандів із CSF1R, а також індукують ADCC проти клітин, зв'язаних згаданими антитілами. Антитіла за цим винаходом мають перевагу над відомими антитілами, оскільки вони мають велику кількість функцій. Антитіла за цим винаходом блокують зв'язування CSF-1 та IL-34 з рецептором, із запобіганням завдяки цьому димеризації згаданого рецептора, результатом чого є фосфорилування внутрішньоклітинних залишків тирозину, функції яких є критичними для запобігання індукованому макрофагами росту пухлини. Антитіла за цим винаходом інтерналізуються і індукують деградацію CSF-1R. Важливо, що, на додаток до блокування зв'язування лігандів, антитіла за цим винаходом посилюють ADCC шляхом стимулювання знищення пухлинних клітин та пухлиноасоційованих макрофагів та моноцитів. Антитіла за цим винаходом також одночасно негативно впливають на активність макрофагів, тобто на активність, яка відіграє головну роль у розвитку пухлин. Завдяки великій кількості терапевтичних функцій, які вони мають, антитіла за цим винаходом мають значну перевагу над антитілами, відомими у цій галузі. Суть винаходу Одним з аспектів цього винаходу є антитіло або його фрагмент, що специфічно зв'язує варіант людського CSF-1R (SEQ ID NO: 15) та містить CDRH1, яка містить послідовність SYGMH (SEQ ID NO: 1), CDRH2, яка містить послідовність VIWYDGSNKYYADSVKG (SEQ ID NO: 2), CDRH3, яка містить послідовність GDYEVDYGMDV (SEQ ID NO: 3), CDRL1, яка містить послідовність RASQGISNALA (SEQ ID NO: 4), CDRL2, яка містить послідовність DASSLES (SEQ ID NO: 5), та CDRL3, яка містить послідовність QQFNSYPWT (SEQ ID NO: 6). Еншим аспектом цього винаходу є антитіло або його фрагмент, що специфічно зв'язує людський CSF-1R (SEQ ID NO: 16) та містить CDRH1, яка містить послідовність SYGMH (SEQ ID NO: 1), CDRH2, яка містить послідовність VIWYDGSNKYYADSVKG (SEQ ID NO: 2), CDRH3, яка містить послідовність GDYEVDYGMDV (SEQ ID NO: 3), CDRL1, яка містить послідовність RASQGISNALA (SEQ ID NO: 4), CDRL2, яка містить послідовність DASSLES (SEQ ID NO: 5), та 1 UA 111818 C2 5 10 15 20 25 30 35 40 45 50 55 60 CDRL3, яка містить послідовність QQFNSYPWT (SEQ ID NO: 6). Одним з аспектів цього винаходу є антитіло або його фрагмент, що специфічно зв'язує людський CSF-1R (SEQ ID NO: 15) та містить CDRH1, яка містить послідовність SYGMH (SEQ ID NO: 1), CDRH2, яка містить послідовність VIWYDGSNKYYADSVKG (SEQ ID NO: 2), CDRH3, яка містить послідовність GDYEVDYGMDV (SEQ ID NO: 3), CDRL1, яка містить послідовність RASQGISNALA (SEQ ID NO: 4), CDRL2, яка містить послідовність DASSLES (SEQ ID NO: 5), та CDRL3, яка містить послідовність QQFNSYPWT (SEQ ID NO: 6). Антитіла за цим винаходом можуть також містити амінокислотну заміну в одній зі згаданих послідовностей CDR. За іншим аспектом вищезгадані CDR не мають амінокислотної заміни у одній зі згаданих послідовностей CDR. Іншим аспектом цього винаходу є антитіло або його фрагмент, що зв'язує CSF-1R і містить VH, яка містить амінокислотну послідовність: QDQLVESGGGVVQPGRSLRLSCAASGFTFSSYGMHWVRQAPGEGLEWVAVIWYDGSNKYYAD SVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCARGDYEVDYGMDVWGQGTTVTVAS (SEQ ID NO: 7), або VL, яка містить амінокислотну послідовність: AIQLTQSPSSLSASVGDRVTITCRASQGISNALAWYQQKPGKAPKLLIYDASSLESGVPSRFSGSG SGTDFTLTISSLQPEDFATYYCQQFNSYPWTFGQGTKVEIK (SEQ ID NO: 8). Іншим аспектом цього винаходу є антитіло або його фрагмент, що зв'язує CSF-1R і містить легкий ланцюг, який містить амінокислотну послідовність SEQ ID NO: 10, і важкий ланцюг, який містить амінокислотну послідовність SEQ ID NO: 9. За ще одним аспектом цього винаходу антитіло містить два легкі ланцюги, кожний з яких містить амінокислотну послідовність SEQ ID NO: 10, і два важкі ланцюги, кожний з яких містить амінокислотну послідовність SEQ ID NO: 9. CSF-1R-зв'язувальні фрагменти таких антитіл є частиною цього винаходу. Цим винаходом також запропоновані ізольована ДНК і полінуклеотиди/полінуклеїнові кислоти, які кодують описані вище антитіла або їхні фрагменти, експресійні вектори, які містять згадані полінуклеотиди, і клітини-хазяї, які містять згадані полінуклеотиди. Цим винаходом також запропоновані способи очищення антитіл або їхніх фрагментів. Цим винаходом також запропоновані фармацевтичні композиції, які містять згадані антитіла або їхні фрагменти, полінуклеотиди, вектори або клітини-хазяї за цим винаходом окремо або із фармацевтично прийнятним носієм, розріджувачем або наповнювачем. Цим винаходом запропоновані фармацевтичні композиції, які містять згадані антитіла або їхні фрагменти за цим винаходом разом із фармацевтично прийнятним носієм, розріджувачем або наповнювачем. Крім того, цей винахід стосується способів пригнічення росту ракової клітини та способів лікування лейкозу, раку молочної залози і раку передміхурової залози у ссавців шляхом введення ефективної кількості антитіла. Інший аспект цього винаходу стосується способів пригнічення росту ракової клітини і способів лікування лейкозу, раку ендометрія, раку молочної залози і раку передміхурової залози у ссавців шляхом введення ефективної кількості антитіла. Ще один аспект цього винаходу стосується способів пригнічення росту ракової клітини і способів лікування лейкозу, раку ендометрія, раку молочної залози і раку передміхурової залози, а також раку яєчника, раку кишечнику, гепатоцелюлярного раку, раку нирок, множинної мієломи і ходжкінської лімфоми. Антитіла за цим винаходом можуть бути застосовані для лікування неопластичних захворювань, у тому числі солідних пухлин, та для лікування раку молочної залози і раку передміхурової залози. За ще одним аспектом антитіла за цим винаходом можуть бути застосовані для лікування неопластичних захворювань, у тому числі солідних пухлин, та для лікування раку молочної залози, раку ендометрія і раку передміхурової залози. За ще одним аспектом антитіла за цим винаходом можуть бути застосовані для лікування неопластичних захворювань, у тому числі солідних пухлин, та для лікування раку молочної залози, раку ендометрія, раку передміхурової залози, раку яєчника, раку кишечнику, гепатоцелюлярного раку і раку нирок. Одним з аспектів цього винаходу є антитіло або його фрагменти для застосування у терапії, або для застосування при лікуванні, або для застосування як лікарський засіб. За ще одним аспектом вищеописані антитіла або їхні фрагменти призначені для застосування при лікуванні раку. Цей винахід може бути застосований при лікуванні раків, до яких належать, але без обмеження ними, лейкоз, рак молочної залози і рак передміхурової залози. За одним з аспектів цей винахід може бути застосований при лікування раків, до яких належать, але без обмеження ними, лейкоз, рак молочної залози, рак ендометрія і рак передміхурової залози. За іншим аспектом цей винахід може бути застосований при лікування раків, до яких належать, але без обмеження ними, лейкоз, рак молочної залози, рак ендометрія, рак передміхурової залози, рак яєчника, рак кишечнику, гепатоцелюлярний рак, рак нирок, множинна мієлома і ходжкінська лімфома. 2 UA 111818 C2 5 10 15 20 25 30 35 40 45 50 55 60 Цей винахід також охоплює антитіло або його фрагмент за цим винаходом для застосування при лікуванні раку, у тому числі з наданням або введенням ефективної кількості іншого протиракового лікарського засобу, де згаданим протираковим лікарським засобом може бути, але без обмеження ними, антиангіогенний засіб, хіміотерапевтичний засіб або антинеопластичний засіб. Крім того, до антинеопластичних засобів належать, але без ® обмеження ними, доцетаксел (docetaxel), паклітаксел (paclitaxel), Herceptin і доксорубіцин (doxorubicin). Згаданий протираковий лікарський засіб вводять пацієнту на додаток до антитіла або фрагмента, розкритих у цьому описі. Згадане антитіло або його фрагмент вводять перед, під час, по суті одночасно з або після початку лікування іншим протираковим лікарським засобом або іншим антинеопластичним засобом. Цим винаходом також запропоноване для застосування антитіло за цим винаходом для виготовлення лікарського засобу для лікування раку. За одним з аспектів згаданим раком є лейкоз, рак молочної залози або рак передміхурової залози. За одним з аспектів згаданим раком є лейкоз, рак молочної залози, рак ендометрія або рак передміхурової залози. За іншим аспектом цього винаходу згаданим раком є лейкоз, рак молочної залози, рак ендометрія, рак передміхурової залози, рак яєчника, рак кишечнику, гепатоцелюлярний рак, рак нирок, множинна мієлома або ходжкінська лімфома. Застосування згаданого антитіла включає надання або введення ефективної кількості іншого протиракового лікарського засобу, де згаданим протираковим лікарським засобом може бути, але без обмеження ними, антиангіогенний засіб, хіміотерапевтичний засіб або антинеопластичний засіб. Крім того, до антинеопластичних засобів належать, але без обмеження ними, доцетаксел, паклітаксел, ® Herceptin і доксорубіцин. Згаданий протираковий лікарський засіб вводять в організм пацієнта на додаток до антитіла або фрагмента, розкритих у цьому описі. Згадане антитіло або його фрагмент вводять перед, під час, по суті одночасно з або після започаткування лікування іншим протираковим лікарським засобом або іншим антинеопластичним засобом. Цим винаходом також запропонований спосіб лікування раку у ссавця, який включає введення в організм згаданого ссавця, який цього потребує, ефективної кількості антитіла або його фрагмента за цим винаходом. Згаданий рак вибирають із групи, яку складають лейкоз, рак молочної залози, рак ендометрія і рак передміхурової залози. За іншим аспектом згаданий рак вибирають із групи, яку складають лейкоз, рак молочної залози, рак ендометрія, рак передміхурової залози, рак яєчника, рак кишечнику, гепатоцелюлярний рак, рак підшлункової залози, множинна мієлома і ходжкінська лімфома. Крім того, згаданий спосіб може також включати введення в організм згаданого ссавця іншого протиракового лікарського засобу. Згаданий протираковий лікарський засіб вибирають із групи, яку складають антиангіогенний засіб, хіміотерапевтичний засіб та антинеопластичний засіб. Згаданий антинеопластичний засіб ® можна вибирати з групи, яку складають доцетаксел, паклітаксел, Herceptin і доксорубіцин. Цим винаходом також запропоновані способи застосування згаданих антитіл або композицій для лікування ссавця, який цього потребує, наприклад, для пригнічення ангіогенезу або кісткових метастазів, або для пригнічення пухлини або гіперпроліферативного росту, або для лікування запальних захворювань. Цим винаходом також запропоновані антитіла або композиції для застосування для лікування ссавця, який цього потребує, наприклад, для пригнічення ангіогенезу або кісткових метастазів, або для пригнічення пухлини або гіперпроліферативного росту, або для пригнічення запальних захворювань. Цей винахід також стосується продукту або фармацевтичної композиції, яка містить розкрите у цьому винаході антитіло або його фрагмент. Крім того, згадані продукт або фармацевтична композиція можуть також містити додатковий фармацевтичний засіб, антинеопластичний засіб або протираковий засіб чи лікарський препарат, у тому числі, але без ® обмеження ними, доцетаксел, паклітаксел, Herceptin або доксорубіцин, який вводять у комбінації з розкритим у цьому винаході антитілом одночасно, окремо або послідовно у процесі лікування. Цим винаходом запропоноване застосування рівня CSF-1 у зразках крові, сироватки, плазми, пухлинних клітин або циркулюючих пухлинних клітин як індикатор успішного лікування антитілами проти CSF-1R за цим винаходом або їхніми фрагментами у пацієнтів, якщо рак має CSF-1R, експресований на поверхні пухлиноасоційованих макрофагів. Цим винаходом також запропонований спосіб лікування раку у пацієнта, який включає стадії: (1) вимірювання рівня CSF-1 у зразку, одержаному від пацієнта, де згаданий зразок вибирають із групи, яку складають кров, сироватка, плазма, пухлинні клітини і циркулюючі пухлинні клітини, і (2) введення в організм згаданого пацієнта антитіла за цим винаходом або його фрагмента, якщо рівень CSF-1 є вищим за рівні CSF-1, визначені у контрольній групі. Цим винаходом запропоноване застосування рівня IL-34 у зразках крові, сироватки, плазми, 3 UA 111818 C2 5 10 15 20 25 30 35 40 45 50 55 60 пухлинних клітин або циркулюючих пухлинних клітин як індикатор успішного лікування антитілами проти CSF-1R за цим винаходом або їхніми фрагментами у пацієнтів. Цим винаходом також запропонований спосіб лікування раку у пацієнта, який включає стадії: (1) вимірювання рівня IL-34 у зразку, одержаному від пацієнта, де згаданий зразок вибирають із групи, яку складають кров, сироватка, плазма, пухлинні клітини і циркулюючі пухлинні клітини, і (2) введення в організм згаданого пацієнта антитіла за цим винаходом або його фрагмента, якщо рівень IL-34 є вищим за рівні IL-34, визначені у контрольній групі. Одним з аспектів цього винаходу є спосіб визначення того, чи є суб'єкт, що має рак, кандидатом для програми лікування раку на основі антитіла проти CSF-1R, де згадане антитіло є антитілом за цим винаходом, який включає: (1) ex vivo або in vitro вимірювання рівня CSF-1 у зразку згаданого суб'єкта, де згаданий зразок вибирають із групи, яку складають кров, сироватка, плазма, пухлинні клітини і циркулюючі пухлинні клітини; та (2) де підвищення рівня CSF-1, у зіставленні з рівнем CSF-1 у індивідуума, що не страждає на рак, вказує на те, що згаданий суб'єкт є кандидатом для програми лікування раку на основі антитіла проти CSF-1R. Іншим аспектом цього винаходу є спосіб визначення того, чи є суб'єкт, що має рак, кандидатом для програми лікування раку на основі антитіла проти CSF-1R, де згадане антитіло є антитілом за цим винаходом, який включає: (1) ex vivo або in vitro вимірювання рівня IL-34 у зразку згаданого суб'єкта, де згаданий зразок вибирають з групи, яку складають кров, сироватка, плазма, пухлинні клітини і циркулюючі пухлинні клітини; та (2) де підвищення рівня IL-34, у зіставленні з рівнем IL-34 у індивідуума, що не страждає на рак, вказує на те, що згаданий суб'єкт є кандидатом для програми лікування раку на основі антитіла проти CSF-1R. Цим винаходом також запропоновані антитіла, які специфічно зв'язуються з CSF-1R. Згадані антитіла мають щонайменше одну властивість, вибрану з групи, яку складають (a) пригнічення зв'язування CSF-1 або IL-34 з CSF-1R; (b) пригнічення активації CSF-1R; (c) зменшення ступеня фосфорилування CSF-1R; (d) зниження ступеня активації MAPK; (e) зниження ступеня активації Akt; (f) зменшення кількості CSF-1R; та (g) індукування ADCC. Варіант здійснення цього винаходу, якому віддається перевага, має властивості від (a) до (g). Одним з аспектів цього винаходу є антитіло або його фрагмент, що специфічно зв'язує варіант людського CSF-1R (SEQ ID NO: 15) або людський CSF-1R (SEQ ID NO: 16) і пригнічує передавання сигналів CSF-1R, інтерналізується і індукує деградацію CSF-1R та стимулює антитілозалежну клітинно-опосередковану цитотоксичність (ADCC) проти множини різних клітин, у тому числі пухлинних клітин, макрофагів та моноцитів. Послідовності SEQ ID NO: 15 і SEQ ID NO: 16 різняться між собою однією амінокислотою у положенні 54, яка виходить за межі ділянки зв'язування. У значенні, вжитому у цьому описі, термін "антитіло" охоплює імуноглобулінові молекули, які містять 4 поліпептидні ланцюги, два важкі (H) ланцюги і два легкі (L) ланцюги, зв'язаних між собою дисульфідними зв'язками. Індивідуальні ланцюги можуть укладатись у домени, які мають однакові розміри (110-125 амінокислот) та однакові структури, але різні функції. Легкий ланцюг може містити одну варіабельну ділянку (скорочено позначену у цьому описі як VL) та/або одну константну ділянку (скорочено позначену у цьому описі як CL). Легкі ланцюги людських антитіл (імуноглобулінів) є легкими ланцюгами типу каппа (Κ) або легкими ланцюгами типу лямбда (λ). У значенні, вжитому у цьому описі, скорочення VL означає як варіабельні ділянки легких ланцюгів типу каппа (VΚ), так і легких ланцюгів типу лямбда (Vλ). Важкий ланцюг може також містити одну варіабельну ділянку (скорочено позначену у цьому описі як VH) та/або, у залежності від класу або ізотипу антитіла, три або чотири константні ділянки (CH1, CH2, CH3 та CH4) (які сукупно скорочено позначені у цьому описі як CH). У людей згаданими ізотипами є IgA, IgD, IgE, IgG та IgM, де IgA та IgG додатково підрозділяються на підкласи або підтипи (IgA12 та IgG1-4). Цей винахід охоплює антитіла будь-якого із вищезгаданих класів або підкласів. Людський IgG1 являє собою ізотип для антитіл за цим винаходом, якому віддається перевага. Кожна з VL та VH містить три ділянки, які називають гіперваріабельними ділянками або ділянками, що обумовлюють комплементарність (CDR), які підтримуються менш варіабельними ділянками, які називають каркасними ділянками (скорочено позначені у цьому описі як FR). Амінокислоти конкретної гіперваріабельної ділянки або домену позначають за схемою нумерації, яка розроблена Кабатом (Kabat, et al., Ann. NY Acad. Sci. 190:382-393 (1971); Kabat, et al., Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242 (1991). Кожна VH та VL складається з трьох гіперваріабельних ділянок (CDR) та чотирьох каркасних ділянок (FR), які, у напрямку від амінокінця до карбоксильного кінця, розміщені у такому порядку: FR1-CDR1-FR2-CDR2-FR3-CDR3FR4. Частина антитіла, яка складається з VL та VH, позначена як Fv (варіабельний фрагмент) і являє собою антигензв'язувальний центр антитіла. Одноланцюговий Fv (scFv) являє собою 4 UA 111818 C2 5 10 15 20 25 30 35 40 45 50 55 60 фрагмент антитіла, який містить VL та VH на одному поліпептидному ланцюзі, де N-кінець одного домену та C-кінець другого домену з'єднані гнучким лінкером. "Виділеним антитілом" є антитіло, яке (1) було частково, значною мірою або повністю виділене із суміші компонентів та очищене; (2) було ідентифіковане та відділене та/або виділене з компонента його природного середовища; (3) є моноклональним; (4) є вільним від інших білків від того самого виду; (5) експресується клітиною від іншого виду; або (6) не зустрічається у природі. У значенні, вжитому у цьому описі, термін "компоненти" виключає антитіло за цим винаходом. Забруднювальними компонентами його природного середовища є матеріали, які можуть перешкоджати діагностичному або терапевтичному застосуванню згаданого антитіла і можуть містити ферменти, гормони та інші білкові або небілкові розчинені речовини. Прикладами виділеного антитіла є антитіло, очищене афінним шляхом, антитіло, продуковане гібридомою або іншою лінією клітин in vitro, та людське антитіло від трансгенної миші. Термін "моноклональне антитіло", у значенні, вжитому у цьому описі, означає антитіло, яке одержали з популяції по суті гомогенних антитіл, наприклад, індивідуальні антитіла, що складають популяцію, є по суті ідентичними за виключенням можливих природних мутацій або незначних посттрансляційних варіацій, які можуть бути присутніми. Моноклональні антитіла є високоспецифічними і спрямовані проти поодиноких ділянок детермінанти у молекулі антигену (відомої також, як антигенна детермінанта або епітоп). На додаток до цього, на відміну від препаратів традиційних (поліклональних) антитіл, які, як правило, містять різні антитіла, спрямовані проти різних антигенних детермінант, кожне моноклональне антитіло спрямоване проти однієї антигенної детермінанти на антигені. Визначник "моноклональне" вказує на характер антитіла як на одержане з по суті однорідної популяції антитіл, і не має вважатись таким, що потребує продукування згаданого антитіла будь-яким конкретним способом. Термін "людське антитіло", у значенні, вжитому у цьому описі, охоплює антитіла, які мають варіабельні та константні ділянки, що відповідають людським зародковим імуноглобуліновим послідовностям (як описано у Kabat et al., supra). Людське антитіло за цим винаходом може містити амінокислотні залишки, що не кодуються людськими зародковими імуноглобуліновими послідовностями (наприклад, мутації, введені неспецифічним або сайт-специфічним мутагенезом in vitro або соматичною мутацією in vivo), наприклад, у гіперваріабельних ділянках (CDR). Людське антитіло може мати щонайменше одне положення, замінене амінокислотним залишком, наприклад, амінокислотним залишком, що стимулює активність, який не кодується людською зародковою імуноглобуліновою послідовністю. Однак термін "людське антитіло", у значенні, вжитому у цьому описі, не охоплює антитіла, у яких послідовності CDR, які були одержані із зародкової лінії ссавців іншого виду, таких як миші, були пересаджені на людські каркасні послідовності. Способи продукування "людського антитіла", у значенні, вжитому у цьому описі, не охоплюють антитіла, продуковані людською істотою. Вислів "рекомбінантне людське антитіло" охоплює людські антитіла, які одержують, експресують, створюють або ізолюють рекомбінантними способами, такі як антитіла, експресовані із застосуванням рекомбінантного вектора експресії, трансфікованого у клітинухазяїна, антитіла, виділені з бібліотеки рекомбінантних комбінаторних людських антитіл, антитіла, виділені з тварини, яка є трансгенною за людськими імуноглобуліновими генами, або антитіла, одержані, експресовані, створені або виділені будь-якими іншими способами, які передбачають сплайсування послідовностей людських імуноглобулінових генів до інших послідовностей ДНК. Такі рекомбінантні людські антитіла мають варіабельні та константні ділянки, одержані з людських зародкових імуноглобулінових послідовностей. Fc (фрагмент, що кристалізується) є позначенням частини або фрагмента антитіла, що містить спаровані константні домени важкого ланцюга. У антитіла IgG, наприклад, Fc містить CH2 та CH3. Fc антитіла IgA або IgM також містить CH4. Fc пов'язаний зі зв'язуванням Fcрецептора, активацією антитілозалежної клітинно-опосередкованої цитотоксичності (ADCC) та/або клітинно-опосередкованої цитотоксичності (CMC). Для таких антитіл, наприклад, як IgA та IgM, які являють собою комплекси численних IgG-подібних білків, утворення комплексу потребує константних ділянок Fc. Таким чином, до антитіл за цим винаходом належать (але без обмеження ними) ізольовані антитіла, людські антитіла, гуманізовані антитіла, рекомбінантні людські антитіла, моноклональні антитіла, фрагменти розщеплення, їхні визначені частини та варіанти, у тому числі антитіла-міметики або такі, що містять частини антитіл, які імітують структуру та/або функцію антитіла або його визначеного фрагмента чи частини, кожне з яких містить щонайменше одну CDR. До функціональних фрагментів належать антигензв'язувальні фрагменти, що зв'язуються з антигеном CSF-1R. Наприклад, до фрагментів антитіл, які здатні 5 UA 111818 C2 5 10 15 20 25 30 35 40 45 50 55 60 до зв'язування з CSF-1R або його частиною і які охоплюються обсягом цього винаходу, належать бівалентні фрагменти, такі як (Fab')2, з інтактними міжланцюговими дисульфідними зв'язками, моновалентні фрагменти, такі як Fab (антигензв'язувальний фрагмент), до яких належать фрагменти антитіла, які складаються з VL-CL та VL-CH1 ділянок і не зберігають шарнірної ділянки важкого ланцюга (одержані, наприклад, шляхом папаїнового розщеплення), Fabs, які зберігають шарнірну ділянку важкого ланцюга, Facb (одержані, наприклад, шляхом плазмінового розщеплення), F(ab')2, Fab', яким бракує дисульфідних зв'язків, pFc' (одержані, наприклад, шляхом пепсинового або плазмінового розщеплення), Fd (одержані, наприклад, шляхом пепсинового розщеплення, часткового відновлення та повторного агрегування) та Fv або scFv (одержані, наприклад, методами молекулярної біології). До фрагментів антитіл належать також, наприклад, антитіла з видаленими доменами, лінійні антитіла, одноланцюгові антитіла, scFv, однодоменні антитіла, полівалентні одноланцюгові антитіла, мультиспецифічні антитіла, утворені із фрагментів антитіла, у тому числі діатіла, триатіла тощо, які специфічно зв'язуються з антигенами. Шарнірна ділянка відокремлює Fab- та Fc-фрагменти антитіла із забезпеченням взаємної рухливості Fabs та рухливості відносно Fc, а також містить численні дисульфідні зв'язки для ковалентного зв'язування двох важких ланцюгів. Були розроблені формати антитіл, що зберігають зв'язувальну специфічність, але мають інші характеристики, які можуть бути необхідними, у тому числі, наприклад, біспецифічність, полівалентність (більше двох зв'язувальних центрів) та компактний розмір (наприклад, лише зв'язувальні домени). Антитіла за цим винаходом є специфічними до CSF-1R. Специфічність антитіла означає вибіркове розпізнання антитілом конкретної антигенної детермінанти антигену. Антитіла за цим винаходом можуть, наприклад, бути моноспецифічними або біспецифічними. Біспецифічними антитілами (BsAb) є антитіла, які мають дві різні антигензв'язувальні специфічності або два різні антигензв'язувальні центри. У разі, якщо антитіло має більше однієї специфічності, розпізнані антигенні детермінанти можуть бути пов'язані з одним антигеном або з більше ніж одним антигеном. Таким чином, цим винаходом запропоновані біспецифічні антитіла, які зв'язуються з двома різними антигенами, із щонайменше однією специфічністю до CSF-1R. Як зазначено вище, до таких антитіл належать будь-які їхні фрагменти. Специфічність згаданих антитіл або їхніх фрагментів до CSF-1R може бути визначена, виходячи із афінності та/або авідності. Афінність, представлена константою дисоціації антигену з антитілом у стані рівноваги (KD), визначає силу зв'язування між антигенною детермінантою та антигензв'язувальним центром антитіла. Антитіла або їхні фрагменти за цим винаходом зв'язуються з антигенною детермінантою CSF-1R, розміщеною на сегментах позаклітинного домену (які нижче позначені просто як "домени" або "ECD"). Термін "антигенна детермінанта" у значенні, вжитому у цьому описі, означає дискретні тривимірні сайти на антигені, які розпізнаються антитілами за цим винаходом. Антигенними детермінантами є імунологічно активні ділянки на комплексному антигені, ділянки, які фактично зв'язані з рецептором B-клітини і які фактично зв'язані молекулами антитіл, що продукуються B-клітиною. Антигени, як правило, містять щонайменше одну антигенну детермінанту, а, зазвичай, більше ніж одну антигенну детермінанту. Антигенні детермінанти на білкових антигенах можуть бути лінійними або нелінійними. Лінійними антигенними детермінантами є детермінанти, які включають в себе прилеглі амінокислотні залишки у амінокислотній послідовності білка. Лінійні антигенні детермінанти можуть потребувати або можуть не потребувати конформаційного укладання для утворення нативної тривимірної структури та викликання імунної реакції, яка продукує антитіла зі зв'язувальною специфічністю до антигену. Нелінійні антигенні детермінанти включають в себе несуміжні амінокислотні залишки. Отже, нелінійні антигенні детермінанти завжди потребують певного ступеня укладання білка для розміщення необхідних амінокислотних залишків у безпосередній близькості один до іншого для утворення нативної тривимірної структури та викликання імунної реакції, яка продукує антитіла зі зв'язувальною специфічністю до антигену. До числа антитіл за цим винаходом або їхніх фрагментів належать також антитіла, зв'язувальні характеристики яких були поліпшені шляхом безпосередньої мутації, методами "визрівання афінності", технікою фагового дисплею або перестановкою ланцюгів. Афінність та специфічність можуть бути модифіковані або поліпшені шляхом мутування залишків CDR та/або FR і проведення перевірки з пошуком антигензв'язувальних центрів антитіла, які мають бажані характеристики (дивись, наприклад, Yang et al., J. Mol. Biol., 254: 392-403 (1995)). Мутацію CDR здійснюють різними способами. Один зі способів полягає у рандомізації окремих залишків або комбінацій залишків, так що у популяції за всіма іншими ознаками ідентичних антигензв'язувальних центрів, субпопуляції, які містять від двох до двадцяти амінокислот, 6 UA 111818 C2 5 10 15 20 25 30 35 40 45 50 55 60 знаходяться у конкретних положеннях. Альтернативно, мутації можуть бути індуковані у множині залишків методами схильної до помилок ПЛР (дивись, наприклад, Hawkins et al., J. Mol. Biol., 226: 889-896 (1992)). За іншим прикладом, вектори фагового дисплею, які містять гени варіабельних ділянок важких та легких ланцюгів, можуть розмножуватись у штамах-мутаторах E. coli (дивись, наприклад, Low et al., J. Mol. Biol., 250: 359-368 (1996)). Ці методи мутагенезу є ілюстративними для багатьох методів, відомих фахівцю у цій галузі. Зручним способом одержання замінених варіантів є "визрівання афінності" із застосуванням техніки фагового дисплею. Стисло, декілька сайтів CDR піддають мутаціям для одержання усіх можливих амінокислотних замін на кожному сайті. Одержані у такий спосіб варіанти антитіл відображають моновалентним чином із частинок нитчастих фагів як злиття з продуктом гена III M13, запакованим у кожній частинці. Після цього фаг-дисплейні варіанти піддають скринінгу на їх біологічну активність (наприклад, зв'язувальну спорідненість (KD), специфічність, EC50), як розкрито у цьому описі. З метою встановлення сайтів CDR, які є кандидатами для модифікування, може бути проведений аланіновий сканувальний мутагенез для встановлення залишків CDR, які значною мірою сприяють зв'язуванню антигену. Альтернативно або на додаток, довільному мутагенезу може бути піддана одна або декілька послідовностей CDR у одному чи декількох положеннях залишків, або незважаючи на те, що CDR є функціонально зв'язаною з варіабельною ділянкою, або незважаючи на те, що CDR є незалежною від іншої послідовності варіабельної ділянки, з подальшим поверненням зміненої CDR у варіабельну ділянку із застосуванням методу рекомбінантних ДНК. Після одержання та експресії таких антитіл-варіантів, панель варіантів піддають скринінгу, як розкрито у цьому описі, і антитіла з переважаючими властивостями за одним або декількома відповідними аналізами можуть бути відібрані для подальшої розробки. На додаток до безпосередньо описаних антитіл, інші "по суті гомологічні" модифіковані антитіла можуть бути легко розроблені та одержані із застосуванням різних методів рекомбінантних ДНК, добре відомих фахівцям у цій галузі. Наприклад, каркасні ділянки можуть відрізнятись від нативних послідовностей на первинному структурному рівні декількома амінокислотними замінами, термінальними та проміжними доданнями та делеціями тощо. Більше того, численні різні людські каркасні ділянки можуть бути застосовані окремо або у комбінації як основа для гуманізованих імуноглобулінів за цим винаходом. Взагалі, модифікації генів можуть бути легко здійснені із застосуванням різних добре відомих методів, таких як сайтспрямований мутагенез. Цей винахід охоплює нуклеїновокислотні послідовності, які кодують важкий ланцюг антитіла проти CSF-1R, який містить будь-яку VH або її частину чи будь-яку з CDR VH, у тому числі будьякі її варіанти, як розкрито у цьому описі. Цей винахід охоплює також нуклеїновокислотні молекули, які кодують легкий ланцюг антитіла проти CSF-1R, який містить будь-яку VL або її частину чи будь-яку з CDR VL, у тому числі будь-які її варіанти, як розкрито у цьому описі. Цей винахід також охоплює нуклеїновокислотні послідовності Антитіла 1, послідовності SEQ ID NO 13 та SEQ ID NO 14 для важкого ланцюга і легкого ланцюга, відповідно. До антитіл за цим винаходом належать антитіла, які містять однакові CDR Антитіла 1, та/або однакову варіабельну ділянку легкого ланцюга, та/або однакову варіабельну ділянку важкого ланцюга Антитіла 1. Антитіла за цим винаходом можна продукувати методами, відомими у цій галузі. До числа цих методів належать імунологічний метод, описаний Kohler та Milstein, Nature 256: 495-497 (1975); Laboratory Techniques in Biochemistry and Molecular Biology, Volume 13 (Burdon et al. eds., Elsevier Science Publishers, Amsterdam) у Monoclonal Antibody Technology, The Production and Characterization of Rodent and Human Hybridomas (Campbell ed., 1984); а також метод рекомбінантних ДНК, опис якого наведений Huse et al., Science 246: 1275-1281 (1989). Антитіла також можуть бути одержані з бібліотек, які несуть комбінації доменів VH та VL у формі scFv або Fab. Домени VH та VL можуть кодуватись нуклеотидами, які є синтетичними, частково синтетичними або мають природне походження. Цей винахід може бути здійснений із застосуванням бібліотек у форматі фагового дисплею, які несуть фрагменти людських антитіл. Еншими джерелами людських антитіл є трансгенні миші, створені методами генної інженерії для експресії людських імуноглобулінових генів. Одним із варіантів одержання антитіл за цим винаходом є експресія нуклеїнової кислоти, яка кодує антитіло за цим винаходом, у трансгенній тварині, якій введена значна частина людського геному, який продукує антитіло, і яку роблять дефіцитною щодо продукування ендогенних антитіл. До трансгенних тварин належать (але без обмеження ними) миші, кози та кролики. Антитіла за цим винаходом одержали із застосуванням трансгенних мишей. Один додатковий варіант здійснення цього винаходу охоплює експресію антитілокодувального гена, 7 UA 111818 C2 5 10 15 20 25 30 35 40 45 50 55 60 наприклад, у молочній залозі тварини, для секреції поліпептиду під час лактації. Традиційним способом продукування "гуманізованих" антитіл є пересадження послідовностей CDR з Mab (продукованих шляхом імунізації хазяїна-гризуна) на каркас людського Ig та трансфікування химерними генами клітин яєчника китайського хом'ячка (CHO), які, у свою чергу, продукують функціональне антитіло, яке секретується згаданими клітинами CHO. Слід мати на увазі, що амінокислотні залишки, які є головними визначниками зв'язування однодоменних антитіл, можуть знаходитись у межах гіперваріабельних ділянок (CDR), визначених за Кеботом або Чотіа, але можуть включати в себе також інші залишки, такі як, наприклад, залишки, які, у іншому разі, були б "заховані" на поверхні розділу VH-VL гетеродимеру VH-VL. Білком, застосованим для ідентифікування CSF-1R-зв'язувальних антитіл за цим винаходом, за варіантом, якому віддається перевага, є CSF-1R, а за варіантом, якому віддається більша перевага, – позаклітинний домен CSF-1R. Згаданий позаклітинний домен CSF-1R може бути вільним або кон'югованим з іншою молекулою. Антитіла за цим винаходом можуть бути приєднані до додаткових амінокислотних залишків. Такими амінокислотними залишками може бути пептидна мітка, можливо, для полегшення ізоляції, або Fc-фрагмент IgG для оптимізації димеризації. Передбачені також інші амінокислотні залишки для спрямування антитіл у окремі органи або тканини. Фрагменти антитіл можна продукувати шляхом розщеплення цілого антитіла або шляхом експресії ДНК, яка кодує згаданий фрагмент. Фрагменти антитіл можна приготувати із застосуванням методів, опис яких наведений у Lamoyi et al., J. Immunol. Methods 56: 235-243 (1983) та Parham, J. Immunol. 131: 2895-2902 (1983). Такі фрагменти можуть містити один або обидва Fab-фрагменти чи F(ab')2-фрагмент. Такі фрагменти можуть також містити одноланцюгові фрагменти варіабельної ділянки антитіл, тобто scFv, діатіла або інші фрагменти антитіл. Методи продукування таких функціональних еквівалентів розкриті у публікації заявки на європейський патент EP 239,400 (Winter); публікації заявки WO 89/09622 (Hann, et al.); публікації заявки на європейський патент EP 338,745 (Owens, et al.) та публікації заявки на європейський патент EP 332,424 (Beldler, et al.). У цій заявці термін "антитіла" за цим винаходом означає будьякі їхні фрагменти, незалежно від того, зазначено це конкретно чи ні. Клітинами-хазяями для трансформації векторів та експресії антитіл за цим винаходом, яким віддається перевага, є клітини ссавців, наприклад, клітини NS0 (несекретуючі (0) клітини мишачої мієломи), клітини 293, клітини SP20, клітини CHO (клітини яєчника китайського хом'ячка) та інші клітинні лінії лімфоїдного походження, такі як клітини лімфоми, мієломи або гібридоми. Альтернативно можуть бути застосовані інші хазяї-еукаріоти, такі як дріжджі. Антитіла за цим винаходом можна виділяти або очищати будь-яким методом, відомим у цій галузі, у тому числі фракціонуванням сульфатом амонію або сульфатом натрію, з подальшим діалізом проти фізіологічного розчину, іонообмінним хроматографуванням, афінним або імуноафінним хроматографуванням, а також гель-фільтруванням або зонним електрофорезом. Методом очищення антитіл за цим винаходом, якому віддається перевага, є протеїн Аспецифічна афінна хроматографія. ДНК, яка кодує людські антитіла, можна одержати шляхом рекомбінування ДНК, яка кодує людські константні ділянки та варіабельні ділянки, окрім CDR, яку одержують по суті або виключно з відповідних ділянок людських антитіл, та ДНК, яка кодує CDR, одержаної від людини. До прийнятних джерел ДНК, яка кодує фрагменти антитіл, належать будь-яка клітина, така як клітини гібридом та селезінки, які експресують непроцесоване антитіло. Згадані фрагменти можуть бути застосовані самі по собі як еквіваленти антитіл або можуть бути рекомбіновані у еквіваленти, як описано вище. Рекомбінації ДНК та інші способи, розкриті у цьому описі, можуть бути здійснені відомими методами. Еншим джерелом ДНК є фаг-дисплейна бібліотека антитіл, як відомо у цій галузі. На додаток до цього цим винаходом запропоновані вектори експресії, які містять полінуклеотидні послідовності, опис яких наведений вище, функціонально зв'язані з контрольною послідовністю, такою як експресійна послідовність, промотор та/або енхансерна послідовність. Була розроблена множина векторів експресії для ефективного синтезу поліпептиду антитіла у прокаріотних системах, таких як бактерії, та еукаріотних системах, у тому числі (але без обмеження) системах культури клітин дріжджів та ссавців. Вектори за цим винаходом можуть містити сегменти послідовностей хромосомної, не хромосомної та синтетичної ДНК. Може бути застосований будь-який прийнятний вектор експресії. Наприклад, до 8 UA 111818 C2 5 10 15 20 25 30 35 40 45 50 55 60 прокаріотних клонувальних векторів належать плазміди E. coli, такі як colE1, pCR1, pBR322, pMB9, pUC, pKSM та RP4. До прокаріотних векторів належать також похідні фагової ДНК, такі як M13 та інші нитчасті фаги з однонитковою ДНК. Прикладом вектора, придатного для застосування у дріжджах, є плазміда 2μ. До числа векторів, придатних для експресії у клітинах ссавців, належать добре відомі похідні SV-40, CMV, аденовірусу, послідовності ДНК ретровірусного походження та "човникові" вектори, які є похідними комбінації функціональних векторів ссавців, таких як вектори, опис яких наведений вище, та функціональних плазмід і фагової ДНК. У цій галузі відомі додаткові еукаріотні вектори експресії (наприклад, P.J. Southern and P. Berg, J. Mol. Appl. Genet. 1: 327-341 (1982); Subramani et al., Mol. Cell. Biol. 1: 854-864 (1981); Kaufmann and Sharp, J. Mol. Biol. 159: 601-621 (1982); Scahill et al., Proc. Nat'l Acad. Sci. USA 80: 4654-4659 (1983); Urlaub and Chasin, Proc. Nat'l Acad. Sci. USA 77: 4216-4220 (1980)). Вектори експресії, придатні для цього винаходу, містять щонайменше одну контрольну послідовність експресії, яка є функціонально зв'язаною з послідовністю ДНК або фрагментом, призначеним для експресії. Контрольну послідовність вводять у вектор для контролювання та регуляції експресії клонованої послідовності ДНК. Прикладами прийнятних контрольних послідовностей експресії є lac система, trp система, tac система, trc система, головні операторні та промоторні ділянки фага ламбда, контрольна ділянка білка оболонки fd, гліколітичні промотори дріжджів, наприклад, промотор 3-фосфогліцераткінази, промотори кислої фосфатази дріжджів, наприклад, Pho5, промотори альфа-фактора дріжджів та промотори, одержані з поліоми, аденовірусу, ретровірусу та мавпячого вірусу, наприклад, ранній та пізній промотори SV40, та інші послідовності, які, як відомо, контролюють експресію генів прокаріотних або еукаріотних клітин та їхніх вірусів або їх комбінації. У разі необхідності експресії генно-інженерної конструкції у дріжджах, прийнятним селекційним геном для застосування у дріжджах є ген trp1, присутній у дріжджовій плазміді YRp7. Ген trp1 забезпечує селекційний маркер для штаму-мутанта дріжджів, якому бракує здатності до росту на триптофані, наприклад, ATCC (Американська колекція типових культур) ą 44076. Присутність пошкодження trp1 у геномі дріжджової клітини-хазяїна у подальшому надає ефективне середовище для виявлення трансформації завдяки росту за відсутності триптофану. Аналогічно, Leu2-дефіцитні дріжджові штами (ATCC 20622 або 38626) передбачаються відомими плазмідами, які несуть ген Leu2. Цим винаходом запропоновані також рекомбінантні клітини-хазяї, які містять рекомбінантні вектори, опис яких наведено вище. Антитіла за цим винаходом можуть експресуватись у інших лініях клітин, окрім гібридом. Нуклеїнові кислоти, які містять послідовність, яка кодує поліпептид за цим винаходом, можуть бути застосовані для трансформації відповідної клітини-хазяїна ссавця. Лінії клітин, яким віддається особлива перевага, можна вибирати, виходячи з високого рівня експресії, конститутивної експресії білка, який становить інтерес, та мінімального забруднення білками хазяїна. Лінії клітин ссавців, доступні як хазяї для експресії, є добре відомими у цій галузі і охоплюють багато імморталізованих ліній клітин, таких як (але без обмеження) клітини COS-7, клітини яєчника китайського хом'ячка (CHO), клітини нирок дитинча хом'ячка (BHK) та багато інших, у тому числі лінії клітин лімфоїдного походження, таких як клітини лімфом, мієлом або гібридом. До прийнятних додаткових еукаріотних клітин належать дріжджі та інші гриби. До прийнятних хазяїв-прокаріотів належать, наприклад, E. coli, такі як E. coli SG-936, E. coli HB 101, E. coli W3110, E. coli X1776, E. coli X2282, E. coli DHI та E. coli MRCl, Pseudomonas, Bacillus, такі як Bacillus subtilis та Streptomyces. Ці рекомбінантні клітини-хазяї можуть бути застосовані для продукування антитіла або його фрагмента, шляхом культивування згаданих клітин за умов, які надають можливість експресії антитіла або його фрагмента, та виділення антитіла або його фрагмента з клітини-хазяїна або середовища, що оточує згадану клітину-хазяїна, та його очищення. Цілеспрямування експресованого антитіла або фрагмента для секреції у рекомбінантних клітинах-хазяях може бути полегшене шляхом введення послідовності, яка кодує сигнальний або секреторний лідерний пептид на 5'-кінці антитілокодувального гена, який становить інтерес. Ці секреторні лідерні пептидні елементи можна одержати з прокаріотних або еукаріотних послідовностей. Відповідно, застосовують прийнятні секреторні лідерні пептиди, які являють собою амінокислоти, приєднані до N-кінця поліпептиду, для спрямування пересування поліпептиду із цитозолю клітини-хазяїна та секреції у живильне середовище. Трансформовані клітини-хазяї культивують методами, відомими у цій галузі, у рідкому живильному середовищі, яке містить засвоювані джерела вуглецю (вуглеводи, такі як глюкоза або лактоза), азот (амінокислоти, пептиди, білки або продукти їх розкладу, такі як пептони, солі амонію тощо) та неорганічні солі (сульфати, фосфати та/або карбонати натрію, калію, магнію та 9 UA 111818 C2 5 10 15 20 25 30 35 40 45 50 55 60 кальцію). Згадане живильне середовище також містить, наприклад, рістстимулювальні речовини, такі як мікроелементи, наприклад, залізо, цинк, марганець тощо. Цим винаходом також запропонований спосіб пригнічення росту пухлини у ссавця шляхом введення в організм згаданого ссавця ефективної кількості антитіла. Відповідні стани для лікування за цим винаходом охоплюють клітини, які, за варіантом, якому віддається перевага, експресують CSF-1R. Не маючи наміру зв'язувати себе жодним конкретним механізмом, способи за цим винаходом пропонують пригнічення росту ракових клітин, в тому числі, наприклад, росту новоутворів, кісткових метастазів, відторгнення трансплантованих органів або імунологічного розладу, такого як аутоімунне захворювання, яке стимулюється CSF-1R. Терміни "лікування" або "лікувати", у контексті цього винаходу, означають терапевтичне лікування, у тому числі пригнічення, уповільнення, зменшення або обернення напрямку розвитку стану, що лежить у основі, або небажаної фізіологічної зміни, пов'язаної із захворюванням або розладом, поліпшення клінічних симптомів стану або запобігання появі клінічних симптомів стану. Сприятливі або бажані клінічні результати охоплюють (але без обмеження ними) полегшення тяжкості симптомів, зменшення ступеня захворювання або розладу, стабілізацію захворювання або розладу (тобто стану, при якому захворювання або розлад не погіршується), уповільнення або затримку розвитку захворювання або розладу, поліпшення або тимчасове полегшення або ослаблення проявів захворювання або розладу та ремісію (часткову або повну) захворювання або розладу, виявну або невиявну. Термін "лікування" може також означати подовження виживаності, порівняно з очікуваною виживаністю у разі неодержання лікування. До числа тих, що потребують лікування, належать ті, у кого захворювання вже діагностовано. За одним із варіантів здійснення цей винахід може бути застосований як лікарський засіб. За способами за цим винаходом терапевтично ефективну кількість антитіла за цим винаходом вводять в організм ссавця або пацієнта, який цього потребує. Крім того, фармацевтичні композиції за цим винаходом можуть містити терапевтично ефективну кількість антитіла проти CSF-1R за цим винаходом. Термін "терапевтично ефективна кількість" або "ефективна доза" означає кількість, яка є ефективною, у дозах та протягом необхідних періодів часу, для досягнення бажаного терапевтичного результату. Терапевтично ефективна кількість антитіла може варіювати у залежності від таких факторів, наприклад, як стан захворювання, вік, стать та маса індивідуума, і здатність антитіла або частини антитіла спричинювати бажану реакцію у індивідуума. До інших факторів належать введення, ділянка-мішень, фізіологічний стан пацієнта, чи є пацієнт людиною або твариною, інші лікарські засоби, які були введені, та чи є лікування профілактичним або терапевтичним. Незважаючи на те, що людські антитіла за цим винаходом є особливо корисними для введення людям, їх можна вводити також іншим ссавцям. Термін "ссавець" у значенні, вжитому у цьому описі, охоплює (але без обмеження ними) людей, лабораторних тварин, домашніх тварин та сільськогосподарських тварин. Терапевтично ефективною кількістю також є кількість, при застосуванні якої будь-яка токсична або шкідлива дія антитіла або частини антитіла переважується терапевтично сприятливою дією. Схему приймання лікарського засобу можна регулювати для забезпечення оптимальної бажаної реакції (наприклад, терапевтичної або профілактичної реакції). Лікувальні дози можна титрувати звичайними способами, відомими фахівцям у цій галузі, для оптимізації безпечності та ефективності. Схеми застосування лікарського засобу будуть як правило коливатись у межах від однієї дози у вигляді болюсу або безперервного вливання до численних введень на добу (наприклад, кожні 4-6 год.) або за призначенням лікаря-куратора та стану пацієнта. Необмежувальний приклад діапазону для терапевтично ефективної кількості антитіла за цим винаходом становить 0,1-50 мг/кг, за варіантом, якому віддається більша перевага, – 3-35 мг/кг і за варіантом, якому віддається ще більша перевага, – 5-20 мг/кг. Кількість та частота введення доз буде визначатись лікарем, який лікує згаданого пацієнта, і може включати дози від менше ніж 1 мг/кг до більше ніж 100 мг/кг, які вводять щодобово, три рази на тиждень, щотижнево, один раз на два тижні або рідше. Слід, однак, звернути увагу на те, що цей винахід не обмежений будь-якою конкретною дозою. Антитіла проти CSF-1R можна вводити у комбінації з одним або декількома іншими протираковими засобами, у тому числі (але без обмеження ними) з антиангіогенним засобом, хіміотерапевтичним засобом та антинеопластичним засобом. Може бути застосований будьякий прийнятний протираковий засіб, такий як хіміотерапевтичний засіб, опромінювання, антитіло або їх комбінації. До протиракових засобів належать, але без обмеження ними, антинеопластичні засоби, антитіла, ад'юванти та проліки. Антинеопластичні засоби, які на цей час є відомими у цій галузі або випробуються, можуть бути згруповані у декілька класів, до яких належать, наприклад, 10 UA 111818 C2 5 10 15 20 25 30 35 40 45 50 55 60 інгібітори мітозу, алкілувальні засоби, антиметаболіти, інтеркалюючі антибіотики, інгібітори фактора росту, інгібітори клітинного циклу, ферменти, інгібітори топоізомераз, засоби, що знижують виживаність, модифікатори біологічних реакцій, антигормони та антиангіогенні засоби. До прикладів алкілувальних засобів належать (але без обмеження ними) цисплатин (cisplatin), циклофосфамід (cyclophosphamide), мелфалан (melphalan) та дакарбазин (dacarbazine). До прикладів антиметаболітів належать (але без обмеження ними) доксорубіцин (doxorubicin), ® даунорубіцин (daunorubicin), паклітаксел (paclitaxel), гемцитабін (gemcitabine), ALIMTA та інгібітори топоізомераз, іринотекан (CPT-11), амінокамптотецин (aminocamptothecin), камптотецин (camptothecin), DX-8951f, топотекан (топоізомераза I), етопозид (VP-16) та теніпозид (VM-26) (топоізомераза II). У разі застосування опромінювання як антинеопластичний засіб, джерело випромінення може бути зовнішнім (зовнішня дистанційна променева терапія – EBRT) або внутрішнім (контактна променева терапія – BT) відносно пацієнта, який зазнає лікування. Введена доза антинеопластичного засобу залежить від численних факторів, у тому числі, наприклад, від типу засобу, типу та тяжкості пухлини, яку піддають лікуванню, та шляху введення згаданого засобу. Слід, однак, звернути увагу на те, що цей винахід не обмежений будь-якою конкретною дозою. За одним з аспектів антинеопластичним засобом за цим винаходом, якому віддається перевага, є доцетаксел (docetaxel). За іншими аспектами цього ® винаходу антинеопластичними засобами, яким віддається перевага, є паклітаксел, Herceptin та доксорубіцин. Антитіла проти CSF-1R за цим винаходом можна вводити з антитілами, які нейтралізують інші рецептори, які спричинюють ріст або ангіогенез пухлин. За одним із варіантів здійснення цього винаходу антитіло проти CSF-1R застосовують у комбінації з антагоністом рецепторів, який специфічно зв'язується з Her2. Еншим прикладом такого рецептора є VEGFR (рецептор фактора росту судинного ендотелію). Антитіло проти CSF-1R за цим винаходом може бути застосоване у комбінації з антагоністом VEGFR. Антитіло проти CSF-1R можна також вводити у комбінації з одним або декількома прийнятними ад'ювантами, такими як, наприклад, цитокіни (наприклад, IL-10, IL-4 та IL-13), або іншими імуностимуляторами, такими як, але без обмеження ними, хемокіни, пухлиноспецифічні антигени та пептиди. За цим винаходом будь-який прийнятний спосіб або шлях може бути застосований для введення антитіл проти CSF-1R за цим винаходом і факультативно для одночасного введення антинеопластичних засобів та/або антагоністів інших рецепторів. У разі проведення комбінованої терапії за цим винаходом антитіло проти CSF-1R можна вводити перед, під час, по суті одночасно з або після започаткування лікування із застосуванням іншого засобу, у тому ® числі, але без обмеження, доцетакселу, паклітакселу, Herceptin або доксорубіцину чи будь-якої їх комбінації. Схеми приймання антинеопластичного засобу, що застосовують за цим винаходом, охоплюють будь-яку схему, яка, як гадають, є оптимально прийнятною для лікування неопластичного стану пацієнта. Різні стадії розвитку злоякісних пухлин можуть вимагати застосування специфічних протипухлинних антитіл та специфічних антинеопластичних засобів, які будуть визначені для пацієнта на індивідуальній основі. Шляхи введення охоплюють, наприклад, пероральне, внутрішньовенне, внутрішньоочеревинне, підшкірне або внутрішньом'язове введення. Доза антагоністу, який вводиться, залежить від численних факторів, у тому числі, наприклад, від типу антагоністів, типу та тяжкості пухлини, яку піддають лікуванню, та шляху введення антагоністів. Слід, однак, звернути увагу на те, що цей винахід не обмежений будь-яким конкретним способом або шляхом введення. Антитілам проти CSF-1R за цим винаходом, у разі застосування ссавцем з метою профілактики або лікування, за варіантом, якому віддається перевага, надана форма фармацевтичних композицій. Такі фармацевтичні композиції та способи їх одержання є добре відомими у цій галузі. Дивись, наприклад, Remington: The Science and Practice of Pharmacy (Gennaro A., et al., eds., 19th ed., Mack Publishing Co., 1995). За іншим аспектом цього винаходу антитіла за цим винаходом можна вводити у поєднанні (або хімічним чи біосинтетичним способом зв'язувати) з протираковими засобами, антинеопластичними або антиангіогенними засобами або засобами, що продукують виявний сигнал. До протипухлинних засобів, зв'язаних з антитілом, належать будь-які засоби, що знищують або пошкоджують неоваскулатуру або пухлини чи макрофаги, з якими зв'язалось антитіло, або у середовищі клітини, з якою зв'язалось антитіло. Цей винахід може являти собою антитіло проти CSF-1R, яке вводять як кон'югат, у тому числі, але без обмеження ним, як імунокон'югат, що специфічно зв'язується з рецептором і доставляє токсин після інтерналізації комплексу ліганд-токсин. Складові кон'югату антитіло-засіб можуть зв'язуватись один з іншим безпосередньо або сполучатись лінкером, пептидом або непептидом. Наприклад, протипухлинним засобом або антимакрофагальним засобом є токсичний засіб, такий як 11 UA 111818 C2 5 10 15 20 25 30 35 40 45 50 55 60 антинеопластичні засоби або радіоізотоп. Прийнятні антинеопластичні засоби, у тому числі хіміотерапевтичні засоби, відомі фахівцям у цій галузі і обговорюються infra. Цим винаходом також передбачені антитіла проти CSF-1R, сполучені з спрямувальними або репортерними складовими, до яких належать, наприклад, лише антинеопластичні засоби, інші антитіла або репортери, такі як радіоізотопи, у діагностичній системі, де засіб, що продукує виявний сигнал, є кон'югованим з антитілом. Спосіб пригнічення ангіогенезу за цим винаходом включає введення композиції, яка містить антитіло або фрагмент антитіла за цим винаходом, в організм ссавця протягом періоду часу та у кількості, ефективній для пригнічення ангіогенезу. Аналогічно, згадані антитіла та фрагменти антитіл можуть бути застосовані у способах пригнічення метастазування пухлини у ссавця шляхом введення композиції, яка містить антитіло за цим винаходом, в організм ссавця протягом періоду часу та у кількості, ефективній для пригнічення метастазування пухлини. Спосіб пригнічення інфільтрації макрофагів у строму пухлини та стимулювання росту пухлини за цим винаходом включає введення композиції, яка містить антитіло або фрагмент антитіла за цим винаходом, в організм ссавця протягом періоду часу та у кількості, ефективній для пригнічення дії макрофагів на ріст пухлини. Аналогічно, згадані антитіла та фрагменти антитіл можуть бути застосовані у способах зменшення ступеня ерозії кісткової тканини довкола пухлинного метастазу у ссавця шляхом введення композиції, яка містить антитіло за цим винаходом, в організм ссавця протягом періоду часу та у кількості, ефективній для пригнічення ерозії кісткової тканини. Цей винахід передбачає застосування ліганду CSF-1R (CSF-1 або IL-34) як біомаркер у крові, сироватці, плазмі, пухлинних клітинах або циркулюючих пухлинних клітинах ракових пацієнтів, які реагують на лікування у тому разі, коли рак має CSF-1R, експресований на поверхні пухлиноасоційованих макрофагів. Цей винахід також передбачає спосіб прогнозування успішного лікування пацієнта антитілом або фрагментом за цим винаходом шляхом вимірювання рівнів CSF-1 у крові у зразку, де згаданий зразок вибирають із групи, яку складають сироватка, плазма, пухлинні клітини або циркулюючі пухлинні клітини. Еншим аспектом цього винаходу є спосіб лікування раку у пацієнта, який включає стадії: (1) вимірювання рівня CSF-1 у зразку, який одержують від пацієнта, де згаданий зразок вибирають із групи, яку складають кров, сироватка, плазма, пухлинні клітини та циркулюючі пухлинні клітини, і (2) введення в організм згаданого пацієнта антитіла або його фрагмента за цим винаходом, якщо рівні CSF-1 є більшими за рівні CSF-1, визначені у контрольній групі. Цей винахід також передбачає спосіб прогнозування успішного лікування пацієнта антитілом або фрагментом за цим винаходом шляхом вимірювання рівнів IL-34 у крові у зразку, де згаданий зразок вибирають із групи, яку складають сироватка, плазма, пухлинні клітини або циркулюючі пухлинні клітини. Еншим аспектом цього винаходу є спосіб лікування раку у пацієнта, який включає стадії: (1) вимірювання рівня IL-34 у зразку, який одержують від пацієнта, де згаданий зразок вибирають із групи, яку складають кров, сироватка, плазма, пухлинні клітини та циркулюючі пухлинні клітини, і (2) введення в організм згаданого пацієнта антитіла або його фрагмента за цим винаходом, якщо рівні IL-34 є більшими за рівні IL-34, визначені у контрольній групі. Цей винахід також передбачає спосіб визначення, чи є суб'єкт, який має рак, кандидатом для програми лікування раку на основі антитіла проти CSF-1R, де згадане антитіло є антитілом за цим винаходом, який включає: (1) ex vivo або in vitro вимірювання рівня CSF-1 у зразку суб'єкта, де згаданий зразок вибирають із групи, яку складають кров, сироватка, плазма, пухлинні клітини та циркулюючі пухлинні клітини, і (2) де підвищення рівня CSF-1, у зіставленні з рівнем CSF-1 у індивідуума, який не страждає на рак, вказує на те, що згаданий суб'єкт є кандидатом для програми лікування раку на основі антитіла проти CSF-1R. Цей винахід також передбачає спосіб визначення, чи є суб'єкт, який має рак, кандидатом для програми лікування раку на основі антитіла проти CSF-1R, де згадане антитіло є антитілом за цим винаходом, який включає: (1) ex vivo або in vitro вимірювання рівня IL-34 у зразку суб'єкта, де згаданий зразок вибирають з групи, яку складають кров, сироватка, плазма, пухлинні клітини та циркулюючі пухлинні клітини, і (2) де підвищення рівня IL-34, у зіставленні з рівнем IL-34 у індивідуума, що не страждає на рак, вказує на те, що згаданий суб'єкт є кандидатом для програми лікування раку на основі антитіла проти CSF-1R. Цей винахід також передбачає спосіб визначення, чи є суб'єкт, який має рак, кандидатом для програми лікування раку на основі антитіла проти CSF-1R, де згадане антитіло є антитілом за цим винаходом, який включає: (1) ex vivo або in vitro вимірювання рівня CSF-1 або IL-34 чи обох у зразку суб'єкта, де згаданий зразок вибирають з групи, яку складають кров, сироватка, плазма, пухлинні клітини та циркулюючі пухлинні клітини, і (2) де підвищення рівня CSF-1 або 12 UA 111818 C2 5 10 15 20 25 30 35 40 45 50 55 60 IL-34 чи обох, у зіставленні з рівнем CSF-1 або IL-34 чи обох у індивідуума, який не страждає на рак, вказує на те, що згаданий суб'єкт є кандидатом для програми лікування раку на основі антитіла проти CSF-1R. Рівні CSF-1 або IL-34 можна визначати різними способами, у тому числі із застосуванням наявних у продажу наборів (R&D Systems для CSF-1 та USCN Life Sciences, Inc. для IL-34). За одним із таких способів, стандарти або зразки CSF-1 або IL-34 додають у планшет, заздалегідь сенсибілізований антитілами проти людського CSF-1 або IL-34, для забезпечення зв'язування CSF-1 або IL-34 зі згаданими антитілами. Після відмивання незв'язаного CSF-1 або IL-34 чи інших білків, додають друге антитіло, яке розпізнає антитіло проти CSF-1 або IL-34, відповідно. Згадане друге антитіло сполучають із пероксидазою з хрону, що дає синювате забарвлення у разі додання субстрату у лунки. Ентенсивність забарвлення корелює з кількістю CSF-1 або IL34, що знаходиться на планшеті. Оскільки CSF-1 та IL-34 природним шляхом існують у здоровому людському організмі, у контрольній групі необхідно визначити вихідний рівень CSF-1 та IL-34. Контрольна група може включати групу індивідуумів, у яких не було діагностовано ракового стану або симптомів інфекційного захворювання. Відповідно, із застосуванням контрольної групи буде встановлений діапазон рівнів CSF-1 та IL-34, які є нормальними або вихідними для здорових індивідуумів. Наприклад, рівні CSF-1 є на 68 % або 77 % більшими у сироватці пацієнтів, які страждають на рак молочної залози або рак кишечнику, відповідно, аніж у сироватці контрольних груп (Lawicki et al., Clin. Chim. Acta 317: 112-116 (2006); Mroczho et al., Clin. Chim. Acta 380: 208-212 (2007)). За одним з аспектів цього винаходу рівні ліганду CSF-1R є на щонайменше 50 % більшими у зразках ракових пацієнтів, аніж у зразках контрольної групи. Діапазон рівнів CSF-1 та/або IL-34 у контрольній групі буде порівнюватись із рівнем CSF-1 та/або IL-34, визначеним за зразком або зразками пацієнта, для визначення, чи є рівень CSF-1 та/або IL-34 пацієнта більшим за вихідний діапазон контрольної групи. За одним з аспектів антитіла за цим винаходом призначені для застосування при лікуванні раку, якщо ракові клітини секретують ліганд. За іншим аспектом антитіла за цим винаходом призначені для застосування при лікуванні раку, якщо ракові клітини секретують CSF-1. За ще одним аспектом антитіла за цим винаходом призначені для застосування при лікуванні раку, якщо ракові клітини секретують IL-34. Цей винахід також охоплює набори для пригнічення росту пухлин та/або ангіогенезу, які включають в себе терапевтично ефективну кількість людського антитіла проти CSF-1R. Згадані набори можуть також включати в себе антитіло або його фрагмент і додатковий засіб, у тому числі протиракові засоби, антинеопластичні засоби або лікарські засоби, у тому числі, але без ® обмеження ними, доцетаксел, паклітаксел, Herceptin або доксорубіцин. Альтернативно або на додаток до переліченого, згадані набори можуть включати в себе прийнятний антагоніст, наприклад, іншого рецептора фактора росту, залученого до туморогенезу або ангіогензу, обговорюваний infra. Набори за цим винаходом можуть також включати в себе ад'ювант. Відповідно, розкриті у цьому описі рецепторні антитіла можуть бути застосовані in vivo та in vitro для дослідницьких, діагностичних, профілактичних або лікувальних методів, які є добре відомими у цій галузі. Фахівець у цій галузі може внести зміни в сутність розкритого у цьому описі винаходу, і вважається, що такі модифікації охоплюються обсягом цього винаходу. Слід розуміти і очікувати, що фахівець у цій галузі може внести зміни в сутність розкритого у цьому описі винаходу, і вважається, що такі модифікації охоплюються обсягом цього винаходу. Приклади Наведені нижче приклади далі ілюструють цей винахід, але вони мають не вважатися як такі, що обмежують обсяг цього винаходу у будь-який спосіб; вони мають ні в якому разі не вважатися як такі, що обмежують цей широкий обсяг цього винаходу. Докладні описи традиційних методів, таких як методи, які застосовують при конструюванні векторів та плазмід, введення генів, які кодують поліпептиди, у такі вектори та плазміди, введення плазмід у клітини-хазяї, а також експресії і визначення генів та генних продуктів можна знайти у численних публікаціях, у тому числі у Sambrook, J. et al., Molecular Cloning: A Laboratory Manual, 2nd ed., Cold Spring Harbor Laboratory Press (1989) та Coligan, J. et al. Current Protocols in Immunology, Wiley & Sons, Incorporated (2007). Експресія та очищення людських антитіл проти CSF-1R Для кожного антитіла конструювали прийнятну нуклеотидну послідовність важкого ланцюга, наприклад, послідовність SEQ ID NO 13 для Антитіла 1, у прийнятній експресійній плазміді, наприклад, pGSHC, та конструювали прийнятну нуклеотидну послідовність легкого ланцюга, наприклад, послідовність SEQ ID NO 14 для Антитіла 1, у прийнятній експресійній плазміді, такій як pGSLC, із застосуванням прийнятного методу, такого як ПЛР-клонування. Для встановлення 13 UA 111818 C2 5 10 стабільної клітинної лінії котрансфікували прийнятну клітинну лінію-хазяїна, таку як клітини NS0 або CHO, плазмідами з переведеними у лінійну форму важкими та легкими ланцюгами шляхом електропорації, та культивували у прийнятних живильних середовищах, таких як модифіковане за способом Дульбекко середовище Ігла без глутамінової кислоти з діалізованою фетальною телячою сироваткою, доповненому глутамінсинтетазою. Перевіряли клони на експресію антитіла із застосуванням твердофазного імуноферментного аналізу (ELISA), та відбирали максимального продуцента для культивування у ролерних колбах. Очищали антитіла із застосуванням прийнятного методу, такого як протеїн-А-афінне хроматографування. У Таблиці 1 наведені амінокислотні послідовності та номери послідовностей (SEQ ID NO.) різних CDR Антитіла 1 за цим винаходом. Усі послідовності CDR визначені за традиційною схемою нумерації, яка розроблена Кабатом. У Таблиці 2 наведені номери (SEQ ID NO.) різних послідовностей, які мають відношення до цього винаходу. Полінуклеїновокислотні послідовності, які кодують амінокислотні послідовності, розкриті нижче, також охоплюються обсягом цього винаходу. 15 Таблиця 1 Амінокислотна послідовність Антитіла 1 CDR варіабельних ділянок важкого і легкого ланцюгів SEQ ID NO. 1 2 3 Важкий ланцюг CDR1 CDR2 CDR3 SYGMH VIWYDGSNKYYADSVKG GDYEVDYGMDV Легкий ланцюг RASQGISNALA DASSLES QQFNSYPWT SEQ ID NO. 4 5 6 Таблиця 2 Номери (SEQ ID NO.) амінокислотних послідовностей Антитіла 1 Важкий ланцюг Антитіло 1 20 25 30 35 40 Варіабельна ділянка 7 Легкий ланцюг Повна без сигналу Повна з сигналом Варіа-бельна ділянка Повна без сигналу Повна з сигналом 9 11 8 10 12 Аналіз зв'язування із застосуванням твердофазного імуноферментного аналізу (ELISA) Для проведення аналізу зв'язування CSF-1R сенсибілізували 96-лунковий планшет розчинним людським рекомбінантним гібридним білком CSF-1R-Fc (R&D Systems) (1 мкг/мл 100 мкл), герметизували планшет та інкубували протягом ночі при температурі 4C. Тричі промивали лунки PBS (забуферений фосфатом фізіологічний розчин), який містить 0,2 % ® TWEEN-20 (PBS/T), після чого блокували лунки протягом 1 год. при кімнатній температурі (2025C) (RT) PBS, який містить 3 % бичачого сироваткового альбуміну (BSA). Відсмоктували суміш BSA-PBS, і тричі промивали планшети PBS/T. Виконували послідовні розведення Антитіла 1 або контрольного IgG (розпочинаючи з 3 мкг/мл з трикратним розведенням), і додавали 100 мкл у лунки на 1 год. при кімнатній температурі. Тричі промивали лунки PBS/T. Після промивання інкубували згаданий планшет зі 100 мкл специфічного до антилюдського фрагмента F(ab')2 кон'югату HRP (пероксидаза з хрону) (Jackson ImmunoResearch) у PBS (розведення 1:5000) при кімнатній температурі протягом 1 год. Промивали планшети 5 разів PBS/T, після чого інкубували із 100 мкл препарату (1:1) TMB-пероксидазного субстрату та розчину пероксидази B (KPL) протягом 15 хв при кімнатній температурі. Припиняли колориметричну реакцію доданням 100 мкл 0,1 М розчину H 2SO4. Збирали дані із застосуванням пристрою для зчитування мікропланшетів при 450 нм. Аналізували дані з оптичної густини із застосуванням програми GraphPad Prism для обчислення ED 50. ED50, або половина максимальної ефективної дози, являє собою дозу, необхідну для досягнення 50 % максимального зв'язування. -11 ED50 Антитіла 1 для людського CSF-1R дорівнює 8,710 M, що відображено як 0,09 нМ. Антитіло 1 демонструє сильне зв'язування з CSF-1R. Аналіз блокування із застосуванням твердофазного імуноферментного аналізу (ELISA) ELISA для демонстрації блокування антитілами взаємодії CSF-1/CSF-1R 14 UA 111818 C2 5 10 15 20 25 30 35 40 45 50 55 60 Сенсибілізували 96-лункові титраційні мікропланшети (0,5 мкг/мл 100 мкл) CSF-1 (R&D Systems) при температурі 4C протягом ночі. Тричі промивали лунки PBS/T, після чого блокували 100 мкл 3 % BSA/PBS протягом 1 год. при кімнатній температурі. Знову тричі промивали PBS/T. Розбавляли розчинний людський гібридний білок rh-CSF-1R-Fc (R&D Systems) до кінцевої концентрації 0,250 мкг/мл у PBS. Одночасно розбавляли Антитіло 1 у PBS до кінцевої концентрації 200 нМ. Послідовно розбавляли Антитіло 1 з приростом 1:3 від -12 початкових 200 нМ до 310 M. Змішували 100 мкл rh-CSF-1R-Fc із 100 мкл кожного розведення Антитіла 1 протягом 30 хв при кімнатній температурі. Енкубували 100 мкл сумішей Антитіло 1:CSF-1R-Fc протягом 1 год. при кімнатній температурі у лунках, сенсибілізованих CSF-1. Після завершення 1 год. інкубації при кімнатній температурі тричі промивали PBS/T, і додавали у планшети антилюдське IgG-Fc-HRP кон'юговане антитіло у розведенні 1:5000 на 1 год. при кімнатній температурі. Промивали планшети 5 разів PBS/T, після чого інкубували із 100 мкл препарату (1:1) TMB-пероксидазного субстрату та розчину пероксидази B (KPL) протягом 15 хв при кімнатній температурі. Припиняли колориметричну реакцію доданням 100 мкл 0,1 М розчину H2SO4. Збирали дані із застосуванням пристрою для зчитування мікропланшетів при 450 нм. Аналізували дані з оптичної густини із застосуванням програми GraphPad Prism для обчислення IC50. IC50, або половина максимальної інгібувальної концентрації, являє собою концентрацію антитіла, яка спричинює 50 % інгібування зв'язування ліганду з рецептором. -10 IC50 зв'язування Антитіла 1 з людським CSF-1R дорівнює 8,110 M, що відображено як 0,81 нМ. Антитіло 1 пригнічує зв'язування CSF-1 з CSF-1R, із запобіганням тим самим активації CSF-1R лігандом CSF-1. ELISA для демонстрації блокування антитілами взаємодії IL-34/CSF-1R Сенсибілізували 96-лункові титраційні мікропланшети (0,5 мкг/мл 100 мкл) IL-34 (R&D Systems) при температурі 4C протягом ночі. Тричі промивали лунки PBS/T, після чого блокували 100 мкл 3 % BSA/PBS протягом 1 год. при кімнатній температурі. Знову тричі промивали PBS/T. Розбавляли розчинний людський гібридний білок rh-CSF-1R-Fc (R&D Systems) до кінцевої концентрації 0,250 мкг/мл у PBS. Одночасно розбавляли Антитіло 1 у PBS до кінцевої концентрації 200 нМ. Послідовно розбавляли Антитіло 1 з приростом 1:3 від -12 початкових 200 нМ до 310 M. Змішували 100 мкл rh-CSF-1R-Fc із 100 мкл кожного розведення Антитіла 1 протягом 30 хв при кімнатній температурі. Енкубували 100 мкл сумішей Антитіло 1-CSF-1R-Fc протягом 1 год. при кімнатній температурі у лунках, сенсибілізованих IL34. Після завершення 1 год. інкубації при кімнатній температурі тричі промивали PBS/T, і додавали у планшети антилюдське IgG-Fc-HRP кон'юговане антитіло у розведенні 1:5000 на 1 год. при кімнатній температурі. Промивали планшети 5 разів PBS/T, після чого інкубували із 100 мкл препарату (1:1) TMB-пероксидазного субстрату та розчину пероксидази B (KPL) протягом 15 хв при кімнатній температурі. Припиняли колориметричну реакцію доданням 100 мкл 0,1 М розчину H2SO4. Зібрати дані із застосуванням пристрою для зчитування мікропланшетів при 450 нм. Аналізували дані з оптичної густини із застосуванням програми GraphPad Prism для обчислення IC50. IC50, або половина максимальної інгибуючої концентрації, являє собою концентрацію антитіла, яка спричинює 50 % інгібування зв'язування ліганду з рецептором. -10 IC50 зв'язування Антитіла 1 з людським CSF-1R дорівнює 7,010 M, що відображено як 0,71 нМ. Антитіло 1 пригнічує зв'язування IL-34 з CSF-1R, із запобіганням тим самим активації CSF-1R лігандом IL-34. ® Аналіз кінетики зв'язування поверхневим плазмонним резонансом/тест-системою Biacore Вимірювали кінетику зв'язування Антитіла 1 з CSF-1R-Fc при температурі 25C із ® застосуванням біосенсора Biacore 2000 SPR (GE Healthcare). Еммобілізували розчинний гібридний білок CSF-1R-Fc (концентрація 10 мкг/мл при рН 5) у межах від 395 еталонних одиниць до 1200 еталонних одиниць на чипі СМ5 за стандартною методикою амінного сполучення. Під час визначення зв'язувальної спорідненості застосовували як протоковий буфер HBS-EP (0,01 M HEPES (pH 7,4), 0,15 мМ NaCl, 3 мМ EDTA і 0,005 % (у об'ємному відношенні) поверхнево-активної речовини P20). Виконували аналіз взаємодії після нанесення антитіл у розчині з концентраціями від 1,5 нМ до 100 нМ на підготовлену поверхню сенсорного чипу СМ5. Виконували введення антитіл протягом 3 хв для зв'язування, і витримували протягом 15 хв для дисоціації. Виконували регенерацію іммобілізованого білка шляхом введення (10 мкл/хв) 20 мМ розчину HCl. Визначали Ka (kon) і Kd (koff) комплексоутворення із застосуванням програми BIA Evaluation, версія 4.1, шляхом одночасної глобальної підгонки даних до моделі Ленгмюра (1:1). Обчислювали константу асоціації у стані рівноваги (K A) з відношення 1/KD, визначеного у молях (1/M). Обчислювали константу дисоціації у стані рівноваги (KD) з відношення констант швидкості Kd/Ka, визначеного у молях (M). ® Середні значення Ka, Kd та KD для численних аналізів Biacore взаємодії Антитіла 1 з 15 UA 111818 C2 людським CSF-1R наведені в узагальненому вигляді у Таблиці 3. Таблиця 3 Кінетика зв'язування антитіла з рекомбінантним людським CSF-1R Антитіло Антитіло 1 5 10 15 20 25 30 35 40 45 50 Ka (1/Ms) Kon 5 3,710 Kd (1/s) Koff -4 3,310 KD (M) -10 8,010 Антитіло 1 демонструє високу зв'язувальну спорідненість до CSF-1R. Фосфорилування CSF-1R, виявлюване із застосуванням вестерн-блотингу Висіювали клітини NIH3T3, стабільно трансфіковані клітинами CSF-1R, на 12-лунковий 5 планшет із густиною 510 клітин на лунку з 1 мл/лунка модифікованого за способом Дульбекко середовища Егла (DMEM), яке містить 10 % фетальної сироватки крові великої рогатої худоби (FBS) та 1 мг/мл генетицину, на 5 год. Двічі промивали моношари PBS, і культивували протягом ночі у 0,9 мл/лунка DMEM з 1 % FBS. Виконували послідовні розведення Антитіла 1 у DMEM (розпочинаючи з 1 мкг/мл з трикратним розведенням), і додавали по 100 мкл/лунка на 2 год. при температурі 37C. Стимулювали клітини 100 нг/мл ліганду CSF-1 або IL-34 протягом 10 хв, після чого розміщували на льоду, і промивали PBS, який має температуру танення льоду. Лізували клітини у 100 мл 50 мМ розчину ГЕПЕС-буфера (pH 7,5, 150 мМ NaCl, 0,5 % Triton X-100, 1 мМ Na3VO4, 10 мМ NaPPi, 50 мМ NaF) з таблеткою інгібіторів протеаз (компанія Roche) на льоду протягом 10 хв. Просвітляли лізовані клітини шляхом центрифугування при температурі 4C. Наносили 20 мкл лізату на денатуруючий гель для електрофорезу, і блотували на нітроцелюлозну мембрану. Виявляли тирозин-фосфорилований CSF-1R на блоті із застосуванням антитіла проти фосфорилованого CSF-1R з концентрацією 1 мкг/мл (Cell Signaling). Визначали передавання сигналу CSF-1R шляхом зондування блоту із застосуванням анти-фосфо-MAPK (розведення 1:500) або анти-фосфо-Akt (розведення 1:1000) (Cell Signaling). Для забезпечення однакового навантаження смуг, зондували блоти антитілами проти CSF-1R (1 мкг/мл; R&D Systems) або антиактиновими антитілами (1:2000; Sigma). Інкубували усі перші антитіла зі струшуванням протягом 1 год. при кімнатній температурі з подальшим інкубуванням відповідного другого антитіла, кон'югованого з HRP, також зі струшуванням протягом 1 год. при кімнатній температурі. Візуалізували смуги хемілюмінесцентним реактивом (GE Healthcare). Клітини NIH-3T3, стабільно трансфіковані CSF-1R, демонструють швидке фосфорилування CSF-1R у разі стимулювання CSF-1 або IL-34. Присутність Антитіла 1 пригнічує фосфорилування CSF-1R навіть у разі присутності антитіл на рівні 1 нМ, що вказує на те, що зв'язування Антитіла 1 з CSF-1R запобігає активації згаданого рецептора CSF-1 або IL-34. Пригнічення фосфорилування CSF-1R також призводить до зменшення фосфорилування сигнальних молекул, які застосовуються шляхами CSF-1 або IL-34. Як Akt, так і MAPK, які є низхідними відносно CSF1-R, мають знижені рівні фосфорилування, коли клітини інкубують розчином Антитіл 1 з концентрацією від 100 нМ до 1 нМ. Отже, Антитіло 1 запобігає активації CSF-1R і активації кіназного каскаду, яка відбувається після стимуляції CSF-1R. Різниці у рівнях білків актину і CSF-1R між смугами не спостерігалось, про що свідчить однаковий хемілюмінесцентний сигнал на кожній смузі, який спостерігається у разі зондування блотів антитілами проти цих молекул. Таким чином, пригнічення фосфорилування CSF-1R обумовлене не технічними утрудненнями з нерівномірним нанесенням білкових зразків, а точним відтворенням зменшеного передавання сигналів. Аналізи інтерналізації і деградації Антитіло 1 індукує інтерналізацію CSF-1R Висіювали клітини NIH-3T3-CSF-1R на 8-камерні предметні стекла (Nunc), та інкубували при температурі 37C, доки клітини не покривали 50 % площі поверхні лунок. Витримували предметні стекла з охолодженням до температури 4C перед початком експерименту у воднольодяній суспензії. Енкубували клітини з 5 мкг/мл Антитіла 1, і одразу ж підвищували температуру до 37C на період часу тривалістю від 15 хв до 4 год. для забезпечення проходження процесу інтерналізації. Продовжували інкубування окремого набору предметних стекол у водно-льодяній суспензії протягом періоду часу тривалістю від 15 хв до 4 год. з 5 мг/мл Антитіла 1 як контролю. Інкубування при температурі 4C запобігає інтерналізації рецептора CSF-1, в результаті чого будь-який сигнал, який спостерігається у межах клітини, являє собою артефакт. Після завершення інкубування двічі промивали клітини холодним PBS перед фіксацією клітин 1 % розчином параформальдегіду, який має температуру танення льоду, 16 UA 111818 C2 5 10 15 20 25 30 35 40 45 50 55 60 протягом 15 хв. Після трикратного промивання холодним PBS підвищували коефіцієнт проникності клітин у PBS, який містить 0,5 % сапоніну та 1 % BSA, протягом 5 хв, після чого знову промивали PBS, який містить 1 % BSA. Мітили козячим Cy3 антилюдський IgG (розведення 1:5000) протягом 1 год. для флуоресцентного мічення Антитіла 1. Виконували три завершувальні промивання PBS перед заливанням гістологічним середовищем GelMount (Biomeda) та накриттям предметних стекол покривними стеклами. Флуоресцентно мічене Антитіло 1 може бути візуалізоване мікроскопічним шляхом для визначення клітинної локалізації за різних умов, описаних вище. Під час мікроскопіювання Антитіло 1 спостерігається на периферії клітини при температурі 4C перед початком експерименту. Підвищення температури до 37C надає можливість швидкої інтерналізації комплексу Антитіло 1/CSF-1R, яка, яка правило, відбувається у межах 15 хв. Після 1-2 год. інкубування з Антитілом 1, усі комплекси антитіло/CSF-1R займають перінуклеарне положення з незначною кількістю згаданих комплексів, які візуалізуються на плазмовій мембрані, що вказує на те, що в результаті зв'язування Антитіла 1 з CSF-1R згаданий рецептор швидко інтерналізується і залишається усередині клітини. У клітин, які витримували при температурі 4C протягом періоду часу тривалістю до 2 год., спостерігалось лише периферичне забарвлення клітини без будь-якої інтерналізації Антитіла 1. Отже, інтерналізація комплексу антитіло/CSF-1R є АТФ-залежним процесом, який відбувається у межах 15 хв після додання антитіла до клітин. Антитіло 1 індукує деградацію CSF-1R 5 Висіювали клітини NIH-3T3-CSF-1R з густиною 510 клітин на лунку на 12-лунковий планшет з 1 мл середовища DMEM, яке містить 10 % FBS та 1 мг/мл генетицину. Після інкубування клітин при температурі 37C протягом 5 год. додавали на планшети 100 нг/мл CSF1 або 15 мкг/мл Антитіла 1. Відомо, що CSF-1 індукує інтерналізацію та деградацію CSF-1R, відіграючи, таким чином, роль позитивного контролю для експерименту. Витримували CSF-1 на клітинах протягом 1-5 год. перед збиранням клітин. У інших лунках інкубували протягом 24-48 год. з Антитілом 1 перед збиранням клітин. Відсмоктували середовище, лізували клітини, і наносили просвітлені лізати на гелі (як описано вище). Зондували перенесені білки антитілами проти CSF-1R для визначення кількості рецептора при кожній умові. Зондували ті самі блоти антиактиновими антитілами для нормалізації рівнів білка. Виконували кількісне визначення рівнів CSF-1R і актину із застосуванням програми Multi-Gauge для визначення щільності смуг вестерн-блотингу. Відносний загальний рівень білка CSF-1R визначений загальною щільністю смуги CSF-1R, поділеною на відповідну щільність смуги актину. Інкубування CSF-1 з клітинами NIH-3T3-CSF-1R призводить до деградації CSF-1R протягом 1 год. обробки, і рівні CSF-1R протягом 5 год. зменшуються наполовину. Деградація CSF-1R, при інкубуванні з Антитілом 1, не є такою вираженою; Антитіло 1 зменшує рівні CSF-1R на чверть. Через 48 год. рівні деградації залишаються такими самими, що вказує на те, що швидкість деградації залишається постійною. Таким чином, зв'язування Антитіла 1 з CSF-1R призводить до деградації згаданого рецептора у клітин. Антитілозалежна клітинно-опосередкована цитотоксичність (ADCC), спричинювана Антитілом 1 Окрім пригнічення зв'язування CSF-1 з CSF-1R та індукування інтерналізації і деградації CSF-1R, Антитіло 1 також пригнічує CSF-1R шляхом ініціювання реакції ADCC. 5 Людські лейкозні клітини NKM-1 висіювали з густиною 210 клітин/мл на 25 мл середовища RPMI, яке містить 10 % FBS з наднизьким вмістом IgG і 3 нг/мл людського IL-2, на 96-лунковому планшеті. Виконували послідовні розведення (1:3) 1 мкг/мл Антитіла 1 на каркасі IgG1 або IgG2 з доданням 25 мкл/лунка. Після 15 хв інкубування висіювали 25 мкл людських NK-клітин (Lonza) 6 з густиною 310 клітин/мл, та інкубували протягом ще 4 год. при температурі 37C. Додавали 10 мкл лізисного буфера з набору aCella-TOX kit (Cell Technology), і доводили до кімнатної температури протягом 15 хв. Додавали 125 мкл FBS з низьким вмістом IgG, і центрифугували планшети протягом 1 хв при 750g. На планшети Optiplates (Perkin Elmer) додавали 50 мкл ферментативного аналітичного розріджувача з набору aCella-TOX kit, і обережно переносили 50 мкл клітинного супернатанту на згадані планшети. Готували ферментативний аналітичний реактив та реактив виявлення за інструкціями до згаданого набору, додаючи у планшети 100 мкл ферментативного аналітичного реактиву з негайним доданням після цього 50 мкл реактиву виявлення. Зчитували планшети із застосуванням люмінометра через 20 хв після додання реактивів. Ступінь ADCC підвищується у залежності від дози Антитіла 1 зі знищенням 9 % клітин NKM1 у разі досягнення концентрацій Антитіла 1 рівня 1 мкг/мл. У протилежність до цього, у разі клонування Антитіла 1 на каркасі IgG2, змін ступеня ADCC при збільшенні кількості Антитіла 1 17 UA 111818 C2 5 10 15 не спостерігається. Таким чином, Антитіло 1, молекула IgG1, індукує ADCC клітин, з якими воно зв'язується. Картування антигенних детермінант У попередніх публікаціях було визначено, що CSF-1 зв'язується з першими трьома Igдоменами CSF-1R. Wang et al., Mol. Cell. Biol. 13: 5348 (1993). Антитіло 1 зв'язує CSF-1R і пригнічує зв'язування CSF-1 з людським CSF-1R, тому воно повинно зв'язуватись на або поблизу від перших трьох Ig-доменів CSF-1R. Для визначення того, які антигенні детермінанти Антитіла 1 зв'язуються з молекулою CSF-1R, перші три Ig-домени миші та людини змішують (дивись Таблицю 4). Антитіло 1 не розпізнає мишачого CSF-1R, в результаті чого, якщо мишачий Ig-домен вводять у критичну зв'язувальну ділянку людського CSF-1R, зв'язування антитіл не буде відбуватись. Вводили модифікації перших трьох Ig-доменів у каркас людського CSF-1R, який містить залишкові два найбільш C-кінцеві Ig-домени позаклітинного домену. Сполучали ці генноінженерні конструкції з Fc-фрагментом молекули IgG для полегшення продукування білка і стабільності згаданих молекул. Таблиця 4 Визначені Ig-домени CSF-1R Номери амінокислот 21-107 108-201 202-292 293-402 401-512 Ig-домен 1 2 3 4 5 20 25 30 35 40 45 50 Таким чином, химера 1 містить мишачий Ig-домен 1, людський Ig-домен 2 і людський Igдомен 3 (m, h, h), людські Ig-домени 4 та 5, сполучені з Fc-міткою. Химери 2-7 виглядають таким чином: m, m, h (химера 2), m, m, m (химера 3), h, m, h (химера 4), h, m, m (химера 5), h, h, m (химера 6) і m, h, m (химера 7), сполучені з останніми двома Ig-доменами людського CSF-1R, а потім з Fc-міткою. Зв'язування Антитіла 1 з химерними білками CSF-1R визначають із застосуванням ® твердофазного імуноферментного аналізу зв'язування (ELISA) та тест-системи Biacore , як описано вище. Стисло, сенсибілізували планшети 100 мкл людських, мишачих або химерних білків 1-7 (200 нг/мл) протягом ночі. Після промивання та блокування планшетів додавали Антитіло 1 з повторенням з концентрацією 100 нМ. Додавали другі антитіла проти людського Fab, кон'юговані з HRP, з концентрацією 1:10000 для виявлення зв'язування Антитіла 1 з молекулами CSF-1R. Як і очікувалось, при проведенні аналізів зв'язування із застосуванням ELISA, Антитіло 1 зв'язується з людським, але не мишачим CSF-1R. Антитіло 1 слабо зв'язується з химерами, які містять перший або другий людські Ig-домени, але не з тими, які містять перший або другий мишачий Ig-домен. Антитіло 1 сильно зв'язується з химерами, які містять як перший, так і другий Ig-домен людського CSF-1R. Усі інші генно-інженерні конструкції Антитіло 1 не зв'язують. Таким чином, Антитіло 1 зв'язується з Ig-доменами один і два, але потребує обох доменів для сильного зв'язування з людським CSF-1R при проведенні аналізу зв'язування. Дані, які ® одержали при проведенні аналізів із тест-системою Biacore , повторюють дані, які одержали із застосуванням ELISA. Ні одна генно-інженерна конструкція, яка не містила людського другого Ig-домену, не зв'язувала Антитіло 1 навіть у тому разі, коли кількість антитіл знаходилась на рівні 1 мкМ, що вказує на те, що для зв'язування Антитіла 1 необхідним є другий Ig-домен. Зв'язування Антитіла 1 ще більш посилювалось, коли перший Ig-домен також мав людське походження. Таким чином, Антитіло 1 головним чином зв'язується з другим Ig-доменом CSF-1R, але має певні позитивні контакти з першим Ig-доменом. Аналізи диференціації і проліферації Диференціація у макрофаги під впливом CSF-1 5 Висіювали моноцити (Lonza) з густиною 410 клітин/мл у кожній камері 8-камерного предметного скла на 900 мкл живильного середовища Roswell Park Memorial Institute (RPMI) 1640, що містить 10 % FBS та 100 нг/мл hCSF-1. Виконували послідовні розведення Антитіла 1 у RPMI (розпочинаючи з 1 мкг/мл з трикратним розведенням), і додавали 100 мкл у лунки. Енкубували при температурі 37C із заміною середовища кожні три дні доти, доки моноцити, за 18 UA 111818 C2 5 10 15 20 25 30 35 40 45 50 55 60 візуальним спостереженням, прикріпляться до планшета і подовжаться, що є характерною ознакою диференціювання у макрофаги. Моноцити, оброблені Антитілом 1 з концентрацією 2нМ або більше у присутності CSF-1, не диференціюються у макрофаги, зберігаючи свої заокруглені морфологічні характеристики моноцитів. Ендукування CSF-1 диференціювання моноцитів у макрофаги може бути пригнічене Антитілом 1 при IC50, що дорівнює 0,25 нМ. На додаток до цього, багато з них гине під час обробки, оскільки є неспроможними до виживання без постійного стимулювання CSF-1. Диференціація у макрофаги під впливом IL-34 5 Висіювали моноцити (Lonza) з густиною 410 клітин/мл у кожній камері 8-камерного предметного скла на 900 мкл живильного середовища Roswell Park Memorial Institute (RPMI) 1640, яке містить 10 % FBS та 100 нг/мл hIL-34. Виконували послідовні розведення Антитіла 1 у RPMI (розпочинаючи з 1 мкг/мл з трикратним розведенням), і додавали 100 мкл у лунки. Енкубували при температурі 37C із заміною середовища кожні три дні доти, доки моноцити, за візуальним спостереженням, прикріпляться до планшета і подовжаться, що є характерною ознакою диференціювання у макрофаги. Моноцити, оброблені Антитілом 1 з концентрацією 2 нМ або більше у присутності IL-34, не диференціюються у макрофаги, зберігаючи свої заокруглені морфологічні характеристики моноцитів. Ендукування IL-34 диференціювання моноцитів у макрофаги може бути пригнічене Антитілом 1 при IC50, що дорівнює 0,3 нМ. На додаток до цього, багато з них гине під час обробки, оскільки є неспроможними до виживання без постійного стимулювання CSF-1. Проліферація моноцитів під впливом CSF-1 Висіювали моноцити (Lonza) з густиною 3000 клітин на лунку на 96-лунковий планшет у присутності живильного середовища RPMI 1640, яке містить 10 % FBS та 100 нг/мл CSF-1. Наступного дня замінювали середовище, і додавали Антитіло 1 у послідовному розведенні з 20 нМ до 0,01 нМ (розведення 1:3). Через три дні замінювали середовище на свіже, яке містило 10 % FBS, 100 нг/мл CSF-1 і антитіло, і надавали клітинам можливість подальшого росту протягом 5 днів. Після додання 100 мкл люмінесцентного буфера CellTiter Glo Luminecent buffer і субстрату (Promega) струшувати клітини протягом 10 хв, і визначали інтенсивність люмінесценції як показник життєздатності. -10 IC50 Антитіла 1, що забезпечує 50 % пригнічення росту моноцитів, дорівнює 1,410 M, що відображено як 0,1 нМ. Згадана IC50 для індукції CSF-1 росту моноцитів у присутності Антитіла 1 вказує на те, що Антитіло 1 пригнічує проліферацію моноцитів у культурі. Проліферація моноцитів під впливом IL-34 Висіювали моноцити (Lonza) з густиною 3000 клітин на лунку на 96-лунковий планшет у присутності живильного середовища RPMI 1640, яке містить 10 % FBS та 100 нг/мл IL-34. Наступного дня замінювали середовище, і додавали Антитіло 1 у послідовному розведенні з 20 нМ до 0,01 нМ (розведення 1:3). Через три дні замінювали середовище на свіже, яке містить 10 % FBS, 100 нг/мл IL-34 і антитіло, і надавали клітинам можливість подальшого росту протягом 5 днів. Після додання 100 мкл люмінесцентного буфера CellTiter Glo Luminecent buffer і субстрату (Promega), струшували клітини протягом 10 хв, і визначали інтенсивність люмінесценції як показник життєздатності. IC50 Антитіла 1, що забезпечує 50 % пригнічення росту моноцитів, дорівнює 0,5 нМ. Згадана IC50 для індукції IL-34 росту моноцитів у присутності Антитіла 1 вказує на те, що Антитіло 1 пригнічує проліферацію моноцитів у культурі. Аналіз проліферації ліній пухлинних клітин з CSF-1 4 Висіювали на ніч лейкозні клітини NKM-1 з густиною 110 клітин/мл на 96-лунковий планшет у присутності 100 мкл живильного середовища RPMI 1640, яке містило 10 % FBS. Додавали 20 нг/мл CSF-1 до клітин у живильному середовищі RPMI 1640, яке містило 1 % FBS і від 20 нМ до 0,01 нМ послідовно розведеного Антитіла 1 (розведення 1:3). Енкубували протягом ще 3 днів при температурі 37C. Після додання 100 мкл люмінесцентного буфера CellTiter Glo Luminecent buffer і субстрату (Promega), струшувати клітини протягом 10 хв перед визначенням інтенсивності люмінесценції (як показник життєздатності). -11 IC50 для росту NKM-1 у присутності Антитіла 1 дорівнює 7,610 M, що відображено як 0,07 нМ. Це вказує на те, що Антитіло 1 пригнічує проліферацію клітин NKM-1 у культурі. In Vivo моделі пухлин, де CSF-1R експресується на поверхні пухлини Тривала виживаність мишей, які несуть людські лейкозні клітини NKM-1, оброблених Антитілом 1 Піддавали "голих" мишей сублетальному опроміненню у дозі 200 радіан на мишу протягом 6 24 год. перед внутрішньовенним введенням 2,510 лейкозних клітин NKM-1. Через 24 год. довільно розподіляли мишей на 4 групи, які двічі на тиждень одержували людський IgG у дозі 60 19 UA 111818 C2 мг/кг і Антитіло 1 у дозі 60 мг/кг, 20 мг/кг або 5 мг/кг. Здійснювали щоденний моніторинг виживаності мишей. Визначали значення P із застосуванням лог-рангового критерію МантелКокса. Таблиця 5 Підвищена виживаність мишей, які несуть лейкозні клітини NKM-1, оброблених Антитілом 1 Обробка Середня виживаність (дні) Людський IgG Антитіло 1 (5 мг/кг) Антитіло 1 (20 мг/кг) Антитіло 1 (60 мг/кг) 35 55 46 46 Порівняння груп N/A Людський IgG Людський IgG Людський IgG контрольний контрольний контрольний Значення P відносно контролю N/A
ДивитисяДодаткова інформація
Автори англійськоюDoody, Jacqueline, Francoise, Li, Yanxia
Автори російськоюДуди Жаклин Франсуаза, Ли Янься
МПК / Мітки
МПК: A61K 39/395, A61P 35/00
Код посилання
<a href="https://ua.patents.su/60-111818-antitilo-proti-csf-1r.html" target="_blank" rel="follow" title="База патентів України">Антитіло проти csf-1r</a>
Попередній патент: Деревообробний агрегат
Наступний патент: Стійкі до спирту кишковорозчинні фармацевтичні композиції
Випадковий патент: П'єзоелектричний перетворювач механічних величин