Спосіб одержання похідних 6-алкіліденпенему
Номер патенту: 78047
Опубліковано: 15.02.2007
Автори: Міхіра Адо, Венкатесан Аранапакам Мудумбай, Абе Такао, Сато Тісато, Сато Коіті, Такасакі Цуйосі, Мацунага Хіросі, Усіроготі Хідекі, Мансоур Тарек Сухайл
Формула / Реферат
1. Спосіб отримання сполук формули I
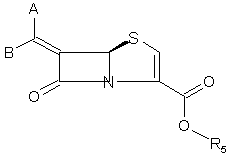 , I
, I
де
один із замісників А або В означає водень, а інший означає арил, необов'язково заміщений одним або двома R2, гетероарил, необов'язково заміщений одним або двома R2, конденсований біциклічний гетероарил, необов'язково заміщений одним або двома R2, конденсований трициклічний гетероарил, необов'язково заміщений одним або двома R2, циклоалкіл, необов'язково заміщений одним або двома R2, алкіл, необов'язково заміщений одним або двома R2, алкеніл, необов'язково заміщений одним або двома R2, алкініл, необов'язково заміщений одним або двома R2, насичену або частково насичену гетероциклічну групу, необов'язково заміщену одним або двома R2; і де будь-який з вказаних гетероарильних залишків, що містить NH-групу в циклі, може необов'язково бути заміщений R1 при вказаному атомі азоту;
R5 являє собою Н, С1-С6-алкіл, С5-С6-циклоалкіл або СНR3ОСО-С1-С6-алкіл або сіль;
R1 являє собою Н, необов'язково заміщений алкіл, необов'язково заміщений арил, необов'язково заміщені гетероарил або моно- або біциклічні насичені гетероциклічні групи, необов'язково заміщений циклоалкіл, необов'язково заміщений алкеніл, необов'язково заміщений алкініл за умови, що атом вуглецю, який безпосередньо зв'язаний з N, не повинен входити до складу подвійного або потрійного зв'язку; необов'язково заміщений перфторалкіл, необов'язково -S(O)p-заміщений алкіл або арил, де р дорівнює 0-2, необов'язково заміщений -С=O-гетероарил, необов'язково заміщений -С=O-арил, необов'язково заміщений -С=O-алкіл, необов'язково заміщений –С=O-циклоалкіл, необов'язково заміщену моно- або біциклічну насичену -С=O-гетероциклічну групу, необов'язково заміщений С1-С6-алкіларил, необов'язково заміщений С1-С6-алкілгетероарил, необов'язково заміщений арил-С1-С6-алкіл, необов'язково заміщений гетероарил-С1-С6-алкіл, необов'язково заміщену моно- або біциклічну насичену С1-С6-алкілгетероциклічну групу, необов'язково заміщений арилалкеніл, що містить 8-16 атомів вуглецю, -CONR6R7, -SO2NR6R7, необов'язково заміщений арилалкілоксіалкіл, необов'язково заміщений алкіл-O-алкіларил, необов'язково заміщений алкіл-O-алкілгетероарил, необов'язково заміщений арилоксіалкіл, необов'язково заміщений гетероарилоксіалкіл, необов'язково заміщений арилоксіарил, необов'язково заміщений арилоксигетероарил, необов'язково заміщений С1-С6-алкіларилоксіарил, необов'язково заміщений С1-С6-алкіларилоксигетероарил, необов'язково заміщений алкіларилоксіалкіламіновмісні групи, необов'язково заміщені алкоксикарбоніл, необов'язково заміщений арилоксикарбоніл або необов'язково заміщений гетероарилоксикарбоніл;
R2 являє собою водень, необов'язково заміщений С1-С6-алкіл, необов'язково заміщений С2-С6-алкеніл, необов'язково заміщений С2-С6-алкініл, галоген, ціано, N-R6R7, необов'язково заміщений С1-С6-алкокси, гідрокси; необов'язково заміщений арил, необов'язково заміщений гетероарил, СООR6, необов'язково заміщені алкіларилоксіалкіламіновмісні групи, необов'язково заміщені арилокси, необов'язково заміщений гетероарилокси, необов'язково заміщений С3-С6-алкенілокси, необов'язково заміщений С3-С6-алкінілокси, С1-С6-алкіламіно-С1-С6-алкокси, алкілендіокси, необов'язково заміщену арилоксі-С1-С6-алкіламіновмісну групу, С1-С6-перфторалкіл, необов'язково S(O)q-заміщений С1-С6-алкіл, необов'язкові S(O)q-заміщений арил, де q дорівнює 0, 1 або 2, CONR6R7, гуанідино- або включену в цикл гуанідиногрупу, необов'язково заміщений алкіларил, необов'язково заміщений арилалкіл, необов'язково заміщений С1-С6-алкілгетероарил, необов'язково заміщений гетероарил-С1-С6-алкіл, необов'язково заміщену моно- або біциклічну насичену С1-С6-алкілгетероциклічну групу, необов'язково заміщений арилалкеніл, що містить від 8 до 16 атомів вуглецю, SO2NR6R7, необов'язково заміщений арилалкілоксіалкіл, необов'язково заміщений арилоксіалкіл, необов'язково заміщений гетероарилоксіалкіл, необов'язково заміщений арилоксіарил, необов'язково заміщений арилоксигетероарил, необов'язково заміщений гeтероарилоксіарил, необов'язково заміщений C1-С6-алкіларилоксіарил або необов'язково заміщений С1-С6-алкіларилоксигетероарил;
R3 являє собою водень, С1-С6-алкіл, С5-С6-циклоалкіл, необов'язково заміщений арил, необов'язково заміщений гетероарил;
R6 і R7 незалежно являють собою Н, необов'язково заміщений С1-С6-алкіл, необов'язково заміщений арил, необов'язково заміщений гетероарил, необов'язково заміщений С1-С6-алкіларил, необов'язково заміщений арилалкіл, необов'язково заміщений гетероарилалкіл, необов'язково заміщений С1-С6-алкілгетероарил, R6 і R7 разом можуть утворювати 3-7-членну насичену циклічну систему, що необов'язково містить один або два гетероатоми, таких як N-R1, О, S=(O)n, де n = 0-2;
вказаний спосіб включає:
(а) конденсацію відповідним чином заміщеного альдегіду 17
А'-CHO, 17
де А' являє собою А, такий, як визначено вище, коли В являє собою водень; або В, такий, як визначено вище, коли А являє собою водень, з похідним 6-бромпенему структури 16
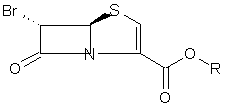 , 16
, 16
де R являє собою п-нітробензил,
в присутності кислоти Льюїса і м'якої основи при низькій температурі, яка приводить до утворення проміжного альдольного продукту 18
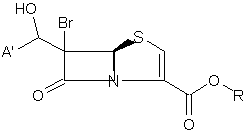 , 18
, 18
де А' і R такі, як визначено вище;
(b) взаємодію проміжної сполуки 18 з хлорангідридом або ангідридом кислоти формули (R8)Cl або (R8)2O або з тетрагалогенметаном формули С(Х1)4 і трифенілфосфіном, де R8 являє собою, алкіл-SО2, арил-SO2, алкіл-СО або арил-СО; Х1 являє собою Вr, І або Сl; з утворенням проміжної сполуки 19
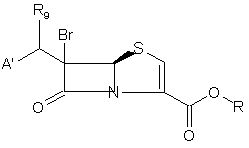 , 19
, 19
де R9 являє собою Х1 або OR8, де R8, Х1, А' і R такі, як визначено вище; і
(с) перетворення проміжної сполуки 19 в цільову сполуку формули І де R5 являє собою водень, за допомогою відновного елімінування; і, якщо потрібно, перетворення в фармацевтично прийнятну сіль або в складний ефір, де R5 являє собою С1-С6-алкіл, С5-С6-циклоалкіл або СНR3ОСО-С1-С6-алкіл.
2. Спосіб за п. 1, де кислотою Льюїса є безводний галогенід магнію.
3. Спосіб за п. 2, де кислотою Льюїса є безводний MgBr2.
4. Спосіб за будь-яким одним з пп. 1-3, де м'якою основою є триетиламін, DMAP або діізопропілетиламін.
5. Спосіб за будь-яким одним з пп. 1-4, де низька температура являє собою температуру від близько –20°С до близько –40°С.
6. Спосіб за будь-яким одним з пп. 1-5, де проміжною сполукою 19 є ацетат, трифлат або тозилат.
7. Спосіб за будь-яким одним з пп. 1-6, де проміжну сполуку 19 не виділяють.
8. Спосіб за будь-яким одним з пп. 1-7, де стадію (с) проводять при помірній температурі.
9. Спосіб за п. 8, де помірна температура являє собою температуру від близько 20°С до близько 35°С.
10. Спосіб за будь-яким одним з пп. 1-9, де відновне елімінування здійснюють дією активованого цинку і фосфатного буфера при рН близько 6,5-8,0 або гідруванням над каталізатором.
11. Спосіб за п. 10, де каталізатор являє собою паладій на вугіллі.
12. Спосіб за будь-яким одним з пп. 1-11, де А або В являє собою конденсовану трициклічну гетероарильну групу.
13. Спосіб за будь-яким одним з пп. 1-11, де А або В являє собою конденсовану біциклічну гетероарильну групу.
14. Спосіб за п. 13, де конденсована біциклічна гетероарильна група являє собою групу структурної формули
 , 16-A
, 16-A
де Z1, Z2 і Z3 незалежно являють собою CR2, N, О, S або N-R1 за умови, що один з Z1, Z2 або Z3 є атомом вуглецю і зв'язаний з іншою молекулою так, як показано в формулі І;
W1, W2 і W3 незалежно являють собою CR4R4, S, SO, SO2, О, N-R1, C=O за умови, що не відбувається утворення ні S-S, ні O-O, ні S-O зв'язку з утворенням насиченої кільцевої системи;
t дорівнює 1-4;
R1, R2, R6 і R7 такі, як визначено в п. 1; і
R4 являє собою Н, необов'язково заміщений С1-С6-алкіл, один з R4 являє собою ОН, С1-С6-алкокси, -S-C1-С6-алкіл, -COOR6, -NR6R7, -CONR6R7; або R4R4 разом можуть являти собою =O, або R4R4 разом з атомом вуглецю, до якого вони приєднані, можуть утворювати 5-8-членну спіросистему, що містить або не містить гетероатоми, вибрані з N, О, S=(O)n (де n дорівнює 0-2), N-R1.
15. Спосіб за п. 13, де конденсована біциклічна гетероарильна група являє собою групу структурної формули
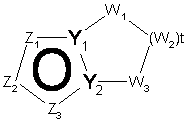 , 16-B
, 16-B
де Z1, Z2 і Z3 незалежно являють собою CR2, N, О, S або N-R1 за умови, що один з Z1-Z3 є атомом вуглецю і зв'язаний з іншою частиною молекули;
W1, W2 і W3 незалежно являють собою CR4R4, S, SO, SO2, О або N-R1;
t дорівнює 1-4;
Y1 і Y2 незалежно являють собою N або С; при цьому, якщо ароматичним кільцем біциклічної гетероарильної групи є імідазол, неароматичний цикл не може містити атом сірки в положенні, що примикає до атома вуглецю в голові містка;
R1 і R2 такі, як визначено в п. 1;
R4 являє собою Н, необов'язково заміщений С1-С6-алкіл, один з R4 являє собою ОН, С1-С6-алкокси, -S-C1-С6-алкіл, -COOR6, -NR6R7, -CONR6R7; або R4R4 разом можуть являти собою =O, або R4R4 разом з атомом вуглецю, до якого вони приєднані, можуть утворювати 5-8-членну спіросистему, що містить або не містить гетероатоми, вибрані з N, О, S=(O)n (де n дорівнює 0-2) і N-R1; і
R6 і R7 незалежно являють собою Н, необов'язково заміщений С1-С6-алкіл, необов'язково заміщений арил, необов'язково заміщений гетероарил, необов'язково заміщений С1-С6-алкіларил, необов'язково заміщений арилалкіл, необов'язково заміщений гетероарилалкіл, необов'язково заміщений С1-С6-алкілгетероарил; або R6 і R7 можуть разом утворювати 3-7-членну насичену циклічну систему, що необов'язково містить один або два гетероатоми, які вибрані з N, О або S.
16. Спосіб за п. 13, де конденсована біциклічна гетероарильна група являє собою групу формули:
 , 16-C
, 16-C
де Z1, Z2, Z3 і Z4 незалежно являють собою CR2 або N за умови, що один з Z1-Z4 є атомом вуглецю і зв'язаний з іншою частиною молекули;
W1, W2 і W3 незалежно являють собою CR4R4, S, SO, SO2, О або N-R1 за умови, що не відбувається утворення ні S-S, ні O-O, ні S-O зв'язку з утворенням насиченої кільцевої системи;
t дорівнює 1-4;
Y1 і Y2 незалежно являють собою С або N;
R1, R2, R4, R6 і R7 такі, як визначено вище в п. 13.
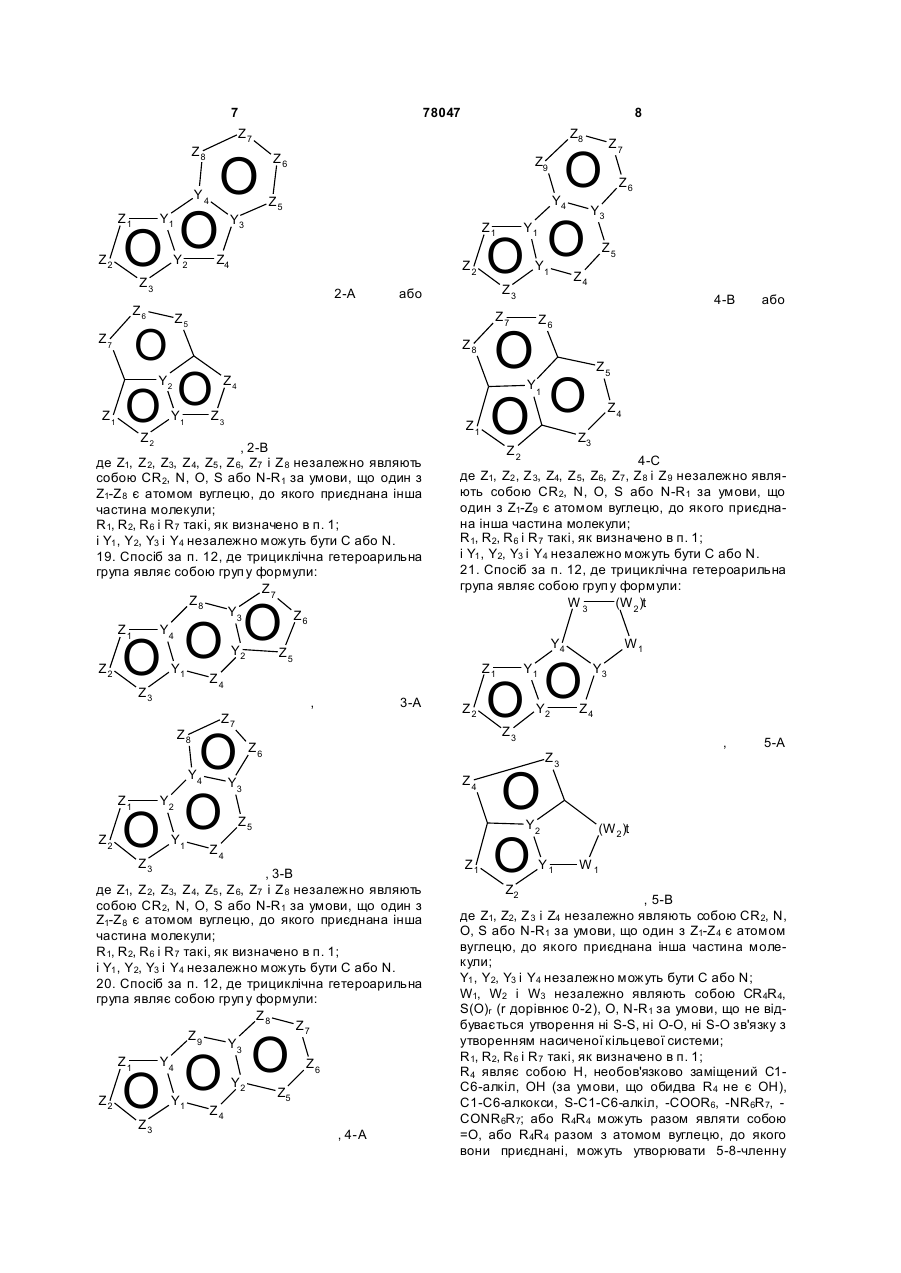
17. Спосіб за п.12, де конденсована трициклічна гетероарильна група являє собою групу формули:
 1-А або
1-А або  , 1-B
, 1-B
де Z1, Z2, Z3, Z4, Z5, Z6 і Z7 незалежно являють собою CR2, N,O, S або N-R1 за умови, що один з Z1-Z7 є атомом вуглецю, до якого приєднана інша частина молекули;
R1, R2, R6 і R7 такі, як визначено в п. 1;
Y1, Y2, Y3 і Y4 незалежно можуть бути С або N.
18. Спосіб за п. 12, де трициклічна гетероарильна група являє собою групу формули:
 2-A або
2-A або  , 2-B
, 2-B
де Z1, Z2, Z3, Z4, Z5, Z6, Z7 i Z8 незалежно являють собою CR2, N, O, S або N-R1 за умови, що один з Z1-Z8 є атомом вуглецю, до якого приєднана інша частина молекули;
R1, R2, R6 і R7 такі, як визначено в п. 1;
і Y1, Y2, Y3 і Y4 незалежно можуть бути С або N.
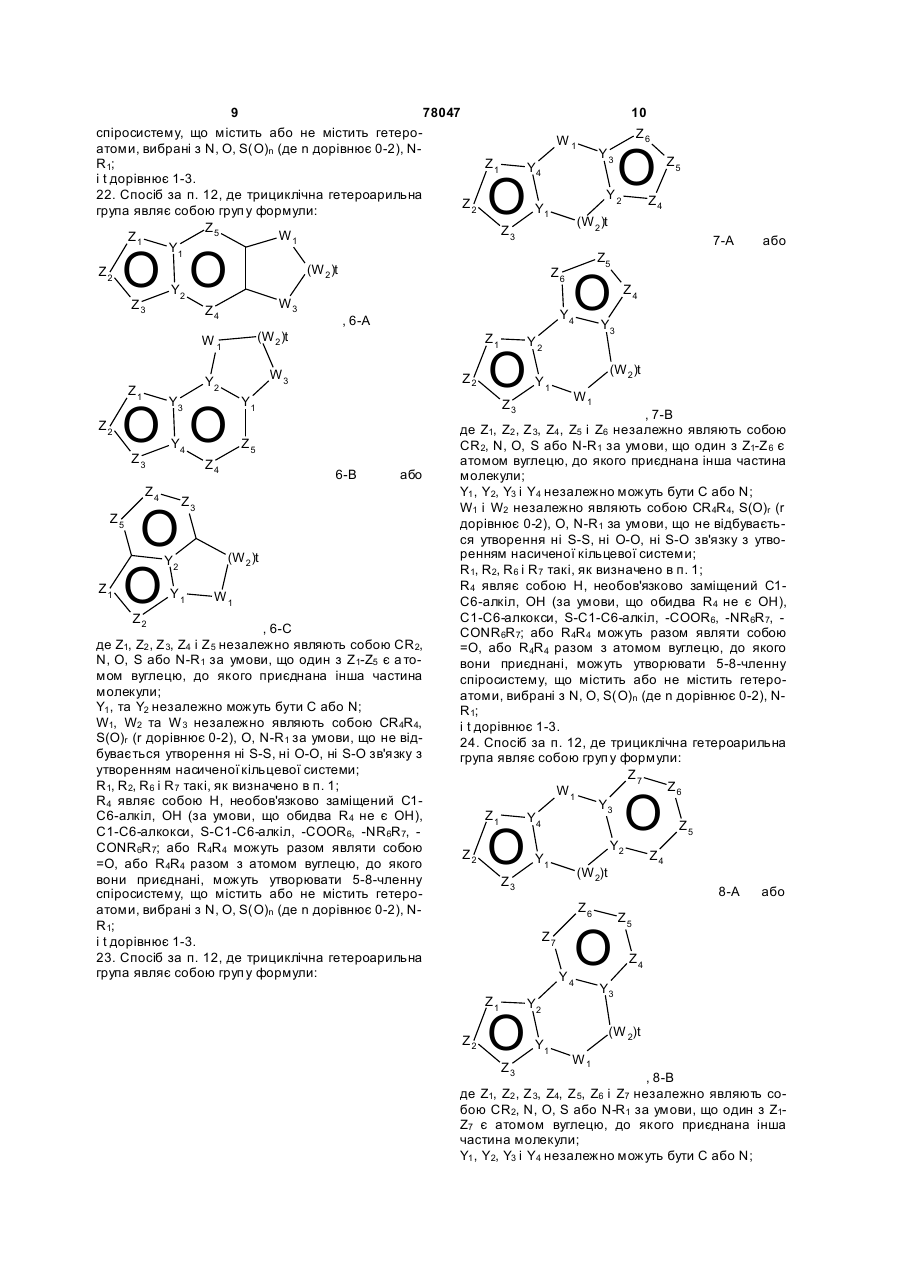
19. Спосіб за п. 12, де трициклічна гетероарильна група являє собою групу формули:
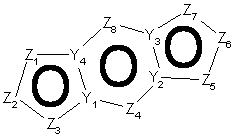 , 3-A
, 3-A  , 3-B
, 3-B
де Z1, Z2, Z3, Z4, Z5, Z6, Z7 i Z8 незалежно являють собою CR2, N, O, S або N-R1 за умови, що один з Z1-Z8 є атомом вуглецю, до якого приєднана інша частина молекули;
R1, R2, R6 і R7 такі, як визначено в п. 1;
і Y1, Y2, Y3 і Y4 незалежно можуть бути С або N.
20. Спосіб за п. 12, де трициклічна гетероарильна група являє собою групу формули:
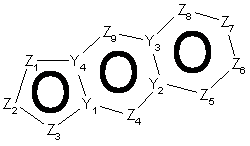 , 4-A
, 4-A
 4-B або
4-B або  4-С
4-С
де Z1, Z2, Z3, Z4, Z5, Z6, Z7, Z8 і Z9 незалежно являють собою CR2, N, O, S або N-R1 за умови, що один з Z1-Z9 є атомом вуглецю, до якого приєднана інша частина молекули;
R1, R2, R6 і R7 такі, як визначено в п. 1;
і Y1, Y2, Y3 і Y4 незалежно можуть бути С або N.
21. Спосіб за п. 12, де трициклічна гетероарильна група являє собою групу формули:
 , 5-А
, 5-А 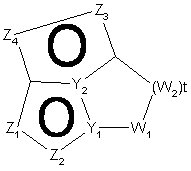 , 5-В
, 5-В
де Z1, Z2, Z3 і Z4 незалежно являють собою CR2, N, O, S або N-R1 за умови, що один з Z1-Z4 є атомом вуглецю, до якого приєднана інша частина молекули;
Y1, Y2, Y3 і Y4 незалежно можуть бути С або N;
W1, W2 і W3 незалежно являють собою CR4R4, S(O)r (r дорівнює 0-2), О, N-R1 за умови, що не відбувається утворення ні S-S, ні O-O, ні S-O зв'язку з утворенням насиченої кільцевої системи;
R1, R2, R6 і R7 такі, як визначено в п. 1;
R4 являє собою Н, необов'язково заміщений С1-С6-алкіл, ОН (за умови, що обидва R4 не є ОН), С1-С6-алкокси, S-C1-С6-алкіл, -COOR6, -NR6R7, -CONR6R7; або R4R4 можуть разом являти собою =O, або R4R4 разом з атомом вуглецю, до якого вони приєднані, можуть утворювати 5-8-членну спіросистему, що містить або не містить гетероатоми, вибрані з N, О, S(O)n (де n дорівнює 0-2), N-R1;
i t дорівнює 1-3.
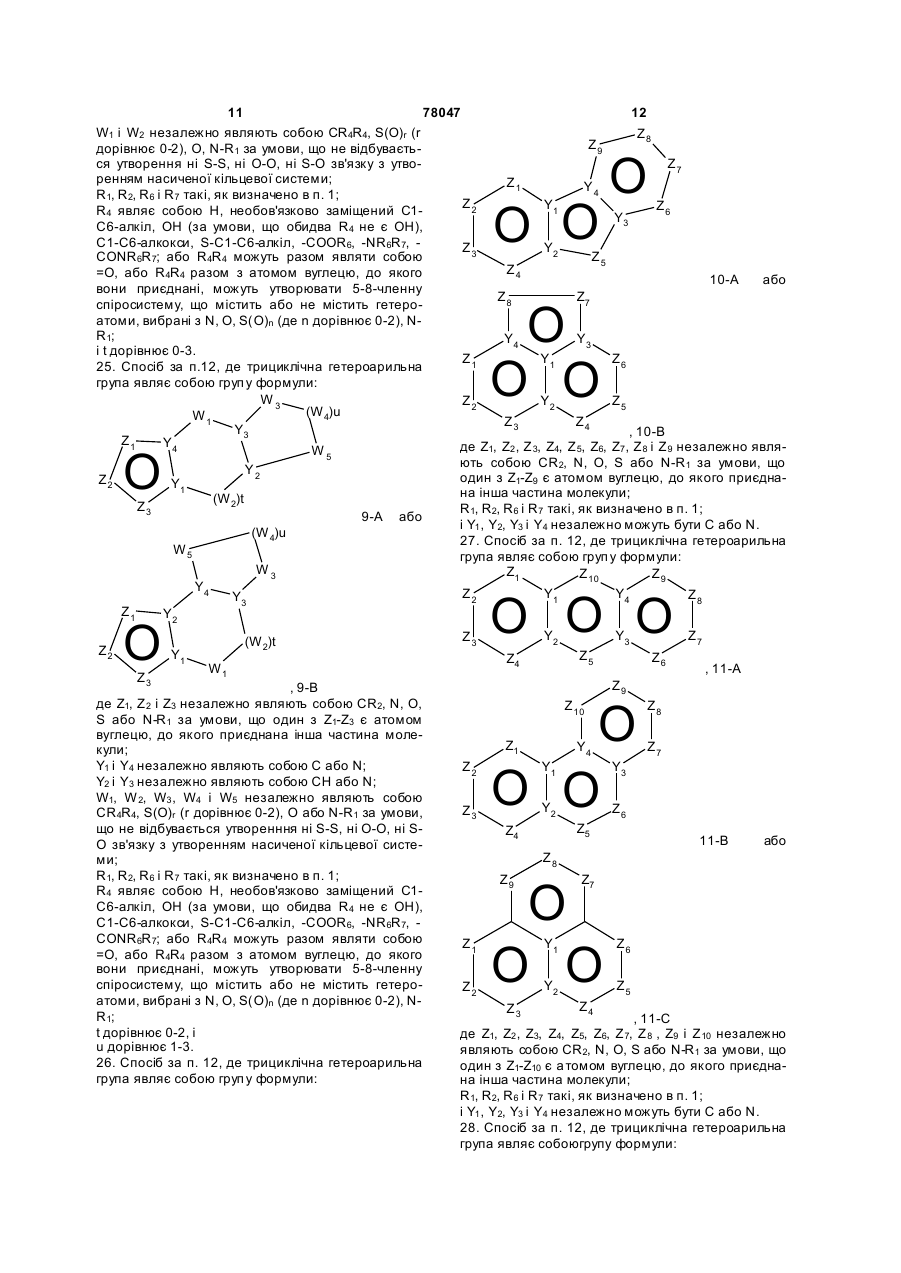
22. Спосіб за п. 12, де трициклічна гетероарильна група являє собою групу формули:
 , 6-A
, 6-A
 6-B або
6-B або 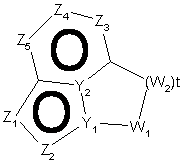 , 6-С
, 6-С
де Z1, Z2, Z3, Z4 і Z5 незалежно являють собою CR2, N, O, S або N-R1 за умови, що один з Z1-Z5 є атомом вуглецю, до якого приєднана інша частина молекули;
Y1, та Y2 незалежно можуть бути С або N;
W1, W2 та W3 незалежно являють собою CR4R4, S(O)r (r дорівнює 0-2), О, N-R1 за умови, що не відбувається утворення ні S-S, ні O-O, ні S-O зв'язку з утворенням насиченої кільцевої системи;
R1, R2, R6 і R7 такі, як визначено в п. 1;
R4 являє собою Н, необов'язково заміщений С1-С6-алкіл, ОН (за умови, що обидва R4 не є ОН), С1-С6-алкокси, S-C1-С6-алкіл, -COOR6, -NR6R7, -CONR6R7; або R4R4 можуть разом являти собою =O, або R4R4 разом з атомом вуглецю, до якого вони приєднані, можуть утворювати 5-8-членну спіросистему, що містить або не містить гетероатоми, вибрані з N, О, S(O)n (де n дорівнює 0-2), N-R1;
i t дорівнює 1-3.
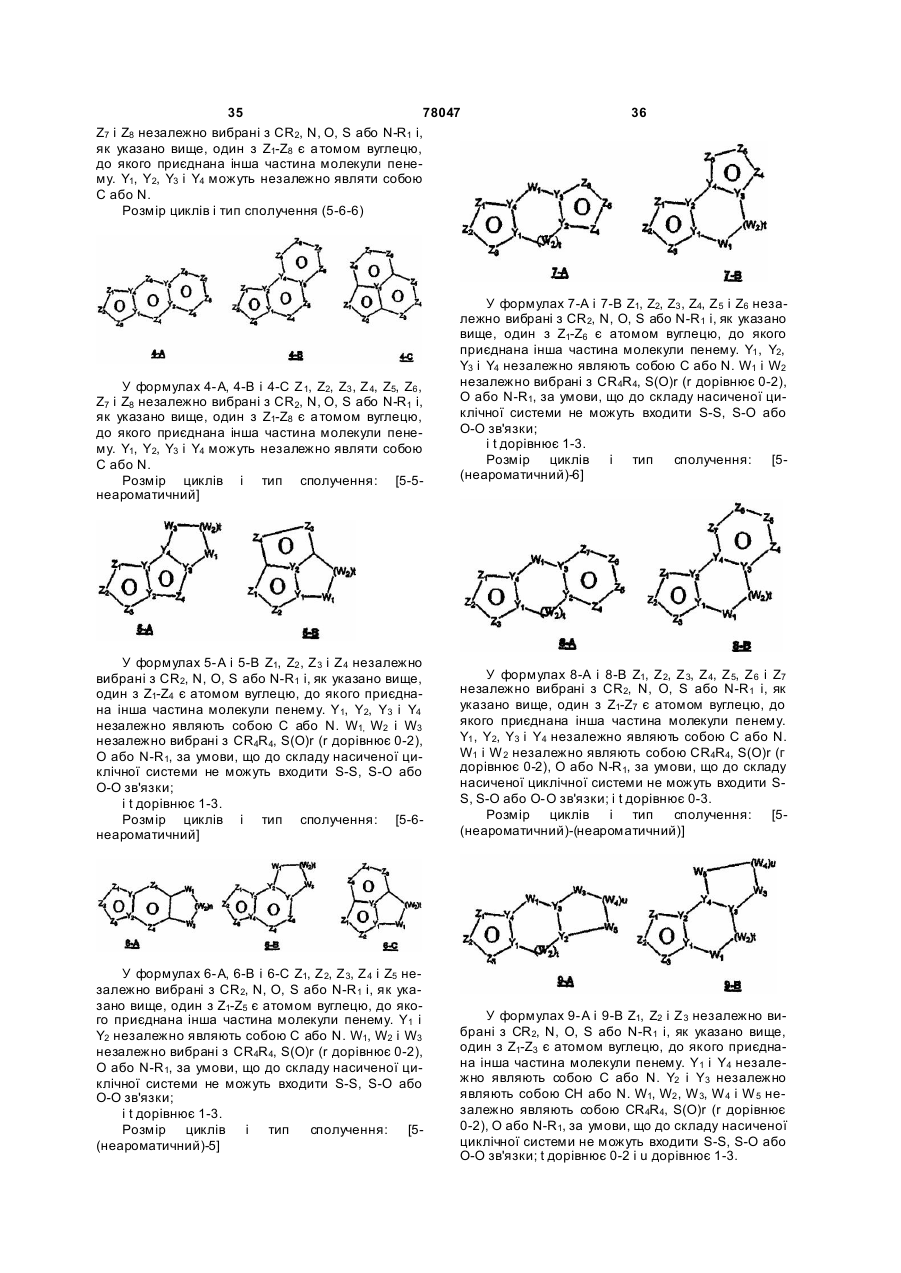
23. Спосіб за п. 12, де трициклічна гетероарильна група являє собою групу формули:
 7-A або
7-A або  , 7-В
, 7-В
де Z1, Z2, Z3, Z4, Z5 і Z6 незалежно являють собою CR2, N, O, S або N-R1 за умови, що один з Z1-Z6 є атомом вуглецю, до якого приєднана інша частина молекули;
Y1, Y2, Y3 і Y4 незалежно можуть бути С або N;
W1 і W2 незалежно являють собою CR4R4, S(O)r (r дорівнює 0-2), О, N-R1 за умови, що не відбувається утворення ні S-S, ні O-O, ні S-O зв'язку з утворенням насиченої кільцевої системи;
R1, R2, R6 і R7 такі, як визначено в п. 1;
R4 являє собою Н, необов'язково заміщений С1-С6-алкіл, ОН (за умови, що обидва R4 не є ОН), С1-С6-алкокси, S-C1-С6-алкіл, -COOR6, -NR6R7, -CONR6R7; або R4R4 можуть разом являти собою =O, або R4R4 разом з атомом вуглецю, до якого вони приєднані, можуть утворювати 5-8-членну спіросистему, що містить або не містить гетероатоми, вибрані з N, О, S(O)n (де n дорівнює 0-2), N-R1;
i t дорівнює 1-3.
24. Спосіб за п. 12, де трициклічна гетероарильна група являє собою групу формули:
 8-А або
8-А або , 8-В
де Z1, Z2, Z3, Z4, Z5, Z6 і Z7 незалежно являють собою CR2, N, O, S або N-R1 за умови, що один з Z1-Z7 є атомом вуглецю, до якого приєднана інша частина молекули;
Y1, Y2, Y3 і Y4 незалежно можуть бути С або N;
W1 і W2 незалежно являють собою CR4R4, S(O)r (r дорівнює 0-2), О, N-R1 за умови, що не відбувається утворення ні S-S, ні O-O, ні S-O зв'язку з утворенням насиченої кільцевої системи;
R1, R2, R6 і R7 такі, як визначено в п. 1;
R4 являє собою Н, необов'язково заміщений С1-С6-алкіл, ОН (за умови, що обидва R4 не є ОН), С1-С6-алкокси, S-C1-С6-алкіл, -COOR6, -NR6R7, -CONR6R7; або R4R4 можуть разом являти собою =O, або R4R4 разом з атомом вуглецю, до якого вони приєднані, можуть утворювати 5-8-членну спіросистему, що містить або не містить гетероатоми, вибрані з N, О, S(O)n (де n дорівнює 0-2), N-R1;
i t дорівнює 0-3.
25. Спосіб за п.12, де трициклічна гетероарильна група являє собою групу формули:
 9-A або
9-A або  , 9-B
, 9-B
де Z1, Z2 і Z3 незалежно являють собою CR2, N, О, S або N-R1 за умови, що один з Z1-Z3 є атомом вуглецю, до якого приєднана інша частина молекули;
Y1 і Y4 незалежно являють собою С або N;
Y2 і Y3 незалежно являють собою СН або N;
W1, W2, W3, W4 і W5 незалежно являють собою CR4R4, S(O)r (r дорівнює 0-2), О або N-R1 за умови, що не відбувається утворенння ні S-S, ні O-O, ні S-O зв'язку з утворенням насиченої кільцевої системи;
R1, R2, R6 і R7 такі, як визначено в п. 1;
R4 являє собою Н, необов'язково заміщений С1-С6-алкіл, ОН (за умови, що обидва R4 не є ОН), С1-С6-алкокси, S-C1-С6-алкіл, -COOR6, -NR6R7, -CONR6R7; або R4R4 можуть разом являти собою =O, або R4R4 разом з атомом вуглецю, до якого вони приєднані, можуть утворювати 5-8-членну спіросистему, що містить або не містить гетероатоми, вибрані з N, О, S(O)n (де n дорівнює 0-2), N-R1;
t дорівнює 0-2, i
u дорівнює 1-3.
26. Спосіб за п. 12, де трициклічна гетероарильна група являє собою групу формули:
 10-А або
10-А або  , 10-В
, 10-В
де Z1, Z2, Z3, Z4, Z5, Z6, Z7, Z8 і Z9 незалежно являють собою CR2, N, O, S або N-R1 за умови, що один з Z1-Z9 є атомом вуглецю, до якого приєднана інша частина молекули;
R1, R2, R6 і R7 такі, як визначено в п. 1;
і Y1, Y2, Y3 і Y4 незалежно можуть бути С або N.
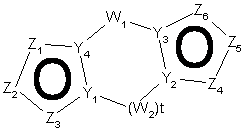
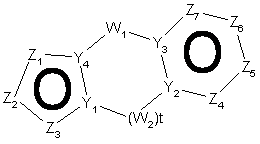
27. Спосіб за п. 12, де трициклічна гетероарильна група являє собою групу формули:
 , 11-A
, 11-A
 11-B або
11-B або 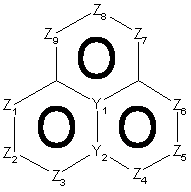 , 11-C
, 11-C
де Z1, Z2, Z3, Z4, Z5, Z6, Z7, Z8 , Z9 і Z10 незалежно являють собою CR2, N, O, S або N-R1 за умови, що один з Z1-Z10 є атомом вуглецю, до якого приєднана інша частина молекули;
R1, R2, R6 і R7 такі, як визначено в п. 1;
і Y1, Y2, Y3 і Y4 незалежно можуть бути С або N.
28. Спосіб за п. 12, де трициклічна гетероарильна група являє собоюгрупу формули:
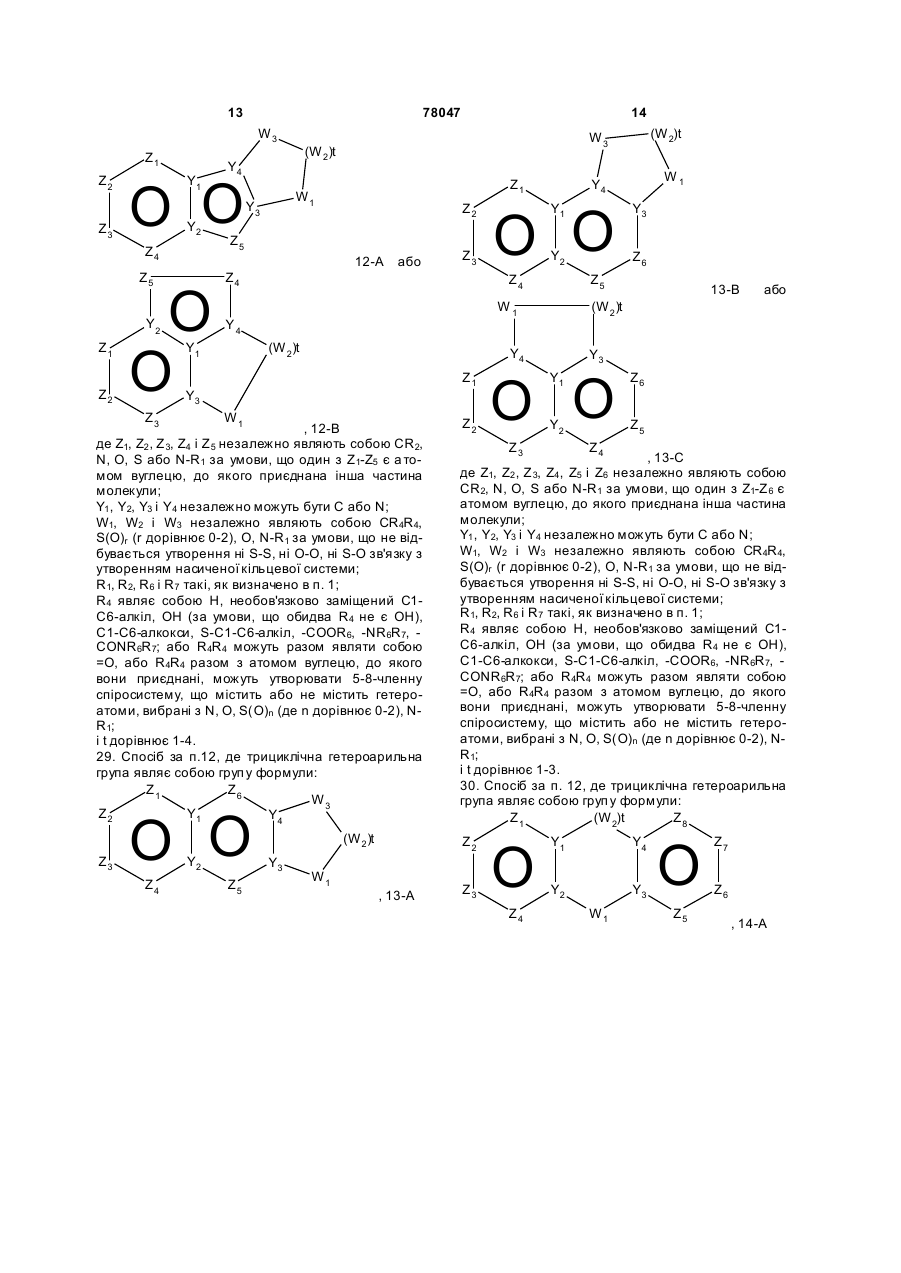
 12-A або
12-A або 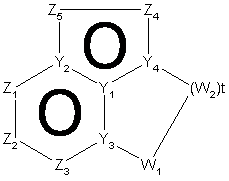 , 12-B
, 12-B
де Z1, Z2, Z3, Z4 і Z5 незалежно являють собою CR2, N, O, S або N-R1 за умови, що один з Z1-Z5 є атомом вуглецю, до якого приєднана інша частина молекули;
Y1, Y2, Y3 і Y4 незалежно можуть бути С або N;
W1, W2 і W3 незалежно являють собою CR4R4, S(O)r (r дорівнює 0-2), О, N-R1 за умови, що не відбувається утворення ні S-S, ні O-O, ні S-O зв'язку з утворенням насиченої кільцевої системи;
R1, R2, R6 і R7 такі, як визначено в п. 1;
R4 являє собою Н, необов'язково заміщений С1-С6-алкіл, ОН (за умови, що обидва R4 не є ОН), С1-С6-алкокси, S-C1-С6-алкіл, -COOR6, -NR6R7, -CONR6R7; або R4R4 можуть разом являти собою =O, або R4R4 разом з атомом вуглецю, до якого вони приєднані, можуть утворювати 5-8-членну спіросистему, що містить або не містить гетероатоми, вибрані з N, О, S(O)n (де n дорівнює 0-2), N-R1;
i t дорівнює 1-4.
29. Спосіб за п.12, де трициклічна гетероарильна група являє собою групу формули:
 , 13-A
, 13-A
 13-B або
13-B або  , 13-C
, 13-C
де Z1, Z2, Z3, Z4, Z5 і Z6 незалежно являють собою CR2, N, O, S або N-R1 за умови, що один з Z1-Z6 є атомом вуглецю, до якого приєднана інша частина молекули;
Y1, Y2, Y3 і Y4 незалежно можуть бути С або N;
W1, W2 і W3 незалежно являють собою CR4R4, S(O)r (r дорівнює 0-2), О, N-R1 за умови, що не відбувається утворення ні S-S, ні O-O, ні S-O зв'язку з утворенням насиченої кільцевої системи;
R1, R2, R6 і R7 такі, як визначено в п. 1;
R4 являє собою Н, необов'язково заміщений С1-С6-алкіл, ОН (за умови, що обидва R4 не є ОН), С1-С6-алкокси, S-C1-С6-алкіл, -COOR6, -NR6R7, -CONR6R7; або R4R4 можуть разом являти собою =O, або R4R4 разом з атомом вуглецю, до якого вони приєднані, можуть утворювати 5-8-членну спіросистему, що містить або не містить гетероатоми, вибрані з N, О, S(O)n (де n дорівнює 0-2), N-R1;
i t дорівнює 1-3.
30. Спосіб за п. 12, де трициклічна гетероарильна група являє собою групу формули:
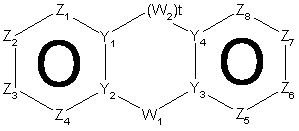 , 14-A
, 14-A
 14-B або
14-B або  , 14-C
, 14-C
де Z1, Z2, Z3, Z4, Z5, Z6, Z7 і Z8 незалежно являють собою CR2, N, O, S або N-R1 за умови, що один з Z1-Z8 є атомом вуглецю, до якого приєднана інша частина молекули;
Y1, Y2, Y3 і Y4 незалежно можуть бути С або N;
W1 і W2 незалежно являють собою CR4R4, S(O)r (r дорівнює 0-2), О, N-R1 за умови, що не відбувається утворення ні S-S, ні O-O, ні S-O зв'язку з утворенням насиченої кільцевої системи;
R1, R2, R6 і R7 такі, як визначено в п. 1;
R4 являє собою Н, необов'язково заміщений С1-С6-алкіл, ОН (за умови, що обидва R4 не є ОН), С1-С6-алкокси, S-C1-С6-алкіл, -COOR6, -NR6R7, -CONR6R7; або R4R4 можуть разом являти собою =O, або R4R4 разом з атомом вуглецю, до якого вони приєднані, можуть утворювати 5-8-членну спіросистему, що містить або не містить гетероатоми, вибрані з N, О, S(O)n (де n дорівнює 0-2), N-R1;
i t дорівнює 1-2.
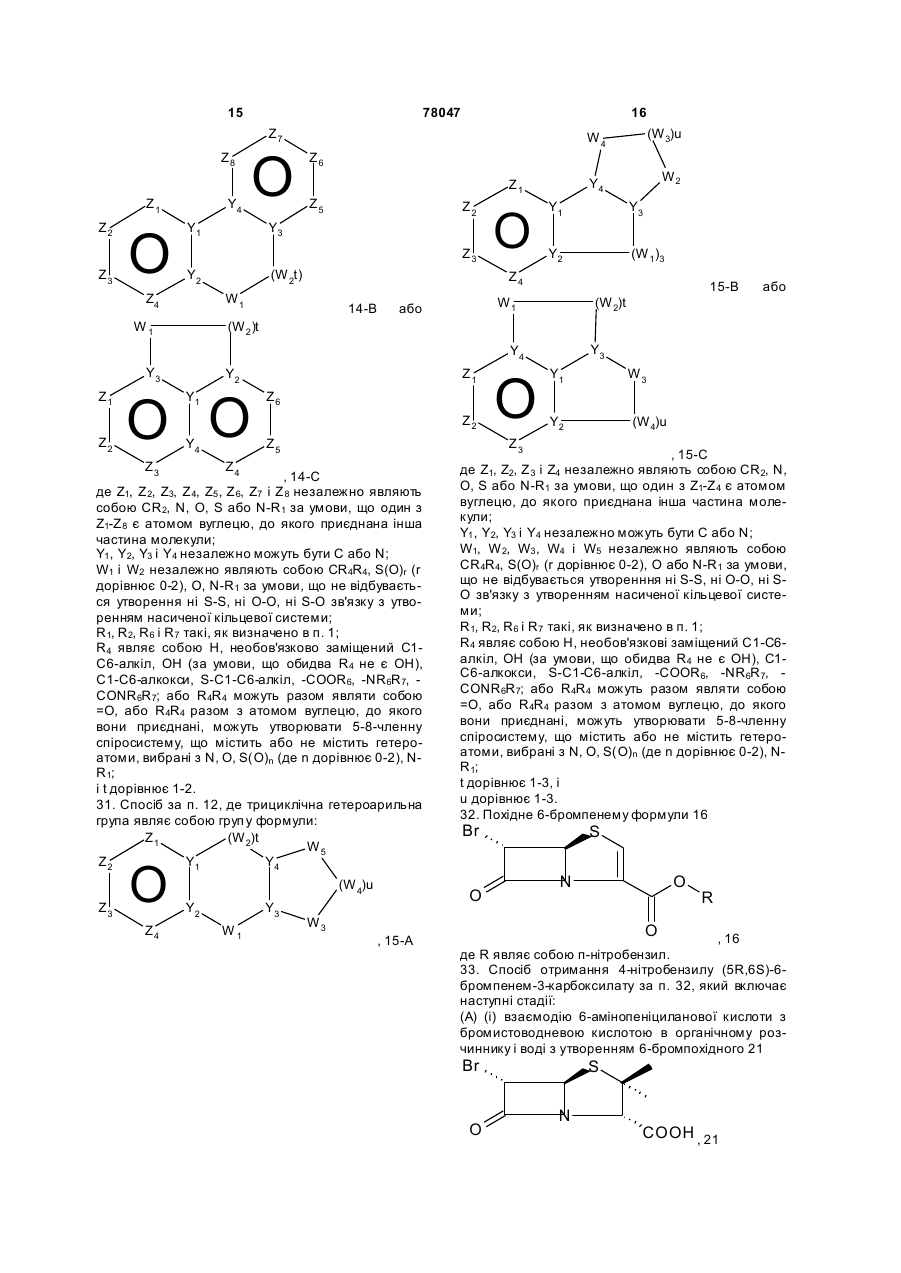
31. Спосіб за п. 12, де трициклічна гетероарильна група являє собою групу формули:
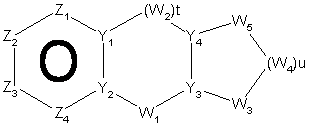 , 15-A
, 15-A
 15-B або
15-B або  , 15-C
, 15-C
де Z1, Z2, Z3 і Z4 незалежно являють собою CR2, N, О, S або N-R1 за умови, що один з Z1-Z4 є атомом вуглецю, до якого приєднана інша частина молекули;
Y1, Y2, Y3 і Y4 незалежно можуть бути С або N;
W1, W2, W3, W4 і W5 незалежно являють собою CR4R4, S(O)r (r дорівнює 0-2), О або N-R1 за умови, що не відбувається утворенння ні S-S, ні O-O, ні S-O зв'язку з утворенням насиченої кільцевої системи;
R1, R2, R6 і R7 такі, як визначено в п. 1;
R4 являє собою Н, необов'язкові заміщений С1-С6-алкіл, ОН (за умови, що обидва R4 не є ОН), С1-С6-алкокси, S-C1-С6-алкіл, -COOR6, -NR6R7, -CONR6R7; або R4R4 можуть разом являти собою =O, або R4R4 разом з атомом вуглецю, до якого вони приєднані, можуть утворювати 5-8-членну спіросистему, що містить або не містить гетероатоми, вибрані з N, О, S(O)n (де n дорівнює 0-2), N-R1;
t дорівнює 1-3, i
u дорівнює 1-3.
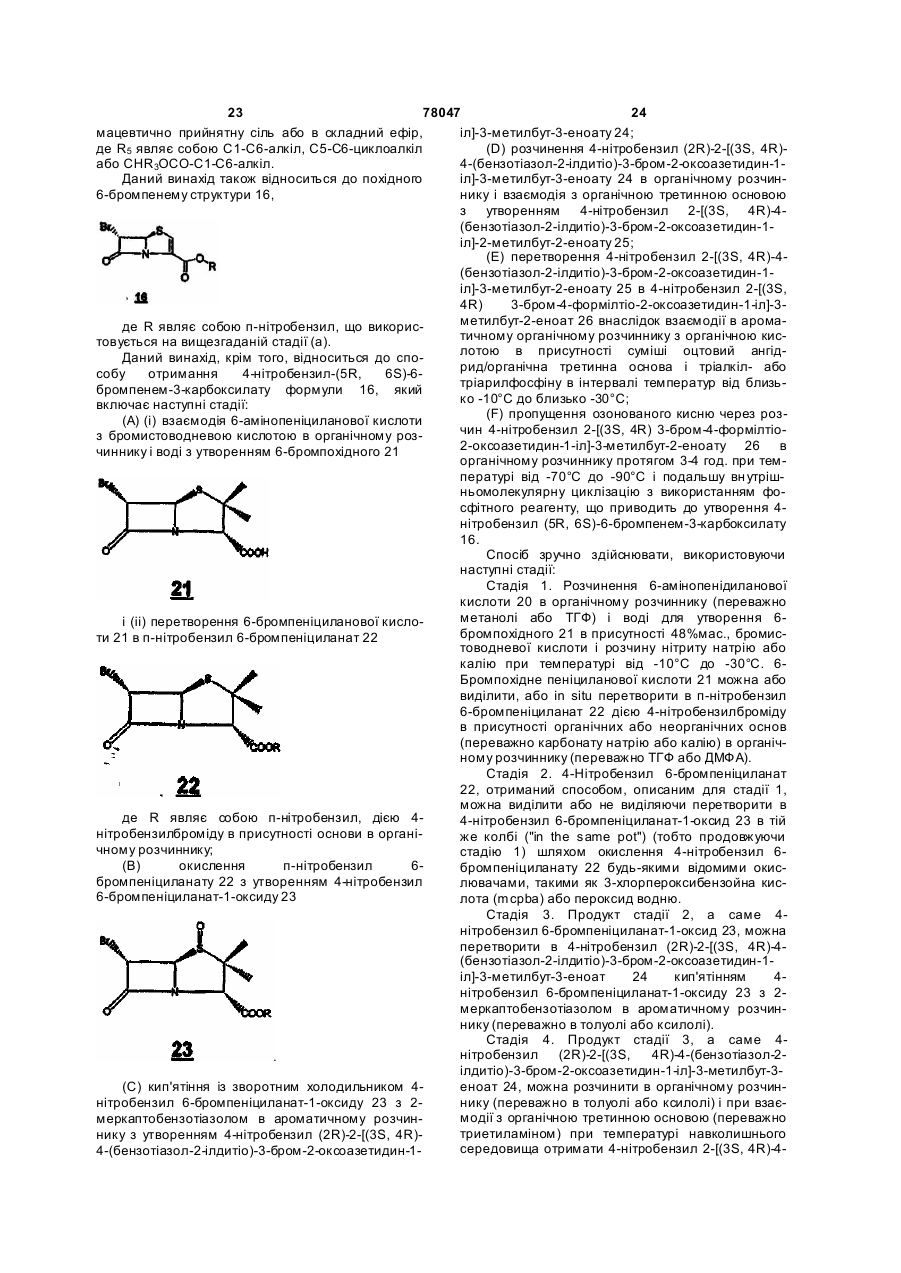
32. Похідне 6-бромпенему формули 16
 , 16
, 16
де R являє собою п-нітробензил.
33. Спосіб отримання 4-нітробензилу (5R,6S)-6-бромпенем-3-карбоксилату за п. 32, який включає наступні стадії:
(А) (і) взаємодію 6-амінопеніциланової кислоти з бромистоводневою кислотою в органічному розчиннику і воді з утворенням 6-бромпохідного 21
 , 21
, 21
і (іі) перетворення 6-бромпеніциланової кислоти 21 в п-нітробензил 6-бромпеніциланат 22
 , 22
, 22
де R являє собою п-нітробензил, дією 4-нітробензилброміду в присутності основи в органічному розчиннику;
(В) окислення п-нітробензил 6-бромпеніциланату 22 з утворенням п-нітробензил 6-бромпеніциланат-1-оксиду 23
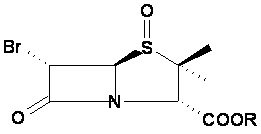 , 23
, 23
(C) кип'ятіння п-нітробензил 6-бромпеніциланат-1-оксиду 23 з 2-меркаптобензотіазолом в ароматичному розчиннику з утворенням 4-нітробензил (2R)-2-[(3S,4R)-4-(бензотіазол-2-ілдитіо)-3-бром-2-оксоазетидин-1-іл]-3-метилбут-3-еноату 24;
(D) розчинення 4-нітробензилу (2R)-2-[(3S,4R)-4-(бензотіазол-2-ілдитіо)-3-бром-2-оксоазетидин-1-іл]-3-метилбут-3-еноату 24 в органічному розчиннику і взаємодію з органічною третинною основою з утворенням 4-нітробензил-2-[(3S,4R)-4-(бензотіазол-2-ілдитіо)-3-бром-2-оксоазетидин-1-іл]-3-метилбут-2-еноату 25;
(Е) перетворення 4-нітробензил-2-[(3S,4R)-4-(бензотіазол-2-ілдитіо)-3-бром-2-оксоазетидин-1-іл]-3-метилбут-2-еноату 25 в 4-нітробензил 2-[(3S,4R)3-бром-4-формілтіо-2-оксоазетидин-1-іл]-3-метилбут-2-еноату 26 внаслідок взаємодії в ароматичному органічному розчиннику з органічною кислотою в присутності суміші оцтовий ангідрид/органічна третинна основа і триалкіл- або триарилфосфіну в інтервалі температур від близько –10°С до близько –30°С;
(F) пропущення озонованого кисню через розчин 4-нітробензилу 2-[(3S,4R)-3-бром-4-формілтіо-2-оксоазетидин-1-іл]-3-метилбут-2-еноату 26 в органічному розчиннику протягом 3-4 год. при температурі від -70°С до -90°С і подальшу внутрішньомолекулярну циклізацію з використанням фосфітного реагенту, що приводить до утворення 4-нітробензилу (5R,6S)-6-бромпенем-3-карбоксилату 16.
34. Спосіб за п. 1 для отримання сполуки формули І
 , I
, I
як визначено в п. 1, в якій 4-нітробензил (5R,6S)-6-бромпенем-3-карбоксилат 16, що використовується на стадії (а), отримують за п. 33.
35. Спосіб за п. 33 або п. 34, де 6-амінопеніциланову кислоту розчиняють в метанолі або ТГФ.
36. Спосіб за будь-яким одним з пп. 33-35, де стадію (А) (і) здійснюють в присутності 48% мас. бромистоводневої кислоти і розчину нітриту натрію або калію.
37. Спосіб за будь-яким одним з пп. 33-36, де стадію (А) (і) здійснюють при температурі від близько -10°С до близько -30°С.
38. Спосіб за будь-яким одним з пп. 33-37, де основою на стадії (А) (іі) є карбонат натрію або калію, а органічним розчинником є ТГФ або ДМФА.
39. Спосіб за будь-яким одним з пп. 33-38, де ароматичним розчинником на стадії (С) є толуол або ксилол.
40. Спосіб за будь-яким одним з пп. 33-39, що включає послідовне перетворення сполуки 23 в сполуку 26, де не виділяють проміжні сполуки.
41. Спосіб за п. 40, в якому 4-нітробензил 6-бромпеніциланат-1-оксид 23 піддають взаємодії з меркаптобензотіазолом в ароматичному органічному розчиннику при кип'ятінні із зворотним холодильником і обробляють триетиламіном при температурі приблизно від 0°С до -20°С з утворенням реакційної суміші, в яку послідовно завантажують органічну кислоту і ангідрид, органічну третинну основу і триалкіл- або триарилфосфін при температурі від приблизно -10°С до приблизно -40°С.
Текст
1. Спосіб отримання сполук формули I A C2 2 (19) 1 3 78047 4 CONR6R7, -SO2NR6R7 , необов'язково заміщений значено вище, коли А являє собою водень, з похіарилалкілоксіалкіл, необов'язково заміщений алдним 6-бромпенему структури 16 кіл-O-алкіларил, необов'язково заміщений алкіл-OBr S алкілгетероарил, необов'язково заміщений арилоксіалкіл, необов'язково заміщений гетероарилоксіO N алкіл, необов'язково заміщений арилоксіарил, неO R обов'язково заміщений арилоксигетероарил, необов'язково заміщений С1-С6O , 16 алкіларилоксіарил, необов'язково заміщений С1де R являє собою п-нітробензил, С6-алкіларилоксигетероарил, необов'язково замів присутності кислоти Льюїса і м'якої основи при щений алкіларилоксіалкіламіновмісні групи, ненизькій температурі, яка приводить до утворення обов'язково заміщені алкоксикарбоніл, необов'язпроміжного альдольного продукту 18 ково заміщений арилоксикарбоніл або HO необов'язково заміщений гетероарилоксикарбоніл; Br R2 являє собою водень, необов'язково заміщений S С1-С6-алкіл, необов'язково заміщений С2-С6A' алкеніл, необов'язково заміщений С2-С6-алкініл, N O галоген, ціано, N-R6R7, необов'язково заміщений O R С1-С6-алкокси, гідрокси; необов'язково заміщений арил, необов'язково заміщений гетероарил, O , 18 СООR6, необов'язково заміщені алкіларилоксіалкіде А' і R такі, як визначено вище; ламіновмісні групи, необов'язково заміщені арило(b) взаємодію проміжної сполуки 18 з хлорангідрикси, необов'язково заміщений гетероарилокси, дом або ангідридом кислоти формули (R8)Cl або необов'язково заміщений С3-С6-алкенілокси, не(R8)2O або з тетрагалогенметаном формули С(Х1)4 обов'язково заміщений С3-С6-алкінілокси, С1-С6і трифенілфосфіном, де R8 являє собою, алкілалкіламіно-С1-С6-алкокси, алкілендіокси, необоSО2, арил-SO2 , алкіл-СО або арил-СО; Х1 являє в'язково заміщену арилоксі-С1-С6собою Вr, І або Сl; з утворенням проміжної сполуки алкіламіновмісну гр уп у, С1-С6-перфторалкіл, не19 обов'язково S(O)q -заміщений С1-С6-алкіл, необоR9 в'язкові S(O)q -заміщений арил, де q дорівнює 0, 1 або 2, CONR6R7, гуанідино- або включену в цикл Br S гуанідиногрупу, необов'язково заміщений алкілаA' рил, необов'язково заміщений арилалкіл, необов'язково заміщений С1-С6-алкілгетероарил, неN O обов'язково заміщений гетероарил-С1-С6-алкіл, O R необов'язково заміщену моно- або біциклічну насичену С1-С6-алкілгетероциклічну групу, необов'яO , 19 зково заміщений арилалкеніл, що містить від 8 до де R9 являє собою Х1 або OR8, де R8, Х1, А' і R 16 атомів вуглецю, SO2NR6R7, необов'язково затакі, як визначено вище; і міщений арилалкілоксіалкіл, необов'язково замі(с) перетворення проміжної сполуки 19 в цільову щений арилоксіалкіл, необов'язково заміщений сполуку формули І де R5 являє собою водень, за гетероарилоксіалкіл, необов'язково заміщений допомогою відновного елімінування; і, якщо потріарилоксіарил, необов'язково заміщений арилоксибно, перетворення в фармацевтично прийнятну гетероарил, необов'язково заміщений сіль або в складний ефір, де R5 являє собою С1гeтероарилоксіарил, необов'язково заміщений C1С6-алкіл, С5-С6-циклоалкіл або СНR3ОСО-С1-С6С6-алкіларилоксіарил або необов'язково заміщеалкіл. ний С1-С6-алкіларилоксигетероарил; 2. Спосіб за п. 1, де кислотою Льюїса є безводний R3 являє собою водень, С1-С6-алкіл, С5-С6галогенід магнію. циклоалкіл, необов'язково заміщений арил, необо3. Спосіб за п. 2, де кислотою Льюїса є безводний в'язково заміщений гетероарил; MgBr2. R6 і R7 незалежно являють собою Н, необов'язково 4. Спосіб за будь-яким одним з пп. 1-3, де м'якою заміщений С1-С6-алкіл, необов'язково заміщений основою є триетиламін, DMAP або діізопропілетиарил, необов'язково заміщений гетероарил, неламін. обов'язково заміщений С1-С6-алкіларил, необо5. Спосіб за будь-яким одним з пп. 1-4, де низька в'язково заміщений арилалкіл, необов'язково затемпература являє собою температуру від близьміщений гетероарилалкіл, необов'язково ко –20°С до близько –40°С. заміщений С1-С6-алкілгетероарил, R6 і R7 разом 6. Спосіб за будь-яким одним з пп. 1-5, де проміжможуть утворювати 3-7-членну насичену циклічну ною сполукою 19 є ацетат, три флат або тозилат. систему, що необов'язково містить один або два 7. Спосіб за будь-яким одним з пп. 1-6, де проміжгетероатоми, таких як N-R1, О, S=(O) n, де n = 0-2; ну сполуку 19 не виділяють. вказаний спосіб включає: 8. Спосіб за будь-яким одним з пп. 1-7, де стадію (а) конденсацію відповідним чином заміщеного (с) проводять при помірній температурі. альдегіду 17 9. Спосіб за п. 8, де помірна температура являє А'-CHO, 17 собою температуру від близько 20°С до близько де А' являє собою А, такий, як визначено вище, 35°С. коли В являє собою водень; або В, такий, як ви 5 78047 6 10. Спосіб за будь-яким одним з пп. 1-9, де відновалкокси, -S-C1-С6-алкіл, -COOR6, -NR6R7, не елімінування здійснюють дією активованого CONR6R7; або R4R4 разом можуть являти собою цинку і фосфатного буфера при рН близько 6,5-8,0 =O, або R4R4 разом з атомом вуглецю, до якого або гідруванням над каталізатором. вони приєднані, можуть утворювати 5-8-членну 11. Спосіб за п. 10, де каталізатор являє собою спіросистему, що містить або не містить гетеропаладій на вугіллі. атоми, вибрані з N, О, S=(O)n (де n дорівнює 0-2) і 12. Спосіб за будь-яким одним з пп. 1-11, де А або N-R1; і В являє собою конденсовану трициклічну гетероR6 і R7 незалежно являють собою Н, необов'язково арильну груп у. заміщений С1-С6-алкіл, необов'язково заміщений 13. Спосіб за будь-яким одним з пп. 1-11, де А або арил, необов'язково заміщений гетероарил, неВ являє собою конденсовану біциклічну гетерообов'язково заміщений С1-С6-алкіларил, необоарильну груп у. в'язково заміщений арилалкіл, необов'язково за14. Спосіб за п. 13, де конденсована біциклічна міщений гетероарилалкіл, необов'язково гетероарильна група являє собою групу стр уктурзаміщений С1-С6-алкілгетероарил; або R6 і R7 моної формули жуть разом утворювати 3-7-членну насичену циклічну систему, що необов'язково містить один або W1 два гетероатоми, які вибрані з N, О або S. Z1 (W 2 )t 16. Спосіб за п. 13, де конденсована біциклічна гетероарильна група являє собою групу формули: W1 Z2 W3 Z1 Y1 (W 2 )t Z3 , 16-A Z2 де Z1, Z 2 і Z3 незалежно являють собою CR2, N, О, Y2 W3 S або N-R1 за умови, що один з Z1, Z2 або Z3 є атомом вуглецю і зв'язаний з іншою молекулою Z3 Z4 так, як показано в формулі І; , 16-C W1, W2 і W 3 незалежно являють собою CR4R4, S, де Z1, Z2 , Z3 і Z4 незалежно являють собою CR2 SO, SO2, О, N-R1, C=O за умови, що не відбуваабо N за умови, що один з Z1-Z4 є атомом вуглецю ється утворення ні S-S, ні O-O, ні S-O зв'язку з і зв'язаний з іншою частиною молекули; утворенням насиченої кільцевої системи; W1, W2 і W 3 незалежно являють собою CR4R4, S, t дорівнює 1-4; SO, SO2 , О або N-R1 за умови, що не відбувається R1, R2, R6 і R7 такі, як визначено в п. 1; і утворення ні S-S, ні O-O, ні S-O зв'язку з утворенR4 являє собою Н, необов'язково заміщений С1ням насиченої кільцевої системи; С6-алкіл, один з R4 являє собою ОН, С1-С6t дорівнює 1-4; алкокси, -S-C1-С6-алкіл, -COOR6, -NR6R7, Y1 і Y2 незалежно являють собою С або N; CONR6R7; або R4R4 разом можуть являти собою R1, R2, R4, R6 і R7 такі, як визначено вище в п. 13. =O, або R4R4 разом з атомом вуглецю, до якого 17. Спосіб за п.12, де конденсована трициклічна вони приєднані, можуть утворювати 5-8-членну гетероарильна група являє собою групу формули: спіросистему, що містить або не містить гетероZ7 Z6 атоми, вибрані з N, О, S=(O)n (де n дорівнює 0-2), N-R1. 15. Спосіб за п. 13, де конденсована біциклічна Y4 Z5 гетероарильна група являє собою групу стр уктурZ1 Y1 Y3 ної формули W1 Z2 Y2 Z4 Z1 (W 2 )t Y1 Z3 1-А або Z2 Y2 W 3 Z5 O O O Z3 , 16-B де Z1, Z 2 і Z3 незалежно являють собою CR2, N, О, S або N-R1 за умови, що один з Z1-Z3 є атомом вуглецю і зв'язаний з іншою частиною молекули; W1, W2 і W 3 незалежно являють собою CR4R4, S, SO, SO 2, О або N-R 1; t дорівнює 1-4; Y1 і Y2 незалежно являють собою N або С; при цьому, якщо ароматичним кільцем біциклічної гетероарильної групи є імідазол, неароматичний цикл не може містити атом сірки в положенні, що примикає до атома вуглецю в голові містка; R1 і R2 такі, як визначено в п. 1; R4 являє собою Н, необов'язково заміщений С1С6-алкіл, один з R4 являє собою ОН, С1-С6 O OO Z6 N N Z1 Z4 Z3 Z2 , 1-B де Z1, Z2 , Z 3, Z4, Z 5, Z6 і Z7 незалежно являють собою CR2, N,O, S або N-R1 за умови, що один з Z1Z7 є атомом вуглецю, до якого приєднана інша частина молекули; R1, R2, R6 і R7 такі, як визначено в п. 1; Y1 , Y2, Y3 і Y4 незалежно можуть бути С або N. 18. Спосіб за п. 12, де трициклічна гетероарильна група являє собою груп у формули: 7 Z7 Z8 Y4 OO Z1 Z2 O Y1 Y2 Y3 78047 Z6 Z1 Z4 Z2 OO Y1 Z1 Z2 , 2-B де Z1, Z 2, Z3, Z 4, Z5 , Z 6, Z7 i Z 8 незалежно являють собою CR2, N, O, S або N-R1 за умови, що один з Z1-Z 8 є атомом вуглецю, до якого приєднана інша частина молекули; R1, R2, R6 і R7 такі, як визначено в п. 1; і Y1 , Y2, Y3 і Y4 незалежно можуть бути С або N. 19. Спосіб за п. 12, де трициклічна гетероарильна група являє собою груп у формули: Z7 Z8 Y3 Z6 Z1 Y4 Y2 Z5 Z2 Y1 Z4 Z3 , 3-A Z7 Z8 Z6 OO O O O O Z1 Z2 Y3 Y2 Y1 Z3 O OO Z5 , 3-B де Z1, Z 2, Z3, Z 4, Z5 , Z 6, Z7 i Z 8 незалежно являють собою CR2, N, O, S або N-R1 за умови, що один з Z1-Z 8 є атомом вуглецю, до якого приєднана інша частина молекули; R1, R2, R6 і R7 такі, як визначено в п. 1; і Y1 , Y2, Y3 і Y4 незалежно можуть бути С або N. 20. Спосіб за п. 12, де трициклічна гетероарильна група являє собою груп у формули: Z8 Z7 Z9 Y3 Z1 Y4 Z6 Y2 Z5 Z2 Y1 Z4 Z3 , 4-A O O O Z4 Z3 Z2 4-С де Z1, Z2 , Z 3, Z4, Z 5, Z6, Z7 , Z 8 і Z 9 незалежно являють собою CR2, N, O, S або N-R1 за умови, що один з Z1-Z9 є атомом вуглецю, до якого приєднана інша частина молекули; R1, R2, R6 і R7 такі, як визначено в п. 1; і Y1 , Y2, Y3 і Y4 незалежно можуть бути С або N. 21. Спосіб за п. 12, де трициклічна гетероарильна група являє собою груп у формули: W3 (W 2 )t Y4 OO Z1 Z2 Y1 Y2 W1 Y3 Z4 Z3 Z4 Z5 Z4 або Z6 Y1 Z3 Y4 Z4 4-B Z7 Z4 Z6 Z5 Z3 Z8 Z7 Y3 Y1 Y1 або Z5 Y2 Z1 Y4 2-A O Z7 O O O Z9 Z5 Z3 Z6 8 Z8 , O Y2 Z1 O Z2 5-А Z3 Y1 (W 2 )t W1 , 5-В де Z1, Z2, Z 3 і Z4 незалежно являють собою CR2, N, O, S або N-R1 за умови, що один з Z1-Z 4 є атомом вуглецю, до якого приєднана інша частина молекули; Y1 , Y2, Y3 і Y4 незалежно можуть бути С або N; W1, W2 і W3 незалежно являють собою CR4R4, S(O)r (r дорівнює 0-2), О, N-R1 за умови, що не відбувається утворення ні S-S, ні O-O, ні S-O зв'язку з утворенням насиченої кільцевої системи; R1, R2, R6 і R7 такі, як визначено в п. 1; R4 являє собою Н, необов'язково заміщений С1С6-алкіл, ОН (за умови, що обидва R4 не є ОН), С1-С6-алкокси, S-C1-С6-алкіл, -COOR6, -NR6R7, CONR6R7; або R4R4 можуть разом являти собою =O, або R4R4 разом з атомом вуглецю, до якого вони приєднані, можуть утворювати 5-8-членну 9 78047 10 спіросистему, що містить або не містить гетероZ6 W1 атоми, вибрані з N, О, S(O)n (де n дорівнює 0-2), NY3 Z5 R1; Z1 Y4 i t дорівнює 1-3. 22. Спосіб за п. 12, де трициклічна гетероарильна Y2 Z4 Z2 Y1 група являє собою груп у формули: (W 2 )t Z5 Z3 W1 Z1 Y1 Z5 (W 2 )t Z2 Z6 Y2 Z4 W3 Z3 Z4 Y4 , 6-A Y3 (W 2 )t Z1 W1 Y2 O O O O Z2 O O Z3 Y4 O O Z5 Y1 O Y1 Z3 Z5 6-B або Z3 Y2 Z2 Z2 Y1 Z4 Z4 Z1 W3 Y3 або O Y2 Z1 7-A (W 2 )t W1 , 6-С де Z1, Z2 , Z 3, Z4 і Z 5 незалежно являють собою CR2, N, O, S або N-R1 за умови, що один з Z 1-Z5 є а томом вуглецю, до якого приєднана інша частина молекули; Y1 , та Y2 незалежно можуть бути С або N; W1, W2 та W 3 незалежно являють собою CR4R4, S(O)r (r дорівнює 0-2), О, N-R1 за умови, що не відбувається утворення ні S-S, ні O-O, ні S-O зв'язку з утворенням насиченої кільцевої системи; R1, R2, R6 і R7 такі, як визначено в п. 1; R4 являє собою Н, необов'язково заміщений С1С6-алкіл, ОН (за умови, що обидва R4 не є ОН), С1-С6-алкокси, S-C1-С6-алкіл, -COOR6, -NR6R7, CONR6R7; або R4R4 можуть разом являти собою =O, або R4R4 разом з атомом вуглецю, до якого вони приєднані, можуть утворювати 5-8-членну спіросистему, що містить або не містить гетероатоми, вибрані з N, О, S(O)n (де n дорівнює 0-2), NR1; i t дорівнює 1-3. 23. Спосіб за п. 12, де трициклічна гетероарильна група являє собою груп у формули: (W 2 )t W1 , 7-В де Z1, Z2 , Z 3, Z4 , Z5 і Z6 незалежно являють собою CR2, N, O, S або N-R1 за умови, що один з Z1-Z 6 є атомом вуглецю, до якого приєднана інша частина молекули; Y1 , Y2, Y3 і Y4 незалежно можуть бути С або N; W1 і W2 незалежно являють собою CR4R4, S(O)r (r дорівнює 0-2), О, N-R1 за умови, що не відбувається утворення ні S-S, ні O-O, ні S-O зв'язку з утворенням насиченої кільцевої системи; R1, R2, R6 і R7 такі, як визначено в п. 1; R4 являє собою Н, необов'язково заміщений С1С6-алкіл, ОН (за умови, що обидва R4 не є ОН), С1-С6-алкокси, S-C1-С6-алкіл, -COOR6, -NR6R7, CONR6R7; або R4R4 можуть разом являти собою =O, або R4R4 разом з атомом вуглецю, до якого вони приєднані, можуть утворювати 5-8-членну спіросистему, що містить або не містить гетероатоми, вибрані з N, О, S(O)n (де n дорівнює 0-2), NR1; i t дорівнює 1-3. 24. Спосіб за п. 12, де трициклічна гетероарильна група являє собою груп у формули: Z7 Z6 W1 Y3 Z1 Y4 Z5 Y2 Z2 Z4 Y1 (W 2)t Z3 8-А або Z6 Z5 Z7 O O Y4 Z1 Z2 O Z3 O Y2 Y1 Z4 Y3 (W 2)t W1 , 8-В де Z1, Z2 , Z 3, Z4, Z 5, Z6 і Z7 незалежно являють собою CR2, N, O, S або N-R1 за умови, що один з Z1Z7 є атомом вуглецю, до якого приєднана інша частина молекули; Y1 , Y2, Y3 і Y4 незалежно можуть бути С або N; 11 78047 12 W1 і W2 незалежно являють собою CR4R4, S(O)r (r Z8 Z9 дорівнює 0-2), О, N-R1 за умови, що не відбувається утворення ні S-S, ні O-O, ні S-O зв'язку з утвоZ7 ренням насиченої кільцевої системи; Z1 Y4 R1, R2, R6 і R7 такі, як визначено в п. 1; Z2 Y1 Z6 R4 являє собою Н, необов'язково заміщений С1Y3 С6-алкіл, ОН (за умови, що обидва R4 не є ОН), С1-С6-алкокси, S-C1-С6-алкіл, -COOR6, -NR6R7, Z3 Y2 CONR6R7; або R4R4 можуть разом являти собою Z5 Z4 =O, або R4R4 разом з атомом вуглецю, до якого 10-А або вони приєднані, можуть утворювати 5-8-членну Z8 Z7 спіросистему, що містить або не містить гетероатоми, вибрані з N, О, S(O)n (де n дорівнює 0-2), NR1; Y4 Y3 i t дорівнює 0-3. Z1 Y1 Z6 25. Спосіб за п.12, де трициклічна гетероарильна група являє собою груп у формули: W3 Z2 Y2 Z5 (W 4)u W1 Z3 Z4 Y3 , 10-В Z1 Y4 де Z1, Z2 , Z 3, Z4, Z 5, Z6, Z7 , Z 8 і Z 9 незалежно являW5 ють собою CR2, N, O, S або N-R1 за умови, що Y2 один з Z1-Z9 є атомом вуглецю, до якого приєднаZ2 Y1 на інша частина молекули; (W 2)t Z3 R1, R2, R6 і R7 такі, як визначено в п. 1; 9-A або і Y1 , Y2, Y3 і Y4 незалежно можуть бути С або N. (W 4)u 27. Спосіб за п. 12, де трициклічна гетероарильна W5 група являє собою груп у формули: W3 Z1 Z 10 Z9 Y4 Z2 Y1 Y4 Z8 Y3 Z1 Y2 O O O O O O O Z2 O Z3 Y1 (W 2)t Z3 Y2 Y3 Z5 Z4 W1 , 9-B де Z1, Z 2 і Z3 незалежно являють собою CR2, N, О, S або N-R1 за умови, що один з Z1-Z3 є атомом вуглецю, до якого приєднана інша частина молекули; Y1 і Y4 незалежно являють собою С або N; Y2 і Y3 незалежно являють собою СН або N; W1, W 2, W3 , W4 і W5 незалежно являють собою CR4R4, S(O)r (r дорівнює 0-2), О або N-R1 за умови, що не відбувається утворенння ні S-S, ні O-O, ні SO зв'язку з утворенням насиченої кільцевої системи; R1, R2, R6 і R7 такі, як визначено в п. 1; R4 являє собою Н, необов'язково заміщений С1С6-алкіл, ОН (за умови, що обидва R4 не є ОН), С1-С6-алкокси, S-C1-С6-алкіл, -COOR6, -NR6R7, CONR6R7; або R4R4 можуть разом являти собою =O, або R4R4 разом з атомом вуглецю, до якого вони приєднані, можуть утворювати 5-8-членну спіросистему, що містить або не містить гетероатоми, вибрані з N, О, S(O)n (де n дорівнює 0-2), NR1; t дорівнює 0-2, i u дорівнює 1-3. 26. Спосіб за п. 12, де трициклічна гетероарильна група являє собою груп у формули: O O O Z6 Z7 , 11-A Z9 O O O Z 10 Z1 Z2 Z3 Y4 Y1 Z7 Y3 Y2 Z6 Z5 Z4 Z8 11-B або Z8 Z9 Z1 Z2 Z7 O O O Y1 Y2 Z3 Z6 Z5 Z4 , 11-C де Z1, Z2 , Z3, Z4, Z5, Z6, Z 7, Z 8 , Z9 і Z 10 незалежно являють собою CR2, N, O, S або N-R1 за умови, що один з Z1-Z10 є а томом вуглецю, до якого приєднана інша частина молекули; R1, R2, R6 і R7 такі, як визначено в п. 1; і Y1 , Y2, Y3 і Y4 незалежно можуть бути С або N. 28. Спосіб за п. 12, де трициклічна гетероарильна група являє собоюгрупу формули: 13 78047 W3 Z1 Z2 Z3 Y2 Z4 O O Y2 Z2 Z2 Z5 12-A або Z5 Z1 Z1 W1 Y3 (W 2 )t W1 , 12-B де Z1, Z2 , Z 3, Z4 і Z 5 незалежно являють собою CR2, N, O, S або N-R1 за умови, що один з Z 1-Z5 є а томом вуглецю, до якого приєднана інша частина молекули; Y1 , Y2, Y3 і Y4 незалежно можуть бути С або N; W1, W2 і W3 незалежно являють собою CR4R4, S(O)r (r дорівнює 0-2), О, N-R1 за умови, що не відбувається утворення ні S-S, ні O-O, ні S-O зв'язку з утворенням насиченої кільцевої системи; R1, R2, R6 і R7 такі, як визначено в п. 1; R4 являє собою Н, необов'язково заміщений С1С6-алкіл, ОН (за умови, що обидва R4 не є ОН), С1-С6-алкокси, S-C1-С6-алкіл, -COOR6, -NR6R7, CONR6R7; або R4R4 можуть разом являти собою =O, або R4R4 разом з атомом вуглецю, до якого вони приєднані, можуть утворювати 5-8-членну спіросистему, що містить або не містить гетероатоми, вибрані з N, О, S(O)n (де n дорівнює 0-2), NR1; i t дорівнює 1-4. 29. Спосіб за п.12, де трициклічна гетероарильна група являє собою груп у формули: Z1 Z6 W3 Z2 Y1 Y4 Z3 Y2 Z4 Z5 Y3 Y2 Z6 O O Z5 (W 2 )t Y3 W1 Z2 або Y3 O O Y1 Y2 Z3 Z6 Z5 Z4 , 13-C де Z1, Z2 , Z 3, Z4 , Z5 і Z6 незалежно являють собою CR2, N, O, S або N-R1 за умови, що один з Z1-Z 6 є атомом вуглецю, до якого приєднана інша частина молекули; Y1 , Y2, Y3 і Y4 незалежно можуть бути С або N; W1, W2 і W3 незалежно являють собою CR4R4, S(O)r (r дорівнює 0-2), О, N-R1 за умови, що не відбувається утворення ні S-S, ні O-O, ні S-O зв'язку з утворенням насиченої кільцевої системи; R1, R2, R6 і R7 такі, як визначено в п. 1; R4 являє собою Н, необов'язково заміщений С1С6-алкіл, ОН (за умови, що обидва R4 не є ОН), С1-С6-алкокси, S-C1-С6-алкіл, -COOR6, -NR6R7, CONR6R7; або R4R4 можуть разом являти собою =O, або R4R4 разом з атомом вуглецю, до якого вони приєднані, можуть утворювати 5-8-членну спіросистему, що містить або не містить гетероатоми, вибрані з N, О, S(O)n (де n дорівнює 0-2), NR1; i t дорівнює 1-3. 30. Спосіб за п. 12, де трициклічна гетероарильна група являє собою груп у формули: Z1 (W 2)t Z8 Z2 , 13-A 13-B (W 2 )t Y4 Z1 O O Y1 W1 Y4 W1 Y4 Z4 Y3 Z3 Z3 Z4 Y1 (W 2)t W3 (W 2 )t Y4 O O Y1 14 Z3 O Z4 Y1 Y4 Y2 Y3 W1 O Z5 Z7 Z6 , 14-A 15 78047 16 Z7 Z8 Z1 Z2 Z3 O Y4 O Y1 Z6 Z5 Z2 Z3 Z4 (W 2t) Y1 Y3 Y2 (W 1 )3 Z4 W1 W1 O 14-B 15-B W1 або (W 2 )t Y3 Z2 Z1 Y2 O O Y1 Y4 Z3 Z6 Z2 Y3 Z3 Z4 Z4 (W 4)u Y2 Y3 W1 O Y1 W3 Y2 (W 4)u Z3 Z5 , 14-C де Z1, Z 2, Z3, Z 4, Z5 , Z 6, Z7 і Z 8 незалежно являють собою CR2, N, O, S або N-R1 за умови, що один з Z1-Z 8 є атомом вуглецю, до якого приєднана інша частина молекули; Y1 , Y2, Y3 і Y4 незалежно можуть бути С або N; W1 і W2 незалежно являють собою CR4R4, S(O)r (r дорівнює 0-2), О, N-R1 за умови, що не відбувається утворення ні S-S, ні O-O, ні S-O зв'язку з утворенням насиченої кільцевої системи; R1, R2, R6 і R7 такі, як визначено в п. 1; R4 являє собою Н, необов'язково заміщений С1С6-алкіл, ОН (за умови, що обидва R4 не є ОН), С1-С6-алкокси, S-C1-С6-алкіл, -COOR6, -NR6R7, CONR6R7; або R4R4 можуть разом являти собою =O, або R4R4 разом з атомом вуглецю, до якого вони приєднані, можуть утворювати 5-8-членну спіросистему, що містить або не містить гетероатоми, вибрані з N, О, S(O)n (де n дорівнює 0-2), NR1; i t дорівнює 1-2. 31. Спосіб за п. 12, де трициклічна гетероарильна група являє собою груп у формули: Z1 (W 2)t W5 Z2 Y1 Y4 O або (W 2)t Y4 Z1 W2 Y4 Z1 Y3 Y2 (W 3)u W4 W3 , 15-C де Z1, Z2, Z 3 і Z4 незалежно являють собою CR2, N, О, S або N-R1 за умови, що один з Z1-Z 4 є атомом вуглецю, до якого приєднана інша частина молекули; Y1 , Y2, Y3 і Y4 незалежно можуть бути С або N; W1, W 2, W3 , W4 і W5 незалежно являють собою CR4R4, S(O)r (r дорівнює 0-2), О або N-R1 за умови, що не відбувається утворенння ні S-S, ні O-O, ні SO зв'язку з утворенням насиченої кільцевої системи; R1, R2, R6 і R7 такі, як визначено в п. 1; R4 являє собою Н, необов'язкові заміщений С1-С6алкіл, ОН (за умови, що обидва R4 не є ОН), С1С6-алкокси, S-C1-С6-алкіл, -COOR6, -NR6R7, CONR6R7; або R4R4 можуть разом являти собою =O, або R4R4 разом з атомом вуглецю, до якого вони приєднані, можуть утворювати 5-8-членну спіросистему, що містить або не містить гетероатоми, вибрані з N, О, S(O)n (де n дорівнює 0-2), NR1; t дорівнює 1-3, i u дорівнює 1-3. 32. Похідне 6-бромпенему формули 16 Br O , 15-A S N O R O , 16 де R являє собою п-нітробензил. 33. Спосіб отримання 4-нітробензилу (5R,6S)-6бромпенем-3-карбоксилату за п. 32, який включає наступні стадії: (А) (і) взаємодію 6-амінопеніциланової кислоти з бромистоводневою кислотою в органічному розчиннику і воді з утворенням 6-бромпохідного 21 Br O S N COOH , 21 17 78047 18 і (іі) перетворення 6-бромпеніциланової кислоти 21 молекулярну циклізацію з використанням в п-нітробензил 6-бромпеніциланат 22 фосфі тного реагенту, що приводить до утворення 4-нітробензилу (5R,6S)-6-бромпенем-3Br S карбоксилату 16. 34. Спосіб за п. 1 для отримання сполуки формули І N A O COOR , 22 S де R являє собою п-нітробензил, дією 4B нітробензилброміду в присутності основи в органічному розчиннику; O N (В) окислення п-нітробензил 6-бромпеніциланату O 22 з утворенням п-нітробензил 6O бромпеніциланат-1-оксиду 23 R5 O ,I як визначено в п. 1, в якій 4-нітробензил (5R,6S)-6Br S бромпенем-3-карбоксилат 16, що використовується на стадії (а), отримують за п. 33. 35. Спосіб за п. 33 або п. 34, де 6N амінопеніциланову кислоту розчиняють в метанолі O COOR , 23 або ТГФ. 36. Спосіб за будь-яким одним з пп. 33-35, де ста(C) кип'ятіння п-нітробензил 6-бромпеніциланат-1дію (А) (і) здійснюють в присутності 48% мас. брооксиду 23 з 2-меркаптобензотіазолом в ароматичмистоводневої кислоти і розчину нітриту натрію ному розчиннику з утворенням 4-нітробензил (2R)або калію. 2-[(3S,4R)-4-(бензотіазол-2-ілдитіо)-3-бром-237. Спосіб за будь-яким одним з пп. 33-36, де стаоксоазетидин-1-іл]-3-метилбут-3-еноату 24; дію (А) (і) здійснюють при температурі від близько (D) розчинення 4-нітробензилу (2R)-2-[(3S,4R)-4-10°С до близько -30°С. (бензотіазол-2-ілдитіо)-3-бром-2-оксоазетидин-138. Спосіб за будь-яким одним з пп. 33-37, де осіл]-3-метилбут-3-еноату 24 в органічному розчинновою на стадії (А) (іі) є карбонат натрію або канику і взаємодію з органічною третинною основою лію, а органічним розчинником є ТГФ або ДМФА. з утворенням 4-нітробензил-2-[(3S,4R)-439. Спосіб за будь-яким одним з пп. 33-38, де аро(бензотіазол-2-ілдитіо)-3-бром-2-оксоазетидин-1матичним розчинником на стадії (С) є толуол або іл]-3-метилбут-2-еноату 25; ксилол. (Е) перетворення 4-нітробензил-2-[(3S,4R)-440. Спосіб за будь-яким одним з пп. 33-39, що (бензотіазол-2-ілдитіо)-3-бром-2-оксоазетидин-1включає послідовне перетворення сполуки 23 в іл]-3-метилбут-2-еноату 25 в 4-нітробензил 2сполуку 26, де не виділяють проміжні сполуки. [(3S,4R)3-бром-4-формілтіо-2-оксоазетидин-1-іл]41. Спосіб за п. 40, в якому 4-нітробензил 63-метилбут-2-еноату 26 внаслідок взаємодії в бромпеніциланат-1-оксид 23 піддають взаємодії з ароматичному органічному розчиннику з органічмеркаптобензотіазолом в ароматичному органічною кислотою в присутності суміші оцтовий ангідному розчиннику при кип'ятінні із зворотним холорид/органічна третинна основа і триалкіл- або тридильником і обробляють триетиламіном при тем арилфосфіну в інтервалі температур від близько – пературі приблизно від 0°С до -20°С з утворенням 10°С до близько –30°С; реакційної суміші, в яку послідовно завантажують (F) пропущення озонованого кисню через розчин органічну кислоту і ангідрид, органічну третинну 4-нітробензилу 2-[(3S,4R)-3-бром-4-формілтіо-2основу і триалкіл- або триарилфосфін при темпеоксоазетидин-1-іл]-3-метилбут-2-еноату 26 в оргаратурі від приблизно -10°С до приблизно -40°С. нічному розчиннику протягом 3-4 год. при температурі від -70°С до -90°С і подальшу внутрішньо Даний винахід відноситься до нового способу отримання похідних 6-алкіліденпенему, які можуть мати значення як інгібіторів b-лактамази і антибактерійних агентів широкого спектра дії. b-Лактамази являють собою ферменти, що продукуються бактеріями, які гідролізуют bлактамні антибіотики і тому є основною причиною бактерійної резистентності. Пеніциліни і цефалоспорини є найчастіше і широко використовуваними в клініці b-лактамними антибіотиками. Однак розвиток резистентності різних патогенів до bлактамних антибіотиків діє руйнівним чином на ефективність лікування бактерійних інфекцій. [Coleman, К. Expert Opin. Invest. Drugs 1995, 4, 693; Sutherland, R. Infection 1995, 23 (4), 191; Bush, K. Cur. Pharm. Design 1999, 5, 839-845]. Найбільш істотним відомим механізмом розвитку стійкості бактерій до b-лактамних антибіотиків є продукування серинових b-лактамаз класу А, класу В і класу С. Ці ферменти руйнують b-лактамні антибіотики, приводячи в результаті до втрати антибактерійної активності. Ферменти класу А переважно гідролізуют пеніциліни, тоді як лактамази класу С мають субстратний профіль, сприяючий гідролізу 19 78047 20 цефалоспорину [Bush, К.; Jacoby, G.A.; Medeiros, A.A. Antimicrob. Agents Chemother. 1995, 39, 1211]. До теперішнього часу описано понад 250 різних bлактамаз [Payne, D.J,: Du, W and Bateson, J.H. Exp. Opin. Invest. Drugs 2000, 247] і існує потреба в новому поколінні інгібіторів b-лактамаз з широким спектром дії. Бактерійну резистентність до антибіотиків, що розглядаються, можна було б значно знизити введенням b-лактамних антибіотиків в поєднанні із сполукою, яка інгібує вищезгадані ферменти. Комерційно доступні інгібітори b-лактамаз, такі як клавуланова кислота, сулбактам і тазобактам, всі ефективні у відношенні патогенів, що продукують ферменти класу А. З'ясований механізм інактивації b-лактамаз класу А (таких як РСІ і ТЕМ-1). [Bush, К.; Antimicrob. Agents Chemother. 1993, 37, 851; Yang, Y.; Janota, K.; Tabei, K.; Huang, N.I Seigal, M.M.; Lin, Y.I.; Rasmussen, B.A. і Shalaes, D.M. J. Biol. Chem. 2000, 35, 26674-26682]. Однак вказані сполуки неефективні відносно організмів, що продукують ферменти класу С. Клавуланову кислоту використовують в комбінації з амоксициліном і тикарциліном; аналогічно сулбактам - з ампіциліном, а тазобактам - з піперациліном. У патентах і заявках ЕР 0041768А, ЕР 0120613А, ЕР 0150781, ЕР 0210065, WO 87/00525, ЕР 0003960В1, GB 2042514А, GB 2042515А, ЕР 0087792А, ЕР 0115308А, GB 2124614В, ЕР 0150984А, ЕР 0087792, ЕР 0115308, ЕР 81301683.9, ЕР 84301255.0, ЕР 85100520.7, ЕР Даний винахід відноситься до способу отри85100521.5, ЕР 86305585.1, ЕР 86305584, ЕР мання сполуки формули І 88311786.3, ЕР 88311787.1, ЕР 87300193.7, WO 93/03042, WO 94/10178, WO 95/28935 і WO 95/17184 як інгібітори b-лактамаз описуються пенеми із заміщеною метиленовою групою в положенні 6. В Європейському патенті ЕР 0232966В1 описаний спосіб отримання пенемів із заміщеною метиленовою групою в положенні 6 і їх проміжних сполук. Згідно з цим патентом, сполуки загальної формули І отримують чотирьохстадійним способом з п-метоксибензил (5R,6S)-6-бромпенем-3карбоксилату А і альдегіду в присутності пірофорде: них реагентів, таких як н-бутиллітій/дифеніламін один із замісників А або В означає водень, а або біс(триметилсиліл)амід літію при -78°С (Схема інший означає арил, необов'язково заміщений од1). Третя стадія вказаного способу, стадія відновним або двома R2, гетероарил, необов'язково заного елімінування, дає Ε і Ζ ізомерні сполуки F і D міщений одним або двома R2, конденсований бів співвідношенні 5:1, відповідно. циклічний гетероарил, необов'язково заміщений одним або двома R2, конденсований трициклічний гетероарил, необов'язково заміщений одним або двома R2, циклоалкіл, необов'язково заміщений одним або двома R2, алкіл, необов'язково заміщений одним або двома R2, алкеніл, необов'язково заміщений одним або двома R2, алкініл, необов'язково заміщений одним або двома R2, насичену або частково насичену гетероциклічну гр упу, необов'язково заміщену одним або двома R2; і де будь-який з вказаних гетероарильних залишків, що містить NH-группу в циклі, може бути необов'язково заміщений R1 при вказаному атомі азоту; R5 являє собою Н, С1-С6-алкіл, С5-С6циклоалкіл або СHR3ОСО-С1-С6-алкіл або сіль; R1 являє собою Н, необов'язково заміщений алкіл, необов'язково заміщений арил, необов'язково заміщені гетероарил або моно- або біциклічні 21 78047 22 насичені гетероциклічні групи, необов'язково заС1-С6-алкіларилоксигетероарил; міщений циклоалкіл, необов'язково заміщений R3 являє собою водень, С1-С6-алкіл, С5-С6алкеніл, необов'язково заміщений алкініл за умоциклоалкіл, необов'язково заміщений арил, необови, що атом вуглецю, який безпосередньо пов'язав'язково заміщений гетероарил; ний з N, не повинен входити до складу подвійного R6 і R7 незалежно являють собою Н, необов'яабо потрійного зв'язку; необов'язково заміщений зково заміщений С1-С6-алкіл, необов'язково заміперфторалкіл, необов'язково -S(O)p-заміщений щений арил, необов'язково заміщений гетероарил, алкіл або арил, де ρ дорівнює 0-2, необов'язково необов'язково заміщений С1-С6-алкіларил, необозаміщений -С=О-гетероарил , необов'язково замів'язково заміщений арилалкіл, необов'язково защений -С=О-арил, необов'язково заміщений -С=Оміщений гетероарилалкіл, необов'язково заміщеалкіл, необов'язково заміщений -С=О-циклоалкіл , ний C1-С6-алкілгетероарил, R6 і R7 можуть разом необов'язково заміщену моно-або біциклічну насиутворювати 3-7-членну насичену циклічну систему, чену -СО-гетероциклічну груп у , необов'язково = що необов'язково містить один або два гетерозаміщений С1-С6-алкіларил, необов'язково заміатоми, таких як N-R1, О, S=(O)n , де n дорівнює 0-2. щений С1-С6-алкілгетероарил, необов'язково заВказаний спосіб включає: міщений арил-С1-С6-алкіл, необов'язково заміще(a) конденсацію відповідним чином заміщеного ний гетероарил-С1-С6-алкіл, необов'язково альдегіду 17 заміщену моно- або біциклічну насичену С1-С6алкілгетероциклічну групу, необов'язково заміщений арилалкеніл, що містить 8-16 атомів вуглецю, CONR6R7, -SO2NR6R7 , необов'язково заміщений арилалкоксіалкіл, необов'язково заміщений -алкілде А' являє собою А, такий, як визначено виО-алкіларил, необов'язково заміщений -алкіл-Още, коли В являє собою водень; або В, такий, як алкілгетероарил, необов'язково заміщений ариловизначено вище, коли А являє собою водень, з ксіалкіл, необов'язково заміщений гетероарилоксіпохідним 6-бромпенему структури 16 алкіл, необов'язково заміщений арилоксіарил, необов'язково заміщений арилоксигетероарил, необов'язково заміщений С1-С6алкіларилоксіарил, необов'язково заміщений С1С6-алкіларилоксигетероарил, необов'язково заміщені алкіларилоксіалкіламіновмісні групи, необов'язково заміщені алкоксикарбоніл, необов'язково заміщений арилоксикарбоніл або необов'язково де R являє собою пара-нітробензил, в присутзаміщений гетероарилоксикарбоніл; ності кислоти Льюїса і м'якої основи при низькій R2 являє собою водень, необов'язково замітемпературі, яка дає проміжний продукт альдольщений С1-С6-алкіл, необов'язково заміщений С2ної конденсації 18 С6-алкеніл, необов'язково заміщений С2-С6алкініл, галоген, ціано, N-R6R7, необов'язково заміщений С1-С6-алкокси, гідрокси; необов'язково заміщений арил, необов'язково заміщений гетероарил, COOR6, необов'язково заміщені алкіларилоксіалкіламіновмісні групи, необов'язково заміщені арилокси, необов'язково заміщений гетероарилокси, необов'язково заміщений С3-С6-алкенілокси, необов'язково заміщений С3-С6-алкінілокси, С1де А' і R такі, як визначено вище; С6-алкіламіно-С1-С6-алкокси, алкілендіокси, не(b) взаємодію проміжної сполуки 18 з хлоранобов'язково заміщену арилокси-С1-С6гідридом або ангідридом кислоти формули (R8)Cl алкіламіновмісну гр уп у, С1-С6-перфторалкіл, неабо- (R8)2O або з тетрагалогенметаном формули обов'язково S(О)q -заміщений С1-С6-алкіл, необоС(Х1) 4 і трифенілфосфіном, де R8 являє собою в'язково S(О)q -заміщений арил, де q дорівнює 0,1 алкіл-SО2, арил-SО2, алкіл-СО або арил-СО; X1 або 2, CONR6R7, гуанідино- або включену в цикл являє собою Вr, І або СІ; з утворенням проміжної гуанідиногрупу, необов'язково заміщений алкіласполуки 19 рил, необов'язково заміщений арилалкіл, необов'язково заміщений С1-С6-алкілгетероарил, необов'язково заміщений гетероарил-С1-С6-алкіл, необов'язково заміщену моно- або біциклічну насичену С1-С6-алкілгетероциклічну групу, необов'язково заміщений арилалкеніл, що містить від 8 до 16 атомів вуглецю, SO2NR6R7, необов'язково заміщений арилалкілоксіалкіл, необов'язково заміде R9 являє собою Х1 або OR8, де R8, Х1, А1 і R щений арилоксіалкіл, необов'язково заміщений такі, як визначено вище; і гетероарилоксіалкіл, необов'язково заміщений (с) перетворення проміжної сполуки 19 в цізрилоксіарил, необов'язково заміщений арилоксильову сполуку формули І, де R5 являє собою вогетероарил, необов'язково заміщений гетероаридень, за допомогою відновного елімінування; і, локсіарил, необов'язково заміщений С1-С6якщо необхідно, подальше перетворення в фаралкіларилоксіарил або необов'язково заміщений 23 78047 24 мацевтично прийнятну сіль або в складний ефір, іл]-3-метилбут-3-еноату 24; де R5 являє собою С1-С6-алкіл, С5-С6-циклоалкіл (D) розчинення 4-нітробензил (2R)-2-[(3S, 4R)або СHR3ОСО-С1-С6-алкіл. 4-(бeнзoтiaзoл-2-iлдитio)-3-бром-2-оксоазетидин-1Даний винахід також відноситься до похідного іл]-3-метилбут-3-еноату 24 в органічному розчин6-бромпенему структури 16, нику і взаємодія з органічною третинною основою з утворенням 4-нітробензил 2-[(3S, 4R)-4(бeнзoтiaзoл-2-iлдитio)-3-бpoм-2-oкcoaзeтидин-1iл]-2-мeтилбyт-2-eнoaтy 25; (Ε) перетворення 4-нітробензил 2-[(3S, 4R)-4(бeнзoтiaзoл-2-iлдитio)-3-бpoм-2-оксоазетидин-1іл]-3-метилбут-2-еноату 25 в 4-нітробензил 2-[(3S, 4R) 3-бром-4-формілтіо-2-оксоазетидин-1-іл]-3метилбут-2-еноат 26 внаслідок взаємодії в аромаде R являє собою п-нітробензил, що використичному органічному розчиннику з органічною кистовується на вищезгаданій стадії (а). лотою в присутності суміші оцтовий ангідДаний винахід, крім того, відноситься до спорид/органічна третинна основа і тріалкіл- або собу отримання 4-нітробензил-(5R, 6S)-6тріарилфосфіну в інтервалі температур від близьбромпенем-3-карбоксилату формули 16, який ко -10°С до близько -30°С; включає наступні стадії: (F) пропущення озонованого кисню через роз(А) (і) взаємодія 6-амінопеніциланової кислоти чин 4-нітробензил 2-[(3S, 4R) 3-бром-4-формілтіоз бромистоводневою кислотою в органічному роз2-оксоазетидин-1-іл]-3-метилбут-2-еноату 26 в чиннику і воді з утворенням 6-бромпохідного 21 органічному розчиннику протягом 3-4 год. при температурі від -70°С до -90°С і подальшу вн утрішньомолекулярну циклізацію з використанням фосфітного реагенту, що приводить до утворення 4нітробензил (5R, 6S)-6-бромпенем-3-карбоксилату 16. Спосіб зручно здійснювати, використовуючи наступні стадії: Стадія 1. Розчинення 6-амінопенідиланової кислоти 20 в органічному розчиннику (переважно метанолі або ТГФ) і воді для утворення 6і (іі) перетворення 6-бромпеніциланової кислобромпохідного 21 в присутності 48%мас., бромисти 21 в п-нітробензил 6-бромпеніциланат 22 товодневої кислоти і розчину нітриту натрію або калію при температурі від -10°С до -30°С. 6Бромпохідне пеніциланової кислоти 21 можна або виділити, або in situ перетворити в п-нітробензил 6-бромпеніциланат 22 дією 4-нітробензилброміду в присутності органічних або неорганічних основ (переважно карбонату натрію або калію) в органічному розчиннику (переважно ТГФ або ДМФА). Стадія 2. 4-Нітробензил 6-бромпеніциланат 22, отриманий способом, описаним для стадії 1, можна виділити або не виділяючи перетворити в де R являє собою п-нітробензил, дією 44-нітробензил 6-бромпеніциланат-1-оксид 23 в тій нітробензилброміду в присутності основи в органіже колбі ("in the same pot") (тобто продовжуючи чному розчиннику; стадію 1) шляхом окислення 4-нітробензил 6(B) окислення п-нітробензил 6бромпеніциланату 22 будь-якими відомими окисбромпеніциланату 22 з утворенням 4-нітробензил лювачами, такими як 3-хлорпероксибензойна кис6-бромпеніциланат-1-оксиду 23 лота (mcpba) або пероксид водню. Стадія 3. Продукт стадії 2, а саме 4нітробензил 6-бромпеніциланат-1-оксид 23, можна перетворити в 4-нітробензил (2R)-2-[(3S, 4R)-4(бензотіазол-2-ілдитіо)-3-бром-2-оксоазетидин-1іл]-3-метилбут-3-еноат 24 кип'ятінням 4нітробензил 6-бромпеніциланат-1-оксиду 23 з 2меркаптобензотіазолом в ароматичному розчиннику (переважно в толуолі або ксилолі). Стадія 4. Продукт стадії 3, а саме 4нітробензил (2R)-2-[(3S, 4R)-4-(бензотіазол-2. ілдитіо)-3-бром-2-оксоазетидин-1-іл]-3-метилбут-3(C) кип'ятіння із зворотним холодильником 4еноат 24, можна розчинити в органічному розчиннітробензил 6-бромпеніциланат-1-оксиду 23 з 2нику (переважно в толуолі або ксилолі) і при взаємодії з органічною третинною основою (переважно меркаптобензотіазолом в ароматичному розчинтриетиламіном) при температурі навколишнього нику з утворенням 4-нітробензил (2R)-2-[(3S, 4R)середовища отримати 4-нітробензил 2-[(3S, 4R)-44-(бензотіазол-2-ілдитіо)-3-бром-2-оксоазетидин-1 25 78047 26 (бензотіазол-2-ілдитіо)-3-бром-2-оксоазетидин-1формули 16 приведені в таблиці 1. іл]-3-метилбут-2-еноат 25. Стадія 7. Взаємодія 4-нітробензил (5R, 6S)-6Стадія 5. Продукт стадії 4, а саме 4бромпенем-3-карбоксилату 16 з відповідним чином нітробензил 2-[(3S, 4R)-4-(бензотіазол-2-ілдитіо)-3заміщеними альдегідами (визначеними вище) для бром-2-оксоазетидин-1-іл]-3-метилбут-2-еноат 25, здійснення стадії альдольної конденсації можна можна перетворити в 4-нітробензил 2-[(3S, 4R-3провести в присутності кислоти Льюїса (переважно бром-4-формілтіо-2-оксоазетидин-1-іл]-3безводного MgBr2 або ефірату MgBr2) метилбут-2-еноат 26 взаємодією з органічною кислотою (переважно мурашиною) в ароматичному органічному розчиннику (переважно в толуолі) в присутності суміші оцтовий ангідрид/органічна третинна основа (переважно піридин) і тріалкілабо тріарилфосфіну (переважно трифенілфосфіну) при температурі приблизно від -10°С-до приблизно -30°С (переважно приблизно від~15°С до 20°С). і органічної третинної основи (переважно Et3N, Альтернативний варіант здійснення даного піридину, диметиламінопіридину (DMAP) або тріавинаходу відноситься до послідовного перетволкіламіну діізопропілетиламіну) в апротонному рення сполуки 23 в сполуку 26 без виділення прополярному органічному розчиннику(ах) (переважно міжних сполук. ТГФ і/або ацетонітрилі) при температурі від -10°С Продукт стадії 2, а саме 4-нітробензил 6до -40°С. Проміжні альдольні продукти загальної бромпеніциланат-1-оксид 23, піддають взаємодії з формули 10 "функціоналізують in situ ("in the same меркаптобензотіазолом в ароматичному органічpot") при температурі від 0°С до -10°С і отримують ному розчиннику (переважно в толуолі) при кип'я складноефірну відхідну гр упу: наприклад, з хлоратінні із зворотним холодильником протягом 1-3год. нгідридом або ангідридом оцтової кислоти отриі обробляють триетиламіном при температурі від 0 мують ацетат, з ангідридом трифторметансульфодо -20°С протягом 3-4год. Після вказаної обробки кислоти - трифлат, з тозилхлоридом - тозилат; в реакційну суміш завантажують послідовно оргаабо, якщо сполуки формули 18 виділяють, їх можнічну кислоту (переважно мурашину кислоту) і анна перетворити в галогенпохідні взаємодією з тетгідрид (оцтовий ангідрид), органічну третинну осрагалогенметаном і трифенілфосфіном при кімнанову (переважно піридин) і тріалкіл- або тній температурі у відповідному органічному тріарилфосфат при температурі від -10°С до розчиннику, переважно СН2СI2. 40°С. Стадія 8. Останню стадію, а саме стадію відСтадія 6. 4-Нітробензил 2-[(3S, 4R)-3-бром-4новного елімінування, яка дає сполуку загальної формілтіо~2-оксоазетидин-1-іл]-3-метилбут-2формули І, можна здійснити розчиненням суміші еноат 26 - продукт стадії 5 або вищезгаданої поальдольних продуктів в органічному розчиннику слідовності перетворень - вміщують в органічний (переважно ТГФ/ацетонітрил) при рН 6,0-8,5, перозчинник (переважно етилацетат) при темперареважно при рН 6,5-7,0 фосфатного буфера, і дією турі від -70°С до -90°С і протягом 3-4год. пропусактивованого металу, такого як цинк, олово або кають озонований кисень, потім здійснюють внуталюміній, при температурі навколишнього середорішньомолекулярну циклізацію, використовуючи вища (переважно при 20°С-35°С). Продукт у вифосфі тний реагент (переважно триметилфосфіт). гляді солі лужного металу можна очистити колонПродукт 4-нітробензил (5R,6S)-6-бромпенем-3ковою хроматографією із зверненою фазою. карбоксилат 16 кристалізують з суміші етилацеАльтернативно, стадії 7 і 8 можна проводити таттексан. послідовно в одній колбі ("in the same pot") без Даний винахід також відноситься до сполуки, виділення проміжного альдольного продукту. представленої наступною формулою (16): Останню стадію, а саме стадію відновного елімінування, можна здійснити розчиненням альдольного продукту в органічному розчиннику (переважно ТГФ або ацетонітрилі) і фосфатному буфері з рН 6,5-7,0 і гідруванням над Pd/C при тиску 10-100фунт/кв.дюйм (переважно при 40фунт/кв.дюйм). Ілюстрацією даного винаходу служить типовий приклад, приведений на схемі А. На схемі А покаОписанний вище спосіб (Стадія 1 - Стадія 6) зані відповідні умови реакції, однак можна викориотримання сполуки, представленої формулою 16, стати і інші реакційні умови, не виходячи за межі є проміжною ланкою в отриманні пенемів із заміоб'єму даного винаходу. Наприклад, можна викощеною метиленовою групою в положенні 6 загаристати меншу або більшу тривалість протікання льної формули І. реакції; звичайно чим довше триває реакція, тим Сполука, представлена формулою 16, являє більш повно вона проходить. собою кристалічне похідне (параметри дифракції рентгенівських променів в порошкоподібному зразку приводяться в Таблиці 2). Кристалічна природа вказаної проміжної сполуки додає йому стабільності і тим самим збільшує термін зберігання. Дані по стабільності сполуки 27 78047 28 ково заміщений арилалкілоксіалкіл, необов'язково заміщений -алкіл-О-алкіларил, необов'язково заміщений -алкіл-О-алкілгетероарил, необов'язково заміщений арилоксіалкіл, необов'язково заміщений гетероарилоксіалкіл, необов'язково заміщений арилоксіарил, необов'язково заміщений арилоксигетероарил, необов'язково заміщений С1-С6алкіларилоксіарил, необов'язково заміщений С1С6-алкіларилоксигетероарил, необов'язково заміщені алкіларилоксіалкіламіновмісні групи, необов'язково заміщені алкоксикарбоніл, необов'язково Даний винахід відноситься до нового способу заміщений арилоксикарбоніл, необов'язково заміотримання сполуки формули І щений гетероарилоксикарбоніл. Переважними R1 групами є водень, необов'язково заміщений алкіл, необов'язково заміщений арил, -СО -(С1-С6)= алкіл, С3-С6-алкеніл, С3-С6-алкініл, необов'язково заміщений циклоалкіл, SО2-алкіл, SO2-арил, необов'язково заміщені гетероциклічні групи, CONR6R7 і необов'язково заміщений гетероарил. R2 являє собою водень, необов'язково заміщений С1-С6-алкіл, необов'язково заміщений С2С6-алкеніл, що містить 1 або 2 подвійних зв'язки, необов'язково заміщений С2-С6-алкініл, що містить 1 або 2 потрійних зв'язки, галоген, ціано, Nде R6R7, необов'язково заміщений С1-С6-алкокси, один із замісників А або В означає водень, а гідрокси; необов'язково заміщений арил, необов'яінший означає арил, необов'язково заміщений одзково заміщений гетероарил, COOR6, необов'язконим або двома R2, гетероарил, необов'язково заво заміщені алкіларилоксіалкіламіновмісні групи, міщений одним або двома R2, конденсований тринеобов'язково заміщені арилокси, необов'язково циклічний гетероарил, необов'язково заміщений заміщений гетероарилокси, необов'язково заміщеодним або двома R2, циклоалкіл, необов'язково ний С3-С6-алкенілокси, необов'язково заміщений заміщений одним або двома R2, алкіл, необов'язС3-С6-алкінілокси, С1-С6-алкіламіно-С1-С6ково заміщений одним або двома R2, алкеніл, неалкокси, алкілендіокси, необов'язково заміщений обов'язково заміщений одним або двома R2, алкіарилокси-С1-С6-алкіламіно, С1-С6-перфторалкіл, ніл, необов'язково заміщений одним або двома R2, необов'язково S(О)q -заміщений С1-С6-алкіл, ненасичену або частково насичену гетероциклічну обов'язково S(O)q - заміщений арил, де q дорівнює груп у, необов'язково заміщену одним або двома 0, 1 або 2, CONR6R7, гуанідино- або включену в R2; цикл гуанідиногрупу, необов'язково заміщений С1R5 являє собою Н, С1-С6-алкіл, С5-С6С6-алкіларил, необов'язково заміщений арилалкіл, циклоалкіл або CHR3OCO-C1-C6-aлкiл (утворюючі необов'язково заміщений С1-С6-алкілгетероарил, складні ефіри, здатні гідролізуватися in vivo) або необов'язково заміщений гетероарил-С1-С6-алкіл, метали, такі як Na, К або Са (утворюючі солі). необов'язково заміщену моно- або біциклічну наR1 являє собою Н, необов'язково заміщений сичену С1-С6-алкілгетероциклічну групу, необов'яС1-С6-алкіл, необов'язково заміщений арил, незково заміщений арилалкеніл, що містить від 8 до обов'язково заміщені гетероарил або моно- або 16 атомів вуглецю, SO2NR6R7, необов'язково забіциклічні насичені гетероциклічні групи, необов'яміщений арилалкілоксіалкіл, необов'язково замізково заміщені С3-С7-циклоалкіл, необов'язково щений арилоксіалкіл, необов'язково заміщений заміщений С3-С6-алкеніл, необов'язково заміщегетероарилоксіалкіл, необов'язково заміщений ний С3-С6-алкініл за умови, що атом вуглецю, арилоксіарил, необов'язково заміщений арилоксиякий безпосередньо зв'язаний з N, не повинен гетероарил, необов'язково заміщений гетероаривходити до складу подвійного або потрійного зв'ялоксіарил, необов'язково заміщений С1-С6зку; необов'язково заміщений С1-С6алкіларилоксіарил, необов'язково заміщений С1перфторалкіл, необов'язково -S(О)р-заміщений С6-алкіларилоксигетероарил, необов'язково заміалкіл або арил, де ρ дорівнює 2, необов'язково щений арилоксіалкіл, необов'язково заміщений заміщений -С=О-гетероарил , необов'язково замігетероарилоксіалкіл, необов'язково заміщені алкіщений -С=О-арил, необов'язково заміщений -С=Оларилоксіалкіламіновмісні групи. Переважними R2 (С1-С6)-алкіл, необов'язково заміщений -С=О-(С3групами є водень, необов'язково заміщений алкіл, С6)циклоалкіл, необов'язково заміщену моно- або необов'язково заміщений алкокси, необов'язково біциклічну насичену -С=О-гетеррциклічну групу , заміщений гетероарил, галоген, CN, гідрокси, ненеобов'язково заміщений С1-С6-алкіларил, необообов'язково заміщена гетероциклічна група, в'язково заміщений С1-С6-алкілгетероарил, неCONR6R7, COOR6 , необов'язково заміщений арил, обов'язково заміщений арил-С1-С6-алкіл, необоS(O)q -алкіл і S(O)q -арил; в'язково заміщений гетероарил-С1-С6-алкіл, R3 являє собою водень, С1-С6-алкіл, С5-С6необов'язково заміщену моно- або біциклічну нациклоалкіл, необов'язково заміщений арил, необосичену С1-С6-алкілгетероциклічну групу, необов'яв'язково заміщений гетероарил; зково заміщений арилалкеніл, що містить 8-16 R4 являє собою водень, необов'язково заміатомів вуглецю, -CONR6R7, -SO2NR6R7, необов'яз 29 78047 30 щений С1-С6-алкіл; один з R4 являє собою ОН, алкіл-О-, R6R7N-алкіл- і -S(О)s-гетероарил (де s С1-С6-алкокси, -S-C1-С6-алкіл, COOR6, -NR6R7, дорівнює 0-2). Переважні замісники для алкілу, CONR6R7; або R4R4 можуть разом являти собою алкенілу, алкінілу і циклоалкілу включають гало=O, або R4R4 разом з атомом вуглецю, до якого ген, нітро, арил, гетероарил, алкоксикарбоніл-, вони приєднані, можуть утворювати 5-8-членну алкокси, -алкоксіалкіл, -ціано, гідрокси і -N-R6R7. спіросистему, що містить або не містить гетероТермін арил означає ароматичний вуглеводатоми, вибрані з N, О, S=(O)n (де n дорівнює 0-2) і невий залишок, вибраний з наступних груп: феніN-R1; льної, a-нафтильної, b-нафтильної, біфенільної, R6 і R7 незалежно являють собою Н, необов'яантрильної, тетрагідронафтильної, флуоренільної, зково заміщений С1-С6-алкіл, необов'язково заміінданільної, біфеніленільної і аценафтенільної. щений арил, необов'язково заміщений гетероарил, Терміном гетероарил визначається ароматичнеобов'язково заміщений С1-С6-алкіларил, необона гетероциклічна система (моноциклічна або бів'язково заміщений арилалкіл, необов'язково зациклічна), дететероарильні залишки вибирають з: міщений гетероарилалкіл, необов'язково заміще(1) фурану, тіофен у, індолу, азаіндолу, оксазолу, ний С1-С6-алкілгетероарил; R6 і R7 можуть разом тіазолу, ізоксазолу, ізотіазолу, імідазолу, Nутворити 3-7-членну насичену циклічну систему, метилімідазолу, піридину, піримідину, піразину, що необов'язково містить один або два гетеропіролу, N-метилпіролу, піразолу, N-метилпіразолу, атоми, таких як N-R1, О, S=(O)n , де n дорівнює 0-2. 1,3,4-оксадіазолу, 1,2,4-триазолу, 1-метил-1,2,4Хімічні визначення триазолу, 1Н-тетразолу, 1-метилтетразолу, бензоТермін алкіл означає алкільні групи, як з лінійксазолу, бензотіазолу, бензофурану, бензізоксаним, так і з розгалуженим ланцюгом, що складазолу, бензімідазолу, N-метилбензімідазолу, азаються з 1-12 атомів вуглецю, переважно 1-6 атомів бензімідазолу, індазолу, хіназоліну, хіноліну і вуглецю. ізохіноліну; (2) біциклічних ароматичних гетероциТермін алкеніл означає алкенільні групи, як з клів, де фенільний, піридиновий, піримідиновий лінійним, так і з розгалуженим ланцюгом, що склаабо піридазиновий цикл конденсований з: (а) 5даються з 2-8 атомів вуглецю, що містять щонайчленним ароматичним (ненасиченим) гетероцикменше один подвійний зв'язок і, що не містять полом, що містить один атом азоту; (b) 5- або 6трійного зв'язку, переважно алкенільна група членним ароматичним (ненасиченим) гетероцикмістить один або два подвійних зв'язки. Такі алкелом, що містить два атоми азоту; (с) 5-членним нільні групи можуть існувати у вигляді Е- і Zароматичним (ненасиченим) гетероциклом, що ізомерів; сполуки згідно з даним винаходом вклюмістить один атом азоту разом або з одним аточають обидва ізомери. У випадку алкенільної грумом кисню, або з одним атомом сірки; або (d) 5пи атом вуглецю, який входить до складу подвійчленним ароматичним (ненасиченим) гетероцикного зв'язку, не повинен бути сполучений з лом, що містить один гетероатом, вибраний з О, N гетероатомами, такими як О, S або N-R1. або S. Термін алкініл означає алкінільні групи, як з ліЯкщо арил або гетероарил визначають як нійним, так і з розгалуженим ланцюгом, що скла«необов'язково заміщений», один або два з ниждаються з 2-6 атомів вуглецю, що містять щонайченаведених є можливими замісниками: нітро, менше один потрійний зв'язок, переважно арил, -гетероарил, алкоксикарбоніл-, -алкокси, алкінільна група містить один або два потрійних алкоксіалкіл, алкіл-О-С2-С4-алкіл-О-, -ціано, зв'язки. У випадку алкінільної групи атом вуглецю, галоген, -гідрокси, -N-R6R7, -трифторметил, який входить до складу подвійного або потрійного трифторметокси, арилалкіл, алкіларил, R6R7Nзв'язку, не повинен бути сполучений з гетероатоалкіл-, НО-С1-С6-алкіл-, алкоксіалкіл-, алкіл-S-, мами, такими як О, S або N-R 1. SO2N-R6R7, -SO2NH-R6, -CO 2H, CONR6R7, арил-О-, Термін циклоалкіл відноситься до аліциклічної гетероарил-О-, -S(O)s-apim (де s=0-2), -aлкiл-Oвуглеводневої групи, що містить 3-7 атомів вуглеaлкiл-NR6R7, -алкіларил-O-алкіл-N-R6R7, С1-С6цю. Термін перфторалкіл в даній заявці викорисалкіл, алкеніл, алкініл, циклоалкіл, алкоксіалкіл-Отовують для позначення насичених аліфатичних і -S(О)s-гетероарил (де s дорівнює 0-2). Переважні вуглеводневих гр уп, як з лінійним, так і з розгалузамісники для арилу і гетероарилу включають алженим ланцюгом, що містять щонайменше один кіл, галоген, -N-R6R7, трифторметил, атом вуглецю і два або декілька атомів фтору. трифторметокси, арилалкіл і алкіларил. Приклади перфторалкільних груп включають CF3, Арилалкіл визначають як арил-С1-С6-алкіл. CH2CF3, CF2CF3 і CH(CF3)2. Термін галоген ознаАрилалкільні групи включають бензил, 1чає СІ, Br, F і І. фенілетил, 2-фенілетил, 3-фенілпропіл, 2Якщо алкіл, алкеніл, алкініл або циклоалкіл фенілпропіл і ним подібні. Термін «необов'язково визначають як «необов'язково заміщений», можзаміщений» відноситься до алкільної або арильної ливими замісниками є один або два з наступних: частини, незаміщеної або заміщеної 1 або 2 заміснітро, -арил, -гетероарил, алкоксикарбоніл-, никами, як визначено вище. алкокси, -алкоксіалкіл, алкіл-О-С2-С4-алкіл-О-, Алкіларил визначають як С1-С6-алкіларил-. ціано, -галоген, -гідрокси, -NR6R7, -трифторметил, Термін «необов'язково заміщений» відноситься до трифторметокси, арилалкіл, алкіларил, R6R7Nалкільної або арильної частини, незаміщеної або алкіл-, НО-С1-С6-алкіл-, алкоксіалкіл-, алкіл-S-, заміщеної 1 або 2 замісниками, як визначено виSO2NR6R7, -SO2NHR6, -CO 2H, CONR6R7, арил-О-, ще. гетероарил-О-, -S(O)s-apmi (де s дорівнює 0-2), Гетероарил-С1-С6-алкіл означає гетероарилалкіл-О-алкіл-NR6R7, -aлкiлapил-O-aлкiл-N-R6R7, заміщену алкільну груп у, що являє собою алкільС1-С6-алкіл, алкеніл, алкініл, циклоалкіл, алкоксіний ланцюг з 1-6 атомів'вуглецю (лінійний або роз 31 78047 32 галужений). Алкілгетероарильні частини включавизначенні або арильний, або гетероарильний ють гетероарил-(СН2)1-6- і до них подібні групи. залишок може бути сполучений з іншою частиною Термін «необов'язково заміщений» відноситься до молекули. Термін «необов'язково заміщений» відалкільної або гетероарильної частини, незаміщеноситься до арильного залишку або гетероарильної або заміщеної 1 або 2 замісниками, як визнаного залишку, незаміщеного або заміщеного 1 або чено вище. 2 замісниками, як визначено вище. С1-С6-Алкілгетероарил означає алкільний лаАлкіларилоксіарил визначають як арил-Онцюг з 1-6 атомів вуглецю (лінійний або розгалуарил-С1-С6-алкіл-. Термін «необов'язково заміщежений), приєднаний до гетероарильної групи, яка ний» відноситься до арильного залишку, незаміпов'язана з іншою частиною молекули, тобто С1щеного або заміщеного 1 або 2 замісниками, виС6-алкілгетероарил-. Термін «необов'язково замізначеними вище. щений» відноситься до алкільної або гетероариАлкіларилоксигетероарил визначають як гетельної частини, незаміщеної або заміщеної 1 або 2 роарил-О-арил-С1-С6-алкіл-. Термін «необов'яззамісниками, як визначено вище. ково заміщений» відноситься до арильного або Насичені або частково насичені гетероциклічні гетероарильного залишку, незаміщеного або загрупи означають такі гетероциклічні залишки, як: міщеного 1 або 2 замісниками, визначеними вище. азиридиніл, азетидиніл, 1,4-діоксаніл, гексагідроаАлкіларилоксіалкіламіновмісні групи визначазепініл, піперазиніл, піперидиніл, піролідиніл, ють як R6R7N-C1-C6-алкіл-O-арил-С1-С6-алкіл. морфолініл, тіоморфолініл, дигідробензімідазоліл, Термін «необов'язково заміщений» відноситься до дигідробензофураніл, дигідробензотієніл, дигідроалкільного або арильного залишку, незаміщеного бензоксазоліл, дигідрофураніл, дигідроімідазоліл, або заміщеного 1 або 2 замісниками, визначеними дигідроіндоліл, дигідроізооксазоліл, дигідроізотіавище, R6 і R7 такі, як визначено вище. золіл, дигідрооксадіазоліл, дигідрооксазоліл, дигіАлкоксикарбоніл визначають як С1-С6-алкілдропіразиніл, дигідропіразоліл, дигідропіридиніл, О-С=O-. Термін «необов'язково заміщений» віднодигідропіримідиніл, дигідропіроліл, дигідрохіноліситься до алкільної групи алкоксильного залишку, ніл, дигідротетразоліл, дигідротіадіазоліл, дигідронезаміщеної або заміщеної 1 або 2 замісниками, тіазоліл, дигідротієніл, дигідротриазоліл, дигідроавизначеними вище. зетидиніл, дигідро-1,4-діоксаніл, Арилоксикарбоніл визначають як арил-О-C=Oтетрагідрофураніл, тетрагідротієніл, тетрагідрохі. Термін «необов'язково заміщений» відноситься нолініл і тетрагідроізохінолініл. до арильного залишку, незаміщеного або заміщеМоно- або біциклічна насичена або частково ного 1 або 2 замісниками, визначеними вище. насичена С1-С6-алкілгетероциклічна група ознаГетероарилоксикарбоніл визначають як гетечає С1-С6-алкільну групу (лінійну або розгалужероарил-O-С=O-. Термін «необов'язково заміщену), приєднану до ге тероциклу (який визначений ний» відноситься до гетероарильного залишку, вище) через атом вуглецю або атом азоту, в якій незаміщеного або заміщеного 1 або 2 замісникаінший кінець алкільного ланцюга приєднаний до ми, визначеними вище. іншої частини молекули. Термін «необов'язково Алкокси визначають як С1-С6-алкіл-О-. Термін заміщений» відноситься до алкільної або гетеро«необов'язково заміщений» відноситься до алкільциклічної частини молекули, незаміщеної або заного залишку, незаміщеного або заміщеного 1 або міщеної 1 або 2 замісниками, визначеними вище. 2 замісниками, визначеними вище. Арилалкілоксіалкіл визначають як арил-С1-С6Арилокси визначають як арил-О-. Термін «неалкіл-О-С1-С6-алкіл. Термін «необов'язково заміобов'язково заміщений» відноситься до арильного щений» відноситься до алкільної і/або арильної залишку, незаміщеного або заміщеного 1 або 2 частинам, незаміщеним або заміщеним 1 або 2 замісниками, визначеними вище. замісниками, визначеними вище. Гетероарилокси визначають як гетероарил-О-. Алкілоксіалкіл визначають як С1-С6-алкіл-ОТермін «необов'язково заміщений» відноситься до С1-С6-алкіл-. Термін «необов'язково заміщений» гетероарильного залишку, незаміщеного або завідноситься до алкільного залишку, незаміщеного міщеного 1 або 2 замісниками, визначеними вище. або заміщеного 1 або 2 замісниками, визначеними Алкенілокси визначають як С3-С6-алкен-О-, вище. наприклад, залишки, подібні до аліл-О-, бутен-2Арилоксіалкіл визначають як арил-О-С1-С6ен-О. Термін «необов'язково заміщений» відноалкіл. Термін «необов'язково заміщений» відноситься до алкенового залишку, незаміщеного або ситься до алкільного або арильного залишку, незаміщеного 1 або 2 замісниками, як визначено заміщеного або заміщеного 1 або 2 замісниками, вище, за умови, що атом вуглецю, що входить до визначеними вище. складу подвійного зв'язку, не сполучений з гетероГетероарилалкілоксіалкіл визначають як гетеатомом, таким як О, S або N-R 1. роарил-С1-С6-алкіл-О-С1-С6-алкіл. Термін «неАлкінілокси визначають як С3-С6-алкін-О-, наобов'язково заміщений» відноситься до алкіл ьної приклад, групи, подібні до НС С-СН 2О-. Термін або гетероарильної частини, незаміщеної або за«необов'язково заміщений» відноситься до алкіноміщеної 1 або 2 замісниками, визначеними вище. вого залишку, незаміщеного або заміщеного 1 або Арилоксіарил визначають як арил-О-арил. Те2 замісниками, як визначено вище, за умови, що рмін «необов'язково заміщений» відноситься до атом вуглецю, що входить до складу подвійного арильного залишку, незаміщеного або заміщеного або потрійного зв'язку, не сполучений з гетеро1 або 2 замісниками, визначеними вище. атомом, таким як О, S або N-R 1. Арилоксигетероарил визначають як арил-ОАлкіламіноалкокси визначають як R6R7N-C1гетероарил- або -арил-О-гетероарил. У даному C6-алкіл-O-C1-C6-алкіл-, де термінальна алкільна 33 78047 34 група, приєднана до атома кисню, сполучена з на група може містити 1-3 ароматичних цикли і 0-2 іншою частиною молекули. R6 і R7 визначені вище. неароматичних цикли. Кожний ароматичний цикл в Термін «необов'язково заміщений» відноситься до конденсованій трициклічній гетероарильній групі алкільного залишку, незаміщеного або заміщеного може містити 5-7 атомів в своєму складі (включа1 або 2 замісниками, визначеними вище. ючи головні атоми містечкової групи), які вибрані з Алкілендіокси визначають як -O-(СН2)2-О-. CR2, О, S, N і N-R1. Кожний з ароматичних циклів Арилоксіалкіламіновмісні групи визначають як конденсованої трициклічної гетероарильної групи R6R7N-C1-C6-алкіл-O-арил-, де арил приєднаний може містити 0-3 гетероатоми, вибрані з О, S, N до іншої частини молекули. Термін «необов'язково або N-R1. Неароматичні цикли, якщо вони є в заміщений» відноситься до алкільного або арильскладі конденсованої трициклічної гетероарильної ного залишку, незаміщеного або заміщеного 1 або групи, можуть містити 5-8 атомів в циклі (включаю2 замісниками, визначеними вище. чи головні атоми місточкової групи), з яких від 0 до Арилалкеніл визначають як арил-С2-С8-алкен4 можуть бути гетероатомами, вибраними з N, N, за умови, що атом вуглецю, що входить до склаR1, О або S(O) n, де n дорівнює 0-2. У кожному неду подвійного зв'язку, не сполучений з гетероатоароматичному циклі конденсованої трициклічної мом, таким як О, S або N-R1. Термін «необов'язкогетероарильної групи один або два немісточкових во заміщений» відноситься до алкенового або атоми вуглецю можуть кожний мати один або два арильного залишку, незаміщеного або заміщеного замісники R4, і R4 можуть бути незалежно однако1 або 2 замісниками, визначеними вище. вими або різними. Приклади конденсованих триГетероарилоксіалкіл визначають як гетероциклічних гетероарильних груп включають: арил-О-С1-С6-алкіл-. Термін «необов'язково заміРозмір циклів і тип сполучення: (5-5-5) щений» відноситься до гетероарильного залишку, незаміщеного або заміщеного 1 або 2 замісниками, визначеними вище. Гетероарилоксіарил визначають як гетероарил-О-арил-, де арильний залишок приєднаний до іншої частини молекули. Термін «необов'язково заміщений» відноситься до гетероарильного або арильного залишку, незаміщеного або заміщеного 1 або 2 замісниками, визначеними вище. Алкокси, алкоксіалкіл, алкоксіалкілокси і алкілВ обох формулах 1-А і 1-B Z1, Z2, Z3 , Z4, Z 5, Z6 і тіоалкілокси являють собою групи, де алкільний Z7 незалежно вибрані з CR2, Ν, Ο, S або N-R1 і, як ланцюг (лінійний або розгалужений) складається з вказано вище, один з Z1-Z7 є атомом вуглецю, до 1-6 атомів вуглецю. Арилокси, гетероарилокси, якого приєднана інша частина молекули пенему. арилтіо і гетероарилтіо містять арильні і гетероY1 , Y2 , Y3 і Υ4 можуть незалежно являти собою С арильні групи, визначені вище. Арилалкілокси, або N. гетероарилалкілокси, арилалкілтіо і гетероарилалРозмір циклів і тип сполучення: (5-5-6) кілтіо містять арильні і гетероарильні групи, визначені вище, і алкільні ланцюги (лінійні або розгалужені) з 1-6 атомів вуглецю. Арилоксіалкіл, гетероарилоксіалкіл, арилоксіалкілокси і гетероарилоксіалкілокси являють собою замісники, де алкільний радикал містить 1-6 атомів вуглецю. Терміни моноалкіламіно і діалкіламіно відносяться до залишків з однією алкільною або двома алкільними групами, де алкільний ланцюг містить 1-6 атомів вуглецю, а групи можуть бути однаковими або різними. Терміни моноалкіВ обох формулах 2-А і 2-B Z1, Z2 , Z3 , Z4 , Z5 , Z6 , ламіноалкіл і діалкіламіноалкіл відносяться до Z7 і Z8 незалежно вибрані з CR2, Ν, Ο, S або N-R1 і, моноалкіламіно- і діалкіламіногрупам з одним або як указано вище, один з Z1-Z8 є а томом вуглецю, двома алкільними замісниками (однаковими або до якого приєднана інша частина молекули пенерізними) при атомі азоту, який приєднаний до алму. Y1, Y2, Y3 і Υ4 можуть незалежно являти собою кільної групи, що містить 1-3 атоми вуглецю. С або N. Вираз «конденсована трициклічна гетероариРозмір циклів і тип сполучення: (5-6-5) льна група» використовують в описі і формулі винаходу для позначення: групи, що містить три конденсованих цикли, з яких щонайменше один цикл ароматичний (тобто відповідає правилу Хюкеля (4n+2)). Конденсована трициклічна гетероарильна група містить 1-6 гетероатомів, вибраних з групи, що складається з О, S, N і N-R1. Конденсована, трициклічна гетероарильна група повинна бути пов'язана з іншою частиною молекули формули І через атом вуглецю, що переважно входить до складу ароматичного кільця системи. Конденсована трициклічна гетероарильВ обох формулах 3-А і 3-В Z1, Z2 , Z3 , Z4 , Z5 , Z6 , 35 78047 Z7 і Z8 незалежно вибрані з CR2, Ν, Ο, S або N-R1 і, як указано вище, один з Z1-Z8 є а томом вуглецю, до якого приєднана інша частина молекули пенему. Y1, Y2, Υ3 і Υ4 можуть незалежно являти собою С або N. Розмір циклів і тип сполучення (5-6-6) У формулах 4-A, 4-В і 4-С Z 1, Z2, Z3 , Z 4, Z5, Z6 , Z7 і Z8 незалежно вибрані з CR2, Ν, Ο, S або N-R1 і, як указано вище, один з Z1-Z8 є а томом вуглецю, до якого приєднана інша частина молекули пенему. Y1, Y2, Y3 і Υ4 можуть незалежно являти собою С або N. Розмір циклів і тип сполучення: [5-5неароматичний] У формулах 5-A і 5-Β Ζ1, Ζ2 , Z 3 і Z 4 незалежно вибрані з CR2, Ν, О, S або N-R1 і, як указано вище, один з Z1-Z4 є атомом вуглецю, до якого приєднана інша частина молекули пенему. Y1, Y2, Y3 і Υ4 незалежно являють собою С або N. W1, W2 і W3 незалежно вибрані з CR4R4, S(O)r (r дорівнює 0-2), О або N-R1, за умови, що до складу насиченої циклічної системи не можуть входити S-S, S-O або O-O зв'язки; i t дорівнює 1-3. Розмір циклів і тип сполучення: [5-6неароматичний] У формулах 6-А, 6-В і 6-С Z1, Z 2, Z 3, Z 4 і Z5 незалежно вибрані з CR2, Ν, О, S або N-R1 і, як указано вище, один з Z1-Z5 є атомом вуглецю, до якого приєднана інша частина молекули пенему. Y1 і Y2 незалежно являють собою С або N. W1, W2 і W3 незалежно вибрані з CR4R4, S(O)r (r дорівнює 0-2), О або N-R1, за умови, що до складу насиченої циклічної системи не можуть входити S-S, S-O або O-O зв'язки; i t дорівнює 1-3. Розмір циклів і тип сполучення: [5(неароматичний)-5] 36 У формулах 7-А і 7-B Z1, Z2, Z3 , Z4, Z 5 і Z6 незалежно вибрані з CR2, Ν, Ο, S або N-R 1 і, як указано вище, один з Z1-Z6 є атомом вуглецю, до якого приєднана інша частина молекули пенему. Y1 , Y2, Y3 і Υ4 незалежно являють собою С або N. W1 і W2 незалежно вибрані з CR4R4, S(O)r (r дорівнює 0-2), О або N-R1, за умови, що до складу насиченої циклічної системи не можуть входити S-S, S-O або O-O зв'язки; i t дорівнює 1-3. Розмір циклів і тип сполучення: [5(неароматичний)-6] У формулах 8-А і 8-Β Z1, Z 2, Z 3, Z 4, Z 5, Z 6 і Z7 незалежно вибрані з CR2, Ν, Ο, S або N-R1 і, як указано вище, один з Z1-Z7 є атомом вуглецю, до якого приєднана інша частина молекули пенему. Y1 , Y2, Y3 і Υ4 незалежно являють собою С або N. W1 і W 2 незалежно являють собою CR4R4, S(O)r (г дорівнює 0-2), О або N-R1, за умови, що до складу насиченої циклічної системи не можуть входити SS, S-O або O-O зв'язки; і t дорівнює 0-3. Розмір циклів і тип сполучення: [5(неароматичний)-(неароматичний)] У формулах 9-А і 9-В Z1, Z2 і Z 3 незалежно вибрані з CR2, Ν, Ο, S або N-R1 і, як указано вище, один з Z1-Z3 є атомом вуглецю, до якого приєднана інша частина молекули пенему. Y1 і Y4 незалежно являють собою С або Ν. Υ2 і Υ3 незалежно являють собою СН або N. W1, W2 , W 3, W 4 i W 5 незалежно являють собою CR4R4, S(O)r (r дорівнює 0-2), О або N-R 1, за умови, що до складу насиченої циклічної системи не можуть входити S-S, S-O або O-O зв'язки; t дорівнює 0-2 і u дорівнює 1-3. 37 Розмір циклів і тип сполучення: (6-5-6) 78047 У формулах 10-А і 10-В Z1, Z2, Z3, Z 4, Z 5, Z 6, Z7 , Z8 і Z9 незалежно являють собою CR2, Ν, Ο, S або N-R1 і, як указано вище, один з Z1-Z9 є атомом вуглецю, до якого приєднана інша частина молекули пенему. Y1, Y2, Υ3 і Υ4 незалежно являють собою С або N. Розмір циклів і тип сполучення: (6-6-6) У формулах 11-А, 11-B і 11-С Ζ1, Ζ 2, Ζ 3, Ζ4, Ζ5 , Ζ6, Ζ 7, Ζ 8, Ζ 9 і Ζ10 незалежно являють собою CR2, Ν, Ο, S або N-R1 і, як указано вище, один з Z1-Z10 є атомом вуглецю, до якого приєднана інша частина молекули пенему. Y1 , Y2 , Y3 і Υ4 незалежно являють собою С або N. Розмір циклів і тип сполучення: [6-5(неароматичний)] У формулах 12-А і 12-В Ζ1, Ζ 2, Ζ3, Ζ4 і Ζ5 незалежно являють собою CR2, Ν, Ο, S або N-R1 і, як указано вище, один з Z1-Z5 є атомом вуглецю, до якого приєднана інша частина молекули пенему. Y1 , Y2, Y3 і Υ4 незалежно являють собою С або N. W1, W 2, W3 незалежно являють собою О, N-R1 або S=(O)r (r дорівнює 0-2), за умови, що до складу насиченої циклічної системи не можуть входити SS, S-O або O-O зв'язки; і t дорівнює 1-4. Розмір циклів і тип сполучення: [6-6(неароматичний)] 38 У формулах 13-А, 13-B і 13-С Z1, Z2, Z3 , Z4 , Z5 і Z6 незалежно являють собою CR2, Ν, Ο, S або NR1 і, як указано вище, один з Z1-Z6 є атомом вуглецю, до якого приєднана інша частина молекули пенему. Υ1, Υ2, Υ3 і Υ4 незалежно являють собою С або N. W1, W2 і W3 незалежно являють собою CR4R4, S(O)r (r дорівнює 0-2), О або N-R 1 за умови, що до складу насиченої циклічної системи не можуть входити S-S, O-O або S-O зв'язки; і t дорівнює 1-3. Розмір циклів і тип сполучення: [6(неароматичний)-6] У формулах 14-А, 14-В і 14-С Z1, Z 2, Z 3, Z4, Z5 , Z6, Z7 і Z8 незалежно являють собою CR2, Ν, Ο, S або N-R1 і, як указано вище, один з Z1-Z8 є атомом вуглецю, до якого приєднана інша частина молекули пенему. Y1 , Y2, Y3 і Υ4 незалежно являють собою С або N. W1, W2 і W3 незалежно являють собою CR4R4, S(O)r (r дорівнює 0-2), О або N-R1 за умови, що до складу насиченої циклічної системи не можуть входити S-S, S-O або O-O зв'язки; і t дорівнює 1 або 2. Розмір циклів і тип сполучення: [6(неароматичний)-(неароматичний)] У формулах 15-А, 15-В і 15-С Z1, Z2, Z3 і Z4 незалежно являють собою CR2, N, О, S або N-R 1 і, як указано вище, один з Z1-Z4 є атомом вуглецю, до якого приєднана інша частина молекули пенему. Y1 , Y2, Y3 і Υ4 незалежно являють собою С або N. W1, W2, W3 і W4 незалежно являють собою CR4R4, S(O)r (r дорівнює 0-2), О або N-R1 за умови, що до складу насиченої циклічної системи не можуть входити S-S, S-O або O-O зв'язки; t дорівнює 1-3 і u дорівнює 1-3. Вираз «конденсована біциклічна гетероарильна група» використовують в описі і формулі даного винаходу для позначення: групи, що містить два конденсованих цикли, з яких один має ароматичну природу [тобто підкоряється правилу Хюкеля (4n+2) ], а інший неароматичну. Конденсована біциклічна гетероарильна група містить від 1 до 6 гетероатомів, вибраних з О, S, N і N-R1. Конденсована біциклічна гетероарильна група пов'язана з іншою частиною молекули за допомогою атома вуглецю ароматичного циклу, як показано в формулі І. Ароматичний цикл конденсованої біциклічної 39 78047 40 гетероарильної групи містить п'ять або шість атодним чином заміщеного альдегіду 17 з похідним 6мів в циклі (включаючи головні атоми місточкової бромпенему структури 16 (Схема 2) в присутності групи), вибраних з CR2, N, О, S або N-R1. Аромакислоти Льюїса, переважно безводного галогеніду тичний цикл конденсованої біциклічної гетероаримагнію, більш переважно безводного MgBr2 або льної групи містить від 0 до 3 гетероатомів, вибраефірату MgBr2 , і м'якої основи, такої як триетиланих з О, S, N і NR1. мін, DMAP або діізопропілетиламін, при низькій Неароматичний цикл конденсованої біциклічтемпературі, переважно приблизно від -20°С до ної гетероарильної групи містить п'ять-вісім атомів 40°С. Проміжний альдольний продукт 18 можна в циклі (включаючи головні атоми місточкової груфункціоналізувати дією хлорангідридів і ангідридів пи), вибраних з CR 4R4, N, N-R1, О, S(O)n, де n дорікислот, переважно перетворити їх в ацетат, трифвнює 0-2. Неароматичний цикл конденсованої білат або тозилат 19; або, якщо сполуку формули 18 циклічної гетероарильної групи містить 0-4 виділяють, її можна перетворити в галогенпохідне гетероатоми, вибрані з N, N-R1, О або S(O)n, де n взаємодією з тетрагалогенметаном і трифенілфодорівнює 0-2. сфіном при кімнатній температурі у придатному Приклади конденсованих біциклічних гетероорганічному розчиннику, переважно СН2СI2. Споарильних груп включають: луку 19 можна легко перетворити в цільовий продукт відновним елімінуванням дією металу, такого як активований цинк, і фосфатного буфера при помірних температурах, переважно від близько 20°С до 35°С і при рН приблизно 6,5-8,0 або гідруванням над каталізатором, переважно паладієм на вугіллі. Потрібно зазначити, що стадію відновного У формулі 16-А Ζ1 , Ζ 2 і Ζ3 незалежно являють елімінування можна здійснити так, що станеться собою CR2, Ν, Ο, S або N-R1 і один з Z1-Z3 є атозняття захисту карбоксильної групи. Якщо карбокмом вуглецю, до якого приєднана інша частина сильну функцію захищає п-нітробензильна група, молекули, як показано в формулі І. Коли один з Ζ тоді відновне елімінування і зняття захисту викоявляє собою CR2, два інших Ζ можуть являти сонується за одну стадію. Однак якщо захисна група бою або два атоми Ν, або один атом N і О, S, N-R1 не є п-нітробензильною, можна використати метов будь-яких комбінаціях без порушення ароматичдику з двох стадій, що залежить від природи захиності; коли два Ζ являють собою CR2, третій Ζ мосної групи. Продукт може бути виділений у вигляді же бути довільно вибраний з Ν, О, S або N-R1 в вільної кислоти або у вигляді солі лужного металу. будь-яких комбінаціях без порушення ароматичноВищезгадану двохстадійну методику можна викості; нувати за одну стадію шляхом здійснення всього W1, W2 і W3 незалежно являють собою CR4R4, процесу без виділення проміжної сполуки 19. Дану S, SO, SO2, О, N-R1, C=O за умови, що до складу відносно просту і надто ефективну з точки зору насиченої циклічної системи не можуть входити Sвиходу і економічності методику можна використаS, O-O або S-O зв'язки; t дорівнює 1-4. ти для отримання широкого кола сполук. Дана У формулі 16-В Z1 , Z 2 і Z3 незалежно являють методика підходить також для великомасштабного собою CR2, Ν, Ο, S або N-R1 і один з Z1-Z3 є атосинтезу і застосовна до різноманітних альдегідів. мом вуглецю, до якого приєднана інша частина молекули, як показано в формулі І. Коли один з Ζ являє собою CR2, два інших Ζ можуть незалежно являти собою CR2, N, О, S або N-R1 в будь-яких комбінаціях без порушення ароматичності коли два Ζ являють собою Ν, тоді третій Ζ являє собою атом вуглецю циклу, пов'язаний з іншою частиною молекули пенему, як показано в формулі І. W1, W2 і W3 незалежно являють собою CR4R4, S, SO, SO2 , О, NR1; t дорівнює 1-4; Y1 і Y2 являють собою N або С; при цьому, якщо ароматичним гетероциклом є імідазол, насичений цикл не може містити атом S в положенні, що примикає до головного атома вуглецю містечкової Один важливий аспект даного винаходу відногрупи. ситься до застосування стійкого проміжного бромУ формулі 16-С Ζ1, Ζ2, Ζ3 і Ζ 4 незалежно являпенему 16. Стабільність проміжної сполуки має ють собою CR2 або N і один з Z1-Z4 є атомом вугзначення на стадії альдольної конденсації, де розлецю, до якого приєднана інша частина молекули. кладання зводять до мінімуму, а також при зберіW1, W2 і W3 незалежно являють собою CR4R4, ганні. У даному винаході ключова проміжна сполуS, SO, SO2 , О або N-R1 за умови, що до складу ка 16, де R являє собою п-нітробензильну груп у, є насиченої циклічної системи не можуть входити Sстійкою і кристалічною проміжною сполукою. У S, O-O або S-O зв'язки; t дорівнює 1-4. даному винаході було знайдено, що проміжна споΥ1 і Y2 незалежно являють собою С або N. лука 16 є більш стабільною, ніж проміжна сполука Сполуки загальної формули І можуть бути легQ. Порівняльні дані по термічній стійкості проміжко отримані в м'яких умовах конденсацією відповіних сполук 16 і Q приводяться нижче (Таблиця 1). 41 78047 42 Дивна стійкість проміжної сполуки 16 збільшує час 22 34,700 2,5830 906 16 зберігання сполуки, а також можливість реалізації 23 36,700 2,4467 785 14 способу у великих масштабах. Як указано вище, 24 37,780 2,3792 862 16 захист карбоксильної групи п-нітробензильною 25 38,980 2,3087 762 14 групою зменшує число стадій в даному способі 26 40,180 2,2425 728 13 отримання кінцевої сполуки структури І. Кристалі27 41,220 2,1883 718 13 чна структура проміжної сполуки встановлена рентгеноструктурним аналізом. У Таблиці 2 показані Перевагою є те, що на стадії відновного еліміпараметри рентгеноструктурного аналізу порошку нування в даному винаході потрібний "Z" ізомер сполуки формули 16. утворюється надто переважно - з селективністю 45-55:1 (близько 50:1). У реакційній суміші не спостерігається утворення "Е" ізомеру. Стадію відновного елімінування можна також здійснити гідруванням проміжної сполуки 19 над 10% Pd/C. Проміжна сполука 16, що використовується в даному винаході, може бути отримана з комерційТаблиця 1 но доступної 6-амінопеніциланової кислоти (6АРА) 20 (Схема 3). Вона може бути перетворена в Залишкове відношення (%)1 бромпенем 16 по методиці, приведеній на схемі 3. День Сполука формули 16 Сполука формули Q 6-Амінопеніциланову кислоту (6-АРА) 20 перетворюють в бром-п-нітробензильне похідне Z2 по од0 100,0 100,0 ностадійній (one pot) методиці. Дане похідне окис1 100,0 99,7 ляють в сульфоксид 23, який піддають реакції 2 100,0 95,3 розкриття циклу, і отримують 24. Сполуку 24 пере4 100,0 72,9 творюють в 16 по методиці, стисло викладеній на 7 98,7 69,8 Схемі 3. Перевагою методики по даному винаходу 14 98,4 Не визначали є можливість перетворення сполуки 23 у 26 в одну стадію, без виділення проміжних продуктів 24 і 25. 1 ) Визначене ВЕРХ аналізом. Отриманий таким чином бромпенем 16 піддають взаємодії з альдегідом 17 (див. Схему 2) в присутТемпература 40°С в твердому стані. ності безводного MgBr2 або комерційно доступного Умови ВЕРХ: MgBr2:O(Et) 2. Альдольний продукт виділяють у Колонка: Inertsil SIL 100-5 4,6x150мм (GL вигляді бромацетату 19, який можна легко переScience Inc.) творити в кінцевий продукт І взаємодією з активоРухома фаза: етилацетат: н-гексан (10:35, ваним цинком (наприклад, свіжеактивованим 0,1н об./об.) НСl) і фосфатним буфером (рН 6,5) при кімнатній Довжина хвилі: 312нм; Швидкість потоку: температурі. Продукт можна легко очистити відо1,0мл/хв. при кімнатній температурі мими методами, наприклад, колонковою хроматографією (з Diaion HP-21). Спочатку елюювання Таблиця 2 проводять водою для видалення будь-яких неорганічних домішок, потім 10% розчином MeCN у Пік# 20 Значення Інтенсивність, Відносна воді. Отриманий продукт має чистоту 98%, і його d (Q) (Гц) інтенсивність можна додатково очистити кристалізацією. Аль 1 9,540 9,2631 1575 28 дольна конденсація з використанням Et3N і MgBr2 2 13,560 6,5246 1225 22 надто ефективна і має загальний характер. Даний 3 15,460 5,7268 3913 70 винахід можна розповсюдити на різноманітні аль4 18,680 4,7462 2509 45 дегіди і отримати кінцевий продукт загальної стру5 19,180 4,6236 820 15 ктури І. Даний винахід відноситься до способу 6 19,940 4,4491 1366 25 отримання сполуки формули І 7 21,060 4,2149 699 13 8 22,360 3,9727 1652 30 9 23,740 3,7448 5560 100 10 24,260 3,6657 3560 64 11 24,940 3,5673 1958 35 12 25,180 3,5338 1799 32 13 25,780 3,4529 878 16 14 26,540 3,3558 1514 27 15 26,900 3,3117 1136 20 де 16 28,900 3,0869 2206 40 один із замісників А або В означає водень, а 17 29,220 3,0538 1507 27 другий означає арил, необов'язково заміщений одним або двома R2, гетероарил, необов'язково 18 29,720 3,0035 1473 26 заміщений одним або двома R2, конденсований 19 30,560 2,9229 906 16 біциклічний гетероарил, необов'язково заміщений 20 31,200 2,8644 815 15 одним або двома R2, конденсований трициклічний 21 31,480 2,8395 888 16 гетероарил, необов'язково заміщений одним або 43 78047 44 двома R2, циклоалкіл, необов'язково заміщений що необов'язково містить один або два гетероодним або двома R2, алкіл, необов'язково заміщеатоми, таких як N-R1, О, S=(O)n , де n дорівнює 0-2. ний одним або двома R2, алкеніл, необов'язково Спосіб отримання сполуки формули І включає заміщений одним або двома R2, алкініл, необов'янаступні стадії: зково заміщений одним або двома R2, насичену Стадія 1. 6-Амінопеніциланoву кислоту 20, або частково насичену гетероциклічну гр упу, нерозчинену в органічному розчиннику (переважно обов'язково заміщену одним або двома R2; метанолі або ТГФ) і воді, перетворюють в 6R5 являє собою Н, С1-С6-алкіл, С5-С6бромпохідне в присутності 48%мас., бромистоводциклоалкіл, СHR3ОСО-С1-С6-алкіл, (утворюючі невої кислоти при температурі від -10°С до -30°С і складні ефіри, здатні гідролізуватися in vivo) або розчину нітриту натрію або калію. 6метали, такі як Na, К або Са (утворюючі солі). Бромпеніциланову кислоту 21 можна або виділити, R2 являє собою водень, необов'язково заміабо in situ перетворити в п-нітробензил-6щений С1-С6-алкіл, необов'язково заміщений С2бромпеніциланат 22, дією 4-нітробензилброміду в С6-алкеніл, що містить 1 або 2 подвійних зв'язки, присутності органічних основ або неорганічних необов'язково заміщений С2-С6-алкініл, що місоснов (переважно карбонату натрію або калію) в тить 1 або 2 потрійних зв'язки, галоген, ціано, Nорганічному розчиннику (переважно ТГФ або R6R7, необов'язково заміщений С1-С6-алкокси, ДМФА). гідрокси; необов'язково заміщений арил, необов'яСтадія 2. Продукт п-нітробензил 6зково заміщений гетероарил, COOR6, необов'язкобромпеніциланат 22, отриманий способом, стисло во заміщені алкіларилоксіалкіламіновмісні групи, викладеним на стадії 1, можна виділити або не необов'язково заміщені арилокси, необов'язково виділяючи перетворити в 4-нітробензил 6заміщений гетероарилокси, необов'язково заміщебромпеніциланат-1-оксид 23 в тій же колбі ("in the ний С3-С6-алкенілокси, необов'язково заміщений same pot") (тобто послідовно продовжуючи стадію С3-С6-алкінілокси, С1-С6-алкіламіно-С1-С61) окисленням п-нітробензил 6-бромпеніциланату алкокси, алкілендіокси, необов'язково заміщену 22 в 1-оксид 4-нітробензил-6-бромпеніциланату арилокси-С1-С6-алкіламіновмісну групу, С1-С623, використовуючи окислювачі, такі як 3перфторалкіл, необов'язково S(O)q -заміщений С1хлорпероксибензойну кислоту (mcpba) або перокС6-алкіл, необов'язково S(O)q -заміщений арил, де сид водню. q дорівнює 0, 1 або 2, -CONR6R7, гуанідино- або Стадія 3. Продукт стадії 2, а саме 4включену в цикл гуанідиногрупу, необов'язково нітробензил 6-бромпеніциланат-1-оксид 23, можна заміщений С1-С6-алкіларил, необов'язково заміперетворити в 4-нітробензил (2R)-2-[(33, 4R)-4щений арилалкіл, необов'язково заміщений С1-С6(бензотіазол-2-ілдитіо)-3-бром-2-оксоазетидин-1алкілгетероарил, необов'язково заміщений гетеіл]-3-метилбут-3-еноат 24 кип'ятінням 4роарил-С1-С6-алкіл, необов'язково заміщену монітробензил 6-бромпеніциланат-1-оксиду 23 з 2ноабо біциклічну насичену С1-С6меркаптобензотіазолом (HSBT) в ароматичному алкілгетероциклічну групу, необов'язково заміщерозчиннику (переважно в толуолі). ний арилалкеніл, що містить від 8 до 16 атомів Стадія 4. Продукт стадії 3, а саме 4вуглецю, SO2NR6R7 , необов'язково заміщений нітробензил (2R)-2-[(3S, 4R)-4-(бензотіазол-2арилалкілоксіалкіл, необов'язково заміщений ариілдитіо)-3-бром-2-оксоазетидин-1-іл]-3-метилбут-3локсіалкіл, необов'язково заміщений гетероарилоеноат 24, можна розчинити в органічному розчинксіалкіл, необов'язково заміщений арилоксіарил, нику (переважно в толуолі) і при взаємодії з органеобов'язково заміщений арилоксигетероарил, нічноютретинною основою (переважно триетиланеобов'язково заміщений гетероарилоксіарил, міном) при температурі навколишнього необов'язково заміщений С1-С6середовища отримати 4-нітробензил 2-[(3S,4R)-4алкіларилоксіарил, необов'язково заміщений С1(бензотіазол-2-ілдитіо)-3-бром-2-оксоазетидин-1С6-алкіларилоксигетероарил, необов'язково замііл]-3-метилбут-2-еноат 25. щений арилоксіалкіл, необов'язково заміщений Стадія 5. Продукт стадії 4, а саме 4гетероарилоксіалкіл, необов'язково заміщені алкінітробензил 2-[(3S,4R)-4-(бензотіазол-2-ілдитіо)-3ларилоксіалкіламіновмісні групи. Переважними R2 бром-2-оксоазетидин-1-іл]-3-метилбут-2-еноат 25, групами є водень, необов'язково заміщений алкіл, можна перетворити в 4-нітробензил 2-[(3S, 4R)-3необов'язково заміщений алкокси, необов'язково бром-4-формілтіо-2-оксоазетидин-1-іл]-3заміщений гетероарил, галоген, CN, гідрокси, неметилбут-2-еноат 26 взаємодією з органічною кисобов'язково заміщена гетероциклічна група, лотою (переважно мурашиною) в ароматичному CONR6R7, СОOR6 , необов'язково заміщений арил, органічному розчиннику (переважно в толуолі) в S(O)q -алкіл і S(O)q -арил; присутності суміші оцтовий ангідрид/органічна R3 являє собою водень, С1-С6-алкіл, С5-С6третинна основа (переважно піридин) і тріалкілциклоалкіл, необов'язково заміщений арил, необоабо тріарилфосфіну (переважно трифенілфосфів'язково заміщений гетероарил; ну) при температурі від -10°Сдо-30°С. R6 і R7 незалежно являють собою Н, необов'яПослідовне перетворення сполуки 23 в сполузково заміщений С1-С6-алкіл, необов'язково заміку 26 без виділення проміжних продуктів щений арил, необов'язково заміщений гетероарил, Продукт стадії 2, а саме 1-оксид 4-нітробензил необов'язково заміщений С1-С6-алкіларил, необо6-бромпеніциланату 23, піддають взаємодії з мерв'язково заміщений арилалкіл, необов'язково закаптобензотіазолом в киплячому ароматичному міщений гетероарилалкіл, необов'язково заміщеорганічному розчиннику (переважно в толуолі) ний С1-С6-алкілгетероарил; R6 і R7 можуть разом протягом 1-3год. і обробляють триетиламіном при утворити 3-7-членну насичену циклічну систему, температурі від 0 до -20°С протягом 3-4год. Після 45 78047 46 даної обробки в реакційну суміш послідовно заваперетворити в галогенпохідні взаємодією 18 з тетнтажують органічну кислоту (переважно мурашину рагалогенметаном і трифенілфосфіном при кімнакислоту) і ангідрид (оцтовий ангідрид), органічну тній температурі у відповідному органічному розтретинну основу (переважно піридин) і тріалкілчиннику, переважно СН2СІ2. або тріарилфосфат при температурі від -10°С до Стадія 8. Останню стадію, а саме стадію від40°С. новного елімінування, яка дає сполуку загальної Стадія 6. 4-Нітробензил 2-[(3S, 4R)-3-бром-4формули І, можна здійснити розчиненням суміші формілтіо-2-оксоазетидин-1-іл]-3-метилбут-2альдольних продуктів в органічному розчиннику еноат 26 - продукт стадії 5 або послідовного одно(переважно ТГФ/ацетонітрил) і фосфатному буфестадійного перетворення - розчиняють в органічрі (рН 6,5-7,0) і дією активованого металу, такого ному розчиннику (переважно етилацетаті) при теяк цинк, олово або алюміній, при температурі нампературі від -70°С до -90°С і пропускають через вколишнього середовища (переважно при 20°Срозчин озонованого кисню протягом 3-4год., потім 35°С). Продукт у вигляді солі лужного металу моздійснюють внутрішньомолекулярну циклізацію за жна очищати колонковою хроматографією із обердопомогою фосфітного реагенту (переважно триненою фазою. метилфосфіту). Продукт 4-нітробензил (5R,6S)-6Альтернативно, стадії 7 і 8 можна провести бромпенем-3-карбоксилат 16, кристалізуют з супослідовно в одній колбі ("in the same pot") без міші етилацетат:гексан. виділення проміжного альдольного продукту. Сполука, представлена наступною формулою Останню стадію, а саме стадію відновного (16): елімінування, можна також здійснити розчиненням альдольного продукту в органічному розчиннику і фосфа тному буфері з рН 6,5-7,0 і гідруванням над Pd/C при тиску Н2 10-100фунт/кв.дюйм (переважно при 40фунт/кв.дюйм). Описаний вище спосіб (Стадія 1 - Стадія 6) отримання сполуки, представленої формулою 16, є проміжною ланкою в отриманні пенемів із заміщеною метиленовою групою в положенні 6 загальної формули І. Сполука, представлена формулою 16, являє собою кристалічне похідне (параметри дифракції рентгенівських променів в порошкоподібному зразку приводяться в Таблиці 2). Кристалічна природа вказаної проміжної сполуки додає їй стабільності і тим самим збільшує термін зберігання. Дані по стабільності сполуки формули 16 приведені в Таблиці 1. Стадія 7. Взаємодія 4-нітробензил (5R, 6S)-6бромпенем-3-карбоксилату 16 з відповідним чином заміщеними альдегідами (визначеними вище) для здійснення стадії альдольної конденсації можна провести в присутності кислоти Льюїса (переважно безводного MgBr2 або ефірату MgBr 2) і органічної третинної основи (переважно Et3N, DMAP або діізопропілетиламіну) в апротонному полярному органічному розчиннику (переважно ТГФ і ацетонітрилі) при температурі від -20°С до 40°С. Проміжні альдольні продукти загальної формули 18 можна функціоналізувати in situ ("in the same pot") при температурі від 0°C до -10°С хлорангідридом або ангідридом оцтової кислоти в ацетат, ангідридом трифторметансульфокислоти в трифлат або тозилхлоридом - в тозилат; або, якщо сполуки формули 18 виділяють, їх можна Експериментальна частина Приклад 1 Отримання (5R)-(Z)-6-(2,3-дигідроімідазо[2,1b]тіазол-6-ілметилен)пенем-3-карбоксилату натрію Стадія 1. п-Нітробензил-6-бромпеніциланат 6-Амінопеніциланову кислоту (5,0г) додають до охолодженого розчину метанолу (44мл), води (14мл) і 48%мас., бромистоводневої кислоти (14мл) при -10°С. Після завершення додавання суміш охолоджують до -15°С і додають до неї протягом 15хв. розчин нітриту натрію (2,4г в 6,6мл води) і отриманий розчин перемішують без охолоджування ще протягом 30хв., потім розчиняють в ньому хлорид натрію (2,4г). Реакційну суміш екстрагують дихлорметаном (2x36мл). Об'єднані органічні шари промивають насиченим сольовим розчином (36мл), сушать (MgSO4) і концентрують до об'єму 20мл при зниженому тиску і 25°С. Розчин, що залишився, містить 6-бромпеніциланову кислоту і його безпосередньо використовують в наступній реакції. Безводний карбонат калію (2,9г), диметилформамід (40мл) і 4-нітробензилбромід (5,0г) послідовно додають до отриманого вище розчину і су 47 78047 48 міш перемішують при 35-40°С протягом 1год. Реабромпеніциланат і його безпосередньо використокційний розчин виливають в суміш води (33мл) і вують в наступній реакції. дихлорметану (41мл) і органічний шар відділяють. До органічного шару протягом 15хв. додають Органічний шар промивають водою (40мл) і наси3-хлорпербензойну кислоту (355г) і перемішують ченим сольовим розчином (40мл), сушать (MgSO4) протягом 10хв. Реакційну суміш розбавляють етиі упарюють. Залишок наносять на хроматографічну лацетатом (4,8л) і промивають насиченим розчиколонку з силікагелем, елююють сумішшю етиланом гідрокарбонату натрію (7,6л). Органічний шар цетат-гексан (4/1) і отримують вказану в заголовку відділяють і водний шар повторно екстрагують сполуку у вигляді безбарвної твердої речовини етилацетатом (3,9л). Об'єднані органічні шари (7,2г, 75%). промивають водою (3,9л) і насиченим сольовим 1 розчином (3,9л), сушать (MgSO4) і упарюють при Н ЯМР (d, CDCl3): 1,41 (с, 3Н), 1,62 (с, 3Н), зниженому тиску при температурі 30°С. Отриману 4,61 (с, 1Н), 4,83 (д, 1Н, J=1,5Гц), 5,25 і 5,34 (AB, 2H, J=13,0Гц), 5,41 (д, 1Н, J=1,5Гц), 7,56 (д, 2Н, тверду речовину розтирають в етилацетаті (1,8л) протягом 30хв. і до суміші по краплях додають J=8,7Гц), 8,26 (д, 2Н, J=8,7Гц). гексан (5,4л) протягом 1год. Тверду речовину відфільтровують, промивають на фільтрі сумішшю етилацетат-гексан (1/4, 0,8л), сушать на повітрі протягом 1год. і залишають на ніч сушитися у вакуумі при кімнатній температурі. Отримують вказану в заголовку сполуку у вигляді блідо-жовтої кристалічної речовини (768г, 77%). Стадія 2. п-Нітробензил-6-бромпеніциланат-1оксид п-Нітробензил 6-бромпеніциланат (1,36г) розчиняють в дихлорметані (20мл) і охолоджують до 0°С. До розчину додають 3-хлорпербензойну кислоту (0,56г) і перемішують протягом 10хв. Реакційний розчин промивають насиченим розчином гідСтадія 3. п-Нітробензил (2R)-2-[(3S,4R)-4рокарбонату натрію, водою і насиченим сольовим (бензотіазол-2-ілдитіо)-3-бром-2-оксоазетидин-1розчином, сушать (MgSO 4) і упарюють при знижеіл]-3-метилбут-3-еноат ному тиску. Залишок наносять на хроматографічну п-Нітробензил 6-бромпеніциланат-1-оксид колонку з силікагелем, елююють сумішшю етила(4,31г) і меркаптобензотіазол (1,67г) нагрівають в цетат-гексан (1/1) і отримують вказану в заголовку киплячому толуолі (14мл) з азеотропним видаленсполуку у вигляді безбарвної твердої речовини ням води (прилад Діна-Старка) протягом 1год. (1,4г, кількісний вихід). Після охолоджування до кімнатної температури 1 Н ЯМР (d,CDCl3): 1,17 (с, 3Н), 1,69 (с, 3Н), реакційний розчин упарюють при зниженому тиску. 4,60 (с, 1Н), 5,04 (д, 1Н, J=1,5Гц), 5,10 (д, 1H, Залишок наносять на хроматографічну колонку з J=1,5Гц), 5,30 і 5,37 (AB, 2H, J=12,9Гц), 7,56 (д, 2Н, силікагелем, елююють сумішшю етилацетатJ=8,7Гц), 8,27 (д, 2Н, J=8,7Гц). гексан (2/5) і отримують вказану в заголовку споПослідовне одностадійне отримання плуку у вигляді блідо-жовтої твердої речовини нітробензил 6-бромпеніциланат-1-оксиду (5,67г, 98%). 1 6-Амінопеніциланову кислоту (500г) додають Н ЯМР (d,CDCl3): 1,92 (с, 3Н), 4,87 (с, 1Н), до охолодженого розчину метанолу (3,5л), води 5,05 (с, 1H), 5,10 (д, 1Н, J=1,7Гц), 5,21 (с, 4H), 7,39 (1,36л) і 48%мас., бромистоводневої кислоти (т, 1Н, J=7,1Гц), 7,41-7,50 (м, 3Н), 7,81 (д, 1Н, (1,36л) при -10°С. Після завершення додавання J=8,0Гц), 7,90 (д, 1Н, J=8,0Гц), 8,20 (д, 2Н, суміш о холоджують до -15°С. Додають розчин нітJ=8,8Гц). риту натрію (235г в 660мл води) протягом 30хв. і отриманий розчин перемішують без охолоджування ще протягом 30хв. У реакційному розчині розчиняють хлорид натрію (240г) і реакційну суміш екстрагують дихлорметаном (2x3л). Об'єднані органічні шари промивають насиченим сольовим розчином (3л), сушать (MgSO4) і упарюють до об'Стадія 4. п-Нітробензил 2-[(3S, 4R)-4єму 1,6л при зниженому тиску і температурі 25°С. (бензотіазол-2-илдитіо)-3-бром-2-оксоазетидин-1Отриманий розчин містить 6-бромпеніциланову іл]-3-метилбут-2-еноат кислоту і його безпосередньо використовують в п-Нітробензил (2R)-2-[(3S,4R)-4-(бензотіазолнаступній реакції. 2-ілдитіо)-3-бром-2-оксоазехидин-1-іл]-3-метилбутБезводний карбонат калію (288г), диметилфо3-еноат (5,1г) розчиняють в толуолі (50мл), охолормамід (2,8л) і 4-нітробензилбромід (500г) посліджують до 0°С і обробляють триетиламіном довно додають до отриманого розчину і суміш пе(0,12мл). Після перемішування при 0°С протягом ремішують при 35-40°С протягом 1год. Реакційний 2год. реакційний розчин промивають 1М НСI, ворозчин виливають в суміш води (2,8л) і дихлормедою, насиченим водним розчином гідрокарбонату тану (3,4л) і органічний шар відділяють. Органічнатрію і насиченим водним розчином хлориду наний шар промивають водою (2,8л) і насиченим трію, сушать (MgSO4) і упарюють при зниженому сольовим розчином (3л) і охолоджують до -2°С. тиску. Залишок наносять на хроматографічну коОрганічний шар містить п-нітробензил 6лонку з силікагелем, елююють сумішшю етилаце 49 78047 50 тат-гексан (1/3) і отримують вказану в заголовку лоджують до -20°С. Додають послідовно мурашисполуку у вигляді безбарвної твердої речовини ну кислоту (360г), оцтовий ангідрид (798г) і піридин (4,16г, 81%). Більш полярна фракція містить симе(145г), підтримуючи температуру нижче -10°С. Сутричний дисульфід у вигляді безбарвної твердої міш охолоджують до -20°С. Трифенілфосфін речовини (0,68г, 19%). (473г) додають порціями протягом 10хв., підтри1 муючи температуру між -15°С і -10°С. Після переН ЯМР (d, CDCl3): 2,01 (с, 3Н), 2,24 (с, 3Н), мішування при -15-10°С ще протягом 1год. отри5,01 (д, 1Н, J=1,7Гц), 5,24 і 5,30 (АВ, 2Н, J=13,1Гц), 5,35 (д, 1Н, J=1,7Гц), 7,34-7,42 (м, 1Н), 7,48-7,57 ману суспензію охолоджують до -30°С і потім фільтрують. Тверду речовину промивають холод(м, 1Н), 7,80 (д, 1Н, J=8,0Гц), 7,90 (д, 1Н, J=8,0Гц), ним (-30°С) толуолом (500мл). Об'єднаний фільт8,14 (д, 3Н, J=8,7Гц). рат промивають послідовно сумішшю крижаної Симетричний дисульфід: 1Н ЯМР (d, CDCl3): води (2л) і крижаного насиченого розчину хлориду 2,01 (с, 6Н), 2,29 (с, 6Н), 4,73 (д, 2Н, J=1,7Гц), 5,06 натрію, (0,26л), сумішшю крижаної води (1,72л) і (д, 2Н, J=1,7Гц), 5,32 (с, 4Н), 7,54 (д, 4Н, J=8,6Гц), крижаного насиченого розчину хлориду натрію 8,24 (д, 4Н, J=8,6Гц). (0,8л), холодним насиченим розчином гідрокарбонату натрію (2x2,6л) і холодним насиченим сольовим розчином (2,6л). Органічний шар сушать (MgSO4) і упарюють. Залишок наносять на хроматографічну колонку з силікагелем (6кг), елююють сумішшю етилацетат-гексан (1/2) і кристалізують вказану в заголовку сполуку з холодного ізопропаСтадія 5. п-Нітробензил 2-[(3S, 4R)-3-бром-4нолу (800мл). Тверду речовину відфільтровують, формілтіо-2-оксоазетидин-1-іл]-3-метилбут-2промивають холодним ізопропанолом (400мл), еноат сушать на повітрі протягом 1год. і у вакуумі над п-Нітробензил 2-[(3S,4R)-4-(бензотіазол-2Р2О5 при кімнатній температурі протягом ночі. ілдитіо)-3-бром-2-оксоазетидин-1-іл]-3-метилбут-2Отримують вказану в заголовку сполуку у вигляді еноат (3,16г) суспендують в толуолі (20мл) і охочервонувато-жовтої кристалічної речовини (553г, лоджують до -20°С. Додають послідовно мураши70%) ну кислоту (1,10г), оцтовий ангідрид (2,45г) і піридин (0,44г). Суміш охолоджують до -20°С. Трифенілфосфін (1,45г) додають порціями протягом 5хв. і перемішують при температурі від -15°С до -10°С протягом 1год., отриману суспензію охолоджують до -30°С і фільтрують. Тверду речовину на фільтрі промивають холодним (-30°С) толуолом (15мл). Об'єднаний фільтрат промивають послідовно сумішшю крижаної води (8мл) і насиченого крижаного розчину хлориду натрію (1мл), сумішшю крижаної води (7мл) і крижаного насиченого розчину хлориду натрію (3мл), холодним насиченим розчином гідрокарбонату натрію (2x11мл), і холодним насиченим сольовим розчином (11мл). Органічний шар сушать (MgSO 4) і упарюють. Залишок наносять на хроматографічну колонку з силікагелем, елююють сумішшю етилацетат-гексан (1/2) і вказану в заголовку сполуку кристалізують з холодного ізопропанолу (10мл). Тверду речовину відфільтровують, промивають холодним ізопропанолом (6мл) і сушать у вакуумі при кімнатній температурі протягом ночі. Отримують вказану в заголовку сполуку у вигляді безбарвної кристалічної речовини (1,87г, 77%), т.пл. 104-106°С; 1 Н ЯМР (d,CDCl3): 2,00 (с, 3Н), 2,30 (с, 3Н), 4,82 (д, 1Н, J=1,9Гц), 5,32 і 5,38 (АВ, 2Н, J=13,3Гц), 5,81 (д, 1Н, J=1,9Гц), 7,61 (д, 2Н, J=8,6Гц), 8,25 (д, 2Н, J=8,6Гц), 10,09 (с, 1Н). Послідовне одностадійне отримання пнітробензил 2-[(3S,4R)-3-бром-4-формілтю-2оксоазетидин-1-іл]-3-метилбут-2-еноату з 1-оксиду п-нітробензил-6-бромпеніциланату п-Нітробензил 6-бромпеніциланат-1-оксид (766г) і меркаптобензотіазол (294г) нагрівають в киплячому толуолі (2,4л) з азеотропним видаленням води (прилад Діна-Старка) протягом 1год. Реакційну суміш охолоджують до 0°С і обробляють триетиламіном (25мл). Після перемішування при 0°С протягом 2год. отриману суспензію охо Стадія 6. п-Нітробензил (5R,6S)-6-бромпенем3-карбоксилат п-Нітробензил 2-[(3S,4R)-3-бром-4формілтіо-2-оксоазетидин-1-іл]-3-метилбут-2еноат (300г) розчиняють в етилацетаті (7,5л) і охолоджують до -70°С. Через розчин, що енергійно перемішується, пропускають озонований кисень протягом приблизно 1,5год., до появи стійкого синього забарвлення. Розчин продувають азотом протягом 2,5год. і обробляють триметилфосфітом (384мл) при -70°С. Суміш повільно доводять до температури навколишнього середовища і продовжують перемішування протягом 17год. Потім розчин обережно нагрівають до кипіння і кип'ятять протягом 45хв. Після охолоджування до кімнатної температури суміш розбавляють етилацетатом (1,25л) і промивають водою (2x2,5л) і насиченим сольовим розчином (2,5л). Органічний шар сушать (MgSO4) і упарюють при зниженому тиску при 25°С. Твердий залишок розтирають в етилацетаті (0,6л) і по краплях додають гексан (0,45л) протягом 50хв. Тверду речовину відфільтровують і осад на фільтрі промивають сумішшю етилацетатгексан (1/1, 2x200мл) і сумішшю етилацетат-гексан (1/2, 300мл). Потім тверду речовину сушать на повітрі протягом 1год. і у вакуумі при кімнатній температурі протягом ночі. Отримують вказану в заголовку сполуку (109,6г, 42%) у вигляді безбарвної кристалічної речовини. Т.пл. 148-151°С. 1 Н ЯМР (d,CDCl3): 5,20 (д, 1Н, J=0,9Гц), 5,29 і 5,43 (АВ, 2Н, J=13,5Гц), 5,81 (д, 1Н, J=1,5Гц), 7,37 (д, 1Н, J=0,9Гц), 7,60 (д, 2Н, J=8,7Гц), 8,25 (д, 2Н, J=8,7Гц). 51 78047 52 бавляють етилацетатом і промивають 5% водним розчином лимонної кислоти, насиченим розчином гідрокарбонату натрію і насиченим сольовим розчином. Органічний шар сушать над MgSO4 і фільтрують через рихлий шар целіту. Ри хлий шар промивають етилацетатом. Фільтрат концентрують при зниженому тиску. Залишок наносять на хромаСтадія 7. Отримання п-нітробензил (5R)-6тографічну колонку з силікагелем, елююють сумі[ацетокси-(2,3-дигідроімідазо[2,1-b]тіазол-6шшю етилацетат-гексан (1/2-1/1) і отримують вкаіл)метил]-6-бромпенем-3-карбоксилату за допомозану в заголовку сполуку у ви гляді суміші двох гою Ph2NLi і ефірату MgBr2 діастереомерів (10/1, безбарвна аморфна тверда Ефірат MgBr2 (335мг) додають до розчину пречовина, 286мг, 90%). нітробензил (5R,6S)-6-бромпенем-3-карбоксилату Отримання п-нітробензил (5R)-6-[ацетокси(2,3(385мг) в сухому ТГФ (12мл) в атмосфері аргону дигідроімідазо[2,1-b]тіазол-6-іл)метил]-6при кімнатній температурі. С уміш охолоджують до бромпенем-3-карбоксилату за допомогою ефірату -78°С. Реакційну посудину закривають фольгою, MgBr2 і Et3Н щоб виключити вплив світла. Дифеніламід літію, Ефірат MgBr2 використовують в реакції замість отриманий додаванням н-бутиллітію (0,87мл, безводного MgBr2 і виділяють продукт з 84% вихо1,5моль/л в н-гексані) до розчину дифеніламіну дом. (220мг) в сухому ТГФ (4мл) при -20°С, додають в один прийом до суспензії, що енергійно перемішується. Через 15-20сек. суміш, що енергійно перемішується, обробляють в один прийом розчином 2,3-дигідроімідазо[2,1-b]тіазол-6-карбальдегіду (170мг) в сухому ацетонітрилі (5мл) однією порцією. Реакційну суміш перемішують протягом 1год. Стадія 8. (5R)-(Z)-6-(2,3-Дигідроімідазо[2,1при -78°С і обробляють оцтовим ангідридом b]тіазол-6-ілметилен)пенем-3-карбоксилат натрію (133мг) однією порцією. Температуру реакційної п-Нітробензил (5R)-6-[ацетокси(2,3суміші доводять до 0°С і перемішують протягом дигідроімідазо[2,1-b]тіазол-6-іл)метил]-61год. при 0°С. Суміш розбавляють етилацетатом і бромпенем-3-карбоксилат (500мг) розчиняють в промивають водою і насиченим сольовим розчиТГФ (7,0мл) і ацетонітрилі (3,2мл). Швидко доданом. Органічний шар сушать (MgSO4) і упарюють ють свіжеактивований цинковий пил (2,0г) з 0,5Μ при зниженому тиску. Залишок наносять на хромафосфа тним буфером (рН 6,5, 10,2мл). Реакційну тографічну колонку з силікагелем, елююють суміпосудину покривають фольгою, щоб виключити шшю етилацетат-гексан (1/2-1/1) і отримують вкавплив світла. Реакційну суміш енергійно перемізану в заголовку сполуку у ви гляді суміші двох шують протягом 2год. при кімнатній температурі. діастереомерів (3/1, безбарвна аморфна тверда Суміш розбавляють водою, охолоджують до 3°С і речовина, 447мг, 77%). додають 1М NaOH, щоб довести рН до 8. РеакційОсновний діастереоізомер: 1Н ЯМР (d,CDCl3): ний розчин змішують з етилацетатом і фільтрують 2,00 (с, 3Н), 3,76-3,86 (м, 2Н), 4,10-4,21 (м, 2Н), через рихлий шар целіту (Celite), який промивають 5,27 і 5,45 (АВ, 2Н, J=13,6Гц), 6,23 (с, 1Н), 6,30 (с, водою і водний шар відділяють. Водний шар міс1Н), 7,15 (с, 1Н), 7,48 (с, 1Н), 7,59-7,65 (м, 2Н), 8,24 тить 224мг (79%) вказаної в заголовку сполуки (д, 2Н, J=8,6Гц). (визначено ВЕРХ), його концентрують у високому Мінорний діастереоізомер: 1Н ЯМР (d,CDCl3): вакуумі при 35°С. Концентрат наносять на хрома2,24 (с, 3Н), 3,76-3,86 (м, 2Н), 4,10-4,21 (м, 2Н), тографічну колонку зі смолою Daiaion HP-21 (20мл, 5,27 і 5,45 (АВ, 2Н, J=13,6Гц), 6,08 (с, 1Н), 6,79 (с, Mitsubishi Kasei Co. Ltd.). Після абсорбції колонку 1Н), 6,91 (с, 1Н), 7,44 (с, 1Н), 7,59-7,65 (м, 2Н), 8,24 елююють водою, потім сумішшю 10% ацетонітрил(д, 2Н, J=8,6Гц). вода і отримують очищені активні фракції сполуки, Отримання п-нітробензил(5R)-6-Гацетокси(2,3вказаної в заголовку. Об'єднані фракції концентдигідроімідазо[2,1-b]тіазол-6-іл)метил]-6рують у високому вакуумі при 35°С, ліофілізують і бромпенем-3-карбоксилату за допомогою безводотримують вказану в заголовку сполуку у вигляді ного MgBr2 i Et3N жовтої аморфної твердої речовини (213мг, 75%). 2,3-Дигідроімідазо[2,1-b]тіазол-6-карбальдегід Дану аморфну тверду речовину розчиняють у воді (88мг) додають до розчину безводного MgBr2 (1,9мл), до розчину додають ацетон (8мл) при пе(115мг) в сухому ацетонітрилі (4мл) в атмосфері ремішуванні при кімнатній температурі, охолоджуаргону при кімнатній температурі. Протягом 30хв. ють до 3°С, потім перемішують протягом 30хв. осаджується безбарвний порошок. Додають розАцетон додають до суміші порціями по 2мл кожні чин п-нітробензил (5R,6S)-6-бромпенем-330хв. протягом 4год. при 3°С (всього додають карбоксилату (200мг) в сухому ТГФ (4мл), охоло16мл ацетону). Після перемішування протягом джують до -20°С, і додають триетиламін (0,18мл) в 1год. при 3°С, тверду речовину відфільтровують і один прийом. Реакційну посудину покривають фоосад на фільтрі промивають ацетоном (2мл). Твельгою, щоб виключити вплив світла . Реакційну рду речовину сушать на повітрі, за відсутності свісуміш перемішують протягом 3год. при -20°С і в тла протягом 1год., потім у вакуумі при кімнатній один прийом обробляють оцтовим ангідридом температурі протягом ночі і отримують вказану в (0,99мл). Реакційній суміші дають зігрітися до 0°С і заголовку сполуку (200мг, 71%) у вигляді жовтої перемішують протягом 16год. при 0°C. Суміш роз 53 78047 54 кристалічної речовини. ратурі. Суміш о холоджують до 3°С, потім перемі1 шують протягом 30хв. Ацетон додають до суміші Н ЯМР (d, D 2O) 3,82 (д, 2Н, J=7,4Гц), 4,14-4,20 (м, 2Н), 6,42 (с, 1Н), 6,82 (с, 1Н), 6,96 (с, 1Н), 7,42 порціями по 625мл кожні 30хв. протягом 4год. при 3°С (всього додають 5л ацетону). Після перемішу(с, 1Н). вання протягом 1год. при 3°С, тверду речовину Послідовне отримання (5R)-(Z)-6-(2,3відфільтровують і осад на фільтрі промивають дигідроімідазо[2,1-b]тіазол-6-ілметилен)пенем-3ацетоном (800мл). Тверду речовину суша ть на карбоксилату натрію з п-нітробензил (5R)-6[ацетокси(2,3-дигідроімідазо[2,1-b]тіазол-6повітрі за відсутності світла протягом 1год., потім у вакуумі при кімнатній температурі протягом ночі і іл)метил]-6-бромпенем-3-карбоксилату отримують вказану в заголовку сполуку (112г, п-Нітробензил (5R)-6-[ацетокси(2,350%) з п-нітробензил (5R)-6-[ацетокси(2,3дигідроімідазо[2,1-b]тіазол-6-іл)метил]-6дигідроімідазо[2,1-b]тіазол-6-іл)метил]-6бромпенем-3-карбоксилат (110,1г) додають до розчину безводного MgBr2 (143,4г) в сухому ацебромпенем-3-карбоксилату у вигляді жовтої кристалічної речовини. тонітрилі (5л) в атмосфері аргону при кімнатній (5R),(Z)-6-(2,3-Дигідроімідазо[2,1-b]тіазол-6температурі. Безбарвний порошок осаджується ілметилен)пенем-3-карбоксилат натрію з 4протягом 30хв. В отриману суспензію додають нітробензил (5R)-6-[ацетокси(2,3розчин п-нітробензил 6-бромпеніциланат-1-оксиду (250г) в сухому ТГФ (5л) через ПТФЕ тр убку при дигідроімідазо[2,1-b]тіазол-6-іл)метил]-6бромпенем-3-карбоксилату по методиці гідрогенопозитивному тиску аргону протягом 12хв. Після лізу охолоджування реакційної суміші до -20°С дода4-Нітробензил (5R)-6-[ацетокси(2,3ють за один прийом триетиламін (217мл). Реакційдигідроімідазо[2,1-b]тіазол-6-іл)метил]-6ну посудину покривають фольгою, щоб виключити вплив світла. Реакційну суміш перемішують протябромпенем-3-карбоксилат (116мг) і 10% Pd/C (50% вологи, 58мг) додають в суміш ТГФ (4мл) і 0,5Μ гом 3год. при -20°С і обробляють за один прийом фосфа тного буферу з рН 6,5 (4мл). Отриману суоцтовим ангідридом (133г). Реакційну суміш підіміш гідрують при тиску водня 40фунтів/кв.дюйм грівають до 0°С і перемішують протягом 16год. при при кімнатній температурi протягом 1год. Реакцій0°С. Суміш розбавляють етилацетатом (20л) і промивають 5% водним розчином лимонної кислону суміш фільтрують, охолоджують до 3°С і додають 1М NaOH для доведення рН до 8. Суміш знову ти (10л), насиченим розчином гідрокарбонату нафільтрують і фільтрат промивають етилацетатом. трію (10л) і насиченим сольовим розчином (10л). Об'єднаний водний шар концентрують при знижеОрганічний шар сушать (MgSO 4) і фільтр ують ченому тиску і температурі 35°С і наносять на хрорез рихлий шар целіту. Ри хлий шар промивають етилацетатом (1,4л). Фільтрат концентрують при матографічну колонку зі смолою Diaion HP-21 (7мл, Mitsubishi Kasei Co. Ltd). Після адсорбції зниженому тиску при 30°С. Залишок у вигляді коздійснюють елюювання водою, потім 10% розчиричневої олії містить 327г (86,7%) альдольного ном ацетонітрилу у воді. Об'єднані фракції, що продукту (за даними ВЕРХ). містять чистий продукт, концентрують при знижеОтриманий продукт у вигляді коричневої олії розчиняють в ТГФ (5,4л) і ацетонітрилі (2,5л). ному тиску при 35°С, ліофілізують і отримують вказану в заголовку сполуку у вигляді жовтої амоШвидко додають свіжеактивований цинковий пил рфної твердої речовини. (1,5кг) з 0,5Μ фосфатним буфером (рН 6,5, 7,9л). Приклад 2 Реакційну посудину покривають фольгою, щоб виключити вплив світла. Реакційну суміш енергійно перемішують протягом 2,5год., підтримуючи температуру близько 35°С, потім охолоджують до 3°С і додають крижаний 1Μ розчин NaOH (приблизно 1750мл) для доведення рН до 8 при температурі нижче 3°С. Суміш розбавляють етилацетатом (4л) і фільтрують через рихлий шар целіту. Ри хлий шар промивають водою (2,5л) і відділяють водний шар, який містить 137г (64%) вказаної в заголовку Стадія 1. 3,1'-Диметил-3Н,1'Нсполуки (за даними ВЕРХ), водний шар концент[2,4']біімідазоліл-4-карбальдегід рують до 8,85кг (близько 8л) у високому вакуумі трет-Бутоксид калію (3,23г) додають до суміші при 35°С. розчину 1Η,1'-[2,1']біімідазоліл-4-карбальдегіду Концентрат наносять на хроматографічну ко(1,95г) в сухому ДМФА (140мл) і 18-краун-6 (634мг) лонку з Sepabeads SP-207 (7л, Mitsubishi Kasei Co. при 0°С. Реакційну суміш перемішують 10хв. і обLtd.). Після абсорбції здійснюють елюювання воробляють метилйодидом (1,85мл). Після перемідою (14л), потім сумішшю 20% ацетонітрил-вода і шування протягом 30хв. при 0°С і потім протягом отримують фракції очищеного (5R)-(Z)-6-(2,317год. при кімнатній температурі, реакційну суміш дигідроімідазо[2,1-b]тіазол-6-ілметилен)пенем-3концентрують при зниженому тиску. Залишок розкарбоксилату натрію. чиняють в суміші Н2О-СНСl3 і розділяють. Водний Об'єднані фракції концентрують у високому шар екстрагують хлороформом. Об'єднані органівакуумі при 35°С до 1,25кг (приблизно 1л, містить чні шари сушать (MgSO4) і фільтрують. Фільтрат 130г (61%) (5R)-(Z)-6-(2,3-дигідроімідазо[2,1упарюють при зниженому тиску. Сирий продукт b]тіазол-6-ілметилен)пенем-3-карбоксилату натрію очищають колонковою хроматографією на силіка(за даними ВЕРХ). До концентрату додають ацегелі (співвідношення хлороформ-метанол станотон (2,5л) при перемішуванні при кімнатній темпе 55 78047 56 вить 9/1). Вказану в заголовку сполуку (887мг, 21 (60мл, Mitsubishi Kasei Co. Ltd.). Після адсорбції 39%) і її позиційний ізомер 1,1'-диметил-1Н,1'Нздійснюють елюювання водою, потім 5%-10% аце[2,4']біімідазоліл-4-карбальдегід (296мг, 13%) тонітрилом у воді. Об'єднані фракції концентрують отримують у вигляді блідо-рожевої твердої речоу високому вакуумі при 35°С, ліофілізують і отривини. мують вказану в заголовку сполуку у вигляді жов3,1'-Диметил-3Н,1'Н-[2,4']біімідазоліл-4тої аморфної твердої речовини (66,3мг, 19%). Т.пл. 113°С (з розкладанням). карбальдегід: 1Н ЯМР (d,CDCl3) 3,78 (с, 3Н), 4,37 1 (с, 3Н), 7,51 (д, 1Н, J=1,0Гц), 7,62 (д, 1Н, J=1,0Гц), Н ЯМР (d, D2O) 3,31 (с, 3Н), 3,52 (с, 3Н), 5,74 7,76 (с, 1Н), 9,71 (с, 1Н). (с, 1Н), 6,43 (с, 2Н), 6,70 (с, 1Н), 7,27 (с, 1Н), 7,46 1,1'-Диметил-1Н,1'Н-[2,4']біімідазоліл-4(s, 1H). Приклад 3 карбальдегід: 1Н ЯМР (d,CDCl3) 3,76 (с, 3Н), 4,10 (с, 3Н), 7,47 (д, 1Н, J=0,9Гц), 7,57 (с, 1Н), 7,59 (д, 1Н J=0,9Гц), 9,85 (с, 1Н). Стадія 2. 4-нітробензиловий ефір (5R,6RS)-6[(RS)-ацетокси (3,1'-диметил-3Н,1'Н[2,4']біімідазол-4-іл)метил]-6-бром-7-оксо-4-тіа-1азабіцикло[3.2.0]гепт-2-ен-2-карбонової кислоти 3,1'-Диметил-3Н,1'Н-[2,4']біімідазоліл-4карбальдегід (171мг) додають до розчину безводного MgBr2 (800мг) в сухому ацетонітрилі (20мл) в атмосфері азоту при кімнатній температурі. До Стадія 1. 2-Бензил-1Н-імідазол-4-карбальдегід отриманої суміші додають розчин 42-Фенілацетамідин (2г) додають до розчину 2нітробензилового ефіру (5R,6S)-6-бром-7-оксо-4бром-3-ізопропоксипропеналю (2,88г) в СHСI3 тіа-1-азабіцикло[3.2.0]гепт-2-ен-2-карбонової кис(30мл). Реакційну суміш перемішують протягом лоти (346мг) в сухому ТГФ (20мл), охолоджують до 1год. при кімнатній температурі. Потім до суміші -20°С і додають в один прийом триетиламін додають триетиламін (2,09мл), нагрівають і кип'я (0,768мл). Реакційну посудину покривають фольтять із зворотним холодильником протягом 6год. гою, щоб виключити вплив світла. Реакційну суміш Суміш охолоджують до кімнатної температури, перемішують 2год. при -20°С і обробляють за один розбавляють СНСІ3 і промивають 10% розчином прийом 4-диметиламінопіридином (22мг) і оцтовим гідрокарбонату калію. Органічний шар сушать ангідридом (0,17мл). Реакційну суміш доводять до (MgSO4) і концентрують при зниженому тиску. За0°С і перемішують протягом 17год. при 0°С. Суміш лишок наносять на хроматографічну колонку з розбавляють етилацетатом і промивають 5% водсилікагелем, потім елююють сумішшю етилацетат ним розчином лимонної кислоти, насиченим розгексан (3/1). Неочищену сполуку кристалізують з чином гідрокарбонату натрію і насиченим сольоетилацетату і н-гексану і отримують вказану в завим розчином. Органічний шар сушать (MgSO4) і головку сполуку (1,10г, 40%). 1 фільтрують. Фільтрат концентрують при зниженоН ЯМР (d,CDCl3) 4,17 (с, 2Н), 7,24-7,36 (м, му тиску. Залишок наносять на хроматографічну 5Н), 7,72 (уш.с, 1Н), 9,60 (уш.с, 1Н), 10,28 (уш.с, колонку з силікагелем, потім елююють сумішшю 1Н). хлороформ-метанол (9/1). Отримують вказану в Стадія 2. 4-Нітробензиловий ефір 2-бензил-4заголовку сполуку (507,6мг, 91,4%). формілімідазол-1-карбонової кислоти 1 Н ЯМР (d,CDCl3) 2,19 (с, 3Н), 3,75 (с, 3Н), 4,03 2-Бензил-1Н-імідазол-4-карбальдегід (1г) і гід(с, 3Н), 5,29 (д, 1Н, J=13,5Гц), 5,42 (д, 1Н, рокарбонат натрію (1,13г) розчиняють в діоксані J=13,5Гц), 6,03 (с, 1Н), 6,65 (с, 1H), 7,34 (с, 1H), (30мл) і воді (30мл). До отриманого розчину дода7,48 (д, 1Н, J=1,2Гц), 7,55 (д, 1Н, J=1,2Гц), 7,59ють 48,7% розчин п-нітробензилхлорформіату 7,61 (м, 3Н), 8,23-8,26 (м, 2Н). (PNZCI) в діоксані (2,63г) при 0°С і перемішують Стадія 3. Натрієва сіль (5R), (6Z)-6-(3,1'протягом 2,5год. Реакційну суміш розбавляють диметил-3Н,1'Н-[2,4']біімідазол-4-ілметилен)-7етилацетатом, промивають насиченим розчином оксо-4-тіа-1-азабіцикло[3.2.0]гепт-2-ен-2гідрокарбонату натрію і насиченим сольовим розкарбонової кислоти чином. Органічний шар суша ть (MgSO 4) і концент4-Нітробензиловий складний ефір (5R,6RS)-6рують при зниженому тиску. Залишок наносять на [(RS)-aцeтoкcи(3,1'-димeтил-3Н,1'Н-[2,4']біімідазолхроматографічну колонку з силікагелем, потім 4-іл)метил]-6-бром-7-оксо-4-тіа-1елююють сумішшю хлороформ-ацетон (9/1). азабіцикло[3.2.0]гепт-2-ен-2-карбонової кислоти Отримують вказану в заголовку сполуку у вигляді (596мг) розчиняють в суміші ТГФ (8,3мл) і ацетоніясно-коричневої олії (1,97г, 100%). 1 трилу (3,9мл). До отриманої суміші додають свіжеН ЯМР (d,CDCl3) 4,46 (с, 2Н), 5,42 (с, 2Н), активований цинковий пил (2,38г) і 0,5Μ фосфат7,19-7,30 (м, 5Н), 7,44-7,47 (м, 2Н), 8,06 (с, 1Н), ний буфер (рН 6,5, 12,2мл). Реакційну посудину 8,21-8,25 (м, 2Н), 9,91 (с, 1Н). покривають фольгою, щоб виключити вплив світСтадія 3. 4-Нітробензиловий ефір (5R,6RS)-6ла. Реакційну суміш енергійно перемішують протя{(RS)-ацетокси[2-бензил-1-(4гом 2год. при кімнатній температурі. Реакційний нітробензилоксикарбоніл)-1Н-імідазол-4-іл]метил}розчин змішують з етилацетатом і фільтрують че6-бром-7-оксо-4-тіа-1-азабіцикло[3.2.0]гепт-2-ен-2рез рихлий шар целіту. Ри хлий шар промивають карбонової кислоти водою, водний шар відділяють і концентрують у Розчин 4-нітробензилового ефіру 2-бензил-4високому вакуумі при 35°С. Концентрат наносять формілімідазол-1-карбонової кислоти (1,9г) в суна хроматографічну колонку зі смолою Diaion HP 57 78047 58 хому ацетонітрилі (10мл) додають до розчину безводного MgBr2 (2,41г) в сухому ацетонітрилі (50мл) в атмосфері азоту при кімнатній температурі. До отриманої суміші додають розчин 4нітробензилового ефіру (5R, 6S)-6-бром-7-оксо-4тіа-1-азабіцикло[3.2.0]гепт-2-ен-2-карбонової кислоти (2г) в сухому ТГФ (60мл), охолоджують до 20°С і додають триетиламін (1,8мл) за один прийом. Реакційну посудину покривають фольгою, Стадія 1. 4-Нітробензиловий ефір 4-форміл-2щоб виключити вплив світла. Реакційну суміш петіазол-2-ілімідазол-1-карбонової кислоти ремішують протягом 2 год. при -20°С і обробляють 2-Тіазол-2-іл-1Н-імідазол-4-карбальдегід 4-диметиламінопіридином (127мг) і оцтовим ангід(570мг) розчиняють в сухому СН 2СI2 (35мл). До ридом (0,98 мл) за один прийом. Реакційну суміш отриманого розчину при 0°С послідовно додають відігрівають до 0°С і перемішують протягом 16год. Ν,Ν'-діізопропілетиламін і 48,7% розчин ппри 0°С. Суміш розбавляють етилацетатом і пронітробензилхлороформіату (PNZCl) в діоксані мивають Н2О, насиченим розчином гідрокарбонату (1,69мл) і перемішують протягом 2год. Реакційну натрію і насиченим сольовим розчином. Органічсуміш розбавляють СНСІ3 і промивають насичений шар сушать (MgSO 4) і фільтрують через рихним розчином гідрокарбонату натрію і насиченим лий шар целіту. Ри хлий шар промивають етилацесольовим розчином. Органічний шар сушать татом. Фільтрат концентрують при зниженому (MgSO4) і концентрують при зниженому тиску. Затиску. Залишок наносять на хроматографічну колишок кристалізують з етилацетату і н-гексану і лонку з силікагелем, здійснюють елюювання воотримують вказану в заголовку сполуку (1,05г, дою, потім сумішшю етилацетат-гексан (2/3-1/1). 92%). Вказану в заголовку сполуку отримують у вигляді 1 суміші дво х діастереомерів (3/2), яка являє собою Н ЯМР (d,CDCl3) 5,49 (с, 2Н), 7,50 (д, 2Н, J=8,8Гц), 7,55 (д, 1Н, J=3,4Гц), 7,89 (д, 1Н, блідо-жовту аморфну тверду речовину (2,8г, 70%). 1 J=3,1Гц), 8,19 (с, 1Н), 8,24 (дкв, 2H, J=8,8 і 2,0Гц), Н ЯМР (d,CDCl3): 2,00 (с, 0,6 x 3Н), 2,26 (с, 0,4 9,97 (с, 1Н). x 3Н), 4,34-4,37 (м, 2Н), 5,25-5,47 (м, 4Н), 6,02 (с, Стадія 2. Натрієва сіль (5R),(6Z)-6-(2-тіазол-20,4 x 1Н), 6,22 (с, 0,6 x 1Н), 6,25 (с, 0,6 x 1Η), 6,85 іл-1Н-імідазол-4-ілметилен)-7-оксо-4-тіа-1(д, 0,4 x 1Η, J=1,5Гц), 7,14-7,62 (м, 11Н), 8,21-8,25 азабіцикло[3.2.0]гепт-2-ен-2-карбонової кислоти (м, 4Н). 4-Нітробензиловий ефір 4-форміл-2-тіазол-2Стадія 4. Натрієва сіль (5R),(6Z)-6-(2-Бeнзилілімідазол-1-карбонової кислоти (940мг) додають 1H-iмiдaзoл-4-iлмeтилeн)-7-оксо-4-тіа-1до розчину безводного MgBr2 (1,26г) в сухому ацеазабіцикло[3.2.0]гепт-2-ен-2-карбонової кислоти тонітрилі (35мл) в атмосфері азоту при кімнатній 4-нітробензиловий ефір (5R,6RS)-6-{(RS)температурі. До отриманої суміші додають розчин ацетокси[2-бензил-1-(4-нітробензилоксикарбоніл)4-нітробензилового ефіру (5R,6S)-6-бром-7-оксо-41Н-імідазол-4-іл]метил}-6-бром-7-оксо-4-тіа-1тіа-1-азабіцикло[3.2.0]гепт-2-ен-2-карбонової кисазабіцикло[3.2.0]гепт-2-ен-2-карбонової кислоти лоти (1,01г) в сухому ТГФ (28мл), охолоджують до (2,5г) розчиняють в ТГФ (35мл) і ацетонітрилі -20°С і за один прийом додають триетиламін (16,3мл). До отриманої суміші додають свіжеакти(0,942мл). Реакційну посудину покривають фольвований цинковий пил (10г) і 0,5Μ фосфатний бугою, щоб виключити вплив світла. Реакційну суміш фер з рН 6,4 (51,3мл). Реакційну посудину покриперемішують протягом 2,8год. при -20°С і обробвають фольгою, щоб виключити вплив світла. ляють 4-диметиламінопіридином (64мг) і оцтовим Реакційну суміш енергійно перемішують протягом ангідридом (0,495мл) за один прийом. Реакційну 2год. при кімнатній температурі. Суміш охолоджусуміш залишають зігріватися до 0°С і перемішують ють до 9°С і додають 1М водний розчин NaOH, протягом 20год. при 0°С. Суміш розбавляють етищоб довести рН до 7,5. Реакційний розчин змішулацетатом і промивають 0,1Μ фосфатним буфеють з етилацетатом і фільтрують через рихлий ром (рН 7), насиченим розчином гідрокарбонату шар целіту, шар промивають водою, відділяють натрію і насиченим сольовим розчином. Органічводний шар і концентрують його у високому вакуний шар сушать (MgSO 4) і фільтрують через рихумі при 35°С. Концентрат наносить на хроматоглий шар целіту. Ри хлий шар промивають етилацерафічну колонку зі смолою Diaion HP-21 (250мл, татом. Фільтрат концентрують при зниженому Mitsubishi Kasei Co. Ltd.). Після адсорбції здійснютиску. Залишок піддають грубому очищенню колоють елюювання водою, потім сумішшю 5-10% аценковою хроматографією на силікагелі (етилацетаттонітрил-вода. Об'єднані фракції концентрують у гексан 1/1-чистий етилацетат) і отримують сирий високому вакуумі при 35°С, ліофілізують і отриму4-нітробензиловий ефір (5R,6RS)-6-{(RS)ють вказану в заголовку сполуку у вигляді жовтої ацетокси[1-(4-нітробензилоксикарбоніл)-2-тіазол-2аморфної твердої речовини (780мг, 67%). іл-1Н-імідазол-4-іл]метил}-6-бром-7-оксо-4-тіа-1Т.пл.146°С (з розкладанням). 1 азабіцикло[3.2.0]гепт-2-ен-2-карбонової кислоти Н ЯМР (d, D2 O) 3,92 (с, 2Н), 6,39 (д, 1Н, (860мг). J=0,8Гц), 6,74 (с, 1Н), 6,89 (с, 1Н), 7,13-7,16 (м, Сирий 4-нітробензиловий ефір (5R,6RS)-63Н), 7,21-7,25 (м, 3Н). {(RS)-ацетокси[1-(4-нітробензилоксикарбоніл)-2Приклад 4 тіазол-2-іл-1Н-імідазол-4-іл]метил}-6-бром-7-оксо4-тіа-1-азабіцикло[3.2.0]гепт-2-ен-2-карбонової кислоти (860мг) розчиняють в ТГФ (12мл) і ацето 59 78047 60 нітрилі (5,6мл). До отриманого розчину додають тіа-1-азабіцикло[3.2.0]гепт-2-ен-2-карбонової киссвіжеактивований Zn пил (3,44г) і 0,5Μ фосфатний лоти (760мг) в сухому ТГФ (28мл), охолоджують до буфер (рН 6,4, 17,6мл). Реакційну посудину покри-20°С і за один прийом додають триетиламін вають фольгою, щоб виключити вплив світла. Реа(0,768мл). Реакційну посудину покривають фолькційну суміш енергійно перемішують протягом гою, щоб виключити вплив світла. Реакційну суміш 2год. при кімнатній температурі. Суміш змішують з перемішують протягом 2год. при -20°С і обробляетилацетатом і фільтрують через рихлий шар цеють за один прийом 4-диметиламінопіридином літу. Рихлий шар промивають водою, відділяють (48мг) і оцтовим ангідридом (0,371мл). Реакційній водний шар і концентрують його у високому вакусуміші дають зігрітися до 0°С і перемішують протяумі при 35°С. Концентрат наносять на хроматоггом 22год. при 0°С. Суміш розбавляють етилацерафічну колонку зі смолою Diaion НР-21 (90мл, татом і промивають 5% водним розчином лимонMitsubishi Kasei Co. Ltd.). Після адсорбції здійснюної кислоти, насиченим розчином гідрокарбонату ють елюювання водою, потім 2,5-5% розчином натрію і насиченим сольовим розчином. Органічацетонітрилу у воді. Об'єднані фракції концентруний шар сушать (MgSO 4) і фільтрують через рихють у високому вакуумі при 35°С, ліофілізують і лий шар целіту. Ри хлий шар промивають етилацеотримують вказану в заголовку сполуку у вигляді татом. Фільтрат концентрують при зниженому жовтої аморфної твердої речовини (126мг, 11% з тиску. Залишок наносять на хроматографічну ко7). Т.пл. 145°С (з розкладанням). лонку з силікагелем, потім елююють сумішшю ети1 лацетат-гексан (3/2). Вказану в заголовку сполуку Н ЯМР (d, D2O): 6,40 (д, 1Н, J=0,7Гц), 6,81 (с, отримують у вигляді суміші двох діастереомерів 1Н), 6,89 (с, 1Н), 7,38 (с, 1Н), 7,48 (д, 1Н, J=3,1Гц), (1/1), яка являє собою блідо-жовту аморфну твер7,71 (д, 1Н, J=3,3Гц). ду речовину (673,4мг, 52%). Приклад 5 1 Н ЯМР (d,CDCl3) 2,00 (с, 0,5 x 3Н), 2,28 (с, 0,5 x 3Н), 4,12 (с, 3Н), 5,28 (д, 0,5 x 1Н, J=13,5Гц), 5,29 (д, 0,5 x 1Н, J=13,5Гц), 5,44 (д, 0,5 x 1Н, J=13,5Гц), 5,47 (д, 0,5 x 1Н, J=13,5Гц), 6,16 (с, 0,5 x 1Н), 6,30 (с, 0,5 x 1Н), 6,42 (с, 0,5 x 1Η), 6,87 (д, 0,5 x 1Н, J=0,8Гц), 6,92 (д, 0,5 x 1Н, J=0,8Гц), 7,19 (с, 0,5 x 1Н), 7,34-7,36 (м, 1Н), 7,47 (с, 0,5 x 1Н), 7,50 (с, 0,5 Стадія 1. 1-Метил-2-тіазол-2-іл-1Н-імідазол-4x 1Н), 7,60-7,64 (м, 2Н), 7,83-7,85 (м, 1Н), 8,23-8,26 карбальдегід (м, 1Н). До розчину 2-тіазол-2-іл-1Н-імідазол-4Стадія 3. Натрієва сіль (5R),(6Z)-6-(1-метил-2карбальдегіду (717мг) і 18-краун-6 (106мг) в сухотіазол-2-іл-1Н-імідазол-4-ілметилен)-7-оксо-4-тіаму ТГФ (30мл) і сухому ДМФА (10мл) додають 1-азабіцикло[3.2.0]гепт-2-ен-2-карбонової кислоти трет-бутоксид калію (494мг) при кімнатній темпе4-Нітробензиловий ефір (5R,6RS)-6-[(RS)ратурі. Реакційну суміш перемішують протягом ацетокси(1-метил-2-тіазол-2-іл-1Н-імідазол-410хв. і обробляють метилйодидом (0,274мл). Після іл)метил]-6-бром-7-оксо-4-тіа-1перемішування протягом 17,5год. при кімнатній азабіцикло[3.2.0]гепт-2-ен-2-карбонової кислоти температурі суміш концентрують при зниженому (604мг) розчиняють в ТГФ (8,5мл) і ацетонітрилі тиску. Залишок розчиняють в етилацетаті і фільт(3,9мл). До отриманої суміші додають свіжеактирують. Фільтрат упарюють при зниженому тиску. вований Ζn пил (2,41г) і 0,5Μ фосфатний буфер з Сиру речовину очищають колонковою хроматогрН 6,4 (23,6мл). Реакційну посудину покривають рафією на силікагелі (етилацетат-гексан, 1/1). Вкафольгою, щоб виключити вплив світла. Реакційну зану в заголовку сполуку (410мг, 53%) і її позиційсуміш енергійно перемішують протягом 2год. при ний ізомер 1-метил-2-тіазол-2-іл-1Н-імідазол-5кімнатній температурі. Реакційний розчин змішукарбальдегід (240мг, 31%) отримують у вигляді ють з етилацетатом і фільтрують через рихлий білої твердої речовини. шар целіту. Ри хлий шар промивають водою, відді1-Метил-2-тіазол-2-іл-1Н-імідазол-4ляють водний шар і концентрують його у високому карбальдегід: 1Н ЯМР (d, CDCl3): 4,21 (с, 3Н), 7,44 вакуумі при 35°С. Концентрат наносять на хрома(д, 1Н, J=3,2Гц), 7,68 (с, 1Н), 7,89 (д, 1Н, J=3,2Гц), тографічну колонку зі смолою Diaion HP-21 (60мл, 9,91 (с, 1Н). Mitsubishi Kasei Co. Ltd.). Після адсорбції здійсню1-Метил-2-тіазол-2-іл-1Н-імідазол-5ють елюювання водою, потім 5% і 10% розчином 1 карбальдегід: Н ЯМР (d,CDCl3) 4,48 (с, 3Н), 7,51 ацетонітрилу у воді. (д, 1Н, J=3,1Гц), 7,82 (с, 1Н), 7,97 (д, 1Н, J=3,1Гц), Об'єднані фракції концентрують у високому 9,82 (с, 1Н). вакуумі при 35°С, ліофілізують і отримують вказаСтадія 2. 4-нітробензиловий ефір (5R,6RS)-6ну в заголовку сполуку у вигляді жовтої аморфної [(RS)-ацетокси(1-метил-2-тіазол-2-іл-1Н-імідазолтвердої речовини (231мг, 64%). Т.пл. 214°С (з роз4-іл)метил]-6-бром-7-оксо-4-тіа-1кладанням). 1 забіцикло[3.2.0]гепт-2-ен-2-карбоновоькислоти Н ЯМР (d, D2O): 3,91 (с, 3Н), 6,44 (с, 1Н), 6,84 1-Метил-2-тіазол-2-іл-1Н-імідазол-4(с, 1Н), 6,91 (с, 1Н), 7,43 (с, 1Н), 7,60 (д, 1Н, карбальдегід (380мг) додають до розчину безводJ=3,3Гц), 7,84 (д, 1Н, J=3,3Гц). ного MgBr2 (1,03г) в сухому ацетонітрилі (28мл) в Приклад 6 атмосфері азоту при кімнатній температурі. Протягом 10хв. випадає в осад безбарвний порошок. До отриманої суміші додають розчин 4нітробензилового ефіру (5R,6S)-6-бром-7-оксо-4
ДивитисяДодаткова інформація
Назва патенту англійськоюA process for preparation of 6-alkylidene penem derivatives
Назва патенту російськоюСпособ получения производных 6-алкилиденпенема
МПК / Мітки
МПК: C07D 498/00, C07D 487/00, C07D 519/00, C07D 499/00, C07D 513/00, C07D 471/00, C07D 495/00
Мітки: одержання, похідних, спосіб, 6-алкіліденпенему
Код посилання
<a href="https://ua.patents.su/61-78047-sposib-oderzhannya-pokhidnikh-6-alkilidenpenemu.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання похідних 6-алкіліденпенему</a>
Попередній патент: Ініціювальна вибухова речовина
Наступний патент: Спосіб сушіння довгомірних фото- та кіноплівок
Випадковий патент: Зброя