Спосіб підвищення продукції полікетидних сполук у streptomyces albus j1074
Номер патенту: 120622
Опубліковано: 10.11.2017
Формула / Реферат
Спосіб підвищення продукції полікетидних сполук у Streptomyces albus J1074, що ґрунтується на уведенні додаткової копії гена rpsL, який відрізняється тим, що використовують мутантний алель rpsLL90K, клонований у складі інтегративної плазміди pTOS.
Текст
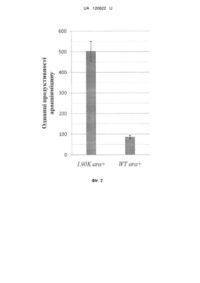
Реферат: Спосіб підвищення продукції полікетидних сполук у Streptomyces albus J1074, що ґрунтується L90K на уведенні додаткової копії гена rpsL, причому використовують мутантний алель rpsL , клонований у складі інтегративної плазміди pTOS. UA 120622 U (54) СПОСІБ ПІДВИЩЕННЯ ПРОДУКЦІЇ ПОЛІКЕТИДНИХ СПОЛУК У STREPTOMYCES ALBUS J1074 UA 120622 U UA 120622 U 5 10 15 20 25 30 35 40 45 50 55 Корисна модель стосується генетики бактерій та біотехнології і може бути використана для підвищення гетерологічної продукції штамом Streptomyces albus J1074 природних речовин полікетидної природи, що можуть мати біологічну дію, зокрема антибактерійну, імуносупресорну, противірусну та протиракову. Streptomyces albus J1074 - одна із найзручніших платформ для експресії кластерів генів актиноміцетного походження [Baltz RH. Streptomyces and Saccharopolyspora hosts for heterologous expression of secondary metabolite gene clusters // J. Ind. Microbiol. Biotechnol. - 2010. - Vol. 37. - P. 759-772]. Відомий спосіб, який ґрунтується на випадковій інтеграції гетерологічних генних кластерів у геном Streptomyces albus J1074 за допомогою транспозона Himar. Рівень продукції модельного полікетидного метаболіту, аранціяміцину, визначають спектрофотометрично. Виявлено клони, що продукують у 8 разів більше аранціяміцину, ніж штам з інтеграцією відповідного кластера у сайт attB-рhiС31 [Bilyk В., Horbal L., Luzhetskyy A. Chromosomal position effect influences the heterologous expression of genes and biosynthetic gene clusters in Streptomyces albus J1074 // Microb. Cell Fact. - 2017. - Vol. 16. - P. 5]. Проте, цей спосіб вимагає конструювання спеціалізованих векторів і отримання бібліотеки транспозонних мутантів для відбору найоптимальніших умов інтеграції гетерологічних генних кластерів. Пошук таких умов емпіричний, і не гарантує підвищення продукції у кожному досліджуваному випадку. Відомий спосіб, за яким бактерії порядку Streptomycetales (стрептоміцетів) вирощують за низьких концентрацій сполук-інгібіторів синтезу жирних кислот (триклозан) чи білкового синтезу (хлорамфенікол). У кінці циклу інкубації полікетидні сполуки екстрагують з клітин і вимірюють рівень їхньої продукції спектрофотометрично. За цих умов досягають підвищення продукції полікетидів на 40 %-100 % [Tanaka Y., Izawa M., Hiraga Y., Misaki Y., Watanabe Т., Ochi K. Metabolic perturbation to enhance polyketide and nonribosomal peptide antibiotic production using triclosan and ribosome-targeting drugs // Appl. Microbiol. Biotechnol. - 2017. - Mar 14. doi: 10.1007/s00253-017-8216-6]. Однак, цей спосіб не апробовано на штамі S. albus J1074. За умов промислової продукції, спосіб вимагатиме додавання у культуральні середовища значних кількостей сполуки-інгібітора, що може невиправдано збільшити вартість кінцевого продукту. Відомий спосіб, що включає секвенування кластерів генів біосинтезу вторинних метаболітів, їхню комп'ютерну анотацію та виявлення генів-регуляторів і використання останніх для активації транскрипції відповідних структурних генів біосинтезу антибіотиків за природних та гетерологічних умов. Нові речовини виявляють за біотестами та способами аналітичної хімії [Laureti L., Song L., Huang S., Corre C, Leblond P., Chain's G. L., Aigle B. Identification of a bioactive 51-membered macrolide complex by activation of a silent polyketide synthase in Streptomyces ambofaciens // Proc. Natl. Acad. Sci. USA-2011. - Vol. 108. - P. 6258-6263]. Однак, цей спосіб економічно невиправданий у великих масштабах, враховуючи тривалість і вартість усіх етапів конструювання рекомбінантних молекул ДНК для надекспресії генів. Автоматична анотація генних кластерів не завжди дає змогу ідентифікувати необхідні шляхспецифічні регуляторні гени, що збільшує ризик негативних результатів. Такий підхід не спрацює для тих кластерів генів вторинного метаболізму, що не кодують шлях-специфічні регулятори. Найближчим за технічною суттю - прототипом - є спосіб, що ґрунтується на надекспресії у клітинах Streptomyces lividans TK21 мутантних алелів гена rpsL, що кодує рибосомний білок S12 [Okamoto-Hosoya Y., Okamoto S., Ochi К. Development of antibiotic-overproducing strains by sitedirected mutagenesis of the rpsL gene in Streptomyces lividans II Appl. Environ. Microbiol. - 2003. Vol. 69. - P. 4256-4259]. Ген rpsL клонують полімеразною ланцюговою реакцєю з клітин Streptomyces lividans у реплікативний вектор pUC19, далі сайт-специфічним мутагенезом вносять заміни в його кодувальну послідовність. Мутантні алелі rpsL клонують у човниковий (Escherichia coli-Streptomyces) одноколійний вектор pV1 і переносять у Streptomyces lividans TK21 за допомогою трансформації протопластів. Рекомбінантні й батьківські штами порівнюють за рівнем антибіотичної активності, і так виявляють ті мутантні алелі, які призводять до підвищення продукції полікетидного антибіотика актинородину. Проте, у цьому підході ген rpsL знаходиться у складі реплікативного вектора і тому він втрачається у штамах, якщо їх вирощують за відсутності маркерного антибіотика - тіострептону. Рекомбінантні штами Streptomyces lividans незручні для подальшої генетичної роботи, оскільки містять маркерний ген стійкості до тіострептону. Тіострептон не є зручним маркерним антибіотиком, оскільки може впливати на синтез деяких білків, часто серед стрептоміцетів до 1 UA 120622 U 5 10 15 20 25 30 35 40 45 50 55 60 нього виникає стійкість, сам антибіотик є дорогим. Цей підхід також не апробовано у штамі S. albus J1074. В основу корисної моделі поставлено задачу удосконалити спосіб продукції полікетидів у стрептоміцетів шляхом безмаркерної інтеграції в геном Streptomyces albus J1074 мутантного L90K алеля гена rpsL , що дасть змогу підвищувати продукцію гетерологічних і ендогенних полікетидів цим штамом. Поставлена задача вирішується так, що у способі підвищення продукції полікетидів у стрептоміцетів, який ґрунтується на уведенні додаткової копії гена rpsL, використовують L90K мутантний алель rpsL , клонований у складі інтегративної плазміди pTOS. Полікетиди - один із найбільших класів природних сполук, що виявляють різноманітні біологічні властивості, зокрема й антибіотичні. Бактерії порядку Streptomycetales - одне із найбагатших джерел полікетидів [Zhan J. Biosynthesis of bacterial aromatic polyketides // Curr. Top. Med. Chem. - 2009. - Vol 9. - P. 1958-1610]. Існує значний інтерес у пошуку нових полікетидів та їхній надпродукції, що дасть змогу виявити і впровадити нові ліки проти низки загрозливих захворювань, таких як інфекції викликані Грам-позитивними патогенами та рак. Аналіз багатьох стрептоміцетних геномів показує, що їхній потенціал щодо продукції полікетидів значно вищий, ніж це випливає з результатів традиційного мікробіологічного скринінгу. Найпростіший доступ до хімічної різноманітності полікетидів, закодованої у геномах стрептоміцетів, відкриває гетерологічна експресія. Спосіб ґрунтується на уведенні великих фрагментів геномів різних стрептоміцетів у мікробіологічно та генетично зручний і добре вивчений штам. Streptomyces albus J1074 є визнаним господарем для гетерологічної експресії генних кластерів біосинтезу полікетидів. Авторами вперше запропоновано сконструювати S. albus J1074 меродиплоїдний за геном рибосомного білка S12-rpsL. Штам містить ген rpsL дикого типу та його мутантний алель, що L90K кодує білок S12 із заміщенням залишку лейцину у 90-ій позиції білка на лізин (L90K) - rpsL . Відомо, що такий алель підвищує продукцію різноманітних антибіотиків у стрептоміцетів [Ochi K. Insights into microbial cryptic gene activation and strain improvement: principle, application and technical aspects // J. Antibiot. - 2017. - Vol. 70. - P. 25-40]. Запропонований підхід має низку переваг порівняно із відомими способами підвищення продукції полікетидів. По-перше, його втілено на основі нового штаму, S. albus J1074, що характеризується швидшим і дисперснішим ростом, ніж інші штами-господарі гетерологічної експресії. По-друге, для створення меродиплоїдів використано інтегративний вектор pTOS [Siegl Т., Luzhetskyy A. Actinomycetes genome engineering approaches // Antonie Van Leeuwenhoek. - 2012. - Vol. 102. - P. 503-516]. L90K Після інтеграції в геном мутантний алель rpsL стабільно успадковується, що дає змогу відмовитися від використання селективних добавок у процесі ферментації. По-третє, будова pTOS дає змогу позбутися зайвих послідовностей вектора за рахунок їхньої сайт-специфічної ексцизії рекомбіназою Dre. Фіг. 1 Схема плазміди pS12_L90K (6,4 тпн), де: аас(3')IV - ген аміноглікозид ацетилтрансферази, що забезпечує стійкість до апраміцину; attP - ділянка аtt фага VWB; int - ген інтегрази фага VWB; oriT - ділянка кон'югаційного переносу плазміди RK2; ColE1ori - ділянка початку реплікації в Е. соli, XNR_3720 - ген rpsL Streptomyces albus J1074 за контролю власного промотора, клонований у сайти Kpnl-Xbal вектора pTOS; rox - ділянки розпізнавання для сайт-специфічної рекомбінази Dre. Фіг. 2. Стовпчикова діаграма середнього рівня продукції аранціяміцину, де: L90K аrа - рівень синтезу (в у.о. поглинання світла при 445 нм (ОГ 445)) рекомбінантним штамом S. albus L90K_ex ara+; WT аrа - рівень синтезу штамом дикого типу S. albus J1074 ara+. Спосіб можна проілюструвати прикладами: L90K Для експресії мутантного гена rpsL , що кодує рибосомний білок S12, конструюють плазміду pS12_L90K. Полімеразною ланцюговою реакцією із використанням полімерази Phusion з хромосомної ДНК S. albus J1074 ампліфікують послідовність ДНК розміром 960 п.н., що кодує рибосомний білок S12. Усі маніпуляції виконують згідно зі стандартними методиками [Sambrook J., Russell D. W. Molecular cloning, a laboratory manual. 3rd ed. // Cold Spring Harbor Laboratory, Cold Spring Harbor, N.Y. - 2001. - 450 P]. Для цього використовують пару праймерів rpsL_XbaIup (AAATCTAGAGTGGTTCCCCGTTCCCCGTC) та rpsL_Kpnlrp (AAAGGTACCTTACTTCTCCTTCTTGGCGC). Ампліфікований фрагмент містить як кодувальну послідовність (369 п.н.), так і промоторну послідовність. Амплікон елююють з агарозного гелю 2 UA 120622 U 5 10 15 20 25 30 35 40 45 50 55 відповідно до стандартних методик [Sambrook J., Russell D. W. Molecular cloning, a laboratory manual. 3rd ed. // Cold Spring Harbor Laboratory, Cold Spring Harbor, N.Y. - 2001. - 450 P.]; елюйований амплікон обробляють ендонуклеазами рестрикції Xbal та Kpnl. Далі вектор pTOS обробляють ендонуклеазами рестрикції Xbal та КрnІ. Отримані лінійні фрагменти вектора та досліджуваного гена лігують між собою, далі отриманою сумішшю трансформують компетентні клітини Е. соlі і відбирають трансформантів за стійкістю до апраміцину у концентрації 100 мкг/мл згідно зі стандартними методиками [Sambrook J., Russell D. W. Molecular cloning, a laboratory manual. 3rd ed. // Cold Spring Harbor Laboratory, Cold Spring Harbor, N.Y. - 2001. - 450 P.]. У сконструйованій плазміді pS12 транскрипція фрагмента гена XNR_3720 знаходиться за контролю власного промотора, як зображено на Фіг. 1. Отриманий вектор перевіряють за допомогою рестрикційного картування. Заміщення лейцинового кодона (СТС) у 90-ій позиції на лізинів (GAA) виконується за способом олігонуклетид-скерованого мутагенезу, згідно зі стандартними способами [Sambrook J., Russell D. W. Molecular cloning, a laboratory manual. 3rd ed. // Cold Spring Harbor Laboratory, Cold Spring Harbor, N.Y. - 2001. - 450 P]. Точність заміщення перевіряють за способом секвенування ДНК. Отриману плазміду позначають як pS12_L90K. Плазмідою pS12_L90K трансформують штам Е. соlі ЕТ12567 (pUZ8002), який за рахунок traгенів плазміди pUZ8002 забезпечує кон'югативне перенесення корезидентних плазмід [Paget М., Chamberlin L., Atrih A., Foster S., Buttner M. Evidence that the extracytoplasmic function sigma factor E is required for normal cell wall structure in Streptomyces coelicolor A3(2) // J. Bacteriol. - 1999. Vol. 181. - P.204-211]. Трансформацію здійснюють згідно зі стандартними методиками [Sambrook J., Russell D. W. Molecular cloning, a laboratory manual. 3rd ed. // Cold Spring Harbor Laboratory, Cold Spring Harbor, N.Y. - 2001. - 450 P.], трансформантів Е. соlі ЕТ12567 (pUZ8002, pS12_L90K) відбирають за стійкістю до апраміцину у концентрації 100 мкг/мл на середовищі із додаванням канаміцину в концентрації 50 мкг/мл (необхідний для підтримання плазміди pUZ8002). Плазміду pS12_L90K у штам S. albus J1074 переносять шляхом міжродової кон'югації зі штамом Е. соlі ЕТ12567 (pUZ8002, pS12_L90K). Далі проводять селекцію та відбирають апраміцин-стійкі клони стрептоміцета. Так отримують штам S. albus LK. Видаляють векторні послідовності pTOS із генома штаму LK за допомогою сайт-специфічної рекомбінази Dre. Видалення виконують як описано у [Siegl Т., Luzhetskyy A. Actinomycetes genome engineering approaches // Antonie Van Leeuwenhoek. - 2012. - Vol. 102. - P. 503-516]. Так L90K отримують меродиплоїдний (rpsL rpsL ) безмаркерний штам S. albus L90K_ex. У S. albus L90K_ex переносять косміду pOJ436ara [Luzhetskyy A., Mayer A., Hoffmann J., Pelzer S., Holzenkamper M, Schmitt В., Wohlert S.E., Vente A., Bechthold A. Cloning and heterologous expression of the aranciamycin biosynthetic gene cluster revealed a new flexible glycosyltransferase // Chembiochem. - 2007. - Vol. 8(6). - P. 599-602], що контролює синтез полікетидного протиракового антибіотика аранціяміцину, за допомогою міжродової кон'югації зі штамом Е. соlі ЕТ12567 (pUZ8002). Селекцію проводять за геном стійкості до апраміцину, що знаходиться на косміді. Так отримують штам S. albus L90K_ex ara+. Аналогічно отримують штам дикого типу S. albus WT ara+. Порівнюють рівні продукції аранціяміцину штамами дикого типу та меродиплоїдного штаму. При виконанні досліду використовують: для визначення температури - ртутний термометр з похибкою показів ± 0,5 °C; об'єму рідин - мірні циліндри з похибкою показів ± 0,5 мл та лабораторні дозатори з похибкою показів ± 0,05-0,5 мкл; маси речовин - аналітичну вагу "Sartorius" з похибкою показів ± 0,00005 г та лабораторну вагу AXIS з похибкою показів ± 0,05 г; час - електронним годинником з похибкою показів ± 0,5 сек. Штами аrа+ вирощують 24 год. при 30 °C у середовищі TSB (tryptic soy broth; Himedia) для отримання однорідної прекультури. Далі 600 мкл прекультури використовують для інокуляції 30 мл (у 250 мл колбах зі скляними кульками) основного середовища SG1 (г/л: глюкоза - 20, сойтон - 10, дріжджовий екстракт - 5, СаСО3 - 2; дистильована вода - до 1 л, рН 7,5). Після п'яти днів росту при 30 °C біомасу із 5 мл відділяють окремо від супернатанту центрифугуванням. До біомаси додають 2 мл суміші метанолу і диметилсульфоксиду (1:1), а до супернатанту рівний об'єм етилацетату та екстрагують постійно перемішуючи суміші упродовж 1 год. Після цього фракцію етилацетату відбирають та висушують у вакуумному концентраторі, а залишок розчиняють в екстракті, отриманому з біомаси, попередньо відділивши залишки біомаси центрифугуванням. Далі визначають оптичну густину отриманих загальних екстрактів при довжині хвилі 445 нм. 3 UA 120622 U 5 10 15 Із решти культури відбирають біомасу центрифугуванням, висушують та обраховують продукцію сухої біомаси в 1 мл культури (г/мл). Для обрахунку продукції аранціяміцину штамами, значення ОГ445 нормалізовують щодо маси сухої біомаси в 1 мл за формулою: Прод. (одиниці продуктивності, оп) = а*ОГ445/с*В, де а - кінцевий об'єм загального екстракту, мл; ОГ445 - оптична густина екстракту при довжині хвилі 445 нм; с - об'єм культури, з якої отримали екстракт, мл; В - маса сухої біомаси в 1 мл культури, г/мл. Згідно з описаною методикою визначають рівень синтезу аранціяміцину штамами S. albus L90K_ex ara+ та S. albus WT ara+. Дослід повторюють тричі та отримують наступні результати, представлені також на Фіг. 2: 503,48±48,89 оп для L90K_ex ara+ та 86,25±12,32 оп для WT аrа+. Тобто, меродиплоїдний штам синтезує у 5-6 разів більше аранціяміцину, ніж штам дикого типу. L90K Уведення мутантного алеля гена rpsL-rpsL - підвищує продукцію аранціяміцину порівняно з вихідним штамом. Це підтверджує отримання передбачуваного результату. ФОРМУЛА КОРИСНОЇ МОДЕЛІ Спосіб підвищення продукції полікетидних сполук у Streptomyces albus J1074, що ґрунтується на уведенні додаткової копії гена rpsL, який відрізняється тим, що використовують мутантний L90K алель rpsL , клонований у складі інтегративної плазміди pTOS. 4 UA 120622 U Комп’ютерна верстка М. Мацело Міністерство економічного розвитку і торгівлі України, вул. М. Грушевського, 12/2, м. Київ, 01008, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 5
ДивитисяДодаткова інформація
МПК / Мітки
МПК: C12Q 1/04, C12Q 1/00, C12Q 1/02
Мітки: j1074, продукції, streptomyces, albus, спосіб, сполук, підвищення, полікетидних
Код посилання
<a href="https://ua.patents.su/7-120622-sposib-pidvishhennya-produkci-poliketidnikh-spoluk-u-streptomyces-albus-j1074.html" target="_blank" rel="follow" title="База патентів України">Спосіб підвищення продукції полікетидних сполук у streptomyces albus j1074</a>
Попередній патент: Спосіб отримання нанокомпозитів поліаніліну з цинку оксидом
Наступний патент: Мехатронний захоплювальний пристрій для пляшок
Випадковий патент: Автомат для продажу страхових продуктів і автоматизована система надання страхових послуг