Біологічний мікрочіп для ідентифікації трансгенних і нетрансгенних послідовностей днк
Номер патенту: 30943
Опубліковано: 25.03.2008
Автори: Волков Сєргєй Ніколаєвіч, Піковський Ігор Александрович
Формула / Реферат
1. Біологічний мікрочіп, що являє собою мікроматрицю з чарунками, одні з яких містять іммобілізовані олігонуклеотиди-зонди, інші - олігонуклеотиди для контролю процедури тестування, а треті - варіативно, флуоресцентні фарбники для правильної орієнтації біологічного мікрочіпа при реєстрації результатів, який відрізняється тим, що як зонди використано олігонуклеотиди для іммобілізації, наведені в таблиці.
2. Біологічний мікрочіп за п. 1, який відрізняється тим, що олігонуклеотиди-зонди для іммобілізації комплементарні фрагментам типових маркерних та допоміжних послідовностей ДНК, що використовуються при генетичній трансформації рослин.
Текст
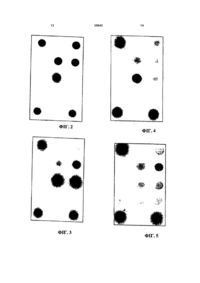
1. Біологічний мікрочіп, що являє собою мікроматрицю з чарунками, одні з яких містять іммобілізовані олігонуклеотиди-зонди, інші олігонуклеотиди для контролю процедури 3 послідовностям дослідних генів і регуляторних елементів, з подальшою гібридизацією цих фрагментів на біологічному мікрочипі, котрий містить оригінальний набір диференцуючих олігонуклеотидів. Використання вказаних праймерів дозволяє ампліфікувати фрагменти невеликого розміру біля 100 п.о. - трансгенної ДНК, якщо вона присутня у геномі дослідного джерела. Отримані одноланцюгові флуоресцентно мічені фрагменти ДНК здатні вступати в специфічну гібридизаційну взаємодію з олігонуклеотидами, іммобілізованими на біологічному мікрочипі. Відомий порядок розташування олігонуклеотидів на біологічному мікрочипі дає можливість встановити, які саме маркерні гени і регуляторні елементи входять до складу трансгенної і нетрансгенної ДНК. Розроблені умови гібридизації забезпечують високий ступінь диференціації між тими чарунками біологічного мікрочипа, де відбулася гібридизація, і тими, де специфічні гібриди не виникли. Дизайн праймерів та олігонуклеотидів забезпечує абсолютну специфічність їхньої взаємодії із знайденими трансгенними і нетрансгенними послідовностями ДНК. При цьому іммобілізований олігонуклеотид має іншу послідовність, ніж праймери для ампліфікації, що виключає можливість гібридизації в чарунці будьякої випадково ампліфікованої флуоресцентно міченої ДНК. Візуальну реєстрацію результатів гібридизації доповнено кількісною реєстрацією на основі спеціально пристосованої комп'ютерної програми, яка дозволяє точно визначити ступінь перевищення сигналу над рівнем фону. Заявлений біологічний мікрочип може бути застосованим у складі вимірювального комплексу, що має також апаратно-програмний комплекс для аналізу флуоресцентних зображень, які одержано на біологічних мікрочипах, що дозволяє перетворити флуоресценцію чарунок біологічного мікрочипа у цифровий формат, кількісно оцінювати флуоресцентний сигнал у будь-якому місці біологічного мікрочипа, визначати відношення флуоресцентного сигналу до фону у кожній чарунці біологічного мікрочипа і, відповідно, - співвідношення флуоресцентних сигналів у чарунках. У якості такого комплексу може бути використано комплекс «Євробіо-ВТО» Принципова схема виявлення фрагментів трансгенної ДНК. До виділеної зі зразка ДНК додають декілька пар праймерів, специфічних до консервативних областей маркерних генів і регуляторних ділянок ДНК, які звичайно використовуються при трансформації рослин. Проводять реакцію мультиплексної ПЛР в обраному режимі. Накопичення флуоресцентно мічених одноланцюгових ПЛР-продуктів досягається за рахунок надлишку в кожній з пар одного з праймерів, що варіативно містить на 5'-кінці флуоресцентну мітку. Отримані продукти ПЛР гібридизують на біологічному мікрочипі з іммобілізованими зондами, комплементарними послідовностям фрагментів детектованих генів і/або регуляторних елементів. 30943 4 Біологічний мікрочип є масивом мікрочарунок гідрогелю, закріплених на поверхні скла. В чарунках іммобілізовано набір олігонуклеотідів, комплементарних фрагментам трансгенних послідовностей ДНК. Кожна з чарунок містить індивідуальний ковалентно іммобілізований олігонуклеотід, причому іммобілізовані олігонуклеотіди мають іншу послідовність, ніж праймери на ті ж самі гени. Крім того, на біологічному мікрочипі розташовані чарунки з неспецифічними олігонуклеотидами, котрі відіграють роль негативного контролю гібридизації, а також чарунки, варіативно, марковані флуоресцентним фарбником і призначені для правильної орієнтації біологічного мікрочипа. Позиція на біологічному мікрочипі усіх чарунок, як дослідних, так і контрольних, строго детермінована. Поверхня біологічного мікрочипа, на якій розташовані мікрочарунки, закрита пластиковим корпусом гібридизаційної камери, котра разом зі склом створює замкнутий простір, що слугує проведенню гібридизації. Корпус камери обладнано відігнутим краєм для видалення камери після проведення та двома отворами для внесення зразку, які герметизують за допомогою липкої стрічки. Фрагменти ДНК, які вивчають, створюють досконалі стабільні гібридизаційні дуплекси тільки з відповідними (повністю комплементарними) олігонуклеотидами. З рештою олігонуклеотидів фрагменти ДНК, які вивчають, можуть формувати лише нестабільні недосконалі дуплекси. Диференціацію досконалих та недосконалих дуплексів виконують шляхом порівняння інтенсивностей флуоресценції чарунок, в котрих утворилися дуплекси. Інтенсивність сигналу в чарунці, в якій утворився досконалий гібридизаційний дуплекс, набагато разів вища, ніж в чарунці, де спроможний сформуватися лише недосконалий дуплекс. При цьому детермінований порядок розташування олігонуклеотидів в чарунках біологічного мікрочипа дає можливість встановити, які саме маркерні гени і регуляторні елементи входять до складу трансгенної ДНК. Результати гібридизації може бути інтерпретовано однозначно як візуально, так і за допомоги програми «Біо-1», що входить до складу апаратнопрограмного комплексу «Євробіо-ВТО» для аналізу флуоресцентних зображень, що їх отримують на біологічних мікрочипах. Винахідниками запропоновано набір специфічних олігонуклеотидів, що наведено нижче у табл., які використовуються в якості праймерів для ПЛР, продукт якої використовують при ідентифікації трансгенних послідовностей ДНК. Запропонованою корисною моделлю є біологічний мікрочип, що являє собою мікроматрицю з чарунками, одні з яких містять іммобілізовані олігонуклеотиди-зонди, інші олігонуклеотиди для контролю процедури тестування, треті - видові ділянки генів нетрансгенних рослин, четверті, варіативно, флуоресцентні фарбники для правильної орієнтації біологічного мікрочипа при реєстрації результатів, який відрізняється тим, що у якості 5 зондів використано олігонуклеотиди, наведені в Таблиці, комплементарні фрагментам типових маркерних і допоміжних послідовностей ДНК, котрі використовуються при генетичній трансформації рослин. Ідентифікація трансгенних послідовностей ДНК в рослинному матеріалі та продуктах на основі такого матеріалу включає стадії, на яких: а) ПЛР проводять на препараті ДНК у вигляді мультіплексної реакції з варіативним отриманням флуоресцентно міченого продукту, при цьому використовують специфічні пари праймерів, один з яких, варіативно, флуоресцентно мічений та присутній у надлишку по відношенню до іншого неміченого праймера; б) результати ПЛР аналізують за допомоги гібридизації на біологічному мікрочипі; в) результати аналізу реєструють за допомоги апаратно-програмного комплексу, котрий дозволяє відображати флуоресценцію на екрані комп'ютера, кількісно визначати флуоресцентний сигнал в будь-якій точці біологічного мікрочипа, визначати відношення величин до фону в кожній чарунці біологічного мікрочипа і, відповідно, співвідношення їх в чарунках. Реєстрація результатів гібридизації на стадії (в) може бути виконана за допомоги апаратнопрограмного комплексу "Євробіо-ВТО", який дозволяє перетворювати отримати результати у цифровому форматі та здійснювати математичну обробку даних. Крім того, при необхідності посилення гібридизаційного сигналу реакцію ПЛР на стадії (а) можливо проводити у двох стадіях, спочатку як симетричну мультіплексну ПЛР, а далі як асиметричну мультіплексну ПЛР з варіативним включенням флуоресцентно мічених праймерів. Запропонований біологічний мікрочип дозволяє визначити видові гени рослин та їх трансгенних аналогів, а також збільшити кількость видів ДНК, що підлягають визначенню. Крім того, він дозволяє значно збільшити кількість детектуємих мішеней. Запропоновані у якості праймерів олігонуклеотиди дозволяють аналізувати значно більш деградовану ДНК. Можливість реєстрації результатів за допомоги вимірювального комплексу, котрий містить запропонований біологічний мікрочип та апаратнопрограмний комплекс «Євробіо-ВТО » для перетворення отриманих результатів у цифровий формат та виконання подальшої математичної обробки дозволяє встановити рівень інтенсивності флуоресцентного сигналу в кожній чарунці та однозначно інтерпретувати результати гібридизації. У подальшому надано детальний опис корисної моделі із залученням прикладів її конкретного здійснення з посиланням на креслення, на яких: Фіг.1. демонструє схему біологічного мікрочипа для ідентифікації трансгенних рослинних об'єктів; Фіг.2. - результат гібридизації на біологічному мікрочипі та виявлення маркерних генів npt та gus, промоторів nos та 35S у зразку ДНК з картоплі сорту Desiree. 30943 6 Фіг.3 - результат гібридизації на біологічному мікрочипі та виявлення маркерного гену npt, промотора nos, термінатора ocs у зразку ДНК з трансгенного тютюну. Фіг.4 - результат гібридизації на біологічному мікрочипі та виявлення маркерного гену npt у зразку ДНК з продукту харчування. Фіг.5 - результат гібридизації на біологічному мікрочипі зразку ДНК з нетрансформованої рослини. Безпосередньо перед випробуванням готують суміш у мікропробірках для проведення мультіплексної ПЛР, до складу якої входять: реакційний буфер для ПЛР; суміш дезоксінуклеотид-трифосфатів в концентрації 200мкМ кожного; декілька пар праймерів у кількості 5-10 пмолей для варіативно флуоресцентно мічених праймерів та 0,5-2 пмолей для немічених праймерів; 12,5 одиниць активності термостабільної Taq ДНК-полімерази, а також дослідна сумарна ДНК у кількості 1-3мкг на пробу. Склад праймерів представлений у наведеній нижче таблиці. Мікропробірки розміщують у програмованому термостат-термоциклері та проводять реакцію ПЛР в наступному режимі: денатурація при 95°С - 30с (в першому циклі 5хв.), відпал при 60(±5)°С - 30с, елонгація при 72°С - 30с (в останньому циклі - 5хв.), загалом близько 35-45 циклів. Для проведення гібридизації аліквоту зразка, отриманого в результаті ПЛР, змішують з буфером гібридизації з доведенням компонентів останнього до наступних концентрацій: GuSCH - 1М, HEPES, рН 7,5-50мМ, EDTA - 5мМ. Отриману суміш розміщують на біологічному мікрочипі, герметично закривають гібридизаційною камерою та проводять гібридизацію при 37°С на протязі 14-18 годин. Після гібридизації біологічний мікрочип тричі споліскують дистильованою водою при 25 °С та висушують. Реєстрацію гібридизаційної картини здійснюють, використовуючи апаратно-програмний комплекс «Євробіо-ВТО» з програмою «Біо-1». Виготовлення олігонуклеотидного біологічного мікрочипа для виявлення маркерних генів та регуляторних ділянок ДНК, які використовуються при трансформації рослин. Олігонуклеотиди синтезують на автоматичному синтезаторі (типу 394 DNA/RNA фірми Applied Biosystems, США) та містять спейсер із вільною аміногрупою 3'-Amino-Modifier C7 CPG 500 (Glen Research, США) для подальшої іммобілизації в гель або 5'-Amino-Modifier C6 (Glen Research, США) для введення флуоресцентної мітки. Введення флуоресцентної мітки Су-5 («Биочип-ИМБ», Росія) здійснюють відповідно до рекомендацій виробника. Гелеві чарунки біологічного мікрочипа наносять на скляну підкладку у вигляді крапель з максимальною акуратністю та відтворюваністю за допомоги роботів. Кожна сформована чарунка є півсферою діаметром 200-250мкм і періодом біля 300мкм та містить іммобілізований олігонуклеотид-зонд, комплементарний послідовності гену або регуляторного елементу 7 (промотора і термінатора), котрі використовуються при генетичній модифікації рослин. Структура біологічного мікрочипа. Біологічний мікрочип містить десять іммобілізованих олігонуклеотидів-зондів, список яких наведено в таблиці, три маркерні точки для правильного позиціонування (захоплення зображення), яке виконує программа «Біо-1», та три чарунки, що містять неспецифічні до дослідних геномів олігонуклеотиди, котрі відіграють роль негативного контролю. Розташування іммобілізованих на мікрочипі олігонуклеотидів показано на Фіг.1. Послідовності іммобілізованих олігонуклеотидів наведено в таблиці. Реєстрацію гібридизаційної картини здійснюють, використовуючи апаратно-програмний комплекс «Євробіо-ВТО». Інтерпретація результатів гібридизації здійснюється шляхом порівняння інтенсивності флуоресцентного сигналу в чарунках 35SI, gusl, nosl, nptl, ocsl, bar, cryl, lecitin, zein, EPSPS з інтенсивністю в чарунках NC (Фіг.1), які служать негативним контролем. Якщо відношення хоча б одного з цих сигналів перевищувало порогове значення, яке визначають для кожної з чарунок, що аналізують, та задають в програмі «Біо-12», то слідує висновок про те, що дослідний зразок є трансгенним, тобто містить чужорідний ДНК. Приклади Приклад 1 Аналіз присутності чужорідних послідовностей в ДНК з трансгенної картоплі. ДНК з трансформованої картоплі сорту Desiree виділяли стандартним методом та використовували в наведеній вище процедурі тестування. Використовували праймери та іммобілізовані олігонуклеотиди для маркерних генів npt II та gus, а також для промотора 35S вірусу мозаїки кольорової капусти, промотора nos і термінатора ocs агробактерії A.tumefaciens, а також bar, cryl, lecitin,zein, EPSPS. Підготовка проб для проведення гібридизації на мікрочипі методом мультиплексної ПЛР. В 27мкл ПЛР-суміші вносили 3мкл розчину ДНК, виділеного з дослідного зразка. Склад ПЛР-суміші: 1хПЛР-буфер: 50мм КСІ, 10мм Tris-HCl (pH 9.0 при 250°С), 0,1% Triton® X-100 (Силекс, Росія) 2мм MgCl2 (Силекс, Росія) 200мкМ кожного dNТР (Силекс, Росія) 12,5 од. термостабільної Taq ДНК-полімерази (Силекс, Росія) 1мкл суміші праймерів (наведена нижче таблиця). Ампліфікацію проводили на програмованому термоциклері «Терцик» (ДНК-Технологія, Росія) з наступним режимом: 95°С - 30с, 62°С - 30с, 72°С 30с; 43 цикла (у першому циклі час денатурації збільшували до 5хв., в останньому - час добудови до 5хв.). На Фіг.2 представлено картину гібридизації на біологічному мікрочипі флуоресцентно мічених продуктів ПЛР. Видно, що чотири чарунки дають сильний флуоресцентний сигнал, що набагато разів перевищує фонову флуоресценцію чарунок 30943 8 негативного контролю NC. Чарунки, які флуоресціюють, містять послідовності генів npt II та gus, а також промоторів 35S та nos. Чарунка, що відповідає термінатору ocs, а також bar, cryl, lecitin, zein, EPSPS, зберегла фонову флуоресценцію. Результат даного тестування можливо однозначно інтерпретувати як позитивний, тобто такий, що виявляє трансгенну природу даного рослинного зразка. Це ж саме тестування встановлює, що в рослинний геном вбудовані маркерні гени npt II та gus, а також промотери 35S та nos. Приклад 2 Аналіз присутності чужорідних послідовностей в ДНК з трансгенного тютюну. Випробування проводили аналогічно наведеному в прикладі 1. На Фіг.3 зображена картина гібридизації на біологічному мікрочипі флуоресцентно мічених продуктів ПЛР. Видно, що три чарунки дають сильний флуоресцентний сигнал, що набагато разів перевищує фонову флуоресценцію чарунок негативного контролю NC. Чарунки, які флуоресціюють, містять послідовності гену npt II, термінатора ocs, а також промотора nos. Ячейки, що містять олігонуклеотиди, комплементарні фрагментам ocs та 35S, а також bar, cryl, lecitin, zein, EPSPS зберегли фонову флуоресценцію. Результат даного тестування можна однозначно інтерпретувати як позитивний, тобто такий, що виявляє трансгенну природу даного рослинного зразка. Це ж саме тестування встановлює, що в рослинний геном вбудовані ген npt II, а також промотор nos, термінатор ocs. Приклад 3 Аналіз присутності чужорідних послідовностей ДНК з продукту харчування (паштет "Популярний", Черкизівський завод). Випробування проводили аналогічно наведеному в прикладі 1. Картина гібридизації на біологічному мікрочипі флуоресцентно мічених продуктів ПЛР представлено на Фіг.4. Флуоресцентний сигнал спостерігається лише в чарунці, що містить олігонуклеотид, комплементарний послідовності фрагмента npt II. В решті чарунок біологічного мікрочипа, що аналізували, інтенсивність сигналу близька до інтенсивності в чарунках негативного контролю. Отже, піддослідний продукт харчування містить генетично модифікований рослинний компонент, що визначається за наявністю гену npt II. Приклад 4 Аналіз присутності чужорідних послідовностей ДНК нетрансформованої рослини. Випробування проводили аналогічно наведеному в прикладі 1. Картина гібридизації на біологічному мікрочипі флуоресцентно мічених продуктів ПЛР представлено на Фіг.5. Результати показують, що жодна з дослідних чарунок не дає флуоресцентного сигналу, який достовірно перевищує сигнал контрольних чарунок. Це свідчить про нетрансгенну природу піддослідної ДНК. 9 Головною перевагою запропонованого біочіпу є одночасний аналіз присутності в піддослідній ДНК одразу великої кількості різних генів та їх регуляторних областей, котрі звичайно використовуються при отриманні трансгенних рослин. Це дозволяє не тільки надійно дискримінувати трансгенні та нетрансгенні зразки ДНК, але й однозначно визначити, які конкретно маркерні гени присутні в трансгенному матеріалі. При цьому велика кількість послідовностей, що підлягають детектируванню, не робить процедуру більш складною для виконання, тому що стадія ПЛР-ампліфікації фрагментів ДНК та стадія гібридизації на мікрочипі виконуються за один підхід незалежно від кількості піддослідних послідовностей. Велика кількість послідовностей ДНК, що підлягають тестуванню, робить малоймовірним хибно негативні результати, тому що імовірність виявити хоча б один фрагмент чужорідної ДНК наближується тут до 100%. Важливо також те, що трансгенні рослини мають, як правило, декілька різних вбудованих в геном послідовностей. Тому у випадку присутності трансгенного матеріалу в первинному зразку сигнал буде частіше всього спостерігатися одразу в декількох чарунках із зондами, специфічними до різних мішеней, кожна з яких служить незалежним підтвердженням позитивного результату тестування, що знижує імовірність хибно позитивних результатів. Наведені приклади ілюструють переваги запропонованої корисної моделі, що одержані завдяки освоєнню генною інженерією нових регуляторних ділянок ДНК та маркерних генів для створення трансгенних рослин. Для досягнення високої надійності запропонованого біочипу додатково здійснено наступні заходи. По-перше, іммобілізовані зонди відповідають внутрішній частині специфічних фрагментів ДНК-мішеней, які ампліфікуються. Це виключає можливість неспецифічної гібридизації будь-якої випадково ампліфікованої ДНК. Подруге, в структуру самого біологічного мікрочипа введено чарунки, котрі відіграють роль негативного контролю. По-третє, довжини фрагментів ДНК, які ампліфікуються, складають біля 100 п.о., що надає можливість виявляти трансгенні послідовності навіть в сильно деградованих до довжин 150-200 н.о зразках ДНК. Крім того, в процесі тестування кожної серії зразків передбачено використання позитивного та негативного контролю порівняння - зразків ДНК, виділеної з охарактеризованих трансгенної та нетрансгенної рослин. Високі чутливість та специфічність біочипу обумовлені тим, що для ідентифікації поєднані переваги двох найбільш чутливих та специфічних способів аналізу геному: полімеразної ланцюгової реакції (ПЛР) та специфічної гібридизації. ПЛР збільшує кількість шуканих послідовностей ДНК в мільйон і більше разів, що є досить достатнім для достовірної та кількісної детекції флуоресцентного сигналу. Виходячи з цього, для надійного виявлення трансгенів у первинній ДНК досить наявності 30943 10 усього 105-106 однакових трансгенних послідовностей, що відповідає приблизно 1-10 фг, тобто 10"15-10"14г їхньої ДНК. Подібна чутливість відповідає одній з самих високих з відомих на даний час методів виявлення трансгенів. Компоненти для ПЛР можуть біти виготовлені заздалегідь в одній суміші, а сама реакція ПЛР займає не більше 1,5 години. Гібридизація на біологічному мікрочипі походить без участі персоналу і може проводитися у неробочій час, тобто на протязі ночі. Відмивання чипа після гібридизації та аналіз флуоресценції та/або оптичної щільності чарунок на апаратнопрограмному комплексі «Євробіо-ВТО» потребують мінімуму трудових затрат та можуть бути виконані на протязі хвилини. Строк зберігання біологічних мікрочипів, що пройшов гібридизацію, складає кілька років, при цьому повторна реєстрація може бути здійснена будьякої миті. Комплекс «Євробіо-ВТО» дозволяє зберігати в пам'яті комп'ютера як зображення, так і цифрові значення флуоресцентного сигналу. Таким чином, зручність та швидкість тестування, а також об'єктивність аналізу дозволяють здійснювати випробування великої кількості зразків ДНК паралельно в строго ідентичних умовах, не потребуючи у жодної зі стадій висококваліфікованого персоналу. При цьому зберігається скільки завгодно довго можливість повторного аналізу біологічного мікрочипа після гібридизації. Назва Назва Довж., Призначення маркеру олігонуклеотиду и.о. праймер ПЛР праймер ПЛР GE-4-2 up 26 GE-6 lo 22 40 GE-9 up 24 GE-9 lo 25 H39 up 40 GE-14 up 24 GE-14 lo 21 H45 up GUS 34 H37 up NPTn 34 GE-7 up ocs 24 H35-m lo NOS GE-6 lo H35-m up 35S 24 28 5' іммобілізація AATCATAAAAACCCA 3' праймер 5' P -AGATATGCGAG ПЛР праймер 5' biotip -GCGGTAAGG ПЛР 5' іммобілізація CAATTCTGTTG1GCA праймер 5' Р-ССTGTCATCTCA ПЛР праймер 5' biotip -CGATGTTTC ПЛР іммобілізація 5' P -GGCTGCATACG GE-13 up 25 праймер іммобілізація гібридиз., перевірка праймер ПЛР праймер ПЛР 5' P - GCGTCATCCCT 5' biotip - CATTGCGAT 5' P - CATCTTTGGG 3 5' AAGATGCCTCTGCCG 5' P - ACCCA'fCrCATA 5' biotip - TGCCGGTC 5' P -TCACCTGCGTCA 11 30943 ПЛР праймер ПЛР 12 GE-13 lo H43 up 27 Zel lo 27 33 20 GE-15 lo 21 H46 up 32 H46 lo 32 GE-16 up 25 GE-16 lo 22 H47 up 30 H47 lo 30 GE-17 up 22 GE-17 lo 23 H48 up 32 H48 lo -K 30 GE-15 up +K 23 ZeH2 up EPSPS Le7 lo Zel up cry1Ab 22 LeH7 up bar 38 Le7 up Zein 38 H43 lo Lectin 25 5' biotip -CCAGCCATGCACACTGATACTCTTC 3' 32 P-GE-13 up P-GE14-51 up (NC2) 25 5' Pіммобілізація GGAGAAACTGCATCAGCCGATTATCATCACCGAATACG 3' 5' biotinгібридиз., CGTATTCGGTGATGATAATCGGCTGATGCAGTTTCTCC перевірка 3' праймер 5' P-CTCTTGGTCGCGCCCTCTACTC 3' ПЛР праймер 5' biotin-GAGAAAGAAGGCAAGCCCATCTG 3' ПЛР іммобілізація 5' P-TGCCAGCTTCGCCGCTTCCTTCAACTTCAC 3' праймер 5' P-CTAGTGCCATTATTCCACAGTTCCTCC 3' ПЛР праймер 5' biotin-TGTATGGTTAGATGTGCCAAGGATTGT 3' ПЛР іммобілізація 5' P-CGGCGAGCGTCTTACAACAACCAATTGCCCAAT 3' праймер 5' P-GGCACGCAACGCCTACGACT 3' ПЛР праймер 5' biotin-GTCCAGCTGCCAGAAACCCAC 3' ПЛР іммобілізація 5' P-TCTACACCCACCTGCTGAAGTCCCTGGAGGCA 3' гібридиз., 5' biotin-TGCCTCCAGGGACTTCAGCAGGTGGGTGTAGA перевірка 3' праймер 5 P-AGCCAAGACCTCGAGATTTACCTGA 3' ПЛР праймер 5' biotin-AGGAGAAGTGGTGGCTGTGGTG 3' ПЛР іммобілізація 5' P-CGTCAACGTGCCCGGTACTGGTTCCCTCTG 3' гібридиз., 5' biotin-CAGAGGGAACCAGTACCGGGCACGTTGACG 3' перевірка праймер 5' P-AATCCTCTGGCCTTTCCGGAAC 3' ПЛР праймер 5' biotin-TATTGATGACGTCCTCGCCTTCC 3' ПЛР іммобілізація 5' С -CAAGTCGATCTCCCACCGGTCCTTCATGTTCG 3' гібридиз., 5' biotin-CGAACATGAAGGACCGGTGGGAGATCGACTTG перевірка 3' іммобілізація 5' P-GAAGAGTATCAGTGTGCATGGCTGG 3' 21 іммобілізація 5' P-CGACGACCATGCGACACATAG 3' 0,1 0,1 0,1 0,1 0,1 0,1 0,1 0,1 0,1 0,1 0,1 13 30943 14
ДивитисяДодаткова інформація
Назва патенту англійськоюBiological microchip for identification of transegene and non- transegene dna sequences
Автори англійськоюVolkov Serhii Mykolaiovych, Pikovskyi Ihor Oleksandrovych
Назва патенту російськоюБиологический микрочип для идентификации трансгенных и нетрансгенных последовательностей днк
Автори російськоюВолков Сергей Николаевич, Пиковский Игорь Александрович
МПК / Мітки
МПК: C07H 19/00
Мітки: біологічний, послідовностей, нетрансгенних, трансгенних, ідентифікації, мікрочіп, днк
Код посилання
<a href="https://ua.patents.su/7-30943-biologichnijj-mikrochip-dlya-identifikaci-transgennikh-i-netransgennikh-poslidovnostejj-dnk.html" target="_blank" rel="follow" title="База патентів України">Біологічний мікрочіп для ідентифікації трансгенних і нетрансгенних послідовностей днк</a>
Попередній патент: Спосіб виготовлення позитивного електрода для плаского гнучкого джерела струму
Наступний патент: Спосіб одержання дифенілфосфорнокислої солі ди(2-хлоретил)аміну
Випадковий патент: Установка для зварювання та рихтування карданних валів