Антитіло до cd38
Номер патенту: 110226
Опубліковано: 10.12.2015
Автори: Ландес Грегорі, Сінгх Швета, Корвер Ваутер, Снелл Гіоргі Пал, Еліас Кетлін Енн, Хаак-Френдсхо Мері, Бхаскар Вінай, Дрейк Ендрю Уоллінг
Формула / Реферат
1. Виділене антитіло, що специфічно зв'язується з CD38 людини (SEQ ID NO: 1) і CD38 яванського макака (SEQ ID NO: 2), що містить:
а) варіабельну область важкого ланцюга, що містить:
і) першу CDR, яка містить SEQ ID NO: 3;
іі) другу CDR, яка містить SEQ ID NO: 4;
ііі) третю CDR, яка містить SEQ ID NO: 5, і
б) варіабельну область легкого ланцюга, що містить:
і) першу CDR, яка містить SEQ ID NO: 6;
іі) другу CDR, яка містить SEQ ID NO: 7;
ііі) третю CDR, яка містить SEQ ID NO: 8.
2. Виділене антитіло за п.1, яке відрізняється тим, що варіабельна область важкого ланцюга містить SEQ ID NO: 9.
3. Виділене антитіло за п. 1, яке відрізняється тим, що варіабельна область легкого ланцюга містить SEQ ID NO: 10.
4. Виділене антитіло за п. 1, яке відрізняється тим, що варіабельна область важкого ланцюга містить SEQ ID NO: 9, а зазначена варіабельна область легкого ланцюга містить SEQ ID NO: 10.
5. Виділене антитіло за п. 1, яке відрізняється тим, що важкий ланцюг містить SEQ ID NO: 21, а легкий ланцюг містить SEQ ID NO: 22.
6. Виділене антитіло, що специфічно зв'язується з CD38 людини (SEQ ID NO: 1) і CD38 яванського макака (SEQ ID NO: 2), що містить:
а) варіабельну область важкого ланцюга, що містить:
і) першу CDR, яка містить SEQ ID NO: 13;
іі) другу СDR, яка містить SEQ ID NO: 14;
ііі) третю CDR, яка містить SEQ ID NO: 15, і
б) варіабельну область легкого ланцюга, що містить:
і) першу CDR, яка містить SEQ ID NO: 16;
іі) другу CDR, яка містить SEQ ID NO: 17;
ііі) третю CDR, яка містить SEQ ID NO: 18.
7. Виділене антитіло за п. 6, яке відрізняється тим, що зазначена варіабельна область важкого ланцюга містить SEQ ID NO: 11.
8. Виділене антитіло за п. 6, яке відрізняється тим, що зазначена варіабельна область легкого ланцюга містить SEQ ID NO: 12.
9. Виділене антитіло за п. 6, яке відрізняється тим, що зазначена варіабельна область важкого ланцюга містить SEQ ID NO: 19, а зазначена варіабельна область легкого ланцюга містить SEQ ID NO: 20.
10. Виділене антитіло за п. 6, яке відрізняється тим, що важкий ланцюг містить SEQ ID NO: 34, а легкий ланцюг містить SEQ ID NO: 35.
11. Виділене антитіло за п. 1 або 6, яке відрізняється тим, що додатково містить Fc-домен.
12. Виділене антитіло за п. 11, яке відрізняється тим, що зазначений Fc-домен є Fc-доменом людини.
13. Виділене антитіло за п. 7, яке відрізняється тим, що зазначений Fc-домен є варіативним Fc-доменом.
14. Виділена нуклеїнова кислота, яка кодує важкий ланцюг за п. 2 або 7.
15. Виділена нуклеїнова кислота, яка кодує легкий ланцюг за п. 3 або 8.
16. Клітина-хазяїн, яка містить виділені нуклеїнові кислоти за п. 14 або 15.
17. Спосіб одержання антитіла за п. 1 або 6, що включає культивування клітини-хазяїна за п. 16 в умовах, при яких продукується зазначене антитіло.
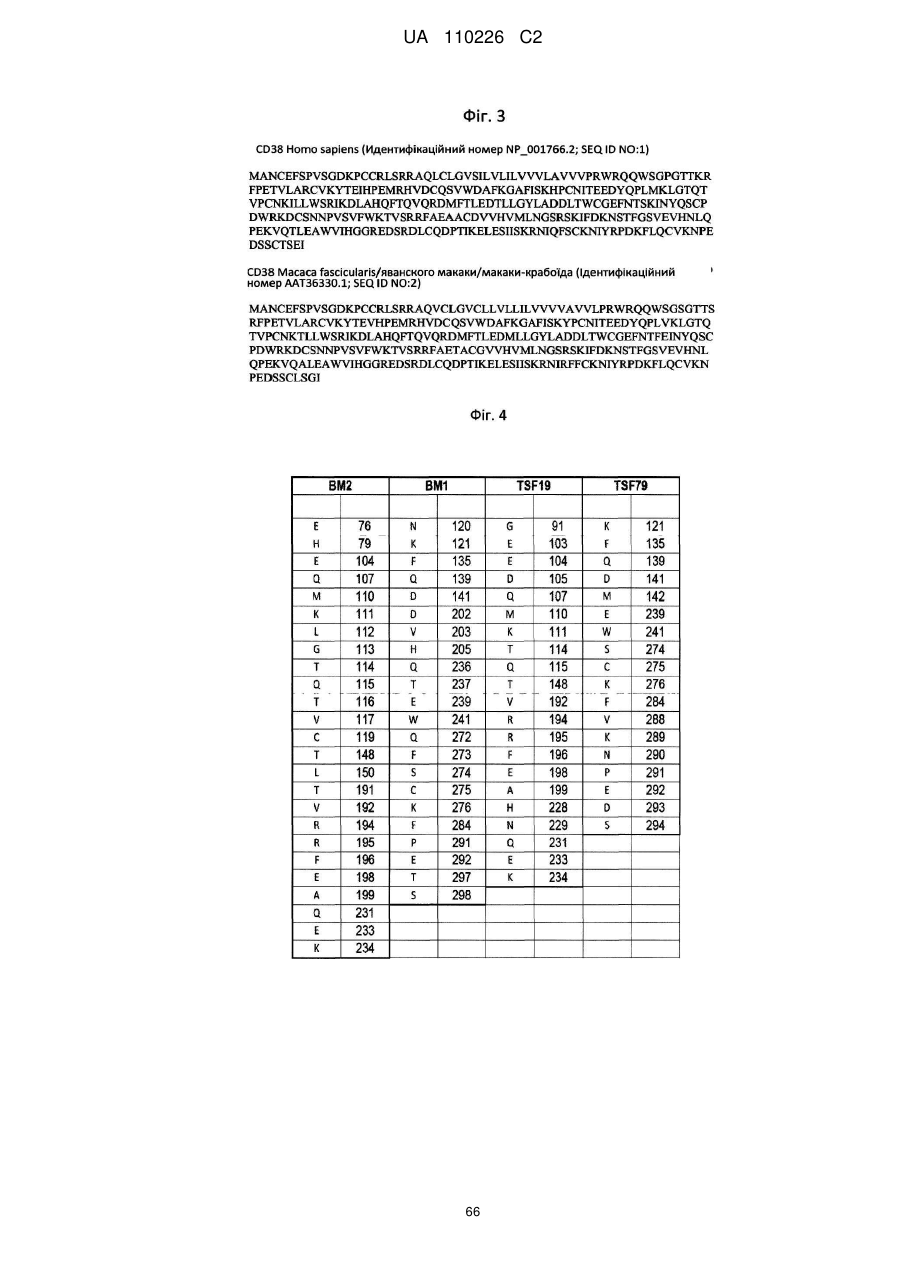
18. Спосіб інгібування біологічної активності білка CD38 людини (SEQ ID NO: 1) і CD38 яванського макака (SEQ ID NO: 2) шляхом контакту зазначеного білка з антитілом за будь-яким з пп. 1-5, 11 та 12, яке взаємодіє з щонайменше K121, F135, Q139, D141, Е239, W241, С275, K276, F284, Р291 і Е292 SEQ ID NO: 1 і SEQ ID NO: 2.
19. Спосіб лікування аутоімунного захворювання, що включає введення пацієнтові, який цього потребує, виділеного антитіла, що специфічно зв'язується з CD38 людини (SEQ ID NO: 1) і CD38 яванського макака (SEQ ID NO: 2), що містить:
а) варіабельну область важкого ланцюга, що містить:
і) першу CDR, яка містить SEQ ID NO: 3;
іі) другу CDR, яка містить SEQ ID NO: 4;
ііі) третю CDR, яка містить SEQ ID NO: 5, і
б) варіабельну область легкого ланцюга, що містить:
і) першу CDR, яка містить SEQ ID NO: 6;
іі) другу CDR, яка містить SEQ ID NO: 7;
ііі) третю CDR, яка містить SEQ ID NO: 8.
20. Спосіб за п. 19, який відрізняється тим, що зазначене аутоімунне захворювання вибране із групи, яка складається з ревматоїдного артриту, системного червоного вовчака, запального захворювання кишечнику, неспецифічного виразкового коліту й реакції трансплантата-проти-хазяїна.
Текст
Реферат: Винахід належить до антитіла проти CD38 людини (SEQ ID NO: 1) та СD38 яванського макака (SEQ ID NO: 2), виділеної нуклеїнової кислоти, клітини-хазяїна, способу одержання зазначеного антитіла та способу лікування за допомогою вказаних антитіл. UA 110226 C2 (12) UA 110226 C2 UA 110226 C2 [0001] Ця заявка просить пріоритет відповідно до § 119 (е) 35 Зведення Законів США відповідно до заявками США: № 61/428,699, поданої 30 грудня 2010 р.; № 61/470,382, поданої 31 березня 2011 р.; № 61/470,406, поданої 31 березня 2011 р. і № 61/485,104, поданої 11 травня 2011 р., усі включені в цей документ у всій своїй повноті шляхом посилання. 5 10 15 20 25 30 35 40 45 50 55 [0002] CD38, також відомий як цАДФР-гідролаза, є трансмембранним глікопротеїном II типу з довгим С-кінцевим позаклітинним доменом і коротким N-кінцевим цитоплазматичним доменом. CD38 є членом групи розчинних фермент або ферментів, зв'язаних з мембраною, яка включає CD157 і АДФР-циклазу молюска Aplysia. Це сімейство ферментів має унікальну здатність перетворювати НАД у циклічну аденозиндифосфорибозу або нікотинова кислота-аденіндинуклеотид фосфат. 2+ [0003] У доповнення до цього повідомлялося, що CD38 бере участь у мобілізації Са і в передачі сигналу через Tyr-фосфорилювання численних сигнальних молекул, у тому числі фосфоліпази С, ZAP-70, syk і з-cbl. На підставі цих спостережень було зроблене припущення, що CD38 є важливою сигнальною молекулою в дозріванні й активації лімфоїдних клітин під час їх нормального розвитку. [0004] Серед гемопоетичних клітин була приписана безліч функціональних ефектів, які приписані CD38-опосередкованому сигналингу, включаючи проліферацію лімфоцитів, вивільнення цитокінів, регулювання розвитку й виживання B- і мієлоїдних клітин і індукції дозрівання дендритних клітин. [0005] Проте, точна роль CD38 у передачі сигналу та гемопоезі залишається нез'ясованою, тому що в більшості досліджень передачі сигналу були використані клітинні лінії, які ектопічно надекспресували CD38 і моноклональні антитіла до CD38, які є нефізіологічними лігандами. [0006] Передбачуваним природнім лігандом CD38 є CD31 (PECAM-1; ендотеліальна молекула клітинної адгезії тромбоцитів-1). CD31(молекулярна маса 130kD) є членом суперсімейства імуноглобулінів, які експресуються на поверхні циркулюючих тромбоцитів, нейтрофілів, моноцитів і наївних В-лімфоцитів. Функціонально CD31, як вважають, діє як адгезивна молекула. Було висловлене припущення, що взаємодія CD38 з CD31 може сприяти виживаності лейкозних клітин. [0007] Тваринні моделі, дефіцитні по одній молекулі, у багатьох випадках були основними засобами для розуміння біологічної ролі молекули в організмі тварини. Основоположним припущенням є те, що якщо білок проявляє безнадлишкову функцію, то його повна відсутність приведе до повної втрати функції. [0008] Були отримані CD 38-нокаутні миші. Ці тварини демонструють практично повну втрату активності тканинного НАД. Проте, ці тварини є життєздатними, що приводить до висновку про те, що CD38 і його функції не є необхідними для життя. Ці миші, проте, демонструють дефект їх вродженого імунітету й знижену Т-клітинну гуморальну імунну відповідь. [0009] На відміну від результатів, отриманих на мишах, у людини існує сильний непрямий доказ, що відсутність CD38 несумісна з життям. Аналіз більше 5000 зразків крові немовлят не змогли визначити хоча б одного CD38 індивідуума; що дає змогу припустити, що на відміну від мишей, CD38 необхідний для виживання. Таким чином, не зрозуміло, чи можуть спостереження, зроблені по відношенню функції CD38 у мишей, бути екстрапольовані на людей. [0010] CD38 активується в багатьох гематопоетичних злоякісних пухлинах і в клітинних лініях, отриманих з різних гематопоетичних злоякісних пухлин, включаючи неходжкінську лімфому (НХЛ), лімфому Беркітта (ЛБ), множинну мієлому (ММ), B-клітинний хронічний лімфолейкоз (В-ХЛЛ), В-клітинний і Т-клітинний гострий лімфоцитарний лейкоз (ГЛЛ), Т-клітинну лімфому (TCL), гострий мієлоїдний лейкоз (ГМЛ), волосатоклітинний лейкоз (ВКЛ), лімфому Ходжкіна (ЛХ) і хронічний мієлолейкоз (ХМЛ). З іншого боку, більшість примітивних плюрипотентних стовбурних клітин кровотворної системи є CD38 (фігура 1). [0011] Незважаючи на недавній прогрес у відкритті й розробці протиракових засобів, багато форм раку, що утягують у патологічний процес CD 38-експресуючі пухлини, дотепер мають несприятливий прогноз. Таким чином, існує потреба в поліпшених способах лікування таких форм рака. СУТЬ ВИНАХОДУ [0012] У цьому документі пропонуються реагенти й способи для зв'язування з CD38 і способи лікування CD38-асоційованих захворювань і виявлення CD38 з використанням CD38специфічних зв'язуюючих агентів, включаючи антитіла, специфічні до CD38. [0013] У зв'язку з цим в деяких варіантах втілення цього винаходу описується виділене антитіло, специфічне до CD38 людини (SEQ ID NO: 1) і CD38 яванського макака (SEQ ID NO: 2). Це антитіло складається з варіабельної області важкого ланцюга й варіабельної області легкого 1 UA 110226 C2 5 10 15 20 25 30 35 40 45 50 55 ланцюга, яке відрізняється тим, що варіабельна область важкого ланцюга складається із трьох гіперваріабельних ділянок (CDRs) HCDR1, HCDR2 і HCDR3 і яке відрізняється тим, що варіабельна область легкого ланцюга також складається із трьох CDRs, LCDR1, LCDR2 і LCDR3. Послідовності CDRs представлені: HCDR1 (SEQ ID NO: 3), HCDR2 (SEQ ID NO: 4), HCDR3 (SEQ ID NO: 5), LCDR1 (SEQ ID NO: 6), LCDR2 (SEQ ID NO 7) і LCDR3 (SEQ ID NO: 8). [0014] В інших варіантах втілення цього винаходу виділене антитіло складається з варіабельної області важкого ланцюга, яке відрізняється тим, що послідовність варіабельної області важкого ланцюга охоплюється SEQ ID NO: 9. В інших варіантах втілення цього винаходу виділене антитіло складається з варіабельної області легкого ланцюга, яке відрізняється тим, що послідовність варіабельної області легкого ланцюга охоплюється SEQ ID NO: 10. [0015] У деяких варіантах втілення цього винаходу виділене антитіло складається з варіабельної області важкого ланцюга, яке відрізняється тим, що послідовність варіабельної області важкого ланцюга охоплюється SEQ ID NO: 9. В інших варіантах втілення цього винаходу виділене антитіло складається з варіабельної області легкого ланцюга, яке відрізняється тим, що послідовність варіабельної області легкого ланцюга охоплюється SEQ ID NO: 10. Ця комбінація варіабельної області важкого ланцюга й варіабельної області легкого ланцюга називається Ab79. [0016] У деяких варіантах втілення цього винаходу виділене антитіло складається з важкого ланцюга й легкого ланцюга, яке відрізняється тим, що послідовність важкого ланцюга охоплюється SEQ ID NO: 11 і легкий ланцюг охоплюється SEQ ID NO: 12. [0017] У деяких варіантах втілення цього винаходу виділене антитіло містить Fc-домен. В інших варіантах втілення цього винаходу Fc-домен є Fc-доменом людини. В інших варіантах втілення цього винаходу Fc-домен є варіантним Fc-доменом. [0018] У деяких варіантах втілення цього винаходу пропонується виділена нуклеїнова кислота, яка кодує важкий ланцюг SEQ ID NO: 11. В інших варіантах втілення цього винаходу пропонується виділена нуклеїнова кислота, яка кодує легкий ланцюг SEQ ID NO: 12. [0019] У деяких варіантах втілення цього винаходу пропонується клітина-хазяїн, клітинахазяїн, яка містить виділену нуклеїнову кислоту, що кодує важкий ланцюг SEQ ID NO: 11 і виділену нуклеїнову кислоту, що кодує легкий ланцюг SEQ ID NO: 12. [0020] У деяких варіантах втілення цього винаходу пропонується спосіб одержання антитіла відповідно до цього винаходу. Спосіб охоплює культивування клітини-хазяїна, яка містить виділену нуклеїнову кислоту, що кодує важкий ланцюг SEQ ID NO: 11 і виділену нуклеїнову кислоту, що кодує легкий ланцюг SEQ ID NO: 12 в умовах, які відрізняються тим, що експресуються виділена нуклеїнова кислота (и) і продукується антитіло. [0021] У деяких варіантах втілення цього винаходу описується виділене антитіло, специфічне до CD38 людини (SEQ ID NO: 1) і CD38 яванського макака (SEQ ID NO: 2). Це антитіло складається із шести CDRs, яке відрізняється тим, що кожна CDR цього антитіла може відрізнятися від SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7 і SEQ ID NO: 8 на 0, 1 або 2 амінокислотні заміни. [0022] В інших варіантах втілення цього винаходу описується виділене антитіло, специфічне до CD38 людини (SEQ ID NO: 1) і CD38 яванського макака (SEQ ID NO: 2). Це антитіло складається з варіабельної області важкого ланцюга й варіабельної області легкого ланцюга, яке відрізняється тим, що варіабельна область важкого ланцюга складається із трьох гіперваріабельних ділянок (CDRs) HCDR1, HCDR2 і HCDR3 і яке відрізняється тим, що варіабельна область легкого ланцюга також складається із трьох CDRs, LCDR1, LCDR2 і LCDR3. Послідовності CDRs представлені: HCDR1 (SEQ ID NO: 13), HCDR2 (SEQ ID NO: 14), HCDR3 (SEQ ID NO: 15), LCDR1 (SEQ ID NO: 16), LCDR2 (SEQ ID NO: 17) і LCDR3 (SEQ ID NO: 18). [0023] В інших варіантах втілення цього винаходу виділене антитіло складається з варіабельної області важкого ланцюга, яке відрізняється тим, що послідовність варіабельної області важкого ланцюга охоплюється SEQ ID NO: 19. В інших варіантах втілення цього винаходу виділене антитіло складається з варіабельної області легкого ланцюга, яке відрізняється тим, що послідовність варіабельної області легкого ланцюга охоплюється SEQ ID NO: 20. [0024] У деяких варіантах втілення цього винаходу виділене антитіло складається з варіабельної області важкого ланцюга, яке відрізняється тим, що послідовність варіабельної області важкого ланцюга охоплюється SEQ ID NO: 19. В інших варіантах втілення цього винаходу виділене антитіло складається з варіабельної області легкого ланцюга, яке відрізняється тим, що послідовність варіабельної області легкого ланцюга охоплюється SEQ ID 2 UA 110226 C2 5 10 15 20 25 30 35 40 45 50 55 60 NO: 20. Ця комбінація варіабельної області важкого ланцюга й варіабельної області легкого ланцюга називається Ab19. [0025] У деяких варіантах втілення цього винаходу виділене антитіло складається з важкого ланцюга й легкого ланцюга, яке відрізняється тим, що послідовність важкого ланцюга охоплюється SEQ ID NO: 21 і легкий ланцюг охоплюється SEQ ID NO: 22. [0026] У деяких варіантах втілення цього винаходу пропонується виділена нуклеїнова кислота, яка кодує важкий ланцюг SEQ ID NO: 21. В інших варіантах втілення цього винаходу пропонується виділена нуклеїнова кислота, яка кодує легкий ланцюг SEQ ID NO: 22. [0027] У деяких варіантах втілення цього винаходу пропонується клітина-хазяїн, клітинахазяїн, яка містить виділену нуклеїнову кислоту, що кодує важкий ланцюг EQ ID NO: 21 і виділену нуклеїнову кислоту, що кодує легкий ланцюг SEQ ID NO: 22. [0028] У деяких варіантах втілення цього винаходу пропонується спосіб продукування антитіла відповідно до цього винаходу. Спосіб охоплює культивування клітини-хазяїна, яка містить виділену нуклеїнову кислоту, що кодує важкий ланцюг SEQ ID NO: 21 і виділену нуклеїнову кислоту, що кодує легкий ланцюг SEQ ID NO: 22 в умовах, які відрізняються тим, що експресуються виділена нуклеїнова кислота (и) і продукується антитіло. [0029] В інших варіантах втілення цього винаходу описується виділене антитіло, специфічне до CD38 людини (SEQ ID NO: 1) і CD38 яванського макака (SEQ ID NO: 2). Це антитіло складається із шести CDRs, яке відрізняється тим, що кожна CDR цього антитіла може відрізнятися від SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17 і SEQ ID NO: 18 на 0, 1 або 2 амінокислотні заміни. [0030] У деяких варіантах втілення цього винаходу пропонується виділене антитіло до CD38, що специфічно зв'язується з CD38 людини (SEQ ID NO: 1) і CD38 яванського макака (SEQ ID -6 -7 NO: 2), яке відрізняється тим, що антитіло зв'язується з CD38 людини з KD приблизно 10 , 10 , -8 -9 -6 -7 -8 -9 10 , 10 або більше і зв'язується з CD38 яванського макака з KD приблизно 10 , 10 , 10 , 10 або більше. [0031] У деяких варіантах втілення цього винаходу пропонуються антитіла, які конкурують із Ab79 і/або Ab19 за зв'язування з CD38 людини й/або CD38 яванського макака. [0032] Ці й інші варіанти втілення цього винаходу, ознаки й потенційні переваги стануть очевидними при посиланні на наступні опис і креслення. КОРОТКИЙ ОПИС КРЕСЛЕНЬ [0033] Фігура 1 ілюструє профіль експресії CD38 на клітинах лімфоїдної диференціації, із зіркою, яка вказує на високу експресію CD38. Експресія CD38 була визначена на про-В-клітинах + + + + (CD34 CD19 CD20 ), активованих В-клітинах (CD19 CD20 ), плазматичних клітинах + + + + + (CD138 CD19 CD20 ), активованих CD4 і CD8 Т-клітинах, NКТ-клітинах (CD3 CD56 ) і NК+ + клітинах (CD56 CD16 ). На додаток до цього, експресія CD38 виявляється на лімфоїдних + + + клітинах-попередницях (CD34 CD45RA CD10 CD19 ), але не лімфоїдних стовбурових клітинах. На додаток до цього, підвищена експресія CD38 спостерігається на зрілих ДК і активованих моноцитах. [0034] Фігура 2 демонструє послідовності важкого й легкого ланцюга Ab79 і Ab19. [0035] Фігура 3 ілюструє послідовності CD38 людини і яванського макака. [0036] Фігура 4 демонструє епітопи CD38 людини, які зв'язуються з кожним з антитіл, Тестом 1 і 2, Ab19 і Ab79. [0037] Фігура 5 ілюструє підвищену експресію CD38 на МКПК хворих СЧВ із використанням комерційно доступного антитіла до CD38 людини. [0038] Фігура 6 ілюструє відсоткову зміну кількості клітин у яванських макаків протягом 24 годин після введення дози. [0039] Фігура 7 демонструє відновлення виснаження після однократної дози Ab79. [0040] Фігура 8 демонструє результати значного скорочення всіх Ig ізотипів у однієї HuSCID миші після однократної дози Ab79. [0041] Фігура 9 подібна до фігури 8 відносно виснажуючої активності Ab79 у HuSCID мишей, як описано у Прикладах. [0042] Фігура 10 ілюструє значне зниження протиправцевої відповіді на HuSCID моделі при лікуванні Ab79. [0043] Фігура 11 демонструє, знову на HuSCID моделі, значне збільшення виживаності при лікуванні Ab79, по суті на типі моделі "трансплантат проти хазяїна". [0044] Фігура 12 ілюструє відмінності в експресії CD38 антигену на МКПК людини й миші з використанням комерційних антитіл у кожному випадку. [0045] Фігура 13 демонструє терапевтичний ефект в умовах запалення, демонструючи, що сурогатне мишаче антитіло до CD38 виснажує імунні клітини з периферичної крові. 3 UA 110226 C2 5 10 15 20 25 30 35 40 45 50 55 60 ДОКЛАДНИЙ ОПИС ВИНАХОДУ Огляд [0046] Було показано, що позаклітинний домен CD38 має активність біфункціонального ферментп, який має як АДФ-рибозилциклазну, так і АДФ-рибозилгідролазну активність. Таким + чином, CD38 може каталізувати перетворення НАД у цАДФР (циклаза) і може надалі гідролізувати її до АДФ-рибози (гідролаза). цАДФР бере участь у мобілізації кальцію із внутрішньоклітинних запасів, що є активністю вторинного месенджера, важливою для клітинної проліферації, диференціації й апоптозу. [0047] Підвищена експресія CD38 була описана для різних захворювань гематопоетичного походження й була описана як негативний прогностичний маркер при хронічному лімфобластному лейкозі. Такі захворювання включають, але не обмежуються цим, множинною мієломою (Jackson et al. (1988)), хронічним лімфобластним лейкозом (Moribito et al. (2001), Jelinek et al. (2001), Chevalier et al. (2002), Dürig et al. (2002)), В-клітинним хронічним лімфолейкозом, гострим лімфобластним лейкозом (Keyhani et al (2000)), включаючи В-клітинний гострий лімфобластний лейкоз, макроглобулінемію Вальденстрема, первинний системний амілоїдоз, лімфому з клітин мантійної зони, пролімфоцитарний/мієлолцитарний лейкоз, гострий мієлоїдний лейкоз (Keyhani et al. (1993)), хронічний мієлоїдний лейкоз (Marinov et al. (1993)), фолікулярну лімфому, NК-клітинний лейкоз і плазмоклітинний лейкоз. Таким чином, CD38 є корисною мішенню при лікуванні захворювань гематопоетичної системи. [0048] Деякі антитіла до CD38 перебувають на стадії клінічних досліджень для лікування CD38-асоційованого раку. У зв'язку з цим антитіла до CD38 з терапевтичним ефектом і/або діагностичними застосуваннями є корисними. Винахід пропонує два різні набори CDRs антитіла до CD38, які зв'язуються з різними епітопами CD38 і форми, що зв'язують CD38 як людини, так і яванського макака й антитіла, що містять ці CDRs. [0049] На додаток до цього, цей винахід демонструє, що антитіла до CD38 знаходять застосування в діагностиці й/або лікуванні запалення й/або імунологічних порушень, асоційованих з активованими лімфоцитами, зокрема включаючи аутоімунні захворювання. Як показано в цьому документі, CD38 експресується у незрілих гемопоетичних клітинах, інгібується в зрілих клітинах і повторно експресується на високих рівнях в активованих лімфоцитах і плазматичних клітинах. Наприклад, висока експресія CD38 спостерігається на активованих Вклітинах, плазматичних клітинах, активованих CD4+ Т-клітинах, активованих CD8+ Т-клітинах, NК-клітинах NKT-клітинах, зрілих дендритних клітинах (ДК) і активованих моноцитах. [0050] Дані сьогодення документа є незвичайними в силу того, що присутність антитіл до CD38 була пов'язана з діабетом, хронічним аутоімунним тиреоідитом і хворобою Грейвса (див. Antonelli et al, Clin. Exp. Immunol. 2001 126:426-431; Mallone et al., Diabetes 50:752 (2001) і Antonelli et al., J. Endocrinol. Invest. 27:695-707 (2004), усе включені шляхом посилання. [0051] У цьому зв'язку, антитіла відповідно до цього винаходу знаходять застосування в діагностиці й/або лікуванні ряду захворювань, що включають, але не обмежуюються цим, аутоімунними захворюваннями, котрі розглянуті нижче, включаючи, але не обмежуючись цим, системною червоною волчанкою (СЧВ), ревматоїдним артритом (РА), запальною хворобою кишечнику (ЗХК) і виразковим колітом. [0052] Таким чином, наприклад, можуть бути відібрані пацієнти з високим вмістом плазматичних клітин, наприклад, пацієнти із СЧВ, які демонструють високий рівень плазматичних клітин, а також пацієнти з РА, ареактивні до лікування на основі CD20. [0053] Терапевтичні антитіла до CD38 відповідно до цього винаходу зв'язуються з CD38позитивними клітинами, що призводить до виснаження клітин, таких як активовані лімфоцити, через численні механізми дії, включаючи, але не обмежуючись цим, CDC, ADCC і шляхами апоптозу, наведеними у цьому документі, які ведуть до лікування й/або усунення аутоімунних захворювань. [0054] Однією з переваг, не очевидною в деяких клінічних випробуваннях антитіл до CD38 в онкології, є здатність зв'язуватися з CD38 яванського макака, тому що ці примати використовуються в доклінічних випробуваннях, і, отже, можуть привести до ранньої оцінки дозування, токсичності, ефективності і т.д. [0055] CD38 білки [0056] У зв'язку з цим, цей винахід пропонує виділені антитіла до CD38, що специфічно зв'язуються з CD38 білком людини (і, як описано нижче, додатково й переважно специфічно зв'язуються з CD38 білком приматів). Як відомо у цій галузі, CD38 білки можна виявити в ряді видів. Конкретно у цьому винаході використовуються антитіла, що зв'язуються як з CD38 білками людини, так і приматів, особливо приматів, яких використовують у клінічному випробуванні, таких, як яванські (Macaca fascicularis, макак-крабоїд, іноді називаний у цьому 4 UA 110226 C2 5 10 15 20 25 30 35 40 45 50 55 документі як "cyno") макаки. "CD38 людини" або "CD38 антиген людини" має відношення до білка SEQ ID NO: 1 або його функціональної фракції, такої як епітоп, зазначений у цьому документі. Загалом, CD38 має короткий інтраплазматичний хвіст, трансмембранний домен і позаклітинний домен, у конкретних варіантах втілення цього винаходу антитіла відповідно до цього винаходу зв'язуються з позаклітинною частиною CD38 білка. Під "CD38 яванського макака" у цьому документі мається на увазі SEQ ID NO: 2, яка на 92 % ідентична CD38 людини. [0057] Синоніми CD38 включають АДФ-рибозилциклазу 1, цАДФР-гідролазу 1, CD38-rs1, гідролазу 1 циклічної АДФ-рибози, 1-19 та NIM-R5 антиген. [0058] У деяких варіантах втілення цього винаходу Ab79 антитіла до CD38 відповідно до цього винаходу взаємодіють із CD38 з деякою кількістю амінокислотних залишків, що включають K121, F135, Q139, D141, M142, D202, V203, H205, Q236, E239, W241, S274, C275, K276, F284, C287, V288, K289, N290, P291, E292, D293. Як наведено в цьому документі, інші антитіла, які взаємодіють із цими залишками, також знаходять застосування в терапевтичних і діагностичних використаннях. [0059] У деяких варіантах втілення цього винаходу антитіла до CD38 відповідно до цього винаходу необов'язково (а в деяких випадках переважно) не зв'язуються з іншими членами сімейства CD38, такими як CD157. Наприклад, перважні варіанти втілення цього винаходу не зв'язуються з CD157 людини з SEQ ID NO: 23 (ідентифікаційний номер по Genbank NP_004325). [0060] Антитіла [0061] Цей винахід пропонує антитіла до CD38, як правило терапевтичні й/або діагностичні антитіла, описані в цьому документі. Антитіла, які знаходять застосування в цьому винаході, можуть мати різні формати, що описані в цьому документі, у тому числі традиційні антитіла, а також похідні, фрагменти й міметики антитіл, що описані нижче. По суті, винахід пропонує структури антитіл, що містять набір 6 CDRs, зазначений у цьому документі (включаючи невелику кількість амінокислотних замін, що описані нижче). [0062] Традиційні структурні частини антитіл зазвичай містять тетрамер. Кожний тетрамер, як правило, складається із двох ідентичних пар поліпептидних ланцюгів, кожна пара має один "легкий" (як правило має молекулярну масу приблизно 25 kDa) і один "важкий" ланцюг (як правило має молекулярну масу приблизно 50-70 kDa). Легкі ланцюги людини класифікуються як легкі ланцюги капа й лямбда. Важкі ланцюги класифікуються як мю, дельта, гама, альфа або епсилон і визначають изотип антитіла як IgM, IgD, IgG, IgA і IgE, відповідно. IgG має кілька підкласів, які включають, але не обмежуються IgG1, IgG2, IgG3 і IgG4. IgM має підкласи, які включають, але не обмежуються IgМ1 і IgМ2. Таким чином, "ізотип" у контексті цього опису означає будь-який з підкласів імуноглобулінів, який визначений хімічними й антигенними характеристиками їх константних областей. Відомими ізотипами імуноглобуліну людини є IgG1, IgG2, IgG3, IgG4, IgA1, IgA2, IgМ1, IgМ2, IgD та IgE. Слід розуміти, що терапевтичні антитіла можуть також містити гібриди ізотипів і/або підкласів. [0063] Аміно-кінцева ділянка кожного ланцюга включає варіабельну область приблизно від 100 до 110 або більше амінокислот, яка несе основну відповідальність за розпізнавання антигену. У варіабельній області три петлі зібрані для кожного з V-доменів важкого ланцюга й легкого ланцюга з утворенням антигензв'язуючого центру антитіла. Кожна з петель називається гіперваріабельна ділянка (далі по тексту "CDR"), у якій варіація в амінокислотній послідовності є найбільш значущою. "Варіабельний" має відношення до того факту, що серед антитіл певні сегменти варіабельної області відрізняються за послідовністю. Варіативність у варіабельній області розподілена нерівномірно. Замість цього, V-області складаються з відносно інваріантних ділянок, котрі називаються каркасними ділянками (FR) з 15-30 амінокислот, які розділені більш короткими областями зі значною мінливістю, які називаються "гіперваріабельні області", кожна з яких має довжину 9-15 амінокислот або довше. [0064] Кожна VH і VL складається із трьох гіперваріабельних областей ("гіперваріабельні ділянки", "CDRs") та чотирьох FR, розташованих від аміно-кінця до карбокси-кінця в наступному порядку: FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4. [0065] Гіперваріабельна область, як правило, охоплює амінокислотні залишки від приблизно амінокислотних залишків 24-34 (LCDR1, "L" позначає легкий ланцюг), 50-56 (LCDR2) і 89-97 (LCDR3) у варіабельній області легкого ланцюга, і приблизно приблизно 31-35B (HCDR1; "Н" позначає важкий ланцюг), 50-65 (HCDR2) і 95-102 (HCDR3) у варіабельній області важкого th ланцюга; Kabat et al., SEQUENCES OF PROTEINS OF IMMUNOLOGICAL INTEREST, 5 Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991) і/або залишки, що формують гіперваріабельну петлю (наприклад, залишки 26-32 (LCDR1), 50-52 (LCDR2) і 91-96 (LCDR3) у варіабельній області легкого ланцюга й 26-32 (HCDR1), 53-55 (HCDR2) і 96-101 5 UA 110226 C2 5 10 15 20 25 30 35 40 45 50 55 60 (HCDR3) у варіабельній області важкого ланцюга; Chothia and Lesk (1987) J. Mol. Biol. 196:901917. Конкретні CDRs відповідно до цього винаходу описані нижче. [0066] У цьому описі система нумерації по Kabat, як правило, використовується, коли мова йде про залишок у варіабельному домені (приблизно, залишки 1-107 варіабельної області легкого ланцюга й залишки 1-113 варіабельної області важкого ланцюга) (наприклад, Kabat et al., supra (1991)), із системою нумерації ЄС, яка використовується для Fc-області. [0067] CDRs сприяють формуванню антигензв'язуючого, або, більш конкретно, епітопзв'язуючого сайту антитіла. "Епітоп" має відношення до детермінанти, яка взаємодіє зі специфічним антигензв'язуючим сайтом у варіабельній області молекули антитіла, відомої як паратоп. Епітопи є групами молекул, такими як амінокислоти або бічні ланцюги цукрів, і зазвичай мають конкретні структурні характеристики, а також конкретні характеристики заряду. Один антиген може мати більше одного епітопа. Наприклад, як показано у цьому документі, два різні антитіла, котрі називаються у цьому документі "Ab19" і "Ab79", зв'язуються з різними епітопами на CD38 молекулі. [0068] Епітоп може містити амінокислотні залишки, які безпосередньо беруть участь у зв'язуванні (котрі також називають імунодомінантним компонентом епітопу) і інші амінокислотні залишки, які безпосередньо не залучені до зв'язування, наприклад, амінокислотні залишки, які ефективно заблоковані специфічним антигензв'язуючим пептидом; інакше кажучи, амінокислотний залишок входить у ділянку конкретного антигензв'язуючого пептиду. [0069] Епітопи можуть бути або конформаційними, або лінійними. Конформаційний епітоп формується амінокислотами, які просторово розміщені поруч, з різних сегментів лінійного поліпептидного ланцюга. Лінійний епітоп формується сусідніми амінокислотними залишками в поліпептидному ланцюзі. Конформаційний і неконформаційний епітопи можуть бути розрізнені тим, що зв'язування з першим, але не з останнім, нівелюється в присутності денатуруючих розчинників. [0070] Як правило, епітоп містить, щонайменше, 3, і зазвичай більше, щонайменше, 5 або 810 амінокислот в унікальній просторовій конформації. Антитіла, що розпізнають той самий епітоп, можуть бути верифіковані простим імунологічним аналізом, що демонструє здатність одного антитіла блокувати зв'язування іншого антитіла з антигеном-мішенню, наприклад, "зв'язування", як наведено в Прикладах Дослідження за допомогою рентгеноструктурної кристалографії, наведені в прикладах, ідентифікували амінокислотні залишки, що зв'язуються як з антитілами відповідно до цього винаходу (включаючи Ab19 і Ab79), так і з антитілами відповідно до відомого рівня техніки (Тест 1 і Тест 2), як продемонстровано на фігурі 4. [0071] У цьому винаході, Ab79, як наведено у Прикладах, взаємодіє з деякою кількістю амінокислотних залишків CD38, включаючи K121, F135, Q139, D141, M142, E239, W241, S274, C275, K276, F284, V288, K289, N290, P291, E292 і D293. Слід зазначити, що ці залишки однакові як у людини, так і в яванских макаків, з тим виключенням, що S274 є F274 у яванського макака. Ці залишки можуть представляти імунодомінантний епітоп і/або залишки, що входять у ділянку конкретного антигензв'язуючого пептиду. [0072] У цьому винаході, Ab19 зв'язується з іншим епітопом, включаючи G91, E103, E1034, D105, Q107, M110, K111, T114, Q115, T148, V192, R194, R195, F196, A199, H228, N229, Q231, E233 і K234. Слід зазначити, що ці залишки однакові як у людини, так і в яванських макаків, з тим виключенням, що M110 є V110 у яванського макака й A199 є T199 у яванського макака. [0073] Таким чином, у деяких варіантах втілення цього винаходу антитіла, що конкурують із Ab79 і Ab19 шляхом зв'язування з будь-яким із цих епітопів, можуть бути використані для лікування аутоімунних захворювань. Слід зазначити, що Ab79 і ВМ1 мають деяке перекриття, у такий спосіб антитіла, що конкурують з Ab79 і не є ВМ1, знаходять застосування у цьому винаході. [0074] Таким чином, цей винахід пропонує антитіла, що зв'язуються як з CD38 людини, так і CD38 яванського макака й взаємодіють із, щонайменше, з 80 %, 90 %, 95 % або 98 % цих залишків. Інакше кажучи, площа поверхні зони взаємодії не перевищує площі цих залишків. [0075] Карбоки-кінцева ділянка кожного ланцюга визначає константну область, яка несе основну відповідальність за ефекторну функцію. Kabat et al. зібрали численні первинні послідовності варіабельних областей важких ланцюгів і легких ланцюгів. Залежно від ступеня збереження послідовності, вони класифікували окремі первинні послідовності в CDR і каркасній th ділянці й створили їх список (див. SEQUENCES OF IMMUNOLOGICAL INTEREST, 5 edition, NIH publication, No. 91-3242, E.A. Kabat et al., робота включена у всій своїй повноті шляхом посилання). [0076] У підкласі імуноглобулінів IgG існує кілька доменів імуноглобуліну у важкому ланцюзі. Під "доменом імуноглобуліну (Ig)" у цьому документі мається на увазі область імуноглобуліну, 6 UA 110226 C2 5 10 15 20 25 30 35 40 45 50 55 60 що має чітку третинну структуру. Доменами важких ланцюгів, що представляють інтерес для цього винаходу, є ті, що включають константні важкі домени (CH) і домени шарніра. У контексті IgG антитіл, кожний з IgG ізотипів має три CН-області. Відповідно, "CH" доменами в контексті IgG є наступні: "CH1" має відношення до позиції 118-220 відповідно до індексу ЄС згідно Kabat. "CH2" має відношення до позиції 237-340 відповідно до індексу ЄС згідно Kabat і "СН3" має відношення до положень 341-447 відповідно до індексу ЄС згідно Kabat. [0077] Іншим типом Ig-домена важкого ланцюга є шарнірна область. Під "шарніром" або " шарнірною областю" або " шарнірною областю антитіла" або "шарнірною областю імуноглобуліну" у цьому документі мається на увазі гнучкий поліпептид, що містить амінокислоти між першим і другим константними доменами антитіла. Структурно СН1-домен IgG закінчується в позиції по ЄС 220 і CH 2-домен IgG починається із залишку в позиції по ЄС 237. Таким чином, для IgG шарнір антитіла у цьому документі визначений як такий, що включає позиції 221 (D221 в IgG1) до 236 (G236 в IgG1), у якому нумерація здійснюється відповідно до індексу ЄС згідно Kabat. У деяких варіантах втілення цього винаходу, наприклад, у контексті Fcобласті, включений нижній шарнір, з "нижнім шарніром", який, як правило, відноситься до позицій 226 або 230. [0078] Особливий інтерес для цього винаходу представляють Fc-області. Під "Fc" або " Fcобластю" або " Fc-доменом" у контексті цього опису мається на увазі поліпептид, що містить константну область антитіла за винятком першої константної області домена імуноглобуліну й у деяких випадках частини шарніра. Таким чином, Fc має відношення до двох останніх константних областях доменів імуноглобуліну IgA, IgD, і IgG, останнім трьом константним областям доменів імуноглобуліну IgE і IgM і гнучкого шарніра N-кінця цих доменів. Для IgA і IgM Fc може включати J ланцюг. Для IgG Fc-область імуноглобуліну складається з доменів C2 і C3 (C2 і C3) і нижньої шарнірної області між C1 (C1) і C2 (C2). Хоча межі Fc-області можуть варіювати, важкий ланцюг Fc-області IgG людини, як правило, визначається як такий, що включає залишки C226 або P230 до його карбоксильного кінця, у якому нумерація здійснюється відповідно до індексу ЄС згідно Kabat. У деяких варіантах втілення винаходу, як це більш докладно описане нижче, в Fc-область внесені амінокислотні модифікації, наприклад, для зміни зв'язування з одним або більше FcR-рецепторами або з FcRn-рецептором. [0079] У деяких варіантах втілення цього винаходу антитіла є повнорозмірними антитілами. Під "повнорозмірним антитілом" у цьому документі мається на увазі структура, яка являє собою природні біологічні форми антитіл, включаючи варіабельні й константні області, включаючи одну або кілька модифікацій, наведених у цьому документі. [0080] Крім того, антитіла можуть бути різними за структурою, включаючи, але не обмежуючись фрагментами антитіл, монокланальними антитілами, біспецифічними антитілами, мініантитілами, доменними антитілами, синтетичними антитілами (які іноді називаються в цьому документі "міметики антитіл"), хімерними антитілами, гуманізованими антитілами, злитими антитілами (які іноді називаються "кон'югати антитіл"), а також фрагментами кожного з них, відповідно. Структури, які як і раніше покладаються [0081] В одному варіанті втілення цього винаходу антитіло є фрагментом антитіла. Специфічні фрагменти антитіл включають, але не обмежуються (i) Fab-фрагментом, який складається із VL, VH, CL і СН 1-доменів (ii) Fd-фрагментом, який складається із VH і СН 1доменів (iii) Fv-фрагментом, який складається із VL і VН-доменів одного антитіла; (iv) dАbфрагментом (Ward et al., 1989, Nature 341:544-546, робота включена у всій своїй повноті шляхом посилання), який складається з однієї варіабельної області, (v) ізольованими CDRобластями, (vi), F(аb') 2-фрагментами, бівалентним фрагментом, що містять два зв'язані Fabфрагменти (vii) одноланцюговими Fv-молекулами (scFv), у яких VН-домен і VL-домен з'єднані пептидним лінкером, який дозволяє двом доменам асоціюватися з утворенням антигензв'язуючого сайту (Bird et al., 1988, Science 242:423-426, Huston et al., 1988, Proc. Natl. Acad. Sci. U.S.A. 85:5879-5883, роботи включені у всій своїй повноті шляхом посилання), (viii), біспецифічним одноланцюговим Fv (WO 03/11161, включений у цей документ у всій своїй повноті шляхом посилання) і (ix) "діатілами" або "тритілами", мультивалентними або мультиспецифічними фрагментами, які сконструйовані за допомогою злиття генів (Tomlinson et. al., 2000, Methods Enzymol. 326:461-479; WO94/13804; Holliger et al., 1993, Proc. Natl. Acad. Sci. U.S.A. 90:6444-6448, роботи включені у всій своїй повноті шляхом посилання). [0082] Хімерні та гуманізовані антитіла [0083] У деяких варіантах втілення цього винаходу антитіло може бути комбінацією різних видів, наприклад, хімерне антитіло й/або гуманізоване антитіло. Тобто, у цьому винаході, набори CDR можуть бути використані з каркасними ділянками й константними областями, відмінними від конкретно описаних послідовністей в цьому документі. 7 UA 110226 C2 5 10 15 20 25 30 35 40 45 50 55 [0084] У цілому, як "хімерні антитіла", так і "гуманізовані антитіла" мають відношення до антитіл, що поєднують області більше, ніж одного виду. Наприклад, традиційно "хвмерні антитіла" містять варіабельну область (-ті) миші (або щура в деяких випадках) і константну область (-ті) людини. "Гуманізовані антитіла" у цілому мають відношення до нелюдських антитіл, які мали варіабельні домени каркасних ділянок, заміщені послідовностями, які виявлені в антитілах людини. Як правило, у гуманізованому антитілі все антитіло, за винятком CDRs, кодується полінуклеотидом людського походження або ідентично цьому антитілу, за винятком його CDRs. CDRs, деякі або всі, які кодуються нуклеїновими кислотами, які мають походження із організмів, що не є людиною, пересаджують у бета-складчасту каркасну ділянку варіабельної ділянки антитіла людини для створення антитіла, специфічність якого визначається пересадженими CDRs. Створення таких антитіл описане, наприклад, в WO 92/11018, Jones, 1986, Nature 321:522-525, Verhoeyen et al., 1988, Science 239:1534-1536, усі роботи включені у всій своїй повноті шляхом посилання. Для відновлення афінності, яка втрачається у вихідній конструкції при пересадженні, часто необхідною є "зворотна мутація" обраних амінокислотних залишків акцепторної каркасної ділянки на відповідні донорні амінокислотні залишки (US 5530101; US 5585089; US 5693761; US 5693762; US 6180370; US 5859205; US 5821337; US 6054297; US 6407213, усе включені у всій своїй повноті шляхом посилання). Оптимально гуманізоване антитіло також буде мати, щонайменше, частину константної області імуноглобуліну, звичайно імуноглобуліну людини, і, отже, буде типово мати Fc-область людини. Гуманізовані антитіла також можуть бути отримані з використанням мишей з генетично сконструйованою імунною системою. Roque et al., 2004, Biotechnol. Prog. 20:639-654, включений у всій своїй повноті шляхом посилання. У цій галузі добре відомі різні методики й способи гуманізації й реконструювання антитіл, що не належать до людині (див. Tsurushita & Vasquez, 2004, Humanization of Monoclonal Antibodies, Molecular Biology of B Cells, 533-545, Elsevier Science (USA), і наведені в цьому документі посилання, усе включені у всій своїй повноті шляхом посилання). Способи гуманізації включають, але не обмежуються способами, описаними в роботах Jones et al., 1986, Nature 321:522-525; Riechmann et al.,1988; Nature 332:323-329; Verhoeyen et al., 1988, Science, 239:1534-1536; Queen et al., 1989, Proc Natl Acad Sci, USA 86:10029-33; He et al., 1998, J. Immunol. 160: 1029-1035; Carter et al., 1992, Proc Natl Acad Sci USA 89:4285-9, Presta et al., 1997, Cancer Res. 57(20):4593-9; Gorman et al., 1991, Proc. Natl. Acad. Sci. USA 88:4181-4185; O'Connor et al., 1998, Protein Eng 11:321-8, усі роботи включені у всій своїй повноті шляхом посилання. Гуманізація або інші способи зниження імуногенності варіабельних областей антитіл, що не є людськими, можуть включати способи відновлення поверхні, як описано, наприклад, у роботі Roguska et al., 1994, Proc. Natl. Acad. Sci. USA 91:969-973, яка включена у всій своїй повноті шляхом посилання. В одному варіанті втілення цього винаходу вихідне антитіло є аффінно зрілим, як це відомо в цій галузі техніки. Для гуманізації й аффінного дозрівання можливо застосовувати структурні способи, як, наприклад, описані у USSN 11/004,590. Для гуманізації й/або аффінного дозрівання варіабельних областей антитіл можливо застосовувати селекційні способи, які включають, але не обмежуються способами, описаними в роботах Wu et al., 1999, J. Mol. Biol. 294:151-162; Baca et al., 1997, J. Biol. Chem. 272(16):10678-10684; Rosok et al., 1996, J. Biol. Chem. 271(37): 2261122618; Rader et al., 1998, Proc. Natl. Acad. Sci. USA 95: 8910-8915; Krauss et al., 2003, Protein Engineering 16(10):753-759, усе включені у всій своїй повноті шляхом посилання. Інші способи гуманізації можуть включати пересадження тільки частин CDRs, ці способи включають, але не обмежуються способами, описаними в роботах USSN 09/810,510; Tan et al., 2002, J. Immunol. 169:1119-1125; De Pascalis et al., 2002, J. Immunol. 169:3076-3084, усе включені у всій своїй повноті шляхом посилання. [0085] В одному варіанті втілення цього винаходу антитіла відповідно до цього винаходу можуть бути мультиспецифічними антитілами й, особливо біспецифічними антитілами, які також іноді називаються "діатіла". Вони є антитілами, що зв'язуються із двома (або більше) різними антигенами або різними епітопами одного антигену. Діатіла можливо виготовити різними способами, відомими в цій галузі техніки (Holliger and Winter, 1993, Current Opinion Biotechnol. 4:446-449, який включений у всій своїй повноті шляхом посилання), наприклад, отримавши хімічним шляхом або з гібридних гібридом. [0086] В одному варіанті втілення цього винаходу антитіло є мініантитілом. Мініантітела є доведеними до мінімуму антитілоподібними білками, які включають scFv, що приєднані до СН3домену. Hu et al., 1996, Cancer Res. 56:3055-3061, включений у всій своїй повноті шляхом посилання. У деяких випадках scFv може бути приєднаний до Fc-області, і може включати деяку частину або всю шарнірну область. 8 UA 110226 C2 5 10 15 20 25 30 35 40 45 50 55 60 [0087] Антитіла відповідно до цього винаходу звичайно є виділеними або рекомбінантними. Термін "виділений", який використовується для опису різних поліпептидів, описаних у цьому документі, означає поліпептид, який був ідентифікований і відділений і/або виділений із клітин або клітинної культури, у якій експресувався. Як правило, виділений поліпептид буде підготовлений, щонайменше, однієї стадією очищення. "Виділене антитіло" означає антитіло, яке по суті не містить інших антитіл, що мають різні антигенні властивості. Наприклад, виділене антитіло, що специфічно зв'язується з CD38, по суті не містить антитіл, які специфічно зв'язують антигени, відмінні від CD38. [0088] Виділене антитіло, що специфічно зв'язується з епітопом, ізоформа або варіант CD38 людини або CD38 яванського макака може, однак, мати перехресну реактивність із іншими спорідненими антигенами, наприклад інших видів, таких як видові гомологи CD38. Більше того, виділене антитіло може бути по суті вільним від іншого клітинного матеріалу й/або хімічних речовин. [0089] Виділені моноклональні антитіла, які мають різні властивості, можуть бути об'єднані в добре визначеній композиції. Так, наприклад, Ab79 і Ab19 можуть бути об'єднані в одній лікарській формі, якщо це необхідно. [0090] Антитіла до CD38, відповідно до цього винаходу, специфічно зв'язують CD38-ліганди (наприклад, CD38 білки SEQ ID NO: 1 і 2 людини і яванського макака). "Специфічне зв'язування" або "специфічно зв'язується з" або "специфічне для" конкретного антигену або епітопа означає зв'язування, яке помітно відрізняється від неспецифічної взаємодії. Специфічне зв'язування може бути виміряне, наприклад, за допомогою визначення зв'язування молекули в порівнянні зі зв'язуванням контрольної молекули, яка звичайно є молекулою аналогічної структури, яка не має зв'язуючої активності. Наприклад, специфічне зв'язування може бути визначене шляхом конкуренції з контрольною молекулою, яка є подібною до мішені. [0091] Специфічне зв'язування для конкретного антигену або епітопу може демонструватися, наприклад, антитілом, яке має KD для антигену або епітопу щонайменше -4 -5 -6 приблизно 10 М, щонайменше приблизно 10 М, щонайменше приблизно 10 М, щонайменше -7 -8 -9 приблизно 10 М, щонайменше приблизно 10 М, щонайменше приблизно 10 М, -10 -11 альтернативно щонайменше приблизно 10 М, щонайменше приблизно 10 М, щонайменше -12 приблизно 10 М, або більше, де KD означає швидкість дисоціації конкретної взаємодії антитіло-антиген. Як правило, антитіло, що специфічно зв'язує антиген, буде мати KD в 20 -, 50 -, 100 -, 500 -, 1000 -, 5000 -, 10000 - і в більше разів вище для контрольної молекули стосовно антигену або епітопу. [0092] Крім того, специфічне зв'язування з конкретним антигеном або епітопом може демонструватися, наприклад, антитілом, яке має KA або Ка для антигену або епітопу щонайменше в 20 -, 50 -, 100 -, 500 -, 1000 -, 5000 -, 10000 - або в більше разів більше для епітопа в порівнянні з контролем, де KA або Ка має відношення до швидкості асоціації конкретної взаємодії антитіло-антиген. [0093] Модифікації антитіл [0094] Цей винахід додатково пропонує варіант антитіл. Тобто, існує ряд модифікацій для антитіл відповідно до цього винаходу, які можуть бути проведені, що включають, але не обмежуються модифікаціями амінокислот в CDRS (аффінне дозрівання), модифікаціями амінокислот в Fc-області, варіантами глікозилування, ковалентними модифікаціями інших типів, і т.д. [0095] Під "варіантною" у цьому документі мається на увазі поліпептидна послідовність, яка відрізняється від вихідного поліпептиду щонайменше модифікацією однієї амінокислоти. Амінокислотні модифікації можуть включати заміни, інсерції та делеції, причому перша модифікація є перважною в багатьох випадках. [0096] Як правило, варіанти можуть включати будь-яку кількість модифікацій до моменту збереження функції білка, яка описана в цьому документі. Тобто, у випадку амінокислотних варіантів, виконаних з CDRs або Ab79, або Ab19, наприклад, антитіло повинне як і раніше специфічно зв'язуватися як з CD38 людини, так і CD38 яванського макака. Аналогічно, якщо амінокислотні варіанти виконуються з Fc-областю, наприклад, варіантні антитіла повинні підтримувати необхідні функції зв'язування рецептора для конкретного застосування або показання для антитіла. [0097] Однак, як правило, використовуються 1, 2, 3, 4, 5, 6, 7, 8, 9 або 10 з амінокислотних замін, які використовуються, і часто цільовий результат переслідують зміну функції з мінімальною кількістю модифікацій. У деяких випадках, проводиться від 1 до 5 модифікацій, з від 1-2, 1-3 і 1-4, що також знаходять застосування в багатьох варіантах втілення цього винаходу. 9 UA 110226 C2 5 10 15 20 25 30 35 40 45 50 55 60 [0098] Слід зазначити, що кількість амінокислотних модифікацій може бути в межах функціональних доменів: наприклад, бажаними можуть бути від 1-5 модифікації в Fc-області дикого типу або генно-інженерних білків, а також від 1 до 5 модифікацій в Fv-області, наприклад. Варіантна послідовність поліпептиду переважно буде мати, щонайменше, приблизно 80 %, 85 %, 90 %, 95 % або до 98 або 99 % ідентичності вихідній послідовності (наприклад, варіабельні області, константні області й/або важкі й легкі ланцюги послідовностей для Ab79 і/або Ab19). Слід зазначити, що залежно від розміру послідовності, відсоток ідентичності буде залежати від кількості амінокислот. [0099] Під "амінокислотною заміною" або "заміною" у цьому документі мається на увазі заміна амінокислоти в певній позиції у вихідній поліпептидній послідовності іншою амінокислотою. Наприклад, заміна S100A має відношення до варіантного поліпептиду, у якому серин у положенні 100 замінений на аланін. Під "інсерцією амінокислоти" або "інсерцією" у контексті цього опису мається на увазі додавання амінокислоти у конкретне положення у вихідній поліпептидній послідовності. Під "делецією амінокислоти" або "делецією" у контексті цього опису мається на увазі видалення амінокислоти в конкретному положенні у вихідній поліпептидній послідовності. [00100] Під "вихідним поліпептидом", "вихідним білком", " поліпептидом-попередником" або "білком-попередником" у контексті цього опису мається на увазі немодифікований поліпептид, який послідовно модифікується для створення варіантного. Загалом, вихідними поліпептидами в цьому документі є Ab79 і Ab19. Вихідний поліпептид може мати відношення до безпосередньо поліпептиду, композицій, що містять вихідний поліпептид, або амінокислотної послідовності, яка його кодує. Відповідно, "вихідний Fc-поліпептид" у контексті цього опису має на увазі Fcполіпептид, модифікований для створення варіантного, а "вихідне антитіло" у контексті цього опису має на увазі антитіло, що модифікується для створення варіантного антитіла. [00101] Під "диким типом" або "ДТ" або "нативним" у цьому документі мається на увазі амінокислотна послідовність або нуклеотидна послідовність, яка зустрічається в природі, включаючи алельні варіанти. ДТ білок, поліпептид, антитіло, імуноглобулін, IgG і т.д. має амінокислотну послідовність або нуклеотидну послідовність, яка не була навмисно модифікована. [00102] Під "варіантною Fc-областю" у цьому документі мається на увазі Fc-послідовність, яка відрізняється від Fc-послідовності дикого типу за допомогою, щонайменше, модифікацією однієї амінокислоти. Варіантний Fc може мати відношення безпосередньо до Fc-поліпептиду, композиціям, що містять варіантний Fc-поліпептид або амінокислотну послідовність. [00103] У деяких варіантах втілення цього винаходу одна або більше амінокислотних модифікацій виконані в одному або більше CDRs антитіла (або Ab79, або Ab19). Як правило, тільки 1 або 2 або 3 амінокислоти заміщаються в будь-якій одиничній CDR і, як правило не більш, ніж від 4, 5, 6, 7, 8, 9 або 10 змін вносяться в межах набору CDRs. Проте, слід розуміти, що будь-яка комбінація відсутності замін, 1, 2 або 3 замін у будь-якій CDR можуть незалежно й необов'язково поєднуватися з будь-якою іншою заміною. [00104] У деяких випадках амінокислотні модифікації в CDRs називаються "афінними дозріванням". "Афінно зрілим" антитілом є антитіло, яке має одну або більше альтерацій в одній або більше CDRs, що приводить до поліпшення афінності антитіла до антигену в порівнянні з вихідним антитілом, яке не має тих альтерацій. У деяких випадках, хоча й рідко, бажаним може бути зменшення афінності антитіла до його антигену, але це, як правило, не є перважним. [00105] Афінне дозрівання може бути здійснене для збільшення афінності зв'язування антитіла з антигеном, щонайменше, приблизно з 10 % до 50-100-150 % або більше, або від 1 до 5 раз у порівнянні з "вихідним" антитілом. Пенреважні афінно зрілі антитіла будуть мати наномолярні або навіть пікомолярні афінності до антигену-мішені. Афінно зрілі антитіла одержують за допомогою відомих процедур. Див., наприклад, роботу Marks et al., 1992, Biotechnology 10:779-783, у якій описано афінне дозрівання шляхом перестановки доменів варіабельної області важкого ланцюга (VH) і варіабельної області легкого ланцюга (VL). Випадковий мутагенез CDR і/або амінокислотних залишків каркасних ділянок описаний у роботах Barbas, et al. 1994, Proc. Nat. Acad. Sci, USA 91:3809-3813; Shier et al., 1995, Gene 169:147-155; Yelton et al., 1995, J. Immunol. 155:1994-2004; Jackson et al., 1995, J. Immunol. 154(7):3310-9; і Hawkins et al, 1992, J. Mol. Biol. 226:889-896, наприклад. [00106] Крім того, амінокислотні модифікації можуть бути проведені в одній або декількох CDRs антитіла відповідно до цього винаходу, які є "мовчазними", наприклад, які суттєво не змінюють афінності антитіла до антигену. Це може бути здійснене з ряду причин, у тому числі для оптимізації експресії (що може бути проведене для нуклеїнових кислот, які кодують антитіла відповідно до цього винаходу). 10 UA 110226 C2 5 10 15 20 25 30 35 40 45 50 55 60 [00107] Таким чином, включеними у визначення CDRs і антитіл відповідно до цього винаходу є варіантні CDRs і антитіла, тобто антитіла відповідно до цього винаходу можуть включати амінокислотні модифікації в одній або декількох CDRs Ab79 і Ab19. На додаток до цього, як наведено нижче, амінокислотні модифікації також можуть незалежно й необов'язково проводиться в будь-якій області поза CDRs, включаючи каркасні ділянки й константні області. [00108] У деяких варіантах втілення цього винаходу описані варіантні антитіла Ab79 і Ab19, специфічні для CD38 людини (SEQ ID NO: 1) і CD38 яванського макака (SEQ ID NO: 2). Це антитіло складається із шести CDRs, яке відрізняється тим, що кожна CDR цього антитіла може відрізнятися від SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7 і SEQ ID NO: 8 на 0, 1 або 2 амінокислотні заміни. В інших варіантах втілення цього винаходу варіантне антитіло до CD38 складається із шести CDRS, яке відрізняється тим, що кожний CDR даного антитіла може відрізнятися від SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17 і SEQ ID NO: 18 на 0, 1 або 2 амінокислотні заміни. [00109] У деяких варіантах втілення цього винаходу антитіла до СD38 відповідно до цього винаходу складаються з варіантного Fc-домену. Як відомо в цій галузі техніки, Fc-область антитіла взаємодіє з рядом Fc-рецепторів і лігандів, передаючи масив важливих функціональних можливостей, котрі називаються ефекторні функції. Ці Fc-рецептори, включають, але не обмежуються (у людини) FcRI (CD64), включаючи ізоформи FcRІa, FcRІb і FcRІc; FcRII (CD32), включаючи ізоформи FcRІІa (включаючи алотипи H131 і R131), FcRІІb (включаючи FcRІІb-1 і FcRІІb-2), і FcRІІc; і FcRIII (CD16), включаючи ізоформи FcRІІІa (включаючи алотипи V158 і F158, що корелюють із антитілозалежною клітинною цитотоксичністю (ADCC)) і FcRІІІb (включаючи алотипиFcRІІІb-NA1 і FcRІІІb-NA2), FcRn (неонатальний рецептор), C1q (комплементарний білок, який залучений у комплементзалежну цитотоксичність (CDC)) і FcRn (неонатальній рецептор, який залучений у сироватковий напіврозпад). Придатні модифікації можуть бути проведені в одному або більше положеннях, загалом наведених, наприклад, у US Patent Application 11/841,654 і посилання в них, US 2004/013210, US 2005/0054832, US 2006/0024298, US 2006/0121032, US 2006/0235208, US 2007/0148170, USSN 12/341,769, US Patent No. 6,737,056, US Patent No. 7,670,600, US Patent No. 6,086,875, усі включені у всій своїй повноті шляхом посилання, і зокрема для конкретних амінокислотних замін, що збільшують зв'язування з Fc-рецепторами. [00110] На додаток до модифікацій, наведених вище, можуть бути виконані інші модифікації. Наприклад, молекули можуть бути стабілізовані шляхом введення дисульфідних містків, які зв'язують VH і VL домени (Reiter et al., 1996, Nature Biotech. 14:1239-1245, робота включена у всій своїй повноті шляхом посилання). На додаток до цього, існують різні ковалентні модифікації антитіл, які можуть бути проведені, наведені нижче. [00111] Ковалентні модифікації антитіл включені в обсяг цього винаходу, і, як правило, але не завжди, проведені пострансляційно. Наприклад, декілька типів ковалентних модифікацій антитіла вводяться в молекулу шляхом реакції специфічних амінокислотних залишків антитіла з органічним дериватизуючим агентом, який здатен реагувати з обраними бічними ланцюгами або N-, або С-кінцевими залишками. [00112] Залишки цистеїнілу найчастіше вступають у реакцію з α-галоацетатами (і відповідними амінами), такими як хлороцтова кислота або хлорацетамід для утворення карбоксиметил- або карбоксиамідометилпохідних. Залишки цистеїнілу також можуть бути дериватизовані реакцією із бромтрифторацетоном, -бром--(5-імідозоїл)пропіоновою кислотою, хлороцтовим фосфатом, N-алкілмалеїнімідами, 3-нітро-2-піридилдисульфідом, метил-2-піридилдисульфідом, n-хлормеркурибензоатом, 2-хлормеркури-4-нітрофенолом або хлор-7-нітробензо-2-оксо-1,3-оксадіазолом і таке інше. [00113] Залишки гістидилу дериватизуються реакцією з діетилпірокарбонатом при рН 5,57,0, тому що цей агент відносно специфічний для бічного ланцюга гістидила. Також використовується пара-бромфенацилбромід, реакцію переважно проводять в 0,1 М натрію какодилаті при рН 6,0. [00114] Лізиніл і термінальні амінокислотні залишки вступають у реакцію з бурштиновим або іншими ангідридами карбонових кислот. Дериватизація із цими агентами має ефект зміни заряду залишків лізинілу. Іншими придатними реагентами для дериватизації залишків, які містять альфа-аміно-групи включають імідоефіри, такі як метилпіколінімідат; піридоксаль фосфат; піридоксаль; хлорборгідрид; тринітробензолсульфонову кислоту; O-метилсечовину, 2,4-пентандіон і реакцію із гліоксилатом, яка каталізується трансаміназою. [00115] Залишки аргінілу модифікують шляхом реакції з одним або декількома загальноприйнятими реагентами, серед яких фенілгліоксаль, 2,3-бутандіон, 1,2-циклогександіон і нінгідрин. Дериватизація залишків аргініну вимагає проведення реакції в лужних умовах у 11 UA 110226 C2 5 10 15 20 25 30 35 40 45 50 55 60 зв'язку p високою рКа функціональної групи гуанідину. Крім того, ці реагенти можуть взаємодіяти із групами лізину, а також епсилон-аміногрупою аргініну. [00116] Специфічна модифікація залишків тирозину може бути проведена, особливий інтерес представляє введення спектральних міток у залишки тирозину шляхом реакції з ароматичними сполуками діазонію або тетранітрометану. Найчастіше використовуються Nацетилимідазол і тетранітрометан для створення сполук О-ацетилтирозилу й 3-нітропохідних, відповідно. Залишки тирозила йодуються з використанням 125I або 131I для створення мічених білків для використання в адіоімунному аналізі, спосіб, який описаний вище з використанням хлораміну T є придатними. [00117] Бічні карбоксильні групи (аспартил або глутаміл) вибірково модифікують шляхом реакції з карбодиімідами (R'-N=C=N--R'), де R і R' необов'язково є різними алкільними групами, такими як 1-циклогексил-3-(2-морфолиніл-4-етил)-карбодиімід або 1-етил-3-(4-азоний-4,4диметилпентил)карбодиімід. Крім того, залишки аспартилу та глутамілу перетворяться в залишки аспарагінілу та глутамінілу шляхом взаємодії з іонами амонію. [00118] Дериватизація за допомогою біфункціональних агентів корисна для перехресного зшивання антитіл з водонерозчинною підтримуючою матрицею або поверхнею для використання в різних способах, на додаток до способів, які описані нижче. Зазвичай агенти, які використовуються для перехресного зшивання, включають, наприклад, 1,1-біс-(діазоацетил)-2фенілетан, глутаральдегід, N-гідроксисукцинімідні ефіри, наприклад, ефіри з 4азидосаліциловою кислотою, гомобіфункціональні імідоефіри, включаючи дисукцинімідильні ефіри, такі як 3,3'-дитіобіс(сукцинімідилпропіонат) і біфункціональні малеїміди, такі як біс-Nмалеїмїдо-1, 8-октан. Дериватизуючі агенти, такі як метил-3-[ (параазидофеніл)дитіо]пропіоімідат дозволяють одержати проміжні продукти, які фото активуються і які здатні до утворення поперечних зшивок у присутності світла. Альтернативно, високореактивні водонерозчинні матриці, такі як "cynomolgusogen" бромід-активовані вуглеводи й реакційноздатні субстрати, описані в U.S. Pat. Nos. 3969287; 3691016; 4195128; 4247642; 4229537 і 4330440, усе включені у всій своїй повноті шляхом посилання, які використовуються для іммобілізації білків. [00119] Залишки глутамінілу та аспарагінілу часто деамідують для одержання відповідних залишків глутамілу й аспартилу, відповідно. Альтернативно, ці залишки деамідують у м'яких кислих умовах. Обидва способи утворення цих залишків входять в обсяг цього винаходу. [00120] Інші модифікації включають гідроксилювання проліну та лізину, фосфорилювання гідроксильних груп залишків серилу або треонілу, метилювання α-аміногруп лізинових, аргінінових і гістидинових бічних ланцюгів (T. E. Creighton, Proteins: Structure and Molecular Properties, W. H. Freeman & Co., San Francisco, pp. 79-86 [1983], робота включена у всій своїй повноті шляхом посилання), ацетилювання N-кінцевого аміну й амідування будь-якої C-кінцевої карбоксильної групи. [00121] На додаток до цього, що буде зрозуміло фахівцям у цій галузі техніки, мітки (включаючи флуоресцентні, ферментні, магнітні, радіоактивні і т.д. усі можуть бути додані до антитіл (а також інші композиції відповідно до цього винаходу). [00122] Глікозилування [00123] Іншим типом ковалентної модифікації є зміни в глікозилуванні. В іншому варіанті втілення цього винаходу антитіла, описані в цьому документі, можуть бути модифіковані для включення однієї або більше сконструйованих глікоформ. Під "сконструйованою глікоформою" у контексті цього опису мається на увазі вуглеводна композиція, ковалентно приєднана до антитіла, у якому зазначена вуглеводна композиція хімічно відрізняється від вуглеводної композиції вихідного антитіла. Сконструйовані глікоформи можуть бути корисні для різних цілей, включаючи, але не обмежуючись, посиленням або зниженням ефекторної функції. Перважним способом утворення сконструйованої глікоформи є афукозилювання, яке, як було показано, корелює зі збільшенням ADCC функції, імовірно за рахунок тісного зв'язку з рецептором FcγRIIIa. У контексті цього опису "афукозилювання" означає, що більша частина антитіла, яке продукується в клітинах-хазяїнах, по суті, вільна від фукози, наприклад, 90-95-98 % утворених антитіл не містять фукозу як важливий компонент вуглеводного залишку антитіла (звичайно прикріпленого до N297 в Fc-області). Функціонально визначено, що афукозилювані антитіла звичайно мають принаймні 50 %-ву або більшу афінність до рецептора FcγRIIIa. [00124] Сконструйовані глікоформи можуть бути створені з використанням різних способів, які відомих у цій галузі техніки (Umaña et al., 1999, Nat Biotechnol 17:176-180; Davies et al., 2001, Biotechnol Bioeng 74:288-294; Shields et al., 2002, J Biol Chem 277:26733-26740; Shinkawa et al., 2003, J Biol Chem 278:3466-3473; US 6,602,684; USSN 10/277,370; USSN 10/113,929; PCT WO 00/61739A1; PCT WO 01/29246A1; PCT WO 02/31140A1; PCT WO 02/30954A1, усі роботи 12 UA 110226 C2 5 10 15 20 25 30 35 40 45 50 55 включені у всій своїй повноті шляхом посилання; (Potelligent® technology [Biowa, Inc., Принстон, Нью-Джерсі]; GlycoMAb® glycosylation engineering technology [Glycart Biotechnology AG, Цюріх, Швейцарія]). Багато з цих методик засновані на регулюванні рівня фукозилювання і/або розгалуджених олігосахаридів, ковалентно приєднаних до Fc-області, наприклад шляхом експресії IgG у різних організмах або клітинних лініях, які сконструйовані або створені іншим способом (наприклад, клітини Lec-13 CHO або клітини гібридоми щура YB2/0, шляхом регулювання ферментів, які залучені у шлях глікозилування (наприклад FUT8 [1,6фукозилтрансферази] і/або 1-4-N-ацетиглюкозамінтрансферази III [GnTIII]), або шляхом модифікації вуглеводу (ів) після експресії IgG. Наприклад, "цукор сконструйоване антитіло" або " SEA технологія" Seattle Genetics функціонує шляхом додавання модифікованих цукрів, які інгібують фукозилювання в процесі виробництва; див., наприклад, 20090317869, яка включена в цей документ у всій своїй повноті шляхом посилання. Сконструйована глікоформа як правило має відношення до різного вуглеводу або олігосахариду; таким чином, антитіло може включати сконструйовану глікоформу. [00125] Альтернативно сконструйована глікоформа може мати відношення до варіантного IgG, який містить різний вуглевод або олігосахарид. Як відомо в цій галузі техніки, глікозилування може залежати як від послідовності білка (наприклад, наявності або відсутності конкретних амінокислотних залишків, придатних для глікозилування, котря розглянуті нижче), так і від клітини-хазяїна або організму, у якому продукується білок. Окремі експресійні системи розглянуто нижче. [00126] Глікозилування поліпептидів зазвичай відбувається або через N-зв'язок, або через О-зв'язок. N-глікозилування має відношення до приєднання вуглеводного залишку до бічного ланцюга залишку аспарагіну. Трипептидні послідовності аспарагін-X-серин і аспарагін-X-треонін, де Х – будь-яка амінокислота, крім проліну, є послідовностями впізнавання для ферментативного приєднання вуглеводного залишку до бічного ланцюга аспарагіну. Таким чином, присутність кожної із цих трипептидних послідовностей у поліпептиді створює потенційний сайт глікозилування. O- глікозилування має відношення до приєднання одного із цукрів N-ацетилгалактозаміну, галактози або ксилози до гідроксиамінокислоті, найчастіше серину або треоніну, хоча також можуть бути використані 5-гідроксипролін або 5-гидроксилізин. [00127] Введення сайтів глікозилування в антитіло зручно здійснювати шляхом зміни амінокислотної послідовності таким чином, щоб вона містила одну або більше з трипептидних послідовностей, які описані вище (для сайтів N-глікозилування). Зміна також може бути виокнане шляхом додавання або заміщення одного або декількох залишків серину або треонину для початку послідовності (для сайтів О-глікозилування). Для зручності амінокислотна послідовність антитіла переважно модифікується в результаті змін на рівні ДНК, зокрема, шляхом мутації ДНК, яка кодує поліпептид-мішень у заздалегідь обраних основах, так, щоб утворювалися кодони, які будуть транслюватися в бажані амінокислоти. [00128] Іншими способами збільшення числа вуглеводних залишків на антитілі є хімічне або ферментативне приєднання глікозидів до білка. Ці процедури мають перевагу, оскільки вони не вимагають продукування білка в клітині-хазяїні, яка має глікозилюючі здатності до N- і Оглікозилування. Залежно від способу приєднання, що використовується, цукор (-и) може бути приєднаний до (а) аргініну та гістидину, (б) вільним карбоксильним групам, (в) вільним сульфгідрильним групам, таким як групи цистеїну, (г) вільним гідроксильним групам, таким як групи серину, треоніну або гідроксипроліну, (д) ароматичним залишкам, таким як залишки фенілаланіну, тирозину або триптофану, або (є) амідній групі глутаміну. Ці способи описані в WO 87/05330 і в Aplin and Wriston, 1981, CRC Crit. Rev. Biochem., pp. 259-306, роботи включені у всій своїй повноті шляхом посилання. [00129] Видалення вуглеводних залишків, які присутні у вихідному антитілі (наприклад, посттрансляційно) може бути реалізоване хімічно або ферментативно. Для хімічного деглікозилування необхідним є дія на білок трифторметансульфонової кислоти або еквівалентної сполуки. Така обробка приводить до відщіплення більшості або всіх цукрів, за винятком зв'язаного цукру (N-ацетилглюкозаміну або N-ацетилгалактозаміну), залишаючи поліпептид інтактним. Хімічне деглікозилування описане в роботах Hakimuddin et al., 1987, Arch. Biochem. Biophys. 259:52 і Edge et al., 1981, Anal. Biochem. 118:131, які включені у всій своїй повноті шляхом посилання. Ферментативне відщіплення вуглеводних залишків поліпептидів може бути досягнуте шляхом використання різних ендо- і екзоглікозидаз, як описано в роботі Thotakura et al., 1987, Meth. Enzymol. 138:350, яка включена у всій своїй повноті шляхом посилання. Глікозилуванню в потенційних сайтах глікозилування можливо запобігти шляхом використання сполуки тунікаміцину, як описано в роботі Duskin et al., 1982, J. Biol. Chem. 13 UA 110226 C2 5 10 15 20 25 30 35 40 45 50 55 60 257:3105, яка включена у всій своїй повноті шляхом посилання. Тунікаміцин блокує утворення білок-N-глікозидних зв'язків. [00130] Інший тип ковалентної модифікації антитіла включає приєднання антитіла до різних небілкових полімерів, які включають, але не обмежені різними поліолами, такими як поліетиленгліколь, поліпропіленгліколь або поліоксиакілени, способом, який описано в, наприклад, 2005-2006 PEG Catalog from Nektar Therapeutics (доступний на веб-сайті Nektar) US Patents 4,640,835; 4,496,689; 4,301,144; 4,670,417; 4,791,192 або 4,179,337, усі роботи включені у всій своїй повноті шляхом посилання. На додаток до цього, як відомо в цій галузі техніки, амінокислотні заміни можуть бути реалізовані в різних позиціях в антитілі для полегшення приєднання полімерів, таких як ПЕГ. Див., наприклад, публікацію U.S. Publication No. 2005/0114037A1, яка включена у всій своїй повноті шляхом посилання. Варіанти втілення конкретних CDR і варіативних областей [00131] Цей винахід пропонує деяку кількість антитіл, кожне з яких має конкретний набір CDRs (включаючи, як наведено вище, деякі амінокислотні заміни). Як наведено вище, ці антитіла можуть характеризуватися набором 6 CDRS варіабельними областями або повнорозмірними важкими й легкими ланцюгами, включаючи константні області. На додаток до цього, як наведено вище, можуть бути здійснені амінокислотні заміни. Загалом, у контексті змін у структурі CDRs, у зв'язку з відносно короткою довжиною CDRs, амінокислотні модифікацій, як правило, характеризуються кількістю амінокислотних модифікацій, які можуть бути проведені. Хоча це також може бути застосоване до обговорення кількості амінокислотних модифікацій, які можуть бути здійснені у варіабельних, константних або повнорозмірних послідовностях, на додаток до ряду змін, слід визначити ці зміни у "% ідентичності". Таким чином, як описано в цьому документі, антитіла, включені в обсяг цього винаходу, ідентичні на 80, 85, 90, 95, 98 або 99 % послідовностям SEQ ID NOs, котрі перераховані у цьому документі. [00132] У контексті Ab79 антитіла, набір CDRs є наступним: три CDRs важкого ланцюга охоплюють HCDR1 SEQ ID NO: 3 (HCDR1), SEQ ID NO: 4 (HCDR2) і SEQ ID NO: 5 (HCDR3) і три CDRs легкого ланцюга охоплюють SEQ ID NO: 6 (LCDR1), SEQ ID NO: 7 (LCDR2) і SEQ ID NO: 8 (LCDR3). [00133] У контексті Ab19, набір CDRs є наступним: HCDR1 (SEQ ID NO: 13), HCDR2 (SEQ ID NO: 14) і HCDR3 (SEQ ID NO: 15), і LCDR1 (SEQ ID NO: 16), LCDR2 (SEQ ID NO: 17) і LCDR3 (SEQ ID NO: 18). [00134] Зокрема виключеними із цього винаходу є антитіла з SEQ ID Nos:. 24 і 25 (важкі й легкі ланцюги Тесту 1) і з SEQ ID Nos:. 26 і 27 (важкі й легкі ланцюги Тесту 2). Слід зазначити, що ці антитіла не є перехресно-реактивними з CD38 яванського макака, який розглянутого нижче. [00135] Антитіла відповідно до цього винаходу є перехресно-реактивними з CD38 людини й CD38 яванського макака й, таким чином, є міжвидовими перехресно-реактивними антитілами. "Міжвидове перехресно-реактивне антитіло" є антитілом, яке володіє афінністю зв'язування з антигеном, характерною для першого виду ссавця, яка є практично ідентичною афінності зв'язування гомолога цього антигену другим видом ссавця. Міжвидова перехресна реактивність може бути виражена, наприклад, як співвідношення KD антитіла для антигену першого виду ссавця до KD того ж антитіла для гомолога того ж антигену другого виду ссавця, де співвідношення становить 1,1, 1.2, 1,3, 1,4, 1,5, 2, 5, 10, 15, до 20. Альтернативно або додатково антитіло має "міжвидову перехресну реактивність", якщо воно демонструє терапевтичну або діагностичну ефективність при введенні другому виду. Таким чином, у цьому випадку, антитіла відповідно до цього винаходу є перехресно-реактивними з CD38 яванського макака, які демонструють доклінічну ефективність при введенні яванським макакам і, таким чином, вважаються перехресно-реактивними. [00136] У деяких варіантах втілення цього винаходу пропонуються антитіла, які конкурують із антитілами відповідно до цього винаходу (наприклад, з Ab79 і/або Ab19) за зв'язування з CD38 людини й/або CD38 яванського макака, але не включені ні ВМ1, ні BM2. Конкуренція за зв'язування з CD38 або частиною CD38 двома або більше антитілами до CD38 може бути визначена будь-якою відповідною методикою, як відомо в цій галузі техніки. [00137] Конкуренція в контексті цього винаходу має відношення до будь-якого значного зниження, котре виявляється, здатності антитіла відповідно до цього винаходу (наприклад, Ab79 або Ab19) зв'язувати свого конкретного партнера по зв'язуванню, наприклад, CD38, у присутності досліджуваної сполуки. Як правило, конкуренція має на увазі, щонайменше, приблизно 10-100 %-ве зниження зв'язування антитіла відповідно до цього винаходу з CD38 у присутності конкурента, яке виміряне стандартними методиками, такими як ELISA або аналізи ® Biacore . Так, наприклад, можливо встановити критерії конкурентоспроможності, при яких 14 UA 110226 C2 5 10 15 20 25 30 35 40 45 50 55 визначається щонайменше приблизно 10 %-ве відносне інгібування зв'язування, визначається щонайменше приблизно 15 %-ве відносне інгібування зв'язування або визначається, щонайменше, приблизно 20 %-ве відносне інгібування зв'язування до того, як антитіло розглядається як достатньо конкурентне. У випадках, коли епітопи, що належать конкуруючим антитілам, в антигені розташовані близько, конкуренція може бути відзначена більш ніж приблизно 40 % -вим інгібуванням зв'язування CD38 (наприклад, щонайменше приблизно 45 %вим інгібуванням, наприклад щонайменше приблизно 50 %-вим інгібуванням, наприклад щонайменше приблизно 55 %-вим інгібуванням, наприклад щонайменше приблизно 60 %-вим інгібуванням, наприклад щонайменше приблизно 65 %-вим інгібуванням, наприклад, щонайменше приблизно 70 %-вим інгібуванням, наприклад, щонайменше приблизно 75 %-вим інгібуванням, наприклад, щонайменше приблизно 80 %- вим інгібуванням, наприклад, щонайменше приблизно 85 %-вим інгібуванням, наприклад, щонайменше приблизно 90 %-вим інгібуванням, наприклад, щонайменше приблизно 95 %-вим інгібуванням або більш високим рівнем відносного інгібування). [00138] У деяких випадках мітяться один або більш компонентів аналізів конкурентного зв'язування, які розглядаються нижче в контексті діагностичних застосувань. [00139] Також можлива конкуренція між антитілами до CD38 у відношенні більш, ніж одного з епітопів CD38 і/або частини CD38, наприклад, у контексті, коли антитілозв'язуючі властивості конкретного регіону CD38 утримуються в його фрагментах, наприклад, у випадку добре репрезентованого лінійного епітопу, який розташовується в різних досліджуваних фрагментах або конформаційного епітопу, який репрезентовано в досить великих фрагментах CD38, а також в CD38. [00140] Оцінка конкуренції, як правило, включає оцінку відносного інгібуючого зв'язування з використанням антитіла відповідно до цього винаходу, CD38 (або людини, або яванського макака, або обох), і досліджуваної молекули. Досліджувані молекули можуть включати будь-яку молекулу, у тому числі інші антитіла, малі молекули, пептиди і т.д. Сполуки змішують у кількостях, які є достатніми для проведення порівняння, яке несе інформацію про селективність й/або специфічність молекул у продукті відносно інших присутніх молекул. [00141] Кількості досліджуваної сполуки, CD38 і антитіл відповідно до цього винаходу можуть варіювати. Наприклад, для оцінки наявності конкуренції методом ELISAпотрібно приблизно 5-50 мкг (наприклад, приблизно 10-50 мкг, приблизно 20-50 мкг, приблизно 5-20 мкг, приблизно 10-20 мкг і т.д.) антитіла до CD38 і/або CD 38-мішеней. Умови також повинні бути придатними для зв'язування. Як правило, фізіологічні або близькі до фізіологічних умови (наприклад, температура приблизно 20-40 °C, рН приблизно 7-8 і т.д.) є придатними для антитіла до CD38: CD38 зв'язування. [00142] Часто конкуренція відзначена значно більшим відносним інгібуванням, ніж приблизно 5 % за даними ELISA і/або FACS аналізу. Бажаним може бути встановлення більш високої межі відносного інгібування як критерію/детермінанти того, що є придатинм рівнем конкуренції в конкретному контексті (наприклад, де аналіз конкуренції використовується для добору або скринінгу нових антитіл, які створені з передбачуваною функцією блокування зв'язування іншого пептиду або молекули, які зв'язуються з CD38 (наприклад, природними партнерами по зв'язуванню CD38, такими як CD31, який також називається CD31 антиген, Endocam, GPIIA, РЕСАМ-1, ендотеліальна молекула клітинної адгезії тромбоцитів або природним антитілом до CD38). [00143] У деяких варіантах втілення цього винаходу антитіло до CD38 відповідно до цього винаходу специфічно зв'язується з одним або більше залишками або областями в CD38, але також не вступає у перехресну реакцію з іншими білками з гомологією до CD38, наприклад, BST-1 (антиген-1 строми кісткового мозку) і Mo5, який також називається CD157. [00144] Як правило, відсутність перехресної реактивності має на увазі менше, ніж приблизно 5 %-ве відносне конкурентне інгібування між молекулами при оцінціюванні методом ELISA і/або FACS аналізу з використанням достатньої кількості молекул у придатних умовах аналізу. [00145] Інгібування активності CD38 [00146] Описані в цьому винаході антитіла можуть знайти застосування в блокуванні взаємодії ліганд-рецептор або інгібуванні взаємодії рецептор-компонент. Антитіла до CD38 відповідно до цього винаходу можуть бути "блокувальними" або "нейтралізуючими". "Нейтралізуюче антитіло" призначене для позначення антитіла, зв'язування якого з CD38 приводить до інгібування біологічної активності CD38, наприклад, його здатності взаємодіяти з лігандами, ферментативну активність, сигнальну активність і, зокрема, його здатність активувати лімфоцити. Інгібування біологічної активності CD38 можливо оцінити за допомогою 15 UA 110226 C2 5 10 15 20 25 30 35 40 45 50 55 60 одного або більше стандартних аналізів in vitro або in vivo, які відомі у цій галузі техніки (див. приклади нижче). [00147] "Інгібує зв'язування" або "блокує зв'язування" (наприклад, коли мова йде про гальмування/ блокування зв'язування CD 38-партнера по зв'язуванню з CD38) охоплюють як часткове, так і повне інгібування/блокування. Інгібування/блокування зв'язування CD38партнера по зв'язуванню з CD38 може знизити або змінити нормальний рівень або тип клітинного сигналінгу, що виникає при зв'язуванні CD38-партнера по зв'язуванню з CD38 без інгібування або блокування. Інгібування та блокування також включають будь-яке зниження афінності зв'язування CD38-партнера по зв'язуванню до CD38, яке можливо виміряти, при контакті з антитілом до CD38 у порівнянні з лігандом, який не контактує із антитілом до CD38, наприклад, блокування зв'язування CD38-партнера по зв'язуванню з CD38, щонайменше, приблизно на 10 %, 20 %, 30 %, 40 %, 50 %, 60 %, 70 %, 80 %, 90 %, 99 % або 100 %. [00148] Описані антитіла до CD38 можуть також інгібувати ріст клітин. "Інгібує ріст" включає будь-яке зниження росту клітин, яке можливо виміряти, при контакті з антитілом до CD38 у порівнянні з ростом тих же клітин, що не конкурують із антитілом до CD38, наприклад, інгібування росту культури клітин, щонайменше, приблизно на 10 %, 20 %, 30 %, 40 %, 50 %, 60 %, 70 %, 80 %, 90 %, 99 % або 100 %. [00149] У деяких варіантах втілення цього винаходу описані антитіла до CD38 здатні виснажувати активовані лімфоцити та плазматичні клітини. "Виснаження" у контексті цього опису має на увазі зниження сироваткових рівнів (наприклад, як досліджено на яванських макаках) активованих лімфоцитів, яке можливо виміряти, і/або плазматичних клітин у порівнянні з тваринами, які не отримували лікування. Загалом, спостерігається виснаження, щонайменше, приблизно на 10 %, 20 %, 30 %, 40 %, 50 %, 60 %, 70 %, 80 %, 90 %, 99 % або 100 %. Як показано нижче в Прикладах, на додаток до цього, особливою перевагою, характерною для антитілам відповідно до цього винаходу, є відновлення цих клітин після введення дози, тобто, як відомо для деяких процедур (наприклад, з антитілами до CD20, наприклад), виснаження клітин може тривати протягом тривалого періоду часу, що приводить до небажаних побічних ефектів. Як показано в цьому документі, функції активованих лімфоцитів і/або плазматичних клітин є відновлюваними. Способи одержання антитіл відповідно до цього винаходу [00150] Цей винахід додатково пропонує способи одержання антитіл до CD38, які описуються. Ці способи включають культивування клітини-хазяїна, яка містить виділену нуклеїнову кислоту (и), яка кодує антитіла відповідно до цього винаходу. Як буде зрозуміло фахівцям у цій галузі техніки, це може бути здійснене різними способами, залежно від природи антитіла. У деяких варіантах втілення цього винаходу, у випадку, коли антитіла відповідно до сьогоденням винаходу є загальноприйнятими повнорозмірними антитілами, наприклад, варіабельна область важкого ланцюга й варіабельна область легкого ланцюга в умовах, при яких продукується антитіло й воно може бути виділене. [00151] Загалом, пропонуються нуклеїнові кислоти, які кодують антитіла відповідно до цього винаходу. Такі полінуклеотиди кодують як варіабельні, так і константні області кожного з важких і легких ланцюгів, хоча інші комбінації також розглядаються в цьому винаході відповідно до композицій, які описані у цьому документі. Цей винахід також розглядає фрагменти олігонуклеотидів, які отримані з описаних полінуклеотидів і послідовностей нуклеїнових кислот, котрі є комплементарними цим полінуклеотидам. [00152] Полінуклеотиди можуть бути у вигляді РНК або ДНК. У межах обсягу цього винаходу знаходяться полінуклеотиди у вигляді ДНК, кДНк, геномної ДНК, аналогів нуклеїнових кислот і синтетичні ДНК. ДНК може бути дволанцюговою або одноланцюговою і у випадку одноланцюгової може бути кодуючим (значеннєвим) або некодуючим (незначиннєвим) ланцюгом. Кодуюча послідовність, яка кодує поліпептид, може бути ідентична послідовності, яка описана в цьому документі, або може бути відмінною кодуючою послідовністю, чия послідовність в результаті надмірності або вирожденості генетичного коду, кодує ті ж поліпептиди, як і ДНК, описана в цьому документі. [00153] У деяких варіантах втілення цього винаходу нуклеїнову кислоту (-ти), яка кодує антитіла відповідно до цього винаходу, вводять в експресійні вектори, які можуть бути позахромосомними або створеними для інтеграції в геном клітини-хазяїна, у яку він вводиться. Експресійні вектори можуть містити будь-яку кількість відповідних регуляторних послідовностей (включаючи, але не обмежуючись послідовностями контролю транскрипції й трансляції, промоторами, сайтами зв'язування рибосом, енхансерами, сайтами ініціації реплікації і т.д.) або інших компонентів (вибір генів і т.д.) усі з яких функціонально зв'язані, як добре відомо в цій галузі техніки. У деяких випадках використовуються дві нуклеїнові кислоти і кожна вводиться в 16 UA 110226 C2 5 10 15 20 25 30 35 40 45 50 55 60 різний експресійний вектор (наприклад, важкий ланцюг є першим експресійним вектором, легкий ланцюг є другим експресійним вектором), або альтернативно вони можуть бути введені в один експресійний вектор. Фахівцям у цій галузі техніки буде очевидно, що розробка експресійного вектора (-ов), включаючи вибір регуляторних послідовностей, може залежати від таких факторів, як вибір клітини-хазяїна, рівень експресії бажаного білка і т.д. [00154] Як правило, нуклеїнові кислоти й/або експресія можуть бути введені у придатну клітину-хазяїна для створення рекомбінантної клітини-хазяїна з використанням будь-якого способу, який підходить для обраної клітини-хазяїна (наприклад, трансформація, трансфекція, електропорація, інфекція), таким чином, що молекула (-и) нуклеїнової кислоти функціонально пов'язана з одним або декількома елементами, які контролюють експресію (наприклад, у векторі, у конструкції, яку створено за допомогою процесів у клітині, яка інтегрована у геном клітини-хазяїна). Отримана рекомбінантна клітина-хазяїн може витримуватися в умовах, які є придатними для експресії (наприклад, у присутності індуктора, у придатній тварині, крім людини, у придатному культуральному середовищі з додаванням відповідних солей, факторів росту, антибіотиків, харчових добавок і т.п.) у результаті чого продукується поліпептид (-и), який кодується. У деяких випадках важкі ланцюги продукуються в одній клітині, а легкий ланцюг в іншій. [00155] Лінії клітин ссавців, які є доступними як хазяїни для експресії, відомі в цій галузі техніки й включають багато безсмертних клітинниї ліній, які доступні з American Type Culture Collection (ATCC), Манассас, Вірджинія, які включають, але не обмежуються клітинами яєчника китайського хом'яка (СНО), НЕК 293 клітинами, NSO клітинами, HeLa клітинами, клітинами нирки дитинчати хом'яка (BHK), клітинами нирки мавпи (COS), клітинами гепатоцелюлярної карциноми людини (наприклад, Нер G2) і рядом інших клітинних ліній. Клітини, що не є клітинами ссавців, включають, але не обмежуються бактеріями, дріжджами, комахами, рослини також можуть бути використані для експресії рекомбінантних антитіл. У деяких варіантах втілення цього винаходу антитіла можуть бути отримані у трансгенних тваринах, таких як корови або кури. [00156] Загальні способи молекулярної біології антитіла, експресії, очищення та скринингу описані, наприклад, у роботах Antibody Engineering, edited by Kontermann & Dubel, Springer, Heidelberg, 2001 і 2010 Hayhurst & Georgiou, 2001, Curr Opin Chem Biol 5:683-689; Maynard & Georgiou, 2000, Annu Rev Biomed Eng 2:339-76; і Morrison, S. (1985) Science 229:1202. Використання й показання [00157] Створені антитіла відповідно до цього винаходу знаходять застосування в різних областях, включаючи діагностику CD38-опосередкованих захворювань і їх лікування. CD 38-опосередковані стани [00158] В одному з аспектів цей винахід пропонує способи діагностики й лікування стану, асоційованого із запаленням і імунними захворюваннями, зокрема захворювань, асоційованих з активованими лімфоцитами. Як показано в цьому документі, CD38 експресується в незрілих гематопоетичних клітинах, інгібується в зрілих клітинах і повторно експресується на високих рівнях в активованих лімфоцитах і плазматичних клітинах. Наприклад, висока експресія CD38 спостерігається на активованих В-клітинах, плазматичних клітинах, активованих CD4+ Тклітинах, активованих CD8+ Т-клітинах, NК-клітинах, NКТ-клітинах, зрілих дендритних клітинах (ДК) і активованих моноцитах. [00159] Терапевтичні антитіла до CD38 відповідно до цього винаходу зв'язуються з CD38позитивними клітинами, що приводить до виснаження цих клітин, таких як активовані лімфоцити, через численні механізми дії, включаючи як CDC, так і ADCC шляхи. [00160] Таким чином, будь-яке аутоімунне захворювання, яке демонструє або підвищену експресію CD38, або підвищене число клітин, які експресують CD38, як компонент захворювання, можливо лікувати з використанням антитіл відповідно до цього винаходу. Ці захворювання включають, але не обмежуються, алогенне відторгнення острівкового трансплантата, осередковою алопецією, анкілозуючим спондилітом, антифосфоліпідним синдромом, аутоімунним захворюванням Аддісона, антинейтрофільними цитоплазматичними аутоантитілами (ANCA), аутоімунними захворюваннями надниркових залоз, аутоімунною гемолітичною анемією, аутоімунним гепатитом, аутоімунним міокардитом, аутоімунною нейтропенією, аутоімуним оофоритом і орхітом, аутоімунною тромбоцитопенією, аутоімунною кропивницею, хворобою Бехчета, булезним пемфігоїдом, кардіоміопатією, синдромом Кастельмана, целіакія ялиновий-дерматит, синдром імунної дисфункції хронічної втоми, хронічної запальної демієлізуючою полінейропатією, синдром Черджа-Стросса, рубцевим пемфігоїдом, CREST синдромом, хворобою холодових аглютинінів, хворобою Крона, дерматоміозитом, дискоідним червоним вовчаком, есенційною змішаною кріоглобулінемією, 17 UA 110226 C2 5 10 15 20 25 30 35 40 45 50 55 60 недостатністю фактора VIII, фібромиалгією-фіброміозитом, гломерилонефритом, хворобою Грейвса, синдромом Гійєна-Барре, синдромом Гудпасчера, реакцією трансплантат-протихазяїна (РТПХ), тиреоїдитом Хашимото, гемофілією А, ідіопатичним легеневим фіброзом, ідіопатичною тромбоцитопенічною пурпурою (ІТП), IgA-нейропатією, IgM-полінейропатією, імуноопосередкованою тромбоцитопенією, ювенільним артритом, хворобою Кавасакі, пласким лишаєм, червоним вовчаком, хворобою Мен'єра, змішаним захворюванням сполучної тканини, розсіяним склерозом, цукровим діабетом 1типу, міастенією гравіс, вульгарним пемфігусом, перніціозною анемією, вузловим поліартритом, поліхондритом, полігландулярним синдромом, ревматичною поліміалгією, поліміозитом і дерматоміозитом, первинною агаммаглобулінемією, первинним біліарним цирозом печінки, псоріазом, псоріатичним артритом, феноменом Рейно, синдромом Рейтера, ревматоїдним артритом, саркоїдозом, склеродермією, синдромом Шегрена, відторгненням трансплантатів паренхіматозних органів, синдромом скованої людини, системним червоним вовчаком, артеріїтом Такаясу, скроневим артеріїтом/гигантоклітковим артеріїтом, тромботичною тромбоцитопенічною пурпурою, виразковим колітом, увеїтом, васкулітами, такими як дерматит, герпетиформний васкуліт, вітіліго та гранулематоз Вегенера. [00161] Конкретне використання в деяких варіантах втілення цього винаходу антитіла знайшли в діагностиці й/або лікуванні ряду захворювань, включаючи, але не обмежуючись аутоімунними захворюваннями, що включають, але не обмежуються системним червоним вовчаком (СЧВ), ревматоїдним артритом (РА), запальною хворобою кишечнику (ЗХК), виразковим колітом і реакцією трансплантата-проти-хазяїна. [00162] Наприклад, можуть бути відібрані пацієнти з високим вмістом плазматичних клітин, наприклад, пацієнти із СЧВ, що мають високий рівень плазматичних клітин, а також пацієнти з РА, які виявилися арективними до CD20 лікарським препаратам. [00163] В одному аспекті цей винахід пропонує способи лікування стану, асоційованого із проліферацією клітин, котрі експресують CD38, які включають введення пацієнту фармацевтично ефективної кількості описаного антитіла. У деяких варіантах втілення цього винаходу станом є рак і в конкретних варіантах втілення цього винаходу рак є гематологічним раком. В інших конкретних варіантах втілення цього винаходу станом є множинна мієлома, хронічний лімфобластний лейкоз, хронічний лімфолейкоз, плазмоклітинний лейкоз, гострий мієлоїдний лейкоз, хронічний мієлоїдний лейкоз, В-клітинна лімфома або лімфома Беркітта. [00164] Як відомо у цій галузі техніки, деякі стани асоційовані із клітинами, які експресують CD38, і деякі стани асоційовані з гіперекспресією, експресією високої щільності або активованою експресією CD38 на поверхні клітин. Експресує або не експресує популяція клітин CD38, можливо визначити способами, які відомі в цій галузі техніки, наприклад, визначення методом проточної цитометрії відсотка клітин у цій популяції, котрі мічені антитілом, яке специфічно зв'язується з CD38 або імуногістохімічними аналізами, які загалом описані нижче для діагностичного використання. Наприклад, популяцію клітин, у якій експресія CD38 виявляється в 10-30 % клітин, можливо розглядати, як таку, що має слабку CD38 позитивність, а популяцію клітин, у якій експресія CD38 виявляється в більш ніж приблизно 30 % клітин, можливо розглядати як CD38 позитивну (наприклад, у роботі Jackson et al. (1988), Clin. Exp. Immunol. 72: 351-356), хоча можуть бути використані інші критерії для визначення того, чи експресує популяція клітин CD38. Щільність експресії на поверхнях клітин може бути визначена з використанням способів, які відомі у цій галузі техніки, таких як, наприклад, вимірювання проточною цитометрією середньої інтенсивності флуоресценції клітин, які були флуоресцентно мічені з використанням антитіл, що специфічно зв'язуються з CD38. [00165] У деяких варіантах втілення цього винаходу композиції та способи відповідно до цього винаходу використовуються при раку, такому як "гематологічний рак", термін, який має відношення до злоякісних новоутворень кровотворних тканин і який включає лейкоз, лімфому й множинну мієлому. Необмежуючі приклади станів, асоційованих з експресією CD38, включають, але не обмежуються множинною мієломою (Jackson et al. (1988), Clin. Exp. Immunol. 72: 351356), В-клітинним хронічним лімфолейкозом (В-ХЛЛ) Dürig et al. (2002), Leukemia 16: 30-5; Morabito et al. (2001), Leukemia Research 25: 927-32; Marinov et al. (1993), Neoplasma 40(6): 3558; і Jelinek et al. (2001), Br. J. Haematol. 115: 854-61), гострим лімфобластним лейкозом (Keyhani et al. (1999), Leukemia Research 24: 153-9; і Marinov et al. (1993), Neoplasma 40(6): 355-8), хронічним мієлоїдним лейкозом (Marinov et al. (1993), Neoplasma 40(6): 355-8), гострим мієлоїдним лейкозом (Keyhani et al. (1999), Leukemia Research 24: 153-9), хронічним лімфолейкозом (ХЛЛ), хронічним мієлобластним лейкозом або хронічним мієлолейкозом (ХМЛ), гострим мієлобластним лейкозом або гострим мієлоїдним лейкозом (ГМЛ), гострим лімфобластним лейкозом (ГЛЛ), волосатоклітинним лейкозом (HCL), мієлодиспластичними синдромами (МДС) або хронічним мієлолейкозом (ХМЛ-БП) у бластній і всіма підтипами цих 18 UA 110226 C2 5 10 15 20 25 30 35 40 45 50 55 60 лейкозів, які визначаються морфологічними, гістохімічними й імунологічними методиками, добре відомими фахівцям у цій галузі техніки. [00166] "Неоплазія" або "непластичний стан" має відношення до стану, асоційованого із проліферацією клітин, яка характеризується втратою нормальних контролів, що приводить до одного або більше симптомів, у тому числі нерегульованому росту, відсутності диференціації, локальній тканинній інвазії й метастазам. [00167] У деяких варіантах втілення цього винаходу гематологічний рак обраний із групи хронічного лімфолейкозу (ХЛЛ), хронічного мієлолейкозу (ХМЛ), гострого мієлобластного лейкозу (ГМЛ) і гострого лімфобластного лейкозу (ГЛЛ). [00168] Крім того, у цій галузі техніки відомо, що експресія CD38 є прогностичним показником для пацієнтів зі станами, такими як, наприклад, В-клітинний хронічний лімфоцитарний лейкоз (Dürig et al. (2002), Leukemia 16: 30-5; і Morabito et al. (2001), Leukemia Research 25: 927-32) і гострий мієлобластний лейкоз (Keyhani et al. (1999), Leukemia Research 24: 153-9). [00169] ХЛЛ є найпоширенішим лейкозом серед дорослого населення в західному світі. ХЛЛ залучає клональну експансію псевдозрілих лімфоцитів із залученням лімфатичних вузлів і інших лімфоїдних тканин із прогресуючою інфільтрацією кісткового мозку й присутністю в периферичній крові. В-клітинна форма (В-ХЛЛ) є присутньою майже у всіх випадках. В-ХЛЛ [00170] В-ХЛЛ є невиліковним захворюванням, яке характеризується поступовим збільшенням анергічних моноклональних клітин B-лінії, котрі накопичуються в кістковому мозку й периферичній крові тривалий час протягом багатьох років. Експресія CD38 розглядається як незалежний несприятливий прогностичний фактор для В-ХЛЛ. Hamblin et al., Blood 99:1023-9 (2002). [00171] Сучасна стандартна терапія В-ХЛЛ носить паліативний характер і в основному провадиться цитостатичними препаратами хлорамбуцилом або флударабіном. При появі рецидивів часто проводиться комбинована терапія з використанням флударабіну, циклофосфаміду в комбінації з ритуксимабом (моноклональне антитіло до CD20) або кемпасом (моноклональне антитіло до CD52). Таким чином, існує критична незадоволена медична потреба в лікуванні В-ХЛЛ. У деяких варіантах втілення цього винаходу пропонуються способи лікування В-ХЛЛ із застосуванням описаних антитіл до CD38 (і, як проведено нижче, це може бути реалізоване за допомогою комбінації лікарських препаратів, які містять необов'язково й незалежно будь-який з вищенаведених лікарських засобів). [00172] В-ХЛЛ характеризується двома підтипами, хронічним і агресивним. Ці клінічні фенотипи корелюють із наявністю або відсутністю соматичних мутацій у гені варіабельної області важкого ланцюга імуноглобуліну (IgVH). У контексті цього опису хронічний В-ХЛЛ має відношення до порушення у суб'єкта, який має ген IgVH, що мутував, і/або який репрезентує один або більше клінічних фенотипів, пов'язаних із хронічним В-ХЛЛ. У контексті цього опису словосполучення агресивний В-ХЛЛ має відношення до порушення у суб'єкта, що має IgVH, який не мутував, і/або який репрезентує один або більше клінічних фенотипів, асоційованих з агресивним В-ХЛЛ. Множинна мієлома [00173] Множинна мієлома є злоякісним порушенням клітин B-лінії, яке характеризується пухлинною проліферацією плазматичних клітин у кістковому мозку. Сучасні схеми лікування демонструють помірні частоти відповіді. Однак, спостерігаються лише незначні зміни в загальній виживаності й середня виживаність становить близько 3 років. Таким чином, існує критична незадоволена медична потреба в лікуванні множинної мієломи. У деяких варіантах втілення цього винаходу пропонуються способи лікування множинної мієломи з використанням антитіл, які розкриті в цьому винаході. [00174] CD38 експресується на високому рівні на плазматичних клітинах, які є термінально диференційованими В-клітинами. [00175] Проліферацію мієломних клітин викликає різні ефекти, у тому числі літичні ураження (дірки) у кістці, знижену кількість еритроцитів, продукування аномальних білків (із супутнім пошкодженням нирок, нервів і інших органів), знижена функція імунної системи й підвищені рівні кальцію в крові (гіперкальціємія). [00176] Сучасні варіанти лікування включають хіміотерапію, переважно асоційовану, коли це можливо, з аутологічною трансплантацією стовбурних клітин (АТСК). Моноклональна гаммапатія невстановленої етіології та уповільнена множинна мієлома [00177] У деяких варіантах втілення цього винаходу пропонуються способи лікування моноклональної гаммапатії з використанням описаних антитіл. В інших варіантах втілення цього 19 UA 110226 C2 5 10 15 20 25 30 35 40 45 50 55 винаходу пропонуються способи лікування уповільненої множинної мієломи з використанням описаних антитіл. [00178] Моноклональна гаммапатія невстановленої етіології (МГНЕ) і уповільнена множинна мієлома (SMM) є безсимптомними, предраковими порушеннями, які характеризуються проліферацією моноклональних плазматичних клітин у кістковому мозку й відсутністю ураження органів-мішеней. [00179] Уповільнена множинна мієлома (SMM) є безсимптомним порушенням проліферації плазматичних клітин з високим ризиком прогресування в симптоматичну або активну множинну мієлому (N. Engl. J. Med. 356(25): 2582-2590 (2007)). [00180] Міжнародні єдині критерії, які визначають SMM, були прийняті в 2003 році й передбачають рівень M-білка у пацієнта > 30 г/л і/або клональнхи плазматичних клітин кісткового мозку > 10 % (Br. J. Haematol 121. 749-57 (2003)). У пацієнта не повинні спостерігатися органна або тканинна недостатність, включаючи кісткові ураження або симптоми (Br. J. Haematol. 121: 749-57 (2003)). [00181] Останні дослідження виявили два підкласи SMM; i) пацієнти із прогресуючим захворюванням і ii) пацієнти з непрогресуючим захворюванням (Br. J. Haematol. 121: 631-636 (2003)). Міжнародні єдині критерії, які визначають МГНЕ, передбачають рівень M-білка у пацієнта 28
ДивитисяДодаткова інформація
Назва патенту англійськоюAntibodies to cd38
Автори англійськоюElias, Kathleen Ann, Landes, Gregory, Singh, Shweta, Korver, Wouter, Drake, Andrew Walling, Haar-Frendscho, Mary, Snell, Gyorgy Pal, Bhaskar, Vinay
Назва патенту російськоюАнтитело к cd38
Автори російськоюЭлиас Кэтлин Энн, Ландес Грегори, Сингх Швета, Корвер Ваутер, Дрэйк Эндрю Уоллинг, Хаак-Френдсхо Мэри, Снелл Гиорги Пал, Бхаскар Винай
МПК / Мітки
МПК: A61P 35/02, A61K 39/395, C07K 16/28
Мітки: антитіло
Код посилання
<a href="https://ua.patents.su/72-110226-antitilo-do-cd38.html" target="_blank" rel="follow" title="База патентів України">Антитіло до cd38</a>
Попередній патент: Пристрій для очищення від налиплих або примерзлих насипних вантажів внутрішніх поверхонь піввагонів на роторному вагоноперекидачі
Наступний патент: Обгорнуте вмістище з язичком для відкривання, спосіб його виготовлення та спосіб видалення зовнішньої обгортки з обгорнутого вмістища
Випадковий патент: Запонка