Антитіло, яке специфічно зв’язується з bst1
Формула / Реферат
1. Антитіло або його антигензв'язуюча частина, що специфічно зв'язується з BST1, де вказане антитіло містить:
a) варіабельну ділянку важкого ланцюга, яка містить:
і) першу vhCDR, яка містить SEQ ID NO:10;
ii) другу vhCDR, яка містить послідовність, вибрану з групи, що складається з SEQ ID NO:12 та SEQ ID NO:51; та
iii) третю vhCDR, яка містить SEQ ID NO:14; та
b) варіабельну ділянку легкого ланцюга, яка містить:
і) першу vlCDR, яка містить SEQ ID NO:16;
ii) другу vlCDR, яка містить SEQ ID NO:18; та
iii) третю vlCDR, яка містить SEQ ID NO:20.
2. Антитіло або його антигензв'язуюча частина за п. 1, що містить:
важкий ланцюг, щонайменше на 95 % ідентичний SEQ ID NO:2, та
легкий ланцюг, щонайменше на 95 % ідентичний SEQ ID NO:4.
3. Антитіло або його антигензв'язуюча частина за п. 1, що містить:
варіабельну ділянку важкого ланцюга SEQ ID NO:2, та
варіабельну ділянку легкого ланцюга SEQ ID NO:4.
4. Антитіло або його антигензв'язуюча частина за п. 1, що містить:
важкий ланцюг, щонайменше на 95 % ідентичний SEQ ID NO:46, та
легкий ланцюг, щонайменше на 95 % ідентичний SEQ ID NO:49.
5. Антитіло або його антигензв'язуюча частина за п. 4, що містить:
варіабельну ділянку важкого ланцюга SEQ ID NO:46, та
варіабельну ділянку легкого ланцюга SEQ ID NO:49.
6. Антитіло за будь-яким з пп. 1-5, де антитіло являє собою повнорозмірне антитіло IgG1, IgG2, IgG3 або IgG4 ізотипу.
7. Антитіло або його антигензв'язуюча частина, за будь-яким одним з пп. 1-6, що додатково містить ковалентно приєднаний фрагмент.
8. Антитіло або його антигензв'язуюча частина за п. 7, де зазначений фрагмент являє собою лікарський засіб.
9. Антитіло або його антигензв'язуюча частина за п. 8, де вказаний лікарський засіб вибраний з групи, що складається з майтанзиноїду, доластатину, ауристатину, трихотецену, каліхеаміцину, CC1065 та їх похідних.
10. Виділене антитіло за будь-яким з пп. 1-9, де вказане антитіло індукує антитілозалежну клітинно-опосередковану цитотоксичність (ADCC), комплементзалежну цитотоксичність (CDC) та/або T-клітинну цитотоксичність.
11. Виділене антитіло за п. 10, де антитіло являє собою сконструйоване антитіло, що має підвищене зв'язування з Fc рецепторами та/або підвищену ефективність щодо ADCC та/або біспецифічного антитіла.
12. Виділене антитіло або його антигензв'язуюча частина за будь-яким одним з пп. 1-11, де антитіло являє собою біспецифічне або мультиспецифічне антитіло, яке специфічно зв'язується з першим антигеном, що містить BST1 та другим антигеном, вибраним з групи, яка складається з CD3 антигену та CD5 антигену.
13. Нуклеїнова кислота, що кодує важкий ланцюг антитіла або його антигензв'язуючу частину за будь-яким з попередніх пунктів.
14. Нуклеїнова кислота, що кодує легкий ланцюг антитіла або його антигензв'язуючу частину за будь-яким з попередніх пунктів.
15. Клітина-хазяїн, яка містить нуклеїнову кислоту за пп. 13 та/або 14.
16. Спосіб одержання антитіла за будь-яким одним з пп. 1-12, у якому культивують клітину-хазяїна за п. 15 в умовах, за яких експресується антитіло або його антигензв'язуюча частина, та необов'язково виділяють антитіло або його антигензв'язуючу частину.
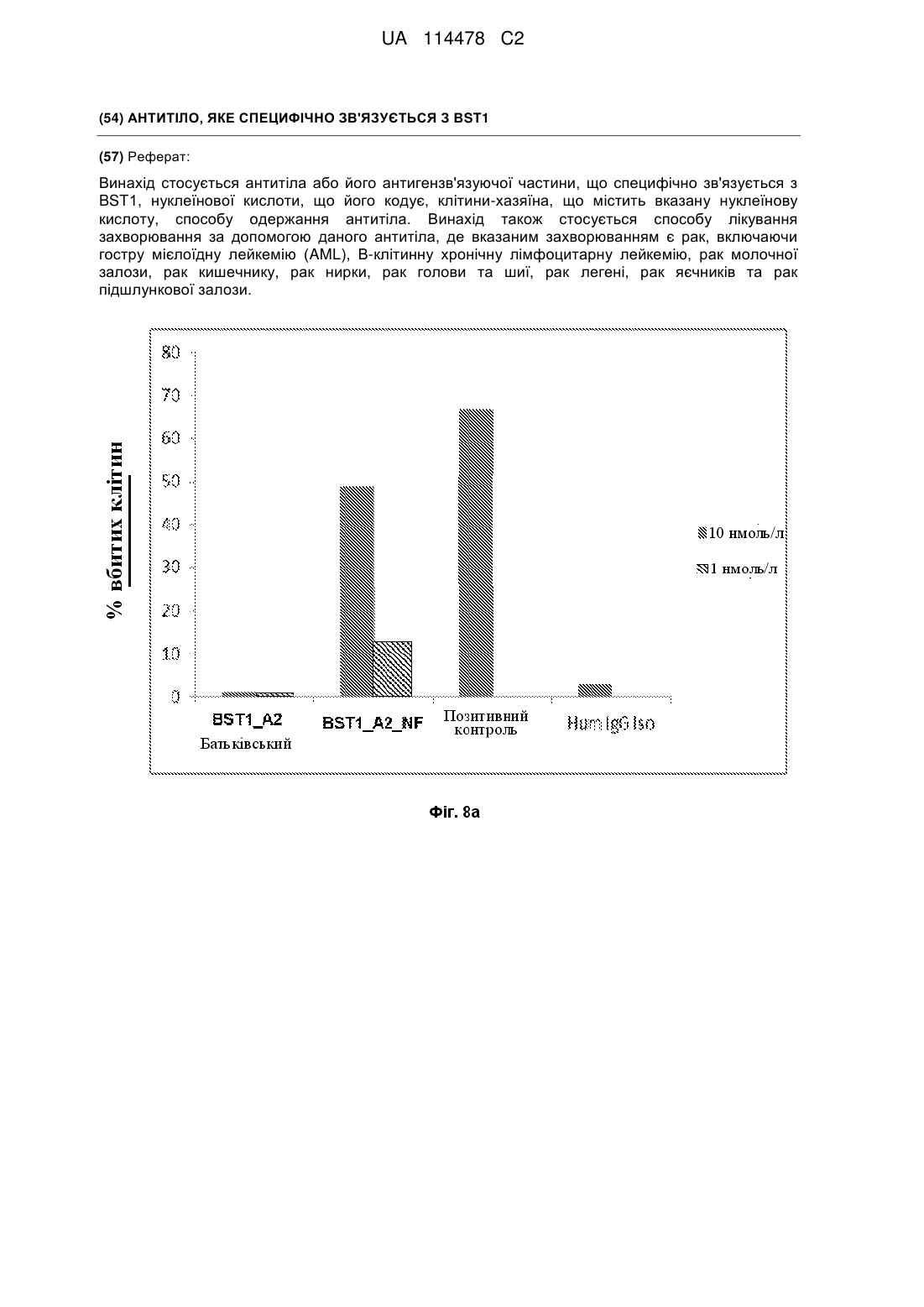
17. Спосіб лікування захворювання, у якому пацієнту, що цього потребує, вводять антитіло або його антигензв'язуючу частину, за будь-яким з пп. 1-12, де антитіло або його антигензв'язуючу частину інтерналізовано клітинами, що експресують BST1, причому вказане антитіло містить ковалентно приєднаний кон'югат лікарського засобу.
18. Спосіб лікування захворювання, у якому пацієнту, що цього потребує, вводять антитіло за будь-яким з пп. 1-12, причому антитіло індукує антитілозалежну клітинно-опосередковану цитотоксичність (ADCC), комплемент-залежну цитотоксичність (CDC) та/або T-клітинну цитотоксичність.
19. Спосіб за будь-яким з пп. 17-18, де вказаним захворюванням є рак, включаючи гостру мієлоїдну лейкемію (AML), В-клітинну хронічну лімфоцитарну лейкемію, рак молочної залози, рак кишечнику, рак нирки, рак голови та шиї, рак легені, рак яєчників та рак підшлункової залози.
20. Антитіло за будь-яким з пп. 1-12 для застосування в терапії або для застосування як лікарського засобу.
Текст
Реферат: Винахід стосується антитіла або його антигензв'язуючої частини, що специфічно зв'язується з BST1, нуклеїнової кислоти, що його кодує, клітини-хазяїна, що містить вказану нуклеїнову кислоту, способу одержання антитіла. Винахід також стосується способу лікування захворювання за допомогою даного антитіла, де вказаним захворюванням є рак, включаючи гостру мієлоїдну лейкемію (AML), В-клітинну хронічну лімфоцитарну лейкемію, рак молочної залози, рак кишечнику, рак нирки, рак голови та шиї, рак легені, рак яєчників та рак підшлункової залози. UA 114478 C2 5 10 15 20 25 30 35 40 45 50 55 60 ВСТУП Представлений винахід, в цілому, відноситься до галузі імунології та молекулярної біології. Більш конкретно, передбаченими в даному документі є антитіла та інші терапевтичні протеїни, спрямовані проти ADP-рибозилциклази 2, нуклеїнових кислот, які кодують такі антитіла та терапевтичні протеїни, способи одержання моноклональних антитіл та інших терапевтичних протеїнів, та способи лікування захворювань, таких як рак, опосередкований експресією/активністю ADP-рибозилциклази 2 та/або асоційований з аномальною експресією/активністю, відповідно лігандів. ГАЛУЗЬ ВИНАХОДУ ADP-рибозилциклаза 2 (також відома, як стромальний антиген кісткового мозку 1 (BST1) або CD157) є ліпід-фіксованим, біфункціональним ектоферментом, який каталізує рибонуклеотидну циклізацію та гідроліз. Вона генерує нуклеотидні вторинні месенджери циклічної ADP-рибози та ADP-рибози, які є здатними до активації вивільнення кальцію та фосфорилювання протеїну (FEBS Lett. 1994, 356(2-3):244-8). Це може підтримувати ріст B-клітин-попередників в паракринному способі, можливо шляхом генерації NAD + метаболітів (Proc. Natl. Acad. Sci. USA 1994, 91:5325-5329; J Biol Chem. 2005, 280:5343-5349). ADP-рибозилциклаза 2 та її гомолог, CD38, викликає, щоб діяти, як рецептори, що генерують метаболіти вторинного месенджера, що включає внутрішньоклітинне вивільнення Ca2+ за допомогою ріанодинового рецептору (Biochem Biophys Res Commun. 1996, 228(3):83845). Крім того, вона може діяти через CD11b інтегрин, щоб впливати на вивільнення Ca2+ через шлях PI-3 кінази (J Biol Regul Homeost Agents. 2007;21(1-2):5-11). Раніше не повідомлялось, що BST1 походить з мембран клітин гострої мієлоїдної лейкемії (AML), раку молочної залози, раку кишечнику, раку нирки, раку легені або раку підшлункової залози та представляє собою протеїн нового терапевтичного та діагностичного значення. Крім того, показано, що BST1 експресується на моноцитах та гранулоцитах, обидва з яких можуть бути асоційованими та активовані в захворюваннях, таких як астма, подагра, Крона, вовчак та діабет. Моноцити, крім того, є включеними в розвиток атеросклеротичних бляшок. КОРОТКИЙ ОПИС СУТІ ВИНАХОДУ Представлене розкриття передбачає антитіла, спрямовані проти BST1, нуклеїнові кислоти, що кодують такі антитіла, та терапевтичні протеїни, способи одержання анти-BST1 антитіл та інших терапевтичних протеїнів, та способи лікування захворювань, таких як розлади опосередковані BST1, наприклад, рак людини, включаючи гостру мієлоїдну лейкемію (AML), Вклітинну хронічну лімфоцитарну лейкемію, рак молочної залози, рак кишечнику, рак нирки, рак голови та шиї, рак легені, рак яєчників, рак підшлункової залози, та запальні захворювання людини, включаючи астму, подагру, Крона, вовчак, розсіяний склероз, ревматоїдний артрит, псоріаз, діабет та атеросклероз, надалі, називатимуться як "захворювання за винаходом". Таким чином, представлене розкриття передбачає виділені антитіла, зокрема мишачі, химерні, гуманізовані та повністю людські моноклональні антитіла, які зв'язуються з BST1, та демонструють одну або більше бажану функціональну властивість. Такі властивості включають, наприклад, високу афінність специфічного зв'язування з BST1. Крім того, передбаченими є способи лікування ряду захворювань, опосередкованих BST1, використовуючи антитіла, протеїни та композиції за представленим винаходом. В одному варіанті втілення, виділене анти-BST1 антитіло має: a) варіабельну ділянку важкого ланцюга, яка містить: i) першу CDR, яка містить послідовність, щонайменше, на 80 % ідентичну до SEQ ID NO: 10; ii) другу CDR, яка містить послідовність, щонайменше, на 80 % ідентичну до SEQ ID NO: 12 або SEQ ID NO: 51; iii) третю CDR, яка містить послідовність, щонайменше, на 80 % ідентичну до SEQ ID NO: 14; та b) варіабельну ділянку легкого ланцюга, яка містить: i) першу CDR, яка містить послідовність, щонайменше, на 80 % ідентичну до SEQ ID NO: 16; ii) другу CDR, яка містить послідовність, щонайменше, на 80 % ідентичну до SEQ ID NO: 18; iii) третю CDR, яка містить послідовність, щонайменше, на 80 % ідентичну до SEQ ID NO: 20. В наступному варіанті втілення, виділене анти-BST1 антитіло має: a) варіабельну ділянку важкого ланцюга, яка містить: i) першу CDR, яка містить послідовність, щонайменше, на 80 % ідентичну до SEQ ID NO: 9; ii) другу CDR, яка містить послідовність, щонайменше, на 80 % ідентичну до SEQ ID NO: 11; iii) третю CDR, яка містить послідовність, щонайменше, на 80 % ідентичну до SEQ ID NO: 13; та b) варіабельну ділянку легкого ланцюга, яка містить: 1 UA 114478 C2 i) першу CDR, яка містить послідовність, щонайменше, на 80 % ідентичну до SEQ ID NO: 15; ii) другу CDR, яка містить послідовність, щонайменше, на 80 % ідентичну до SEQ ID NO: 17; iii) третю CDR, яка містить послідовність, щонайменше, на 80 % ідентичну до SEQ ID NO: 19. В наступному варіанті втілення, виділене анти-BST1 антитіло має: a) варіабельну ділянку важкого ланцюга, яка містить: i) першу CDR, яка містить послідовність, щонайменше, на 80 % ідентичну до SEQ ID NO: 56; ii) другу CDR, яка містить послідовність, щонайменше, на 80 % ідентичну до SEQ ID NO: 57; iii) третю CDR, яка містить послідовність, щонайменше, на 80 % ідентичну до SEQ ID NO: 58; 5 та 10 15 20 25 30 35 40 45 50 55 60 b) варіабельну ділянку легкого ланцюга, яка містить: i) першу CDR, яка містить послідовність, щонайменше, на 80 % ідентичну до SEQ ID NO: 59; ii) другу CDR, яка містить послідовність, щонайменше, на 80 % ідентичну до SEQ ID NO: 60; iii) третю CDR, яка містить послідовність, щонайменше, на 80 % ідентичну до SEQ ID NO: 61. Епітоп(и), що розпізнаються антитілами за винаходом, є виявленими в поліпептидній послідовності SEQ ID NO: 44. В наступному варіанті втілення, антитіла за винаходом містять варіабельні CDR в порівнянні з батьківськими антитілами, описаними в даному документі. Таким чином, винахід передбачає варіантні антитіла, що містять варіантні варіабельні ділянки батьківського антитіла, де батьківське антитіло містить першу vhCDR, яка містить SEQ ID NO:10, другу vhCDR, яка містить послідовність, вибрану з групи, що складається з SEQ ID NO: 12 та SEQ ID NO: 51, третю vhCDR, яка містить SEQ ID NO:14, першу vlCDR, яка містить SEQ ID NO:16, другу vlCDR, яка містить SEQ ID NO: 18; та третю vlCDR, яка містить SEQ ID NO:20, та, де варіантне антитіло має 1, 2, 3, 4, 5 або 6 амінокислотних заміщень разом в серії першої vhCDR, другої vhCDR, третьої vhCDR, першої vlCDR, другої vlCDR та третьої vlCDR, з від 1 до 4 заміщень для конкретного застосування, та де антитіло зберігає специфічне зв'язування з BST1. Аналогічним чином, батьківське антитіло може містити першу vhCDR, яка містить SEQ ID NO:9, другу vhCDR, яка містить SEQ ID NO:11, третю vhCDR, яка містить SEQ ID NO:13; першу vlCDR, яка містить SEQ ID NO:15, другу vlCDR, яка містить SEQ ID NO: 17, та третю vlCDR, яка містить SEQ ID NO:19. Крім того, батьківське антитіло може містити першу vhCDR, яка містить SEQ ID NO:56, другу vhCDR, яка містить SEQ ID NO: 57, третю vhCDR, яка містить SEQ ID NO:58, першу vlCDR, яка містить SEQ ID NO:59, другу vlCDR, яка містить SEQ ID NO:60, та третю vlCDR, яка містить SEQ ID NO:61. В наступному варіанті втілення, виділене анти-BST1 антитіло має послідовність варіабельної ділянки важкого ланцюга, як представлено в SEQ ID NO: 2, та послідовність варіабельної ділянки легкого ланцюга, як представлено в SED ID NO: 4. В іншому варіанті втілення, виділене анти-BST1 антитіло має послідовність варіабельної ділянки важкого ланцюга, як представлено в SEQ ID NO: 45, та послідовність варіабельної ділянки легкого ланцюга, як представлено в SED ID NO: 49. В іншому варіанті втілення, виділене анти-BST1 антитіло має послідовність варіабельної ділянки важкого ланцюга, як представлено в SEQ ID NO: 1, та послідовність варіабельної ділянки легкого ланцюга, як представлено в SED ID NO: 3. В наступному варіанті втілення, виділене анти-BST1 антитіло має послідовність варіабельної ділянки важкого ланцюга, як представлено в SEQ ID NO: 52, та послідовність варіабельної ділянки легкого ланцюга, як представлено в SED ID NO: 53. В одному варіанті втілення, будь-які попередні антитіла мають Fc домен. В деяких варіантах втілення Fc домен є людським. В інших варіантах втілення, Fc домен є варіантним людським Fc доменом. В іншому варіанті втілення, будь-які попередньо описані антитіла представляють собою моноклональні антитіла. В одному варіанті втілення, будь-які попередньо описані антитіла додатково містять кон'югуючий агент. В деяких варіантах втілення кон'югуючий агент представляє собою цитотоксичний агент. В інших варіантах втілення кон'югуючий агент представляє собою полімер. В іншому варіанті втілення, полімером є поліетиленгліколь (ПЕГ). В іншому варіанті втілення, ПЕГ представляє собою похідну ПЕГ. В одному варіанті втілення, виділене антитіло представляє собою антитіло, яке конкурує з будь-якими антитілами-попередниками за зв'язування з BST1. В іншому варіанті втілення описаним є спосіб одержання будь-яких антитіл-попередників, де відповідно до способу одержують клітину-господар, яка містить одну або більше молекул нуклеїнової кислоти, яка кодує антитіла-попередники, ріст клітини-господаря в культурі клітинигосподаря, забезпечуючи умови для культури клітини-господаря, де експресується одна або 2 UA 114478 C2 5 10 15 20 25 30 35 40 45 50 55 60 більше молекул нуклеїнової кислоти, та відновлення антитіла з клітини-господаря або культури клітини-господаря. В одному варіанті втілення, будь-яке з описаних анти-BST1 антитіл передбачається в фармацевтичній композиції. В іншому варіанті втілення, передбачається спосіб лікування або попередження захворювання, асоційованого з BST1, спосіб, за яким суб'єкту, який потребує цього, вводять ефективну кількість будь-якого з антитіл-попередників. Представлений винахід передбачає виділене моноклональне антитіло, або його антигензв'язуючу частину, фрагмент антитіла або антитіло-міметик, які зв'язують епітоп на людському BST1, який розпізнається антитілом, що містить варіабельну ділянку важкого ланцюга, яка містить амінокислотну послідовність, представлену в SEQ ID NO, яка вибрана з групи, що складається з 2, 1 та 52, та варіабельну ділянку легкого ланцюга, яка містить амінокислотну послідовність, представлену в SEQ ID NO, яка вибрана з групи, що складається з 4, 3, 54 та 55. В деяких варіантах втілення, виділене антитіло представляє собою повнорозмірне антитіло IgG1, IgG2, IgG3 або IgG4 ізотипу. В деяких варіантах втілення, антитіло за представленим винаходом вибирають з групи, що складається з: цілого антитіла, фрагменту антитіла, гуманізованого антитіла, антитіла з одинарним ланцюгом, імунокон'югату, дефукозильованого антитіла та біспецифічного антитіла. Фрагмент антитіла може бути вибраним з групи, що складається з: частини-носія юнітіла, домену антитіла та нанотіла. В деяких варіантах втілення, імунокон'югати за винаходом містять терапевтичний агент. В іншому аспекті за винаходом, терапевтичний агент представляє собою цитотоксин або радіоактивний ізотоп. В деяких варіантах втілення, антитіло за представленим винаходом вибирають з групи, що складається з: афібоді, DARPin, антикаліну, авімеру, версатіла та дуокаліну. В альтернативних варіантах втілення, композиції за представленим винаходом містять виділене антитіло або його антиген-зв'язуючу частину та фармацевтично прийнятний носій. В інших аспектах, антитіло за представленим винаходом представляє собою композицію, яка містить виділене антитіло або його антиген-зв'язуючу частину у відповідності з винаходом та фармацевтично прийнятний носій. В деяких варіантах втілення, винахід включає молекулу виділеної нуклеїнової кислоти, яка кодує важкий або легкий ланцюг виділеного антитіла або його антиген-зв'язуючої частини, яка зв'язуються з епітопом на BST1 людини. Інші аспекти за винаходом включають вектори, які експресують, що містять такі молекули нуклеїнової кислоти, та клітини-господарі, що містять такі вектори, які експресують. В деяких варіантах втілення, представлений винахід передбачає спосіб одержання антиBST1 антитіла, де зазначений спосіб включає стадії: одержання клітини-господаря, яка містить одну або більше молекул нуклеїнової кислоти, які кодують антитіло за винаходом; ріст клітинигосподаря в культурі клітини-господаря; забезпечення умов для культури клітини-господаря, за яких експресують одна або більше молекул нуклеїнової кислоти; та відновлення антитіла з клітини-господаря або з культури клітини-господаря. В інших варіантах втілення, винахід стосується способів лікування або попередження захворювання, асоційованого з клітинами-мішенями, що експресують BST1, де зазначений спосіб включає стадію введення суб'єкту анти-BST1 антитіла, або його антиген-зв'язуючої частини, в кількості ефективній для лікування або попередження захворювання. В деяких аспектах, захворювання, яке лікують або попереджують за допомогою антитіл або їх антигензв'язуючої частини за винаходом, представляє собою рак людини. В деяких варіантах втілення, захворювання, які лікують або попереджують за допомогою антитіл за представленим винаходом, включають захворювання за винаходом. В інших варіантах втілення, винахід стосується способів лікування або попередження захворювання, асоційованого з клітинами-мішенями, що експресують BST1, де зазначений спосіб включає стадію введення суб'єкту анти-BST1 антитіла, або його антиген-зв'язуючої частини, в кількості ефективній для лікування або попередження захворювання. В деяких аспектах, захворювання, яке лікують або попереджують за допомогою антитіл або його антигензв'язуючої частини за винаходом, представляє собою рак людини. В деяких варіантах втілення, захворювання, які лікують або попереджують за допомогою антитіл за представленим винаходом, представляють собою захворювання за винаходом. В інших варіантах втілення, винахід стосується анти-BST1 антитіла, або його антигензв'язуючої частини, для застосування в лікуванні або попередженні захворювання, асоційованого з клітинами-мішенями, що експресують BST1. В деяких аспектах, захворювання, яке лікують або попереджують за допомогою антитіл, або їх антиген-зв'язуючої частини за 3 UA 114478 C2 5 10 15 20 25 30 35 40 45 50 55 60 винаходом, представляє собою рак людини. В деяких варіантах втілення, захворювання, які лікують або попереджують за допомогою антитіл за представленим винаходом, представляють собою захворювання за винаходом. В інших варіантах втілення, винахід стосується застосування анти-BST1 антитіла, або його антиген-зв'язуючої частини для виробництва лікарського засобу для застосування в лікуванні або попередженні захворювання, асоційованого з клітинами-мішенями, що експресують BST1. В деяких аспектах, захворювання, яке лікують або попереджують за допомогою лікарського засобу за винаходом, представляє собою рак людини. В деяких варіантах втілення, захворювання, які лікують або попереджують за допомогою лікарського засобу за представленим винаходом, представляють собою захворювання за винаходом. В інших варіантах втілення, представлений винахід представляє собою виділене моноклональне антитіло або його антиген-зв'язуючу частину, фрагмент антитіла, або антитіломіметик, які зв'язують епітоп на BST1 людини, який розпізнається антитілом, що містить варіабельну ділянку важкого ланцюга та варіабельну ділянку легкого ланцюга, вибрану з групи, яка складається з варіабельної ділянки важкого ланцюга амінокислотної послідовності, представленої в SEQ ID NO: 2, та варіабельної ділянки легкого ланцюга амінокислотної послідовності, представленої в SEQ ID NO: 4; варіабельної ділянки важкого ланцюга амінокислотної послідовності, представленої в SEQ ID NO: 1, та варіабельної ділянки легкого ланцюга амінокислотної послідовності, представленої в SEQ ID NO: 3; варіабельної ділянки важкого ланцюга амінокислотної послідовності, представленої в SEQ ID NO: 52, та варіабельної ділянки легкого ланцюга амінокислотної послідовності, представленої в SEQ ID NO: 53. В наступних аспектах, антитіло вибирають з групи, що складається з: цілого антитіла, фрагменту антитіла, гуманізованого антитіла, антитіло з одинарним ланцюгом, імунокон'югату, дефукозильованого антитіла та біспецифічного антитіла. В наступних аспектах за винаходом, фрагмент антитіла вибирають з групи, що складається з: юнітіла, домену антитіла та нанотіла. В деяких варіантах втілення, антитіло-міметик вибирають з групи, що складається з: афібоді, DARPin, антикаліну, авімеру, версатіла та дуокаліну. В наступних варіантах втілення, композиція містить виділене антитіло або його антиген-зв'язуючу частину, та фармацевтично прийнятний носій. В деяких варіантах втілення, представлений винахід представляє собою молекулу виділеної нуклеїнової кислоти, яка кодує важкий або легкий ланцюг виділеного антитіла або його антигензв'язуючу частину антитіла за винаходом, та, в наступних аспектах, можуть включати вектор, що експресує, який містить такі нуклеїнові кислоти, та клітини-господарі, що містять такі вектори, які експресують. Інший варіант втілення за представленим винаходом представляє собою гібридому, яка експресує антитіло або його антиген-зв'язуючу частину будь-якого одного з антитіл за винаходом. Інші аспекти за винаходом стосуються способів одержання антитіл за винаходом, які включають стадії: імунізації тваринного BST1 пептидом; відновлення мРНК з B клітин вказаного тваринного; перетворення вказаної мРНК в кДНК; експресування вказаної кДНК в фагах, таким чином, що анти-BST1 антитіла, кодовані вказаною кДНК, є присутніми на поверхні вказаних фагів; відбір фагів, які відтворюють анти-BST1 антитіла; відновлення молекул нуклеїнової кислоти з вказаних виділених фагів, які кодують вказані анти-BST1 імуноглобуліни; експресування вказаних відновлених молекул нуклеїнової кислоти в клітині-господарі; та відновлення антитіла з вказаної клітини-господаря, яке зв'язується з BST1. В деяких аспектах за винаходом, виділене моноклональне антитіло, або його антигензв'язуюча частина, зв'язують епітоп на BST1 поліпептиді, який має амінокислотну послідовність SEQ ID NO: 44, яка розпізнається антитілом, що містить варіабельну ділянку важкого ланцюга, яка містить амінокислотну послідовність, представлену в SEQ ID NO: вибрану з групи, яка складається з 2, 1 або 52, та варіабельну ділянку легкого ланцюга, яка містить амінокислотну послідовність, представлену в SEQ ID NO: вибрану з групи, яка складається з 4, 3 або 53. Інші особливості та переваги представленого винаходу будуть розкриті з наступного детального опису та прикладів, які не повинні бути витлумачені як обмеження. Сутність всіх посилань, запису Genbank, патентів та опублікованих заявок на патент, які цитуються впродовж всієї даної заявки, певно включені в даний документ у вигляді посилання. КОРОТКИЙ ОПИС ФІГУР 4 UA 114478 C2 5 10 15 20 25 30 35 40 45 50 55 60 Фігура 1a показує вирівнювання нуклеотидних послідовностей CDR1 ділянок A1 важкого ланцюга (SEQ ID NO:21) з нуклеотидами 138392-138424 нуклеотидної послідовності мишачої зародкової лінії VH 1-80 (SEQ ID NO:33); вирівнювання нуклеотидних послідовностей CDR1 ділянок A2 важкого ланцюга (SEQ ID NO:22) з нуклеотидами 153362-153394 нуклеотидної послідовності мишачої зародкової лінії VH 1-39 (SEQ ID NO:35). Фігура 1b показує вирівнювання нуклеотидних послідовностей CDR2 ділянок A1 важкого ланцюга (SEQ ID NO:23) з нуклеотидами 138461-138511 нуклеотидної послідовності мишачої зародкової лінії VH 1-80 (SEQ ID NO:34); вирівнювання нуклеотидних послідовностей CDR2 ділянок A2 важкого ланцюга (SEQ ID NO:24) з нуклеотидами 153431-153481 нуклеотидної послідовності мишачої зародкової лінії VH 1-39 (SEQ ID NO:36). Фігура 2a показує вирівнювання нуклеотидних послідовностей CDR1 ділянок A1 легкого ланцюга (SEQ ID NO:27) з нуклеотидами 496-531 нуклеотидної послідовності мишачої зародкової лінії VK 4-74 (SEQ ID NO:37); вирівнювання нуклеотидних послідовностей CDR1 ділянок A2 легкого ланцюга (SEQ ID NO:28) з нуклеотидами 523-552 нуклеотидної послідовності мишачої зародкової лінії VK 4-55 (SEQ ID NO:40). Фігура 2b показує вирівнювання нуклеотидних послідовностей CDR2 ділянок A1 легкого ланцюга (SEQ ID NO:29) з нуклеотидами 577-597 нуклеотидної послідовності мишачої зародкової лінії VK 4-74 (SEQ ID NO:38); вирівнювання нуклеотидних послідовностей CDR2 ділянок A2 легкого ланцюга (SEQ ID NO:30) з нуклеотидами 598-618 нуклеотидної послідовності мишачої зародкової лінії VK 4-55 (SEQ ID NO:41). Фігура 2c показує вирівнювання нуклеотидних послідовностей CDR3 ділянок A1 легкого ланцюга (SEQ ID NO:31) з нуклеотидами 691-718 нуклеотидної послідовності мишачої зародкової лінії VK 4-74 (SEQ ID NO:39); вирівнювання нуклеотидних послідовностей CDR3 ділянок A2 легкого ланцюга (SEQ ID NO:32) з нуклеотидами 715-739 нуклеотидної послідовності мишачої зародкової лінії VK 4-55 (SEQ ID NO:42). Фігура 3a та 3b показують результати проточного цитометричного аналізу BST1 на A549 та H226 клітинах. Фігура 4a та 4b показують інтерналізацію анти-BST1 моноклональних антитіл A549 та H226 клітинами, використовуючи MabZAP аналіз. Фігура 5 показує вирівнювання залишків 21-137 SEQ ID NO: 2 (SEQ ID NO: 45), гуманізованого VH ланцюга з CDR ділянками (виділені товстим шрифтом) SEQ ID NO: 2, перенесеними у відповідні положення зародкової лінії людини BF238102 VH (SEQ ID NO: 46), із зародковою лінією людини BF238102 VH (SEQ ID NO: 47). Залишки, які демонструють значний контакт з CDR ділянками, заміщеними відповідними людськими залишками. Дані заміщення (підкреслені) виконували в положеннях 30, 48, 67, 71 та 100. Фігура 6 показує вирівнювання залишків 22-128 SEQ ID NO: 4 (SEQ ID NO: 48), гуманізованого VL ланцюга з CDR ділянками (виділені товстим шрифтом) SEQ ID NO: 4, перенесеними у відповідні положення зародкової лінії людини X72441 VL (SEQ ID NO: 49) із зародковою лінією людини X72441 VL (SEQ ID NO: 50). Залишки, які демонструють значний контакт з CDR ділянками, заміщеними відповідними людськими залишками. Дане заміщення (підкреслене) виконували в положення 71. Фігура 7 показує вирівнювання CDR2 ділянки A2 важкого ланцюга (SEQ ID NO: 12) з можливими амінокислотними заміщеннями (SEQ ID NO: 51) без втрати антиген-зв'язуючої афінності. Фігура 8 показує BST1_A2 та BST1_A2_NF вибір антитіла в залежності від відповіді на клітинну цитотоксичність (ADCC) в присутності ефекторних клітин. ДЕТАЛЬНИЙ ОПИС ВИНАХОДУ Представлене розкриття стосується виділених антитіл, включаючи, але не обмежуючись цим, моноклональні антитіла, наприклад, які специфічно зв'язують BST1 з високою афінністю, як описано в даному документі. В певних варіантах втілення, антитіла, що передбачаються, мають специфічні структурні особливості, такі як CDR ділянки з певними амінокислотними послідовностями. Дане розкриття передбачає виділені антитіла (які, як описано нижче, включає широку різноманітність добре відомих структур, похідних, міметиків та кон'югатів), способи створення вказаних молекул та фармацевтичні композиції, що містять вказані молекули та фармацевтичний носій. Дане розкриття, крім того, стосується способів застосування молекул, таких як детектування BST1, а також лікування захворювань, асоційованих з експресією BST1, таких як BST1 експресовані на пухлинах та при запальних захворюваннях, включаючи захворювання за винаходом. Для того, щоб представлене розкриття могло бути більш легко зрозумілим, спочатку визначають деякі терміни. Додаткові визначення наведені по всьому детальному опису. 5 UA 114478 C2 5 10 15 20 25 30 35 40 45 50 55 60 Гуманізовані та мишачі антитіла за даним розкриттям можуть, в певних випадках, перехресно реагують з BST1 від інших видів, ніж людина. В певних варіантах втілення, антитіла можуть бути повністю специфічними для одного або більше людського BST1, та не можуть демонструвати види або інші типи нелюдської перехресної реактивності. Термін "імунна відповідь" стосується дії, наприклад, лімфоцитів, антигену, що є присутнім в клітинах, фагоцитарних клітин, гранулоцитів та розчинних макромолекул, що продукуються клітинами, описаними вище, або печінкою (включаючи антитіла, цитокіни та комплемент), що в результаті призводить до селективного пошкодження, руйнуванню або видаленню з тіла людини, враженого патогенами, клітинами або тканинами, інфікованими патогенами, раковими клітинами або, у випадках аутоімунності або патологічного запалення, нормальних людських клітин або тканин. Термін "сигнальний шлях трансдукції" стосується біохімічного взаємозв'язку між різними молекулами сигнальної трансдукції, які приймають участь в передачі сигналу від однієї частини клітини до іншої частини клітини. Як використовується в даному документі, вираз "клітинний поверхневий рецептор" включає, наприклад, молекули та комплекси здатні до отримання сигналу та передачі такого сигналу через плазмову мембрану клітини. Прикладом "клітинного поверхневого рецептору" є BST1. Термін "антитіло", як згадується в даному документі, включає, як мінімум, антигензв'язуючий фрагмент (тобто "антиген-зв'язуючу частину") імуноглобуліну. Визначення "антитіло" включає, але не обмежується цим, повнорозмірні антитіла, фрагменти антитіл, антитіла з одинарним ланцюгом, біспецифічні антитіла, мінітіла, домени антитіл, синтетичні антитіла (іноді, називають в даному документі як "антитіла-міметики"), химерні антитіла, гуманізовані антитіла, антитіла злиття (іноді, які називають, як "антитілакон'югати") та фрагменти та/або похідні кожного, відповідно. Як правило, повнорозмірне антитіло (іноді, які називають, як "цілі антитіла") стосується глікопротеїну, який може містити, щонайменше, два важких (H) ланцюга та два легких (L) ланцюга взаємозв'язаних за рахунок дисульфідних зв'язків. Кожен важкий ланцюг міститься в варіабельній ділянці важкого ланцюга (скорочено в даному документі, як VH) та константній ділянці важкого ланцюга. Константна ділянка важкого ланцюга міститься в трьох доменах, C H1, CH2 та CH3. Кожен легкий ланцюг міститься в варіабельній ділянці легкого ланцюга (скорочено в даному документі, як V L або VK) та константній ділянці легкого ланцюга. Константна ділянка легкого ланцюга міститься в одному домені, CL. VH та VL/VK ділянки, крім того, можуть бути підрозділені на ділянки гіперваріабельності, термінованої комплементарності визначаючих ділянок (CDR), розсіяних з ділянками, які є більш збереженими, термінованими структурними ділянками (FR). Кожна V H та VL/VK міститься в трьох CDR та чотирьох FR, впорядкованих від аміно-кінця до карбокси кінця в наступному порядку: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. Варіабельні ділянки важких та легких ланцюгів містять зв'язуючий домен, який взаємодіє з антигеном. Константні ділянки антитіла можуть бути посередниками зв'язування імуноглобуліну з тканинами господаря або факторами, включаючи різні клітини імунної системи (наприклад, ефекторні клітини) та перший компонент (Clq) класичної системи комплементу. В одному варіанті втілення, антитіло представляє собою фрагмент антитіла. Специфічні фрагменти антитіл включають, але не обмежуються цим, (i) Fab фрагмент, який складається з VL, VH, CL та CH1 доменів, (ii) Fd фрагмент, який складається з V H та CH1 доменів, (iii) Fv фрагмент, який складається з VL та VH доменів одного антитіла, (iv) dAb фрагмент, який складається з одного варіабельного домену, (v) виділені CDR ділянки, (vi) F(ab')2 фрагменти, бівалентний фрагмент, який містить два зв'язаних Fab фрагмента, (vii) молекули з одинарним ланцюгом Fv (scFv), де VH домен та VL домен є зв'язаними за рахунок пептидного лінкеру, який дозволяє двом доменам зв'язуватися з утворенням антиген-зв'язуючого сайту, (viii) біспецифічні димери з одинарним ланцюгом Fv, та (ix) "діатіла" або "триотіла", мультивалентніабо мультиспецифічні фрагменти, сконструйовані за рахунок генного злиття. Фрагменти антитіл можуть бути модифіковані. Наприклад, молекули можуть бути стабілізовані за рахунок включення дисульфідних зв'язків в зв'язування VH та VL доменів. Приклади форматів та архітектур антитіла описані в Holliger & Hudson (2006) Nature Biotechnology 23(9):1126-1136, та Carter (2006) Nature Reviews Immunology 6:343-357, та посилання, які цитуються в даному документі, всі повністю включені у вигляді посилання. Представлене розкриття передбачає аналоги антитіла. Такі аналоги можуть містити багато структур, включаючи, але не обмежуючись цим, повнорозмірні антитіла, фрагменти антитіл, біспецифічні антитіла, мінітіла, домени антитіл, синтетичні антитіла (іноді, які називають, в даному документі як "антитіла-міметики"), антитіла злиття, антитіла-кон'югати, та фрагменти з кожного, відповідно. 6 UA 114478 C2 5 10 15 20 25 30 35 40 45 50 55 60 В одному варіанті втілення, імуноглобулін містить фрагмент антитіла. Специфічні фрагменти антитіл включають, але не обмежуються цим, (i) Fab фрагмент, який складається з VL, VH, CL та CH1 доменів, (ii) Fd фрагмент, який складається з VH та CH1 доменів, (iii) Fv фрагмент, який складається з VL та VH доменів одного антитіла; (iv) dAb фрагмент, який складається з одного варіабельного, (v) виділені CDR ділянки, (vi) F(ab')2 фрагменти, бівалентний фрагмент, яка містить два зв'язаних Fab фрагмента, (vii) молекули з одинарним ланцюгом Fv (scFv), де VH домен та VL домен є зв'язаними за рахунок пептидного лінкеру, який дозволяє двом доменам зв'язуватися з утворенням антиген-зв'язуючого сайту, (viii) біспецифічні димери з одинарним ланцюгом Fv, та (ix) "діатіла" або "триотіла", мультивалентні або мультиспецифічні фрагменти, сконструйовані за рахунок генного злиття. Фрагменти антитіл можуть бути модифіковані. Наприклад, молекули можуть бути стабілізовані за рахунок включення дисульфідних зв'язків в зв'язування VH та VL доменів. Приклади форматів та архітектур антитіла описані в Holliger & Hudson, 2006, Nature Biotechnology 23(9):1126-1136, та Carter 2006, Nature Reviews Immunology 6:343-357 та посилання, які цитуються в даному документі, всі повністю включені у вигляді посилання. Імуноглобулінові гени, що розпізнаються, наприклад, у людей, включають каппа (κ), лямбда (λ), та генетичні локуси важкого ланцюга, які разом містять різноманітні гени варіабельної ділянки, та гени мю (υ), дельта (δ), гамма (γ), сигма (σ) та альфа (α) константної ділянки, які кодують IgM, IgD, IgG (IgG1, IgG2, IgG3, та IgG4), IgE, та IgA (IgA1 та IgA2) ізотипи, відповідно. Мається на увазі, що антитіло в даному документі включає повнорозмірні антитіла та фрагменти антитіл, та може відноситись до природного антитіла з будь-якого організму, сконструйованого антитіла або антитіла, створеного рекомбінантно для експериментальних, терапевтичних або інших цілей. В одному варіанті втілення, антитіло, розкрите в даному документі, може бути мультиспецифічним антитілом, та, зокрема, біспецифічним антитілом, також, яке іноді називають, як "діатіло". Існують антитіла, які зв'язують два (або більше) різних антигени. Діатіла можуть бути отримані різними шляхами, відомими в даній галузі з рівня техніки, наприклад, одержані з хімічних або з гібридних гібридом. В одному варіанті втілення, антитіло представляє собою мінітіло. Мінітіла представляють собою мінімізовані антитіло-подобні протеїни, що містять scFv, зв'язані з CH3 доменом. В деяких випадках, scFv можуть бути зв'язаними з Fc ділянкою, та можуть включати декілька або всі шарнірні ділянки. Для опису мультиспецифічних антитіл, дивись Holliger and Hudson (2006) Nature Biotechnology 23(9):1126-1136 та посилання, які цитуються в даному документі, всі повністю включені у вигляді посилання. Під "CDR", як використовується в даному документі, мають на увазі "ділянку, що визначає комплементарність" варіабельного домену антитіла. Систематична ідентифікація залишків, включених в CDR, розроблена Кабатом (Kabat) (Kabat et al. (1991) Sequences of Proteins of Immunological Interest, 5th Ed., United States Public Health Service, National Institutes of Health, Bethesda) та альтернативно Чотія (Chothia) [Chothia and Lesk (1987) J. Mol. Biol. 196: 901-917; Chothia et al. (1989) Nature 342: 877-883; Al-Lazikani et al. (1997) J. Mol. Biol. 273: 927-948]. Для цілей за представленим винаходом, CDR визначають, як ненабагато менший набір залишків, ніж CDR, визначений Чотія (Chothia). Визначено, що в даному документі VL CDR включають залишки в положеннях 27-32 (CDR1), 50-56 (CDR2) та 91-97 (CDR3), де нумерація представлена у відповідності з Чотія. Так як VL CDR, як визначено за Чотія та Кабатом, є ідентичними, нумерація положень даного VL CDR також представлена у відповідності з Кабатом. Визначено, що в даному документі VH CDRs включають залишки в положеннях 27-33 (CDR1), 52-56 (CDR2), та 95-102 (CDR3), де нумерація представлена у відповідності з Чотія. Дані VH CDR положення відповідають положенням Кабата 27-35 (CDR1), 52-56 (CDR2), та 95102 (CDR3). Як буде оцінено кваліфікованим спеціалістом в даній галузі, CDR, розкриті в даному документі, можуть, крім того, включати варіанти, наприклад, при обернено мутуючих CDR, розкритих в даному документі, в різних структурних ділянках. Як правило, ідентичність нуклеїнових кислот між індивідуальними варіантами CDR становить, щонайменше, 80 % до послідовностей, описаних в даному документі, та більш типово з переважно зростаючими ідентичностями, щонайменше, 85 %, 90 %, 91 %, 92 %, 93 %, 94 %, 95 %, 96 %, 97 %, 98 %, 99 % та майже 100 %. Аналогічним чином, "відсоток (%) ідентичності послідовності нуклеїнової кислоти" по відношенню до послідовності нуклеїнової кислоти, що зв'язує протеїни, ідентифікованих в даному документі, визначають як відсоток нуклеотидних залишків в кандидатну послідовність, яка є ідентичною за нуклеотидними залишками в кодуючій послідовності антиген-зв'язуючого протеїну. Специфічний спосіб використовує BLASTN модуль WU-BLAST-2 набору значених параметрів за замовчуванням, з перекриттям меж та 7 UA 114478 C2 5 10 15 20 25 30 35 40 45 50 55 60 перекриттям набору фрагментів 1 та 0,125, відповідно, та без вибраних фільтрів. Як правило, ідентичність послідовності нуклеїнової кислоти між нуклеотидними послідовностями, які кодують індивідуальний варіант CDR, та нуклеотидними послідовностями, описаними в даному документі, становить, щонайменше, 80 %, та більш типово з переважно зростаючими ідентичностями, щонайменше, 80 %, 81 %, 82 %, 83 %, 84 %, 85 %, 86 %, 87 %, 88 %, 89 %, 90 %, 91 %, 92 %, 93 %, 94 %, 95 %, 96 %, 97 %, 98 %, або 99 % та майже 100 %. Таким чином, "варіант CDR" представляє собою одну з специфікованою гомологією, подібністю або ідентичністю до батьківської CDR за винаходом, та біологічна функція участі, включає, але не обмежуючись цим, щонайменше, 80 %, 81 %, 82 %, 83 %, 84 %, 85 %, 86 %, 87 %, 88 %, 89 %, 90 %, 91 %, 92 %, 93 %, 94 %, 95 %, 96 %, 97 %, 98 % або 99 % специфічність та/або активність батьківського CDR. В той час як, сайт або ділянка для введення варіації амінокислотної послідовності є наперед визначеною, мутація сама по собі не має потреби бути наперед визначеною. Наприклад, для того, щоб оптимізувати здійснення мутації на заданому сайті, довільний мутагенез може бути проведений на кодоні-мішені або ділянці-мішені, та експресовані варіанти антиген-зв'язуючого протеїну CDR скринінгували для оптимальної комбінації бажаної активності. Технології для створення мутацій заміщення на попередньо визначених сайтах в ДНК, які мають відому послідовність, є добре відомими, наприклад, M13 мутагенез праймер та PCR мутагенез. Скринінг мутантів роблять, використовуючи аналізи активності антиген-зв'язуючого протеїну, як описано в даному документі. Амінокислотні заміщення, як правило, представляють собою одиночні залишки; інсерції, як правило, будуть складати приблизно від близько одного (1) до близько двадцяти (20) амінокислотних залишків, хоча може бути допустимим значно більше інсерцій. Ряд делецій становить від приблизно одного (1) до приблизно двадцяти (20) амінокислотних залишків, хоча в деяких випадках делецій може бути набагато більше. Заміщення, делеції, інсерції або будь-які їх комбінація може бути використана, щоб досягти кінцевої похідної або варіанта. Як правило, такі зміни роблять на декількох амінокислотах, щоб мінімізувати зміну молекули, зокрема, імуногенність та специфічність антиген-зв'язуючого протеїну. Однак, більшість змін можуть бути толерантними в певних умовах. Під "Fab" або "Fab ділянкою", як використовується в даному документі, мають на увазі поліпептид, який містить VH, CH1, VL, та CL імуноглобулінові домени. Fab може мати відношення до даної ділянки при виділенні, або даної ділянки в контексті повнорозмірного антитіла, фрагменту антитіл або Fab гібридного протеїну, або будь-якого іншого варіанту здійснення антитіла, як описано в даному документі. Під "Fv", або "Fv фрагментом", або "Fv ділянкою", як використовується в даному документі, мають на увазі поліпептид, який містить VL та VH домени одного антитіла. Під "структурою", як використовується в даному документі, мають на увазі ділянку варіабельного домену антитіла, що обмежує ті ділянки, визначені, як CDR. Структура варіабельного домену кожного антитіла, крім того, може бути підрозділена на суміжні ділянки, розділені за рахунок CDR (FR1, FR2, FR3 та FR4). Термін "антиген-зв'язуюча частина" антитіла (або просто "частина антитіла"), як використовується в даному документі, стосується одного або декількох фрагментів антитіла, який зберігає здатність специфічно зв'язуватися з антигеном (наприклад, BST1). Показано, що антиген-зв'язуюча функція антитіла може бути здійснена фрагментами повнорозмірного антитіла. Приклади зв'язуючих фрагментів, який охоплює термін "антиген-зв'язуюча частина" антитіла, включає (i) Fab фрагмент, моновалентний фрагмент, який складається з VL/VK, VH, CL та CH1 доменів; (ii) F(ab') 2 фрагмент, бівалентний фрагмент, яка містить два Fab фрагмента, зв'язаних дисульфідним містком в шарнірній ділянці; (iii) Fab" фрагмент, який, по суті, представляє собою Fab з частиною шарнірної ділянки (дивись, FUNDAMENTAL IMMUNOLOGY (Paul ed., 3.sup.rd ed. 1993); (iv) Fd фрагмент, який складається з V H та CH1 доменів; (v) Fv фрагмент, який складається з VL та VH доменів одного плеча антитіла; (vi) dAb фрагмент [Ward et al. (1989) Nature 341:544-546], який складається з VH домену; (vii) виділену ділянку, яка визначає комплементарність (CDR); та (viii) нанотіло, варіабельна ділянка важкого ланцюга, яка містить один варіабельний домен та два константних домени. Більш того, незважаючи на те, що два домени Fv фрагменту, VL/VK та VH, кодуються окремими генами, вони можуть бути зв'язані, використовуючи рекомбінантні способи, за рахунок синтетичного лінкеру, який дає можливість їм бути зробленими як одиночний протеїновий ланцюг, в якому V L/VK та VH ділянки паруються з утворенням моновалентних молекул (відомий як одинарний ланцюг Fv (scFv); дивись, наприклад, Bird et al. (1988) Science 242:423-426; та Huston et al. (1988) Proc. Natl. Acad. Sci. USA 85:5879-5883. Мається на увазі, що такі антитіла з одинарним ланцюгом також є 8 UA 114478 C2 5 10 15 20 25 30 35 40 45 50 55 60 охопленими терміном "антиген-зв'язуюча частина" антитіла. Дані фрагменти антитіл одержують, використовуючи традиційні методики, відомі кваліфікованому спеціалісту в даній галузі з рівня техніки, та фрагменти піддають скринінгу для застосування за тим самим способом, як інтактні антитіла. Мається на увазі, що "виділене антитіло", як використовується в даному документі, стосується антитіла, яке, по суті, є вільним від інших антитіл, що мають різні антигенні специфічності (наприклад, виділене антитіло, яке специфічно зв'язуються з BST1, по суті, є вільним від антитіл, які специфічно зв'язують антигени інші, ніж BST1). Виділене антитіло, яке специфічно зв'язуються з BST1, однак, може мати перехресну реактивність до інших антигенів, таких як BST1 молекули з інших видів. Крім того, та/або альтернативно виділене антитіло може бути, по суті, вільним від іншого клітинного матеріалу та/або хімічних речовин, які знаходяться в формі, яка зазвичай не зустрічається в природі. В деяких варіантах втілення, антитіла за винаходом представляють собою рекомбінантні протеїни, виділені протеїни або, по суті, чисті протеїни. "Виділений" протеїн є таким, що не супроводжується, щонайменше, деякими з матеріалів, з якими він, зазвичай, асоційований в його природному стані, наприклад, які складають, щонайменше, приблизно 5 %, або, щонайменше, приблизно 50 % за масою від загального протеїну в наданому зразку. Мається на увазі, що виділений протеїн може становити від 5 до 99,9 % за масою від загального протеїну, де вміст залежить від умов. Наприклад, протеїн може бути створений в значно більш високій концентрації внаслідок застосування індукованого промотору або високо експресованого промотору, таким чином, протеїн створюють при зростаючих рівнях концентрації. У випадку рекомбінантних протеїнів, визначення включає продуковані антитіла в широкій множині організмів та/або клітин-господарів, які відомі в даній галузі з рівня техніки, в якій не продукується природним чином. Терміни "моноклональне антитіло" або "композиція моноклонального антитіла", як використовується в даному документі, відноситься до отримання молекул антитіла одиничної молекулярної композиції. Композиція моноклонального антитіла демонструє одиничну зв'язуючу специфічність та афінність для певного епітопу. Як використовується в даному документі, "поліклональне антитіло" стосується антитіла, яке продукується декількома клонами Bлімфоцитів, як повинно б бути в цілій тварині. Як використовується в даному документі, "ізотип" стосується класу антитіла (наприклад, IgM або IgGl), який кодується генами константної ділянки важкого ланцюга. Вирази "антитіло, що розпізнає антиген" та "антитіло специфічне для антигену" використовують взаємозамінно в даному документі з терміном "антитіло, яке специфічно зв'язуються з антигеном". Термін "похідні антитіла" стосується будь-якої модифікованої форми антитіла, наприклад, кон'югату (як правило, хімічне зчеплення) антитіла та іншого агента або антитіла. Наприклад, антитіла за представленим винаходом можуть бути кон'югованими з агентами, включаючи, але не обмежуючись цим, полімери (наприклад, ПЕГ), токсини, мітки, тощо, як більш повно описано нижче. Антитіла за представленим винаходом можуть бути нелюдськими, химерними, гуманізованими або повністю людськими. Для опису концепцій химерних та гуманізованих антитіл, дивись Clark et al. (2000) та посилання, що цитуються в даному документі (Clark, 2000, Immunol Today 21:397-402). Химерні антитіла містять варіабельну ділянку нелюдського антитіла, наприклад VH та VL домени мишачого або щурячого походження, реально зв'язані з константною ділянкою людського антитіла (дивись, наприклад, патент США № 4,816,567). В переважному варіанті втілення, антитіла за представленим винаходом є гуманізованими. Під "гуманізованим" антитілом, як використовується в даному документі, мається на увазі антитіло, що містить ділянку з людською структурою (FR) та одну або більше ділянок, що визначають комплементарність (CDR) з нелюдського (як правило, мишачого або щурячого) антитіла. Нелюдське антитіло, що забезпечує CDR, називають "донором", та людський імуноглобулін, що забезпечує структуру, називають "акцептором". Гуманізація ґрунтується переважно на щепленні донора CDR на акцепторні (людські) VL та VH структури (Патент США No, 5,225,539). Дана стратегія називається як "CDR щеплення". "Обернена мутація" вибраних акцепторних структурних залишків до відповідного донорного залишку часто вимагає відновлення афінності, яка є втраченою у вихідному щепленому конструкті (US 5,530,101; US 5,585,089; US 5,693,761; US 5,693,762; US 6,180,370; US 5,859,205; US 5,821,337; US 6,054,297; US 6,407,213). Гуманізоване антитіло оптимально, крім того, буде містити, щонайменше, частину імуноглобуліну константної ділянки, типово людського імуноглобуліну, та, таким чином, типово буде містити людську Fc ділянку. Способи гуманізації нелюдських антитіл добре відомі в даній галузі з рівня техніки, та по суті можуть бути виконані наступним способом Вінтера (Winter) та 9 UA 114478 C2 5 10 15 20 25 30 35 40 45 50 55 60 співробітників [Jones et al. (1986) Nature 321:522-525; Riechmann et al. (1988) Nature 332:323-329; Verhoeyen et al. (1988) Science, 239:1534-1536]. Додаткові приклади гуманізованих мишачих моноклональних антитіл також відомі в даній галузі з рівня техніки, наприклад, антитіла, які зв'язують людський протеїн C (O'Connor et al., 1998, Протеїн Eng 11:321-8), рецептор інтерлейкіну 2 [Queen et al. (1989) Proc Natl Acad Sci, USA 86:10029-33] та рецептор людського епідермального фактору росту 2 [Carter et al. (1992) Proc Natl Acad Sci USA 89:4285-9]. В альтернативному варіанті втілення, антитіла за представленим винаходом можуть бути повністю людськими, що представляє собою послідовності антитіла, які є повністю або по суті людськими. Ряд способів, відомі в даній галузі з рівня техніки для генерації повністю людських антитіл, включаючи застосування трансгенних мишей [Bruggemann et al. (1997) Curr Opin Biotechnol 8:455-458] або бібліотек людського антитіла, в поєднанні з вибраними способами [Griffiths et al. (1998) Curr Opin Biotechnol 9:102-108]. Мається на увазі, що термін "гуманізоване антитіло" включає антитіла, в яких CDR послідовності, одержані із зародкової лінії інших видів ссавців, таких як миша, щеплені з людськими структурними послідовностями. Додаткові модифікації структурної ділянки можуть бути створені з людськими структурними послідовностями, такі як амінокислотні модифікації Fc домену, як описано в даному документі. Мається на увазі, що термін "химерне антитіло" стосується антитіл, в яких послідовності варіабельної ділянки є похідними від одного виду та послідовності константної ділянки є похідними від іншого виду, таких як антитіло, в якому послідовності варіабельної ділянки є похідними від мишачого антитіла, та послідовності константної ділянки є похідними від людського антитіла. Мається на увазі, що термін "специфічно зв'язують" (або "імуноспецифічно зв'язують") показує, що антитіло зв'язуються виключно з його наміченою мішенню, незважаючи на те, що в багатьох варіантах втілення це буде правдою; тобто, антитіло "специфічно зв'язується" зі своєю мішенню та не виявляється, або по суті зв'язується з іншими компонентами в зразку, клітині або пацієнті. Однак, в деяких варіантах втілення, антитіло "специфічно зв'язують", якщо його афінність для його наміченої мішені є приблизно в 5-раз більшою, в порівнянні з його афінністю до молекули-немішені. Відповідно, існують незначні перехресні реакції або перехресне зв'язування з небажаними речовинами, головним чином, протеїнами, що зустрічаються в природі, або тканинами здорової людини або тварини. Афінність антитіла, наприклад, буде, щонайменше, приблизно в 5 разів, наприклад, в 10 разів, наприклад, в 25 разів, головним чином в 50 разів, та особливо в 100 разів або більше для молекули-мішені, ніж його афінність для молекули-немішені. В деяких варіантах втілення, специфічне зв'язування між антитілом або 6 -1 іншим зв'язуючим агентом та антигеном означає зв'язуючу афінність, щонайменше, 10 M . 7 -1 Антитіла можуть, наприклад, зв'язуватися з афінностями, щонайменше, приблизно 10 M , такої 8 -1 9 -1 9 -1 10 -1 як від приблизно 10 M до приблизно 10 M , від приблизно 10 M до приблизно 10 M , або 10 -1 11 -1 від приблизно 10 M до приблизно 10 M . Антитіла можуть, наприклад, зв'язуватися з EC50 50 нМ або менше, 10 нМ або менше, 1 нМ або менше, 100 пM або менше, або більш переважно 10 пM або менше. Термін "по суті не зв'язуються" з протеїном або клітинами, як використовується в даному документі, означає, що не зв'язуються або не зв'язуються з високою афінністю з протеїном або -6 клітинами, тобто зв'язуються з протеїном або клітинами з KD 1×10 M або більше, більш -5 -4 -3 переважно 1×10 M або більше, більш переважно 1×10 M або більше, більш переважно 1×10 -2 M або більше, ще більш переважно 1×10 M або більше. Мається на увазі, що термін "EC50", як використовується в даному документі, стосується ефективності сполуки шляхом кількісного визначення концентрації, що призводить до 50 % максимальної відповіді/ефекту. EC50 може бути визначене, використовуючи Scratchard або FACS. Мається на увазі, що термін "Kасоц." або "Ka", як використовується в даному документі, стосується швидкості асоціації певної взаємодії антитіло-антиген, тоді як мається на увазі, що термін "Kдис." або "Kd", як використовується в даному документі, стосується швидкості дисоціації певної взаємодії антитіло-антиген. Мається на увазі, що термін "KD, ” як використовується в даному документі, стосується константи афінності, яку одержують з відношення Kd к Ka (тобто Kd/Ka) та виражається як молярна концентрація (M). Значення KD антитіла можуть визначатися, використовуючи способи добре встановлені для даної ділянки. Переважним способом для визначення KD антитіла є застосування резонансу поверхневого плазмону, переважно, ® використовуючи біосенсорну систему, таку як Biacore система. Як використовується в даному документі, термін "висока афінність" для IgG антитіла -7 -8 стосується антитіла, яке має KD 1×10 M або менше, більш переважно 5×10 M або менше, ще 10 UA 114478 C2 -8 5 10 15 20 25 30 35 40 45 50 55 60 -9 більш переважно 1×10 M або менше, ще більш переважно 5×10 M або менше, та ще більш -9 переважно 1×10 M або менше, для антигена-мішені. Однак, "висока афінність" зв'язування може варіювати для інших ізотипів антитіла. Наприклад, "висока афінність" зв'язування для IgM -6 -7 ізотипу стосується антитіла, яке має KD 10 M або менше, більш переважно 10 M або менше, -8 ще більш переважно 10 M або менше. Термін "епітоп" або "антигенна детермінанта" стосується сайту на антигені, з яким імуноглобулін або антитіло специфічно зв'язуються. Епітопи можуть бути утворені як з суміжних амінокислот або несуміжних амінокислот, розташованих рядом, шляхом третинного складання протеїну. Епітопи, утворені з суміжних амінокислот, як правило, зберігаються, коли їх піддають дії денатуруючих розчинів, тоді як епітопи, утворені шляхом третинного складування, як правило, втрачаються, коли їх піддають дії денатуруючих розчинів. Епітоп, як правило, включає, щонайменше, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 або 15 амінокислот в унікальній просторовій конформації. Способи визначення просторової конформації епітопів включає методики з рівня техніки та ті, які описані в даному документі, наприклад, рентгенівська кристалографія та 2вимірний ядерно-магнітний резонанс [дивись, наприклад Epitope Mapping Protocols in Methods in Molecular Biology, Vol. 66, G. E. Morris, Ed. (1996)]. Відповідно, крім того, охопленими представленим винаходом є антитіла, які зв'язуються з (тобто розпізнають) однаковим епітопом, як антитіла, описані в даному документі (тобто BST1_A2, BST1_A1 та BST1_A3). Антитіла, які зв'язуються з однаковим епітопом, можуть бути ідентифіковані за рахунок їх здатності до перехресного конструювання з (тобто, конкурентно інгібують зв'язування) еталонним антитілом за антиген-мішень в статистично значний спосіб. Конкурентне інгібування може відбуватися, наприклад, якщо антитіла зв'язуються з ідентичними або структурно подібними епітопами (наприклад, епітопами, що перекриваються), або просторово проксимальними епітопами, які, коли зв'язуються, викликають стеричну невідповідність між антитілами. Конкурентне інгібування може бути визначене, використовуючи звичайні аналізи, в яких імуноглобулін при дослідженні інгібує специфічне зв'язування еталонного антитіла із загальним антигеном. Чисельні типи аналізів конкурентного зв'язування є відомими, наприклад: твердофазний прямий або непрямий радіоімунологічний аналіз (RIA), твердофазний прямий або непрямий ферментний імунологічний аналіз (EIA), сандвіч конкурентний аналіз [дивись, Stahl et al. (1983) Methods in Enzymology 9:242]; твердофазний прямий біотин-авідин EIA [дивись, Kirkland et al. (1986) J. Immunol. 137:3614]; твердофазний прямий мічений аналіз, твердофазний прямий мічений сандвіч аналіз [дивись, Harlow та Lane (1988) Антитіла: A Laboratory Manual, Cold Spring Harbor Press]; твердофазний прямий мічений RIA із застосуванням I-125 мітки [дивись, Morel et al. (1988) Mol. Immunol. 25(1):7)]; твердофазний прямий біотин-авідин EIA [Cheung et al. (1990) Virology 176:546]; та прямий мічений RIA. [Moldenhauer et al. (1990) Scand. J. Immunol. 32:77]. Як правило, такий аналіз включає застосування очищеного антигену, зв'язаного з твердою поверхнею або клітинами, що несуть їх, немічений імуноглобулін, що досліджується, та мічений еталонний імуноглобулін. Конкурентне інгібування вимірюють шляхом визначення кількості міченого зв'язаного з твердою поверхнею або клітинами в присутності імуноглобуліну, що досліджується. Зазвичай, імуноглобулін, що досліджується, є присутнім в надлишку. Як правило, коли конкуруюче антитіло є присутнім в надлишку, воно буде інгібувати специфічне зв'язування еталонного антитіла із загальним антигеном на, щонайменше, 50-55 %, 55-60 %, 60-65 %, 65-70 % 70-75 % або більше. Інші способи включають, наприклад, способи мапування епітопів, такі як рентгенівський аналіз кристалів комплексів антиген:антитіло, який забезпечує атомну роздільність епітопу. Інші способи контролюють зв'язування антитіла з фрагментами антигену або мутованими варіаціями антигену, де втрата зв'язування через модифікацію амінокислотного залишку з послідовністю антигену часто розглядається як індикація епітопного компоненту. Крім того, також можуть бути застосовані розрахункові комбінаторні способи для мапування епітопу. Дані способи ґрунтуються на здатності антитіла з афінністю, що викликає інтерес, виділяти специфічні короткі пептиди з комбінаторних бібліотек фагового показаного пептиду. Потім пептиди співвідносять, що призводить до визначення епітопу, що відповідає антитілу, яке застосовують для скринінгу пептидної бібліотеки. Для мапування епітопу, крім того, розробляють розрахункові алгоритми, які є показаними для мапування конформаційних дискретних епітопів. Як використовується в даному документі, термін "суб'єкт" включає будь-який людський або тваринний крім людини, організм. Термін "тваринний, крім людини, ” включає всі хребетні тварини, наприклад, ссавців та не ссавців, такі як не людиноподібні примати, вівці, собаки, коти, коні, корови, кури, земноводні, рептилії, тощо. Різні аспекти розкриття описуються надалі в деталях в наступних підрозділах. 11 UA 114478 C2 5 10 15 20 25 30 35 40 45 50 55 60 Анти-BST1антитіла Антитіла за винаходом характеризуються певними функціональними особливостями або властивостями антитіла. Наприклад, антитіла специфічно зв'язуються з людським BST1. Переважно, антитіло за винаходом зв'язується з BST1 з високою афінністю, наприклад, з K D -7 -8 8×10 M або менше, ще більш, як правило, 1×10 M або менше. Анти-BST1 антитіла за винаходом переважно демонструють одну або декілька з наступних характеристик, з антитілами, що демонструють обидва виявлення конкретного застосування: зв'язуються з людським BST1 з EC50 50 нМ або менше, 10 нМ або менше, 1 нМ або менше, 100 пМ або менше, або більш переважно 10 пМ або менше; зв'язуються з людськими клітинами, що експресують BST1. В одному варіанті втілення, антитіла переважно зв'язуються з антигенним епітопом, що є присутнім в BST1, епітоп якого не є присутнім в інших протеїнах. Переважно, антитіла не зв'язуються зі спорідненими протеїнами, наприклад, антитіла по суті не зв'язуються з іншими молекулами клітинної адгезії. В одному варіанті втілення, антитіло може бути інтерналізованим в клітину, яка експресує BST1. Стандартні аналізи для оцінки інтерналізації антитіла є відомими в даній галузі з рівня техніки, включаючи, наприклад, MabZap або HumZap аналізи інтерналізації. Стандартні аналізи для оцінки здатності зв'язування антитіла з BST1 можуть бути виконані на протеїновому або клітинному рівні, та за відомими методиками в даній галузі з рівня техніки, включаючи наприклад, ELISA, вестерн-блотинги, RIA, BIAcore® аналізи та аналіз проточної цитометрії. Прийнятні аналізи описані детально в прикладах. Кінетики зв'язування (наприклад, афінність зв'язування) антитіла також можуть бути оцінені за стандартними аналізами, ® відомими в даній галузі з рівня техніки, такими як системний аналіз Biacore . Для оцінки зв'язування з клітинами Раджи (Raji) або Дауді (Daudi) в клітинні пухлини, Раджи (ATCC Депонування № CCL-86) або Дауді (ATCC Депонування № CCL-213) клітини можуть бути одержані з джерел, що знаходяться у вільному доступі, таких як американська колекція типових культур (American Type Culture Collection), та застосовані в стандартних аналізах, таких як аналіз проточної цитометрії. Моноклональні антитіла за винаходом Переважними антитілами за винаходом є моноклональні антитіла BST1_A2 та BST1_A1, виділені та структурно охарактеризовані, як описано в прикладах 1-4. VH амінокислотні послідовності BST1_A2, BST1_A1 та BST1_A3 показані в SEQ ID NO: 2, 1 та 52, відповідно. V K амінокислотні послідовності BST1_A2, BST1_A1 та BST1_A3 показані в SEQ ID NO: 4, 3 та 53, відповідно. Задано, що кожне з даних антитіл може зв'язуватися з BST1, VH та VK послідовності можуть бути "змішаними та співставленими", щоб створити інші анти-BST1, які зв'язують молекули за винаходом. BST1 зв'язування таких "змішаних та співставлених" антитіл можуть бути досліджені, використовуючи аналізи зв'язування, описані вище та в прикладах (наприклад, ELISA). Переважно, коли VH та VK ланцюга є змішаними та співставленими, VH послідовність з конкретного VH/VK парування замінюють на структурно подібну VH послідовність. Аналогічним чином, переважно VK послідовність з конкретного VH/VK парування замінюють на структурно подібну VK послідовність. Відповідно, в одному аспекті, винахід передбачає антитіло, що містить: варіабельну ділянку важкого ланцюга, яка містить амінокислотну послідовність, представлену в SEQ ID NO: вибрану з групи, яка складається з 2, 1 та 52, та варіабельну ділянку легкого ланцюга, яка містить амінокислотну послідовність, представлену в SEQ ID NO: вибрану з групи, яка складається з 4, 3 та 53; де антитіло специфічно зв'язуються з BST1, переважно, з людським BST1. Переважні комбінації важкого та легкого ланцюга включають: варіабельну ділянку важкого ланцюга, яка містить амінокислотну послідовність SEQ ID NO: 2, та варіабельну ділянку легкого ланцюга, яка містить амінокислотну послідовність SEQ ID NO: 4; або варіабельну ділянку важкого ланцюга, яка містить амінокислотну послідовність SEQ ID NO: 1, та варіабельну ділянку легкого ланцюга, яка містить амінокислотну послідовність SEQ ID NO: 3; або варіабельну ділянку важкого ланцюга, яка містить амінокислотну послідовність SEQ ID NO: 52, та варіабельну ділянку легкого ланцюга, яка містить амінокислотну послідовність SEQ ID NO: 53. В іншому аспекті, винахід передбачає антитіла, які містять важкий ланцюг та легкий ланцюг CDR1s, CDR2s та CDR3s від BST1_A2, BST1_A1 та BST1_A3, або їх комбінації. Амінокислотні послідовності VH CDR1s від BST1_A2, BST1_A1 та BST1_A3 показані в SEQ ID NO: 10, 9 та 56, 12 UA 114478 C2 5 10 15 20 25 30 35 40 45 50 55 60 відповідно. Амінокислотні послідовності VH CDR2s від BST1_A2, BST1_A1 та BST1_A3 показані в SEQ ID NO: 12 або 51, 11 та 57, відповідно. Амінокислотні послідовності V H CDR3s від BST1_A2, BST1_A1 та BST1_A3 показані в SEQ ID NO: 14, 13 та 58, відповідно. Амінокислотні послідовності VK CDR1s від BST1_A2, BST1_A1 та BST1_A3 показані в SEQ ID NO: 16, 15 та 59, відповідно. Амінокислотні послідовності VK CDR2s від BST1_A2, BST1_A1 та BST1_A3 показані в SEQ ID NO: 18, 17 та 60, відповідно. Амінокислотні послідовності VK CDR3s від BST1_A2, BST1_A1 та BST1_A3 показані в SEQ ID NO: 20, 19 та 61, відповідно. Ділянки CDR зображують, використовуючи систему [Kabat, E. A. et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, US Department of Health and Human Services, NIH Publication No. 91-3242]. Задано, що кожне з даних антитіл може зв'язуватися з BST1, та що антиген-зв'язуюча специфічність передбачається спочатку за рахунок CDR1, CDR2, та CDR3 ділянок, V H CDR1, CDR2, та CDR3 послідовності та VK CDR1, CDR2, та CDR3 послідовності можуть бути "змішаними та співставленими" (тобто CDR від різних антитіл можуть бути змішаними та співставленими, незважаючи на те, що кожне антитіло, як правило, містить V H CDR1, CDR2, та CDR3 та VK CDR1, CDR2, та CDR3), щоб створити інші анти-BST1, які зв'язують молекули за винаходом. Відповідно, винахід, зокрема, включає кожну можливу комбінацію CDR важкого та легкого ланцюгів. BST1 зв'язування таких "змішаних та співставлених" антитіл може бути дослідженим, ® використовуючи аналізи зв'язування, описані вище та в прикладах (наприклад, ELISA, Biacore аналіз). Переважно, коли VH CDR послідовності є змішаними та співставленими, CDR1, CDR2 та/або CDR3 послідовність від певної VH послідовності заміщують на структурно подібну(і) CDR послідовність(і). Аналогічним чином, коли VK CDR послідовності є змішаними та співставленими, CDR1, CDR2 та/або CDR3 послідовність від певної V K послідовності, переважно, заміщують на структурно подібну(і) CDR послідовність(і). Для кваліфікованого спеціаліста в даній галузі буде достатньо очевидним, що нові VH та VK послідовності можуть створюватися шляхом заміщення однієї або більше VH та/або VL /VK послідовностей CDR ділянки на структурно подібні послідовності від CDR послідовностей, які розкриті в даному документі для моноклональних антитіл BST1_A2, BST1_A1 та BST1_A3. Відповідно, в іншому аспекті, винахід передбачає виділене моноклональне антитіло, або його антиген-зв'язуючу частину, який містить: варіабельну ділянку важкого ланцюга CDR1, яка містить амінокислотну послідовність, вибрану з групи, яка складається з SEQ ID NO: 10, 9 та 56; варіабельну ділянку важкого ланцюга CDR2, яка містить амінокислотну послідовність, вибрану з групи, яка складається з SEQ ID NO: 12 або 51, 11 та 57; варіабельну ділянку важкого ланцюга CDR3, яка містить амінокислотну послідовність, вибрану з групи, яка складається з SEQ ID NO: 14, 13 та 58; варіабельну ділянку легкого ланцюга CDR1, яка містить амінокислотну послідовність, вибрану з групи, яка складається з SEQ ID NO: 16, 15 та 59; варіабельну ділянку легкого ланцюга CDR2, яка містить амінокислотну послідовність, вибрану з групи, яка складається з SEQ ID NO: 18, 17 та 60; та варіабельна ділянка легкого ланцюга CDR3, яка містить амінокислотну послідовність, вибрану з групи, яка складається з SEQ ID NO: 20, 19 та 61; з всіма можливими комбінаціями, які є можливими, в яких антитіло специфічно зв'язується з BST1, переважно людським BST1. В іншому переважному варіанті втілення, антитіло має: варіабельну ділянку важкого ланцюга CDR1, яка містить SEQ ID NO: 10; варіабельну ділянку важкого ланцюга CDR2, яка містить SEQ ID NO: 12 або SEQ ID NO: 51; варіабельну ділянку важкого ланцюга CDR3, яка містить SEQ ID NO: 14; та варіабельну ділянку легкого ланцюга CDR1, яка містить SEQ ID NO: 16; варіабельну ділянку легкого ланцюга CDR2, яка містить SEQ ID NO: 18; варіабельну ділянку легкого ланцюга CDR3, яка містить SEQ ID NO: 20. В іншому переважному варіанті втілення, антитіло має: варіабельну ділянку важкого ланцюга CDR1, яка містить SEQ ID NO: 9; варіабельну ділянку важкого ланцюга CDR2, яка містить SEQ ID NO: 11; варіабельну ділянку важкого ланцюга CDR3, яка містить SEQ ID NO: 13; та варіабельну ділянку легкого ланцюга CDR1, яка містить SEQ ID NO: 15; варіабельну ділянку легкого ланцюга CDR2, яка містить SEQ ID NO: 17; варіабельну ділянку легкого ланцюга CDR3, яка містить SEQ ID NO: 19. В іншому переважному варіанті втілення, антитіло має: варіабельну ділянку важкого ланцюга CDR1, яка містить SEQ ID NO: 56; 13 UA 114478 C2 5 10 15 20 25 30 35 40 45 50 55 60 варіабельну ділянку важкого ланцюга CDR2, яка містить SEQ ID NO: 57; варіабельну ділянку важкого ланцюга CDR3, яка містить SEQ ID NO: 58; та варіабельну ділянку легкого ланцюга CDR1, яка містить SEQ ID NO: 59; варіабельну ділянку легкого ланцюга CDR2, яка містить SEQ ID NO: 60; варіабельну ділянку легкого ланцюга CDR3, яка містить SEQ ID NO: 61. в даній галузі з рівня техніки добре відомо, що CDR3 домен, незалежно від CDR1 та/або CDR2 домена(ів), сам може визначати специфічність зв'язування антитіла для подібного антигену, та що багато антитіл, як і очікувалось, може створюватися, маючи одну й ту саму специфічність зв'язування, що ґрунтується на загальній CDR3 послідовності. Дивись, наприклад, Klimka et al. (2000) British J. of Cancer 83(2):252-260 (опис одержання гуманізованого анти-CD30 антитіла, використовуючи тільки варіабельний домен важкого ланцюга CDR3 мишачого анти-CD30 антитіла Ki-4); Beiboer et al. (2000) J. Mol. Biol. 296:833-849 (опис рекомбінантного епітеліального глікопротеїну-2 (EGP-2) антитіла, використовуючи тільки послідовність важкого ланцюга CDR3 батьківського мишачого MOC-31 анти-EGP-2 антитіла); Rader et al. (1998) Proc. Natl. Acad. Sci. USA. 95:8910-8915 (опис панелі гуманізованих антиінтегрин αvβ3 антитіл, використовуючи варіабельний домен важкого та легкого ланцюга CDR3 мишачого анти-інтегрин αvβ3 антитіла LM609, де кожен член антитіла містить несхожу послідовність за межами CDR3 домену та здатну до зв'язування одного й того ж епітопу, як батьківського мишачого антитіла з афінностями, як високими або більш високими, ніж батьківське мишаче антитіло); Barbas et al. (1994) J. Am. Chem. Soc. 116:2161-2162 (розкриття, що CDR3 домен забезпечує найбільш значний вклад в зв'язуючий антиген); Barbas et al. (1995) Proc. Natl. Acad. Sci. USA. 92:2529-2533 (опис щеплення послідовностей важкого ланцюга CDR3 трьох Fabs (SI-1, SI-40, та SI-32) по відношенню до людської плацентарної ДНК важкого ланцюга анти-правцевого токсоїду Fab, таким чином, замінюючи існуючий важкий ланцюг CDR3, та демонструючи, що CDR3 домен сам давав специфічність зв'язування); та Ditzel et al. (1996) J. Immunol. 157:739-749 (опис досліджень щеплення, в яких перенесення тільки важкого ланцюга CDR3 батьківського поліспецифічного Fab LNA3 до важкого ланцюга моноспецифічного IgG правцевого токсоїд-зв'язуючого Fab p313 антитіла було достатнім для збереження специфічності зв'язування батьківського Fab). Кожне з даних посилань, таким чином, є включеним у вигляді посилання в повному об'ємі. Відповідно, представлений винахід передбачає моноклональні антитіла, що містять один або більше доменів важкого та/або легкого ланцюга CDR3 від антитіла, отриманого від людини або тварини, крім людини, де моноклональне антитіло є здатним специфічно зв'язуватися з BST1. В певних аспектах, представлений винахід передбачає моноклональні антитіла, що містять один або більше доменів важкого та/або легкого ланцюга CDR3 від нелюдського антитіла, такого як мишаче або щуряче антитіло, де моноклональне антитіло є здатним до специфічного зв'язування з BST1. В деяких варіантах втілення, такі вибіркові антитіла, що містять один або більше доменів важкого та/або легкого ланцюга CDR3 від нелюдського антитіла, (a) є здатними до конкурування за зв'язування з; (b) зберігають функціональні характеристики; (c) зв'язуються з одним й тим самим епітопом; та/або (d) мають подібну афінність зв'язування як і відповідне батьківське нелюдське антитіло. В інших аспектах, представлений винахід передбачає моноклональні антитіла, що містять один або більше домени важкого та/або легкого ланцюга CDR3 від людського антитіла, такого як, наприклад, людське антитіло, одержане від тварини, крім людини, де людське антитіло є здатним до специфічного зв'язування з BST1. В інших аспектах, представлений винахід передбачає моноклональні антитіла, що містять один або більше домен важкого та/або легкого ланцюга CDR3 від першого людського антитіла, такого як, наприклад, людське антитіло, одержане від тварини, крім людини, де перше людське антитіло є здатним до специфічного зв'язування з BST1, та де CDR3 домен від першого людського антитіла заміщує CDR3 домен в людському антитілі, у якого відсутня специфічність зв'язування з BST1, щоб згенерувати друге людське антитіло, яке є здатним до специфічного зв'язування з BST1. В деяких варіантах втілення, такі винайдені антитіла, які містять один або більше домен важкого та/або легкого ланцюга CDR3 від першої людського антитіла, (a) є здатними до конкуруючого зв'язування; (b) зберігають функціональні характеристики; (c) зв'язуються з одним й тим самим епітопом; та/або (d) мають подібну афінність зв'язування як у відповідного батьківського першого людського антитіла. Антитіла, що мають певні послідовності зародкової лінії В певних варіантах втілення, антитіло за винаходом містить варіабельну ділянку важкого ланцюга від гена певної зародкової лінії важкого ланцюга імуноглобуліну та/або варіабельну ділянку легкого ланцюга від гена певної зародкової лінії легкого ланцюга імуноглобуліну. 14 UA 114478 C2 5 10 15 20 25 30 35 40 45 50 55 60 Наприклад, в переважному варіанті втілення, винахід передбачає виділене моноклональне антитіло або його антиген-зв'язуючу частину, що містить варіабельну ділянку важкого ланцюга, яка є продуктом або похідною від мишачого VH 1-39 гена, мишачого VH 1-80 гена або мишачого VH 69-1 гена, де антитіло специфічно зв'язується з BST1. В ще іншому переважному варіанті втілення, винахід передбачає виділене моноклональне антитіло або його антиген-зв'язуючу частину, що містять варіабельну ділянку легкого ланцюга, яка є продуктом або похідною від мишачого VK 4-55 гена, мишачого VK 4-74 гена або мишачого VK 44-1 гена, де антитіло специфічно зв'язується з BST1. В ще іншому переважному варіанті втілення, винахід передбачає виділене моноклональне антитіло або його антиген-зв'язуючу частину, де антитіло: містить варіабельну ділянку важкого ланцюга, яка є продуктом або похідною від мишачого VH 1-39 гена (ген якого включає нуклеотидну послідовність, представлену в SEQ ID NO: 35 та 36); містить варіабельну ділянку легкого ланцюга, яка є продуктом або похідною від мишачого V K 4-55 гена (ген якого включає нуклеотидні послідовності, представлені в SEQ ID NO: 40, 41 та 42); та специфічно зв'язується з BST1, переважно, з людським BST1. Приклади антитіл, які мають гени VH 1-39 та VK 4-55, з послідовностями, описаними вище, представляють собою BST1_A2. В ще іншому переважному варіанті втілення, винахід передбачає виділене моноклональне антитіло або його антиген-зв'язуючу частину, де антитіло: містить варіабельну ділянку важкого ланцюга, яка є продуктом або похідною від мишачого VH 1-80 гена (ген якого включає нуклеотидну послідовність, представлену в SEQ ID NO: 33 та 34); містить варіабельну ділянку легкого ланцюга, яка є продуктом або похідною від мишачого V K 4-74 гена (ген якого включає нуклеотидні послідовності, представлені в SEQ ID NO: 37, 38 та 39); та специфічно зв'язується з BST1, переважно, людським BST1. Прикладом антитіла, яке включає VH 1-80 та VK 4-74 гени, з послідовностями, описаними вище, є BST1_A1. В ще іншому переважному варіанті втілення, винахід передбачає виділене моноклональне антитіло або його антиген-зв'язуючу частину, де антитіло: містить варіабельну ділянку важкого ланцюга, яка є продуктом або похідною від мишачого VH 69-1 гена (ген якого включає нуклеотидну послідовність, представлену в SEQ ID NO: 68 та 69); містить варіабельну ділянку легкого ланцюга, яка є продуктом або похідною від мишачого V K 44-1 гена (ген якого включає нуклеотидні послідовності, представлені в SEQ ID NO: 70, 71 та 72); та специфічно зв'язується з BST1, переважно, людським BST1. Прикладом антитіла, яке має VH та VK гени, з послідовностями, описаними вище, є BST1_A3. Як використовується в даному документі, антитіло містить варіабельну ділянку важкого або легкого ланцюгів, які є "продуктом" або "похідною" послідовності певної зародкової лінії, якщо варіабельні ділянки антитіла одержують з системи, яка застосовує мишачі гени зародкової лінії імуноглобуліну. Такі системи включають скринінг бібліотеки мишачих генів імуноглобуліну, що демонструється на фазі з антигеном, що викликає зацікавленість. Антитіло, яке є "продуктом" або "похідною" послідовності імуноглобуліну мишачої зародкової лінії, може бути ідентифіковане як таке шляхом порівняння нуклеотидної або амінокислотної послідовності антитіло з нуклеотидними або амінокислотними послідовностями імуноглобулінів мишачої зародкової лінії, та вибираючи послідовність імуноглобуліну мишачої зародкової лінії, яка є найбільш близькою в послідовності (тобто має найбільший % ідентичності) до послідовності антитіла. Антитіло, яке є "продуктом" або "похідною" певної послідовності імуноглобуліну мишачої зародкової лінії, може містити амінокислотні відмінності в порівнянні з послідовністю зародкової лінії, через, наприклад, соматичні мутації, що зустрічаються в природі, або навмисного введення сайт-спрямованої мутації. Однак, вибране антитіло, як правило, є, щонайменше, на 90 % ідентичним щодо амінокислот в послідовності до амінокислотної послідовності, що кодується геном імуноглобуліну мишачої зародкової лінії, та містить амінокислотні залишки, які ідентифікують антитіло, як мишаче, в порівнянні з амінокислотними послідовностями імуноглобуліну зародкової лінії інших видів (наприклад, послідовностями людської зародкової лінії). В певних випадках, антитіло може бути, щонайменше, на 95 %, або навіть, щонайменше, на 96 %, 97 %, 98 % або 99 % ідентичним за амінокислотною послідовністю до амінокислотної послідовності, що кодується геном імуноглобуліну зародкової 15 UA 114478 C2 5 10 15 20 25 30 35 40 45 50 55 60 лінії. Як правило, антитіло, одержане від певної послідовності мишачої зародкової лінії, буде демонструвати відмінності не більше, ніж в 10 амінокислотах від амінокислотної послідовності, що кодується геном імуноглобуліну мишачої зародкової лінії. В певних випадках, антитіло може демонструвати відмінності не більше, ніж в 5, або навіть не більше, ніж в 4, 3, 2 або 1 амінокислоті від амінокислотної послідовності, що кодується геном імуноглобуліну зародкової лінії. Гомологічні антитіла В ще іншому варіанті втілення, антитіло за винаходом містить варіабельну ділянку важкого та легкого ланцюгів, яка містить амінокислотні послідовності, які є гомологічними до амінокислотних послідовностей переважних антитіл, описаних в даному документі, та де антитіла зберігають потрібні функціональні властивості анти-BST1 антитіл за винаходом. Наприклад, винахід передбачає виділене моноклональне антитіло або його антигензв'язуючу частину, яка містить варіабельну ділянку важкого ланцюга та варіабельну ділянку легкого ланцюга, де: варіабельна ділянка важкого ланцюга містить амінокислотну послідовність, яка є, щонайменше, на 80 % ідентичною до амінокислотної послідовності, яка вибрана з групи, що складається з SEQ ID NO: 2, 1 та 52; варіабельна ділянка легкого ланцюга містить амінокислотну послідовність, яка є, щонайменше, на 80 % ідентичною до амінокислотної послідовності, яка вибрана з групи, що складається з SEQ ID NO: 4, 3 та 53; та антитіло зв'язується з людським BST1. Такі антитіла можуть зв'язуватися з людським BST1 зEC 50 50 нМ або менше, 10 нМ або менше, 1 нМ або менше, 100 пМ або менше, або більш переважно 10 пМ або менше. Антитіло, крім того, може зв'язуватися з CHO клітинами, трансфікованими з людським BST1. В різних варіантах втілення, антитіло може бути, наприклад, людським антитілом, гуманізованим антитілом або химерним антитілом. В інших варіантах втілення, VH та/або VK амінокислотні послідовності можуть бути на 85 %, 90 %, 95 %, 96 %, 97 %, 98 % або 99 % гомологічними до послідовностей, представленим вище. Антитіло, яке має VH та VK ділянки, що мають високу (тобто 80 % або більшу) ідентичність до VH та VK ділянок послідовностей, що представлені вище, може бути одержане шляхом мутагенезу (наприклад, сайт-спрямований або PCR-опосередкований мутагенез) молекул нуклеїнової кислоти, що кодують SEQ ID NO: 6, 5, 8, 7, 54 та 55 з наступним дослідженням кодованого зміненого антитіла за збереженою функцією, використовуючи функціональні аналізи, описані в даному документі. Відсоткова ідентичність між двома послідовностями є функцією ряду ідентичних положень, розділених послідовностями (тобто % гомології = # ідентичні положення /загальна # положень×100), беручи в розрахунок кількість пропусків, та довжину кожного пропуску, яка потрібна для введення для оптимального вирівнювання двох послідовностей. Порівняння послідовностей та визначення відсоткової ідентичності між двома послідовностями можуть виконувати, використовуючи математичний алгоритм, як описано в необмежуючих прикладах нижче. Відсоткова ідентичність між двома амінокислотними послідовностями може бути визначена, використовуючи алгоритм Мейера та Міллера (E. Meyers та W. Miller) [Comput. Appl. Biosci. (1988) 4:11-17], який був включеним в ALIGN програму (версія 2.0), використовуючи PAM120 таблицю масових залишків, штраф за довжину пропуску 12 та штраф за пропуск 4. Крім того, відсоткова ідентичність між двома амінокислотними послідовностями може бути визначена, використовуючи алгоритм Нідлемана та Вунша (Needleman та Wunsch) [J. Mol. Biol. (1970) 48:444-453], який був включеним в GAP програму в GCG пакеті програмного забезпечення (доступний на http://www.gcg.com), використовуючи або Blossum 62 матрицю, або PAM250 матрицю, та масу пропуску 16, 14, 12, 10, 8, 6, або 4 та масу довжини 1, 2, 3, 4, 5 або 6. Додатково або альтернативно, протеїнові послідовності за представленим винаходом можуть, крім того, застосовувати як "послідовність запиту", щоб виконувати пошук за загальнодоступними базами даних, наприклад, ідентифікувати споріднені послідовності. Такі пошуки можуть бути виконані, використовуючи XBLAST програму (версія 2.0) Altschul, et al. (1990) J. Mol. Biol. 215:403-10. Пошуки BLAST протеїну можуть бути виконані, використовуючи XBLAST програму, множина = 50, довжина слова = 3, щоб одержати амінокислотні послідовності гомологічні до молекул антитіла за винаходом. Для одержання вирівнювань, що містять пропуски, з метою порівняння, може бути застосований Gapped BLAST, як описано в Altschul et al., (1997) Nucleic Acids Res. 25(17):3389-3402. При застосуванні BLAST та Gapped BLAST програм, значення параметру за замовчуванням відповідних програм (наприклад, XBLAST та NBLAST) можуть бути застосовані. Дивись, www.ncbi.nlm.nih.gov. Антитіла з консервативними модифікаціями 16 UA 114478 C2 5 10 15 20 25 30 35 40 45 50 55 60 В певних варіантах втілення, антитіло за винаходом містить варіабельну ділянку важкого ланцюга, яка містить CDR1, CDR2 та CDR3 послідовності, та варіабельну ділянку легкого ланцюга, яка містить CDR1, CDR2 та CDR3 послідовності, де одна або більше з даних CDR послідовностей містять специфічні амінокислотні послідовності, що ґрунтуються на переважних антитілах, описаних в даному документі (наприклад, BST1_A2, BST1_A1 та BST1_A3), або їх консервативні модифікації, та де антитіла зберігають потрібні функціональні властивості антиBST1 антитіл за винаходом. Відповідно, винахід передбачає виділене моноклональне антитіло, або його антиген-зв'язуючу частину, що містить варіабельну ділянку важкого ланцюга, яка містить CDR1, CDR2, та CDR3 послідовності, та варіабельну ділянку легкого ланцюга, яка містить CDR1, CDR2, та CDR3 послідовності, де: послідовність CDR3 варіабельної ділянки важкого ланцюга містить амінокислотну послідовність, вибрану з групи, яка складається з амінокислотних послідовностей SEQ ID NO: 14, 13 та 58, та їх консервативних модифікацій; послідовність CDR3 варіабельної ділянки легкого ланцюга містить амінокислотну послідовність, вибрану з групи, яка складається з амінокислотної послідовності SEQ ID NO: 20, 19 та 61, та їх консервативних модифікацій; та антитіло зв'язується з людським BST1 з EC 50 50 нМ або менше, 10 нМ або менше, 1 нМ або менше, 100 пМ або менше, або більш переважно, 10 пМ або менше. Крім того, антитіло може зв'язуватися з CHO клітинами трансфікованими з людським BST1. В переважному варіанті втілення, послідовність CDR2 варіабельної ділянки важкого ланцюга містить амінокислотну послідовність, вибрану з групи, яка складається з амінокислотних послідовностей SEQ ID NO: 12 або 51, 11 та 57, та їх консервативних модифікацій; та послідовність CDR2 варіабельної ділянки легкого ланцюга містить амінокислотну послідовність, вибрану з групи, яка складається з амінокислотних послідовностей SEQ ID NO: 18, 17 та 60, та їх консервативних модифікацій. В іншому переважному варіанті втілення, послідовність CDR1 варіабельної ділянки важкого ланцюга містить амінокислотну послідовність, вибрану з групи, яка складається з амінокислотних послідовностей SEQ ID NO: 10, 9 та 56, та їх консервативних модифікацій; та послідовність CDR1 варіабельної ділянки легкого ланцюга містить амінокислотну послідовність, вибрану з групи, яка складається з амінокислотних послідовностей SEQ ID NO: 16, 15 та 59, та їх консервативних модифікацій. В іншому переважному варіанті втілення, послідовність CDR3 варіабельної ділянки важкого ланцюга містить амінокислотну послідовність, вибрану з групи, яка складається з амінокислотних послідовностей SEQ ID NO: 14, 13 та 58, та їх консервативних модифікацій; та послідовність CDR3 варіабельної ділянки легкого ланцюга містить амінокислотну послідовність, вибрану з групи, яка складається з амінокислотних послідовностей SEQ ID NO: 20, 19 та 61, та їх консервативних модифікацій. В переважному варіанті втілення, послідовність CDR2 варіабельної ділянки важкого ланцюга містить амінокислотну послідовність, вибрану з групи, яка складається з амінокислотних послідовностей SEQ ID NO: 12 або 51, 11 та 57, та їх консервативних модифікацій; та послідовність CDR2 варіабельної ділянки легкого ланцюга містить амінокислотну послідовність, вибрану з групи, яка складається з амінокислотних послідовностей SEQ ID NO: 18, 17 та 60, та їх консервативних модифікацій. В іншому переважному варіанті втілення, послідовність CDR1 варіабельної ділянки важкого ланцюга містить амінокислотну послідовність, вибрану з групи, яка складається з амінокислотних послідовностей SEQ ID NO: 10, 9 та 56, та їх консервативних модифікацій; та послідовність CDR1 варіабельної ділянки легкого ланцюга містить амінокислотну послідовність, вибрану з групи, яка складається з амінокислотних послідовностей SEQ ID NO: 16, 15 та 59, та їх консервативних модифікацій. В різних варіантах втілення, антитіло може бути, наприклад, людським антитілом, гуманізованим антитілом або химерним антитілом. Як використовується в даному документі, мається на увазі, що термін "консервативні модифікації послідовності" стосується амінокислотних модифікацій, які не чинять значну дію або впливають на характеристики зв'язування антитіла, яке містить амінокислотну послідовність. Такі консервативні модифікації включають амінокислотні заміщення, додавання та делеції. Модифікації можуть вводити в антитіло за винаходом із застосуванням стандартних методик, відомих в даній галузі з рівня техніки, таких як сайт-спрямований мутагенез та PCRопосередкований мутагенез. Консервативні амінокислотні заміщення є заміщеннями, в яких амінокислотний залишок заміщується на амінокислотний залишок, що має подібний бічний ланцюг. Родини амінокислотних залишків, що мають подібні бічні ланцюги, визначені в рівні техніки. Дані родини включають амінокислоти з основними бічними ланцюгами (наприклад, лізин, аргінін, гістидин), кислотними бічними ланцюгами (наприклад, аспарагінова кислота, глутамінова кислота), незарядженими полярними бічними ланцюгами (наприклад, гліцин, аспарагін, глутамін, серин, треонін, тирозин, цистеїн, триптофан), неполярними бічними 17 UA 114478 C2 5 10 15 20 25 30 35 40 45 50 55 60 ланцюгами (наприклад, аланін, валін, лейцин, ізолейцин, пролін, фенілаланін, метіонін), бетарозгалуженими бічними ланцюгами (наприклад, треонін, валін, ізолейцин) та ароматичними бічними ланцюгами (наприклад, тирозин, фенілаланін, триптофан, гістидин). Таким чином, один або більше амінокислотних залишків в CDR ділянках антитіла за винаходом може бути заміщеним на інші амінокислотні залишки з тієї же родини бічного ланцюга, та альтернативне антитіло можуть досліджувати на збережену функцію, використовуючи функціональні аналізи, описані в даному документі. Послідовності важкого ланцюга CDR1 SEQ ID NO: 10, 9 та 56 можуть містити одну або більше консервативних модифікацій послідовності, таких як одне, два, три, чотири, п'ять або більше амінокислотних заміщень, додавань або делецій; послідовності легкого ланцюга CDR1 SEQ ID NO: 16, 15 та 59 можуть містити одну або більше консервативних модифікацій послідовності, таких як одне, два, три, чотири, п'ять або більше амінокислотних заміщень, додавань або делецій; послідовності важкого ланцюга CDR2, показані в SEQ ID NO: 12 або 51, 11 та 57, можуть містити одну або більше консервативних модифікацій послідовності, таких як одне, два, три, чотири, п'ять або більше амінокислотних заміщень, додавань або делецій; послідовності легкого ланцюга CDR2, показані в SEQ ID NO: 18, 17 та 60, можуть містити одну або більше консервативних модифікацій послідовності, таких як одне, два, три, чотири, п'ять або більше амінокислотних заміщень, додавань або делецій; послідовності важкого ланцюга CDR3, показані в SEQ ID NO: 14, 13 та 58, можуть містити одну або більше консервативних модифікацій послідовності, таких як одне, два, три, чотири, п'ять або більше амінокислотних заміщень, додавань або делецій; та/або послідовності легкого ланцюга CDR3, показані в SEQ ID NO: 20, 19 та 61, можуть містити одну або більше консервативних модифікацій послідовності, таких як одне, два, три, чотири, п'ять або більше амінокислотних заміщень, додавань або делецій. Антитіла, які зв'язуються з одним й тим самим епітопом, як анти-BST1 антитіла за винаходом В іншому варіанті втілення, винахід передбачає антитіла, які зв'язуються з одним й тим самим епітопом на людському BST1, як будь-яким з BST1 моноклональних антитіл за винаходом (тобто антитіла, які мають здатність перехресно конкурувати за зв'язування з BST1 з будь-яких моноклональних антитіл за винаходом). В переважних варіантах втілення, еталонне антитіло для досліджень перехресного конкурування може бути моноклональним антитілом BST1_A2 (що має VH та VK послідовності, як показано в SEQ ID NO: 2 та 4, відповідно), моноклональним антитілом BST1_A1 (що має VH та VK послідовності, як показано в SEQ ID NO: 1 та 3, відповідно), моноклональним антитілом BST1_A3 (що має V H та VK послідовності, як показано в SEQ ID NO: 52 та 53, відповідно). Такі перехресно-конкуруючі антитіла можуть бути ідентифікованими ґрунтуючись на їх здатності до перехресного конструювання з BST1_A2, BST1_A1 та BST1_A3 в стандартних BST1 аналізах зв'язування. Наприклад, BIAcore аналіз, ELISA аналізи або проточна цитометрія можуть бути застосовані для демонстрації перехресного конкурування з антитілами за представленим винаходом. Здатність антитіла, що досліджують, інгібувати зв'язування, наприклад, BST1_A2, BST1_A1 та BST1_A3, з людським BST1 демонструє, що антитіло, що досліджують, може конкурувати з BST1_A2, BST1_A1 або BST1_A3 за зв'язування з людським BST1 й, таким чином, зв'язуватися з одним й тим самим епітопом на людському BST1_A2, BST1_A1 або BST1_A3. Сконструйовані та модифіковані антитіла Антитіло за винаходом можуть одержувати, використовуючи антитіло, що має одну або більше з VH та/або VL послідовностей, розкритих в даному документі, яке може бути застосоване, як вихідний матеріал, щоб сконструювати модифіковане антитіло, де модифіковане антитіло може мати змінені властивості в порівнянні з вихідним антитілом. Антитіло може бути сконструйоване шляхом модифікації однієї або більше амінокислот в межах однієї або обох варіабельних ділянок (тобто VH та/або VL), наприклад, в межах однієї або більше CDR ділянок та/або в межах однієї або більше структурних ділянок. Додатково або альтернативно, антитіло може бути сконструйоване шляхом модифікації залишків в межах константної(их) ділянки(ок), наприклад, щоб змінити ефектрону(і) функцію(ї) антитіла. В певних варіантах втілення, щеплення CDR може бути застосоване для того, щоб сконструювати варіабельні ділянки антитіла. Антитіла взаємодіють з антигенами-мішенями переважно за рахунок амінокислотних залишків, які є розташованими в шести ділянках, що визначають комплементарність (CDR) важкого та легкого ланцюга. По цій причині, амінокислотні послідовності з CDR більше розрізняються між індивідуальними антитілами, ніж послідовності за межами CDR. Так як CDR послідовності є відповідальними за найбільші 18 UA 114478 C2 5 10 15 20 25 30 35 40 45 50 55 60 взаємодії антитіло-антиген, то існує можливість експресувати рекомбінантні антитіла, які імітують властивості специфічних антитіл, що зустрічаються в природі, шляхом конструювання експресуючих векторів, які включають CDR послідовності від специфічного антитіла, що зустрічається в природі, прищепленого на структурних послідовностях від відмінного антитіла з різними властивостями (дивись, наприклад, Riechmann, L. et al. (1998) Nature 332:323-327; Jones, P. et al. (1986) Nature 321:522-525; Queen, C. et al. (1989) Proc. Natl. Acad. Дивись. USA. 86:10029-10033; Патент США № 5,225,539 Winter, та Патент США № 5,530,101; 5,585,089; 5,693,762 та 6,180,370 Queen et al.). Відповідно, інший варіант втілення за винаходом стосується виділеного моноклонального антитіла або його антиген-зв'язуючої частини, що містить варіабельну ділянку важкого ланцюга, яка містить CDR1, CDR2, та CDR3 послідовності, що містять амінокислотну послідовність, вибрану з групи, яка складається з SEQ ID NO 10, 9 та 56; 12 або 51, 11 та 57; та 14, 13 та 58, відповідно, та варіабельну ділянку легкого ланцюга, яка містить CDR1, CDR2, та CDR3 послідовності, що містять амінокислотну послідовність, вибрану з групи, яка складається з SEQ ID NO: 16, 15 та 59; 18, 17 та 60; та 20, 19 та 61, відповідно. Таким чином, такі антитіла містять VH та VK CDR послідовності моноклональних антитіл BST1_A2, BST1_A1 та BST1_A3, ще можуть містити різні структурні послідовності з даних антитіл. Такі структурні послідовності можуть бути одержані із загальнодоступних ДНК баз даних або опублікованих посилань, які включають генні послідовності антитіла зародкової лінії. Наприклад, ДНК послідовності зародкової лінії для мишачих генів варіабельної ділянки важкого та легкого ланцюга можуть бути знайдені в IMGT (міжнародний ImMunoGeneTics) базі даних послідовностей мишачої зародкової лінії (доступної за гіперпосиланням протоколу передачі //www.imgt.cines.fr/?), а також в Kabat, E. A., et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, US Department of Health and Human Services, NIH Publication No. 91-3242; зміст кожного з яких повністю включено в даний документ у вигляді посилання. Як інший приклад, ДНК послідовності зародкової лінії для мишачих генів варіабельної ділянки важкого та легкого ланцюга можуть бути знайдені в Genbank базі даних. Протеїнові послідовності антитіла порівнюють з протеїновими послідовностями компільованих баз даних, використовуючи один зі способів пошуку за подібністю послідовності, що називається Gapped BLAST [Altschul et al. (1997) Nucleic Acids Research 25:3389-3402], який є добре відомим кваліфікованому спеціалісту в даній галузі з рівня техніки. BLAST представляє собою евристичний алгоритм, в якому статистично значне вирівнювання між послідовністю антитіла та послідовністю бази даних є можливим, щоб містити високо-ранжовані сегментні пари (HSP) слів, що вирівнюють. Сегментні пари, чиї оцінки не можуть бути покращені шляхом розширення або урізання, називаються хітом. Коротко кажучи, нуклеотидні послідовності, наведені в базі даних, та ділянка між, та включаючи, FR1 через FR3 структурну ділянку зберігаються. Послідовності бази даних мають середню довжину 98 залишків. Послідовності, що повторюються, які представляють собою точні співпадіння по всій довжині протеїну, видаляються. Пошук BLAST для протеїнів, використовуючи програму blastp за замовчуванням, стандартні параметри, крім фільтру низьких багатокомпонентностей, який є виключеним, та матричне заміщення BLOSUM62, фільтри для топ 5 хітів, що дають сумісності послідовності. Нуклеотидні послідовності транслюють в усі шість скелетів, та скелет без стоп-кодонів у відповідному сегменті послідовності бази даних вважається потенційним хітом. Це, в свою чергу, підтверджено за допомогою програми BLAST tblastx, яка транслює послідовність антитіла в усіх шести скелетах та порівнює дані трансляції з нуклеотидними послідовностями в базі даних, що динамічно транслюються в усіх шести скелетах. Ідентичності є точними співпадіннями амінокислоти між послідовністю антитіла та протеїну бази даних по всій довжині послідовності. Позитивні (співпадіння ідентичностей + заміщення) не є ідентичними, а амінокислотні заміщення регулюються матрицею заміщення BLOSUM62. Якщо два співпадіння послідовностей антитіла з послідовності бази даних з тією самою ідентичністю, то слід вважати, що хіт з більшістю позитивних є співпадаючим хітом послідовності. Переважні структурні послідовності для застосування в антитілах за винаходом є структурно подібними до структурних послідовностей, що застосовують вибрані антитіла за винаходом, наприклад, подібні до VH 1-80 структурної послідовності, VH 1-39 структурної послідовності, VK 474 структурної послідовності та/або VK 4-55 структурної послідовності, які використовуються переважними моноклональними антитілами за винаходом. VH CDR1, CDR2, та CDR3 послідовності, та VK CDR1, CDR2, та CDR3 послідовності, можуть бути прищеплені в структурні ділянки, які мають ідентичну послідовність, як та, що знайдена в гені імуноглобуліну зародкової лінії, від якого походить структурна послідовність, або CDR послідовності можуть бути прищеплені в структурні ділянки, які містять одну або більше мутацій в порівнянні з 19 UA 114478 C2 5 10 15 20 25 30 35 40 45 50 55 60 послідовностями зародкової лінії. Наприклад, виявлено, що в деяких випадках є вигідним мутування залишків в межах структурних ділянок для збереження або підвищення антигензв'язуючої здатності антитіла (дивись, наприклад, патент США № 5,530,101; 5,585,089; 5,693,762 та 6,180,370 Queen et al.). Іншим типом модифікації варіабельної ділянки є мутування амінокислотних залишків в межах VH та/або VK CDR1, CDR2 та/або CDR3 ділянок, щоб, таким чином, модифікувати одне або більше властивостей зв'язування (наприклад, афінність) антитіла, яке викликає зацікавленість. Сайт-спрямований мутагенез або PCR-опосередкований мутагенез може бути виконаний, щоб ввести мутацію(ї), та ефективність зв'язування антитіла, або інші функціональні властивості, які викликають зацікавленість, може бути оцінена в аналізах in vitro або in vivo, як описано в даному документі та представлено в прикладах. В деяких варіантах втілення, вводять консервативні модифікації (як обговорювалося вище). Альтернативно, можуть бути виконані не консервативні модифікації. Мутаціями можуть бути амінокислотні заміщення, додавання або делеції, але переважними є заміщення. Більш того, як правило, не більше, ніж один, два, три, чотири або п'ять залишків в межах CDR ділянки є зміненими, незважаючи на те, що, як буде зрозуміло кваліфікованому спеціалісту в даній галузі, варіантів в інших ділянках (структурних ділянках, наприклад) може бути більше. Відповідно, в іншому варіанті втілення, представлене розкриття передбачає виділені антиBST1 моноклональні антитіла або їх антиген-зв'язуючі частини, що містять варіабельну ділянку важкого ланцюга, яка містить: (a) VH CDR1 ділянку, яка містить амінокислотну послідовність, вибрану з групи, яка складається з SEQ ID NO: 10, 9 та 56 або амінокислотної послідовності, що має одне, два, три, чотири або п'ять амінокислотних заміщень, делецій або додавань, в порівнянні з SEQ ID NO: 10, 9 та 56; (b) VH CDR2 ділянку, яка містить амінокислотну послідовність, вибрану з групи, яка складається з SEQ ID NO: 12 або 51, 11 та 57, або амінокислотної послідовності, що має одне, два, три, чотири або п'ять амінокислотних заміщень, делецій або додавань, в порівнянні з SEQ ID NO: 12 або 51, 11 та 57; (c) V H CDR3 ділянку, яка містить амінокислотну послідовність, вибрану з групи, яка складається з SEQ ID NO: 14, 13 та 58, або амінокислотної послідовності, що має одне, два, три, чотири або п'ять амінокислотних заміщень, делецій або додавань, в порівнянні з SEQ ID NO: 14, 13 та 58; (d) V K CDR1 ділянку, яка містить амінокислотну послідовність, вибрану з групи, яка складається з SEQ ID NO: 16, 15 та 59, або амінокислотної послідовності, що має одне, два, три, чотири або п'ять амінокислотних заміщень, делецій або додавань, в порівнянні з SEQ ID NO: 16, 15 та 59; (e) V K CDR2 ділянку, яка містить амінокислотну послідовність, вибрану з групи, яка складається з SEQ ID NO: 18, 17 та 60, або амінокислотної послідовності, що має одне, два, три, чотири або п'ять амінокислотних заміщень, делецій або додавань, в порівнянні з SEQ ID NO: 18, 17 та 60; та (f) VK CDR3 ділянку, яка містить амінокислотну послідовність, вибрану з групи, яка складається з SEQ ID NO: 20, 19 та 61, або амінокислотної послідовності, що має одне, два, три, чотири або п'ять амінокислотних заміщень, делецій або додавань, в порівнянні з SEQ ID NO: 20, 19 та 61. Сконструйовані антитіла розкриття включають ті, в яких модифікації зроблені в структурних залишках в межах VH та/або VK, наприклад, щоб покращити властивості антитіла. Як правило, такі структурні модифікації роблять, щоб знизити імуногенність антитіла. Наприклад, одним підходом є "мутування до початкового вигляду" одного або більше структурних залишків до відповідної послідовності зародкової лінії. Більш конкретно, антитіло, яке піддавали соматичній мутації, може містити структурні залишки, які відрізняються від послідовності зародкової лінії, з якої походить антитіло. Такі залишки можуть бути ідентифіковані шляхом порівняння структурних послідовностей антитіла з послідовностями зародкової лінії, з якої походить антитіло. Інший тип структурної модифікації включає мутацію одного або більше залишків в межах структурної ділянки, або навіть в межах однієї або більше CDR ділянок, щоб видалити T клітинні епітопи, таким чином, знизити потенційну імуногенність антитіла. Даний підхід також називається як "деімунізація", та є описаним, крім того, в деталях в публікації патенту США № 2003/0153043. На додаток або альтернативно до модифікацій, зробленим в межах структурних або CDR ділянок, антитіла за винаходом можуть бути сконструйовані так, щоб включати модифікації в межах Fc ділянки, як правило, щоб змінити одну або декілька функціональних властивостей антитіла, таких як сироватковий період напів-виведення, фіксація комплементі, зв'язування Fc рецептора, та/або антиген-залежна клітинна цитотоксичність. Більш того, антитіло за винаходом може бути хімічно модифікованим (наприклад, один або декілька хімічних фрагментів можуть бути приєднаними до антитіла) може бути модифікованим, щоб змінити своє глікозування, знову, щоб змінити одну або більше функціональних властивостей антитіла. Кожен з даних 20 UA 114478 C2 5 10 15 20 25 30 35 40 45 50 55 60 варіантів втілення є описаним дальше детально нижче. Нумерація залишків на Fc ділянці є такою ж, як EU індекс Кабата. В одному варіанті втілення, шарнірну ділянку CH1 модифікують таким чином, що кількість цистеїнових залишків в шарнірній ділянці змінюється, наприклад, підвищується або знижується. Даний підхід, крім того, є описаним в патенті США № 5,677,425. Кількість цистеїнових залишків в шарнірній ділянці CH1 змінюється, наприклад, щоб сприяти утворенню легких та важких ланцюгів, або, щоб підвищити або знизити стабільність антитіла. В іншому варіанті втілення, Fc шарнірна ділянка антитіла мутує, щоб знизити біологічний період напів-виведення антитіла. Більш конкретно, одну або більше амінокислотних мутацій вводять в граничну ділянку CH2-CH3 домену Fc-шарнірного фрагменту таким чином, щоб антитіло пошкоджувало зв'язування стафілококового протеїну A (SpA) по відношенню до зв'язування нативного Fc-шарнірного домену SpA. Даний підхід, крім того, детально є описаним в патенті США № 6,165,745. В іншому варіанті втілення, антитіло модифікують, щоб підвищити його біологічний період напів-виведення. Різні підходи є можливими. Наприклад, введеними можуть бути одна або більше з наступних мутацій: T252L, T254S, T256F, як описано в патенті США № 6,277,375. Альтернативно, щоб підвищити біологічний період напів-виведення, антитіло може бути змінене в межах CH1 або CL ділянки, щоб містити збережений епітоп, зв'язуючий рецептор, взятий з двох петель CH2 домену Fc ділянки IgG, як описано в патенті США № 5,869,046 та 6,121,022. В іншому варіанті втілення, антитіло продукують, як юнітіло як описано в WO2007/059782, яка є включеною в даний документ у вигляді посилання в повному об'ємі. В ще інших варіантах втілення, Fc ділянку змінюють шляхом заміщення, щонайменше, одного амінокислотного залишку на відмінний амінокислотний залишок, щоб змінити ефектрону(і) функцію(ї) антитіла. Наприклад, одна або більше амінокислот, вибраних з амінокислотних залишків 234, 235, 236, 237, 297, 318, 320 та 322, можуть бути заміщені на відмінний амінокислотний залишок таким чином, що антитіло має змінену афінність для ефекторного ліганду, але зберігає антиген-зв'язуючу здатність батьківського антитіла. Ефекторний ліганд, афінність якого змінюється, може бути, наприклад, Fc рецептором або C1 компонентом комплементу. Даний підхід, крім того, є детально описаним в патенті США № 5,624,821 та 5,648,260. В іншому прикладі, одна або декілька амінокислот, вибраних з амінокислотних залишків 329, 331 та 322 можуть бути заміщеними на відмінний амінокислотний залишок таким чином, щоб антитіло змінило C1q зв'язування та/або знизило або анулювало комплемент-залежну цитотоксичність (CDC). Даний підхід, крім того, детально є описаним в патенті США № 6,194,551. В іншому прикладі, один або декілька амінокислотних залишків в амінокислотних положеннях 231 та 239 змінюються таким чином, щоб змінити здатність антитіла фіксувати комплемент. Даний підхід, крім того, є описаним в публікації заявки на патент PCT WO 94/29351. В ще іншому прикладі, Fc ділянку модифікують так, щоб підвищити здатність антитіла виступати посередником в антитіло-залежній клітинній цитотоксичності (ADCC) та/або підвищити афінність антитіла для Fcγ рецептора шляхом модифікування однієї або більше амінокислот в наступних положеннях: 238, 239, 248, 249, 252, 254, 255, 256, 258, 265, 267, 268, 269, 270, 272, 276, 278, 280, 283, 285, 286, 289, 290, 292, 293, 294, 295, 296, 298, 301, 303, 305, 307, 309, 312, 315, 320, 322, 324, 326, 327, 329, 330, 331, 333, 334, 335, 337, 338, 340, 360, 373, 376, 378, 382, 388, 389, 398, 414, 416, 419, 430, 434, 435, 437, 438 або 439. Даний підхід, крім того, є описаним в публікації PCT WO 00/42072 Presta. Більш того, сайти зв'язування на людському IgG1 for FcγR1, FcγRII, FcγRIII та FcRn були маповані та варіанти з покращеним зв'язуванням були описані (дивись, Shields, R.L. et al. (2001) J. Biol. Chem. 276:6591-6604). Специфічні мутації в положеннях 256, 290, 298, 333, 334 та 339 показані для покращення зв'язування з FcγRIII. Крім того, наступні комбінаційні мутанти були показані для покращення FcγRIII зв'язування: T256A/S298A, S298A/E333A, S298A/K224A та S298A/E333A/K334A. Крім того, ADCC варіанти є описаними, наприклад, в WO2006/019447. В ще іншому прикладі, Fc ділянку модифікують, щоб підвищити період напіввиведення антитіла, як правило, шляхом підвищення зв'язування з FcRn рецептором, як описано, наприклад, в PCT/US2008/088053, US 7,371,826, US 7,670,600 та WO 97/34631. В іншому варіанті втілення, антитіло модифікують, щоб підвищити його біологічний період напіввиведення. Різні підходи є можливими. Наприклад, одна або більше з наступних мутацій можуть бути введеними: T252L, T254S, T256F, як описано в патенті США № 6,277,375 Уордом (Ward). Альтернативно, щоб підвищити біологічний період напів-виведення, антитіло може бути змінене 21 UA 114478 C2 5 10 15 20 25 30 35 40 45 50 55 60 в межах CH1 або CL ділянки, щоб містити збережений епітоп, зв'язуючий рецептор, взятий з двох петель CH2 домену Fc ділянки IgG, як описано в патенті США № 5,869,046 та 6,121,022. В ще іншому варіанті втілення, модифікують глікозилювання антитіла. Наприклад, аглікозильоване антитіло може бути зробленим (тобто антитіло, яке зазнає потреби в глікозилюванні). Глікозилювання може змінювати, наприклад, підвищувати афінність, антитіла для антигену. Такі вуглеводні модифікації можуть бути виконані, наприклад, шляхом зміни одного або більше сайтів глікозилювання в послідовності антитіла. Наприклад, одне або більше амінокислотних заміщень може бути зроблено, що в результаті призводить до елімінування одного або більше структурних сайтів глікозилювання варіабельної ділянки, щоб, таким чином, виключити глікозилювання в такому сайті. Таке aглікозилювання може підвищувати афінність антитіла для антигену. Такий підхід, крім того, є детально описаним в патенті США № 5,714,350 та 6,350,861 Ко (Co) та співробітниками, та може бути виконаний шляхом видалення аспарагіну в положенні 297. Додатково або альтернативно, антитіло може бути зробленим так, що має змінений тип глікозилювання, такий як гіпофукозильоване антитіло, що має знижену кількість фукозильних залишків, або антитіло, що має підвищене бісектирування GlcNac структур. Іноді в даній галузі це називають як "сконструйована глікоформа". Такі змінені типи глікозилювання продемонстрували підвищення ADCC здатності антитіл. Такі вуглеводні модифікації, як правило, можуть бути виконані двома шляхами; наприклад, в деяких варіантах втілення, антитіло експресують в клітині-господарі за зміненим механізмом глікозилювання. Клітини зі зміненим механізмом глікозилювання описані в даній галузі в рівні техніки та можуть бути застосовані як клітини-господарі, в яких експресують рекомбінантні антитіла за винаходом, щоб, таким чином, одержати антитіло зі зміненим глікозилюванням. Посилання робиться на POTELLIGENT® технологію. Наприклад, клітинні лінії Ms704, Ms705 та Ms709 зазнають нестачу в гені фукозилтрансферази, FUT8 (альфа (1,6) фукозилтрансфераза), таким чином, що антитіла, експресовані в Ms704, Ms705, та Ms709 клітинних лініях зазнають нестачу фукози в -/своїх вуглеводах. Ms704, Ms705, та Ms709 FUT8 клітинні лінії були створені шляхом спрямованого руйнування FUT8 гена в CHO/DG44 клітинах, використовуючи два вектора заміщення [дивись, публікацію патенту США № 2004/0110704, патент США № 7,517,670 та Yamane-Ohnuki et al. (2004) Biotechnol. Bioeng. 87:614-22]. Як інший приклад, EP 1,176,195 Ханаі (Hanai) та співробітники описують клітинну лінію з функціонально зруйнованим FUT8 геном, який кодує фукозилтрансферазу, таким чином, що антитіла, експресовані в такій клітинній лінії демонструють гіпофукозилювання шляхом зменшення або елімінування альфа 1,6 відносно зв'язаного ферменту. Ханаі (Hanai) та співробітники, крім того, описують клітинні лінії, які мають низьку ферментну активність щодо додавання фукози до N-ацетилглюкозаміну, який зв'язується з Fc ділянкою антитіла, або не має ферментної активності, наприклад, клітинна лінія щурячої мієломи YB2/0 (ATCC CRL 1662). Альтернативно, сконструйовані глікоформи, зокрема афукозильовані, можуть бути зроблені, використовуючи низькомолекулярні інгібітори шляхом глікозилювання ферментів [дивись, наприклад, Rothman et al. (1989) Mol. Immunol. 26(12):1131123; Elbein (1991) FASEB J. 5:3055; PCT/US2009/042610 та патент США № 7,700,321]. Публікація PCT WO 03/035835 описує варіантну CHO клітинну лінію, Lec13 клітини, зі зниженою здатністю приєднувати фукозу до Asn(297)-зв'язаних вуглеводів, також призводячи в результаті до гіпофукозилювання антитіл, експресованих в такій клітині-господарі [дивись, також Shields, R.L. et al. (2002) J. Biol. Chem. 277:26733-26740]. Публікація PCT WO 99/54342 описує клітинні лінії, сконструйовані, щоб експресувати глікопротеїн-модифікуючі фукозилтрансферази (наприклад, бета(1,4)-N-ацетилглюкозамінилтрансферазу III (GnTIII)), таким чином, що антитіла, експресовані в сконструйованій клітинній лінії демонструють підвищене бісектирування GlcNac структур, що в результаті призводить до підвищеної ADCC активності антитіла [дивись, також Umana et al. (1999) Nat. Biotech. 17:176-180]. Альтернативно, залишки фукози антитіла можуть бути розщеплені, використовуючи фермент фукозидазу. Наприклад, фукозидаза альфа-L-фукозидази видаляє фукозильні залишки з антитіла [Tarentino, A.L. et al. (1975) Biochem. 14:5516-23]. Інша модифікація антитіла в даному документі, яка розглядається винаходом, представляє собою ПЕГилювання. Антитіло може бути ПЕГильованим щоб, наприклад, підвищити біологічний (наприклад, сироватковий) період напів-виведення антитіла. Щоб ПЕГилювати антитіло, антитіло або його фрагмент, як правило, піддають взаємодії з поліетиленгліколем (ПЕГ), наприклад, реакційноздатну складноефірну або альдегідну похідну ПЕГ, в умовах, в яких одна або декілька ПЕГ груп стають приєднаними до антитіла або фрагменту антитіл. Переважно, ПЕГилювання здійснюється за рахунок реакції ацилювання або реакції алкілування з реакційноздатною молекулою ПЕГ (або аналогічного реакційноздатного водорозчинного 22 UA 114478 C2 5 10 15 20 25 30 35 40 45 50 55 60 полімеру). Як використовується в даному документі, мається на увазі, що термін "поліетиленгліколь" охоплює будь-яку з форм ПЕГ, які були застосовані для дериватизації інших протеїнів, таких як моно (С1-С10) алкокси- або арилокси-поліетиленгліколь або поліетиленгліколь-малеімід. В певних варіантах втілення, антитіло, яке є ПЕГильованим, представляє собою аглікозильоване антитіло. Способи ПЕГилювання протеїнів відомі в даній галузі з рівня техніки та можуть бути застосовані до антитіл за винаходом. Дивись, наприклад, ЕР 0154316 та ЕР 0401384. В додаткових варіантах втілення, наприклад, при застосуванні антитіла за винаходом в діагностичних цілях або цілях виявлення, антитіла можуть містити мітку. Під "міченим" в даному документі мають на увазі те, що сполука має, щонайменше, один елемент, ізотоп або хімічну сполуку, яку приєднують для того, щоб зробити можливим виявлення сполуки. Загалом, мітки розділяють на три класи: а) ізотопні мітки, які можуть бути радіоактивними або важкими ізотопами, b) магнітні, електричні, теплові; та c) кольорові або люмінесцентні барвники; незважаючи на те, що мітки також включають ферменти та частинки, такі як магнітні частинки. Переважні мітки включають, але не обмежуються цим, флуоресцентні комплекси лантаноїдів (включаючи європію та тербію), та флуоресцентні мітки, включаючи, але не обмежуючись цим, квантові точки, флуоресцеїн, родамін, тетраметилродамін, еозин, еритрозин, кумарин, метилкумарини, пірен, малахітовий зелений, стильбен, люцифер жовтий, каскадний блакитний, техаський червоний, Алекса барвники, ціанінові барвники, та інші, описані в 6-ому виданні Molecular Probes Handbook під редакцією Richard P. Haugland, таким чином, спеціально включені в якості посилання. Лінкери Представлений винахід передбачає кон'югати антитіло-партнер, де антитіло зв'язуються з партнером за рахунок хімічного лінкеру. В деяких варіантах втілення, лінкер представляє собою пептидильний лінкер, інші лінкери включають гідразин та дисульфідні лінкери. На додаток до лінкерів, які приєднуються до партнеру, представлене розкриття, крім того, передбачає лінкерні плечі, що розщеплюються, які є прийнятними для приєднання, по суті, до будь-якого молекулярного виду. Аспект лінкерного плеча за винаходом ілюструється в даному документі шляхом посилання на їх приєднання до терапевтичного фрагменту. однак, кваліфікованому спеціалісту в даної галузі техніки буде достатньо очевидним, що лінкери можуть бути прикріплені до різних видів, включаючи, але не обмежуючись цим, діагностичні агенти, аналітичні агенти, біомолекули, агенти-мішені, мітки, які детектуються, тощо. Застосування пептидильних та інших лінкерів в кон'югатах антитіло-партнер є описаним в попередніх заявках на патент США № 60/295,196; 60/295,259; 60/295342; 60/304,908; 60/572,667; 60/661,174; 60/669,871; 60/720,499; 60/730,804 та 60/735,657; та заявці на патент США № 10/160,972; 10/161,234; 11/134,685; 11/134,826; та 11/398,854 та патенті США № 6,989,452 та заявці на патент PCT № PCT/US2006/37793, всі з яких включені в даний документ у вигляді посилання. Додаткові лінкери є описаними в патенті США № 6,214,345, заявці на патент США 2003/0096743 та заявці на патент США 2003/0130189, de Groot et al, J. Med. Chem. 42, 5277 (1999); de Groot et al. J. Org. Chem. 43, 3093 (2000); de Groot et al., J. Med. Chem. 66, 8815, (2001); WO 02/083180; Carl et al., J. Med. Chem. Lett. 24, 479, (1981); Dubowchik et al., Bioorg & Med. Chem. Lett. 8, 3347 (1998); та попередній заявці на патент США 60/891,028. В одному аспекті, представлене розкриття стосується лінкерів, які є корисними для приєднання груп-мішеней до терапевтичних агентів та маркерів. В іншому аспекті, дане розкриття передбачає лінкери, які надають стабільність сполукам, зниження їх токсичності in vivo, або в протилежному випадку прийнятно відобразиться на їх фармакокінетиках, біодоступності та/або фармакодинаміках. Як правило, переважним є те, що в таких варіантах втілення лінкер розщеплюється, вивільняючи активний лікарський засіб, як тільки лікарський засіб досягає місця його дії. Таким чином, в одному варіанті втілення, лінкери за представленим винаходом є безслідним, таким чином, що після його видалення з терапевтичного агента або маркера (таких як, під час активації), ніякого сліду присутності лінкеру не залишається. В іншому варіанті втілення, лінкери характеризуються своєю здатністю відщеплюватися в сайті, в межах або поблизу клітини-мішені, такі як в сайті терапевтичної дії або активності маркера. Таке розщеплення може бути ферментативним в природі. Дана характеристика сприяє зниженню системної активації терапевтичного агента або маркера, знижуючи токсичність та системні побічні ефекти. Переважні групи, що розщеплюються, для ферментативного розщеплення включають пептидні зв'язки, складноефірні зв'язки та дисульфідні містки. В інших варіантах втілення, лінкери є чутливими до рН та розщеплюються через зміну в рН. Аспектом представленого розкриття є здатність контролювати швидкість, з якою лінкери розщеплюються. Часто лінкер, який швидко розщеплюється, є потрібним. В деяких варіантах 23 UA 114478 C2 5 10 15 20 25 30 35 40 45 50 55 60 втілення, однак, лінкер, який розщеплюється більш повільно, може бути переважним. Наприклад, в композиції з подовженим вивільненням компонента або в композиції, як зі швидким вивільненням, так і з повільним вивільненням компонента, може бути корисним, забезпечення лінкеру, який розщеплюється більш повільно. WO 02/096910 передбачає декілька конкретних комплексів ліганд-лікарський засіб, що має гідразиновий лінкер. Однак, не існує ніякого способу, щоб "відрегулювати" композицію лінкеру в залежності від швидкості потрібної циклізації, та конкретних сполук, описаних відщеплень ліганду від лікарського засобу при більш повільній швидкості, ніж це є переважним для багатьох кон'югатів лікарський засіб-лінкер. На противагу цьому, гідразинові лінкери представленого винаходу передбачають діапазон швидкостей циклізації, від дуже швидко до дуже повільно, тим самим, дозволяючи вибір конкретного гідразинового лінкеру, ґрунтуючись на необхідній швидкості циклізації. Наприклад, дуже швидка циклізація може бути досягнута з гідразиновими лінкерами, які продукують один 5-членний цикл при розщепленні. Швидкості переважної циклізації для спрямованої доставки цитотоксичного агенту до клітин досягаються із застосуванням гідразинових лінкерів, які одержують, при розщепленні, або двох 5-членних кілець, або одного 6-членного кільця, що в результаті призводить до лінкеру, що має два метили в гемінальному положенні. Гем-диметильний ефект, як було показано, збільшує швидкість реакції циклізації в порівнянні з єдиним 6-членним циклом без двох метилів в гемінальному положенні. Це відбувається в результаті деформації, яка вивільняється в кільце. Іноді, однак, замісники можуть сповільнити реакцію, замість того, щоб прискорити. Часто причини уповільнення можуть бути прослідковані за стеричними невідповідностями. Наприклад, гем-диметильне заміщення дозволяє здійснити реакцію циклізації набагато швидше, в порівнянні з тим, коли гемінальним вуглецем є CH2. Важливо відмітити, однак, що в деяких варіантах втілення, лінкер, який розщеплюється більш повільно, може бути переважним. Наприклад, в композиції з подовженим вивільненням або в композиції, як зі швидким вивільненням, так і з повільним вивільненням компоненту, це може бути корисним, щоб забезпечити лінкер, який розщеплює більш повільно. В певних варіантах втілення, повільна швидкість циклізації досягається застосуванням гідразинового лінкеру, який продукується, при розщепленні або одного 6-членного кільця, без гемдиметильного заміщення, або одного 7-членного кільця. Лінкери також слугують для стабілізації терапевтичного агенту або маркеру по відношенню до деградації, при кровообігу. Дана особливість передбачає значну перевагу, так як така стабілізація, що в результаті призводить до продовження періоду напів-виведення при кровообігу приєднаного агента або маркера. Лінкер, крім того, слугує для послаблення активності приєднаного агента або маркера так, що кон'югат є відносно доброякісним, в той час, коли знаходиться в кровообігу, та має необхідний ефект, наприклад, є токсичним, після активації в необхідному місці дії. Для кон'югатів терапевтичного агента, дана особливість лінкеру слугує для покращення терапевтичного індексу агента. Стабілізуючі групи переважно вибирають так, щоб обмежити кліренс та метаболізм терапевтичного агента або маркера ферментами, які можуть бути присутніми в крові або нецільовій тканині та додатково вибирають, щоб обмежити перенесення агента або маркера в клітини. Стабілізуючі групи слугують для блокування деградації агента або маркера, та можуть також діяти щодо забезпечення інших фізичних характеристик агента або маркера. Стабілізуюча група може також покращувати стабільність агента або маркера при зберіганні в будь-якому вигляді препарату або в не сформульованій формі. В ідеалі, стабілізуюча група є корисною, щоб стабілізувати терапевтичний агент або маркер, якщо він слугує для захисту агенту або маркеру від деградації при дослідженні щодо зберігання агента або маркера в людській крові при 37 °C впродовж 2 годин та, що в результаті призводить до менше, ніж 20 %, переважно менше, ніж 10 %, більш переважно, менше, ніж 5 % та ще більш переважно менше, ніж 2 %, розщеплення агента або маркера ферментами, що є присутніми в людській крові за даних умов аналізу. Представлений винахід також стосується кон'югатів, що містять дані лінкери. Більш конкретно, винахід стосується застосування проліків, які можуть бути застосовані для лікування захворювання, особливо для хіміотерапії раку. Зокрема, застосування лінкерів, описане в даному документі, передбачає проліки, які демонструють високу специфічність дії, понижену токсичність, та покращену стабільність в крові по відношенню до проліків подібної структури. Лінкери за представленим розкриттям, як описано в даному документі, можуть бути присутніми в різних положеннях всередині молекули партнера. Таким чином, забезпечується лінкер, який може містити будь-яке з множини груп, як частину свого ланцюга, які будуть розщеплятися in vivo, наприклад, в кровотоці, зі швидкістю, яка підвищується по відношенню до того з конструктів, в яких відсутні такі групи. Крім того, 24 UA 114478 C2 5 10 15 20 25 30 35 40 45 50 55 60 передбаченими є кон'югати лінкерних плечей з терапевтичними та діагностичними агентами. Лінкери є прийнятними для формування проліків-аналогів терапевтичних агентів та для оборотного зв'язування терапевтичного або діагностичного агента з агентом-мішенню, який детектується міткою або з твердим носієм. Лінкери можуть бути включені в комплекси, які включають цитотоксини. Приєднання проліків до антитіла може дати додаткові переваги безпеки в порівнянні зі звичайними антитілами-кон'югатами цитотоксичних лікарських засобів. Активація проліків може бути досягнута за допомогою естерази, як в пухлинних клітинах, так і в деяких нормальних тканинах, включаючи плазму. Показано, що рівень відповідної активності естерази у людей є дуже схожим з тим, що спостерігається у щурів та приматів, крім людей, незважаючи на те, що є меншим, ніж той, що спостерігається у мишей. Активація проліків, крім того, може бути досягнута шляхом розщеплення глюкуронидазою. На додаток до пептиду, що розщеплюється, гідразину або дисульфідної групи, необов'язково вводять одну або декілька лінкерних груп, що самостійно руйнується, між цитотоксином та агентом-мішенню. Дані лінкерні групи також можуть бути описані, як спейсерні групи, та містять, щонайменше, дві реакціоноздатні функціональні групи. Як правило, одна хімічна функціональність спейсерних груп зв'язується з хімічною функціональністю терапевтичного агента, наприклад цитотоксину, тоді як інша хімічна функціональність спейсерної групи застосовується для зв'язування з хімічною функціональністю агента-мішені або лінкера, що розщеплюється. Приклади хімічних функціональностей спейсерних груп включають гідрокси, меркапто, карбонільні, карбокси, аміно, кетонні та меркаптогрупи. Лінкерами, що самостійно руйнуються, як правило, є заміщена або незаміщена алкільна, заміщена або незаміщена арильна, заміщена або незаміщена гетероарильна, або заміщена або незаміщена гетероалкільна група. В одному варіанті втілення, алкільні або арильні групи можуть містити від 1 до 20 атомів вуглецю. Вони можуть також містити поліетиленгліколевий фрагмент. Ілюстративні спейсерні групи включають, наприклад, 6-аміногексанол, 6-меркаптогексанол, 10-гідроксидеканову кислоту, гліцин та інші амінокислоти, 1,6-гександіол, β-аланін, 2аміноетанол, цистеамін (2-аміноетантіол), 5-амінопентанову кислоту, 6-амінокапроєву кислоту, 3-малеімідобензойну кислоту, фталід, α-заміщені фталіли, карбонільну групу, тваринні складні ефіри, нуклеїнові кислоти, пептиди, тощо. Спейсер може слугувати для введення додаткової молекулярної маси та хімічної функціональності в комплекс цитотоксин-цільовий агент. Як правило, додаткова маса та функціональність будуть впливати на сироватковий період напів-виведення та інші властивості комплексу. Таким чином, за рахунок дбайливого вибору спейсерних груп, можуть бути одержані комплекси цитотоксину з діапазоном сироваткового періоду напів-виведення. Коли є присутніми складні спейсери, можуть бути застосовані або ідентичні, або різні спейсери. Додатковий лінкерний фрагмент може бути використаний для того, щоб, переважно, надати підвищену розчинність або знижені агрегаційні властивості кон'югатам, що застосовують лінкер, який містить фрагмент, або модифікує швидкість гідролізу кон'югата, такі лінкери не повинні бути такими, що руйнуються самостійно. В одному варіанті втілення, зв'язуючий фрагмент представляє собою заміщений алкіл, незаміщений алкіл, заміщений арил, незаміщений арил, заміщений гетероалкіл або незаміщений гетероалкіл, будь-який з яких може бути лінійним, розгалуженим або циклічним. Замісниками можуть бути, наприклад, нижчий (C1-C6) алкіл, алкокси, алкілтіо, алкіламіно або діалкіламіно. В певних варіантах втілення, лінкери включають нециклічний фрагмент. В іншому варіанті втілення, лінкери містять будь-який позитивно або негативно заряджений амінокислотний полімер, такий як полілізин або поліаргінін. Лінкери можуть містити полімер, такий як поліетиленгліколевий фрагмент. Крім того, лінкер може містити, наприклад, як полімерний компонент, так і невеликий хімічний фрагмент. В переважному варіанті втілення, такі лінкери містять поліетиленгліколевий (ПЕГ) фрагмент. Частина ПЕГ може становити від 1 та 50 одиниць довжиною. Переважно, ПЕГ буде мати 1-12 одиниць, що повторюються, більш переважно 3-12 одиниць, що повторюються, більш переважно 2-6 одиниць, що повторюються, або ще більш переважно 3-5 одиниць, що повторюються та найбільш переважно 4 одиниці, що повторюються. Лінкер може складатися виключно з ПЕГ фрагменту, або він може також містити додатковий заміщений або незаміщений алкіл або гетероалкіл. Прийнятним є комбінування ПЕГ, як частини фрагменту, щоб підвищити розчинність комплексу у воді. Крім того, ПЕГ фрагмент знижує ступінь агрегації, яка може відбуватися під час кон'югації препарату з антитілом. Для подальшого обговорення типів цитоксинів, лінкерів та інших способів для кон'югування 25 UA 114478 C2 5 10 15 20 25 30 35 40 45 50 55 60 терапевтичних агентів з антитілами, дивись, також PCT публікацію WO 2007/059404 Gangwar et al. та під назвою "Cytotoxic Compounds And Conjugates, " Saito, G. et al. (2003) Adv. Drug Deliv. Rev. 55:199-215; Trail, P.A. et al. (2003) Cancer Immunol. Immunother. 52:328-337; Payne, G. (2003) Cancer Cell 3:207-212; Allen, T.M. (2002) Nat. Rev. Cancer 2:750-763; Pastan, I. та Kreitman, R. J. (2002) Curr. Opin. Investig. Drugs 3:1089-1091; Senter, P.D. та Springer, CJ. (2001) Adv. Drag Deliv. Rev. 53:247-264, кожна з яких є включеною в даний документ у вигляді посилання в повному об'ємі. Молекули-партнери Представлений винахід включає антитіло, кон'юговане з партнером-молекулою, такою як цитотоксин, лікарський засіб (наприклад, імунодепресант) або радіотоксин. Такі кон'югати також називаються в даному документі як "імунокон'югати." Імунокон'югати, які включають один або декілька цитотоксинів називаються, як "імунотоксини". Цитотоксин або цитотоксичний агент включає будь-яке агент, який є шкідливим (наприклад, знищує) для клітин. Приклади молекул-партнерів представленого розкриття включають таксол, цитохалазин В, граміцидин D, бромід етидію, еметин, мітоміцин, етопозид, тенопозид, вінкристин, вінбластин, колхіцин, доксорубіцин, даунорубіцин, дигідроксіантрациндіон, мітоксантрон, мітраміцин, актиноміцин D, 1-дегідротестостерон, глюкокортикоїди, прокаїн, тетракаїн, лідокаїн, пропранолол та пуроміцин та їх аналоги або гомологи. Приклади молекул-партнерів також включають, наприклад, антиметаболіти (наприклад, метотрексат, 6-меркаптопурин, 6-тіогуанін, цитарабін, 5-фторурацилдекарбазин), алкілуючі агенти (наприклад, мехлоретаміна, тіоепахлорамбуцил, мелфалан, кармустин (BSNU) та ломустин (CCNU), циклотосфамід, бусульфан, дибромоманітол, стрептозотоцин, мітоміцин C, та цис-дихлордіамін платини (II) (DDP) цисплатин), антрацикліни (наприклад, даунорубіцин (раніше дауноміцин) та доксорубіцин), антибіотики (наприклад, дактиноміцин (раніше актиноміцин), блеоміцин, мітраміцин та антраміцин (АМС)) та антимітотичні агенти (наприклад, вінкристин та вінбластин). Інші переважні приклади молекул-партнерів, які можуть бути кон'югованими з антитілом за винаходом, включають дуокарміцини, каліхеаміцини, майтансини та ауристатини, та їх похідні. Приклад кон'югата каліхеаміцину з антитілом є комерційно доступним (Mylotarg®; American Home Products). Переважними прикладами молекул-партнерів є СС-1065 та дуокарміцини. СС-1065 вперше був виділеним з Streptomyces zelensis в 1981 році компанією Upjohn Company (Hanka et al, J. Antibiot. 31: 1211 (1978); Martin et al., J. Antibiot. 33: 902 (1980); Martin et al., J. Antibiot. 34: 1119 (1981)) та було встановлено наявність сильної протипухлинної та антимікробної активності як in vitro, так і у експериментальних тварин (Li et al., Cancer Res. 42: 999 (1982)). СС-1065 зв'язуються з дволанцюговою B-ДНК в малій борозці (Swenson et al., Cancer Res. 42: 2821 (1982)) з переважною послідовністю 5'- d(A/GNTTA)-3' та 5'-d(AAAAA)-3' та алкілує N3 положення 3'-аденіну своєї CPI лівосторонньою одиницею, яка є присутньою в молекулі (Hurley et al., Science 226: 843 (1984)). Незважаючи на свою потенційну та широку протипухлинну активність, CC-1065 не може бути застосований у людей, тому що він викликає уповільнену смерть піддослідних тварин. Багато аналогів та похідних СС-1065 та дуокарміцинів є відомими в даній галузі з рівня техніки. Дослідження структури, синтезу та властивостей багатьох сполук було розглянуто. Дивись, наприклад, Boger et al., Angew. Chem. Int. Ed. Engl. 35: 1438 (1996); та Boger et al., Chem. Rev. 97: 787 (1997). Група в Kyowa Hakko Kogya Co., Ltd. одержала ряд CC-1065 похідних. Дивись, наприклад, патент США № 5,101, 038; 5,641,780; 5,187,186; 5,070,092; 5,703,080; 5,070,092; 5,641,780; 5,101,038; та 5,084,468; та опубліковану заявку PCT WO 96/10405 та опубліковану заявку на Європейський патент 0 537 575 Al. Компанія Upjohn Company (Pharmacia Upjohn) також приймає активну участь в одержанні похідних CC-1065. Дивись, наприклад, патент США № 5,739,350; 4,978,757, 5,332, 837 та 4,912,227. Фізичні властивості антитіла Антитіла за представленим винаходом, крім того, можуть характеризуватися різними фізичними властивостями анти-BST1 антитіла. Різні аналізи можуть бути застосовані для виявлення та/або диференціювання різних класів антитіл, ґрунтуючись на їх фізичних властивостях. В деяких варіантах втілення, антитіла за представленим винаходом можуть містити один або більше сайтів глікозилювання в варіабельній ділянці або легкого, або важкого ланцюга. Присутність одного або більше сайтів глікозилювання в варіабельній ділянці може в результаті призвести до підвищеної імуногенності антитіла або зміні pK антитіла за рахунок зміненого антиген-зв'язування [Marshall et al (1972) Annu Rev Biochem 41:673-702; Gala FA та Morrison SL (2004) J Immunol 172:5489-94; Wallick et al (1988) J Exp Med 168:1099-109; Spiro RG (2002) 26 UA 114478 C2 5 10 15 20 25 30 35 40 45 50 55 60 Glycobiology 12:43R-56R; Parekh et al (1985) Nature 316:452-7; Mimura et al. (2000) Mol Immunol 37:697-706]. Відомо, що глікозилювання здійснюється на фрагментах, що містять N-X-S/T послідовність. Глікозилювання варіабельної ділянки можуть досліджувати, використовуючи гліко-блотинг аналіз, який відщеплює антитіло, щоб одержати Fab, та потім досліджують глікозилювання, використовуючи аналіз, який вимірює перйодатне окиснення та утворення основи Шиффа (Schiff). Альтернативно, глікозилювання варіабельної ділянки можуть досліджувати, використовуючи Dionex рідинну хроматографію (Dionex-РХ), які відщеплюють сахариди від Fab в моносахаридах, та аналізують вміст конкретного сахариду. В деяких випадках, переважним є наявність анти-BST1 антитіла, яке не містить глікозилювання варіабельної ділянки. Це може бути досягнуто або відбором антитіл, які не містять фрагмента глікозилювання в варіабельній ділянці або мутуванням залишків в фрагменті глікозилювання, використовуючи стандартні методики, добре відомі в даній галузі з рівня техніки. В переважному варіанті втілення, антитіла за представленим винаходом не містять сайти ізомеризму аспарагіну. Ефекти деамідування або ізоаспарагінової кислоти можуть здійснюватися на N-G або D-G послідовностях, відповідно. Ефекти деамідування або ізоаспарагінової кислоти в результаті призводять до утворення ізоаспарагінової кислоти, яка знижує стабільність антитіла шляхом створення ламаної структури карбокси кінця бічного ланцюга переважніше, ніж головного ланцюга. Утворення ізоаспарагінової кислоти можуть вимірювати, використовуючи ізо-квантовий аналіз, який використовує ВЕРХ з оберненою фазою, щоб дослідити ізоаспарагінову кислоту. Кожне антитіло буде мати унікальну ізоелектричну точку (pI), але, як правило, антитіла будуть припадати на діапазон pH від 6 до 9,5. pI для IgG1 антитіла, як правило, припадає на діапазон pH 7-9,5 та pI для IgG4 антитіла, як правило, припадає на діапазон pH 6-8. Антитіла можуть мати pI, яка виходить за даний діапазон. Незважаючи на те, що ефекти, як правило, є невідомими, існує припущення, що антитіла з pI за межами нормального діапазону можуть мати деяке розгортання та нестабільність в умовах in vivo. Ізоелектрична точка може бути досліджена, використовуючи капілярний ізоелектричний фокусуючий аналіз, який створює pH градієнт та може застосовувати лазерне фокусування для підвищеної точності [Janini et al (2002) Electrophoresis 23:1605-11; Ma et al. (2001) Chromatographia 53:S75-89; Hunt et al (1998) J Chromatogr A 800:355-67]. В деяких випадках, переважним є мати анти-BST1 антитіло, яке містить значення pI, яке припадає на нормальний діапазон. Це може бути досягнуто або шляхом відбору антитіла з pI в нормальному діапазоні, або шляхом мутування заряджених поверхневих залишків, використовуючи стандартні методики, добре відомі в даній галузі з рівня техніки. Кожне антитіло буде мати температуру плавлення, яка є показовою щодо термічної стабільності [Krishnamurthy R and Manning MC (2002) Curr Pharm Biotechnol 3:361-71]. Більш висока термічна стабільність демонструє більшу загальну стабільність антитіла in vivo. Температуру плавлення антитіла можуть вимірювати, використовуючи методики, такі як диференціальна скануюча калориметрія [Chen et al. (2003) Pharm Res 20:1952-60; Ghirlando et al. (1999) Immunol Lett 68:47-52]. TM1 демонструє температуру початкового розгортання антитіла. TM2 демонструє температуру повного розгортання антитіла. Як правило, переважним є те, що TM1 антитіла за представленим винаходом становить більше, ніж 60ºC, переважно більше, ніж 65ºC, ще більш переважно більше, ніж 70ºC. Альтернативно, термічну стабільність антитіла можуть вимірювати, використовуючи круговий дихроїзм [Murray et al. (2002) J. Chromatogr Sci 40:343-9]. В переважному варіанті втілення, антитіла вибирають такі, які не розкладаються швидко. Фрагментацію анти-BST1 антитіла можуть вимірювати, використовуючи капілярний електрофорез (CE) та MALDI-MS, як добре розуміється в даній галузі з рівня техніки [Alexander AJ and Hughes DE (1995) Anal. Chem. 67:3626-32]. В іншому переважному варіанті втілення, антитіла вибирають такі, які мають мінімальні агрегаційні ефекти. Агрегування може призводити до запуску небажаної імунної відповіді та/або змінених або небажаних фармакокінетичних властивостей. Як правило, антитіла є прийнятними з агрегацією 25 % або менше, переважно 20 % або менше, ще більш переважно 15 % або менше, ще більш переважно 10 % або менше та ще більш переважно 5 % або менше. Агрегацію можуть вимірювати, використовуючи декілька методик, добре відомих в даній галузі з рівня техніки, включаючи ексклюзійну колонкову (SEC) високоефективну рідинну хроматографію (ВЕРХ), та розсіяння світла, щоб ідентифікувати мономери, димери, тримери або мультимери. Способи конструювання антитіл Як описано вище, анти-BST1 антитіла, що мають VH та VK послідовності, розкриті в даному документі, можуть бути застосовані для створення нових анти-BST1 антитіл шляхом 27 UA 114478 C2 5 10 15 20 25 30 35 40 45 50 55 60 модифікування VH та/або VK послідовностей, або константної(их) ділянки(ок), приєднаної до них. Таким чином, в іншому аспекті за винаходом, структурні особливості анти-BST1 антитіла за винаходом, наприклад BST1_A2, BST1_A1 або BST1_A3, використовують для створення структурно споріднених анти-BST1 антитіл, які зберігають, щонайменше, одну функціональну властивість антитіла за винаходом, таку як зв'язування з людським BST1. Наприклад, одна або більше CDR ділянки BST1_A2, BST1_A1 або BST1_A3, або їх мутації, можуть бути комбіновані рекомбінантно з відомими структурними ділянками та/або іншими CDR, щоб створити додаткові, рекомбінантно-сконструйовані анти-BST1 антитіла за винаходом, як описано вище. Інші типи модифікацій включають ті, що є описаними в попередньому розділі. Вихідний матеріал для способу конструювання представляє собою одну або більше з VH та/або VK послідовностей, передбачених в даному документі, або одну або більше їх CDR ділянок. Для створення сконструйованого антитіла, немає необхідності фактично готувати (тобто, експресувати, як протеїн) антитіло, що має одну або більше з VH та/або VK послідовностей, передбачених в даному документі, або одну або більше їх CDR ділянок. Переважніше, інформація, яка міститься в послідовності(ях), застосовується, як вихідний матеріал для створення "другого покоління" послідовності(ей), одержаних з вихідної(их) послідовності(ей), та потім послідовність(і) "другого покоління" одержують та експресують як протеїн. Відповідно, в іншому варіанті втілення, винахід передбачає спосіб одержання анти-BST1 антитіла, що включає: передбачене: (i) послідовність варіабельної ділянки важкого ланцюга антитіла, яка містить CDR1 послідовність, вибрану з групи, яка складається з SEQ ID NO: 10, 9 та 56, CDR2 послідовність, вибрану з групи, яка складається з SEQ ID NO: 12 або 51, 11 та 57, та/або CDR3 послідовність, вибрану з групи, яка складається з SEQ ID NO: 14, 13 та 58; та/або (ii) послідовність варіабельної ділянки легкого ланцюга антитіла, яка містить CDR1 послідовність, вибрану з групи, яка складається з SEQ ID NO: 16, 15 та 59, CDR2 послідовність, вибрану з групи, яка складається з SEQ ID NO: 18, 17 та 60 та/або CDR3 послідовність, вибрану з групи, яка складається з SEQ ID NO: 20, 19 та 61, зміну, щонайменше, одного амінокислотного залишку в послідовності варіабельної ділянки важкого ланцюга антитіла та/або послідовності варіабельної ділянки легкого ланцюга антитіла, щоб створити, щонайменше, одну змінену послідовність антитіла; та експресування зміненої послідовності антитіла як протеїну. Стандартні методики молекулярної біології можуть бути застосовані для одержання та експресування зміненої послідовності антитіла. Переважно, антитіло, кодоване зміненою(ими) послідовністю(ями) антитіла, є антитілом, яке зберігає одну, декілька або всі з функціональних властивостей анти-BST1 антитіл, описаних в даному документі, функціональні властивості яких включають, але не обмежуються цим: (a) -7 зв'язування з людським BST1 з KD 1×10 M або менше; (b) зв'язування з людськими CHO клітинами трансфікованими з BST1. Функціональні властивості змінених антитіл можуть бути оцінені, використовуючи стандартні аналізи доступні в даній галузі з рівня техніки та/або описані в даному документі, такі як ті, що є представленими в прикладах (наприклад, проточна цитометрія, аналізи зв'язування). В певних варіантах втілення способів конструювання антитіл за винаходом, мутації можуть вводиться довільно або вибірково вздовж всього або частини анти-BST1 антитіла, що кодує послідовність, та в результаті модифіковані анти-BST1 антитіла можуть бути скринінговані за активністю зв'язування та/або іншими функціональними властивостями, як описано в даному документі. Мутаційні способи є описаними в даній галузі в рівні техніки. Наприклад, PCT публікація WO 02/092780 описує способи створення та скринінгу мутацій антитіла, використовуючи мутагенез насищення, зборку синтетичного лігування або їх комбінацію. Альтернативно, PCT публікація WO 03/074679 описує способи, що використовують розрахункові способи скринінгу, щоб оптимізувати фізико-хімічні властивості антитіл. Молекули нуклеїнової кислоти, що кодують антитіла за винаходом Інший аспект за винаходом стосується молекул нуклеїнової кислоти, які кодують антитіла за винаходом. Нуклеїнові кислоти можуть бути присутніми в цілих клітинах, в клітинному лізаті, або в частково очищеній, або по суті чистій формі. Нуклеїнова кислота є "виділена" або "виявляється по суті чистою", коли вона є очищеною від інших клітинних компонентів або інших домішок, наприклад інших клітинних нуклеїнових кислот або протеїнів, за стандартними методиками, включаючи лужну/SDS обробку, CsCl бендінг, колонкову хроматографію, агарозний гель-електрофорез та інші добре відомі в даній галузі з рівня техніки. Дивись, F. Ausubel, et al., ed. (1987) Current Protocols in Molecular Biology, Greene Publishing та Wiley Interscience, N. Y. Нуклеїновою кислотою за винаходом може бути, наприклад, ДНК або РНК та може або не може містити інтронні послідовності. В переважному варіанті втілення, нуклеїнова кислота представляє собою молекулу кДНК. 28
ДивитисяДодаткова інформація
Назва патенту англійськоюAntibodies to adp-ribosyl cyclase 2
Автори англійськоюRohlff, Christian, Terrett, Jonathan, Alexander
Автори російськоюРольфф Кристиан, Территт Джонатан Александер
МПК / Мітки
МПК: A61K 39/395, C07K 16/28
Мітки: зв'язується, специфічно, антитіло, яке
Код посилання
<a href="https://ua.patents.su/72-114478-antitilo-yake-specifichno-zvyazuehtsya-z-bst1.html" target="_blank" rel="follow" title="База патентів України">Антитіло, яке специфічно зв’язується з bst1</a>
Попередній патент: Пристрій для інтрамедулярної фіксації переломів трубчатих кісток
Наступний патент: Система та спосіб забезпечення теплових умов агроенергокомплексу
Випадковий патент: Пристрій для перекривання проміжку між поворотним диском та гармошкою переходу між двома шарнірно з'єднаними секціями транспортного засобу