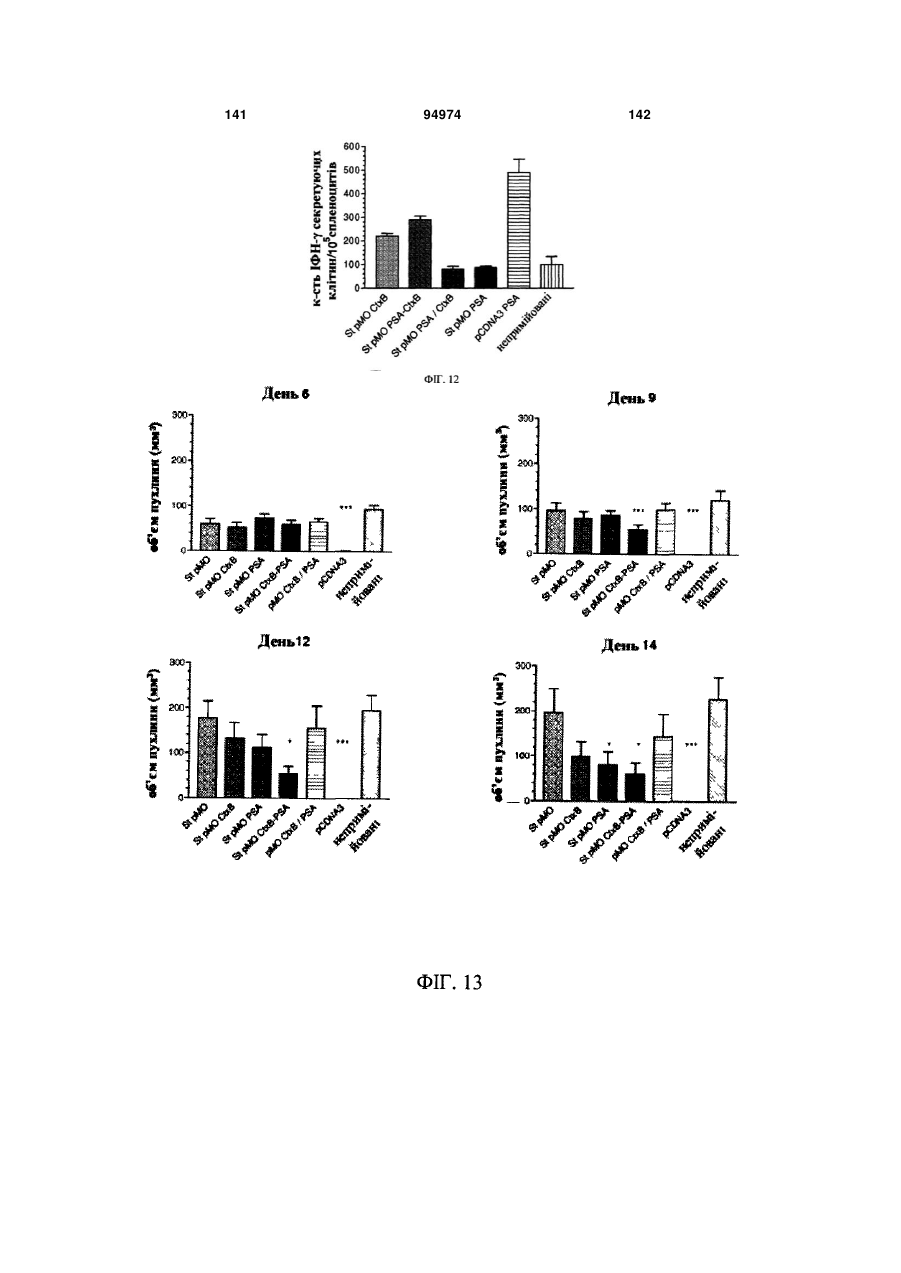
Мікроорганізми як носії нуклеотидних послідовностей, що кодують антигени та білкові токсини, спосіб їх одержання та застосування
Номер патенту: 94974
Опубліковано: 25.06.2011
Автори: Гебель Вернер, Гентшев Івайло, Фенштерле Йоахім, Рапп Ульф-Р.
Формула / Реферат
1. Мікроорганізм як носій нуклеотидних послідовностей, що кодують антигени та білкові токсини, який включає наступні компоненти:
(I) щонайменше одну нуклеотидну послідовність, що кодує щонайменше один повний або частковий антиген з щонайменше одного білка дикого типу або мутантного білка;
(II) щонайменше одну нуклеотидну послідовність, що кодує щонайменше один білковий токсин та/або щонайменше одну субодиницю білкового токсину; і
(III)
a) щонайменше одну нуклеотидну послідовність, що кодує щонайменше одну систему транспорту, що забезпечує можливість експресії продуктів експресії компонента (I) і компонента (II) на зовнішній поверхні мікроорганізму та/або забезпечує можливість секреції продуктів експресії компонента (I) і компонента (II); та/або кодує принаймні одну сигнальну послідовність, що забезпечує можливість секреції продуктів експресії компонента (I) і компонента (II); та/або
b) необов'язково щонайменше одну нуклеотидну послідовність, що кодує щонайменше один білок для лізису мікроорганізму в цитозолі клітин ссавців і для внутрішньоклітинного вивільнення плазмід або векторів експресії, які утримуються в лізованому мікроорганізмі, і
(IV) щонайменше одну нуклеотидну послідовність для щонайменше однієї послідовності активації для експресії одного або більше компонентів (I)-(III), причому зазначена послідовність активації може бути активована в мікроорганізмі та/або є специфічною для клітини тканини, специфічною для пухлинної клітини, макрофаг-специфічною, дендрит-специфічною, лімфоцит-специфічною, функціє-специфічною або неспецифічною відносно клітини;
причому кожен з компонентів (I)-(IV) може бути присутнім або один, або кілька разів і, якщо компонент із компонентів (I)-(IV) присутній кілька разів, він може незалежно від інших бути ідентичним або відрізнятися; та
компонент (I) і компонент (II) неідентичні, тобто компонент (I) не кодує щонайменше одну нуклеотидну послідовність, що кодує щонайменше один білковий токсин та/або щонайменше одну субодиницю білкового токсину.
2. Мікроорганізм за п. 1, у якому мікроорганізм вибраний із групи, що складається з бактерії, грампозитивної бактерії, грамнегативної бактерії, еукаріотичної клітини; і переважно вибраний із групи, що складається з Escherichia spp., Escherichia coli, Salmonella spp., Salmonella typhi, Salmonella typhimurium, Yersinia spp., Yersinia enterocolitica, Vibrio spp., Vibrio cholerae, Listeria spp., Listeria monocytogenes, Shigella spp., Shigella flexneri, Yersinia spp., Pseudomonas spp., при цьому переважно, коли вірулентність мікроорганізму послаблена.
3. Мікроорганізм за п. 2, у якому Vibrio cholerae виключений як мікроорганізм.
4. Мікроорганізм за будь-яким з пп. 1-3, у якому щонайменше один повний або частковий антиген щонайменше одного білка дикого типу або мутантного білка, що відповідає компоненту (I), вибраний із групи, що складається з наступних білків дикого типу і їх відомих мутантів: рецептор; позаклітинна, трансмембранна або внутрішньоклітинна частина рецептора; молекула адгезії; позаклітинна, трансмембранна або внутрішньоклітинна частина молекули адгезії; білок сигнальної трансдукції; білок клітинного циклу; фактор транскрипції; білок диференціювання; ембріональний білок; вірусний білок; алерген; білок мікробного патогену; білок еукаріотичного патогену; білок антигену раку яєчка; білок пухлинного антигену та/або специфічний білок клітини тканини,
причому клітина тканини вибрана із групи, що складається з щитовидної залози, молочної залози, слинної залози, лімфатичного вузла, слизової оболонки шлунка, нирки, яєчника, простати, шийки матки, серозної оболонки сечового міхура і невусу.
5. Мікроорганізм за п. 4, у якому щонайменше один повний або частковий антиген щонайменше одного білка дикого типу або мутантного білка, що відповідає компоненту (I), вибраний із групи, що складається з наступних білків дикого типу і їх відомих мутантів: Her-2/neu, андрогенний рецептор, естрогенний рецептор, midkine-рецептор, рецептор EGF, рецептор ERBB2, ERBB4, рецептор TRAIL, FAS, рецептор TNFα, рецептор TGF-β, лактофериновий рецептор, основний мієлін, α-лактальбумін, GFAP, фібрилярний кислий білок, тирозиназа, EGR-1, MUC1, c-Raf (Raf-1), A-Raf, B-Raf, B-Raf V599E, B-Raf V600E, B-Raf KD, домен кінази B-Raf V600E, B-Raf V600E KD, домен кінази KD B-Raf V600E, домен кінази B-Raf, домен кінази KD B-Raf, N-Ras, K-Ras, H-Ras, Bcl-2, Bcl-X, Bcl-W, Bfl-1, Brag-1, Mcl-1, A1, Bax, BAD, Bak, Bcl-Xs, Bid, Bik, Hrk, Bcr/abl, Myb, C-Met, IAP1, IAO2, XIAP, ML-IAP LIVIN, сурвивін, APAF-1, циклін D(1-3), циклін E, циклін A, циклін B, циклін H, Cdk-1, Cdk-2, Cdk-4, Cdk-6, Cdk-7, Cdc25C, p16, p15, p21, p27, p18, pRb, p107, p130, E2F(1-5), GAAD45, MDM2, PCNA, ARF, PTEN, APC, BRCA, Akt, PI3K, mTOR, p53 і гомологи, C-Myc, NFkB, c-Jun, ATF-2, Sp1, простатаспецифічний антиген (PSA), карциноембріональний антиген, α-фетопротеїн, PAP; PSMA; STEAP; MAGE, MAGE-1, MAGE-3, NY-ESO-1, PSCA, MART, Gp100, тирозиназа, GRP, TCF-4, вірусні антигени вірусів ВІЛ, HPV, HCV, HPV, EBV, CMV, HSV, вірусу грипу, вірусу грипу типу A, вірусу грипу типу A (H5N1) і (H3N2), вірусу грипу типу B, вірусу грипу типу C; гемаглютинінів, гемаглютиніну H1, гемаглютиніну H5, гемаглютиніну H7, гемаглютиніну HA1 (переважно з вірусу грипу А (A/Thailand/1 (KAN-1)2004(H5N1), гемаглютиніну HA12 (переважно з вірусу грипу А (A/Thailand/1 (KAN-1)2004(H5N1), гемаглютиніну HA12C (переважно з вірусу грипу А (A/Thailand/1 (KAN-1)2004(H5N1), нейрамідази, p60, LLO, уреази, CSP, калфлагіну та/або CPB, або в якому щонайменше один повний або частковий антиген щонайменше одного білка дикого типу або мутантного білка, що відповідає компоненту (I), вибраний із групи кіназ, що складається з наступних білків дикого типу і їх відомих мутантів (реєстраційні номери приводять у дужках): AAK1 (NM 014911), AATK (NM 004920), ABL1 (NM 005157), ABL2 (NM 005158), ACK1 (NM 005781), ACVR1 (NM 001105), ACVR1B (NM 020328), ACVR2 (NM 001616), ACVR2B (NM 001106), ACVRL1 (NM 000020), ADCK1 (NM 020421), ADCK2 (NM 052853), ADCK4 (NM 024876), ADCK5 (NM 174922), ADRBK1 (NM 001619), ADRBK2 (NM 005160), AKT1 (NM 005163), AKT2 (NM 001626), AKT3 (NM 005465), ALK (NM 004304), ALK7 (NM 145259), ALS2CR2 (NM 018571), ALS2CR7 (NM 139158), AMHR2 (NM 020547), ANKK1 (NM 178510), ANKRD3 (NM 020639), APEG1 (NM 005876), ARAF (NM 001654), ARK5 (NM 014840), ATM (NM 000051), ATR (NM 001184), AURKA (NM 003600), AURKB (NM 004217), AURKC (NM 003160), AXL (NM 001699), BCKDK (NM 005881), BCR (NM 004327), BIKE (NM 017593), BLK (NM 001715), BMPR1 A (NM 004329), BMPR1 B (NM 001203), BMPR2 (NM 001204), BMX (NM 001721), BRAF (NM 004333), BRD2 (NM 005104), BRD3 (NM 007371), BRD4 (NM 014299), BRDT (NM 001726), BRSK1 (NM 032430), BRSK2 (NM 003957), BTK (NM 000061), BUB1 (NM 004336), BUB1 B (NM 001211), CABC1 (NM 020247), CAMK1 (NM 003656), CaMK1b (NM 198452), CAMK1D (NM 020397), CAMK1G (NM 020439), CAMK2A (NM 015981), CAMK2B (NM 001220), CAMK2D (NM 001221), CAMK2G (NM 001222), CAMK4 (NM 001744), CAMKK1 (NM 032294), CAMKK2 (NM 006549), CASK (NM 003688), CCRK (NM 012119), CDC2 (NM 001786), CDC2L1 (NM 001787), CDC2L5 (NM 003718), CDC42BPA (NM 014826), CDC42BPB (NM 006035), CDC7L1 (NM 003503), CDK10 (NM 003674), CDK11 (NM 015076), CDK2 (NM 001798), CDK3 (NM 001258), CDK4 (NM 000075), CDK5 (NM 004935), CDK6 (NM 001259), CDK7 (NM 001799), CDK8 (NM 001260), CDK9 (NM 001261), CDKL1 (NM 004196), CDKL2 (NM 003948), CDKL3 (NM 016508), CDKL4 (NM 001009565), CDKL5 (NM 003159), CHEK1 (NM 001274), CHUK (NM 001278), CIT (NM 007174), CLK1 (NM 004071), CLK2 (NM 003993), CLK3 (NM 003992), CLK4 (NM 020666), CRK7 (NM 016507), CSF1 R (NM 00521 1), CSK (NM 004383), CSNK1 A1 (NM 001892), CSNK1 D (NM 001893), CSNK1 E (NM 001894), CSNK1 G1 (NM 022048), CSNK1 G2 (NM 001319), CSNK1 G3 (NM 004384), CSNK2A1 (NM 001895), CSNK2A2 (NM 001896), DAPK1 (NM 004938), DAPK2 (NM 014326), DAPK3 (NM 001348), DCAMKL1 (NM 004734), DCAMKL2 (NM 152619), DCAMKL3 (XM 047355), DDR1 (NM 013993), DDR2 (NM 006182), DMPK (NM 004409), DMPK2 (NM 017525.1), DYRK1 A (NM 001396), DYRK1 B (NM 006484), DYRK2 (NM 006482), DYRK3 (NM 003582), DYRK4 (NM 003845), EEF2K (NM 013302), EGFR (NM 005228), EIF2AK3 (NM 004836), EIF2AK4 (NM_001013703), EPHA1 (NM 005232), EPHA10 (NM 001004338), EPHA2 (NM 004431), EPHA3 (NM 005233), EPHA4 (NM 004438), EPHA5 (NM 004439), EPHA6 (XM 114973), EPHA7 (NM 004440), EPHA8 (NM 020526), EPHB1 (NM 004441), EPHB2 (NM 017449), EPHB3 (NM 004443), EPHB4 (NM 004444), EPHB6 (NM 004445), ERBB2 (NM 004448), ERBB3 (NM 001982), ERBB4 (NM 005235), ERK8 (NM 139021), ERN1 (NM 001433), ERN2 (NM 033266), FASTK (NM 025096), FER (NM 005246), FES (NM 002005), FGFR1 (NM 000604), FGFR2 (NM 022970), FGFR3 (NM 000142), FGFR4 (NM 022963), FGR (NM 005248), FLJ23074 (NM 025052), FLJ23119 (NM 024652), FLJ23356 (NM 032237), FLT1 (NM 002019), FLT3 (NM 0041 19), FLT4 (NM 002020), FRAP1 (NM 004958), FRK (NM 002031), FYN (NM 002037), GAK (NM 005255), GPRK5 (NM 005308), GPRK6 (NM 002082), GPRK7 (NM 139209), GRK4 (NM 005307), GSG2 (NM 031965), GSK3A (NM 019884), GSK3B (NM 002093), GUCY2C (NM 004963), GUCY2D (NM 000180), GUCY2F (NM 001522), H11 (NM 014365), HAK (NM 052947), HCK (NM 0021 10), HIPK1 (NM 152696), HIPK2 (NM 022740), HIPK3 (NM 005734), HIPK4 (NM 144685), HRI (NM 014413), HUNK (NM 014586), ICK (NM 016513), IGF1 R (NM 000875), IKBKB (NM 001556), IKBKE (NM 014002), ILK (NM 004517), INSR (NM 000208), INSRR (NM 014215), IRAKI (NM 001569), IRAK2 (NM 001570), IRAK3 (NM 007199), IRAK4 (NM 016123), ITK (NM 005546), JAK1 (NM 002227), JAK2 (NM 004972), JAK3 (NM 000215), KDR (NM 002253), KIS (NM 144624), KIT (NM 000222), KSR (XM 290793), KSR2 (NM 173598), LAK (NM 025144), LATS1 (NM 004690), LATS2 (NM 014572), LCK (NM 005356), LIMK1 (NM 016735), LIMK2 (NM 005569), LMR3 (XM 055866), LMTK2 (NM 014916), LOC149420 (NM 152835), LOC51086 (NM 015978), LRRK2 (XM 058513), LTK (NM 002344), LYN (NM 002350), MAK (NM 005906), MAP2K1 (NM 002755), MAP2K2 (NM 030662), MAP2K3 (NM 002756), MAP2K4 (NM 003010), MAP2K5 (NM 002757), MAP2K6 (NM 002758), MAP2K7 (NM 005043), MAP3K1 (XM 042066), MAP3K10 (NM 002446), MAP3K1 1 (NM 002419), MAP3K12 (NM 006301), MAP3K13 (NM 004721), MAP3K14 (NM 003954), MAP3K2 (NM 006609), MAP3K3 (NM 002401), MAP3K4 (NM 005922), MAP3K5 (NM 005923), MAP3K6 (NM 004672), MAP3K7 (NM 003188), MAP3K8 (NM 005204), MAP3K9 (NM 033141), MAP4K1 (NM 007181), MAP4K2 (NM 004579), MAP4K3 (NM 003618), MAP4K4 (NM 145686), MAP4K5 (NM 006575), MAPK1 (NM 002745), MAPK10 (NM 002753), MAPK11 (NM 002751), MAPK12 (NM 002969), MAPK13 (NM 002754), MAPK14 (NM 001315), MAPK3 (NM 002746), MAPK4 (NM 002747), MAPK6 (NM 002748), MAPK7 (NM 002749), MAPK8 (NM 002750), MAPK9 (NM 002752), MAPKAPK2 (NM 032960), MAPKAPK3 (NM 004635), MAPKAPK5 (NM 003668), MARK (NM 018650), MARK2 (NM 017490), MARK3 (NM 002376), MARK4 (NM 031417), MAST1 (NM 014975), MAST205 (NM 0151 12), MAST3 (XM 038150), MAST4 (XM 291 141), MASTL (NM 032844), MATK (NM 139355), MELK (NM 014791), MERTK (NM 006343), MET (NM 000245), MGC33182 (NM 145203), MGC42105 (NM 153361), MGC43306 (C9orf96), MGC8407 (NM 024046), MIDORI (NM 020778), MINK (NM 015716), MKNK1 (NM 003684), MKNK2 (NM 017572), MLCK (NM 182493), MLK4 (NM 032435), MLKL (NM 152649), MOS (NM 005372), MST1 R (NM 002447), MST4 (NM 016542), MUSK (NM 005592), MYLK (NM 053025), MYLK2 (NM 0331 18), MYO3A (NM 017433), MYO3B (NM 138995), NEK1 (NM 012224), NEK10 (NM 152534), NEK11 (NM 024800), NEK2 (NM 002497), NEK3 (NM 002498), NEK4 (NM 003157), NEK5 (MGC75495), NEK6 (NM 014397), NEK7 (NM 133494), NEK8 (NM 178170), NEK9 (NM 0331 16), NLK (NM 016231), NPR1 (NM 000906), NPR2 (NM 003995), NRBP (NM 013392), NRBP2 (NM 178564), NRK (NM 198465), NTRK1 (NM 002529), NTRK2 (NM 006180), NTRK3 (NM 002530), OBSCN (NM 052843), OSR1 (NM 005109), PACE-1 (NM 020423), PAK1 (NM 002576), PAK2 (NM 002577), PAK3 (NM 002578), PAK4 (NM 005884), PAK6 (NM 020168), PAK7 (NM 020341), PASK (NM 015148), PCTK1 (NM 006201), PCTK2 (NM 002595), PCTK3 (NM 212503), PDGFRA (NM 006206), PDGFRB (NM 002609), PDK1 (NM 002610), PDK2 (NM 00261 1), PDK3 (NM 005391), PDK4 (NM 002612), PDPK1 (NM 002613), PFTK1 (NM 012395), PHKG1 (NM 006213), PHKG2 (NM 000294), PIK3R4 (NM 014602), PIM1 (NM 002648), PIM2 (NM 006875), PIM3 (NM 001001852), PINK1 (NM 032409), PKE (NM 173575), PKMYT1 (NM 004203), pknβ (NM 013355), PLK (NM 005030), PLK3 (NM 004073), PRKAA1 (NM 006251), PRKAA2 (NM 006252), PRKACA (NM 002730), PRKACB (NM 002731), PRKACG (NM 002732), PRKCA (NM 002737), PRKCB1 (NM 002738), PRKCD (NM 006254), PRKCE (NM 005400), PRKCG (NM 002739), PRKCH (NM 006255), PRKCI (NM 002740), PRKCL1 (NM 002741), PRKCL2 (NM 006256), PRKCM (NM 002742), PRKCN (NM 005813), PRKCQ (NM 006257), PRKCZ (NM 002744), PRKD2 (NM 016457), PRKDC (NM 006904), PRKG1 (NM 006258), PRKG2 (NM 006259), PRKR (NM 002759), PRKWNK1 (NM 018979), PRKWNK2 (NM 006648), PRKWNK3 (NM 020922), PRKWNK4 (NM 032387), PRKX (NM 005044), PRKY (NM 002760), PRPF4B (NM 003913), PSKH1 (NM 006742), PSKH2 (NM 033126), PTK2 (NM 005607), PTK2B (NM 004103), PTK6 (NM 005975), PTK7 (NM 002821), PTK9 (NM 002822), PTK9L (NM 007284), PXK (NM 017771), QSK (NM 025164), RAD53 (NM 007194), RAF1 (NM 002880), RAGE (NM 014226), RET (NM 020975), RHOK (NM 002929), RIOK1 (NM 031480), RIOK2 (NM 018343), RIPK1 (NM 003804), RIPK2 (NM 003821), RIPK3 (NM 006871), RIPK5 (NM 015375), RNASEL (NM 021 133), ROCK1 (NM 005406), ROCK2 (NM 004850), ROR1 (NM 005012), ROR2 (NM 004560), ROS1 (NM 002944), RPS6KA1 (NM 002953), RPS6KA2 (NM 021 135), RPS6KA3 (NM 004586), RPS6KA4 (NM 003942), RPS6KA5 (NM 004755), RPS6KA6 (NM 014496), RPS6KB1 (NM 003161), RPS6KB2 (NM 003952), RPS6KC1 (NM 012424), RPS6KL1 (NM 031464), RYK (NM 002958), SBK (XM 370948), SCYL1 (NM 020680), SCYL2 (NM 017988), SGK (NM 005627), SgK069 (SU SgK069), SgK085 (XM 373109), SgK110 (SU SgK110), SGK2 (NM 016276), SgK223 (XM 291277), SgK269 (XM 370878), SgK424 (CGP SgK424), SgK493 (SU_SgK493), SgK494 (NM 144610), SgK495 (NM 032017), SGKL (NM 013257), SK681 (NM 001001671), SLK (NM 014720), SMG1 (NM 015092), SNARK (NM 030952), SNF1 LK (NM 173354), SNF1 LK2 (NM 015191), SNK (NM 006622), SNRK (NM 017719), SRC (NM 005417), SRMS (NM 080823), SRPK1 (NM 003137), SRPK2 (NM 003138), SSTK (NM 032037), STK10 (NM 005990), STK11 (NM 000455), STK16 (NM 003691), STK17A (NM 004760), STK17B (NM 004226), STK18 (NM 014264), STK19 (NM 032454), STK22B (NM 053006), STK22C (NM 052841), STK22D (NM 032028), STK23 (NM 014370), STK24 (NM 003576), STK25 (NM 006374), STK3 (NM 006281), STK31 (NM 031414), STK32B (NM 018401), STK33 (NM 030906), STK35 (NM 080836), STK36 (NM 015690), STK38 (NM 007271), STK38L (NM 015000), STK39 (NM 013233), STK4 (NM 006282), STLK5 (NM 001003787), STYK1 (NM 018423), SUDD (NM 003831), SYK (NM 003177), TAF1 (NM 138923), TAF1 L (NM 153809), TAO1 (NM 004783), TAOK1 (NM 020791), TAOK3 (NM 016281), TBCK (NM 0331 15), TBK1 (NM 013254), TEC (NM 003215), TEK (NM 000459), TESK1 (NM 006285), TESK2 (NM 007170), TEX14 (NM 031272), TGFBR1 (NM 004612), TGFBR2 (NM 003242), TIE (NM 005424), TIF1 (NM 003852), TLK1 (NM 012290), TLK2 (NM 006852), TNIK (NM 015028), TNK1 (NM 003985), TOPK (NM 018492), TP53RK (NM 033550), TRAD (NM 007064), TRIB1 (NM 025195), TRIB2 (NM 021643), TRIB3 (NM 021 158), TRIM28 (NM 005762), TRIM33 (NM 015906), TRIO (NM 0071 18), TRPM6 (NM 017662), TRPM7 (NM 017672), TRRAP (NM 003496), TSSK4 (NM 174944), TTBK1 (NM 032538), TTBK2 (NM 173500), TTK (NM 003318), TTN (NM 003319), TXK (NM 003328), TYK2 (NM 003331), TYRO3 (NM 006293), ULK1 (NM 003565), ULK2 (NM 014683), ULK3 (NM 015518), ULK4 (NM 017886), VRK1 (NM 003384), VRK2 (NM 006296), VRK3 (NM 016440), WEE1 (NM 003390), Wee1 B (NM 173677), YANK1 (NM 145001), YES1 (NM 005433), ZAK (NM 016653) та/або ZAP70 (NM 001079).
6. Мікроорганізм за будь-яким з пп. 1-5, у якому компонент (II) вибраний з групи, що складається з бактеріального токсину, ентеротоксину, екзотоксину, токсину типу I, токсину типу II, токсину типу III, токсину типу IV, токсину типу V, токсину RTX, токсину AB, токсину A-B, токсину A/B, токсину A+B, токсину A-5B та/або токсину AB5.
7. Мікроорганізм за п. 6, у якому компонент (II) вибраний із групи, що складається з токсину аденилатциклази, токсину сибірської виразки, токсину сибірської виразки (EF), токсину сибірської виразки (LF), ботулінічного токсину, холерного токсину (CT, Ctx), субодиниці холерного токсину B (CTB, CtxB), дифтерійного токсину (DT, Dtx), токсину E. coli LT, термолабільного ентеротоксину E. coli (LT), субодиниці В термолабільного ентеротоксину E. coli (LTB), токсину E. coli ST, термостабільного ентеротоксину E. coli (ST), еритрогенного токсину, токсину ексфоліатину, екзотоксину A, ентеротоксину Perfringens, токсину коклюшу (PT, Ptx), шига-токсину (ST, Stx), субодиниці В шига-токсину (STB, StxB), шига-подібного токсину, ентеротоксинів Staphylococcus, правцевого токсину (TT), токсину синдрому токсичного шоку (TSST-1), веро-токсину (VT), токсину A (TA) і токсину B (TB) Clostridium difficile, летального токсину (LT) і геморагічного токсину (HT) Clostridium sordellii, α -токсину (AT) Clostridium novyi.
8. Мікроорганізм за будь-яким з пп. 1-7, у якому компонент (I) і компонент (II) зв'язані один з одним, щоб забезпечити можливість експресії та/або секреції злитого білка, який кодується обома компонентами.
9. Мікроорганізм за п. 8, у якому злитий білок вибраний з групи, що складається з CtxB-PSA, CtxB-B-Raf V600E KD, CtxB-домен кінази B-Raf V600E, CtxB-домен кінази KD B-Raf V600E, CtxB-B-Raf, CtxB-B-Raf KD, CtxB-домен кінази KD B-Raf, CtxB-HA1, CtxB-HA12C.
10. Мікроорганізм за будь-яким з пп. 1-9, у якому компонент (III) a) вибраний із групи, що складається з системи секреції типу I, системи секреції типу II, системи секреції типу III, системи секреції типу IV, системи секреції типу V, гемолізинової системи транспорту (сигналу) Escherichia coli (нуклеотидні послідовності, що включають HlyA, HlyB і HlyD під контролем hly-специфічного промотору), гемолізинової системи транспорту (сигналу) Escherichia coli (нуклеотидних послідовностей, що включають HlyA, HlyB і HlyD під контролем не-hly-специфічного бактеріального промотору), транспортного сигналу для білка S-Шару (Rsa A) Caulobacter crescentus, транспортного сигналу для білка ToIC Escherichia coli, сигналу секреції Vtgss та/або сигналів секреції, виділених з лістеріолізину, p60 та/або ActA і причому компонент (III) b) вибраний із групи, що складається з ендолізинів, літичного білка грампозитивних бактерій, літичного білка Listeria monocytogenes, PLY551 Listeria monocytogenes та/або холіну Listeria monocytogenes.
11. Мікроорганізм за п. 10, у якому компонент (III) a) являє собою щонайменше одну нуклеотидну послідовність, що кодує тільки одну транспортну систему, що забезпечує можливість супутньої експресії продуктів експресії компонента (I) і компонента (II) на зовнішній поверхні мікроорганізму та/або забезпечує можливість супутньої секреції продуктів експресії компонента (I) і компонента (II), причому даний компонент (III) a) переважно являє собою принаймні одну нуклеотидну послідовність, що кодує гемолізинову транспортну систему (сигнал) Escherichia coli (нуклеотидні послідовності, що включають HlyA, HlyB і HlyD під контролем hly-специфічного промотору) або гемолізинову транспортну систему (сигнал) Escherichia coli (нуклеотидні послідовності, що включають HlyA, HlyB і HlyD під контролем не-hly-специфічного бактеріального промотору).
12. Мікроорганізм за будь-яким з пп. 1-11, у якому відповідно до компонента (III) a) продукти експресії компонентів (I) і компонента (II) секретуються.
13. Мікроорганізм за будь-яким з пп. 1-12, у якому
компонент (I) вибраний із групи, що складається з B-Raf V600E, домену кінази B-Raf V600E, B-Raf V600E KD, домену кінази KD B-Raf V600E, B-Raf KD, домену кінази B-Raf, домену кінази KD B-Raf, простатаспецифічного антигену (PSA), гемаглютиніну HA1 (переважно з вірусу грипу А (A/Thailand/1 (KAN-1)2004(H5N1), гемаглютиніну HA12 (переважно з вірусу грипу А (A/Thailand/1 (KAN-1)2004(H5N1), гемаглютиніну HA12C (переважно з вірусу грипу А (A/Thailand/1 (KAN-1)2004(H5N1);
компонент (II) вибраний із групи, що складається з субодиниці В холерного токсину (CTB, CtxB), субодиниці В термолабільного ентеротоксину E. coli (LTB), правцевого токсину (TT);
компонент (III) a) вибраний із групи, що складається з сигналу гемолізинового транспорту HlyA Escherichia coli разом з компонентами системи секреції Hly (нуклеотидними послідовностями, що включають HlyA, HlyB і HlyD під контролем hly-специфічного промотору);
компонент (IV) вибраний із групи, що складається з ендогенного промотору локусу hly E. coli,
причому компонент (I) і компонент (II) зв'язані один з одним, щоб забезпечити можливість експресії злитого білка, який кодується обома компонентами й при цьому злитий білок секретується.
14. Фармацевтична композиція, що включає щонайменше один мікроорганізм, переважно щонайменше один ліофілізований мікроорганізм, за будь-яким з пп. 1-13 і фармацевтично прийнятний носій, переважно капсули.
15. Лікарський засіб, що включає щонайменше один мікроорганізм за будь-яким з пп. 1-13 або щонайменше одну фармацевтичну композицію за п. 14.
16. Застосування мікроорганізму за будь-яким з пп. 1-13 для одержання лікарського засобу для лікування та/або профілактики фізіологічних та/або патофізіологічних станів, вибраних із групи, що складається з неконтрольованого розподілу клітин, злоякісних пухлин, доброякісних пухлин, солідних пухлин, сарком, карцином, гіперпроліферативних порушень, карциноїдів, сарком Евінга, сарком Капоші, пухлин головного мозку, пухлин, що походять з головного мозку та/або нервової системи, та/або мозкових оболонок, гліом, нейробластом, раку шлунка, раку нирки, карциноми ниркових клітин, раку простати, карцином простати, пухлин сполучних тканин, сарком м'яких тканин, пухлин підшлункової залози, пухлин печінки, пухлин голови, пухлин шиї, раку стравоходу, раку щитовидної залози, остеосарком, ретинобластом, тимоми, раку яєчка, раку легені, бронхіальних карцином, раку молочної залози, карцином молочної залози, раку кишки, колоректальних пухлин, карцином товстої кишки, карцином прямої кишки, гінекологічних пухлин, пухлин яєчника/оваріальних пухлин, раку матки, раку шийки матки, карцином шийки матки, раку тіла матки, карцином тіла, ендометріальних карцином, раку сечового міхура, раку порожнини, раку шкіри, базаліом, спіналіом, меланом, внутріочних меланом, лейкозу, хронічного лейкозу, гострого лейкозу, лімфом, інфекції, вірусної або бактеріальної інфекції, грипу, хронічного запалення, відторгнення органа та/або аутоімунних захворювань.
17. Плазміда або вектор експресії, що включає компоненти (I)-(IV) за будь-яким з пп. 1-13.
18. Спосіб одержання мікроорганізму за будь-яким з пп. 1-13, у якому
одержують плазміду або вектор експресії за п. 17, і
трансформують мікроорганізм даною плазмідою або вектором експресії.
19. Фармацевтичний набір, що включає щонайменше один мікроорганізм за будь-яким з пп. 1-13 і фармакологічно прийнятний буфер, переважно карбонатний буфер.
Текст
1. Мікроорганізм як носій нуклеотидних послідовностей, що кодують антигени та білкові токсини, який включає наступні компоненти: (I) щонайменше одну нуклеотидну послідовність, що кодує щонайменше один повний або частковий антиген з щонайменше одного білка дикого типу або мутантного білка; (II) щонайменше одну нуклеотидну послідовність, що кодує щонайменше один білковий токсин та/або щонайменше одну субодиницю білкового токсину; і (III) a) щонайменше одну нуклеотидну послідовність, що кодує щонайменше одну систему транспорту, що забезпечує можливість експресії продуктів експресії компонента (I) і компонента (II) на зовнішній поверхні мікроорганізму та/або забезпечує можливість секреції продуктів експресії компонента (I) і компонента (II); та/або кодує принаймні одну сигнальну послідовність, що забезпечує можливість секреції продуктів експресії компонента (I) і компонента (II); та/або 94974 4 b) необов'язково щонайменше одну нуклеотидну послідовність, що кодує щонайменше один білок для лізису мікроорганізму в цитозолі клітин ссавців і для внутрішньоклітинного вивільнення плазмід або векторів експресії, які утримуються в лізованому мікроорганізмі, і (IV) щонайменше одну нуклеотидну послідовність для щонайменше однієї послідовності активації для експресії одного або більше компонентів (I)(III), причому зазначена послідовність активації може бути активована в мікроорганізмі та/або є специфічною для клітини тканини, специфічною для пухлинної клітини, макрофаг-специфічною, дендрит-специфічною, лімфоцит-специфічною, функціє-специфічною або неспецифічною відносно клітини; причому кожен з компонентів (I)-(IV) може бути присутнім або один, або кілька разів і, якщо компонент із компонентів (I)-(IV) присутній кілька разів, він може незалежно від інших бути ідентичним або відрізнятися; та компонент (I) і компонент (II) неідентичні, тобто компонент (I) не кодує щонайменше одну нуклеотидну послідовність, що кодує щонайменше один білковий токсин та/або щонайменше одну субодиницю білкового токсину. 2. Мікроорганізм за п. 1, у якому мікроорганізм вибраний із групи, що складається з бактерії, грампозитивної бактерії, грамнегативної бактерії, еукаріотичної клітини; і переважно вибраний із групи, що складається з Escherichia spp., Escherichia coli, Salmonella spp., Salmonella typhi, Salmonella typhimurium, Yersinia spp., Yersinia enterocolitica, Vibrio spp., Vibrio cholerae, Listeria spp., Listeria monocytogenes, Shigella spp., Shigella flexneri, Yersinia spp., Pseudomonas spp., при цьому переважно, коли вірулентність мікроорганізму послаблена. 3. Мікроорганізм за п. 2, у якому Vibrio cholerae виключений як мікроорганізм. 4. Мікроорганізм за будь-яким з пп. 1-3, у якому щонайменше один повний або частковий антиген щонайменше одного білка дикого типу або мутантного білка, що відповідає компоненту (I), вибраний із групи, що складається з наступних білків дикого типу і їх відомих мутантів: рецептор; позаклітинна, трансмембранна або внутрішньоклітинна частина рецептора; молекула адгезії; позаклітинна, трансмембранна або внутрішньоклітинна частина молекули адгезії; білок сигнальної трансдукції; білок клітинного циклу; фактор транскрипції; білок диференціювання; ембріональний білок; вірусний білок; алерген; білок мікробного патогену; білок еукаріотичного патогену; білок антигену раку яєчка; білок пухлинного антигену та/або специфічний білок клітини тканини, причому клітина тканини вибрана із групи, що складається з щитовидної залози, молочної залози, слинної залози, лімфатичного вузла, слизової оболонки шлунка, нирки, яєчника, простати, шийки матки, серозної оболонки сечового міхура і невусу. 5. Мікроорганізм за п. 4, у якому щонайменше один повний або частковий антиген щонайменше одного білка дикого типу або мутантного білка, що відповідає компоненту (I), вибраний із групи, що 5 складається з наступних білків дикого типу і їх відомих мутантів: Her-2/neu, андрогенний рецептор, естрогенний рецептор, midkine-рецептор, рецептор EGF, рецептор ERBB2, ERBB4, рецептор TRAIL, FAS, рецептор TNFα, рецептор TGF-β, лактофериновий рецептор, основний мієлін, αлактальбумін, GFAP, фібрилярний кислий білок, тирозиназа, EGR-1, MUC1, c-Raf (Raf-1), A-Raf, BRaf, B-Raf V599E, B-Raf V600E, B-Raf KD, домен кінази B-Raf V600E, B-Raf V600E KD, домен кінази KD B-Raf V600E, домен кінази B-Raf, домен кінази KD B-Raf, N-Ras, K-Ras, H-Ras, Bcl-2, Bcl-X, Bcl-W, Bfl-1, Brag-1, Mcl-1, A1, Bax, BAD, Bak, Bcl-Xs, Bid, Bik, Hrk, Bcr/abl, Myb, C-Met, IAP1, IAO2, XIAP, MLIAP LIVIN, сурвивін, APAF-1, циклін D(1-3), циклін E, циклін A, циклін B, циклін H, Cdk-1, Cdk-2, Cdk4, Cdk-6, Cdk-7, Cdc25C, p16, p15, p21, p27, p18, pRb, p107, p130, E2F(1-5), GAAD45, MDM2, PCNA, ARF, PTEN, APC, BRCA, Akt, PI3K, mTOR, p53 і гомологи, C-Myc, NFkB, c-Jun, ATF-2, Sp1, простатаспецифічний антиген (PSA), карциноембріональний антиген, α-фетопротеїн, PAP; PSMA; STEAP; MAGE, MAGE-1, MAGE-3, NY-ESO-1, PSCA, MART, Gp100, тирозиназа, GRP, TCF-4, вірусні антигени вірусів ВІЛ, HPV, HCV, HPV, EBV, CMV, HSV, вірусу грипу, вірусу грипу типу A, вірусу грипу типу A (H5N1) і (H3N2), вірусу грипу типу B, вірусу грипу типу C; гемаглютинінів, гемаглютиніну H1, гемаглютиніну H5, гемаглютиніну H7, гемаглютиніну HA1 (переважно з вірусу грипу А (A/Thailand/1 (KAN-1)2004(H5N1), гемаглютиніну HA12 (переважно з вірусу грипу А (A/Thailand/1 (KAN-1)2004(H5N1), гемаглютиніну HA12C (переважно з вірусу грипу А (A/Thailand/1 (KAN1)2004(H5N1), нейрамідази, p60, LLO, уреази, CSP, калфлагіну та/або CPB, або в якому щонайменше один повний або частковий антиген щонайменше одного білка дикого типу або мутантного білка, що відповідає компоненту (I), вибраний із групи кіназ, що складається з наступних білків дикого типу і їх відомих мутантів (реєстраційні номери приводять у дужках): AAK1 (NM 014911), AATK (NM 004920), ABL1 (NM 005157), ABL2 (NM 005158), ACK1 (NM 005781), ACVR1 (NM 001105), ACVR1B (NM 020328), ACVR2 (NM 001616), ACVR2B (NM 001106), ACVRL1 (NM 000020), ADCK1 (NM 020421), ADCK2 (NM 052853), ADCK4 (NM 024876), ADCK5 (NM 174922), ADRBK1 (NM 001619), ADRBK2 (NM 005160), AKT1 (NM 005163), AKT2 (NM 001626), AKT3 (NM 005465), ALK (NM 004304), ALK7 (NM 145259), ALS2CR2 (NM 018571), ALS2CR7 (NM 139158), AMHR2 (NM 020547), ANKK1 (NM 178510), ANKRD3 (NM 020639), APEG1 (NM 005876), ARAF (NM 001654), ARK5 (NM 014840), ATM (NM 000051), ATR (NM 001184), AURKA (NM 003600), AURKB (NM 004217), AURKC (NM 003160), AXL (NM 001699), BCKDK (NM 005881), BCR (NM 004327), BIKE (NM 017593), BLK (NM 001715), BMPR1 A (NM 004329), BMPR1 B (NM 001203), BMPR2 (NM 001204), BMX (NM 001721), BRAF (NM 004333), BRD2 (NM 005104), BRD3 (NM 007371), BRD4 (NM 014299), BRDT (NM 001726), BRSK1 (NM 032430), BRSK2 (NM 003957), BTK (NM 000061), BUB1 (NM 004336), BUB1 B (NM 001211), CABC1 (NM 94974 6 020247), CAMK1 (NM 003656), CaMK1b (NM 198452), CAMK1D (NM 020397), CAMK1G (NM 020439), CAMK2A (NM 015981), CAMK2B (NM 001220), CAMK2D (NM 001221), CAMK2G (NM 001222), CAMK4 (NM 001744), CAMKK1 (NM 032294), CAMKK2 (NM 006549), CASK (NM 003688), CCRK (NM 012119), CDC2 (NM 001786), CDC2L1 (NM 001787), CDC2L5 (NM 003718), CDC42BPA (NM 014826), CDC42BPB (NM 006035), CDC7L1 (NM 003503), CDK10 (NM 003674), CDK11 (NM 015076), CDK2 (NM 001798), CDK3 (NM 001258), CDK4 (NM 000075), CDK5 (NM 004935), CDK6 (NM 001259), CDK7 (NM 001799), CDK8 (NM 001260), CDK9 (NM 001261), CDKL1 (NM 004196), CDKL2 (NM 003948), CDKL3 (NM 016508), CDKL4 (NM 001009565), CDKL5 (NM 003159), CHEK1 (NM 001274), CHUK (NM 001278), CIT (NM 007174), CLK1 (NM 004071), CLK2 (NM 003993), CLK3 (NM 003992), CLK4 (NM 020666), CRK7 (NM 016507), CSF1 R (NM 00521 1), CSK (NM 004383), CSNK1 A1 (NM 001892), CSNK1 D (NM 001893), CSNK1 E (NM 001894), CSNK1 G1 (NM 022048), CSNK1 G2 (NM 001319), CSNK1 G3 (NM 004384), CSNK2A1 (NM 001895), CSNK2A2 (NM 001896), DAPK1 (NM 004938), DAPK2 (NM 014326), DAPK3 (NM 001348), DCAMKL1 (NM 004734), DCAMKL2 (NM 152619), DCAMKL3 (XM 047355), DDR1 (NM 013993), DDR2 (NM 006182), DMPK (NM 004409), DMPK2 (NM 017525.1), DYRK1 A (NM 001396), DYRK1 B (NM 006484), DYRK2 (NM 006482), DYRK3 (NM 003582), DYRK4 (NM 003845), EEF2K (NM 013302), EGFR (NM 005228), EIF2AK3 (NM 004836), EIF2AK4 (NM_001013703), EPHA1 (NM 005232), EPHA10 (NM 001004338), EPHA2 (NM 004431), EPHA3 (NM 005233), EPHA4 (NM 004438), EPHA5 (NM 004439), EPHA6 (XM 114973), EPHA7 (NM 004440), EPHA8 (NM 020526), EPHB1 (NM 004441), EPHB2 (NM 017449), EPHB3 (NM 004443), EPHB4 (NM 004444), EPHB6 (NM 004445), ERBB2 (NM 004448), ERBB3 (NM 001982), ERBB4 (NM 005235), ERK8 (NM 139021), ERN1 (NM 001433), ERN2 (NM 033266), FASTK (NM 025096), FER (NM 005246), FES (NM 002005), FGFR1 (NM 000604), FGFR2 (NM 022970), FGFR3 (NM 000142), FGFR4 (NM 022963), FGR (NM 005248), FLJ23074 (NM 025052), FLJ23119 (NM 024652), FLJ23356 (NM 032237), FLT1 (NM 002019), FLT3 (NM 0041 19), FLT4 (NM 002020), FRAP1 (NM 004958), FRK (NM 002031), FYN (NM 002037), GAK (NM 005255), GPRK5 (NM 005308), GPRK6 (NM 002082), GPRK7 (NM 139209), GRK4 (NM 005307), GSG2 (NM 031965), GSK3A (NM 019884), GSK3B (NM 002093), GUCY2C (NM 004963), GUCY2D (NM 000180), GUCY2F (NM 001522), H11 (NM 014365), HAK (NM 052947), HCK (NM 0021 10), HIPK1 (NM 152696), HIPK2 (NM 022740), HIPK3 (NM 005734), HIPK4 (NM 144685), HRI (NM 014413), HUNK (NM 014586), ICK (NM 016513), IGF1 R (NM 000875), IKBKB (NM 001556), IKBKE (NM 014002), ILK (NM 004517), INSR (NM 000208), INSRR (NM 014215), IRAKI (NM 001569), IRAK2 (NM 001570), IRAK3 (NM 007199), IRAK4 (NM 016123), ITK (NM 005546), JAK1 (NM 002227), JAK2 (NM 004972), JAK3 (NM 000215), KDR (NM 002253), KIS (NM 144624), KIT (NM 000222), KSR (XM 290793), KSR2 (NM 7 173598), LAK (NM 025144), LATS1 (NM 004690), LATS2 (NM 014572), LCK (NM 005356), LIMK1 (NM 016735), LIMK2 (NM 005569), LMR3 (XM 055866), LMTK2 (NM 014916), LOC149420 (NM 152835), LOC51086 (NM 015978), LRRK2 (XM 058513), LTK (NM 002344), LYN (NM 002350), MAK (NM 005906), MAP2K1 (NM 002755), MAP2K2 (NM 030662), MAP2K3 (NM 002756), MAP2K4 (NM 003010), MAP2K5 (NM 002757), MAP2K6 (NM 002758), MAP2K7 (NM 005043), MAP3K1 (XM 042066), MAP3K10 (NM 002446), MAP3K1 1 (NM 002419), MAP3K12 (NM 006301), MAP3K13 (NM 004721), MAP3K14 (NM 003954), MAP3K2 (NM 006609), MAP3K3 (NM 002401), MAP3K4 (NM 005922), MAP3K5 (NM 005923), MAP3K6 (NM 004672), MAP3K7 (NM 003188), MAP3K8 (NM 005204), MAP3K9 (NM 033141), MAP4K1 (NM 007181), MAP4K2 (NM 004579), MAP4K3 (NM 003618), MAP4K4 (NM 145686), MAP4K5 (NM 006575), MAPK1 (NM 002745), MAPK10 (NM 002753), MAPK11 (NM 002751), MAPK12 (NM 002969), MAPK13 (NM 002754), MAPK14 (NM 001315), MAPK3 (NM 002746), MAPK4 (NM 002747), MAPK6 (NM 002748), MAPK7 (NM 002749), MAPK8 (NM 002750), MAPK9 (NM 002752), MAPKAPK2 (NM 032960), MAPKAPK3 (NM 004635), MAPKAPK5 (NM 003668), MARK (NM 018650), MARK2 (NM 017490), MARK3 (NM 002376), MARK4 (NM 031417), MAST1 (NM 014975), MAST205 (NM 0151 12), MAST3 (XM 038150), MAST4 (XM 291 141), MASTL (NM 032844), MATK (NM 139355), MELK (NM 014791), MERTK (NM 006343), MET (NM 000245), MGC33182 (NM 145203), MGC42105 (NM 153361), MGC43306 (C9orf96), MGC8407 (NM 024046), MIDORI (NM 020778), MINK (NM 015716), MKNK1 (NM 003684), MKNK2 (NM 017572), MLCK (NM 182493), MLK4 (NM 032435), MLKL (NM 152649), MOS (NM 005372), MST1 R (NM 002447), MST4 (NM 016542), MUSK (NM 005592), MYLK (NM 053025), MYLK2 (NM 0331 18), MYO3A (NM 017433), MYO3B (NM 138995), NEK1 (NM 012224), NEK10 (NM 152534), NEK11 (NM 024800), NEK2 (NM 002497), NEK3 (NM 002498), NEK4 (NM 003157), NEK5 (MGC75495), NEK6 (NM 014397), NEK7 (NM 133494), NEK8 (NM 178170), NEK9 (NM 0331 16), NLK (NM 016231), NPR1 (NM 000906), NPR2 (NM 003995), NRBP (NM 013392), NRBP2 (NM 178564), NRK (NM 198465), NTRK1 (NM 002529), NTRK2 (NM 006180), NTRK3 (NM 002530), OBSCN (NM 052843), OSR1 (NM 005109), PACE-1 (NM 020423), PAK1 (NM 002576), PAK2 (NM 002577), PAK3 (NM 002578), PAK4 (NM 005884), PAK6 (NM 020168), PAK7 (NM 020341), PASK (NM 015148), PCTK1 (NM 006201), PCTK2 (NM 002595), PCTK3 (NM 212503), PDGFRA (NM 006206), PDGFRB (NM 002609), PDK1 (NM 002610), PDK2 (NM 00261 1), PDK3 (NM 005391), PDK4 (NM 002612), PDPK1 (NM 002613), PFTK1 (NM 012395), PHKG1 (NM 006213), PHKG2 (NM 000294), PIK3R4 (NM 014602), PIM1 (NM 002648), PIM2 (NM 006875), PIM3 (NM 001001852), PINK1 (NM 032409), PKE (NM 173575), PKMYT1 (NM 004203), pknβ (NM 013355), PLK (NM 005030), PLK3 (NM 004073), PRKAA1 (NM 006251), PRKAA2 (NM 006252), PRKACA (NM 002730), PRKACB (NM 94974 8 002731), PRKACG (NM 002732), PRKCA (NM 002737), PRKCB1 (NM 002738), PRKCD (NM 006254), PRKCE (NM 005400), PRKCG (NM 002739), PRKCH (NM 006255), PRKCI (NM 002740), PRKCL1 (NM 002741), PRKCL2 (NM 006256), PRKCM (NM 002742), PRKCN (NM 005813), PRKCQ (NM 006257), PRKCZ (NM 002744), PRKD2 (NM 016457), PRKDC (NM 006904), PRKG1 (NM 006258), PRKG2 (NM 006259), PRKR (NM 002759), PRKWNK1 (NM 018979), PRKWNK2 (NM 006648), PRKWNK3 (NM 020922), PRKWNK4 (NM 032387), PRKX (NM 005044), PRKY (NM 002760), PRPF4B (NM 003913), PSKH1 (NM 006742), PSKH2 (NM 033126), PTK2 (NM 005607), PTK2B (NM 004103), PTK6 (NM 005975), PTK7 (NM 002821), PTK9 (NM 002822), PTK9L (NM 007284), PXK (NM 017771), QSK (NM 025164), RAD53 (NM 007194), RAF1 (NM 002880), RAGE (NM 014226), RET (NM 020975), RHOK (NM 002929), RIOK1 (NM 031480), RIOK2 (NM 018343), RIPK1 (NM 003804), RIPK2 (NM 003821), RIPK3 (NM 006871), RIPK5 (NM 015375), RNASEL (NM 021 133), ROCK1 (NM 005406), ROCK2 (NM 004850), ROR1 (NM 005012), ROR2 (NM 004560), ROS1 (NM 002944), RPS6KA1 (NM 002953), RPS6KA2 (NM 021 135), RPS6KA3 (NM 004586), RPS6KA4 (NM 003942), RPS6KA5 (NM 004755), RPS6KA6 (NM 014496), RPS6KB1 (NM 003161), RPS6KB2 (NM 003952), RPS6KC1 (NM 012424), RPS6KL1 (NM 031464), RYK (NM 002958), SBK (XM 370948), SCYL1 (NM 020680), SCYL2 (NM 017988), SGK (NM 005627), SgK069 (SU SgK069), SgK085 (XM 373109), SgK110 (SU SgK110), SGK2 (NM 016276), SgK223 (XM 291277), SgK269 (XM 370878), SgK424 (CGP SgK424), SgK493 (SU_SgK493), SgK494 (NM 144610), SgK495 (NM 032017), SGKL (NM 013257), SK681 (NM 001001671), SLK (NM 014720), SMG1 (NM 015092), SNARK (NM 030952), SNF1 LK (NM 173354), SNF1 LK2 (NM 015191), SNK (NM 006622), SNRK (NM 017719), SRC (NM 005417), SRMS (NM 080823), SRPK1 (NM 003137), SRPK2 (NM 003138), SSTK (NM 032037), STK10 (NM 005990), STK11 (NM 000455), STK16 (NM 003691), STK17A (NM 004760), STK17B (NM 004226), STK18 (NM 014264), STK19 (NM 032454), STK22B (NM 053006), STK22C (NM 052841), STK22D (NM 032028), STK23 (NM 014370), STK24 (NM 003576), STK25 (NM 006374), STK3 (NM 006281), STK31 (NM 031414), STK32B (NM 018401), STK33 (NM 030906), STK35 (NM 080836), STK36 (NM 015690), STK38 (NM 007271), STK38L (NM 015000), STK39 (NM 013233), STK4 (NM 006282), STLK5 (NM 001003787), STYK1 (NM 018423), SUDD (NM 003831), SYK (NM 003177), TAF1 (NM 138923), TAF1 L (NM 153809), TAO1 (NM 004783), TAOK1 (NM 020791), TAOK3 (NM 016281), TBCK (NM 0331 15), TBK1 (NM 013254), TEC (NM 003215), TEK (NM 000459), TESK1 (NM 006285), TESK2 (NM 007170), TEX14 (NM 031272), TGFBR1 (NM 004612), TGFBR2 (NM 003242), TIE (NM 005424), TIF1 (NM 003852), TLK1 (NM 012290), TLK2 (NM 006852), TNIK (NM 015028), TNK1 (NM 003985), TOPK (NM 018492), TP53RK (NM 033550), TRAD (NM 007064), TRIB1 (NM 025195), TRIB2 (NM 021643), TRIB3 (NM 021 158), TRIM28 (NM 9 005762), TRIM33 (NM 015906), TRIO (NM 0071 18), TRPM6 (NM 017662), TRPM7 (NM 017672), TRRAP (NM 003496), TSSK4 (NM 174944), TTBK1 (NM 032538), TTBK2 (NM 173500), TTK (NM 003318), TTN (NM 003319), TXK (NM 003328), TYK2 (NM 003331), TYRO3 (NM 006293), ULK1 (NM 003565), ULK2 (NM 014683), ULK3 (NM 015518), ULK4 (NM 017886), VRK1 (NM 003384), VRK2 (NM 006296), VRK3 (NM 016440), WEE1 (NM 003390), Wee1 B (NM 173677), YANK1 (NM 145001), YES1 (NM 005433), ZAK (NM 016653) та/або ZAP70 (NM 001079). 6. Мікроорганізм за будь-яким з пп. 1-5, у якому компонент (II) вибраний з групи, що складається з бактеріального токсину, ентеротоксину, екзотоксину, токсину типу I, токсину типу II, токсину типу III, токсину типу IV, токсину типу V, токсину RTX, токсину AB, токсину A-B, токсину A/B, токсину A+B, токсину A-5B та/або токсину AB5. 7. Мікроорганізм за п. 6, у якому компонент (II) вибраний із групи, що складається з токсину аденилатциклази, токсину сибірської виразки, токсину сибірської виразки (EF), токсину сибірської виразки (LF), ботулінічного токсину, холерного токсину (CT, Ctx), субодиниці холерного токсину B (CTB, CtxB), дифтерійного токсину (DT, Dtx), токсину E. coli LT, термолабільного ентеротоксину E. coli (LT), субодиниці В термолабільного ентеротоксину E. coli (LTB), токсину E. coli ST, термостабільного ентеротоксину E. coli (ST), еритрогенного токсину, токсину ексфоліатину, екзотоксину A, ентеротоксину Perfringens, токсину коклюшу (PT, Ptx), шигатоксину (ST, Stx), субодиниці В шига-токсину (STB, StxB), шига-подібного токсину, ентеротоксинів Staphylococcus, правцевого токсину (TT), токсину синдрому токсичного шоку (TSST-1), веро-токсину (VT), токсину A (TA) і токсину B (TB) Clostridium difficile, летального токсину (LT) і геморагічного токсину (HT) Clostridium sordellii, α -токсину (AT) Clostridium novyi. 8. Мікроорганізм за будь-яким з пп. 1-7, у якому компонент (I) і компонент (II) зв'язані один з одним, щоб забезпечити можливість експресії та/або секреції злитого білка, який кодується обома компонентами. 9. Мікроорганізм за п. 8, у якому злитий білок вибраний з групи, що складається з CtxB-PSA, CtxB-BRaf V600E KD, CtxB-домен кінази B-Raf V600E, CtxB-домен кінази KD B-Raf V600E, CtxB-B-Raf, CtxB-B-Raf KD, CtxB-домен кінази KD B-Raf, CtxBHA1, CtxB-HA12C. 10. Мікроорганізм за будь-яким з пп. 1-9, у якому компонент (III) a) вибраний із групи, що складається з системи секреції типу I, системи секреції типу II, системи секреції типу III, системи секреції типу IV, системи секреції типу V, гемолізинової системи транспорту (сигналу) Escherichia coli (нуклеотидні послідовності, що включають HlyA, HlyB і HlyD під контролем hly-специфічного промотору), гемолізинової системи транспорту (сигналу) Escherichia coli (нуклеотидних послідовностей, що включають HlyA, HlyB і HlyD під контролем не-hlyспецифічного бактеріального промотору), транспортного сигналу для білка S-Шару (Rsa A) Caulobacter crescentus, транспортного сигналу для 94974 10 білка ToIC Escherichia coli, сигналу секреції Vtgss та/або сигналів секреції, виділених з лістеріолізину, p60 та/або ActA і причому компонент (III) b) вибраний із групи, що складається з ендолізинів, літичного білка грампозитивних бактерій, літичного білка Listeria monocytogenes, PLY551 Listeria monocytogenes та/або холіну Listeria monocytogenes. 11. Мікроорганізм за п. 10, у якому компонент (III) a) являє собою щонайменше одну нуклеотидну послідовність, що кодує тільки одну транспортну систему, що забезпечує можливість супутньої експресії продуктів експресії компонента (I) і компонента (II) на зовнішній поверхні мікроорганізму та/або забезпечує можливість супутньої секреції продуктів експресії компонента (I) і компонента (II), причому даний компонент (III) a) переважно являє собою принаймні одну нуклеотидну послідовність, що кодує гемолізинову транспортну систему (сигнал) Escherichia coli (нуклеотидні послідовності, що включають HlyA, HlyB і HlyD під контролем hlyспецифічного промотору) або гемолізинову транспортну систему (сигнал) Escherichia coli (нуклеотидні послідовності, що включають HlyA, HlyB і HlyD під контролем не-hly-специфічного бактеріального промотору). 12. Мікроорганізм за будь-яким з пп. 1-11, у якому відповідно до компонента (III) a) продукти експресії компонентів (I) і компонента (II) секретуються. 13. Мікроорганізм за будь-яким з пп. 1-12, у якому компонент (I) вибраний із групи, що складається з B-Raf V600E, домену кінази B-Raf V600E, B-Raf V600E KD, домену кінази KD B-Raf V600E, B-Raf KD, домену кінази B-Raf, домену кінази KD B-Raf, простатаспецифічного антигену (PSA), гемаглютиніну HA1 (переважно з вірусу грипу А (A/Thailand/1 (KAN-1)2004(H5N1), гемаглютиніну HA12 (переважно з вірусу грипу А (A/Thailand/1 (KAN1)2004(H5N1), гемаглютиніну HA12C (переважно з вірусу грипу А (A/Thailand/1 (KAN-1)2004(H5N1); компонент (II) вибраний із групи, що складається з субодиниці В холерного токсину (CTB, CtxB), субодиниці В термолабільного ентеротоксину E. coli (LTB), правцевого токсину (TT); компонент (III) a) вибраний із групи, що складається з сигналу гемолізинового транспорту HlyA Escherichia coli разом з компонентами системи секреції Hly (нуклеотидними послідовностями, що включають HlyA, HlyB і HlyD під контролем hlyспецифічного промотору); компонент (IV) вибраний із групи, що складається з ендогенного промотору локусу hly E. coli, причому компонент (I) і компонент (II) зв'язані один з одним, щоб забезпечити можливість експресії злитого білка, який кодується обома компонентами й при цьому злитий білок секретується. 14. Фармацевтична композиція, що включає щонайменше один мікроорганізм, переважно щонайменше один ліофілізований мікроорганізм, за будь-яким з пп. 1-13 і фармацевтично прийнятний носій, переважно капсули. 15. Лікарський засіб, що включає щонайменше один мікроорганізм за будь-яким з пп. 1-13 або щонайменше одну фармацевтичну композицію за п. 14. 11 94974 12 16. Застосування мікроорганізму за будь-яким з пп. 1-13 для одержання лікарського засобу для лікування та/або профілактики фізіологічних та/або патофізіологічних станів, вибраних із групи, що складається з неконтрольованого розподілу клітин, злоякісних пухлин, доброякісних пухлин, солідних пухлин, сарком, карцином, гіперпроліферативних порушень, карциноїдів, сарком Евінга, сарком Капоші, пухлин головного мозку, пухлин, що походять з головного мозку та/або нервової системи, та/або мозкових оболонок, гліом, нейробластом, раку шлунка, раку нирки, карциноми ниркових клітин, раку простати, карцином простати, пухлин сполучних тканин, сарком м'яких тканин, пухлин підшлункової залози, пухлин печінки, пухлин голови, пухлин шиї, раку стравоходу, раку щитовидної залози, остеосарком, ретинобластом, тимоми, раку яєчка, раку легені, бронхіальних карцином, раку молочної залози, карцином молочної залози, раку кишки, колоректальних пухлин, карцином товстої кишки, карцином прямої кишки, гіне кологічних пухлин, пухлин яєчника/оваріальних пухлин, раку матки, раку шийки матки, карцином шийки матки, раку тіла матки, карцином тіла, ендометріальних карцином, раку сечового міхура, раку порожнини, раку шкіри, базаліом, спіналіом, меланом, внутріочних меланом, лейкозу, хронічного лейкозу, гострого лейкозу, лімфом, інфекції, вірусної або бактеріальної інфекції, грипу, хронічного запалення, відторгнення органа та/або аутоімунних захворювань. 17. Плазміда або вектор експресії, що включає компоненти (I)-(IV) за будь-яким з пп. 1-13. 18. Спосіб одержання мікроорганізму за будь-яким з пп. 1-13, у якому одержують плазміду або вектор експресії за п. 17, і трансформують мікроорганізм даною плазмідою або вектором експресії. 19. Фармацевтичний набір, що включає щонайменше один мікроорганізм за будь-яким з пп. 1-13 і фармакологічно прийнятний буфер, переважно карбонатний буфер. Галузь техніки Винахід відноситься до мікроорганізмів як носіям гетерогенних нуклеотидних послідовностей, що кодують антигени та білкові токсини, способу їх одержання, а також відповідним плазмідам або векторам експресії. Дані мікроорганізми можна використовувати як лікарські засоби, зокрема, як протипухлинні вакцини для лікування різних пухлин. Попередній рівень техніки Імунотерапія рака дає багатообіцяючу можливість лікування пухлин. Безліч клінічних досліджень із використанням різних підходів зосереджується на її ефективності в пацієнтів. У принципі представлене розходження між пасивною й активною імунотерапією. Активна імунотерапія спрямована на індукцію пов'язаного з вакциною пухлиноспецифічної імунної відповіді. Останню у цей час досліджують у клінічних умовах з використанням ряду різних підходів. Наприклад, є, так звані цільноклітинні вакцини, вихідним матеріалом для яких є пухлинні клітини, які або одержують безпосередньо від пацієнта (аутологічні) або виділяють із відповідних клітинних ліній (гетерологічні). Потім дані клітини, як правило, інактивують, диференційовано проводять маніпуляції й уводять (назад уводять) пацієнтові. Навпроти, антигенспецифічні вакцини включають один (або більше) пухлиноспецифічних антигенів, частин антигенів або ДНК, що кодує специфічний антиген, а також, так звані антиідиотипові вакцини. Звичайно дані вакцини не є виділеними, але їх вводять шляхом ін'єкції у комбінації з підходящим носієм. Отже, з одного боку, використовують різні класичні ад'юванти, але також комбінації з біологічними ісуностимуляторами, такими як цитокіни. З метою імуностимуляції використовують підходи, які включають антиген-асоційовані імунос тимулятори, такі як правцевий токсин. Більше того, є спроби з використанням антигенів у комбінації з дендритними клітинами. І, нарешті, є ряд спроб з використанням рекомбінантних живих вакцин з вірусними або бактеріальними носіями. Злиті білки бактеріальних токсинів, такі як правцевий токсин, шига-токсин, летальний токсин або холерний токсин, у якості ад'ювантів з антигеном використовують як вакцини, особливо протиінфекційні, у той же самий час (див. статтю Freytag і Clements, 1999). Крім того, нативні токсини, часто злиті зі специфічної відносно клітини молекулоюмішенню, такий як молекула клітинної поверхні пухлинних клітин, також використовують із метою руйнування клітин-мішеней. У такому випадку, злиті білки з нативним токсином, що, як правило, включає ферментну групу й білок-єднальних домен, проявляють свій оптимальний ефект при використанні в якості ад'ювантів (див. статтю Freytag і Clements, 1999). За допомогою даних вакцин одержують задовільну імунну відповідь навіть після імунізації через слизуваті й особливо послу пероральної імунізації. Утруднення з даними злитими білками полягає в тому, що нативні токсини є високотоксичними й, внаслідок цього, не можуть бути створені для людини (див. статтю Holmgren et al., 2005). Цілий напрямок досліджень, таким чином, займається детоксификацією токсинів, які в той же час зберігають ад'ювантний ефект. Однак, оскільки в більшості випадків ад'ювантний ефект збігається з ферментною активністю, що відповідальна за токсичний ефект (див. статтю Lycke et al., 1992), детоксифікація не може бути проведена прямим шляхом, навіть якщо це представляється можливим для деяких токсинів, які не втрачають своєї ферментної ад'ювантної активності (див. статті Hormozi et al., 1999; Lycke et al., 1992). У випадку холерного токсину (СТ) започатковано ряд спроб детоксифікації (див. статті Agren et 13 al., 1999; Вуun et al., 2001; Eriksson et al., 2004; Kweon et al., 2002; Sanchez et al., 2002), у яких, однак, переважає використання ад'юванта для слизових (див. роботу Freytag і Clements). Внаслідок цього головним чином ефективна індукція відповіді антитіл (в основному IgA слизових), які одержують посилену пов'язану з токсином підтримку Т-клітин з рестрикцією МНС (головного комплексу гистосумісності) класу II, є основною попередньою умовою для ад'юванта для слизових для вакцини, що складається з білка-антигену й злитого або спільно використовуваного токсину (див. статтю Freytag і Clements). Що стосується холерного токсину, особливо його В-субодиниці (CtxB), то його тестують як ад'ювант, оскільки він є відповідальним за зв'язування з рецептором GM-1 і не проявляє токсичних ефектів, будучи виділеним (див. статтю Holmgren et al.). Злиття білка з CtxB характеризуються в основному індукцією так званих Th2 імунних відповідей. Вони являють собою Т-клітинні відповіді, які головним чином характеризуються цитокінами, такими як ІЛ-4 або ІЛ-6 і які в основному викликають індукцію антитіл, але які зовсім не ініціюють або найбільш обмежено ініціюють клітинну імунну відповідь, зокрема, цитотоксичних Т-Клітин (CTL) (див. статтю Holmgren et al.). Крім того, CtxB у якості ад'юванта для слизових індукує системну толерантність до білкаантигену. Системна толерантність описує виснаження або інактивацію антиген-специфічних лімфоцитів, зокрема, Т-клітин або В-клітин. Підхід даного типу, внаслідок цього, не може бути застосований для індукції системної імунної відповіді (див. статтю Holmgren et al.). На противагу застосуваннюна слизових внутрішньоревинне або підшкірне застосування злитого білка токсин-антиген здатні індукувати системну, а також низьку цитотоксичну відповіді. Це в дійсності використовують для протипухлинної вакцинації в модельних системах (див., наприклад роботу (Becerra et al., 2003)). Однак дану відповідь також одержують від самого очищеного антигена і головним чином вона залежить від ад'юванта, що використовують. За винятком того факту, що визначені відповіді CTL на моделі є дуже низькими, відсутні докази того, що захист тією самою мірою залежить від даних ефектів. Більше того, антиген не застосовують перорально, але тільки шляхом прямої ін'єкції (s.c (підшкірної), i.d. (внутрішньошкірної, і.т. (внутрішньом'язової), і.р. (внутрішньочеревної)) антигену. Антигенні білки, злиті в детоксифіційованому токсині, як правило, неефективні при застосуванні в якості протипухлинної вакцини. Основними причинами є, якщо вони взагалі є, лише низька індукція системної імунної відповіді або навіть, у випадку CtxB, індукція системної толерантності, а також індукція обмежених слизових антитіл і імунних відповідей типу Тh2. У статті McSorley et al., наприклад, показано, що назальна імунізація злитим білком Ctx-Антиген (який для протипухлинної вакцини являє кращий шлях індукції системної відповіді) переважно переноситься й, внаслідок цього, інактивує Th 1 94974 14 клітини, тоді як Th 2-клітини не піддаються впливу (див. статтю McSorley et al., І998). Відповіді Th2 характеризуються Т-хелперними клітинами, які переважно продукують ІЛ-4 або ІЛ-6. Дані цитокіни особливо відповідальні за ініціацію продукції антитіл В-клітинами, які забезпечують захист у випадку найпоширеніших вакцин. Навпроти, Т-клітини Тh1 в основному секретують ІЛ-2 і ΘΦΗ-, відповідно, цитокіни, які відіграють роль у клітинній імунній відповіді. Залежно від мети стратегії імунізації має велике значення, чи ініціюється викликана антитілами імунна відповідь Th2 (так зване зрушення Th2) або викликане клітинами відповідь Th1 (так зване зрушення Th1). Навпроти, системна індукція Th1-домінучої клітинної імунної відповіді за допомогою ІФН- що дає Т-клітини хелпери, і індукція цитотоксичних Тклітин (CTL) є необхідною для імунотерапії пухлин. Попередній рівень техніки показує, що токсини можуть діяти як ад'юванти. Зокрема, холерний токсин (СТ) показує сильний ад'ювантний ефект. Однак даний ефект істотно послабляється, як тільки токсин детоксифікують. Що стосується його субодиниці CtxB, пероральне застосування навіть індукує системну толерантність. Даної проблеми можна частково уникнути шляхом назального застосування. Однак, якщо використовують назальне введення, виникають інші проблеми, зокрема, такі як асоційовані із субодиницею CtxB, що зачіпають експресію рецептора GM-1 у головному мозку (див. статтю van Ginkel et al., 2000), які виражаються в підвищеному ризику розвитку деяких важких побічних ефектів (див. статтю Mutsch et al., 2004). Для подолання даних проблем можливо генерувати рекомбінантні живі вакцини, які співекспресують токсини та (гетерологічні) антигени. Дана можливість уже розглядалася у зв'язку із протиінфекційними вакцинами, тобто вакцинами, які спрямовані на специфічний патоген, наприклад, на збудника туберкульозу, і призначені для індукції імунітету проти даного патогену. У процесі розробки даних протиінфекційними вакцин уже отримані рекомбінантні токсини, злиті з відповідними (гетерологічними) антигенами, з використанням ряду рекомбінантних бактеріальних штамів, які вводять перорально як у випадку живої, так і інактивованої вакцини. У більшості випадків генеровані штами експресують тільки рекомбінантний токсин. Внаслідок цього дані підходи в основному спрямовані на імунізацію винятково проти самого токсину (індукцію відповіді антитіл) і, отже, штаму, який експресує токсин (патоген). Дані типи вакцин непридатні для застосування в якості потенційних протипухлинних вакцин при лікуванні пухлин і не дивно, що у відповідних випробуваннях не згадують про яку-небудь можливість даного застосування, (див. статтю Reveneau et al., 2002), (див. статтю Vertiev et al., 2001), (див. статті Freytag і Clements, 1999; Jackson et al., 1996). Що стосується даних протиінфекційних вакцин, у процесі індукції відповіді антитіл токсин не працює як ад'ювант, у цьому випадку переважає індукція імунної відповіді антитіл слизових. Дані випробування протиінфекційних вакцин не вклю 15 чають або включають тільки дуже слабку системну імунну відповідь. На противагу протипухлинним вакцинам дані вакцини не здійснюють індукцію клітинної імунної відповіді, особливо цитотоксичних Т-клітин. Бактеріальні патогени, які експресують токсин, звичайно відносяться до позаклітинного живого типу й, внаслідок цього, не беруть участь в активації CTL, тобто захист, що представляється даними протиінфекційними вакцинами, є CTL-незалежним. У згаданих випробуваннях вакцин використані наступні бактеріальні штами: рекомбінантні Lactobacilli (див. статтю Reveneau et al., 2002), Listeria (див. статтю Vertiev et al., 2001), Bacillus anthracis (див. статті Mendelson et al., 2005; Mesnage et al., 1999), Shigellae (див. статті Anderson et al., 2000; Tzschaschel et al., 1996b), E. coli (див. статтю Walker et al., 1992), Vibrio (див. статті Butterton et al., 1995; Chen et al., 1998; Thungapathra et al., 1999) і Salmonella (див. статтю Jackson et al., 1996). Крім того, намагалися підсилити імунні відповіді слизових шляхом поверхневої презентації (див. статтю Konieczny et al., 2000) або секреції токсину в якості гетерологічного антигену (Salmonella, Shigellae (див. статті Garmory et al., 2003; Orr et al., 1999; Su et al., 1992; Tzschaschel et al., 1996a; Tzschaschel et al., 1996b), Yersinia (див. статтю Sory і Comelis, 1990), Vibrio (див. статтю Ryan et al., 1997a), E. coli (див. статтю Zhu et al., 2006)). Однак, у даних додаткових випадках самі токсини представляють антигени, у відношенні яких спрямована імунна відповідь. Таким чином, слід зазначити, що токсини не діють як ад'юванти й в описаних дослідженнях не планували експресувати токсини у вигляді злитих білків з додатковим окремим (гетерологічним) антигеном. Більше того, злиті білки з СТ або CtxB не були генеровані з даними системами, і це не передбачалося. Отже, злиті білки, згадані у вищенаведених документах, являють собою злиті білки пептидного сигналу секреції, такого як НlуА, і білка токсину, а не злиті білки, що складаються з токсину й (гетерологічного) антигену. Головною метою даних досліджень є просто одержати оптимальну імунну відповідь слизових (див. статтю Tzschaschel et al., 1996a). Індукцією системної імунної відповіді не займались. Дотепер, якщо порівнювати в цілому, аналізи системних імунних відповідей були обмежені тільки антитілами (зокрема, системними IgA), оскільки захист у моделях даного типу головним чином опосередковувана антитілами (порівн., наприклад, [31]). Індукція системної клітинної імунної відповіді, зокрема, відповіді цитолітичних Т-клітин, не описана. Злиття із сигналом секреції в основному використовували для підвищення розчинності токсинів і підвищення їхньої стабільності, відповідно, оскільки сильна абсолютна цитоплазматична експресія часто приводить у результаті до продукування нерозчинних агрегатів (див. статтю Gentschev et al., 2002a). У даному аспекті ряд авторів звертає увагу на те, що білки із сигналом секреції викликають швидке цитоплазматичний розклад (див. статтю 94974 16 Tzschaschel et al., 1996а), тоді як інші спостерігають стабілізацію (див. статтю Orr et al., 1999). Попередній рівень техніки, отже, у цьому випадку має протиріччя. Дотепер попередні експерименти із токсинуми, які декретуються, (токсин + сигнал секреції) насамперед спрямовані на підвищення стабільності, що очевидним чином не досягається у всіх випадках. Одна причина, безумовно, виявлена в інтенсивності, що змінюється, експресії й стабільності плазмід. У статті Tzschaschel et al. описано, що використовувана плазмідная система високо нестабільна й, крім того, без селекції просто знайдена в декількох бактеріях. Як можливе рішення автори використовують хромосомну інтеграцію за допомогою мінітранспозону (див. статті Tzschaschel et al., 1996a; Tzschaschel et al., 1996b). Однак, дана система має ряд недоліків. З одного боку, точка інтеграції не визначена, що може привести до небажаної фенотипової зміні штамухазяїна (наприклад підвищеної/зниженої експресії фланкуючих генів). З іншого боку, очікуваний рівень експресії при використанні однієї геномної копії тільки низький, що впливає на імуногенність. Крім іншого, хромосомна інтеграція транспозону відносно нестабільна, оскільки вона дуже часто приводить зі спонтанним ексцизіям по сторонах повторюваних елементів. Як відзначено вище, рівень техніки є суперечливим відносно стабільності гетерологічного токсину, що секретується. У статті Garmory et al. навіть припускають, що секреція гетерологічного антигену не має якунебудь особливу перевагу у відношенні імуногенності (див. статті Garmory et al., 2002; Roland et al., 2005). В інших випадках підвищена системна відповідь антитіл на токсин, що декретується, після внутрішньовенного введення в дійсності спостерігають, але не після перорального введення. Навпроти, пероральне застосування нехай навіть побічно входить у проблему (див. статтю Roland et al., 2005). В остаточному підсумку дослідження із грампозитивним штамом (Lactobacillus plantarum), що продукує правцевий токсин, не показують істотних розходжень в індукції системної відповіді антитіл у порівнянні зі штамами, які секретують токсин, є присутнім чи він у пов'язаному з їхньою мембраною вигляді, або вони містять токсин у цитоплазмі (див. статтю Reveneau et al., 2002). Системні клітинні імунні відповіді, зокрема, відповіді цитотоксичних Т-клітин, і отриманий в результаті захист не досліджені й не описані. Таким чином, на основі вищенаведених даних по попередньому рівні техніки, що стосуються протиінфекційних вакцин на основі токсинів, не можна затверджувати, чи представляє секреція токсину, використовуваного у якості ад'юванта, перевага в плані індукції системного (клітинного) імунної відповіді. Навпроти, вищенаведені дослідження скоріше вказують на проблему стабільності й відзначають втрату позитивного ефекту гетерологічного токсину, що секретується. Злиті білки, що складаються із сигналу, токсину й гетерологічного антигену, зовсім не описані або не передбачаються. 17 У вищенаведених абзацах представлений попередній рівень техніки, що описує бактеріальні носії, які гетерологічно експресують токсини й можуть бути використані в якості протиінфекційних вакцин. У наведених прикладах здійснені в основному модифікації, що стосуються експресії або стабільності токсинів і їхньої розчинності, наприклад, інсерція сильного промотору експресії або злиття токсину із сигналом секреції. Інші автори одержують також досліджені генетичні злиття токсинів з гетерологічними антигенами в живих вакцинах. У даних випадках токсин в основному використовують у якості ад'юванта. У ряді випадків (наприклад (див. статтю Brassier et al., 2000)) гетерологічний антиген діє як ад'ювант і токсин як придатний антиген. Однак, важливо відзначити, що в згаданих випадках експресія конструкції злитих генів токсинуантигену відбувається винятково цитоплазматично або периплазматично. Конструкція токсин-антиген не злитих з додатковим сигналом секреції (який може привести до його повної секреції) і не секретується безпосередньо. У процесі одержання даних конструкцій злитих генів токсину-антигену використовують рекомбінантну Е. coli (див. статтю Clemens et al., 2004), Bacillus anthracis (див. статтю Brassier et al., 2000), Shigella (див. статті Koprowski et al., 2000; Ranallo et al., 2005; Zheng et al., 2005) і штами Vibrio (див. статтю Silva et al., 2003). Для Salmonella (див. огляд у статті (Garmory et al., 2002)) описані також злиття варіантів СТ з антигенами (див. статті Hajishengallis et al., 1996; Huang et al., 2000) або інших токсинів з антигенами (див. статті Barry et al., 1996; Cardenas i Clements, 1993; Chabalgoity et al., 1997; Chabalgoity et al., 1996; Chabalgoity et al., 2000; Chabalgoity et al., 1995; Chacon et al., 1996; Jagusztyn-Krynicka et al., 1993; Khan et al., 1994a; Khan et al., 1994b; Lee et al., 2000; Pogonka et al., 2003; Schodel et al., 1990; Smerdou et al., 1996; Ward et al., 1999; Wu et al., 2000). У більшості даних випадків основна увага зосереджена на індукції імунної відповіді слизових (антитіл), і для індукції системної імунної відповіді вибирають тільки підшкірне, але не пероральне застосування [36]. Кілька робіт з Salmonella як підтримуючий штам обмежені простою характеризацією штаму (див. статті Gomez-Duarte et al., 1995; JagusztynKrynicka et al., 1993), а інші тільки аналізують відповідь антитіл слизових і/або системну відповідь антитіл і/або захист (див. статті Barry et al., 1996; Cardenas i Clements, 1993; Dunstan et al., 2003; Hajishengallis et al., 1996; Harokopakis et al., 1997; Khan et al., 1994a; Khan et al., 1994b; Pogonka et al., 2003; Smerdou et al., 1996; Somner et al., 1999). У всіх даних випадках, де попутно використовують злиття антигену й правцевого токсину, і які використовують винятково в якості протиінфекційних вакцин, системні клітинні імунні відповіді, особливо відповіді цитотоксичних Т-клітин, не вивчали. Внаслідок цього, з імунологічної точки зору з даних досліджень не можна зробити ніяких висновків щодо потенційного застосування в якості протипухлинної вакцини, оскільки вони зосереджені 94974 18 на опосередкованих антитілами ефектах у якості протиінфекційних вакцин. Дослідження, які включають аналіз ізотипу досліджуваної імунної відповіді, очевидно, є більше підходящими. У дійсності в даних випадках безпосередньо вимірюють клітинні імунні відповіді, але ізотопічний профіль відповіді антитіл дозволяє зробити висновок щодо зрушення Th1/Th2 імунної відповіді. Ізотипи антитіл, подібних IgGI, пов'язані з відповідями Th2, та ізотипи, подібні IgG2a асоційовані з відповідями ТМ. Як уже відзначали, відповіді ТМ являють собою переважні клітинні імунні відповіді, тоді як відповіді Th2 в основному представляють гуморальні відповіді, що направляються антитілами. Крім того, у даних дослідженнях не описують протипухлинні вакцини, і в них не припускають якого-небудь застосування протипухлинного регагента. Одне дослідження протиінфекційної вакцини на основі Salmonella як носій, що експресує злитий білок правцевого токсину й антигену здійснено на собаках. Низькі рівні відповідей антитіл, які індуковані в собак, показують зрушення ТМ, що стосується профілю антитіл, отже, відповіді, що сильно корелює з імунною відповіддю клітинного типу (див. статтю Chabalgoity et al., 2000). Треба відзначити, що імунологія собак недостатньо вивчена, і, внаслідок цього, неясно, у якому ступені профіль антитіл собаки може дати інформацію щодо зрушення Th1. Дослідження на мишах, проведені тією же групою з використанням порівнянних конструкцій, показали проте профіль антитіл з однаковим рівнем для IgGl, що для IgG2a, що буде вказувати на змішану відповідь Th1/Th2. Цікаво, що наявний імунітет до правцевого токсину, як він виявлений у більшості людей внаслідок попередніх імунізацій, викликає іншу відносно сильну індукцію IgG1, тоді як IgG2a майже не індукується. Це ясно вказує на інше співвідношення Th2 (див. статтю Chabalgoity et al., 1995). З даної причини живаючи вакцина на основі правцевого токсину в якості протипухлинної вакцини є дуже шкідливою для використання в людини. Внаслідок цього можна чекати, що сильна відповідь Th2, яка викликається антитілами, індукується в більшості даних пацієнтів, які демонструють специфічну відповідь на правцевий токсин. Тільки в декількох дослідженнях також аналізують клітинну імунну відповідь і порівнюють генетичні конструкції зі злитим токсином і без нього. В одному випадку, наприклад, злиття антигену із правцевим токсином і без нього порівнюють на Salmonella (див. статтю Lee et al.). У цьому випадку злита конструкція правцевого токсину й антигену головним чином підвищує загальний рівень антитіл, тоді як профіль Th1/Th2 мало змінюється. Навіть антиген-специфічна секреція Т-клітинами CD4+ типових цитокінів Th1, таких як ΘΦΗ- і ІЛ-2, відповідно, показує тільки слабке відхилення. У більше ранньому дослідженні тієї ж групи вимірюють також рівні ΘΦΗ-. Однак не представлено ніякого порівняння з конструкціями без правцевого токсину (див. статтю Chabalgoity et al.). В інших дослідженнях з різними грампозитивними бактері 19 альними носіями, подібними Shigella (див. статті Koprowski et al., Ranallo et al., Zheng et al.) або Vibrio (див. статті Campos et al., Ryan et al.) не аналізують ні ізотипи ані клітинні імунні відповіді. Підводячи підсумки, можна затверджувати, що згадані дослідження ясно зосереджені на індукції імунної відповіді направляється, що антитілами гуморального. У дійсності використовують генетичні конструкції токсину й антигену, не вони не мають сигналу секреції, і вони безпосередньо не секретуються. Однак, ні при яких умовах не аналізували системні клітинні імунні відповіді, зокрема, відповіді цитотоксичних Т-клітин. До того ж дані клітинні відповіді цитотоксичних Т-клітин не можуть бути виведені з гуморальної відповіді антитіл і не можуть бути визначені, якщо відповідь антитіл включає Th1/Th2. Однак, це саме ті клітинні імунні відповіді цитотоксичних Т-клітин, які важливі для використання в лікуванні шляхом протипухлинної вакцинації. Проте в плані злиттів антиген^-антиген-токсинантиген, які обмежені тільки протиінфекційними вакцинами для слизових, стан рівня техніки не допускає ніякого твердження щодо можливого використання яких-небудь даних конструкцій у якості протипухлинних вакцин. Як уже відзначено, експресію генетичних злитих конструкцій здійснюють без допомоги системи секреції. Токсини й конструкції токсин-антиген, відповідно, як правило, розташовані цитоплазматично, а також периплазматично, тобто між двома мембранами. Для індукції ефективної клітинної імунної відповіді токсин повинен бути вільно доступний для антиген-презентируючої клітини (АРС). Як правило, нативний токсин продукується в периплазмі грамнегативних бактерій. Це досить для повних імунних відповідей слизових, оскільки периплазматичні токсини можуть вийти з периплазми в товстій кишці й, отже, також є доступними (див. статтю Hunt і Hardy, 1991). Однак це не беруть до уваги, якщо носій спрямований на антигенпрезентуючі клітини поза товстою кишкою, такі як, наприклад, пейєрові бляшки або лімфатичні органи, такі як лімфатичні вузли або селезінка. У принципі два фактори є важливими в плані ефективності протипухлинної вакцини: індукція клітинної імунної відповіді Th 1-типу й участь компонентів уродженої імунної системи, таких як NKклітини, NKT-клітини та - Т-клітини, які відіграють важливу роль у плані ефективності протипухлинної терапії (див. статтю Dunn et al., 2004). Важливість даних компонентів уроджених імунних систем лежить на безлічі рівнів. Належним чином активовані NK-клітини, NKT-клітини та - Тклітини здатні локально продукувати більші кількості ΘΦΗ-. Даний інтерферон, що також продукується специфічними Th 1-поляризованими Тклітинами, має безліч функцій, що відносяться до терапії пухлин. Однієї з його головних функцій є інгібування ангіогенезу, що перекриває постачання пухлини киснем і поживними речовинами й приводить фактично до голодування пухлини. Крім того, NK-клітини мають рецептори, які розпізнають молекули МНС клаcу I. Якщо дані молекули присутні на клітині, NK-клітини інгібуються. 94974 20 Що стосується вакцини, що індукує специфічні цитотоксичні Т-клітини, то пухлинні клітини можуть бути знищені даними CTL. Якщо пухлинна клітина втрачає свою здатність експресувати молекули МНС класу І, що дуже часто має місце в пухлинах, специфічні цитотоксичні Т-клітини неефективні. Внаслідок цього в цьому випадку інгібування NKклітин припиняється, і вони здатні безпосередньо елімінувати пухлинні клітини. Отже було б ідеальним, якби протипухлинна вакцина ефективно індукувала обидва компоненти. Є суперечливі дані щодо зрушення Th1-Th2 злитого токсину-ад'юванта. Як обговорювалося раніше, злиті конструкції токсин-антиген, використовувані у виділеному виді, очевидним образом індукують сильну Th 2-поляризовану імунну відповідь. Ряд авторів, крім того, описує низький рівень зрушення для живих носіїв; інші автори відзначають невелике Th 1-зрушення. Однак, дані результати знову засновані винятково на конструкціях, що не секретуються. Індукцію вродженого імунітету за допомогою даних типів протиінфекційних вакцин ніколи не порівнювали й не передбачали. Як уже відзначено, головна причина полягає в тому, що наявні вакцини являють собою протиінфекційні вакцини для слизових, а не протипухлинні вакцини. Внаслідок цього індукція Th 1-імунних відповідей, імунних відповідей CTL і відповідей уродженої імунної системи не були в центрі уваги. Навпроти, що стосується протипухлинних вакцин, індукція даних імунних відповідей обов'язкова. Цікаво, що в біології клітини нативні токсини звичайно використовують як інгібітори шляхів передачі сигналу. Так, серед іншого показано, що нативний токсин коклюшу, але не холерний токсин, здатний інгібувати певний тип апоптозу NKКлітин (див. статтю Ramirez et al., 1994). Інше наукове дослідження здатне показати, що холерний токсин, але не його В-Субодиниця блокує специфічні функції NK-Клітин (див. статтю Poggi et al., 1996). Нативний токсин коклюшу використовують для інгібування хемотаксису лімфоцитів (див. статтю Spangrude et al., 1985). Навіть якщо дані дослідження не ставляться до протипухлинної вакцинації, компетентний фахівець в галузі техніки міг бути зробити висновок про те, що використання токсинів у якості протипухлинних вакцин було б шкідливим, оскільки відповідь уродженої імунної системи, важлива для терапії пухлин, більше інгібується, ніж індукується. Інші наукові дослідження здатні показати, що токсини, подібні нативному токсину коклюшу (не іактивованому токсину коклюшу), ефективно індукують компоненти вродженої імунної системи. Відносно імунотерапії пухлин це буде означати, що якщо їх взагалі будуть використовувати, то варто використовувати нативні токсини. Однак, із причин токсичності даний тип введення неприпустимий. Крім того, дана індукція неминуче приводила б до Th 2-направленої вторинної імунної відповіді, що у свою чергу, буде шкідливим для лікування пухлин (див. статтю Boyd et al., 2005). Отже, відносно індукції вродженої імунної відповіді, у попередньому рівні техніки не описана й не передбачена проти 21 пухлинна вакцинація. Навпроти, критичний аналіз літератури навіть заважає використанню токсинів при лікуванні пухлин. Цікавим, проте, є аналіз синергичного ефекту токсинів або їх субодиниць із іншими стимуляторами, такими як імуностимулюючі олігонуклеотиди ДНК із гіпометильованими мотивами CpG (CpG ODN) (див. статтю Holmgren et al., 2005) або ліпосахариди (LPS). У випадку LPS в основному індукція моноцитів, очевидно, підвищується головним чином за допомогою В-субодиниць токсинів, тоді як вона інгібується токсином у цілому (голотоксином) (див. статтю Hajishengallis et al., 2004). Однак дані дослідження засновані винятково на використанні очищених злитих конструкцій токсин-антиген, до яких додають субстанції, подібні LPS або CpG у якості ад'ювантов. Крім того, аналіз у цьому випадку проводять тільки на макрофагах, які індукують адаптивну імунну відповідь, але безпосередньо не діють на пухлини. Отже дані дослідження не мають істотного значення відносно індукції компонентів уродженої імунної системи, зокрема, NKклітин, які можуть безпосередньо діяти на пухлини. Інші дослідження, однак, показують, що NKклітини можуть бути активовані й хемотаксично притягнуті токсинуми, подібними екзотоксину A Pseudomonas aeruginosa (див. статтю Muhlen et al., 2004). Залежно від експериментальної системи можна також індукувати Th 1-відповіді, хоча внаслідок цього головним чином відбувається супресія NK-клітин і Th 1-відповідей (див. статтю Michalkiewicz et al., 1999). Проте, дані дослідження в основному спрямовані на аналіз гепатотоксичності ентеротоксину А та не відносяться до протипухлинної вакцинації. Цікаво, що ефекти є у високому ступені дозозалежними, і тільки незначна зміна дози може інвертувати ефекти. Хоча автори не могли показати, який відповідь ефективно має місце in vivo. Внаслідок цього дані не дають пророкування, які ефекти можуть мати місце, якщо токсин або навіть детоксифікований токсин використовують у якості ад'юванта. У загальному й цілому імунна відповідь у сильному ступені залежить від вЧжористовуваної конкретної системи. У більшості випадків протиінфекційна вакцина для слизових спрямована на локальну маніпуляцію з імунною системою в слизовій з метою індукції ефективної імунної відповіді в слизовій (див. статтю Lycke, 2005). Однак, дані дослідження не включають розробку протипухлинної вакцини. Крім того, у даних дослідженнях відсутня інформація про індукцію системних клітинних імунних відповідей, зокрема, відповідей цитотоксичних Т-клітин, які є основними для протипухлинної вакцинації. Уже показано, що секреція гетерологічного антигену дає переваги системної імунної відповіді (див. статтю Hess et al., 1996). Однак, описані антигени, що декретуються, не є конструкціями токсин-антиген, що секретуються; токсини або їх субодиниці не використовують. Імунні відповіді, що досягаються таким чином, у моделі трансгенної пухлини також у високому ступені обмежені (див. статтю Gentschev et al., 2005). Дійсно, у цьому ви 94974 22 падку можуть бути індуковані слабкі відповіді антитіл і цитотоксичних Т-клітин, які частково захищають від розвитку пухлини. Однак, не тільки самі імунні відповіді, але й сам захист обмежений. Аналогічно в даних дослідженнях протипухлинної вакцинації відсутнє порівняння з конструкціями, що не секретуються. Більше того, порівняльні дослідження не проводили в контексті протипухлинної вакцинації (див. статтю Hess et al., 1996) і, вони суперечать подальшим дослідженням, у яких не спостерігають якої-небудь переваги відносно секреції (див. статті Garmory et al., 2002; Roland et al., 2005). У підсумку і як відзначено раніше, що передує рівень техніки дуже суперечливий у плані секреції й у загальному й цілому не дає ніякого натяку відносно потенційних переваг конструкцій токсинантиген, що декретуються, при лікуванні пухлин. Навпроти, критичний аналіз наявної літератури значною мірою суперечить даному типу застосування. Бактеріальні токсини (див. статтю Todar, 2002): на хімічному рівні існує два типи бактеріальних токсинів, ліпополісахариди, які пов'язані із клітинними стінками грамнегативних бактерій, і білки, які вивільняються з бактеріальних стінок і можуть діяти на тканинні ділянки, вилучені від області бактеріального росту. Пов'язані із кліткою ліпополісахаридні (LPS) токсини називають ендотоксинуми, і позаклітинні здатні до дифузії токсини називають екзотоксинуми. Екзотоксини, як правило, являють собою розчинні білки, що секретуються живими бактеріями в період експонентного росту, але в ряді випадків вони вивільняються шляхом лізису бактеріальної клітини. Продукція токсину, як правило, специфічна відносно певних видів бактерій, які викликають захворювання, асоційоване з токсином (напрклад, тільки Clostridium tetani продукують правцевий токсин; тільки Corynebacterium diphtheriae продукують дифтерійний токсин). Як грампозитиіні, так і грамнегативні бактерії продукують розчинні білкові токсини. У загальному є три класи білкових (екзо)токсинів: (і) токсини типу І (суперантигени), які зв'язуються з поверхнею клітини-хазяїна й модулюють імунну відповідь, але не транслокуються в клітину, (іі) токсини типу II (пороутворюючі токсини), які діють на мембрану клітини-хазяїна й викликають витікання із клітини-хазяїна і її загибель, і (ііі) токсини типу III (A-B токсини), які зв'язуються із клітиною-хазяїном за допомогою специфічного рецептора й транслокуються в клітину, стають у ній активними й модифікують білки або інші компоненти клітини-хазяїна. Як показано вище, токсини типу III, що діють всередині клітини відносно клітин-хазяїв, складаються із двох компонентів: один компонент (субодиниця А) відповідає за ферментну активність токсину, інший компонент (субодиниця В) бере участь у зв'язуванні зі специфічним рецептором на мембрані клітини-хазяїна й переносі ферменту через мембрану. Ферментний компонент неактивний доти, поки не вивільниться з нативного (А+В) токсину. Виділені А-субодиниці ферментативно активні, але позбавлені здатності зв'язування й входу в 23 клітку. Виділені В-субодиниці можуть зв'язуватися із клітинами-мішенями (і навіть блокувати зв'язування нативного токсину), але вони нетоксичні. Існує ряд шляхів, якими можна синтезувати й зібрати субодиниці токсину: А+В показує, що токсин синтезований і секретується у вигляді двох окремих білкових субодиниць, які взаємодіють на поверхні клітини-мішені; А-В або А-5В або АВ5 показує, що А- і В-субодиниці синтезують роздільно, але зв'язані нековалентними зв'язками під час секреції й зв'язуються зі своєю мішенню; 5В або В5 показує, що домен зв'язування білка складається з 5 ідентичних субодиниць. АВ або А/В показує токсин, синтезований у вигляді одного поліпептиду, розділеного на домени А і В, які можуть бути розділені шляхом протеолітичного розщеплення. Прикладами токсинів АВ або А/В є дифтерійний токсин, екзотоксин А, ботуліничний токсин і правцевий токсин. Прикладами токсинів А-5В або АВ5 є холерний токсин і шига-токсин, тоді як токсин сибірської виразки LF і токсин сибірської виразки EF є прикладами токсинів А-В. Подальші релевантні документи попереднього рівня техніки включають наступні: Міchl et al. описують використання бактерій і бактеріальних токсинів як лікувальних факторів для солідних пухлин. Розкривають злиті конструкції токсин-антиген, а також бактеріальну спрямованість даної конструкції. Досліджують використання дифтерійного токсину (DT), екзотоксину A Pseudomonas (PE) і ентеротоксину Clostridium perfringens (CPE). Однак, автори не згадують використання холерного токсину й не показують або не представляють помітну секрецію злитих конструкцій токсин-антиген, виділених з бактерій (див. статтю Michl і Gress, 2004). Lahiri представляє огляд по різних бактеріальних токсинух і обговорює їхнє різноманітне застосування. Хоча автор згадує злиті білки токсинантиген, він не говорить про холерний токсин і бактеріальну спрямованість злитих конструкцій токсин-антиген, що декретуються, (див. статтю Lahiri, 2000). Lavelle et al. розкриває молекули інфекційних агентів у якості імуномодулюючих лікарських препаратів. Автори також відзначають злиті білки холерний токсин-антиген, але дані конструкції використовують тільки безпосередньо як білки й не в якості генетично модифікованих живих вакцин (див. статтю Lavelle et al., 2004). Заявка WO 01/74383 спрямована на химерні імуногени для слизових типу антиген-ентеротоксин і, крім того, у ній згадують використання субодиниць холерного токсину А2 і В. Однак, дані химерні імуногени завжди включають субодиниці А2 і В одночасно й призначені для використання в імунізації через слизові, але не в лікуванні пухлин. Заявка WO 02/077249 описує авірулентні мутантні штами Yersinia enterocolitica, призначені для доставки гетерологічних білків до специфічних мутантних клітин-мішень. Крім того, згадують використання субодиниці А1 холерного токсину, але патентний документ не говорить про секрецію й відноситься тільки до лікування інфекцій і інфекційних станів. 94974 24 Заявка WO 2004/018630 розкриває рекомбінантні дволанцюгові Рнк-Фаги, що кодують дволагцюгову еукаріотичну касету експресії. Хоча згадують субодиницю А холерного токсину, документ не має подальшої значимості. Holmgren et al. дають короткий огляд, що стосуються області імунізації слизових і ад'ювантів. Автори обговорюють у числі іншого ефекти холерного токсину як ад'юванту для слизових, але не розкривають інформацію про генетичні системи експресує або живі вакцин і, крім того, не говорять про протипухлинну терапію (див. статтю Holmgren et al., 2003). Holmgren і Czerkinsky приводять також огляд по імунітеті слизових і вакцинам. Однак дана стаття обмежена тільки протиінфекційними факторами і у ній не обговорюють або не представляють очевидне можливе застосування в галузі протипухлинної терапії (див. статтю Holmgren і Czerkinsky, 2005). В іншому огляді, написаному Freytag і Clements, обговорюють ад'юванти для слизових у плані застосування в протипухлинній імунотерапії. Хоча холерний токсин відзначають у якості ад'ювантів для слизових, автори не говорять про конструкції токсин-антиген, що декретуються, і протипухлинну терапію як можливу галузь застосування (див. статтю Freytag і Clements, 2005). Shaw і Starnbach описують використання модифікованих бактеріальних токсинів для доставки вакцинних антигенів. Однак, у статті не згадують холерний токсин і, крім того, обмежуються прямим застосуванням злитих білків токсин-антиген для цілей вакцинації (див. статтю Shaw і Starnbach, 2003). Заявка WO 03/072789 стосується мікроорганізмів як носіїв нуклеотидних послідовностей, що кодують клітинні антигени, використовувані для лікування пухлин. Хоча патентний документ згадує секрецію й використання в галузі протипухлинної терапії, він зовсім не говорить про бактеріальні токсини й злиті білки. У роботах Gentschev, Dietrich і Goebel, а також Gentschev et al. описують бактеріальну спрямованість і її використання в розробці протипухлинної вакцини. Однак у двох даних документах не згадують про застосування бактеріальних токсинів і злитих білків у протипухлинній терапії (див. статті Gentschev et al., 2002a; Gentschev et al., 2002b). Заявка WO 98/23763 розкриває клітини Vibrio cholerae, що експресують субодиниці В і D гемолізину Е.coli поряд зі злитим поліпептидом, що включає гетерологічний антиген, злитий з hylA. Далі описаний вакцинний штам Vibrio cholerae, що експресує субодиницю В холерного токсину й злитий поліпептид секреторної сигнальної послідовності, гетерологічного антигену та субодиницю А2 холерного токсину. Нарешті, описаний злитий поліпептид, що включає субодиницю В холерного токсину, злиту з антигенною частиною субодиниці А або В токсину С difficile. Однак у патентній заявці не згадують використання злитого білка білкового токсину з антигеном гетерологічного небілкового токсину в протипухлинній терапії. Dietrich зі співавторами обговорюють два інструменти для доставки вакцини - гемолізин А і 25 Ns-теріолізин, які можна використовувати для одержання опосередкованого клітинами імунітету. Однак не згадують ніяких злитих білків типу білковий токсин - гетерологічний антиген або спільної експресії (див. статтю Dietrich et al., 2003). Gentschev et al. описують використання системи секреції -гемолізину Escherichia coli для доставки антигену у вакцинному штамі Salmonella typhi Ty21. Однак, автори не згадують про використання бактеріальних токсинів і злитих білків у протипухлинній терапії (див. статтю Gentschev et al., 2004). Заявка WO 02/47727 спрямована на лікувальні фактори, що включають В-субодиницю білкового токсину. Документ розкривають тільки злиті білки CtxB і EtxB з вірусним антигеном. Не згадують ніяку бактеріальну вакцину або доставку бактеріальної вакцини. Cheng-hua S і співавт. описують злиття генів В-субодиниці холерного токсину й епітопу HBV PreS2 і антигенність злитого білка в дослідженнях прямої імунізації. Однак не згадують ніяку бактеріальну вакцину або доставку бактеріальної вакцини (див. статтю Cheng-hua et al., 1995). Sanchez et al. розкривають, що ген Всубодиниці холерного токсину підвищує цитотоксичні відповіді імуноглобуліну A, Th 1-типу й CD8+ при внутрішньошкірному спільному введенні із ДНК-вакциною (див. статтю Sanchez et al., 2004). Однак у даному підході автори використовують ДНК як носій, що діє як стимулюючий Th1 ад'ювант для самої себе. Крім того, білки продукуються клітинами-хазяїнами й не доставляються безпосередньо або за допомогою бактеріального носія й, внаслідок цього, безпосередньо доступні для еукаріотичних клітин. Заявка WO 01/29233 спрямована на химерні імуногенні композиції й кодуючі їх нуклеїнові кислоти. Однак не згадують ніяку бактеріальну вакцину або доставку бактеріальної вакцини. Заявка WO 2007/044406 відноситься до способів стимуляції імунної відповіді з використанням системи доставки бактеріального антигену, що заснована на SopE, що несе сигнал секреції типу III. Однак у патентній заявці не згадують використання бактеріальних токсинів і злитих білків у протипухлинній терапії. У підсумку, з попереднього рівня техніки можна укласти, що неможливо створити нативні токсини для використання в людині через їх сильну токсичність. Крім того, їх використання в протипухлинній терапії було б шкідливим, оскільки придушувалася б відповідь уродженої імунної системи, зокрема, NK-клітин. Однак це та імунна відповідь, що є важливим компонентом успішної протипухлинної терапії, оскільки пухлинні клітини дуже часто втрачають свою здатність експресувати молекули МНС класу І i внаслідок цього стійкі до розпізнавання й атаки CTL. Використання субодиниць детоксифікованого токсину, з іншого боку, окремо або злитих з (гетерологічними) білками антигенів, приводить у результаті до сильно атенюірованого ад'ювантного ефекту і/або навіть індукованої системної толера 94974 26 нтності імунної системи, а також обмеженим слизуватими імунним відповідям антитіл і Th 2-типу. Крім того, секреція злитих білків (гетерологічний) антиген-токсин, що описаний тільки в розділі протиінфекційних вакцин (тобто торкається антигену або навіть сам токсину), як уважають, не тільки не проявляє переваг відносно цитоплазматичної експресії, але загалом, скоріше, є неприйнятною. У загальному й цілому не представлений ні підхід протипухлинної терапії, ні системна індукція Th 1-переважної клітинної імунної відповіді з використанням Т-клітин-хелперів, продукуючих ΘΦΗ-, ні індукція CTL, і не описана або не досягнута активація вродженої імунної системи, всі аспекти, які необхідні для протипухлинної терапії. Опис винаходу Метою даного винаходу є одержання нових протипухлинних вакцин, за допомогою яких індукується сильна системна клітинна відповідь імунної системи й може бути досягнута ефективна протипухлинна терапія. Ціль даного винаходу несподівано здійснена в одному аспекті шляхом одержання мікроорганізму як носія нуклеотидних послідовностей, що кодують антигени та білкові токсини, що включає наступні компоненти: (I) щонайменше одну нуклеотидну послідовність, що кодує щонайменше один повний або частковий антиген із щонайменше одного білка дикого типу або мутантного білка; і (II) щонайменше одну нуклеотидну послідовність, що кодує щонайменше один білковий токсин і/або щонайменше одну субодиницю білкового токсину; і (III) а) щонайменше одну нуклеотидну послідовність, що кодує щонайменше одну систему транспорту, що забезпечує можливість експресії продуктів експресії компонента (І) і компонента (II) на зовнішній поверхні мікроорганізму і/або забезпечує можливість секреції продуктів експресії компонента (І) і компонента (II) і/або кодує принаймні одну сигнальну послідовність, що забезпечує можливість секреції продуктів експресії компонента (І) і компонента (II) і/або b) необов'язково щонайменше одну нуклеотидну послідовність, що кодує щонайменше один білок для лізису мікроорганізму в цитозолі клітин ссавців і для внутрішньоклітинного вивільнення плазмід або векторів експресії, які утримуються в лізированому мікроорганізмі, і (IV) щонайменше одну нуклеотидну послідовність для щонайменше однієї послідовності активації для експресії одного або більше компонентів (І)-(III), причому зазначена послідовність активації може бути активована в мікроорганізмі і/або є специфічною для клітини тканини, специфічною для пухлинної клітини, макрофаг-специфічною, дендрит-специфічною, лімфоцит-специфічною, функція-специфічною або неспецифічною відносно клітини; причому кожен з компонентів (І)-(IV) може бути присутнім або один, або кілька разів і, якщо компонент із компонентів (I)-(IV) є присутнім кілька 27 разів, він може незалежно друг від друга бути або ідентичним або відрізнятись. У кращому варіанті здійснення передбачають мікроорганізм, що включає вищеописані компоненти (І)-(IV), причому компонент (І) і компонент (II) неідентичні, тобто компонент (І) не кодує щонайменше одну нуклеотидну послідовність, що кодує щонайменше один білковий токсин і/або щонайменше одну субодиницю білкового токсину. Термін "специфічний відносно клітини тканини" у сполученні з компонентом (IV) у даному винаході відноситься до послідовності(ям) активації, які специфічно активовані в клітинах тканинимішенях, таким як, наприклад, гормон-залежні промотори в тканинах простати. Термін "специфічний відносно пухлинних клітин" у сполученні з компонентом (IV) у даному винаході відноситься до послідовності(ям) активації, які специфічно активовані в пухлинних клітинах, таким як промоторні елементи, активовані дією пухлиноспецифічних онкогенів. Термін "макрофаг-специфічний" у сполученні з компонентом (IV) у даному винаході відноситься до послідовностям) активації, які специфічно активовані в макрофагах, таким як промоторні елементи, які кодуються макрофаг-специфічними генами, наприклад, геном, що кодує F4/80. Термін "дендрит-специфічний" у сполученні з компонентом (IV) у даному винаході відноситься до послідовності(ям) активації, які специфічно активовані в дендритних клітинах, таким як промоторні елементи, що контролюють експресію В7.1. Терміни " дендрит-специфічний" і "специфічний відносно дендритних клітин" еквіваленти, тобто вони мають однакове значення й обидва відносяться до дендритних клітин. Термін " лімфоцит-специфічний" у сполученні з компонентом (IV) у даному винаході відноситься до елементів, які специфічно активовані в клітинах лимфоцитарної лінії, таким як промоторні елементи, що регулюють експресію молекул CD3 в Тклітинах, або промоторні елементи, що регулюють експресію CD20 у зрілих В-клітинах. Термін " функція-специфічний" у сполученні з компонентом (IV) у даному винаході відноситься до послідовності(ям) активації, які специфічно активовані в клітинному контексті, наприклад, у пухлинних клітинах, які втратили експресію р53, або послідовність(і) активації, які активовані в бактеріях залежно від контексту, наприклад клітинної локалізації або тиску кисню. Термін "неспецифічний відносно клітини" у сполученні з компонентом (IV) у даному винаході відноситься до послідовності(ям) активації, які повсюдно активні, таким як конститутивно активні бактеріальні промотори. Термін "нуклеотидна послідовність" у даному винаході відноситься до dsDNA, ssDNA, dsRNA, ssRNA або гібридів dsDNA/RNA. Кращою є dsDNA. Термін "антиген" у даному винаході відноситься до молекул, які реактивні з антитілами, тобто які здатні генерувати антитіла. Деякі антигени самі по собі не викликають продукцію антитіл; тільки ті, які можуть індукувати продукцію антитіл, називають імуногенами. Для мети даного винаходу пе 94974 28 редбачають включення всіх відомих антигенів. Урівень знань компетентного фахівця в даній галузі техніки входить знайти необхідну інформацію щодо потенційних антигенів за допомогою баз даних і/або експериментального скринінгу без зайвих зусиль. Прикладами антигенів є в числі інших клітинних антигенів специфічні антигени клітин тканини (наприклад, клітин тканини, з яких утворюється пухлина), клітинні білкові антигени, вірусні антигени, вірусні білкові антигени й т.п. Кращими є білкові антигени. Крім того, кращі гетерологічні антигени або чужорідні антигени, тобто антигени, які не є ендогенними для відповідного мікроорганізму, представленого у винаході, або антигени, які не експресуються відповідним мікроорганізмом, представленим у винаході, у природних умовах, але інтродуковані за допомогою стандартних молекулярних біотехнологічних способів. Термін "повний антиген" у даному винаході відноситься до повних молекул, які реагують із антитілами відповідно до вищенаведеного визначення. Прикладами повних антигенів є, наприклад, білки повної довжини (непроцесовані), які також кращі. Термін "частковий антиген" у даному винаході відноситься до специфічних частин молекул, які реагують із антитілами відповідно до вищенаведеного визначення. Часткові антигени можуть являти собою, наприклад, білкові мотиви, такі як амінокислотні петлі в білках, домени протеїнкінази, епітопи й т.п. Кращими є домени протеїнкінази й епітопи, останні з яких являють собою специфічні центри антигену, розпізнаваного антитілом (які називають також антигенними детермінантами). Терміни "дикий тип" і "мутантний" у сполученні з терміном "білок" у даному винаході відноситься до білка, що складається із їх будь-який "природної" переважної послідовності амінокислот (яка кодується відповідною нуклеотидною послідовністю), і білкам, які включають одну або більше мутацій у їх послідовностях амінокислот (які кодуються відповідною нуклеотидною послідовністю) у порівнянні з послідовністю дикого типу, відповідно. Переважно, коли білки дикого типу і/або мутантні білки виділені з пухлинних клітин. Що стосується часткових антигенів, переважно, крім того, щоб послідовність охоплювала мутації, тобто вибирають епітоп, що переважно включає одну або більше мутацій, наприклад, епітоп B-Raf V600E. Мікроорганізми в розумінні винаходу являють собою бактерії, грампозитивні бактерії, грамнегативні бактерії й еукаріотичні клітини, з яких останні включають одноклітинні паразити, дріжджі, пухлинні клітини й клітини клітинних ліній, такі як Sacharomyces cerevisiae, Leishmania spp., аутологічні виділені в пацієнта пухлинні клітини й пухлинні клітинні лінії. Дані мікроорганізми, як правило, використовують як носії для переносу нуклеотидних послідовностей, що є чужорідними (гетерологічними або гетерогенними) для мікроорганізму. Переважно, коли використовують бактерії, які атенюіровані по вірулентності, наприклад, бактерії, які несуть делецію або інактивований ген aroА, aro, asd, gal, pur, cya, crp, phoP/Q, omp або являють собою чуттєві до температури мутанти (див. стат 29 тю Cardenas і Clements, 1992). Крім того, кращою як мікроорганізм, що включає вищевказані компоненти (І)-(IV), є грамнегативна, атенюірована, факультативно внутрішньоклітинна бактерія як носій, що здатна подолати слизову оболонку кишки (наприклад, Salmonella spp. або Shigella spp.). У кращому варіанті здійснення передбачають мікроорганізм, що включає вищевказані компоненти (І)-(IV), причому мікроорганізм вибраний із групи, що складається з "бактерії, грампозитивної бактерії, грамнегативної бактерії, еукаріотичної клітини" і переважно вибраний із групи, що складається з "Escherichia sрр., Escherichia coli, Salmonella spp., Salmonella typhi, Salmonella typhimurium, Yersinia spp., Yersinia enterocolitica, Vibrio spp., Vibrio cholerae, Listeria spp., Listeria monocytogenes, Shigella spp., Shigella flexneri", причому переважно, коли вірулентність мікроорганізму атенюірована. Крім того, кращий Vibrio cholerae виключений з визначених вище мікроорганізмів. Термін "spp." у зв'язку з будь-яким мікроорганізмом передбачає включення для мети даного винаходу всіх членів даного роду, включаючи види, підвиди й ін. Термін "Salmonella spp.", наприклад, передбачає включення всіх членів роду Salmonella, таких як Salmonella typhi і Salmonella typhimurium. В іншому кращому варіанті здійснення передбачають мікроорганізм, що відповідає вищенаведеним визначенням, у якому щонайменше один повний або частковий антиген щонайменше одного білка дикого типу або мутантного білка, що відповідає компоненту (І), вибраний із групи, що складається з наступних білків дикого типу і їхніх відомих мутантів: "рецептор; позаклітинна, трансмембранна або внутрішньоклітинна частина рецептора; молекула адгезії; позаклітинна, трансмембранна або внутрішньоклітинна частина молекули адгезії; білок сигнальної трансдукції; білок клітинного циклу; фактор транскрипції; білок диференціювання; ембріональний білок; вірусний білок; алерген; білок мікробного патогену; білок еукаріотичечного патогену; білок антигену рака яєчка; білок пухлинного антигену і/або специфічний білок клітини тканини", причому клітина тканини вибрана із групи, що складається з "щитовидної залози, молочної залози, слинної залози, лімфатичного вузла, слизової оболонки шлунка, нирки, яєчника, простати, шийки матки, серозної оболонки сечового міхура й невуса". Що стосується мутантного білка, то мутація може бути онкогенною й може викликати втрату або розширення його вихідних клітинних функцій. Дані антигени здійснюють контроль клітинного росту у клітині й розподілу клітини та представлені на клітинній мембрані нормальних клітин, наприклад, за допомогою молекули МНС класу І. У пухлинних клітинах дані гени часто надекспресуються або специфічно піддаються мутації. Дані мутації можуть мати обмеження функцій супресорів онкогенів або, як наслідок, активацію протоонкогенів в онкогени й можуть бути включені самі по собі або, звичайно, зі надекспресією у ріст пухлини. Дані клітинні антигени представлені на мембрані пух 94974 30 линних клітин і, таким чином, представляють антиген на пухлинних клітинах, однак, не викликаючи імунну реакцію, що впливає на пухлинне захворювання пацієнта. Rapp (US 5156841) уже описав використання онкопротеїнів, тобто продуктів експресії онкогенів у якості імуногену для протипухлинних вакцин. Прикладами антигенів і їх (онкогенних) мутацій, що відповідають винаходу, є і) рецептори, такі як Her-2/neu, андрогенний рецептор, естрогенний рецептор, лактоферриновий рецептор, midkineрецептор, рецептор EGF, рецептор ERBB2, ERBB4, рецептор TRAIL, FAS, рецептор TNF, рецептор TGF-; іі) білки сигнальної трансдукції, такі як c-Raf (Raf-1), A-Raf, B-Raf, B-Raf V599E, BRaf V600E, B-Raf KD, домен кінази B-Raf V600E, домен кінази KD B-Raf V600E, B-Raf V600E, домен кінази B-Raf, домен кінази KD B-Raf, Ras, Bcl-2, Bcl-X, Bcl-W, Bfl-1, Brag-1, Mcl-1, A1, Bax, BAD, Bak, Bcl-Xs, Bid, Bik, Hrk, Bcr/abl, Myb, C-Met, IAP1, IAO2, XIAP, ML-IAP LIVIN, сурвивін, APAF-1; iii) білки контролю клітинного циклу, такі як циклін D(1-3), циклін Е, циклін А, циклін В, циклін Н, Cdk1, Cdk-2, Cdk-4, Cdk-6, Cdk-7, Cdc25C, p16, p15, p21, p27, p18, pRb, p107, p130, E2F(1-5), GAAD45, MDM2, PCNA, ARF, PTEN, APC, BRCA, p53 і гомологи; iv) фактори транскрипції, такі як С-Мус, NFB, c-Jun, ATF-2, Sp1; v) ембріональні білки, такі як карциноембріональний антиген, -фетопротеїн, MAGE, MAGE-1, MAGE-3, NY-ESO-1, PSCA; vi) антигени диференціювання, такі як MART, Gp100, тирозиназа, GRP, TCF-4, основний мієлін, лактальбумін, GFAP, простатаспецифічний антиген (PSA), фібрилярний кислий білок, тирозиназа, EGR-1, MUC1; vii) вірусні антигени, такі як наступні віруси: ВІЛ, HPV, HCV, HPV, EBV, CMV, HSV, вірусу грипу, вірусу грипу типу А, вірусу грипу типу A (H5N1) і (H3N2), вірусу грипу типу В, вірусу грипу типу С; гемагглютининів, гемагглютиніну Н1, гемагглютиніну Н5, гемагглютиніну Н7, гемагглютиніну НА1 (переважно з вірусу грипу A (A/Thailand/1 (ΚΑΝ-1)2004(Η5Ν1), гемагглютиніну НА12 (переважно з вірусу грипу A (A/Thailand/1 (KANl)2004(H5Nl), гемагглютиніну НА12С (переважно з вірусу грипу A (A/Thailand/1 (KAN-1)2004(Η5Ν1), нейрамідаза, мікробні антигени: р30, LLO, уреаза й т.п., антигени еукаріотичних патогенів: CSP (малярія), калфлагін (трипаносома), СРВ (Leishmania major) і т.п. У ще одному кращому варіанті здійснення передбачають мікроорганізм, що відповідає вищенаведеним визначенням, причому щонайменше один повний або частковий антиген щонайменше одного білка дикого типу або мутантного білка, що відповідає компоненту (І), вибраний із групи, що складається з наступних білків дикого типу і їхніх відомих мутантів: Her-2/neu, андрогенний рецептор, естрогенний рецептор, midkine-рецептор, рецептор EGF, рецептор ERBB2, ERBB4, рецептор TRAIL, FAS, рецептор TNF-, рецептор TGF-, лактофериновий рецептор, основний мієлін, лактальбумін, GFAP, фібрилярний кислий білок, тирозиназа, EGR-1, MUC1, c-Raf (Raf-1), A-Raf, BRaf, B-Raf V599E, B-Raf V600E, B-Raf KD, домен кінази B-Raf V600E, B-Raf V600E KD, домен кінази 31 KD B-Raf V600E, домен кінази B-Raf, домен кінази KD B-Raf, N-Ras, K-Ras, H-Ras, Bcl-2, Bcl-X, Bcl-W, Bfl-1, Brag-1, Mcl-1, A1, Bax, BAD, Ваk, Bcl-Xs, Bid, Віk, Hrk, Bcr/abl, Myb, C-Met, IAP1, IAO2, XIAP, MLIAP LIVIN, сурвивін, APAF-1, циклін D(1-3), циклін Ε, циклін А, циклін В, циклін Η, Cdk-1, Cdk-2, Cdk4, Cdk-6, Cdk-7, Cdc25C, p16, p15, p21, p27, p18, pRb, p107, p130, E2F(1-5), GAAD45, MDM2, PCNA, ARF, PTEN, APC, BRCA, Akt, PI3K, mTOR, p53 і гомологи, С-Мус, NFB, c-Jun, ATF-2, Sp1, простатаспецифічний антиген (PSA), карциноембріональний антиген, -фетопротеїн, PAP; PSMA; STEAP; MAGE, MAGE-1 , MAGE-3, NY-ESO-1, PSCA, MART, Gp100, тирозиназа, GRP, TCF-4, вірусні антигени вірусів ВІЛ, HPV, HCV, HPV, EBV, CMV, HSV, вірусу грипу, вірусу грипу типу А, вірусу грипу типу A (H5N1) і (H3N2), вірусу грипу типу В, вірусу грипу типу С; гемагглютининів, гемагглютиніну Н1, гемагглютиніну Н5, гемагглютиніну Н7, гемагглютиніну НА1 (переважно з вірусу грипу A (A/Thailand/1 (ΚΑΝ-1)2004(Η5Ν1), гемагглютиніну НА12 (переважно з вірусу грипу А (A/Thailand/1 (KAN-1)2004(H5N1), гемагглютиніну НА12С (переважно з вірусу грипу A (A/Thailand/1 (ΚΑΝ1)2004(Η5Ν1), нейрамидази, р60, LLO, уреази, CSP, калфлагіну і/або СРВ». У ще одному кращому варіанті здійснення передбачають мікроорганізм, що відповідають вищенаведеним визначенням, причому щонайменше один повний або частковий антиген щонайменше одного білка дикого типу або мутантного білка, що відповідає компоненту (І) вибраного із групи кіназ, що складається з наступних білків дикого типу і їх відомих мутантів (реєстраційні номери наводяться у дужках: ААK1 (NM 014911), ААТK (NM 004920), ABL1 (NM 005157), ABL2 (NM 005158), АСK1 (NM 005781), ACVR1 (NM 001105), ACVR1B (NM 020328), ACVR2 (NM 001616), ACVR2B (NM 001106), ACVRL1 (NM 000020), ADCK1 (NM 020421), ADCK2 (NM 052853), ADCK4 (NM 024876), ADCK5 (NM 174922), ADRBK1 (NM 001619), ADRBK2 (NM 005160), АKТ1 (NM 005163), АKТ2 (NM 001626), АKТ3 (NM 005465), ALK (NM 004304), ALK7 (NM 145259), ALS2CR2 (NM 018571), ALS2CR7 (NM 139158), AMHR2 (NM 020547), ANKK1 (NM 178510), ANKRD3 (NM 020639), APEG1 (NM 005876), ARAF (NM 001654), ARK5 (NM 014840), ATM (NM 000051), ATR (NM 001184), AURKA (NM 003600), AURKB (NM 004217), AURKC (NM 003160), AXL (NM 001699), BCKDK (NM 005881), BCR (NM 004327), BIKE (NM 017593), BLK (NM 001715), BMPR1 A (NM 004329), BMPR1 В (NM 001203), BMPR2 (NM 001204), BMX (NM 001721), BRAF (NM 004333), BRD2 (NM 005104), BRD3 (NM 007371), BRD4 (NM 014299), BRDT (NM 001726), BRSK1 (NM 032430), BRSK2 (NM 003957), ВТK (NM 000061), BUB1 (NM 004336), BUB1 В (NM 001211), CABC1 (NM 020247), CAMK1 (NM 003656), CaMK1b (NM 198452), CAMK1D (NM 020397), CAMK1G (NM 020439), CAMK2A (NM 015981), CAMK2B (NM 001220), CAMK2D (NM 001221), CAMK2G (NM 001222), CAMK4 (NM 001744), CAMKK1 (NM 032294), CAMKK2 (NM 006549), CASK (NM 003688), CCRK (NM 012119), CDC2 (NM 001786), 94974 32 CDC2L1 (NM 001787), CDC2L5 (NM 003718), CDC42BPA (NM 014826), CDC42BPB (NM 006035), CDC7L1 (NM 003503), CDK10 (NM 003674), CDK11 (NM 015076), CDK2 (NM 001798), CDK3 (NM 001258), CDK4 (NM 000075), CDK5 (NM 004935), CDK6 (NM 001259), CDK7 (NM 001799), CDK8 (NM 001260), CDK9 (NM 001261), CDKL1 (NM 004196), CDKL2 (NM 003948), CDKL3 (NM 016508), CDKL4 (NM 001009565), CDKL5 (NM 003159), CHEK1 (NM 001274), CHUK (NM 001278), CIT (NM 007174), CLK1 (NM 004071), CLK2 (NM 003993), CLK3 (NM 003992), CLK4 (NM 020666), CRK7 (NM 016507), CSF1 R (NM 00521 1), CSK (NM 004383), CSNK1 A1 (NM 001892), CSNK1 D (NM 001893), CSNK1 Ε (NM 001894), CSNK1 G1 (NM 022048), CSNK1 G2 (NM 001319), CSNK1 G3 (NM 004384), CSNK2A1 (NM 001895), CSNK2A2 (NM 001896), DAPK1 (NM 004938), DAPK2 (NM 014326), DAPK3 (NM 001348), DCAMKL1 (NM 004734), DCAMKL2 (NM 152619), DCAMKL3 (XM 047355), DDR1 (NM 013993), DDR2 (NM 006182), DMPK (NM 004409), DMPK2 (NM 017525.1), DYRK1 A (NM 001396), DYRK1 В (NM 006484), DYRK2 (NM 006482), DYRK3 (NM 003582), DYRK4 (NM 003845), EEF2K (NM 013302), EGFR (NM 005228), EIF2AK3 (NM 004836), EIF2AK4 (NM_001013703), EPHA1 (NM 005232), EPHA10 (NM 001004338), EPHA2 (NM 004431), EPHA3 (NM 005233), EPHA4 (NM 004438), EPHA5 (NM 004439), EPHA6 (XM 114973), EPHA7 (NM 004440), EPHA8 (NM 020526), EPHB1 (NM 004441), EPHB2 (NM 017449), EPHB3 (NM 004443), EPHB4 (NM 004444), EPHB6 (NM 004445), ERBB2 (NM 004448), ERBB3 (NM 001982), ERBB4 (NM 005235), ERK8 (NM 139021), ERN1 (NM 001433), ERN2 (NM 033266), FASTK (NM 025096), FER (NM 005246), FES (NM 002005), FGFR1 (NM 000604), FGFR2 (NM 022970), FGFR3 (NM 000142), FGFR4 (NM 022963), FGR (NM 005248), FLJ23074 (NM 025052), FLJ23119 (NM 024652), FLJ23356 (NM 032237), FLT1 (NM 002019), FLT3 (NM 0041 19), FLT4 (NM 002020), FRAP1 (NM 004958), FRK (NM 002031), FYN (NM 002037), GAK (NM 005255), GPRK5 (NM 005308), GPRK6 (NM 002082), GPRK7 (NM 139209), GRK4 (NM 005307), GSG2 (NM 031965), GSK3A (NM 019884), GSK3B (NM 002093), GUCY2C (NM 004963), GUCY2D (NM 000180), GUCY2F (NM 001522), H11 (NM 014365), HAK (NM 052947), HCK (NM 0021 10), HIPK1 (NM 152696), HIPK2 (NM 022740), HIPK3 (NM 005734), HIPK4 (NM 144685), HRI (NM 014413), HUNK (NM 014586), ICK (NM 016513), IGF1 R (NM 000875), IKBKB (NM 001556), IKBKE (NM 014002), ILK (NM 004517), INSR (NM 000208), INSRR (NM 014215), IRAKI (NM 001569), IRAK2 (NM 001570), IRAK3 (NM 007199), IRAK4 (NM 016123), ITK (NM 005546), JAK1 (NM 002227), JAK2 (NM 004972), JAK3 (NM 000215), KDR (NM 002253), KIS (NM 144624), KIT (NM 000222), KSR (XM 290793), KSR2 (NM 173598), LAK (NM 025144), LATS1 (NM 004690), LATS2 (NM 014572), LCK (NM 005356), LIMK1 (NM 016735), LIMK2 (NM 005569), LMR3 (XM 055866), LMTK2 (NM 014916), LOC149420 (NM 152835), LOC51086 (NM 015978), LRRK2 (XM 058513), LTK (NM 002344), LYN (NM 002350), МАK (NM 005906), MAP2K1 (NM 002755), MAP2K2 (NM 030662), 33 MAP2K3 (NM 002756), MAP2K4 (NM 003010), MAP2K5 (NM 002757), MAP2K6 (NM 002758), MAP2K7 (NM 005043), MAP3K1 (XM 042066), MAP3K10 (NM 002446), MAP3K1 1 (NM 002419), MAP3K12 (NM 006301), MAP3K13 (NM 004721), MAP3K14 (NM 003954), MAP3K2 (NM 006609), MAP3K3 (NM 002401), MAP3K4 (NM 005922), MAP3K5 (NM 005923), MAP3K6 (NM 004672), MAP3K7 (NM 003188), MAP3K8 (NM 005204), MAP3K9 (NM 033141), MAP4K1 (NM 007181), MAP4K2 (NM 004579), MAP4K3 (NM 003618), MAP4K4 (NM 145686), MAP4K5 (NM 006575), MAPK1 (NM 002745), MAPK10 (NM 002753), МАРK11 (NM 002751), MAPK12 (NM 002969), МАРK13 (NM 002754), MAPK14 (NM 001315), MAPK3 (NM 002746), MAPK4 (NM 002747), MAPK6 (NM 002748), MAPK7 (NM 002749), MAPK8 (NM 002750), MAPK9 (NM 002752), MAPKAPK2 (NM 032960), MAPKAPK3 (NM 004635), MAPKAPK5 (NM 003668), MARK (NM 018650), MARK2 (NM 017490), MARK3 (NM 002376), MARK4 (NM 031417), MAST1 (NM 014975), MAST205 (NM 0151 12), MAST3 (XM 038150), MAST4 (XM 291 141), MASTL (NM 032844), MATK (NM 139355), MELK (NM 014791), MERTK (NM 006343), MET (NM 000245), MGC33182 (NM 145203), MGC42105 (NM 153361), MGC43306 (C9orf96), MGC8407 (NM 024046), MIDORI (NM 020778), MINK (NM 015716), MKNK1 (NM 003684), MKNK2 (NM 017572), MLCK (NM 182493), MLK4 (NM 032435), MLKL (NM 152649), MOS (NM 005372), MST1 R (NM 002447), MST4 (NM 016542), MUSK (NM 005592), MYLK (NM 053025), MYLK2 (NM 0331 18), MYO3A (NM 017433), MYO3B (NM 138995), NEK1 (NM 012224), NEK10 (NM 152534), NEK11 (NM 024800), NEK2 (NM 002497), NEK3 (NM 002498), NEK4 (NM 003157), NEK5 (MGC75495), NEK6 (NM 014397), NEK7 (NM 133494), NEK8 (NM 178170), NEK9 (NM 0331 16), NLK (NM 016231), NPR1 (NM 000906), NPR2 (NM 003995), NRBP (NM 013392), NRBP2 (NM 178564), NRK (NM 198465), NTRK1 (NM 002529), NTRK2 (NM 006180), NTRK3 (NM 002530), OBSCN (NM 052843), OSR1 (NM 005109), PACE-1 (NM 020423), ΡΑΚ1 (NM 002576), PAK2 (NM 002577), PAK3 (NM 002578), PAK4 (NM 005884), PAK6 (NM 020168), PAK7 (NM 020341), PASK (NM 015148), PCTK1 (NM 006201), PCTK2 (NM 002595), PCTK3 (NM 212503), PDGFRA (NM 006206), PDGFRB (NM 002609), PDK1 (NM 002610), PDK2 (NM 00261 1), PDK3 (NM 005391), PDK4 (NM 002612), PDPK1 (NM 002613), PFTK1 (NM 012395), PHKG1 (NM 006213), PHKG2 (NM 000294), PIK3R4 (NM 014602), PIM1 (NM 002648), PIM2 (NM 006875), PIM3 (NM 001001852), PINK1 (NM 032409), PKE (NM 173575), PKMYT1 (NM 004203), pkn (NM 013355), PLK (NM 005030), PLK3 (NM 004073), PRKAA1 (NM 006251), PRKAA2 (NM 006252), PRKACA (NM 002730), PRKACB (NM 002731), PRKACG (NM 002732), PRKCA (NM 002737), PRKCB1 (NM 002738), PRKCD (NM 006254), PRKCE (NM 005400), PRKCG (NM 002739), PRKCH (NM 006255), PRKCI (NM 002740), PRKCL1 (NM 002741), PRKCL2 (NM 006256), PRKCM (NM 002742), PRKCN (NM 005813), PRKCQ (NM 006257), PRKCZ (NM 002744), PRKD2 94974 34 (NM 016457), PRKDC (NM 006904), PRKG1 (NM 006258), PRKG2 (NM 006259), PRKR (NM 002759), PRKWNK1 (NM 018979), PRKWNK2 (NM 006648), PRKWNK3 (NM 020922), PRKWNK4 (NM 032387), PRKX (NM 005044), PRKY (NM 002760), PRPF4B (NM 003913), PSKH1 (NM 006742), PSKH2 (NM 033126), PTK2 (NM 005607), PTK2B (NM 004103), PTK6 (NM 005975), PTK7 (NM 002821), PTK9 (NM 002822), PTK9L (NM 007284), PXK (NM 017771), QSK (NM 025164), RAD53 (NM 007194), RAF1 (NM 002880), RAGE (NM 014226), RET (NM 020975), RHOK (NM 002929), RIOK1 (NM 031480), RIOK2 (NM 018343), RIPK1 (NM 003804), RIPK2 (NM 003821), RIPK3 (NM 006871), RIPK5 (NM 015375), RNASEL (NM 021 133), ROCK1 (NM 005406), ROCK2 (NM 004850), ROR1 (NM 005012), ROR2 (NM 004560), ROS1 (NM 002944), RPS6KA1 (NM 002953), RPS6KA2 (NM 021 135), RPS6KA3 (NM 004586), RPS6KA4 (NM 003942), RPS6KA5 (NM 004755), RPS6KA6 (NM 014496), RPS6KB1 (NM 003161), RPS6KB2 (NM 003952), RPS6KC1 (NM 012424), RPS6KL1 (NM 031464), RYK (NM 002958), SBK (XM 370948), SCYL1 (NM 020680), SCYL2 (NM 017988), SGK (NM 005627), SgK069 (SU SgK069), SgK085 (XM 373109), SgK110 (SU SgKHO), SGK2 (NM 016276), SgK223 (XM 291277), SgK269 (XM 370878), SgK424 (CGP SgK424), SgK493 (SU_SgK493), SgK494 (NM 144610), SgK495 (NM 032017), SGKL (NM 013257), SK681 (NM 001001671), SLK (NM 014720), SMG1 (NM 015092), SNARK (NM 030952), SNF1 LK (NM 173354), SNF1 LK2 (NM 015191), SNK (NM 006622), SNRK (NM 017719), SRC (NM 005417), SRMS (NM 080823); SRPK1 (NM 003137), SRPK2 (NM 003138), SSTK (NM 032037), STK10 (NM 005990), STK11 (NM 000455), STK16 (NM 003691), STK17A (NM 004760), STK17B (NM 004226), STK18 (NM 014264), STK19 (NM 032454), STK22B (NM 053006), STK22C (NM 052841), STK22D (NM 032028), STK23 (NM 014370), STK24 (NM 003576), STK25 (NM 006374), STK3 (NM 006281), STK31 (NM 031414), STK32B (NM 018401), STK33 (NM 030906), STK35 (NM 080836), STK36 (NM 015690), STK38 (NM 007271), STK38L (NM 015000), STK39 (NM 013233), STK4 (NM 006282), STLK5 (NM 001003787), STYK1 (NM 018423), SUDD (NM 003831), SYK (NM 003177), TAF1 (NM 138923), TAF1 L (NM 153809), TAO1 (NM 004783), TAOK1 (NM 020791), TAOK3 (NM 016281), TBCK (NM 0331 15), TBK1 (NM 013254), TEC (NM 003215), ТЕК (NM 000459), TESK1 (NM 006285), TESK2 (NM 007170), TEX14 (NM 031272), TGFBR1 (NM 004612), TGFBR2 (NM 003242), TIE (NM 005424), TIF1 (NM 003852), TLK1 (NM 012290), TLK2 (NM 006852), TNIK (NM 015028), TNK1 (NM 003985), TOPK (NM 018492), TP53RK (NM 033550), TRAD (NM 007064), TRIB1 (NM 025195), TRIB2 (NM 021643), TRIB3 (NM 021 158), TRIM28 (NM 005762), TRIM33 (NM 015906), TRIO (NM 0071 18), TRPM6 (NM 017662), TRPM7 (NM 017672), TRRAP (NM 003496), TSSK4 (NM 174944), TTBK1 (NM 032538), TTBK2 (NM 173500), TTK (NM 003318), TTN (NM 003319), TXK (NM 003328), TYK2 (NM 003331), TYRO3 (NM 006293), ULK1 (NM 003565), ULK2 (NM 014683), ULK3 (NM 015518), ULK4 (NM 017886), VRK1 (NM 35 003384), VRK2 (NM 006296), VRK3 (NM 016440), WEE1 (NM 003390), Weel В (NM 173677), YANK1 (NM 145001), YES1 (NM 005433), ΖΑΚ (NM 016653), і/або ZAP70 (NM 001079)". Термін "алерген" у контексті даного винаходу відноситься до повних або часткових антигенів, як визначено в даному контексті, які викликають гіперчутливість і/або алергійні реакції. Прикладами є Der p 5 (кліщі), Bet v 1 (пилок берези), Phi p 1 (пилок злаків), Asp f I/a (Aspergillus), PLA 2 (бджола), Hev b (латекс) (див. статтю Schmid-Grendelmeier і Crameri, 2001). Антигени мікробних і еукаріотичних патогенів і антигени раку яєчка наведені в переліку вище. У даному винаході білкові токсини і/або їх субодиниці, що відповідають компоненту (II), переважно являють собою бактеріальні білкові токсини, більш переважно - екзотоксини. Прикладами бактеріальних екзотоксинів є токсини типу І (суперантигени), токсини типу II (пороутворюючі токсини) і (ііі) токсини типу III (A-В токсини). У кращому варіанті здійснення передбачають мікроорганізм, що відповідає вищенаведеним описам, причму компонент (II) вибраний із групи, що складається з "бактеріального токсину, ентеротоксину, екзотоксину, токсину типу І, токсину типу II, токсину типу III, токсину типу IV, токсину типу V, токсину RTX, токсину АВ, токсину А-В, токсину А/В, токсину А+В, токсину А-5В і/або токсину АВ5. У ще одному кращому варіанті здійснення передбачають мікроорганізм, що відповідає вищенаведеним описам, причому компонент (II) вибраний із групи, що складається з "токсину аденілатциклази, токсину сибірської виразки, токсину сибірської виразки (EF), токсину сибірської виразки (LF), ботуліничного токсину, холерного токсину (СТ, Ctx), субодиниці холерного токсину В (СТВ, CtxB), дифтерійного токсину (DT, Dtx), токсину Е. coli LT, термолабільного ентеротоксину Е. coli (LT), субодиниці В термолабільного ентеротоксину Е. coli (LTB), токсину Е. coli ST, термостабільного ентеротоксину Е. coli (ST), еритрогенного токсину, токсину ексфоліатину, екзотоксину А, ентеротоксину Perfringens, токсину коклюшу (РТ, Ptx), шигатоксину (ST, Stx), субодиниці В шига-токсину (STB, StxB), шига-подібного токсину, ентеротоксинів Staphylococcus, правцевого токсину (ТТ), токсину синдрому токсичного шоку (TSST-1), веро-токсину (VT), токсину А (ТА) і токсину В (ТВ) Clostridium difficile, летального токсину (LT) і геморагічного токсину (НТ) Clostridium sordellii, -токсину (AT) Clostridium novyi". Однак, якщо холерний токсин або його субодиницю CtxB використовують як токсини, що відповідають компоненту (II), представленому у винаході, переважно не використовувати Vibrio cholerae як бактеріальний носій (мікроорганізму). У кращому варіанті здійснення передбачають мікроорганізм, що відповідає вишенаведеним визначенням, причому компонент (І) і компонент (II) зв'язані один з одним, щоб забезпечити можливість експресії і/або секреції злитого білка, який кодується обома компонентами. Більш переважно, коли даний злитий білок вибраний із групи, що складається з "CtxB-PSA, CtxB-B-Raf V600E KD 94974 36 (кіназа dead), CtxB- домен кінази B-Raf V600E, CtxДомен кінази KD B-Raf V600E (кіназа dead), CtxBB-Raf, CtxB-B-Raf KD (кіназа dead), Ctx-Домен кінази KD B-Raf (кіназа dead), CtxB-HAl (субодиниці І гемагглютиніну вірусу грипу), CtxB-HA12C". Секреція являє собою процес відділення, перетворення й вивільнення хімічних агентів із клітини, або хімічної субстанції, що декретується, або кількості субстанції. Секреція не унікальна тільки для еукаріот; вона присутня також у бактерій і архей. Транспортери типу АТФ-єднальної касети поширені у всіх трьох типах живих організмів. Система Sec також є іншою консервативною системою, що гомологічна транслокону в еукаріотичному ендоплазматичному ретикулюме, що складається з комплексу транслокону Sec 61 у дріжджів і комплексу Sec Y-E-G у бактерій. Грамнегативні бактерії мають дві мембрани, роблячи, таким чином, секрецію більш складною. Внаслідок цього в грамнегативних бактерій є щонайменше п'ять спеціалізованих систем секреції: (1) Система секреції типу І: Така ж, як вищезгадані транспортери АТФ-єднальної касети. (2) Система секреції типу II: від системи Sec залежить, чи перейде білок внутрішню мембрану й від іншої спеціальної системи - чи перейде він зовнішню мембрану. Бактеріальні пили використовують модифікації системи sec, але відрізняються від системи типу І. (3) Система секреції типу III (T3SS): вона гомологічна бактеріальному флагелярному базальному тілу. Вона схожа на молекулярний шприц, через який бактерія (наприклад Shigella або Yersinia) може інжектувати білки в еукаріотичні клітини. Низька концентрація Са2+ у цитозолі відриває вхід, що регулює T3SS. Система Нгр у патогенів рослин інжектує у рослини шпильки через подібні механізми. (4) Система секреції типу IV: Вона гомологічна механізму кон'югації бактерій (і архейних жгутикових). Вона здатна транспортувати як ДНК, так і білки. Вона виявлена в Agrobacterium tumefaciens, що використовує дану систему для інтродукції ТіПлазміди й білків хазяїнові, у якого розвивається корончатий галл (пухлина). Helicobacter pylori використовує систему секреції IV, щоб увести Cag А в епітеліальні клітини шлунка. Bordetella pertussis, збудник коклюшу, секретує токсин коклюшу частково за допомогою системи типу IV. (5) Система секреції типу V, також називана системою аутотранспортерів: Вона використовує систему sec для переходу крізь внутрішню мембрану. Білки, які використовують даний шлях мають здатність формувати -бочку на С-кінці й інсерт у зовнішню мембрану для транспорту іншої частини пептиду із клітини. Нарешті, -бочка може відщепитись й залишатися в зовнішній мембрані. Деякі вважають, що з даних залишків аутотранспортерів утворяться порини, які подібні -бочкам. Бактерії, а також мітохондрії й хлоропласти також використовують багато інших спеціальних транспортних систем, таких як шлях подвійної транслокації аргиніну (Tat), що, на противагу SeeЗалежному експорту, транспортують повністю покладені білки крізь мембрану. Назва даної системи 37 походить із необхідності присутності двох наступних один за одним аргінінів у сигнальній послідовності, що вимагаються для спрямованості на дану систему. Секреція в грамнегативних бактеріях включає подолання внутрішньої й зовнішньої мембран за допомогою підходящої системи секреції, подібної, наприклад, системі секреції НІу типу І або типу III або аутоторанспортеру AIDА. У грампозитивних бактеріях система секреції повинна переборювати внутрішню мембрану й клітинну стінку, що в більшості штамів може досягатися злиттям у підходящим сигналом секреції. Компонент (III) а) являє собою щонайменше одну нуклеотидну послідовність, що кодує щонайменше одну транспортну систему, що забезпечує можливість експресії продуктів експресії компонента (І) і компонента (II) на зовнішній поверхні мікроорганізму і/або забезпечує можливість секреції продуктів експресії компонента (І) і компонента (II). Відповідний компонент необов'язково може або декретуватись, або експресуватись на мембрані мікроорганізму, тобто бути пов'язаним з мембраною. Дані транспортні системи являють собою, наприклад і) систему секреції типу І, систему секреції типу II, систему секреції типу III, систему секреції типу IV, систему секреції типу V, іі) гемолізинову транпортну систему (сигнал) Е. coli (нуклеотидні послідовності, що включають HlyA, HlyB і HlyD під контролем hly-специфічного промотору); варто використовувати наступні транспортні сигнали: для секреції - С-Кінцевий транспортний сигнал HlyA у присутності білків HlyB і HlyD; для пов'язаної з мембраною експресії - С-кінцевий транспортний сигнал HlyA у присутності білка HlyB, ііі) гемолізинову транспортну систему (сигнал) Е. coli (нуклеотидні послідовності, що включають HlyA, HlyB і HlyD, під контролем не-hlуспецифічного бактеріального промотору), iv) Транспортний сигнал для білка S-Шapy (Rsa A) Caulobacter crescentus; варто використовувати наступні транспортні сигнали: для секреції й пов'язаної з мембраною експресії - С-кінцевий транспортний сигнал RsaA, ν) транспортний сигнал для білка ToIC Escherichia coli; варто використовувати наступні транспортні сигнали: пов'язаної з мембраною експресії - N-кінцевий транспортний сигнал ТоІС (повний мембранний білок ToIC E. coli являє собою багатофункціональний пороутворюючий білок зовнішньої мембрани Е. coli, що служить на додаток до таких функцій, як прийом коліцину Е1 (див. статтю Morona et al., 1983) і секреція коліцину V (див. статтю Fath et al., 1991), також як рецептор для фага U3 (див. статтю Austin et al., 1990); даний білок виявлений не тільки в Е. coli, але також у безлічі грамнегативних бактерій (див. статтю Wiener, 2000); локалізація в зовнішній мембрані й широкому поширенні роблять ТоІС ідеальним кандидатом для подання гетерологічних антигенів, щоб, наприклад, викликати імунну реакцію. Грамнегативні бактерії не укладені в зовнішню мембрану. Секреція в-даних випадках відбувається простіше й звичайно не вимагає спеціального механізму секреції для транспорту через клітинну мембрану й клітинну стінку. У випадку грампозитивних бактерій сигнали секреції злиті по N-Кінці з 94974 38 гетерологічним білком і, як правило, необхідні й достатні для секреції. Білки, для яких описані дані сигнальні послідовності, включають в основному всі бактеріальні білки, що секретуються. Прикладами для листерій є сигнали секреції, виділені з листеріолізину, р60 або ActA. У загальному аналогічний підхід застосовують до еукаріотичних клітин, де сигнальна послідовність (наприклад, універсальний сигнал секреції Vtgss), напрямна білок на ендоплазматичний ретикулюм під час відсутності сигналу втримання, необхідна й достатня для секреції. Необов'язковий компонент (III) b) являє собою щонайменше одну нуклеотидну послідовність, що кодує щонайменше один білок для лізису мікроорганізму в цитозолі клітин ссавців і для внутрішньоклітинного вивільнення плазмід або векторів екпресії, які утримуються в лізированому мікроорганізмі. Дані літичні білки (ендолізини) являють собою, наприклад білки лізису, специфічні для Listeria, такі як PLY551 (див. статтю Loessner et al., 1995) і/або специфічний для Listeria холін під контролем промотору листерій. Кращий варіант здійснення даного винаходу являє собою комбінацію різних компонентів (III) b), наприклад, комбінацію білка лізису й холіну. Обидва компоненти (III) а) і/або (III) b) можуть бути незалежно один від одного конститутивно активними. У кращому варіанті здійснення передбачають мікроорганізм, що відповідає вищенаведеним визначенням, причому компонент (III) а) вибраний із групи, що складається з "системи секреції типу І, системи секреції типу II, системи секреції типу III, системи секреції типу IV, системи секреції типу V, гемолізинової системи транспорту (сигнал) Escherichia coli (нуклеотидні послідовності, що включають HlyA, HlyB і HlyD під контролем hlyспецифічного промотору), гемолізинової системи транспорту (сигнал) Escherichia coli (нуклеотидні послідовності, що включають HlyA, HlyB і HlyD під контролем не-hlу-специфічного промотору)), транспортного сигналу для білка S-Шару (Rsa A) Caulobacter crescentus, транспортного сигналу для білка ToIC Escherichia coli, сигналу секреції Vtgss і/або сигналів секреції, виділених з листеріолізину, р60 і/або ActA" і причому компонент (III) b) вибраний із групи, що складається з "ендолізинів, літичного білка грампозитивних бактерій, літичного білка Listeria monocytogenes, PLY551 Listeria monocytogenes і/або холіну Listeria monocytogenes". У наступному кращому варіанті здійснення такий же компонент (III) а) забезпечує можливість експресії продуктів експресії компонента (І) і компонента (II) на зовнішній поверхні мікроорганізму і/або забезпечує можливість секреції продуктів експресії компонента (І) і компонента (II). Саме в даному кращому варіанті здійснення компонент(III) а) являє собою щонайменше одну нуклеотидну послідовність, що кодує тільки одну транспортну систему, що забезпечує можливість супутньої експресії продуктів експресії компонента (І) і компонента (II) на зовнішній поверхні мікроорганізму і/або забезпечує можливість супутньої секреції продук 39 тів експресії компонента (І) і компонента (II), причому даний кращий компонент (III) а) являє собою щонайменше одну нуклеотидну послідовність, що кодує гемолізинову транспортну систему (сигнал) Escherichia coli (нуклеотидні послідовності, що включають HlyA, HlyB і HlyD під контролем hlyспецифічного промотору) або гемолізинову транспортну систему (сигнал) Escherichia coli (нуклеотидні послідовності, що включають HlyA, HlyB і HlyD під контролем не-hlу-специфічного бактеріального промотору. У ще одному кращому варіанті здійснення передбачають мікроорганізм, що відповідає вищенаведеним визначенням, причому відповідно до компонента (III) а) продукти експресії компонентів (І) і компонента (II) секретуються. Краще, коли компонент (І) і компонент (II) зв'язані один з одним, експресуються разом у вигляді злитого білка, який кодується, обома компонентами. Ще краще, коли даний злитий білок вибраний із групи, що складається з "CtxB-PSA, CtxB-B-Raf V600E KD (кіназа dead), Ctx-Домен кінази B-Raf V600E, Ctx-B-Домен кінази KD Raf V600E (кіназа dead), CtxB-B-Raf, CtxB-B-Raf KD (кіназа dead), CtxB-B- домен кінази KD Raf (кіназа dead), CtxB- HA1 (субодиница І гемагглютиніну вірусу грипу), CtxB-НА12С". У даному винаході, термін "секреція" відноситься до секреції білкового антигену, білкового токсину і/або злитого білка токсин-антиген через обидві мембрани грамегативної бактерії або крізь внутрішню мембрану й клітинну стінку грампозитивної бактерії в прилягаюче середовище за допомогою належної системи секреції, такої як проілюстровані вище. Оскільки відомо, що при використанні системи секреції, такої як гемолізинова система секреції типу І з Е. coli, продукт секреції, як правило, виявляють у всіх клітинних фракціях: цитоплазматично асоційованим з мембраною й локалізованим в аутомембранних пухирцях і таким, що повністю секретується у прилягаюче середовище (див. статтю Balsalobre et al., 2006), у даному винаході не потрібно, щоб секреція була повною. Однак бажана й краща повна або майже повна секреція, тобто більша частина продукту секреції, що повністю секретується. Компонент (IV) являє собою щонайменше одну нуклеотидну послідовність для щонайменше однієї послідовності активації для експресії одного або більше компонентів (І)-(III), причому зазначена послідовність активації може бути активована в мікроорганізмі і/або є специфічною для клітини тканини, специфічної для пухлинної клітини, макрофаг-специфічний, дендрит-специфічної, лімфоцит-специфічної, функці-специфічної або неспецифічної відносно клітини. Якщо експресія є мембрана-зв'язаною на зовнішній поверхні мікроорганізму, то переважно послідовність активації вибирають так, щоб вона була здатна активуватися в мікроорганізмі. Дані послідовності активації являють собою, наприклад: і) конститутивно активні промоторні ділянки, такі як промоторна ділянка з "сайтом зв'язування рибосом" (RBS) гена -лактамази Е. coli або гена tetA (див. статтю Busby і Ebright, 1994), ендогенний 94974 40 промотор локусу hly Ε. coli; іі) промотори, які здатні індукуватись, переважно промотори, які стають активними після входу в клітку. До них належить промотор actA L. monocytogenes (див. статтю Dietrich et al., 1998) або промотор pagC S. typhimurium (див. статтю Bumann, 2001). Якщо плазміди вивільняються з мікроорганізму після його лізису в цитозолі клітини ссавця, послідовність активації не є специфічною відносно клітини, але специфічної відносно клітини тканини, специфічної відносно клітинного циклу або функціспецифічної. Переважно, коли вибирають такі послідовності активації, які особливо активуються в макрофагах, дендритні клітини й лімфоцитах. У наступному кращому варіант здійснення передбачають мікроорганізм, що відповідає вищенаведеним визначенням, у якому компонент (І) вибраний із групи, що складається з B-Raf V600E, домену кінази B-Raf V600E, B-Raf V600E KD (кіназа dead), домену кінази KD B-Raf V600E (кіназа dead), B-Raf KD (кіназа dead), домену кінази B-Raf, домену кінази KD B-Raf (кіназа dead), простатаспецифічного антигену (PSA), гемагглютиніну НА1 (переважно з вірусу грипу A (A/Thailand/1 (ΚΑΝ1)2004(Η5Ν1), гемагглютиніну НА12 (переважно з вірусу грипу A (A/Thailand/1 (ΚΑΝ-1)2004(Η5Ν1), гемагглютиніну НА12С (переважно з вірусу грипу А (A/Thailand/1 (KAN-1)2004(H5N1)"; компонент (II) вибраний із групи, що складається з "субодиниці В холерного токсину (СТВ, CtxB), субодиниці В термолабільного ентеротоксину Е. coli (LTB), правцевого токсину (ТТ)"; компонент (III) а) вибраний із групи, що складається з "сигналу гемолізинового транспорту HlyA Escherichia coli разом з компонентами системи секреції Hly (нуклеотидними послідовностями, що включають Hly А, НІуВ і HlyD під контролем hly-специфічного промотору)"; компонент (IV) вибраний із групи, що складається з "ендогенного промотору локусу hly E. coli", причому компонент (І) і компонент (II) зв'язані один з одним, щоб забезпечити можливість експресії злитого білка, який кодується обома компонентами й причому злитий білок секретується. Проілюстровані вище мікроорганізми, що відповідають компонентам (І)-(IV), а також кращі варіанти здійснення далі називаються мікроорганізмами, що відповідають винаходу. Мікроорганізми, що відповідають винаходу, переважно підходять для використання в протипухлинній терапії як живі вакцини в ході одержання спрямованості на пухлину. Саме за допомогою мікроорганізмів, що відповідають винаходу, які діють як носії генетичної інформації, гетерологічні антигени разом з білковими токсинуми транспортуються в область пухлини, експресуються як злиті білки й секретуються in situ. Виявлено, що мікроорганізми, які відповідають винаходу, несподівано й переважно характеризуються за допомогою ефективної й підвищеної експресії й секреції злитих білків токсин-антиген, що транспортуються, кодуються і експресуються, тобто ніякі цитоплазматичні і/або периплазматичні агрегати не присутні. Більше того, шляхом введення мікроорганізмів, що відповідають винаходу, несподівано ви 41 кликається сильна системна клітинна відповідь імунної системи в порівнянні з перорально білковими вакцинами, що вводяться, які, навпроти, індукують системну толерантність імунної системи. Найбільше помітно, що, крім індукції системної клітинної відповіді імунної системи Th 1-типу, мікроорганізми, що відповідають винаходу, викликають активацію цитотоксичних Т-клітин (CTL) CD8+ з рестрикцією МНС класу І і сильно підвищують дану імунну відповідь CTL. Крім того, на додаток до індукції і/або підвищенню рівня сильних клітинних системних Th1- і CTL-Відповідей імунної системи вроджена імунна система, наприклад NK-клітини, NKT-клітини і/або - Т-клітини також несподівано активуються мікроорганізмами, що відповідають винаходу, синергичним шляхом. При використанні холерного токсину як компонента токсину, мікроорганізми, що відповідають винаходу, мають перевагу в тому, що в людині відсутній звичайно ісиучий конституціональний імунітет проти токсину, (на відміну від правцевого токсину, наприклад, внаслідок протиправцевої вакцинації в дитинстві). Тому кращим є використання холерного токсину і/або його субодиниць, зокрема, CtxB. Мікроорганізми, що відповідають винаходу, особливо підходять для перорального застосування в спрямованій протипухлинній (імуно)терапії на основі живої вакцини. Внаслідок цього можна поліпшити дотримання пацієнтами режиму й схеми лікування. Однак мікроорганізми, що відповідають винаходу, не обмежені застосуванням тільки в протипухлинній терапії. У принципі мікроорганізми, що відповідають винаходу, підходять також для лікування і/або профілактики всіх даних захворювань, для яких потрібна терапія, у якій обов'язковою є індукція системної клітинної Th 1-відповіді імунної системи. Приклади даних інфекційних захворювань включають, але без обмеження ВІЛ, грип, HCV і інші вірусні хвороби, Mycobacterium tuberculosis, Listeria monocytogenes і інші бактеріальні захворювання. Мікроорганізми, що відповідають винаходу, повною мірою підходять для лікування захворювань, подібних до грипу, при яких необхідна оптимальний захист за допомогою комбінації відповіді імунної системи слизових і системної клітинної імунної відповіді. Крім того, їх можна було б використовувати для специфічної індукції Th 1подібного імунітету при алергійних захворюваннях, наприклад, алергійному риніті. У цьому випадку антиген представляв би собою алерген, що зливають із компонентом білкового токсину й принцип дії відповідної вакцини складався б у зрушенні імунної відповіді з Th 2-переважні імунні відповіді відносно алергену при алергійних реакціях (захворюваннях) до Th 1-імунної відповіді. Кращим способом застосування є пероральне застосування. У кращому варіанті здійснення штам Salmonella, що відповідає даному винаходу, ферментують у підходящому середовищі, збирають і промивають центрифугуванням і потім одержують і стабілізують із використанням відповідних субстанцій і ліофілізують. Ліофілізованою субстанцією 94974 42 наповнюють стійкі в шлунку капсули, що містять 9 10 живі клітини в кількості переважно від 10 до 10 бактерій. Капсули перорально приймають із рідиною. Альтернативно ліофілізовані бактерії, як описано вище, вводять разом з пакетиком, що містять буфер, який може нейтралізувати шлункову кислоту (фармацевтичний набір). У кращому варіанті здійснення даний буфер являє собою карбонатний буфер. Безпосередньо перед застосуванням буфер готовлять із водою й приймають, відразу після цього приймають ліофілізовані бактерії, змішані з водою. Ще одною альтернативою є використання заморожених бактерій. У цьому випадку після промивання бактерії стабілізують за допомогою стабілізатора, переважно сахарози або гліцерину, і потім заморожують і зберігають при -80°С, пере9 10 важно в концентраціях від 10 до 10 бактерій/доза. Краще, коли даний препарат використовують у фармацевтичному наборі, як описано вище, у сполученні з карбонатним буфером. У кращому варіанті здійснення передбачають фармацевтичну композицію, що включає щонайменше один мікроорганізмзгідно з винаходом, переважно щонайменше один ліофілізований мікроорганізм згідно з винаходом і фармацевтично прийнятний носій, переважно капсули. Компоненти (І)-(IV), що відповідають даному винаходу, уводять у мікроорганізми, що відповідають винаходу, способами, добре відомими фахівцеві в даній галузі техніки. Якщо мікроорганізми представлені бактеріями, компоненти вводять у плазміди або вектори експресії, і плазміди або вектори експресії переносять у бактерії. Способи молекулярно-біологічного клонування й трансформації, придатні для одержання плазмід, векторів експресії і мікроорганізмів, що відповідають винаходу, добре відомі фахівцеві в даній галузі техніки і являють собою рутинну експериментальну роботу. Іншим об'єктом винаходу є введення лікарського препарату, що включає мікроорганізми, що відповідають винаходу. Введення проводять місцево або системно, наприклад, орально, перорально, ректально, в епідерміс, підшкірно, внутрішньом'язово, у порожнину тіла, в орган, у пухлину або у кровотік. Дані лікарські препарати являють собою, наприклад, суспензії мікроорганізмів, що відповідають винаходу, у розчинах, відомих фармацевтам, що підходять для ін'єкцій. Особливим об'єктом даного винаходу є пероральне або ректальне введення лікарського препаратузгідно з винаходом для лікування і/або профілактики захворювань. Введення проводять однократно або кілька разів. При кожному застосу11 ванні вводять приблизно 10-10 мікроорганізмів, що відповідають винаходу. Якщо введення даної кількості мікроорганізмів, що відповідають винаходу, не викликає достатньої імунної реакції, кількість, призначену для ін'єкції, збільшують. Після введення мікроорганізмів, що відповідають винаходу, толерантність відносно клітини, яка презентує компонент (І), наприклад, пухлинної 43 клітини або клітини тканини, з якої походить пухлина, порушується й запускається сильна системна імунна відповідь, спрямована на пухлину і/або клітину її тканини. Залежно від вибору компонента (І) дана клітинна імунна реакція спрямована або винятково відносно пухлини, або, крім того, відносно пухлинних клітин, що включають клітини тканини, з якої походять пухлинні клітини. В іншому аспекті ціль даного винаходу здійснюють шляхом одержання лікарського препарату, що включає щонайменше один мікроорганізмзгідно з винаходом, який включає проілюстровані вище генетичні компоненти (І)-(IV) або щонайменше одну фармацевтичну композицію, як визначено в даному контексті. У кращому варіанті здійснення мікроорганізми, що відповідають винаходу, можуть бути використані для одержання лікарського препарату для лікування і/або профілактики фізіологічних і/або патофізіологічних станів, обраних із групи, що складається з "неконтрольованого розподілу клітин, злоякісних пухлин, доброякісних пухлин, солідних пухлин, сарком, карцином, гіперпроліферативних порушень, карциноїдів, сарком Евінга, сарком Капоші, пухлин головного мозку, пухлин, що походять з головного мозку і/або нервової системи і/або мозкових оболонок, гліом, нейробластом, рака шлунка, рака нирки, карциноми ниркових клітин, рака простати, карцином простати, пухлин сполучних тканин, сарком м'яких тканин, пухлин підшлункової залози, пухлин печінки, пухлин голови, пухлин шиї, рака стравоходу, рака щитовидної залози, остеосарком, ретінобластом, тимоми, рака яєчка, рака легенів, бронхіальних карцином, рака молочної залози, карцином молочної залози, рака кишки, колоректальних пухлин, карцином товстої кишки, карцином прямої кишки, гінекологічних пухлин, пухлин яєчника/овариальних пухлин, рака матки, рака шийки матки, карцином шийки матки, рака тіла матки, карцином тіла, ендометриальних карцином, рака сечового міхура, рака порожнини, рака шкіри, базалиом, спиналиом, меланом, внутріочних меланом, лейкозу, хронічного лейкозу, гострого лейкозу, мікроманометрів, інфекції, вірусної або бактеріальної інфекції, грипу, хронічного запалення, відторгнення органа і/або аутоімунних захворювань". Бактеріальні інфекції включають, але без обмеження перерахованим, сибірську виразку, бактеріальний менінгіт, ботулізм, бруцельоз, камплобактеріоз, хворобу котячих подряпин, холеру, дифтерію, епідемічний тиф, імпетиго, легіогелез, лепру (хвороба Гансена), лептоспіроз, листериоз, лаймскую хворобу, меліоідоз, інфекцію MRSA ( метицилин-резистентних стафілококів), нокардіоз, коклюш (судорожний кашель), чуму, пневмококову пневмонію, пситакоз, Ку-лихоманку, плямисту лихоманку Скелястих гір (RMSF), сальмонельоз, скарлатину, іііигелез, сифіліс, правець, трахому, туберкульоз, туляремію, черевний тиф, тиф, інфекції сечових шляхів, викликувані бактеріями серцеві захворювання. Вірусні інфекції включають, але без обмеження перерахованими, СНІД, зв'язаний зі СНІДом комплекс (ARC), вітрянку (вітряну віспу), застуду, цитомегаловірусну інфекцію, колорадську 94974 44 кліщову лихоманку, лихоманку Денге, геморагічну лихоманку Ебола, ящур, гепатит, простий герпес, оперізувальний лишай, HPV, інфлюенцу (грип), лихоманку Ласса, кір, марбургскую геморагічну лихоманку, інфекційний мононуклеоз, паротит, поліомієліт, прогресуючу багатовогнищеву лейкоенцефалопатію, сказ, краснуху, САРС (атипову пневмонію), віспу (натуральну віспу), вірусний енцефаліт, вірусний гастроентерит, вірусний менінгіт, вірусну пневмонію, лихоманку Західного Нила, жовту лихоманку. Хронічні запалення або хронічні запальні захворювання включають, але без обмеження перерахованими, хронічний холецистит, бронхектаз, ревматоїдний артрит, тиреоідит Хашімото, запальну хворобу кишки (виразковий коліт і хворобу Крона), силікоз і інший пневмоконіоз. Аутоімунні хвороби включають, але без обмеження перерахованими, системні синдроми, такі як SLE, синдром Шегрена, склеродерму, ревматоїдний артрит і поліміозит, а також місцеві синдроми, такі як IDDM (інсулінозалежний цукровий діабет), тиреоідит Хашімото, хворобу Адісона, звичайну пухирчатку, псоріаз, атопічний дерматит, атопічний синдром, астму, аутоімунну гемолітичну анемію, неуважний склероз. Відповідні лікарські препарати, що включають щонайменше один мікроорганізм, як описано в даному контексті, або щонайменше одну фармацевтичну композицію, як визначено в даному контексті згідно всім описаним у даному контексті варіантам здійснення, призначеним для застосування для лікування і/або профілактики фізіологічних і/або патофізіологічних станів, як описано й визначено в даному контексті, також включені в даний винахід. В іншому аспекті ціль даного винаходу здійснюють шляхом одержання плазміди або вектора експресії, що включає компоненти (І)-(IV), як проілюстровано в даному контексті. Кращим є мікроорганізм згідно з винаходом, що несе щонайменше одну плазміду або вектор експресії, що включає компоненти (І)-(IV), як проілюстровано в даному контексті. В іншому аспекті ціль даного винаходу здійснюють, передбачаючи спосіб одержання мікроорганізмузгідно з винаходом, причому одержують плазміду або вектор експресії, як проілюстровано в даному контексті, і трансформують мікроорганізм даної плазмідою або вектором експресії. В іншому аспекті ціль даного винаходу здійснюють, отримуючи фармацевтичний набір, що включає щонайменше один мікроорганізм згідно з винаходом, або фармацевтичну композицію, як описано вище, або лікарський препарат, як описано вище, і фармакологічно прийнятний буфер, переважно карбонатний буфер. Короткий опис креслень На Фігурі 1 представлена нуклеотидна послідовність (5'>3') сигналу секреції гемолізину А (hlуА) Ε. coli. Сайт Nsil підкреслено. На Фігурі 2 представлена нуклеотидна послідовність (5'>3') гемолізину В (NyB) Ε. coli транспортної системи типу 1 гемолізину Е. coli. 45 На Фігурі 3 представлена нуклеотидна послідовність (5'>3') гемолізину D (MyD) Ε. coli транспортної системи типу 1 гемолізину Е. coli. На Фігурі 4 представлена нуклеотидна послідовність (5'-3') людського простата-специфічного антигену (PSA) без сигнального пептиду, реєстраційний номер М26663 (мрнк простатаспецифічного антигену Homo, повні cds), ділянка 100-807 (відповідний пептид: АА 26- 261). На Фігурі 5 представлена нуклеотидна послідовність (5'>3') субодиниці В холерного токсину (CtxB) без сигнального пептиду, що охоплює ділянка 204-494, реєстраційний номер K01170 (гени toxA і toxB Vibrio cholerae для субодиниці А2 холерного ентеротоксину А2 (). На Фігурі 6 представлена нуклеотидна послідовність (5'-3') домену кінази В-Raf (B-Raf KD) людського білка B-raf (BRAF), реєстраційний номер М95712 (мрнк білка B-raf Homo sapiens (BRAF), повні cds), ділянка 1403-2359 без ділянки 1448-1477 (відповідний пептид: АА 448-766 без АА 463-472), що включає мутацію V600E. На Фігурі 7 представлена нуклеотидна послідовність (5'>3') епітопу людського B-Raf V600E з рестрикцією HLA B27. На Фігурі 8 представлена нуклеотидна послідовність (5'>3') генетично злитої конструкції CtxB PSA - HlyA. На Фігурі 9 представлена нуклеотидна послідовність (5'>3') генетично злитої конструкції Ctx B-Raf V600E - HlyA. На Фігурі 10 представлена нуклеотидна послідовність (5'>3') генетично злитої конструкції CtxB домен кінази KD B-Raf V600E - HlyA. На Фігурі 11 представлені функціональна експресія й секреція злитих білків PSA-CtxB у різних видах бактерій, рекомбінантних по pMKhly-PSACtxB. На Фігурі 12 представлені спленоцити, які секретують ІФН-, як міра відповідей Т-Клітин CD8+ і вродженої імунної системи ( NK-клітин) у мишей, імунізованих різними живими вакцинними носіями. На Фігурі 13 представлене зменшення обсягу пухлини у відповідь на імунізацію різними живими вакцинними носіями. На Фігурі 14 представлені спленоцити, які секретують ΘΦΗ-, як міра відповідей Т-клітин CD8+ і вродженої імунної системи (NK-клітин) у мишей, імунізованих різними живими вакцинами, що несуть різні імунологічні ад'юванти зі злитими конструкціями CtxB-OVA. На Фігурі 15 представлені ефективна експресія й функціональна секреція злитих білків гемагглютинін Н1 курячого грипу- CtxB у ветеринарному вакцинному штамі, що включає повну послідовність гемагглютиніну H5N1 (НА1 +НА2, представлено, НА12) без трансмембранної ділянки (НА12с). Жива атенюірована Salmonella enterica, серовар Ту- phimurium vacT (gyrA D87G) і жива атенюірована Salmonella enterica серовар Enteritidis vacE, (штам Sm24/Rif12/Ssq), обидві фірми Lohmann Animal Health GMBH & CO KG. На Фігурі 16 представлена нуклеотидна послідовність, що кодує злитий білок CtxB-HA12c-HlyA. 94974 46 На Фігурі 17 представлені експресія й секреція злитого білка з використанням вектора pMBKDC, електропорированого в штам Salmonella typhi Ty21a і інші бактеріальні штами: A) доріжки А1-А3: Аналіз супернатанта згідно ТР StMoBKDC з використанням антитіла до B-Raf для детекції. Доріжка А1: S. typhi Ty21a pMoBKDC, A2: S. typhi Ty21a, A3: S. typhimurium aroA. Злитий білок BRaf-V600E KD-CtxB відзначений угорі стрілкою й має передбачуваний розмір приблизно 48 кд. Білковий маркер: попередньо пофарбовані білкові сходи Bench-Mark, No 10748-010. B) аналіз, аналогічний А з використанням недавно отриманого антитіла до HlyА як антитіло для детекції. Доріжки 1,2: конструкції StMoPC, доріжка 3: S. typhi Ту21а MoBKDC; доріжка 4: Е. coli MoBKDC, доріжка 5: S. typhi Ty21a, доріжка 6: S. typhimurium aroА. Білковий маркер: попередньо пофарбовані білкові сходи Bench-Mark, No 10748010 Invitrogen BenchMark, партія 1315592.' На Фігурі 18 представлена повна нуклеoтидна послідовність (5'>3') ненавантажені вектори pMKhlyi. Зміст всіх наведених посилань і патентів у такий спосіб включено у вигляді посилання у всій їхній повноті. Винахід більш докладно пояснюють за допомогою наступних прикладів, однак, вони не обмежують втнахід. Приклади Приклад 1: Конструювання, експресія й секреція злитих білків PSA-CtxB у різних штамах бактеріальних носіїв Для доказу можливості здійснення та демонстрації ефективності системи секреції гемолізину типу І Е. coli секретують злиті білки пухлинних антигенів, у цьому випадку простата-специфічного антигену (PSA), і компонентів білкових токсинів, у цьому випадку CtxB, у якості ад'юванта, конструюють злитий білок PSA-CtxB, як описано в даному контексті. Експресію й секрецію тестують у різних грамнегативних бактеріальних штамах, які потенційно ефективні в якості живих вакцинних штамів у протипухлинній терапії. Молекулярно-біологічне клонування засноване на плазміді/векторі експресії pMOhlyl, які описані раніше (див. статті Gentschev et al., 2005; Gentschev et al., 1996, WO 03/072789). 1А Конструювання стійкого до канаміцину похідного вектора експресії pMOhlyl Заміну касети стійкості до ампіциліну pMOhlyl здійснюють, як описано в статті Datsenko і Wanner, 2000. Стисло, смисловий праймер Р1 (5'GAGTATTCAACATTTCCGTGTCGCCCTTATCCCTTTTTTGGTGTAGGCTGGAGCTGCTTC-S') і антисмисловий праймер Р2 (5'GCGATCTGTCTATTTCGTTCATCCATAGTGCCTGACTCCCCATATGAATATCCTCCTTA-S') і плазміду pKD4 як матрицю використовують для ПЦР із метою одержання фрагмента, що несе ген стійкості до канацицину (KanR), фланкирований ділянками, гомологічними гену стійкості до ампіциліну (непідкреслені). Штам Е. coli BW251 14, що несе плазміду pKD46 і спрямовану плазміду pMOhlyl вирощують при 37°С із середовищу LB 47 (Difco) з додаванням 0,2% L-(+)-арабінози протягом 3-4 годин перед трансформацією ПцрФрагментом. Після трансформації бактеріальні клітини розподіляють на пластинках агару LB, що містять 25 мкг/мол канаміцину та інкубують при 37°С протягом ночі. Наступного дня клони KanR знімають і інкубують протягом додаткових 48 год. у середовищі LB, що містить 50 мкг/мол канаміцину, щоб позбутися від всіх плазмід, що обумовлюють стійкість до ампіциліну. Нарешті, селектують клони з KanR і чутливим в ампіциліну фенотипом. Заміну гена ApR касетою KanR підтверджують за допомогою ПЦР і секвенування. Отриману в результаті плазміду називають pMKhlyl. 1В Клону вання плазмід та рМ Khly-PSA Смисловий праймер PSA-Nsil (5'GATTGGTGATGCATCCCTCAT-S'; рестрикційні сайти Nsil підкреслені) і антисмисловий праймер PSA-Nsi2 (5'-GGTGCTCATGCATTGGCCACG-3') використовують для ампліфікації фрагмента ДНК, який кодує PSA, за допомогою ПЦР. ПЦР проводять у циклері Thermal Cycler 60 (Biometra, Góttingen, Germany) протягом 30 циклів при 94°С протягом 1 хв., 54°С протягом 1 хв. і 72°С протягом 2 хв. Після розрізування рестрикційним ферментом Nsil фрагмент ДНК, що несе ген psa уводять у єдиний сайт Nsil вектора, що експортує, pMKhly1. Отриману в результаті плазміду pMKhly-PSA виділяють із Е. coli DH5 (Invitrogene, Germany), аналізують із використанням рестрикційного аналізу й секвенують. 1С Клонування плазміди pMKhly-PSA/CtxB Смисловий праймер Ptac-Sall (5'AAAAAAGTCGACGGCTGTGCAGGTCGTAATCACTGC-3') і антисмисловий праймер Ptac-Notl (5'AAAAAAGCGGCCGCGAAATTGTTATCCGCCACAATTCC-3') використовують для ампліфікації за допомогою ПЦР фрагмента ДНК із 201 пари основ, що кодує промотор Ptac із плазміди pGEX6p-1 (Amersham Bioscience, Germany). ПЦР проводять у термоциклері Т3 (Biometra, Germany): протягом 30 циклів при 95°С протягом 30 сек., 55°С протягом 30 сек. і 72°С протягом 90 сек. Смисловий праймер Rbs-Notl-Прямій (5'AAAAAAGCGGCCGCTAAGGATGAATTATGTTAAATTAAAATTTGG-S') і антисмисловий праймер ctb-Sall зворотний (5'TTTATAGTCGACTTAATTTGCCATACTAATGCGGCAATCGC-S') використовують для ампліфікації за допомогою ПЦР фрагмента ДНК із 413 пар основ, що кодує сайт зв'язування рибосом, і повної кодуючої CtxB з V. cholerae El tor. ПЦР проводять у термоциклері Т3 (Biometra, Germany): стадія 1-30 циклів при 95°С протягом 30 сек., 50°С протягом 30 сек. і 72°С пртягом 2 хв. Після очищення за допомогою набору Qiaquick PCR Purification Kit (Qiagen, Germany) і розрізування обох фрагментів рестрикційним ферментом Notl два фрагменти піддають лігуванню, одержуючи в результаті фрагмент із 594 пар основ Ptac-cfxB. Отриманий у результаті фрагмент також очища 94974 48 ють і після розрізування рестрикційним ферментом Sail фрагмент Ptac-cfxB уводять у єдиний сайт Sail вектора, що експортує, pMKhly-PSA. Отриману в результаті плазміду pMKhly-PSA/CtxB виділяють із Е. coli DH5 (Invitrogene, Germany), аналізують і секвенують. 1D Клонування злитої конструкції PSA-CtxBHlyAs Смисловий праймер 5'ctxB Nsil (5'GCATATGCACATGCATCACCTCAAAATATACTGAT-3') і антисмисловий праймер 3' ctxB Srfl Nsil (5'GGCTTTTTTATATCTTATGCATGCCCGGGATTGCGGCAATCGC-3') (сайт Srfl виділений жирним шрифтом) використовують для ампліфікації за допомогою ПЦР фрагмента ДНК із -300 пар основ, що представляє ген ctxB з V. cholerae El tor. Після очищення за допомогою набору Qiaquick PCR Purification Kit (Qiagen, Germany) і розрізування рестрикційним ферментом Nsil фрагмент ДНК, що несе цілий ген ctxB без N-Кінцевої сигнальної послідовності вводять у єдиний сайт Nsil вектора, що експортує, pMKhly1. Отриману в результаті плазміду pMKhly-CtxB виділяють із Е. coli DH5 (Life Technologies), аналізують і секвенують. Людський ген psa ампліфікують із плазміди pCDNA3PSA за допомогою ПЦР із використанням праймерів 5! PSA-Blunt (5 -GTGGGAGGCTGGGAGTGC-3') і 3PSA-Blunt (5'-GGGGTTGGCCACGATGGT-S'). ПЦР проводять у циклері Thermal Cycler 60 (Biometra, Gottingen, Germany) протягом 30 циклів при 94°С протягом 1 хв., 56°С протягом 1 хв. і 72°С протягом 2 хв. Потім продукт ДНК 0,7 т.п.н. клонуть у сайт Srfl pMKhly-CtxB. Отриману в результаті плазміду pMKhly-CtxB-PSA перевіряють за допомогою рестрикційного аналізу й секвенування. 1E Експресія й секреція злитих білків у різних бактеріальних штамах Використовуючи стандартні способи електропорації плазмідою pMKhly-CtxB-PSA трансформують електрокомпетентні бактеріальні штами. Стійкі до канаміцину окремі колонії знімають і вирощують у середовищі ВНІ (Beckton Dickinson, USA: телячий головний мозок, екстракт із 200 г, 6,0 г/л; бичаче серце, екстракт із 250 г, 9,8 г/л; протеозопептон 10,0 г/л; хлорид натрію 5.0 г/л; декстроза 2,0 9 г/л; динатрійфосфат 2,5 г/л) до густини 1x10 клітин/мол. Після вирощування 20 мол культури центрифугують протягом 30 хв. при 4000 об./хв. (3000 g) у центрифузі Heraeus при 4°С. 18 мол супернатанта переносять у свіжу пробірку. Потім додають 1,8 мол ТСА (трихлороцтової слоти, Applichem, Germany), рідину перемішують і інкубують щнайменше 1 годину на льоді. Після інкубування суспензію центрифугують протягом 30 хв. при 4000 об./хв. (3000 g) у центрифузі Heraeus при 4°С. Супернатант зливають із осаду й осад промивають 1 мол ацетону р.а. (чистого для аналізу) (Applichem, Germany). Осад центрифугують протягом 10 хвилин при 4000 об./хв. (3000 g) у центрифузі Heraeus при 4°С. Осад сушать на повітрі й поміщають в 150 мкл 5х буфера Лемлі (70 мм Трис-НСІ, рН 6,8, 40% (об./об.) гліцерин, 3% (об./об.) додецилсульфату натрію, 5% (об./об.) 2меркаптоетанола й 0,05% (мас/об.) бромфеноло 49 вого синього) з додаванням або без додавання меркаптоетанола (див. статтю Laemmli, 1970). Для кожної доріжки при SDS PAGE (електрофорез у поліакриламідному гелі з використанням додецилсульфату натрію) використовують 20 мкл розчину. Розділені білки електрофоретичним методом переносять (вестерн-блот) на нітроцеллюлозну мембрану Hybond ECL (Amersham-Pharmacia, Little Chalfont, UK) і блокують протягом ночі PBS (хлорид калію 0,20 г/л, дигідрофосфат калію 0,20 г/л, хлорид натрію 8,00 г/л, дигідрофосфат динатрій безводний 1,15 г/л), що містить 1% BSA (бичачий сироватковий альбумін). Мембрану промивають в PBS-Твін 0,05%, інкубують з поліклональним кролячим антитілом до PSA (1:750, DAKO, Denmark), антитілом до CtxB (1:1000, Zytomed, Berlin, Germany) або антитілом до HlyAs (див. статтю Gentschev et al., 1996)) і потім інкубують з HRPзв'язаним анти-кролячим IgG (1/2000; Dianova, Hamburg, Germany) протягом 1 години. ВестернБлот проявляють за допомогою набору з посиленою флуоресценцією (GE Healthcare Life Science, Germany). На Фігурі 11 представлені функціональна експресія й секреція злитих білків PSA-CtxB у ряді бактеріальних штамів, включаючи Escherichia coli spp., Salmonella dublin, Citrobacter spp, Salmonella typhi Ty21a, Salmonella typhimurium spp, Erwinia spp і Shigella flexneri spp. Штам Salmonella typhi Ty21a, що експресує і секретує злитий білок PSA-CtxB депонований у Німецькій колекції мікроорганізмів і клітинних культур (DSMZ) під номером DSM 19244. Приклад 2: Імунна відповідь і захист від щеплення пухлинних клітин у мишей, імунізованих штамами Salmonella, що секретують злиті білки пухлинних антигенів і CtxB або CtxB у вигляді монокомпонента За допомогою наступних експериментів підвищена захисна ефективність злитих білків пухлинних антигенів, що секретуються, і білкових токсинів продемонстрована на моделі пухлин у тварин. Для даної моделі штам Salmonella typhimurium aroA (SL7207) pMKhly-CtxB-PSA, що експресує і секретує злитий білок CtxB-PSA порівнюють із іншими контрольними штамами. 2А Способи імунізації Мишей DBA/2 імунізують три рази з інтервалом 3 тижні. Для імунізації бактеріями тварин попередньо лікують введенням 50 мкл 7% NaHCO3 внутрішньошлунково з метою підвищення внутрішньолункового рН. Через 5-10 хвилин після попе8 реднього лікування вводять 5x10 живих нечутливих до канаміцину бактерій в обсязі 100 мкл PBS внутрішньошлунково. Як контроль мишей імунізують внутрішньом'язово голою (депротеїнізованою) плазмідною ДНК, що кодує PSA (рсднк-PSA), як описано в статті Fensterle et al., 2005. 2В Т-Клітинні відповіді Через сім днів після останньої імунізації спленоцити імунізованих мишей одержують, як опубліковано раніше (див. статтю Fensterle et al., 1999) пропущенням селезінки через сітку з наступним лізисом еритроцитів. Аналіз ELISPOT для детекції PSA-Специфічних Т-клітин CD8+ проводять відпо 94974 50 відно до способу, опублікованому в статті Fensterle et al., 1999. Стисло, для аналізу ex vivo PSA-Специфічних Т-клітин CD8+ 96-ямкові нітроцелюлозні планшети (Millititer НА; Millipore, Bedford, MA) покривають 5 мкг/мол моноклонального антитіла (mAb) до мишачого ΘΦΗ- R4 (PharMingen) в 100 мкл карбонатного буфера (див. статтю Fensterle et al., 1999), рН 9,6. Після інкубування протягом ночі при 4°С та блокування 1 % 5 BSA в PBS додають 1x10 спленоцитів, отриманих від вакцинованих мишей в 100 мкл RP10 (див. статтю Fensterle et al., 1999)/лунку. Для аналізу відповіді Т-клітин CD8+ використовують PSA клон експресії клітин Р815 PPSA 24; стисло, даний клон експресує PSA повної довжини за допомогою промотору CMV, що кодується плазмідою pCDNA3 (див. статтю Fensterle et al., 2005). Після інкубування протягом 20-22 час. при 37°С, 5% СО2 у присутності 30 од./мол ІЛ-2 планшети промивають і інкубують протягом додаткових 2 час. з 100 мкл біотинільованого mAb XMB1.2 до мишачого ΘΦΗ- (0,25 мкг/мол, PharMingen). Планшети промивають і інкубують протягом 1 год. при 37°С у присутності 100 мкл розведення 1/20000 пов'язаного з лужною фосфатазою стрептавідину (PharMingen). Плями візуалізують додаванням 50 мкл готового до застосування субстрату BCIP/NBT (Sigma, St. Louis, МО), розчиненого у воді. Плями підраховують під препаровальним мікроскопом при збільшенні в 3 рази. Частоту пептид-специфічних Т-клітин (CTL) 5 виражають як число ΘΦΗ--секретуючих клітин/10 спленоцитів. Для аналізу відповідей Т-клітин після 7 повторної стимуляції 2,5х10 спленоцитів повторно 6 стимулюють 2x10 опромінених експресуючих PSA клітин Р815 (див. статтю Fensterle et al., 2005) у середовищі RP10 (див. статтю Fensterle et al., 1999) у присутності 60 од./мол рекомбінантного МУЛ-2 протягом 5 днів. Аналіз ELISPOT проводять, як описано вище, використовуючи різні кіль5 4 кості повторно стимульованих клітин (10 , 3x10 , 4 3 5 10 або 3х10 /лунку), змішаних з 4x10 фідерних клітин (= свіжеодержаних спленоцитів від непримі5 йованих (наївних) мишей DBA/2) і 10 клітин PPSA24. Індукція клітинної імунної відповіді, особливо цитотоксичних Т-клітин CD8+, відіграє важливу роль у плані ефективності протипухлинної терапії (див. статті Boon et al., 2006; Rosenberg, 2001). Тому спочатку тестують ефективність рекомбінантного бактеріального штаму Salmonella typhimurium (SL7207), що несе вектор експресії pMKhly-CtxB-PSA, в індукції PSA-Специфічної імунної відповіді Т-клітин CD8+. Для цієї мети 64 самок мишей DBA-2 у віці 1014 тижнів імунізують перорально рекомбінантним SL7207/pMKhly-CtxB (n=10), SL7207/pMKhly-CtxBPSA (n=10), SL7207/pMKhly-PSA (n=10), SL7207/pMKhly-PSA/CxtB (n=10), SL7207/pMKhlyl (n=7)іголою рсДНКЗ-PSA (п=10) у якості позитивного контролю, як описано в даному контексті. На Фігурi 12 представлені дані ELISPOT, що показують, що iмунізовані ДНК миші демонструють виражені відповіді Т-Клітин CD8+. Після повторної стимуляції явні імунні відповіді визначають у тва 51 рин, вакцинованих Salmonella, що секретує білок PSA, злитий з CtxB, але не штамами, що секретують PSA у вигляді монокомпонента або роздільно PSA і CtxB. Цікаво, що тварини, вакциновані Salmonella, що секретує токсин CtxB у вигляді монокомпонента, також проявляють суттєві імунні відповіді після повторної стимуляції. Дані відповіді найбільше ймовірно обумовлені NK-клітинами або іншими клітинами вродженої імунної системи, що неспецифічно розпізнає клітинну лінію-мішень. Отже, на основі даних по CtxB, що декретується у вигляді монокомпонента можна вважати, що імунна відповідь, що спостерігається для злитого білка CtxB-PSA, що секретується (секретуючі ΘΦΗ- спленоцити) складається з відповіді Т-клітин CD8+, а також вираженої відповіді вродженої імунної системи (найбільше імовірно, NK-Клітин). 2С Захист від щеплення пухлинних клітин Для аналізу захисної здатності імунізації 6-7 мишей/групу імунізують відповідно до вищеописаної схеми. Через три тижні після третьої імунізації мишам прищеплюють PPSA 24 (див. вище) шля6 хом підшкірної ін'єкції 1x10 клітин з кожного боку виголеної шкіри живота. Мишей піддають моніторингу протягом 14 днів у плані появи пухлин і оцінюють обсяг пухлин виміром найбільшого (а) і самого маленького (b) діаметра пухлини. Обсяг пухлини розраховують як тіло, утворене обертанням еліпса, використовуючи наступну формулу: V a b2, a b. 6 Аналізують значимість результатів за допомогою однобічного ANOVA і повторного тесту множинного порівняння Данета з використанням пакета програм Graph Pad Prism. Повторний тест проводять тільки у випадку, коли ANOVA показує значимість результатів. На Фігурі 13 представляють усереднині результати як ±SD (стандартна помилка). У день 6, 9, 12 і 14 спостерігають істотні захисні ефекти. Як очікують, вакцинація голої ДНК включає як контроль мишей, повністю захищених від росту пухлин. Однак вакцинація голої ДНК показує якнайбільше середню ефективність у людини. Що стосується бактеріальних конструкцій, те вакцинний штам SL7207/pMKhly-CtxB-PSA (експресуючий і cекретуючий злитий білок CtxB-PSA) виявляється найбільш ефективним. Він істотно зменшує обсяг пухлини в 9, 12 і 14 після щеплення пухлини. Відомо також, що штам SL7207/pMKhly-CtxB зменшує ріст пухлини на величини, порівнянні з SL7207/pMKhly-CtxB-PSA, у день 14. Хоча недостовірно, даний затримуючий ефект добре погодиться із клітинною відповіддю, що вимірюють за допомогою аналізу ELISPOT. Більше того, штам SL7207/pMKhly-PSA також дає значний захист у день 14, що показує, що даний штам також індукує Т-Клітинну відповідь, яка є нижчою порогу визначення. Навпроти, штам SL7207/pMKhly-PSA/CxtB не індукує відповідний ефект і залишається в тім же діапазоні, що SL7207/pMKhlyl як монокомпонент. 94974 52 Приклад 3: Експресія й секреція злитого білка онкоген-токсин в S. typhi Ty21a Аналогічно прикладу 1 інший пухлинний антиген, використовують домен кінази онкогена B-Raf V600E з делецією 10 аа (амінокислот) у домені кінази (домен кінази BRaf V600E кіназа dead (KD) або, скорочено, BRaf* KD, більш коротко BKD). Злитий білок даного онкогена й компонентів білкового токсину, у цьому випадку CtxB, у якості ад'юванта, конструюють, як описано в даному контексті. Експресію й секрецію демонструють на людському вакцинному штамі S. typhi Ty21a. Молекулярне клонування засноване на використанні плазміди/вектора експресії pMOhlyl, що описаний раніше (див. статті Gentschev et al., 2005; Gentschev et al., 1996) і спосіб клонування аналогічний описаному у прикладі 1 даної заявки. Отриманий у результаті вектор називають pMBKDC. Послідовність злитого білка наведена на Фігурі 10. На Фігурі 17 показують експресію й секрецію злитого білка з використанням вектора pMBKDC, електропорированого в штам Salmonella typhi Ty21a і інші бактеріальні штами. Штам Salmonella typhi Ty21a, який експресує і секретує злитий білок BKD-CtxB депонований у Німецькій колекції Мікроорганізмів і клітинних культур (DSMZ) під номером DSM 19245. Приклад 4: Порівняння злитої конструкції OVACtxB з іншими генетично кодуємими імунологічними ад'ювантами Для порівняння імунологічної ефективності злитих білків токсин-антиген, які секретуються живими вакцинами, конструюють злитий білок, що включає широко використовуваний для імунологічних досліджень антиген, курячий овальбумін (OVA), і CtxB. Смисловий праймер Nsil-OVA-Прямої 5' - CAT GTA TGC ATT AGC CAT GGT ATA CCT GG - 3' і антисмисловий праймер Nsil-OVA-Зворотний 5' TTT ТТТ ATG CAT AAG GG AAA С АС С АС АТС TGC С - 3' використовують для ампліфікації за допомогою ПЦР фрагмента ДНК із 1033 пар основ, що представляє собою ген ova (NM205152). Після очищення за допомогою набору QIAquick PCR Purification Kit (Qiagen, Germany) і розрізування рестрикційним ферментом Nsil фрагмент ДНК, що несе цілий ген ova без N-кінцевої сигнальної послідовності вводять у єдиний сайт Nsil вектора, що експортує, pMKhlyl. Отриману в результаті плазміду pMKhly-Ova виділяють із Е. coli DH5 (Life Technologies), аналізують і секвенують. Смисловий праймер 5'cfxB Nsil (5'GCATATGCACATGCAICACCTCAAAATATACTGAT-3') і антисмисловий праймер 3' ctxB Srfl Nsil (5'GGCTTTTTTATATCTTATGCATGCCCGGGATTGCGGCAATCGC-3') (сайт Srfl виділений жирним шрифтом) використовують для ампліфікації за допомогою ПЦР фрагмента ДНК із ~300 пар основ, що представляє собою ген ctxB з V. cholerae El tor. Після очищення за допомогою набору Qiaquick PCR Purification Kit (Qiagen, Germany) і розрізування рестрикційним ферментом Nsil фрагмент ДНК, що несе цілий ген ctxB без N-Кінцевої сигнальної послідовності, уводять у єдиний сайт Nsil вектора, 53 що експортує, pMKhlyl. Отриману в результаті плазміду pMKhly-CtxB виділяють із Е. coli DH5 (Life Technologies), аналізують і секвенують. Людський ген ova ампліфікують із плазміди рСІ- OVA за допомогою ПЦР із використанням праймерів 5OVA-Sfrl GCC АТС ATG TCA GCT СТА і 3-OVA-Sfrl AGG GGA AAC АСА ТСТ GCC. ПЦР проводять у циклері Thermal Cycler 60 (Biometra, Gottingen, Germany) протягом 30 циклів 1 хв. при 94°С, 1 хв. при 49°С і 2 хв. 30 сек. при 72°С. Потім продукт ДНК 1,1 т.п.н. клонуть у сайт Srfl pMKhly-CtxB. Отриману в результаті плазміду pMKhly-CtxB-OVA перевіряють за допомогою рестрикційного аналізу й секвенування. Здатність даного злитого білка викликати імунні відповіді Th1 порівнюють зі здатністю OVA, який кодується вектором pMKhly, у вигляді монокомпонента в комбінації із плазмідами, що доставляють ДНК (які кодують білки під контролем еукаріотичного промотора), що кодують інтерферони (ИФН-), інтерлейкіни (ІЛ-12) і хемокіни (IP-10). Способи імунізації й аналіз ELISPOT здійснюють, як описано вище. Стисло, мишей C57BL/6 імунізують перорально три рази різними штамами. Через 7 днів після кінцевої імунізації спленоцити видаляють, повторно стимулюють протягом 5 днів і досліджують за допомогою аналізу ELISPOT. Для повторної стимуляції спленоцитів використовують клітини, оброблені з імпульсному режимі пептидом SIINFEKL (букви означають амінокислоти), епітопом овальбуміна Н-2b з рестрикцією МНС-І. На Фігурі 14 показана підвищена ефективність злитого білка, що включає курячий овальбумін (OVA) і CtxB, в індукції OVA-Специфічних відповідей Т-клітин CD8+ і потенційних відповідей уродженої імунної системи в порівнянні з конструкціями, що спільно доставляють ΘΦΗ- або IP-10. Він проявляє ефективність, близьку ефективності штаму з конструкцією спільної доставки ІЛ-12. Приклад 5: Експресія й секреція вірусних антигенів Придатність мікроорганізмів, що відповідають винаходу, для експресії й секреції якого-небудь (непухлинного) антигену демонструють за допомогою експресії білка гемагглютиніну Н1 вірусу курячого грипу H5N1, злитого з CtxB у ветеринарному вакцинному штамі Salmonella typhimurium VacT. Смисловий праймер 5'-HA-G: 5'- АТС TGT CAA ATG GAG AAA -3' і антисмисловий праймер 3HA12C: 5'-TAC ТСС ACT TAT TTC CTC TCT-3' використовують у ПЦР, здійснюючи ампліфікацію фрагмента ДНК, що кодує Н5 без С-Кінцевого мембранного домену (Н12С). Потім продукт ПЦР клонуть у сайт Srfl pMKhly-CtxB. Отриману в результаті плазміду pMKhly-CtxB-H12C досліджують за допомогою рестрикційного аналізу й секвенування. Штам S. typhimurium VacT/pMKhly-CtxBH12C ефективного експресує і секретує гібридний білок Н5, як показано за допомогою імуноблотингу з поліклональними антитілами, що утворяться до CtxB і HlyА (див. Фіг. 2). Кількість Н5, що декретується, становить 2-3 мкг білка/мол супернатанта в умовах експерименту. Бактерії вирощують у середовищі ВНІ до гус9 тоти 1х10 клітин/мол. 20 мол культури центрифу 94974 54 гують протягом 30 хв. при 4000 об./мін. (3000 g) і 4°С у центрифузі Hereaus. 18 мол супернатанта переносять у свіжу пробірку. Потім додають 1,8 мол ТСА (трихлороцтової кислоти, Applichem, Germany), рідину перемішують і інкубують на льоді протягом щонайменше 1 години. Після інкубування суспензію центрифугують протягом 30 хв. при 4000 об./мін. (3000 g) у центрифузі Heraeus при 4°С. Супернатант зливають із осаду й осад промивають 1 мол ацетону р.а. (чистого для аналізу) (Applichem, Germany); осад центрифугують протягом 10 хвилин при 4000 об./мін. (3000 g) при 4°С у центрифузі Heraeus. Осад сушать на повітрі й поміщають в 150 мкл 5х буфера Леммли. Для кожної доріжки при SDS PAGE використовують 20 мкл розчину. Розділені білки електрофоретично переносять (вестерн-блот) на нітроцеллюлозну мембрану Hybond ECL (Amersham-Pharmacia, Little Chalfont, UK) і блокують протягом ночі PBS, що містить 1% BSA. Мембрану промивають в PBSТвін 0,05%, інкубують з поліклональним кролячим антитілом до CtxB (1:1000, Zytomed, Berlin, Germany) або антитілом до HlyAs (див. статтю Gentschev et al., 1996)) і потім інкубують з HRPЗв'язаним IgG до кролика (1/2000; Dianova, Hamburg, Germany) протягом 1 години. ВестернБлот проводять із використанням набору з посиленою флуоресценцією (GE Healthcare Life Science, Germany). На Фігурі 15 представлені ефективна експресія й функціональна секреція злитого білка HA12CCtxB у ветеринарному вакцинному штамі Salmonella typhimurium VacT. Приклад 6: Експресія й секреція злитих білків токсинних ад'ювантів і пухлинних антигенів за допомогою систем секреції типу III Деякі грамнегативні бактерії несуть системи секреції типу III, які можна використовувати для секреції антигенів. Як правило, дані системи можна використовувати для безпосередньої ін'єкції гетерологічних антигенів у клітини. У даному прикладі токсинний компонент Yersinia, що служить як сигнал секреції (ΥοpΕ) генетично злитий із фрагментом термолабільної субодиниці ентеротоксину В (LT-B), що служить у якості ад'юванта, і пухлинним антигеном PSA. Дана конструкція повинна експресуватись в придатних, переважно атенюірованих штамах Yersinia, які приводять до секреції злитого білка шляхом ендогенного механізму секреції типу III за допомогою сигнальної послідовності ΥοpΕ. У даному прикладі генетичне злиття YopE18LT-B-PSA клоиуть у сайт EcoRJ плазміди paCYCI 84 для використання конструкції з такою ж орієнтацією, у якій використовують ген, з одержанням продукту, що експресується плазмідою, що кодує промотор cat (http:/www.fermentas.com/techinfo/nucleicacids/mapp acycl84.htm). Для підвищеного рівня експресії можна використовувати будь-який підходящий промотор. Надалі ілюструють спосіб клонування. Хромосомну ДНК із Е. coli, що включає субодиницю В термолабільного ентеротоксину, або вектор, що включає дану послідовність (GenBank реєстрацій 55 ний номер AF242418) ампліфікують, використовуючи наступні праймери в реакції ПЦР: Eco-yope18-f (що включає сайт EcoRI site + сигнальну послідовність YopE18): CTGAATTCATGAAAATATCATCATTTATTTCTACAT CACTGCCCCTGCCGGCAJCAGTGTCAAATAAGTAAAATGTTATGTTTTAT3' (5'-ділянка показана чорним: сайт EcoRI +3 основи 5', показаний червоним: послідовність, що кодує сигнал для секреції типу III білка YopE (aa 1-18), GenBank реєстраційний No M92066; ділянка, виділена курсивом: ділянка гомології гена LT-B (GB реєстраційний No AF242418), основи 4-28). Фосфорильований зворотний праймер LT-B-r: 5'-GTTTTCCATACTGATTGCCGCAATTGAATTGG3' (зворотний ланцюг 372-341 GB AF242418). Паралельно послідовність PSA, як описано в даній заявці, з вектора pMKCtxB-PSA ампліфікують, використовуючи наступні праймери: фосфорильований прямий праймер psa-f: 5'GTGGGAGGCTGGGAGTGCGAG-3' Зворотний праймер psa-eco-r: 5'-CCTGAATTCTT AGACGTGAT ACCTTGAAGCAC (5', показаний чорним: сайт EcoRI+3 основи 5', показані синім: стопкодон, показаний чорним: 3'-ділянка послідовності PSA, дана заявка). Потім два фрагменти лігують за допомогою ДНК-лігази в придатних умовах. Після лігування новий фрагмент ампліфікують у другій реакції ПЦР, використовуючи праймери Eco-yope18-f і PSA-Eco-R, описані вище. Отриманий у результаті фрагмент очищають, використовуючи підходящий набір очищення для ПЦР, з метою видалення буфера й олігонуклеотидів і потім розріжуть ферментом EcoRI у придатних умовах реакції. Отриманий у результаті фрагмент із 1040 пар основ очищають, використовуючи електрофорез в агарозному гелі, і лігують у розрізаний EcoRI вектор paCYC184. Після секвенування вибирають стійкі до тетрацикліну, чутливі до cm (канаміцину) клони, які мають правильну послідовність, інтегровану в тій орієнтації, що ген cm, і трансформують підходящий штам Yersinia, використовуючи електропорацію. Даний вакцинний штам буде секретувати злиття LT-B-PSA за допомогою ендогенної системи секреції типу III. Приклад 7: Експресія й секреція злиттів токсин-антиген у грампозитивних бактеріях Грампозитивні й негативні бактерії мають різні попередні умови для секреції. Грамнегативні бактерії мають дві мембрани й, внаслідок цього, механізм секреції на додаток до сигналів секреції є необхідним для повної секреції. У випадку грампозитивних бактерій досить сигнальної послідовності секреції. У даному прикладі описана система для секреції злиття правцевий токсоїд-PSA в Listeria з використанням сигналу секреції р60. На першій стадії вектор pUC18(PS)actAOVATinIA (див. статтю Loeffler et al., 2006) розрізають, використовуючи Nsil, і потім обробляють, 3'-5' екзонуклеазою у придатних умовах. Нарешті, фрагмент очищають електрофорезом на агарозному гелі. Паралельно фрагмент Із правцевого токсоїду (GenBank реєстраційний номер No. M12739) амп 94974 56 ліфікують з підходящого джерела, наприклад, геномної ДНК зі штаму Clostridium tetanii, з використанням наступних фосфорильованих праймерів: tetc прямій: 5' IAAAAATCTGGATTGTTGGGTTG - 3', де підкреслене додаткова основа уведена, щоб забезпечити правильну рамку злиття. tetc зворотний: 5' ATCATTTGTCCATCCTTCATCTG - 3'. Фрагмент BRAF KD ампліфікують із плазміди рМО BKDC, описаної в даній заявці, з використанням фосфорильованих праймерів: br прямій: 5' - GATTGGGAGATTCCTGATG - 3' br зворотний: 5' - CCCGTGG ACAGG AAACGCACC - 3'. Обидва фрагменти очищають із використанням підходящого набору для ПЦР-очищення й потім легують за допомогою ДНК-лігази в придатних умовах. Після лігування фрагмент очищають знову, використовуючи підходящий набір для ПЦРочищення й ампліфікують, використовуючи tetc прямій і br зворотний праймер. Після ампліфікації отриманий у результаті фрагмент із 2280 пар основ очищають електрофорезом на агарозному гелі та лігують в очищений фрагмент 3'-5' екзонуклеази Nsil pUC18(PS)actAOVATinlA. Після лігування й трансформації Е. coli відбирають клон, що несе фрагмент у рамці зчитування. Потім плазміду розрізають, використовуючи Pstl і Sacl, і фрагмент із 2837 пар основ та очищають, використовуючи гель-електрофорез, і лігують у відповідним чином розрізаний Pstl і Sacl і очищають вектор pSPl 18 (див. статтю Loeffler et al., 2006). Отриманим у результаті вектором pSP118-act-TetC-BRaf*KD трансформують пітам Listeria, що несе делецію trpS, наприклад Listeria monocytogenes trps aroA/ (див. статтю Loeffler et al., 2006). У даному дослідженні плазміду стабілізують за допомогою trpS на основі плазміди ("Збалансована летальна система"), і плазміда кодує фаговий лізин, що приводить до внутрішньоклітинного лізису штаму. Касету act-TetC-BRaf*KD експресують головним чином в еукаріотичних клітинах-хазяях під контролем промотору actA, у яких відбувається деяке позаклітинне витікання (Loeffler et al., 2006). Сигнальна послідовність касети actA приводить до секреції злитого білка TetC-BRaf*KD. Приклад 8: Еукаріотичні клітини, що секретують злиття токсин-антиген У даному прикладі конструюють еукаріотичну клітинну лінію, наприклад, пухлинну клітинну лінію, що секретує злитий білок CtxB-PSA. Для цієї мети використовують універсальний сигнал секреції (US 6733997), що у принципі забезпечує секрецію відповідної касети експресії в клітинах різної природи, включаючи клітини ссавців, дріжджі й прокаріотичні клітини. На першому етапі злиття CtxB-BRaf* KD ампліфікують із плазміди рМО BKDC (див. дану заявку), використовуючи наступні праймери: СВ-Прямій: 5' atcGGATCCTCAAAATATTACTGATTTGTGTGC - 3' (малі літери: спейсер підкреслений: сайт BamHI, прописні букви: CtxB 5') 57 СВ-Зворотний: 5' tagGGATCCTTAGTGGACAGGAAACGCACATATCC - 3' (малі літери: спейсер підкреслений: сайт BamHI, курсив: стоп-кодон, прописні букви: BRaf* KD 3'). Потім продукт ПЦР очищають, використовуючи підходящий набір для ПЦР-очищення, і потім частково розрізають (фрагмент включає внутрішній сайт BamHI) за допомогою BamHI. Фрагмент часткового розрізування з 1231 пари основ виділяють за допомогою електрофореза на агарозному гелі й потім лигують у розрізану BamHI і гель-гель-очищену плазміду pVtgEGFP (патентна заявка США 6733997). Потім відбирають клон, що несе в орієнтації рамки зчитування з Vtgss, і називають pVtgCtxBRAf. Даною плазмідою можна трансформувати за допомогою електропорації еукаріотичну клітинну лінію, яку можна вибрати за допомогою селекційної касети kan/neo. Клітинні лінії можуть являти собою стабілізовані клітинні лінії, подібні раковим клітинним лініям, призначеним для використання в якості гетерологічною протиракової вакцини, або пухлинним клітинам, виділеним у пацієнта, призначеним для використання в якості аутологічних протиракових вакцин. У кожному разі сигнал секреції Vtgss, що кодується вектором pVtgEGFP, генетично злитий з CtxBBRaf* KD, буде приводити в результаті до секреції злитого білка. Використовуючи аналогічний підхід, злиті білки можна також експресувати у дріжджах. Як приклад демонструють модифіковану стратегію клонування, як показано на Фіг. 11 заявки US 6733997. На першому етапі касету, що включає злиття VtgssCtxB-BRafKD з вищеописаної плазміди pVtgCtxBRAf, вирізують за допомогою EagI і Есо47III і вводять у вектор pBSPGK (див. US 6733997, Фіг. 11). Потім отриманий у результаті вектор розрізають Sad і Hindlll і фрагмент, що включає елемент PGK і злиття Vtgss- CtxBBRaf*KD інтегрують у відповідну ділянку вектора pYEX-S1 аналогічно опису заявки US 6733997 (див. Фіг. 11). Отриманою в результаті плазмідою можна трансформувати шляхом електропорації штами дріжджів, такі як Saccharomyces cerevisiae. Дріжджі будуть експресувати і секретувати злитий білок і можуть бути використані для цілей вакцинації. Скорочення ABC - АТФ-з'єднувальна касета AIDA - адгезин, що бере участь у дифузійній адгезії АРС - антиген-презентуюча клітина aroА - ген aroА AT - -токсин АТФ - аденозинтрифосфат B-RafKD- домен кінази B-Raf BSA - бичачий сироватковий альбумін Cag A - головний асоційований із захворюванням білок вірулентності Helicobacter pylori CPE - ентеротоксин Clostridium perfringens CpG- послідовності ДНК, що містять гипометильовані імуностимулюючі послідовності ДНК, що включають мотиви CpG CT/Ctx - Холерний токсин 94974 58 CTB/CtxB - субодиниця В холерного токсину CTL - цитотоксичні Т-Клітини CD8+ (Т-Клітини кілери) CMV - цитомегаловірус ДНК - дезоксирибнуклеїнова кислота ds - дволанцюгова DT/Dtx - дифтерійний токсин Е. coli - Escherichia coli ЕВV - вірус Епштейна-Барр рецептор GM-1 - рецептор моносиалоганглиозидази 1 НА - гемагглютинін HCV - вірус гепатиту С ВІЛ - вірус імунодефіциту людини Hly - гемолізин HPV - вірус папіломи людини НТ - геморрагічний токсин i.d. - внутрішньошкірно і.m. - внутрішньом'язово і.р. - внутрішньочеревинно ІФН - інтерферон IgA - імуноглобулін ізотипу А IgG - імуноглобулін ізотипу G ІЛ - інтерлейкин KD - кіназа dead LPS - липополісахарид LT - термолабільний ентеротоксин Е. coli LT - летальний токсин LTB - субодиниця В термолабільного ентеротоксину Е. coli mAb - моноклональное антитіло МНС - головний комплекс гістосумісності NK-Клітина - натуральна клітина-кілер NKT-Клітина - Т-клітина натуральний кілер PAGE - електрофорез у поліакриламідному гелі PBS - забуферений фосфатом сольовий розчин ПЦР - полімеразна ланцюгова реакція РЕ - екзотоксин A Pseudomonas PSA - простата-специфічний антиген PT/Ptx - токсин коклюшу РНК - рибонуклеїнова кислота s.c. - підшкірний SDS - додецилсульфат натрію Sec- головний секреторний (Sec) шлях Ss - одноланцюговий ST - термостабільний ентеротоксин Е. coli ST/Stx - шига- токсин STB/StxB - субодиниця В шига-токсину T3SS- система секреції типу III Tat - подвійна транслокація аргиніну ТСА - трихлороцтова кислота Th1 (клітина) - запальні Т-клітини CD4+ Th2 (клітина) - Т-клітини-Хелпери CD4+ TSST-1 - токсин синдрому токсичного шоку ТТ - правцевий токсин VT - Vero-Токсин Бібліографія 1. Agren, L. С, Ekman, L, Lowenadler, В., Nedrud, J. G., and Lycke, N. Y. (1999). Adjuvanticity of the cholera toxin A1-based gene fusion protein, CTA1DD, is critically dependent on the ADPribosyltransferase and Ig-binding activity. J Immunol 162, 2432-2440. 59 2. Anderson, R. J., Pasetti, M. F., Sztein, M. В., Levine, M. M., and Noriega, F. R. (2000). guaBA attenuated Shigella flexneri 2a strain CVD 1204 as a Shigella vaccine and as a live mucosal delivery system for fragment С of tetanus toxin. Vaccine 18, 2193-2202. 3. Austin, Ε. Α., Graves, J. F., Hite, L. Α., Parker, С. Т., and Schnaitman, С. A. (1990). Genetic analysis of lipopolysaccharide core biosynthesis by Escherichia coli K-12: insertion mutagenesis of the rfa locus. J Bacteriol 172, 5312-5325. 4. Balsalobre, C, Silvan, J. M., Berglund, S., Mizunoe, Y., UhNn, B. E., and Wai, S. N. (2006). Release of the type I secreted alpha-haemolysin via outer membrane vesicles from Escherichia coli. J. Mol Microbiol 59, 99-1 12. 5. Barry, E. M., Gomez-Duarte, O., Chatfield, S., Rappuoli, R., Pizza, M., Losonsky, G., Galen, J., and Levine, Μ. Μ. (1996). Expression and immunogenicity of pertussis toxin S1 subunit-tetanus toxin fragment С fusions in Salmonella typhi vaccine strain CVD 908. Infect Immun 64, 4172-4181. 6. Becerra, J. C, Arthur, J. F., Landucci, G. R., Formal, D. N. and Theuer, С. Р. (2003). CD8+ T-cellmiediated tumor protection by Pseudomonas ехоtoxin fused to ovalbumin in C57BL/6mice. Surgery 133, 404-410. 7. Boon, Т., Coulie, P. G., Van den Eynde, B. J., and van der Bruggen, P. (2006). Human Τ cell responses against melanoma. Annu Rev Immunol 24, 175-208. 8. Boyd, A. P., Ross, P. J., Conroy, H., Mahon, N., Lavelle, E. C, and Mills, K. Н. (2005). Bordetella pertussis adenylate cyclase toxin modulates innate and adaptive immune responses: distinct roles for acylation and enzymatic activity in immunomodulation and cell death. J Immunol 175, 730-738. 9. Brassier, F., Weber-Levy, M, Mock, M., and Sirard, J. С (2000). Protective antigen- mediated antibody response against a heterologous protein produced in vivo by Bacillus anthracis. Infect Immun 68, 57315734. 10. Bumann, D. (2001). Regulated antigen expression in live recombinant Salmonella enterica serovar Typhimurium strongly affects colonization capabilities and specific CD4(+)-T-cell responses. Infect Immun 69, 7493-7500. 11. Busby, S., and Ebright, R. H. (1994). Promoter structure, promoter recognition, and transcription activation in prokaryotes. Cell 79, 743-746. 12. Butterton, J. R., Beattie, D. Т., Gardel, С L, Carroll, P. Α., Hyman, Т., Killeen, K. P., Mekalanos, J. J., and Calderwood, S. B. (1995). Heterologous antigen expression in Vibrio cholerae vector strains. Infect Immun 63, 2689-2696. 13. Byun, Y., Ohmura, M., Fujihashi, K., Yamamoto, S., McGhee, J. R., Udaka, S., Kiyono, H., Takeda, Y., Kohsaka, Т., and Yuki, Y. (2001 ). Nasal immunization with E. coli vero- toxin 1 (VT1)-B subunit and a nontoxic mutant of cholera toxin elicits serum neutralizing antibodies. Vaccine 19, 20612070. 14. Campos, J., Martinez, E., Marrero, K., Silva, Y., Rodriguez, B. L, Suzarte, E., Ledon, Т., and Fando, R. (2003). Novel type of specialized transduction for CTX phi or its satellite phage RSI mediated by 94974 60 filamentous phage VGJ phi in Vibrio cholerae. J Bacteriol 185, 7231-7240. 15. Cardenas, L, and Clements, J. D. (1992). Oral immunization using live attenuated Salmonella spp. as carriers of foreign antigens. Clin Microbiol Rev 5, 328-342. 16. Cardenas, L., and Clements, J. D. (1993). Development of mucosal protection against the heatstable enterotoxin (ST) of Escherichia coli by oral immunization with a genetic fusion delivered by a bacterial vector. Infect Immun 61, 4629-4636. 17. Chabalgoity, J. Α., Harrison, J. Α., Esteves, Α., Demarco de Hormaeche, R., Ehrlich, R., Khan, С Μ., and Hormaeche, С. Е. (1997). Expression and immunogenicity of an Echinococcus granulosus fatty acid-binding protein in live attenuated Salmonella vaccine strains. Infect Immun 65, 2402-2412. 18. Chabalgoity, J. Α., Khan, С Μ., Nash, Α. Α., and Hormaeche, С. Ε. (1996). A Salmonella typhimurium htrA live vaccine expressing multiple copies of a peptide comprising amino acids 8-23 of herpes simplex virus glycoprotein D as a genetic fusion to tetanus toxin fragment С protects mice from herpes simplex virus infection. J. Mol Microbiol 19, 791-801. 19. Chabalgoity, J. Α., Moreno, M., Carol, H., Dougan, G., and Hormaeche, С. Е. (2000). Salmonella typhimurium as a basis for a live oral Echinococcus granulosus vaccine. Vaccine 19, 460469. 20. Chabalgoity, J. Α., Villareal-Ramos, В., Khan, С Μ., Chatfield, S. N., de Hormaeche, R. D., and Hormaeche, С. Ε. (1995). Influence of preimmunization with tetanus toxoid on immune responses to tetanus toxin fragment C-guest antigen fusions in a Salmonella vaccine carrier. Infect Immun 63, 2564-2569. 21. Chacon, M. R., Londono, P., Dougan, G., and Selkirk, Μ. Ε. (1996). Heterologous expression of the cuticular-glutathione peroxidase of lymphatic filariae in an attenuated vaccine strain of Salmonella typhimurium abrogates H-2 restriction of specific antibody responses. Parasite Immunol 18, 307-316. 22. Chen, I., Finn, T. M., Yanqing, L, Guoming, Q., Rappuoli, R., and Pizza, M. (1998). A recombinant live attenuated strain of Vibrio cholerae induces immunity against tetanus toxin and Bordetella pertussis tracheal colonization factor. Infect Immun 66, 1648-1653. 23. Cheng-hua, S., Cheng, C, Jing-sheng, Z., Jiezhi., L., and Qing-jun, M. (1995). Gene fusion of cholera toxin В subunit and HBV PreS2 epitope and the antigenicity of fusion protein. Vaccine 13, 933-937. 24. Clemens, J., Savarino, S., Abu-Elyazeed, R., Safwat, M., Rao, M., Wierzba, Т., Svennerholm, A. M., Holmgren, J., Frenck, R., Park, E., and Naficy, A. (2004). Development of pathogenicity-driven definitions of outcomes for a field trial of a killed oral vaccine against enterotoxigenic Escherichia coli in Egypt: application of an evidence-based method. J Infect Dis 189, 2299-2307. 25. Datsenko, Κ. Α., and Wanner, B. L. (2000). Onestep inactivation of chromosomal genes in Escherichia coli K-12 using PCR products. Proc Natl Acad Sci USA 97, 6640-6645.
ДивитисяДодаткова інформація
Назва патенту англійськоюMicroorganisms as carriers of nucleotide sequences coding antigenes and protein toxines, method for theirs preparation and using
Автори англійськоюGentschev, Ivaylo, Fensterle, Joachim, Rapp, Ulf R., Goebel, Werner
Назва патенту російськоюМикроорганизмы как носители нуклеотидных последовательностей, которые кодируют антигены и белковые токсини, способ их получения и применения
Автори російськоюГентшев Ивайло, Фенштерле Йоахим, Рапп Ульф Р., Гебель Вернер
МПК / Мітки
МПК: C07K 14/28, C07K 14/245, G01N 33/569, C07K 14/33, C12N 15/62, C12R 1/145, A61K 39/385, C12R 1/42, C07K 14/24, C12R 1/63, A61K 39/112, C12R 1/01, C07K 14/255, C12R 1/19, A61K 39/108
Мітки: білкові, мікроорганізми, нуклеотидних, токсини, антигени, одержання, спосіб, застосування, кодують, послідовностей, носії
Код посилання
<a href="https://ua.patents.su/79-94974-mikroorganizmi-yak-nosi-nukleotidnikh-poslidovnostejj-shho-koduyut-antigeni-ta-bilkovi-toksini-sposib-kh-oderzhannya-ta-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Мікроорганізми як носії нуклеотидних послідовностей, що кодують антигени та білкові токсини, спосіб їх одержання та застосування</a>
Попередній патент: Спосіб попереднього обробляння, переробляння або вторинного обробляння термопластичного матеріалу
Наступний патент: Композиція та її застосування для лікування гіперглікемії та пов’язаних з нею хвороб
Випадковий патент: Стойка для корекції фізичних вад