Застосування лактопротеїну з сорбітолом як цитопротектора аденогіпофіза при опіковій хворобі
Формула / Реферат
Застосування лактопротеїну з сорбітолом як цитопротектора аденогіпофіза при опіковій хворобі.
Текст
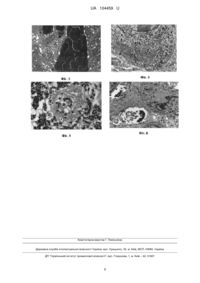
Реферат: UA 104459 U UA 104459 U 5 10 15 20 25 30 35 40 45 50 55 Корисна модель, що заявляється, стосується нового застосування лактопротеїну з сорбітолом як цитопротектора аденогіпофіза, за рахунок включення механізмів селективної автофагії та кринофагії. Дослідженнями останніх років [3, 9] встановлено, що автофагія є еволюційно закріпленим механізмом захисту клітин ссавців від накопичення пошкоджених органел або білкових агрегатів. Клітинна загибель, що відбувається при явищах автофагії, також отримала назву "автофагія" [5]. В ендокринних органах автофагія відіграє важливу роль у контролі внутрішньоклітинних рівнів гормонів у нормі та за умов розвитку різних захворювань [3, 4, 7]. У той же час, в складному патогенезі опікової хвороби [8] роль автофагії в структурних змінах аденогіпофіза не була предметом спеціальних досліджень. Лактопротеїн-С - це інфузійний колоїдно-гіперосмолярний препарат, який містить альбумін (5 %), сорбітол (6 %), лактат натрію (2,1 %), а також електроліти в збалансованих кількостях. Теоретична осмолярність препарату - 1020 мОсм/л. Лактопротеїн-С показаний до застосування як засіб корекції кислотно-лужного стану і гіпопротеїнемії, покращення мікроциркуляції, зменшення інтоксикації, покращення гемодинаміки при травматичному, операційному, гемолітичному та опіковому шоку, при опіковій хворобі; в післяопераційному періоді після порожнинних операцій; при гіпопротеїнемії різноманітного походження, хронічних гепатитах, при різних інфекційних захворюваннях. Винахідником цієї корисної моделі раніше було запропоновано застосування лактопротеїну з сорбітолом як маркера змін проникності кровоносних капілярів внутрішніх органів при опіковій хворобі [патент України на корисну модель UA92234, А61К31/047, опуб. 11.08.2014]. В ході попередніх досліджень було виявлено, що введення лактопротеїну з сорбітолом гальмує структурні прояви клітинної загибелі та сприяє збереженню життя ендокринних клітин аденогіпофіза за рахунок залучення механізмів автофагії та кринофагії. Кринофагія в ендокринних клітинах аденогіпофіза носить адаптивний характер; вона забезпечує знищення і виділення надлишкової кількості гормонів, що є спотвореними у результаті характерної для опікової хвороби катаболічної реакції. Автофагія спрацьовує у разі нагальної (аварійної) потреби видалення ушкоджених органел разом з прилеглими ділянками цитоплазми. Тому задачею корисної моделі було виявлення застосування лактопротеїну з сорбітолом як цитопротекторного засобу, що перешкоджає загибелі клітин аденогіпофіза при опіковій хворобі. Поставлена задачу було вирішено за рахунок внутрішньовенної інфузії лактопротеїну з сорбітолом при вивченні автофагії і кринографії в аденогіпофізі щурів у експериментальною опіковою хворобою. Відповідно, об'єктом корисної моделі є застосування лактопротеїну з сорбітолом як цитопротектора аденогіпофіза. Представлена корисна модель далі пояснюється із залученням графічних матеріалів, де на Фіг. 1 показаний стаз еритроцитів у просвіті кровоносного капіляра аденогіпофіза щура через 1 добу після експериментальної опікової травми за умов введення 0,9 % розчину NaCl. Зб. 6000; на Фіг. 2. показаний стаз еритроцитів у просвіті кровоносного капіляра, периваскулярний набряк, локальний крововилив та зона некрозу в аденогіпофізі щура через 3 доби після експериментальної опікової травми за умов введення 0,9 % розчину NaCl. Зб.10000; на Фіг. 3 показаний осередок крововиливу в аденогіпофізі щура через 7 діб після експериментальної опікової травми за умов введення 0,9 % розчину NaCl. Зб. 6 000; на Фіг. 4 показане концентричне групування канальців гранулярної ендоплазматичної сітки (як початкова стадія утворення автофагосоми) в цитоплазмі кортикотропоцита аденогіпофіза щура через 3 доби після експериментальної опікової травми за умов введення лактопротеїну-С. Зб. 15000; на Фіг. 5 показане дозрівання автофагосоми в цитоплазмі соматотропоцита аденогіпофіза щура через 7 діб після експериментальної опікової травми за умов введення лактопротеїну-С. Зб. 16000; на Фіг. 6 показана руйнація вмісту автофаголізосом в цитоплазмі кортикотропоцита аденогіпофіза щура через 7 діб після експериментальної опікової травми за умов введення лактопротеїну-С. Зб. 14 000. Експериментальне дослідження морфологічних змін в аденогіпофізі при опіковій травмі (через 1, 3, 7, 14, 21, 30 діб) за умов інфузії 0,9 % розчину NACl, а також колоїдногіперосмолярних препаратів HAES-LX-5 % та лактопротеїну з сорбітолом (фірмова назва препарату - "Лактопротеїн-С") було виконано на 90 щурах-самцях лінії Вістар масою 155-160 грам. 1 UA 104459 U 5 10 15 20 25 30 35 Утримання та маніпуляції з тваринами проводили у відповідності до "Загальних етичних принципів експериментів на тваринах", ухвалених Першим національним конгресом з біоетики (Київ, 2001), також керувалися рекомендаціями "Європейської конвенції про захист хребетних тварин, які використовуються для експериментальних та інших наукових цілей" (Страсбург, 1985) і положеннями "Правил до клінічної оцінки безпеки фармакологічних засобів (GLP)". Тварини були розділені на 7 груп: І - інтактні тварини, II, III, IV - щури без термічної травми, яким проводилась окрема інфузія 0,9 % розчину NaCl, HAES-LX-5 % та лактопротеїну-С відповідно у дозі 10 мл/кг; V; VI; VII - тварини з опіком, яким за аналогічною схемою та у такому ж дозовому режимі проводили окреме введення досліджуваних речовин. Опік (після відповідної премедикації) викликали шляхом прикладання до бічних поверхонь тулуба тварин чотирьох мідних пластинок (по дві пластинки з кожного боку), які попередньо тримали упродовж 6 хвилин у воді з постійною температурою 100 °C. Загальна площа опіку у щурів зазначеної маси складала 21-23 % при експозиції 10 с, що є достатнім для формування опіку II ступеня - дермального поверхневого опіку (колишній III А ступінь) та розвитку шокового стану середнього ступеня важкості. Досліджувані розчини вводили внутрішньовенно упродовж 5-6 хв. у дозі 10 мл/кг маси тіла. Інфузію проводили у нижню порожнисту вену, для чого виконували її катетеризацію в асептичних умовах через стегнову вену. Катетер, встановлений у стегновій вені, підшивали під шкіру. Його просвіт по всій довжині заповнювали титрованим розчином гепарину (0,1 мл гепарину на 10 мл 0,9 % розчину NaCl) після кожного введення речовин. Перше введення розчинів здійснювали через 1 годину після моделювання патологічного стану, наступні інфузії виконували щоденно загалом впродовж 7 діб. Забір матеріалу проводився під наркозом. У тварин після декапітації робили розтин грудної порожнини і вирізали за допомогою леза невеликі шматочки тимуса. Матеріал для морфологічних досліджень обробляли за загальноприйнятою методикою. Ультратонкі зрізи готували на ультрамікротомі "LKB", і вивчали та фотографували на електронному мікроскопі ПЕМ-125К. Напівтонкі зрізи забарвлювали толуїдиновим синім, вивчали та фотографували за допомогою світлового мікроскопа Olympus BX 51. Експеримент був здійснений на базі Науково-дослідного центру Вінницького національного медичного університету імені М.І. Пирогова. Електронномікроскопічне дослідження виконано на базі відділу електронної мікроскопії (науковий керівник - професор Л.О. Стеченко) Інституту проблем патології Національного медичного університету імені О.О. Богомольця. Проведені нами попередні дослідження показали (Табл. 1), що щури-самці без будь-якої фармакологічної корекції на фоні опікової травми шкіри гинули всі на 9-у добу експерименту, а на 7-у добу летальність складала 80 %, в зв'язку з чим (враховуючи питання біоетики), практично не можливим було набрати коректну, у кількісному відношенні, групу контролю з чистим опіком шкіри без лікування. З метою контролю лікувальної дії колоїдно-гіперосмолярних розчинів ми спиралися на групу тварин, які на фоні опіку шкіри отримували 0,9 % розчин NaCl. Таблиця 1 Летальність щурів після опікової травми шкіри без введення будь-яких фармакологічних розчинів Кількість щурів n=10 1 n=3 2 n=1 Термін спостереження (доба) 3 4 5 6 7 n=2 n=0 n=1 n=0 n=1 8 n=0 9 n=2 40 45 У групі тварин з опіковою травмою шкіри, яким вводили 0,9 % розчин NaCl, виявлене прогресуюче збільшення показника летальності від 5 % через 1-у добу до 11 % у проміжку від 4ї до 7-ї доби з наступним поступовим зменшенням величини даного показника до 3 % у проміжку від 22-ї до 30-ї доби після опіку шкіри. Загальний показник летальності в групі щурів самців, яким після опіку шкіри вводили 0,9 % розчин NaCl склав 43,5 %. Окрема лікувальна курсова терапія щурів з опіковою травмою шкіри розчином HAES-LX-5 % подібно до такої лактопротеїном-С суттєво перешкоджала загибелі тварин упродовж усього спостереження. 2 UA 104459 U Таблиця 2 Вплив фармакотерапії 0,9 % розчином NaCl, лактопротеїном-С та HAES-LX-5 % на показники летальності щурів з опіковою травмою шкіри Умови досліду Опік + 0,9 % розчин NaCl (n=200) Опік + HAES-LX-5 % (n=120) Опік + лактопротеїн-С (n=120) 1 n=10 (5 %) n=2 (1,7 %) n=1 (0,8 %) Летальність тварин (n-%) Термін спостереження (доба) 2-3 4-7 8-14 15-21 n=21 n=22 n=17 n=11 (10,5 %) (11 %) (8,5) (5,5 %) n=4 n=5 n=4 n=2 (3,3 %)* (4,2 %)* (3,3 %)# (1,7 %) n=4 n=3 n=3 n=1 (3,3 %)* (2,5 %)* (2,5 %)* (0,8 %) 22-30 n=6 (3 %) N=1 (0,8 %) n=3 (1,7 %) * - достовірна різниця відносно контролю (опік + 0,9 % NaCl); # - тенденція різниці відносно контролю (опік + 0,9 % NaCl). 5 10 15 20 25 30 35 40 Для аденогіпофіза щурів з опіковою травмою шкіри, яким вводили 0,9 % розчин NaCl, через 1, 3, 7 та 14 діб експерименту (терміни, коли зареєстроване збільшення та стабілізація) величини показників летальності та ендогенної інтоксикації) Найбільш характерним загальним проявом патоморфологічних змін була альтерація функціонально різних клітин органів та стінок судин гемомікроциркулярного русла на тлі мозаїчного, але інколи виразного (особливо через 1 добу) міжклітинного та паравазального набряку та крововиливів. У стінці деяких кровоносних капілярів і вену спостерігається парціальний і тотальний некроз ендотеліоцитів, відбувається потоншення та локальна руйнація базальної мембрани, утворюються паравазальні крововиливи. Зміни конфігурації міжендотеліальних контактів призводять до того, що в ділянках простих за формою і невеликих за довжиною міждотеліальних контактів з'являються розширені міжендотеліальні щілини або трансендотеліальні канали, які в зонах відповідних до них локусів руйнації базальної мембрани мають вигляд наскрізних трансмуральних дефектів. Описані трасмуральні дефекти разом з прилеглими і розширеними (у результаті розвитку набряку) міжклітинними просторами вивчених органів є місцями "протікання" і внутрішньоорганного "проникнення" плазми та клітин крові, що призводить до прогресування набряку та крововиливів. У щурів з опіковою травмою, яким за схемою експерименту були введені гіперосмолярні розчини у аденогіпофізі не виявлені суттєві пошкодження стінки кровоносних судин та крововиливи, а також, відповідно, не зареєстровані структурні ознаки паравазального та міжклітинного набряку. Це свідчить про ангіопротекторні властивості застосованих комбінованих гіперосмолярних розчинів, які за умов застосування лактопротеїну з сорбітолом пов'язані з доволі специфічною мембранопластичною дією цього препарату. Проведені нами попередні дослідження [1, 2] вказують, що внутрішньовенна інфузія розчину лактопротеїну з сорбітолом забезпечує гальмування процесу ендогенної інтоксикації і, таким чином, пролонгацію фази відносної резистенції, а також включення механізмів компенсаторнопристосувальних та відновних процесів у аденогіпофізі за умов дослідженої експериментальної опікової травми. Це відбувається за рахунок структурних трансформацій гістогематичного бар'єру коли співдружня діяльність клітин судинної стінки та ендокринних клітин призводить до формування "перивазального мамбранного комплексу, що має бічні відгалуження", або простіше кажучи "колатералізованого мамбранного комплексу" в паренхімі аденогіпофіза щурів VII експериментальної групи. Нами встановлено, що частина ендокринних клітин аденогіпофіза на етапах розвитку опікової травми гине шляхом апоптозу та некрозу. З'ясовано також, що введення лактопротеїну з сорбітолом гальмує структурні прояви клітинної загибелі та сприяє збереженню життя клітин аденогіпофіза за рахунок залучення механізмів автофагії та кринофагії. Свідченням ініціації автофагії є оточення та секвестрація клітинних органел і локусів ущільнення дрібногранулярного цитоплазматичного матрикса ізолюючою мембраною (фагофором). Найбільш типовим та розповсюдженим варіантом утворення фагофорів є концентричне групування канальців гранулярної ендоплазматичної сітки навколо "ядра" 3 UA 104459 U 5 10 15 20 25 30 35 40 45 50 55 60 (секреторних гранул, агрегованих протеїнів, ушкоджених мітохондрій та канальців ендоплазматичної сітки). Канальці ендоплазматичної сітки з'єднуються своїми кінцями і утворюють концентричні кола. В результаті утворюється замкнена автофагосома. Як свідчать одержані нами дані, автофагосоми в клітинах аденогіпофіза підлягають послідовному процесу розвитку, що включає їх об'єднання з лізосомами та утворення автофаголізосом. Останнє забезпечує ізольований контакт секвестрованого цитоплазматичного вмісту з лізосомальними компонентами, їх злиття та деградацію. В подальшому відбувається руйнування внутрішніх мембран, потім вмісту автофагосоми і, нарешті, перетворення її на автофагійну вакуоль з електроннопрозорим вмістом. Автофагійні вакуолі тривалий час перисистують в цитоплазмі ендокриноцитів аденогіпофіза, а потім, після злиття з цитолемою, виділяють свій вміст назовні. Одержані нами дані свідчать, що кринофагія в ендокринних клітинах аденогіпофіза носить адаптивний характер; вона забезпечує знищення і виділення надлишкової кількості гормонів, що є спотвореними у результаті характерної для опікової хвороби катаболічної реакції [8]. Автофагія, яка є енергозатратним процесом [9], спрацьовує у разі нагальної (аварійної) потреби видалення ушкоджених органел разом (з прилеглими ділянками цитоплазми) усіх випадках кринофагія і автофагія супроводжується виразною лізосомальною реакцією. Іноді вміст лізосом вивільнюється у цитозоль і відбувається саморуйнування клітини, тобто відбувається автоліз. Саме тому лізосоми ще називають "знаряддям самогубства" [6]. Можна припустити, що шлях клітинної загибелі ендокриноцитів аденогіпофіза при опіковій хворобі визначається ступенем і контрольованістю лізосомальної реакції: якщо масове пошкодження лізосом або автофаголізосом призводить до некрозу, то контрольований вихід лізосомальних ферментів у цитозоль здатен призвести до запуску апоптоза. Загальною ознакою реакції усіх ендокриноцитів аденогіпофіза (незалежно від рівня структурних проявів секреторної активності) у обпечених щурів, які одержували лактопротеїн з сорбітолом, є кринографія. Вперше цей феномен специфічної взаємодії лізосом з секреторними гранулами був виявлений R.E. Smith, M.G. Farquar в 1966 році, [10], але широкого розповсюдження термін "кринографія" набув після виходу у світ відомої і часто цитованої статті С. de Duve [6]. При кринофагії (на відмінну від автофагії) попередньої ізоляції ділянок цитоплазми ендокринної клітини аденогіпофіза з секреторними гранулами за допомогою мембранних елементів не відбувається, натомість інкорпорація вмісту лізосом в секреторні гранули здійснюється за умов справжнього злиття цих двох органел. Пряме злиття секреторних гранул з лізосомами призводить до руйнування або модифікації секреторного матеріалу. Трансформовані секреторні гранули після злиття з цитолемою виділяють свій вміст назовні (екзоцитоз) або відбувається руйнація мембрани трансформованої секреторної гранули в цитоплазмі. В останньому випадку продукти гідролітичного перетворення вмісту секреторних гранул шляхом дифузії проникають через цитолему у перикапілярний простір і через фенестри ендотелія кровоносних капілярів виділяються у кровоносне русло. Висновки 1. Внутрішньовенна інфузія розчину лактопротеїну з сорбітолом забезпечує пролонгацію фази відносної резистенції, а також включення механізмів компенсаторно-пристосувальних та відновних процесів у аденогіпофізі за умов дослідженої експериментальної опікової травми. Це відбувається за рахунок структурних трансформацій гістогематичного бар'єру, коли співдружня діяльність клітин судинної стінки та ендокринних клітин призводить до формування "колагенізованого мембранного комплексу" в паренхімі аденогіпофіза щурів. 2. Введення лактопротеїну з сорбітолом гальмує структурні прояви клітинної загибелі та сприяє збереженню життя ендокринних клітин аденогіпофіза за рахунок залучення механізмів автофагії та кринофагії. Кринофагія в ендокринних клітинах аденогіпофіза носить адаптивний характер; вона забезпечує знищення і виділення надлишкової кількості гормонів, що є спотвореними у результаті характерної для опікової хвороби катаболічної реакції. Автофагія спрацьовує у разі нагальної (аварійної) потреби видалення ушкоджених органел разом з прилеглими ділянками цитоплазми. 3. При кринографії (на відмінну від автофагії) попередньої ізоляції ділянок цитоплазми ендокринної клітини аденогіпофіза з секреторними гранулами за допомогою мембранних елементів не відбувається, натомість інкорпорація вмісту лізосом в секреторні гранули здійснюється за умов справжнього злиття двох органел. Пряме злиття секреторних гранул з лізосомами призводить до руйнування або модифікації секреторного матеріалу. Трансформовані секреторні гранули після злиття з цитолемою виділяють свій вміст назовні (екзоцитоз) або відбувається руйнація мембрани трансформованої секреторної гранули в цитоплазмі. В останньому випадку продукти гідролітичного перетворення вмісту секреторних 4 UA 104459 U 5 10 15 20 25 30 гранул шляхом дифузії проникають через цитолему у перикапілярний простір і через фенестри ендотелія кровоносних капілярів виділяються у кровоносне русло. Перспектива подальших досліджень у даному напрямку полягає у вивченні за допомогою цитофотометрії показників клітинного циклу та апоптозу в аденогіпофізі тварин при експериментальній опіковій травмі шкіри за умов застосування інфузії розчинів лактопротеїну з сорбітолом та HAES-LX-5 %. Джерела інформації: 1. Вплив внутрішньовенної інфузії комбінованих гіперосмолярних розчинів на перебіг опікової хвороби та структурні зміни органів нейроімуноендокринної системи при опіковій хворобі / І.В. Гунас, І.В. Дзевульська, Е.В. Черкасов, O.I. Ковальчук // Світ медицини та біології. 2014. - № 1. - С. 111-118. 2. Вплив ендогенної інтоксикації на структурні зміни органів нейроімуноендокринної системи за умов лікування опікової хвороби комбінованими гіперосмолярними розчинами / О.І. Ковальчук, Е.В. Черкасов, І.В. Дзевульська, І.В. Гунас // Український науково-медичний молодіжний журнал. - 2014. - №1 (79). С. 42-47. 3. Autophagy in the endocrine glands / A. Werman, A. Di Leva, F. Rotondo [et. al.] // Youmal of Molecular Endocrinology. - 2014. - Vol. 52 (2). - p. 151-163. 4. Autophagy in human health and disease / A.M. Choi, S.W. Ryter, B. Levine // New England Journal of Medicine/ - 2013. - Vol. 368. - p. 651-662. 5. Classification of cell death: recommendations of the Nomenclature Committee on Cell Death / G. Kromer, L. Galluzzi, P. Vandenabeele [et. al.] // Cell Death Differ. - 2009. - Vol. 16. - p. 1-3. 6. de Duve C. The lysosome in retrospect / C. de Duve // Lysosome in Biology and Patology. 1969. - Vol. 1. - p. 3-40. 7. Levine B. Autophagy in the pathogenesis of disease / B. Levine, G. Kroemver // Cell. - 2008. Vol. 132. - P. 27-42. 8. Pathophysiology of burns / M. Keck, D. Herdon, L. - P. Kromolz [et. al.] // Wien Med. Wochenschr. - 2009. - Vol. 159. - P. 327-336. 9. Regulation of mammalian autophagy in physiology and pathophysiology / b. Ravikmura, S. Sakar, J. E. Davies [et. al.] // Physiological Reviews. - 2010. - Vol. 90. - P. 1383-1435. 10. Smith R.E. Lysosome function in the regulation of the secretory process in cells of the anterior pituitary gland / R.E. Smith, M.C. Farguhar // Journal of Cell Biology. 1966. - Vol. 31. - p. 319-347. ФОРМУЛА КОРИСНОЇ МОДЕЛІ Застосування лактопротеїну з сорбітолом як цитопротектора аденогіпофіза при опіковій хворобі. 5 UA 104459 U Комп’ютерна верстка Г. Паяльніков Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 6
ДивитисяДодаткова інформація
МПК / Мітки
МПК: A61K 31/047
Мітки: хвороби, аденогіпофіза, сорбітолом, цитопротектора, застосування, опіковій, лактопротеїну
Код посилання
<a href="https://ua.patents.su/8-104459-zastosuvannya-laktoprotenu-z-sorbitolom-yak-citoprotektora-adenogipofiza-pri-opikovijj-khvorobi.html" target="_blank" rel="follow" title="База патентів України">Застосування лактопротеїну з сорбітолом як цитопротектора аденогіпофіза при опіковій хворобі</a>
Попередній патент: Пристрій для проточної ультразвукової стерилізації газорідинної суміші
Наступний патент: Упаковка для гарбузового насіння
Випадковий патент: Спосіб одержання заклепувального з'єднання підвищеної міцності