Спосіб визначення ефективності лікування експериментальної пудендопатії
Номер патенту: 120656
Опубліковано: 10.11.2017
Автори: Дехтяр Юрій Миколайович, Костєв Федір Іванович, Сон Анатолій Сергійович, Руденко Олександр Вікторович, Красилюк Леонід Іванович
Формула / Реферат
Спосіб визначення ефективності лікування експериментальної пудендопатії шляхом дослідження біологічних тканин тварини, який відрізняється тим, що тваринам після відтворення пудендопатії і введення адренотропного препарату протягом 2,5 місяців та виведення тварин з експерименту виконують забір крові та біологічних тканин, визначають їх біохімічні константи і додатково - морфологічні порушення, і при зниженні лактатдегідрогенази до 50 %, зменшенні дегенеративно-дистрофічних проявів, а саме - набряку та некрозу м'язових волокон, фрагментації нервових волокон у порівнянні з тваринами з відтвореною пудендопатією проведене експериментальної пудендопатії лікування вважають ефективним.
Текст
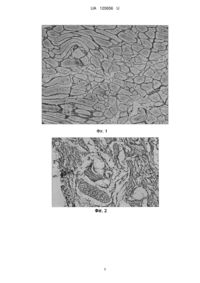
Реферат: Спосіб визначення ефективності лікування експериментальної пудендопатії шляхом дослідження біологічних тканин тварини, причому тваринам після відтворення пудендопатії і введення адренотропного препарату протягом 2,5 місяців та виведення тварин з експерименту виконують забір крові та біологічних тканин, визначають їх біохімічні константи і додатково морфологічні порушення, і при зниженні лактатдегідрогенази до 50 %, зменшенні дегенеративно-дистрофічних проявів, а саме - набряку та некрозу м'язових волокон, фрагментації нервових волокон у порівнянні з тваринами з відтвореною пудендопатією проведене експериментальної пудендопатії лікування вважають ефективним. UA 120656 U (54) СПОСІБ ВИЗНАЧЕННЯ ЕФЕКТИВНОСТІ ЛІКУВАННЯ ЕКСПЕРИМЕНТАЛЬНОЇ ПУДЕНДОПАТІЇ UA 120656 U UA 120656 U 5 10 15 20 25 30 35 40 45 50 55 60 Корисна модель належить до області медицини, а саме урології, і може бути застосована для визначення ефективності лікування синдрому хронічного тазового болю (СХТБ) в експерименті. Згідно з опублікованими даними, у 5-10 % випадків причиною виникнення хронічного простатиту служить бактеріальне ураження. В 90 % випадків, коли за допомогою лабораторних методів дослідження не вдається виявити бактеріального збудника, діагностують хронічний небактеріальний простатит або простатодинію. За сучасною класифікацією захворювань, синдром хронічного тазового болю є синонімом III категорії хронічного абактеріального простатиту. СХТБ у чоловіків посідає перше місце по поширеності серед захворювань чоловічої статевої сфери й одне з перших місць серед чоловічих захворювань у цілому (1). Незважаючи на множинні спроби охарактеризувати СХТБ і виробити діагностичний і лікувальний алгоритм, цей стан продовжує являти собою важку, невирішену проблему як для урологів, так і для самих хворих. Основна проблема полягає в труднощах виявлення причин наявних симптомів і, відповідно, їх лікування. Соціальна значимість захворювання обумовлена його високою поширеністю, негативним впливом на статеву, репродуктивну й психоемоційну сфери, значним погіршенням якості життя чоловіків, яке порівнюється з гострим інфарктом міокарда, хворобою Крона, серцевою недостатністю або цукровим діабетом. Останнім часом значно змінився підхід до патогенезу, діагностики й лікування СХТБ. Насамперед, він став комплексним, оскільки органи малого таза тісно зв'язані між собою, часто мають загальну аферентну й еферентну іннервацію, кровообіг, м'язово-зв'язковий апарат. Таким чином, ураження одного органа часто втягує в патологічний процес інші (2). Також, усе частіше переважає точка зору про зниження ролі інфекційно-запальних захворювань у патогенезі СХТБ. У цей час основну роль, на думку дослідників, відіграють міофасціальні (спастичні) синдроми м'язів тазового дна й нейропатія статевого нерва, який неофіційно називають king of perineum - "король промежини" (3). Найбільш близьким до заявленого технічного рішення є розробка, в якій вивчалися особливості перебігу денерваційного синдрому в тканинах реінервованої кінцівки щурів під впливом локальної резонансної вібрації. Дослідження проводилося на безпорідних щурах самцях у віці 2-3 місяців, котрим виконувалося пересічення сідничного нерва, накладання епіпериневрального шва. На 14, 28, 35, 49 і 56 добу після операції оцінювали наявність трофічних виразок, аномалій росту кігтів, сухість і лущення шкірних покривів підошовні поверхні ступні, симптом обвисання хворої кінцівки, симптом "віяла", реакцію на больовий подразнювач. Вібраційний резонансний вплив дозволяє зменшити частоту випадіння кігтів, покращити репаративні процеси у поверхневих тканинах, більш швидко відновити функції нерва: перші ознаки регенерації з'являються в середньому на 4 тижні раніше, ніж в контролі, анейротрофічні виразки виникали. Зникнення симптому обвисання нижньої кінцівки був більш швидким у тварин основної групи, симптом "віяла" більш швидко відновлювався. На момент закінчення експерименту повне відновлення функції реіннервованої кінцівки спостерігалося у 75 % тварин експериментальної групи. Однак вказаний метод не є достатньо вірогідним, оскільки базується на візуальному спостереженні за тваринами. В основу корисної моделі поставлено задачу розробки способу визначення ефективності лікування синдрому хронічного тазового болю в експерименті шляхом вивчення застосованої лікарської форми гексопреналіну сульфату на раніше створеній моделі СХТБ, результати дослідження якого дозволять застосовувати спосіб в клінічній практиці. Поставлена задача вирішується тим, що, згідно з корисною моделлю, тварині із відтвореною пудендопатією призначають гексопреналіну сульфат у добовій дозі 0,05 мг/кг перорально протягом 2,5 місяців; після виведення тварин з експерименту виконують забір крові та біологічних тканин для визначення біохімічних констант і морфологічних порушень і при зниженні лактатдегідрогенази до 50 % та зменшенні дегенеративно-дистрофічних проявів, а саме набряку та некрозу м'язових волокон, фрагментації нервових волокон, у порівнянні з тваринами з відтвореною пудендопатією лікування вважають ефективним. Спосіб виконується наступним чином. Експериментальні методи дослідження проведені на 54 білих безпородних крисах-самцях чотиримісячного віку, вагою 195±30 г, які утримувалися в стандартних умовах у лабораторії біологічної клініки Одеського національного медичного університету. Підготовка тварин, усі інвазивні втручання, знеболювання й виведення з експерименту здійснювалися в повній відповідності з вимогами правил GLP, що передбачені Європейською 1 UA 120656 U 5 10 15 20 25 30 35 40 45 50 55 комісією з нагляду за проведенням лабораторних досліджень. Моделювання СХТБ виконували шляхом пошкодження крижового сплетення у тварин, перев'язуючи найбільший нерв даного сплетення -сідничний. Втручання виконувалися під внутрішньоочеревинним тіопенталовим наркозом (40 мг/кг). Після підготовки операційного поля у верхній третині стегна виконувався розріз, після чого рану розширювали гачками й оголювали сідничний нерв. Нерв перев'язували вище місця біфуркації його ниткою із синтетичного співполімеру. Після закінчення операції рана ушивалася пошарово. Прооперовані тварини виводилися з експерименту в строки 1 місяць і 3,5 місяці. Усі тварини були розподілені на 3 групи: - перша - інтактні тварини, n=6 (контрольна група); - друга - експериментальне створення СХТБ і виведення з експерименту в строк 3,5 міс. (n=6) - неліковані тварини; - третя - експериментальне створення СХТБ і виведення з експерименту в строк 3,5 міс. (n=6), яким призначався гексопреналіну сульфат (Гініпрал) у дозі 0,05 мг/кг як селективний бета2-адреноміметик. Препарат вводився усередину, згідно з розрахованою дозою протягом 2,5 місяців через 1 місяць після операції. Після виведення з експерименту у всіх тварин проводили забір крові й біологічних тканин, а саме сечового міхура й м'язів тазового дна. У крові досліджували α2-макроглобулін, креатинфосфокіназу (КФК) як маркер ушкодження, лактатдегідрогеназу (ЛДГ) як маркер гіпоксії. У гомогенаті сечового міхура й м'язів тазового дна досліджували КФК і ЛДГ за допомогою загальноприйнятих методик. Морфологічні дослідження сечового міхура й м'язів тазового дна виконувалися за допомогою фарбування гематоксилін-еозином і Більшовського-Грос у модифікації Б.І. Лаврент'єва. У м'язах тазового дна оцінювали стан м'язових волокон, судин і нервових утворень, а саме пери- та інтрам'язових нервових сплетінь. Досліджували детрузор і ділянку trigonum vesicae, де оцінювали перицелюлярні нервові утворення. Морфологічні дослідження в контрольній групі тварин показують, що м'яза тазового дна інтактних тварин були розташовані у вигляді невеликих пучків, які переплітаються між собою, цитоплазма їх однорідна, напівпрозора, ядра клітин чітко видимі, розташовані в центральній частині м'язового волокна, інтенсивно пофарбовані. Судини розташовувалися між м'язовими волокнами, просвіт їх дещо розширений, стінки судин тонкі, просвіт одиничних судин заповнений кров'ю. Тонкі сполучнотканинні волокна у вигляді невеликих пучків розташовувалися між м'язовими волокнами. Перицелюлярні тонкі нервові волокна розташовувалися між пучками м'язових волокон, обплітаючи їх (Фіг. 1). Через 3,5 міс. після операції спостерігався осередковий набряк м'язових волокон, перицелюлярний і периваскулярний набряки. Некроз окремих м'язових волокон. Виражена фрагментація перим'язових нервових волокон, їх нерівномірне стовщення (Фіг. 2), виявляються ділянки інтенсивного фарбування. Стінки судин нерівномірно стовщені, у просвіті окремих судин кров. Морфологічна картина відтвореної пудендопатії. При призначенні гексопреналіна сульфату спостерігалися морфологічні зміни. М'язові волокна тазового дна в експериментальних тварин з відтвореною пудендопатією і наступною фармакокорекцією гексопреналіна сульфату були розташовані компактно, цитоплазма їх напівпрозора із чітко контурованими ядрами, ознак набряку немає. Судини міжуточної тканини помірно повнокровні, тонкі колагенові волокна пухко розташовані між м'язовими волокнами. Тонкі перимускулярні нервові волокна чітко контуруються, рівномірної товщини, в окремих ділянках фрагментовані й нерівномірно потовщені, утворюючи тонкопетлисту сітку (Фіг. 3). Ефективність лікування експериментальної пудендопатії із застосуванням адренотропного препарату проводилася шляхом оцінки біохімічних і метаболічних констант у крові, а також гомогенатів сечового міхура й м'язів тазового дна. Рівень білка гострої фази α2-макроглобуліну в групі, яка одержувала гексопреналіна сульфат знижено на 24,5 % у порівнянні з контрольною групою тварин і на 42,1 % - відповідно у порівнянні з нелікованими тваринами з відтвореною пудендопатією, що вірогідно вказує на зниження протеолізу в біологічних тканинах і процесів відновлення структури тканини (табл. 1), на якій представлені показники активності ЛДГ відрізняються залежно від виду біологічної тканини. У крові тварин, яким проводилося лікування гексопреналіну сульфатом ЛДГ знижено на 24,7 % в порівнянні з контрольною групою тварин і на 28,4 % у порівнянні з нелікованими тваринами з відтвореною пудендопатією, що свідчить про активне розщеплення організмом 2 UA 120656 U глюкози з метою одержання енергії, головним чином м'язовими клітинами, в анаеробних умовах - з метою компенсації гіпоксії. Таблиця 1 Показники α2-макроглобулін в крові експериментальних тварин Без лікування Білок гострої фази α макроглобулін, mg/gl 2 група (неліковані тварини з відтвореною пудендопатією), (n=6) 3 група (гексопреналіна сульфат), (n=6) 261,220±68,52* 1 група (контрольна), (n=6) Пудендопатія після лікування 151,088±15,38** 200,206±4,36 Примітка: *р
ДивитисяДодаткова інформація
МПК / Мітки
МПК: A61B 10/00
Мітки: лікування, визначення, спосіб, експериментальної, пудендопатії, ефективності
Код посилання
<a href="https://ua.patents.su/8-120656-sposib-viznachennya-efektivnosti-likuvannya-eksperimentalno-pudendopati.html" target="_blank" rel="follow" title="База патентів України">Спосіб визначення ефективності лікування експериментальної пудендопатії</a>
Попередній патент: Спосіб калібрування блока датчиків системи орієнтації
Наступний патент: Установка безперервної глибокої термічної утилізації термопластичних відходів з одержанням рідкого палива легких фракцій
Випадковий патент: Спосіб прогнозування ризику проведення повторних некректомій у хворих з пролежнями м'яких тканин