Протипухлинний засіб, виділений з слизової кишечника, спосіб його виділення
Номер патенту: 28084
Опубліковано: 16.10.2000
Автори: Бошев Нікола Атанасов, Тріфонов Боріслав Борісов, Роуссев Георг Константінов
Текст
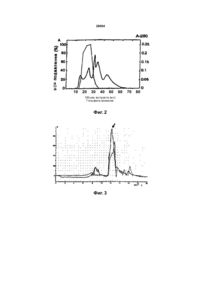
1 Противоопухолевое средство, выделенное из слизистой кишечника, отличающееся тем, что представляет собой два нуклеопептида ИЭГ1 с молекулярной массой 4450+180 Да и ИЭГ2 с молекулярной массой 950+120 Да, причем пептид ИЭГ1 состоит из 2 Thr, 4 Glu, 5 Gly, 2 Asp, 2 Ser, 4 Ala, 2 Val, 1 lie, 1 Try, 3 Us, 1 His, Arg, 2 Leu b 3 Pro, связанных с двумя гуаниловыми остатками, ИЭГ2 является гексапептидом со следующей аминокислотной цепью Arg-Arg-Asp-Asp-His-Arg-NH 2, связанной с одним гуаниловым остатком 2 Способ выделения противоопухолевых ве ществ из слизистой кишечника, включающий отделение эпителия тонкого кишечника, его гомогенизацию, центрифугирование, функционирование и лиофилизацию, отличающийся тем, что гомогенизацию проводят с добавлением уксусной кислоты до конечной концентрации 2% от общей массы, а полученный гомогенат подвергают дестр укции в присутствии этилового спирта с последующей дополнительной ультрафильтрацией и гельфильтрацией Изобретение относится к медицине, в частности к противоопухолевым веществам из слизистой кишечника и способу их выделения Известны различные противоопухолевые вещества, выделенные из слизистой тонкого кишечника Известен грубый экстракт из тонкого кишечника теплокровных животных [1] Его недостаток состоит в том, что он подавляет разрастание клеток только тонкого кишечника животных, из которых выделен Известна фракция грубого экстракта тонкого кишечника теплокровного животного - зайца [2] Ее недостаток состоит в том, что она in vivo ингибирует только деление опухолевы х клеток печени и почек Известно противоопухолевое ве щество из класса кейлонов, выделенное из тонкого кишечника мышей [3], которое является трипептидом со следующей стр уктурой p-Glu-His-Glu-OH Его недостатком является то, что оно подавляет разрастание только клеток толстой кишки Известен лабораторный способ выделения экстрактов из эпителия пищеварительного тракта [1], в котором используются небольшие экспериментальные животные, которых обезглавливают или наркотизируют После этого эпителий механически собирают, например, посредством отделения исходной биомассы После этого сырье подвергают только основным этапам экстракции Данный способ является малоэффективным, так как полученный продукт термически неустойчив, недостаточно очищен и неидентифицируем с точки зрения своей химической природы, в результате чего это т продукт имеет низкую биологическую активность Известен способ выделения веществ из слизистой тонкого кишечника с морфогенной активностью [4], в том числе противоопухолевых ве ществ Способ состоит в препарировании кишечного эпителия только что декапитированных животных, например свиней, которые голодали 24 ч перед декапитацией Используют также и отмытый материал в результате обработки тонких кишок на мясокомбина см О 00 о 00 см < 28084 тах Этот о тмытый материал содержит кишечный эпителий, отделенный до мускульного слоя, и другие вещества, которые являются излишним балластом в процессе выделения веществ с морфогенной активностью Далее эта масса гомогенизируется с добавлением 1-2 объемов воды для получения водного экстракта, который затем центри фугир уется с часто той 10000-12000 об/мин при низких температура х Полученный супернатант фракционируется по молекулярной массе через диафлофильтрацию Далее низкомолекулярный фильтрат очищается посредством последовательных экстракций с использованием аппарата противоточного деления Нефильтруемый высокомолекулярный остаток после сефадексного обессоливания фракционируется через ионнообменную хроматографию, через ионнообменную колонну ДЕАЕ-Целлюлоза с элуент нарастающей концентрацией хлорида натрия, и после этого промывается IN-ным раствором NaOH После получения отчета о спектрофотометрической абсорбции на 280 нм или белковой концентрации (например по методу Лоури), фракции собираются в зависимости от их максимальных показателей После диализа фракции лиофилизируются для сохранения Выделенные фракции тестируются на наличие морфогенного эффекта биологическим способом по спровоцированным изменениям в количестве энтероцитов, радиометрически - по ДНК-синтезу и по классической гистологической картине тонкокишечного эпителия опытных животных (например мыши), в который было инжектировано определенное количество тестируемой фракции Таким образом выделяются фракции с подчеркнутой морфогенной активностью Недостаток данного способа состоит в том, что из-за балластных примесей конечные продукты, имеющие низкую биологическую активность, не дифференцированы, из-за чего трудно выделить конечные продукты, обладающие ярковыраженными противоопухолевыми свойствами и, кроме того, конечные продукты имеют общеклеточную активность Недостаток данного способа также в том, что конечные продукты чувствительны к протеолитическому воздействию кишечных ферментов, которые содержатся в исходной биомассе Это уменьшает производительность, так как в процессе первоначальной обработки часть биополимеров разлагается под воздействием ферментов Еще один недостаток данного способа в том, что во время водяной экстракции высокомолекулярные полимеры из ядер клеток не оседают, из-за чего сильно выражен общетоксический эффект конечных продуктов Кроме того, недостатком способа является то, что из-за одновременного выделения некоторых конечных биоактивных фракций из общей смеси полученные продукты, по результатам спектрофотометрического отчета, являются смесями веществ с различной биологической активностью Это также ведет к снижению полезного эффекта Кроме того, фракции невозможно идентифицировать по молекулярному весу, то есть невозможно определить их химическую природу Технической задачей предложенного изобретения является получение новых противоопухолевы х ве ществ с ра сширенными возможностями , повышенной эффективностью, чистотой и биологической активностью относительно опухолевы х клеток и уменьшенной активностью относительно здоровых, а также нахождение способа выделения противоопухолевы х ве ществ из слизистой тонкого кишечника и применение выделенных противоопухолевых ве ществ для подавления роста легочной карциномы Льюиса и подавления роста плоскоклеточной карциномы Ю-София-линии 7 Новое противоопухолевое вещество, выделенное из слизистой тонкого кишечника, предста вляет собой два н уклеопеп тида - ингиби рующие энтероци то генины (ИЭГ), где ИЭГ1 пептид с молекулярной массой 4,450+0,180 кДа, связанный с двумя гуаниловыми остатками и содержащий 2 Thr (треонин), 4 Glu (глутаминовую кислоту), 5 Gl y (глицин), 2 Asp (аспарагиновую кислоту), 2 Ser (серии), 4 Ala (аланин), 2 Val (валин), 1 Не (изолевцин), 1 Try (триптофан), 3 Lys (лизин), 1 His (ХИСТИДИН ), 1 Arg (аргинин), 2 Leu (левцин), 3 Pro (пролин) ИЭГ2 - гексапептид с молекулярной массой 0,95+0,120 кДа, связанный с одним гуаниловым остатком и следующей аминокислотной последовательностью Arg-Arg-Asp-Asp-His-Arg-Nha2 Способ выделения противоопухолевых веществ, выделенных из слизистой кишечника, заключается в следующем Отделяют кишечный эпителий декапитированных животных, полученную массу гомогенизируют с добавлением уксусной кислоты до конечной ее концентрации 2% от общей массы Полученный гомогенат подвергают клеточной деструкции посредством типового механического дезинтегрирования с добавлением трех объемов 96%-ного этилового спирта при одновременном быстром подогревании до 70°С и последующем охлаждении до 15°С После этого полученная масса расслаивается на осадочный балластный слой и надосадочный слой - супернатант, который в дальнейшем подвергают высокооборотному сепарированию Отделенную после сепарирования легкую фракцию фильтруют до получения прозрачного раствора, у которого рН коррегируется до 6,5-7, а затем подвергают дополнительно ультрафильтрации в рамках от 6 до 1 кДа Полученный ультрафильтрат леофилизируют для длительного хранения При необходимости работы с леофилизатом его дополнительно очищают способом гельфильтрации Технический результат предложенного способа заключается в улучшенной экстракции белков за счет разрушения клеточных мембран уксусной кисло той , ко торая добавляе тся при гомо генизации Кроме того, техническим результатом является повышение устойчивости белковой массы, полученной после дезинтегратора за счет добавления этилового спирта в процессе дезинтеграции Полученные данным способом противоопухолевые вещества обладают способностью воздействия на опухолевые клетки различных органов теплокровных животных, при этом процесс воздействия необратим, а также обладают повышенной чистотой и биологической активностью по отношению к опухолевым клеткам и пониженной токсичностью по отношению к здоровым клеткам 28084 Из обр е тен ие п оясн яе тся сле дующими схемами: на фиг. 1 - принципиальная схема осуществления заявленного способа; на фиг. 2 - график зависимости роста подавления опухолевых клеток от объема экстракта; на фиг. 3 - график, иллюстрирующий биологическую активность ИЭГ1 при HPIC очищении; на фиг. 4 - хроматофамма, иллюстрирующая аминокислотный состав ИЭГ1. Пример осуществления способа выделения противоопухолевых веществ из слизистой кишечника (фиг. 1). Согласно способу выделения противоопухолевых ве ществ из слизистой тонкого кишечника, отделение кишечного эпителия производится у только что декапитированных свиней, которые голодали 24 ч перед декапитацией. Используются отходы от переработки на мясокомбинатах тонкого кишечника свиней, которые содержат кишечный эпителий и другие балластные вещества. Этот материал представляет собой клеточную массу из слизистой тонкого кишечника с преобладающим содержанием клональных клеток из тонкокишечных крипт. Эта клеточная масса собирается не позднее 3 ч после декапитации из вторых валиков машины для последовательного вальцевания тонкого кишечника, при этом щель между валиками составляет от 2 до 4 мм Эффективно использование машины типа Битерлинг, в которой кишки очищаются для их последующего использования в производстве колбас. Настройка щели между вторыми валиками этой машины в диапазоне от 2 до 4 мм не мешает машине выполнять ее основные функции. При этом одновременно, согласно данному способу, выделенная на этих валиках клеточная масса из слизистой тонкого кишечника является самой подходящей для последующего выделения ИЭГ1 и ИЭГ2. Полученная после отпрепарирования масса смешивается в реакторе, куда добавляется чистая концентрированная уксусная кислота с конечной концентрацией 2% от общей клето чной массы. Эта масса подвергается клеточной деструкции в дезинтеграторе, например типа Рани-1251Н, посредством механического дезинтегрирования. Полученный гомо гена т из дезинте грир ованной биомассы смешивается в реакторе с тремя объемами 96% этилового спирта с одновременным быстрым подогреванием до температуры 70°С и с последующим охлаждением до 15°С, затем оста вляется для осаждения находящи хся в ней полимеров. Тяжелая фракция не используется в дальнейшей обработке и удаляется. Супернатант (легкая фракция) подвергается высокооборотному сепарированию, например в сепараторе типа БРПХ207 фирмы Альфа Лавал, при оборотах тарелок 380 рад/с. Полученная легкая фракция после сепарирования фильтруется через ЗАЯЦ-фильтр типа ОРИОН-40 до получения прозрачного раствора, у которого рН коррегируется до 6,5 -7,0. Для более качественной ультрафильтрации возможно удаление из этого раствора этилового спирта и липидных примесей посредством вакуумного концентрирования. После этого раствор ультрафильтруется, например на ультрафильтрационной установке типа ЛАБ-3 8-4,5, в пределах от б до 1 кДа. Полученный ультрафильтрат лиофилизуется. Лиофилизат можно сохранять при температуре 10°С, сохраняя его биологическую активность до 5 лет Если необходимо, лиофилизат растворяется в бидистиллированной воде в соотношении: 0,1 г (лиофилизат)/0,5 мл (вода), после чего дополнительно сепарируется и очищается препаративно в хроматографической колонне с SEPHADEX G-25 Medium При этом образуются две биоактивные фракции - противоопухолевые вещества ИЭГ1 и ЙЭГ2, каждая из которых содержит некоторое количество примесей. Примеси удаляются посредством точного хроматографического сепарирования и очищения по молекулярной массе ИЭП и ИЭГ2 типа FPLC. На фиг. 1 жирная линия показывает максимальное количество ИЭП при объеме эллюента около 31 мл при FPLC очищении ИЭП посредством фракционирования через фильтрацию при использовании геля SEPHADEX G-25 Medium. Однако ИЭП с этим максимумом имеет низкую биологическую активность. Второй максимум, который находится в зоне около 25 мл, однако, совпадает с горизонтальной частью тонкой линии - А, которая показывает максимум биологической активности ингибирования при воздействии ИЭП над мышиными лимфомными клетками L5178Y относительно контрольной группы необработанных клеток. Из-за этой причины в качестве конечного продукта берется ИЭП из зоны второго максимума с биологической активностью, а это составляет более 70% ИЭ П . После этого выполняется HPLC с использованием «Sorbax». В качестве конечного результата получены противоопухолевые вещества - нуклеопептиды: ИЭП- пептид с молекулярной массой 4,450+0,180 кДа и ИЭГ2-гексапептид с молекулярной массой 0,950+0,120 кДа. Определение молекулярного веса очищенных, согласно способу, биоактивных фракций ИЭП и ИЭГ2 выполняется посредством HPLC в колонне с использованием силикагеля «Sorbax». Определено, что молекулярная масса ИЭП 4,450+0,180 кДа, а молекулярная масса ИЭГ2 0,950+0,120 кДа. Посредством ультрафиолетового спектрального анализа определяются по двум максимумам погло щения для каждого ИЭГ для ИЭП - 220 и 248 нм; для ИЭГ2 - 220 и 245 нм. Наличие гуанозина в качестве остатка, который идентифицируется максимумами на 248 нм (два гуаниловых остатка) и на 245 нм (один гуаниловый остаток), подтверждает нуклеопептидную природу двух ИЭГ Наличие пептидов и в двух ИЭГ подтверждается другим максимумом на 220 нм Аминокислотный анализ ИЭГ подтверждает наличие: 2 Thr (Треонин), 4 Glu (глутаминовая кислота), 4 Ala (аланин), 2 Val (валин), 1 Не (изолевцин), 1Тгу ( триптофан),3 Lys (лизин), 1 His ( хистидин), 1 Arg (аргинин), 2 Leu (левцин), 3 Pro (пролин), что видно по пикам графика на фиг. 4. Самым высоким является содержание Glu -13,33%, 28084 затем следует Lys - 10,95%, после чего по нисходящей следуют Ser, Tre, Asp, Gly, Ala, Val, lie, Leu, His, Arg ИЭГ2 аналогично идентифицируется как Arg-Arg-Asp-Asp-His-Arg-NHb ИЭГ1 и/или ИЭГ2 применяются в качестве ингиби торо в биосин тетически х процессо в ДНК-, РНК- и синтеза протеинов тонкого кишечника Каждая фракция, полученная в результате очищения двух конечных продуктов ИЭГ, тестируется биологически на мышах С этой целью 3 мг содержания пептидов соответствующей фракции вводятся подкожно мышам одновременно с тестирующим реагентом, например изотопный маркер ЗНтимидин и 14С-уридин при использовании двухканального жидкого сцинтиллятора После 7 ч животные подвергаются декапитации Исследуются четыре тонкокишечных участка дуоден ум, йеюн ум, средняя часть и иле ум Как видно из табл 1, иллюстрирующей влияние ИЭП и ИЭГ2 на биосинтетические и морфогенные процессы в тонких кишка х, ИЭП за 7 ч своего воздействия уменьшает количество энтероцитов в среднем на 16,5% относительно контролируемых животных, ИЭГ2 - на 17,25% Оба ИЭГ подавляют синтез нуклеиновых кислот, особенно в средней части тонкого кишечника в илеуме Таблица 1 ИЭГ Участок тон- Вклю Вклю- ДНК Клекого кишеччечение концен точ14Сника ние тра- ность ЗНури- ция, % энтетиди- дин, % ромин, цит, % % ИЭП Двенадцатиперстная кишка Тонкая кишка Средняя часть Подвздошная кишка ИЭГ2 Двенадцати перстная кишка Тонкая кишка Средняя часть Подвздошная кишка 74 75 66 82 94 67 84 95 52 62 58 76 57 68 69 81 77 78 68 88 88 78 97 75 48 74 62 83 55 74 77 85 В методике, изложенной в [5], которую можно использовать и для ИЭП и ИЭГ2, доказывается, что оба ИЭГ повышают цитозольный уровень Са 2+ в гладкомышечных клетках, используя при этом внутриклеточные депо Са 2+ Таким образом, они подключают цепь молекулярных механизмов, обеспечивающих их влияние на гладкомускульную подвижность и ускорение клеточной смерти, через которое достигается дополнительное ингибирование клеточного роста Противоопухолевый эффект использования ИЭП определяется in vitro для подтверждения возможности использования ИЭГ1 в качестве ингибитора развития клеточных культур из нормальных и злокачественных клеточных линий Результаты исследования приведены в табл 2 Таблица 2 1С 50 Імгімп) Клеточная лиNR-тест КВР-тест ния НППМЯПКНЫР КПРТОЧНЫР пинии ЗТЗ 123 9 187 5 FI* 993 9 964 5 RHK* бопыий ЧОП бопкімр ЧПО СНО* 213 2 256 4 1Q?fi 747 4 мпок* Vero* 156 7 197 3 Злокачественные клеточные линии 1Q9 8 I 5178Y 91? fi Нео2 290 4 300 Н РІЯ ?ч1 5 768 5 Rn 1Qfi 15 976 3 MFTH-A** 9 №9 996 4 Аа8** 212 3 246 5 198,9 234,8 Используются 6 видов нормальных клеточных линий ЗТЗ - мышиные фибробласты, FL* - человеческие амнионные, ВНК* - по че чные о т зо ло тисто го сирий ско го хомяка, СНО* - яичниковые от хомяка, MDCK* - почечные от собаки, Vero* - почечные от африканской зеленой обезьяны, 7 видов злокачественных клеточных линий L5178 Y- мышиные лимфомные, Hep 2 -человеческие из карценомы пищевода, HeLa - человеческие из эпителиоидной карценомы на шейке матки, RD - человеческие из эмбриональной рабдомиосаркомы, Sp2**, МЕТН-А**, Ад8** - различные миеломные мышиные, где линии, обозначенные символом **, являются суспензионными клеточными линиями, а обозначенные символом *- продолжительными линиями Все эти линии использованы при клеточной плотности тестирования от 4-Ю4 /мл до 1,5-104 /мл Цитоксический эффект ИЭП над клеточными культурами количественно определяется в двух тестах NR-тест и КВР-тест для определения токсической активности Рез ульта ты эти х тесто в в табл 2 показывают подчеркнутую зависимость эффекта о т концентрации ИЭП При этом IC50показатели, те концентрация ИЭП, ин гибир ующая до 50% разрастание в соответствующих клеточных линиях, на ходится в диапазоне от 123,9 мг/мл до 300 мг/мл Цитотоксический эффект проявляется и суммарно, и во времени Этот эффект у клеточных культур устанавливается через типовой тест разрастания и подтверждается как тенденция результато в типо вого клонир ующе го теста, те ИЭИ уменьшает скорость клонирования клеточных культур способом m vi tro Этот эффект является 28084 результатом более поздних во времени внутриклеточных необратимых повреждений и вызванных нарушений кальциевой внутриклеточной гомеостазы При экспериментальном способе in vitro -in vi vo для подавления легочной карциномы Люиса (LLCa) в стадии in vitro опухолевые клетки легочной карценомы Люиса LLCa обрабатываются проти вооп ухоле выми ве ще ствами ИЭП с дозой от 350 до 1050 мг/мл Эти опухолевые клетки низкодифференцированны и происходят из спонтанно появившейся в легких мышей из линии ДВА/2 опухо ли , которая впо сле дствии пересажи вае тся LLCa - это опухоль, сравнительно устойчивая к большей части цитостатикам, обычно используемым в клинике, что объясняется ее ранним метастазированием на 7-й день Полученная оп ухоле воклето чная фракция эти х клеток инжектируется способом in vivo подкожно в организмы здоровых мышей, при этом индекс подавления опухолево го роста, появившийся в этих мышах, является самым большим 88,2% по сравнению с опухолевым ростом у необработанных мышей, когда упомянутая выше доза ИЭП - 1050 мг/мл Согласно международно принятым нормам, если индекс подавления равен или больше 50%, то считается достоверным, что использованное вещество обладает противоопухолевой активностью Средний вес опухолей, развитых из трансплантируемых опухолевы х клеток карценомы Люиса LLCa, обработанных мини мальной дозой ИЭП 350 мг/мл, достигает 1,5 г и у каждого из шести животных этой опытной группы не развивается опухоль При опухоля х, развиты х из клеток, обработанных оптимальной дозой ИЭП 1050 мг/мл, средний вес этих опухолей достигает 0,4 г и у пяти из каждых шести животных не развивается опухоль Кроме того, появившиеся опухоли дифференцируемы и подвергаются нижеследующей терапии Патоморфологические изменения в опухолях выражаются преимущественно в некробиозе клеток, который также проявляется в различной степени в зависимости от концентрации ИЭП При экспериментальном способе «in vivo» подавления роста плоскоклеточной карценомы ICСофия-линии 7 молодая периферийная опухолевая масса из tumor sollidum карциномы больных золотых сирийских хомяков переносится на здоровых хомяков Через 7 дней этим же хомякам инжектируется подкожно 12 раз через 48 ч противоопухолевое ве щество ИЭП с дозой 4 мг/кг веса Опухолевая масса у обработанных ИЭП хомяков падает до 51,9% Индекс подавления опухолевого роста, появившийся у обработанных ИЭП хомяков, 60,5%, ингибирование синтеза ДНК опухолевых клеток 48%, митозы редуцируются до 21,0% по сравнению с опухолями у необработанных хомяков, а появившиеся опухоли дифференцируемы и подвергаются последующему терапевтическому лечению 28084 Принципиальная блок-схема способа выделения ИЄГ1 и ИЄГ2 Продукт средство операция Тонкие кишки свиней до трех часов после убоя Клеточное фракционирование Отделенный клеточный эпителий со 2 валика Размешивание Подкисленная биомасса, содержащая 2% уксусной кислоты Деструктурированная биомасса Гомогенизация Смешивание с этиловым спиртом Машина "Битерлинг" Концентрированная уксусная кислота Дезинтегратор Подогрев г Смесь, содержащая 25% спирта ---------- Быстрый подогрев с последующим охлаждением Подогрев г Разделение Сепаратор г Жидкий экстракт Нейтрализация Нейтрализованный экстракт Ультрафильтрация в определенном интервале 1 Ультрафильтрат 1-6 кДа ------- г Лиофилизация Раствор щелочи натрия ддс ультра фильтрационная установка Лиофилизатор Г Лиофилизированная пыль Дополнител ьное гельфильтре івание Колонна Сефадекс Г-25 питательная среда 1 2 гельфильтрата ИЭГ1 и ИЭГ2 г Хранение Фиг. 1 Холодильная камера 28084 а О а 10 20 30 40 60 Объем экстракта (мл) Гельфильтрование Фиг. 2 Фиг. 3 60 70 80 28084 Si і і і і і і Л і і і j t О і і • і і Л і « і і і О »< і і і Л і t і Фиг. 4 ДП "Український інститут промислової власності" (Укрпатент) Бульв. Лесі Українки, 26, Київ, 01133, Україна (044) 254-42-30, 295-61-97 Підписано до др ук у /0.0 і/ 2001 р . Форма т 60 x8 4 1 /8 . Обсяг 4?, SJ/ обл.-вид. арк. Тираж 50 прим. Зам. S УкрІНТЕІ Вул. Горького, 180, Київ, 03680 МСП, Україна (044) 268-25-22
ДивитисяДодаткова інформація
Назва патенту англійськоюAntitumoral agent, isolated from intestine mucous membrane, method of its isolation
Автори англійськоюTrifonov Borislav Borisov, Roussev Heorh Kostiantynov, Boshev Mykola Atanasov
Назва патенту російськоюПротивоопухолевое средство, выделенное из слизистой кишечника, способ его выделения
Автори російськоюТрифонов Борислав Борисов, Роуссев Георг Константинов, Бошев Никола Атанасов
МПК / Мітки
МПК: C07K 14/47, C07K 7/06
Мітки: спосіб, слизової, протипухлинний, виділення, засіб, виділений, кишечника
Код посилання
<a href="https://ua.patents.su/8-28084-protipukhlinnijj-zasib-vidilenijj-z-slizovo-kishechnika-sposib-jjogo-vidilennya.html" target="_blank" rel="follow" title="База патентів України">Протипухлинний засіб, виділений з слизової кишечника, спосіб його виділення</a>
Попередній патент: Спосіб виготовлення повітряної турбіни та повітряна турбіна
Наступний патент: Складене залізничне колесо та спосіб його виготовлення
Випадковий патент: Декоративна заготовка для виготовлення сувеніра