Спосіб одержання гідроксованадату кальцію та твердих розчинів на його основі
Номер патенту: 32075
Опубліковано: 15.12.2000
Автори: Марченко Валерій Іванович, Грищенкова Таісія Олексіївна, Гетьман Євген Іванович, Арданова Людмила Іванівна
Текст
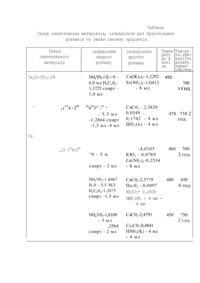
MKB 5 СОІ В 25/32, СО1 G 31/00 СПОСІБ ОДЕРЖАННЯ ГІДРОКСОВАНАДАТУ КАЛЬЩЮ ТА ТВЕРДИХ РОЗЧИНІВ НА ЙОГО ОСНОВІ Винахід відноситься до галузі синтезу неорганічних речовин і може застосовуватися для виготування матеріалів які є або індивідуальною , сполукою гідроксованадату кальцію, або твердими розчинами на його основі. З літературних джерел відомо, що гідроксованадат кальцію Са5(У04> 30Н ізоструктурний з гїдроксиапатитом кальцію Са5(Р0 4) 30Н. Це дозволяє припустити наявність у цих сполук і інших схожих характеристик . Як відомо , гідроксиапатит кальцію у вигляді індивідуальної сполуки а також модифі, кований різними домішками , виявляє люмінісцентні , абсорбційні та інші властивості, завдяки чому інтенсивно використовується в різних галузях науки і техніки. Сіюлука Св^іЧО^^ОЯ не знайшла такого різностороннього використання тому, що досліджена не так глибоко і всебічно як гідрокси, апатит кальцію. Дослідження властивостей Ca 5 (V04> 30H стримується складністю синтезу цієї сполуки. Аналіз літературних джерел показав, що робіт, присвячених синтезу Ca5 (V0 4) 30H, надзвичайно мало. Так, в [1] було запропоновано методику синтезу сполук М5 (Х0 4) 3 0Н (де М - Ca, Sr, Ba, Pb, а Х* Р, As 1 V), до числа яких відноситься і гідроксованадат кальцію Синтез . здійснювали з використанням важкорозчинних сульфатів двовалентних мета лів, які вносили в 0,2 М розчин N83X04 (де X = Р, As, V), додавали NaOH і кип'ятили протягом 1,5 години. Після охолодження розчину осад відфільтровували через скляний фільтр, промивали ацетоном і сушили у вакуумі або на повітрі при температурі приблизно 300°С. Така методика одержання сполук із структурою фосфатно-кальцієвого апатиту має суттєвий недолік, який полягає в тому, що проведення синтезу в розчині в присутності сторонніх іонів (Na + і SCn") може супроводжуватися їх оклюзією і забрудненням осадів або навіть утворенням сполук за участю таких іонів. Дійсно, в [1 ] показано, що у випадку синтезу сполуки взятої у відношенні NH^Og/HgC^Og = 2/1-1.1, з додаванням до нього спирту в об'ємі 15 - ЗОЖ, а другий - розчиненням мінеральних солей кальцію , стронцію, лужних та рідкісноземельних металів або їх оксидів у воді або , в азотній кислоті та наступним змішуванням обох розчинів дозованним, внесенням у зону нагріву з температурою 450-480°С і додатковою термічною обробкою в інтервалі 650-750°С протягом 2-4 годин. Використання азотної кислоти для приготування розчинів зумовлено тим , що деякі солі (наприклад, карбонат кальцію) І оксиди дво- та тривалентних металів у воді не розчиняються Розчинення ванадату амонію у водному . розчині винної кислоти відбувається переважно, за рахунок створення , комплексу, який стає стабільнішим після додавання спирту (одно- або багатоатомного). Утворений комплекс не руйнується якщо до нього додавати , амонійні солі фосфорної кислоти або розчини з катіонами більшості одно, дво- та тривалентних металів Це дозволяє готувати розчини до складу , яких можуть входити потрібні елементи у необхідних співвідношеннях Такі . розчини використовують длн синтезу не тільки Індивідуальної сполуки Ga5 (V0 4) 30H, а також і твердих розчинів на II основі із заміщенням катіону або аніону. Приклад І. Для синтезу 3 г сполуки Ca 5(V0 4) 3 0H у 6 мл води розчиняють 1,3 г винної кислоти І додають 1,8726 г NH^VO^. Легким збовтуванням ванадат амонію переводять у розчин, який забарвлюється в червоно-коричневий колір. До розчину додають 1,0 мл спирту. У іншій склянці в 8 мл вода розчиняють 4,3779 г Ca(NO3)2- Обидва розчини змішують і краплями додают^ у тигель, який знаходиться в зоні нагріву з температурою 480°С. Сухий залишок, шр утворюється після випарювання розчину і розкладання взаємодію* , чих речовин, охолоджують, подрібнюють І додатково нагрівають при 700°С протягом 3 годин. На рентгенограмі синтезованого матеріалу присутні тільки лінії від фвзи зі структурою фосфорно-кальцієвого апатиту Хімічний . аналіз синтезованого зразку показав такий вміст компонентів Са - 35,78Ж : РЬ5 (Р0 4) 30Н, поряд з нею утворюється і сполука Найбільш близьким за технічною суттєвістю та кінцевим результатом до запропонованого нами винаходу є спосіб одержання гідроксиапатиту [23. За цим способом в органічному розчиннику, який може змішуватися з водою або в його суміші з водою, розчиняють мінеральну сполуку кальцію та органіч ну сполуку фосфору і додають аміачну воду або розчинний амін Потім роз. чин піддають терморозкладанню в полум'ї або в зоні нагріву . Розглянутий метод синтезу можна поділити на дві стадії Перла - при. готування розчину, до складу якого входять потрібні елементи в необхід ному співвідношенні. Друга - випарювання розчину і термоліз сухого за лишку, який супроводжується синтезом необхідної сполуки і вилученням га зуватих продуктів реакції. Недоліком цього методу, що не дозволяє використати його для синтезу гідроксованадату кальцію, є відсутність у широкій лабораторній практиці органічних сполук ванадію, здатних розчинятися в органічних розчинниках , які змішуються з водою. Отже, перелік хімічних елементів, здатних надходити до складу розчину який використовується для синтезу сполук типу , фосфорно-кальцієвого апатиту, обмежений. В основу винаходу покладене вдосконалення способу одержання сполук із структурою гідроксиапатиту кальцію в тому числі і гідроксованадату , кальцію та твердих розчинів на його основі в якому заміною органічної , сполуки фосфору на недифіцитну та дешеву неорганічну сполуку ванадію вда ється здійснювати синтез сполук необхідного хімічного та фазового складу, завдяки чому значно розширити елементний склад синтезованих речовин які , можуть знайти застосування в різних галузях науки і техніки . Спосіб одержання гідроксованадату кальцію та твердих розчинів на його основі, який складається з приготування розчину, розпилення його в зону нагріву та додаткової термічної обробки, відрізняється тим, що загальний розчин готують з двох інших, перший із яких отримують розчиненням ванадату амонію та гідрофосфату амонію у водному розчині винної кислоти , 4 (теор. - 35,6456) і V - 27,13Ж (теор, - 27Д8Ж). Таким чином, результати рвнтгенофазового та хімічного аналізів дозволяють зробити висновок що , запропонована методика дає змогу синтезувати гідроксованадат кальцію Ca5(V04)30HПриклад 2. Для синтезу 3 г твердого розчину складу Ca5 (V04)2 (P04 )0H в 5 мл вода розчиняють І г винної кислоти та 1,2717 г NH^VOg» додають 2 мл спирту і там хе розчиняють 0,7305 г flffl^HPO^. У іншій склянці розчи чиняють наважку 2,7687 г CaCOg у мінімальній кількості концентрованої азотної кислоти і розводять водою до об'єму8 мл. Далі обидва розчини змішують і краплями додають у зону нагріву (470°С). Утворений сухий продукт подрібнюють та ще випалюють при 750°С протягом 2 годин. На рентгенограмі синтезованого матеріалу спостерігаються тільки лінії від фази , ізоструктурної з апатитом Параметри елементарної комірки синтезованої . фази мають розміри: а - 9,691; с = 6,969 І. Ці величини знаходяться між значеннями, характерними дня Са5(У04)30Н, де а = 9,718 і с = 6,979 І та для Са5 (Р0^)30Н, де а = 9,388 і с = 6,854 І [11. Отже, результати рентгенофазового аналізу дозволяють стверджувати що синтезований продукт , твердий розчин на основі гідроксованадату кальцію з частковою заміною аніону. Приклад 3, Для синтезу 3 г твердого розчину складу Са ,>І.і0 -4 (У04)30Н у 5 мл вода розчиняють 1,2 г винної кислоти і 1,7990 г та дода ють 2 м л с пир ту. У і нші й с кля нці роз чин яют ь 2 ,14 30 г ^ 0,0753 г Li2 C03 та 0,3322 г I^Og в мінімальній кількості концентрованої азотної кислоти і доводять об'єм розчину водою до 8 мл. Обидва розчини змішують і краплями додають у зону нагріву (450°С). Сухий залишок подрібнюють і піддають додатковій термічній обробці при 650°С протягом 4 годин. На рентгенограмі синтезованого матеріалу спостерігаються лінії тільки від фази, ізоструктурної з апатитом і параметри елементарної комірки б а = 9,W ; с = 7,0101. Хімічним аналізом визначено , що у синтезованому продукті міститься: Са - 28,4556 (теор. 28,60%); V -26,10% (теор. 25,97%); La - 9,50% (теор. 9,44%); Ы - 0,47% (теор. 0,47%). Однофазність продукту, відповідність результатів хімічного аналізу міх складам, який задавали, та отриманим, а також деяка зміна параметрів елементарної комірки у порівнянні з параметрами елементарної комірки для сполуки Са^(У0 4 )з0Н (яку можна пояснити різницею розмірів катіонів що , заміщуються ) дозволяють зробити висновок , що синтезований матеріал в твердим розчином складу Са4 2L1 D 4La 0 4^ V04*30H' Запропонований спосіб дозволяє одержувати і інші сполуки , які на підставі рентгенофазоаого та хімічного аналізів можна віднести до твердих розчинів на основі гідроксованадату кальцію Ca 5(V04 )g0H. В таблиці наведено склади деяких з них, інгредієнти для приготування розчинів та умови синтезу (розрахунки наведено на 3 г продукту). Використання винної кислоти у мольному відношенніNH^VOg/HgC^Og = 2/1-1.1, зумовлено тим, що зменшення кількості HgC^Og супроводжується не повним зв'язуванням ванадію в комплекс а збільшення II може викликати , утворення малорозчинних сполук з катіонами деяких металів. Додавання до розчину ванадату амонію від 10 до 30% спирту достатнє для забезпечення стабільнлсті виннокислого комплексу ванаділ-іону сту, пеня паруватості розчину та утворення рихлих матеріалів. Підтримування температури в зоні нагріву в інтервалі 450 - 480°С зу мовлено тим, що при температурі нижче ніж 450°С процес випарювання крап лин розчину помітно уповільнюється. Це, в свою чергу, є причиною повіль ного терморозкладання утворених під час випарювання розчину солей і, в » цілому, не сприяє ефективній взаємодії речовин з утворенням необхідних продуктів. £ Підвищення температури зони нагріву понад 480°С не рекомендується з , метою запобігання можливої сублімації оксиду ванадію, вірогідність утворення якого в процесі термолізу не виключена . . ' Таблиця Склад синтезованих матеріалів, інгредієнти для приготування розчинів та умови синтезу продуктів Склад синтезованого матеріалу NH4V03-1 IL>0 6,0 мл H6C4061,1725 спирт 1,0 мл Ca4Sr(V04)30H 4 інгредієнти першого розчину V0 0Н 2 ( 4 >3 інгредієнти другого розчину Темпе рату_ ра в зоні на Са(Ж)3)2~3,2292 Sr(N03 )2 -1,0412 450 700 - 8 мл 4 3"1 -81 ^ - 5, 5 м л -1,2864 спирт -1,5 мл -4 мл СаС03 - 2,3829 0,0549 0, 1742 - 4 м л Ш0 3 (к) - 4 м л ^0 - 5 м -4,0105 КЮ 3 - 0,0789 La(N03 ) 3 -0,2534 Ш 70 Тем-ра та.тривалість додатк. термообробки 3 ГОД. 470 750 2 год. Са ,15 30H спирт - 2 мл NH4V03-1 ,8447 Н 2 0 - 5,5 МЛ Н6 С40 6-1,2875 спирт -1,5 мл NH4V03-1,8109 - 5 мл ,2564 спирт - 2 мл 460 700 2 год. - 8 мл СаС03-2,5779 Но 2 03 - 0,0497 480 650 4 год. RD2CO3- О.ОЗОЗ HN03(K) - 4 мл 4 мл СаС03-2,4791 Cs 2C03-0,0841 HN03 (K) - 4 мл - 4 мл 450 750 2 год. Температурний інтервал повторної термічної обробки зумовлено тим що , нагрівання зразків в межах від 450 до 600°С не сприяє їх достатній кристалізації (на рентгенограмах зразків спостерігаються широкі лінії від фаз із структурою апатиту). Підвищення температури випалювання до 650-750°С вед© до того, що на рентгенограмах лінії від структури апатиту стають інтенсивними та вузькими. Це дозволяє з високою точністю виміряти параметри елементарних комірок, а також впевнитися в тому, що зразки однофазні_ Тривалість повторної термічної обробки визначається необхідністю одержання матеріалів із сформованою кристалічною структурою Експеримен. том встановлено, що це досягається тоді, коли тривалість нагрівання при температурі 650°С складає не менше 4 годин, а при температурі 750°С - не більше 2 годин. Відмінність запропонованого способу від прототипу полягав в тому , що використання винної кислоти дозволяє одержувати розчинну комплексну сполуку ванадію, яка здатна стабільно існувати у розчині поряд з фосфат іоном та катіонами одно -, дво- та тривалентних металів у необхідних співвідношеннях . Без винної кислоти сумісне існування у розчині іонів Са2+ (а також багатьох інших іонів) з ванадат-іоном не можливе внаслідок зв'язування їх у важкорозчинні осади з різним складом. Таким чином, використання винної кислоти як комплексоутворювача для приготування розчинів, до складу яких вдається залучити необхідні компоненти для синтезу гідроксованадату кальцію і твердих розчинхв на його основі забезпечує значні , переваги у порівнянні зі способом, який використовується в прототипі. Ця перевага виявляється перш за все в тому, що: а) дозволяє для приготування розчинів використовувати недифіцитну та дешеву неорганічну сполуку ванадію; б) дозволяє створювати стабільні розчини, до складу яких можуть вхо дити всі елементи, необхідні для синтезу сполук зі структурою фосфорно кальцієвого апатиту і хімічним складом СаЛУО^оОН та твердих розчинів на його основі. • 7 8 даЄРЕЛА ІНФОРМАЦІЇ, ЯКІ ВИКОРИСТАНО ДЛЯ СКЛАДАННЯ ВИНАХОДУ 1. Mayer I., Wahnon 3., Cohen S. Preparetlon ої hydroxyapatites viathe MSO^ sulpfhates (M = Ca, Sr, BaP Pb and Bu).// Mat.Res.Bull.-1979, vol.14.-P.1479-1483. 2. Заявка Японии N 92-0228 87.05.25 МКИ 5 COI В 25/32 Капто Кагану . Способ получения гидроксиапатита (прототип).
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for the preparation of calcium hydroxovanadate and solid solutions based on it
Автори англійськоюMarchenko Valerii Ivanovych, Hetman Yevhen Ivanovych, Hryschenkova Taisiia Oleksiivna, Ardanova Liudmyla Ivanivna
Назва патенту російськоюСпособ получения гидроксованадата кальция и твердых растворов на его основе
Автори російськоюМарченко Валерий Иванович, Гетьман Евгений Иванович, Грищенкова Таисия Алексеевна, Арданова Людмила Ивановна
МПК / Мітки
МПК: C01B 25/32, C01G 31/00
Мітки: основі, спосіб, кальцію, твердих, одержання, гідроксованадату, розчинів
Код посилання
<a href="https://ua.patents.su/8-32075-sposib-oderzhannya-gidroksovanadatu-kalciyu-ta-tverdikh-rozchiniv-na-jjogo-osnovi.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання гідроксованадату кальцію та твердих розчинів на його основі</a>
Попередній патент: Фільтр для очистки води від заліза
Наступний патент: Посудина для теплової обробки харчових продуктів
Випадковий патент: Спосіб оперативного лікування міхурово-сечоводного рефлюксу у один із сегментів подвоєної нирки при повному подвоєнні сечоводів