Мигдалевокислі солі заміщених тетрациклічних похідних тетрагідрофурану
Номер патенту: 79248
Опубліковано: 11.06.2007
Автори: Руйсшерт Ів Жорж, Стокбрукс Сігрід Карл Марія, Веертс Йохан Ервін Едмонд, Медер Барт Петрус Анна Марія Йозеф, Віллемс Ян Йозефус Марія
Формула / Реферат
1. Мигдалевокисла сіль сполуки формули (І)
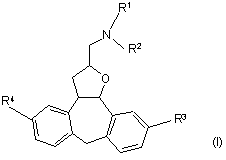 ,
,
її N-оксидні форми та стереохімічно ізомерні форми, де R1 та R2 кожний незалежно означають гідроген чи C1-6-алкіл, R3 та R4 кожний незалежно означають гідроген чи галоген, C1-6-алкіл означає лінійні та розгалужені насичені вуглеводневі радикали, що містять від 1 до 6 атомів карбону, і галоїд є родовою назвою флюору, хлору, брому та йоду.
2. Мигдалевокисла сіль за п. 1, яка відрізняється тим, що R1 та R2 кожний незалежно означають гідроген чи метил.
3. Мигдалевокисла сіль за будь-яким з пп. 1, 2, яка відрізняється тим, що R3 та R4 кожний незалежно означають гідроген чи флюор.
4. Мигдалевокисла сіль за п. 1, яка відрізняється тим, що сполука є мигдалевокислою сіллю:
11-флюор-3,3а,8,12b-тетрагідро-N-метил-2Н-дибензо-[3,4:6,7]циклогепта[1,2-b]фуран-2-метанаміну;
3,3а,8,12b-тетрагідро-N-метил-2Н-дибензо-[3,4:6,7]циклогепта[1,2-b]фуран-2-метанаміну;
5,11-дифлюор-3,3а,8,12b-тетрагідро-N,N-диметил-2Н-дибензо[3,4:6,7]циклогепта[1,2-b]фуран-2-метанаміну;
11-флюор-3,3а,8,12b-тетрагідро-N,N-диметил-2Н-дибензо[3,4:6,7]циклогепта[1,2-b]фуран-2-метанаміну чи
3,3a,8,12b-тетрагідро-N,N-диметил-2Н-дибензо-[3,4:6,7]циклогепта[1,2-b]фуран-2-метанаміну.
5. Мигдалевокисла сіль за будь-яким з пп. 1-4, яка відрізняється тим, що сполука формули (І) є (2![]() ,3а
,3а![]() ,12b
,12b![]() )-ізомером.
)-ізомером.
6. Мигдалевокисла сіль за будь-яким з пп. 1-5, яка відрізняється тим, що мигдалевокисла сіль знаходиться в S-формі.
7. Мигдалевокисла сіль за будь-яким з пп. 1-6, призначена для використання як лікарського засобу.
8. Використання сполуки за будь-яким з пп. 1-7 у виробництві лікарського засобу для лікування тривожного стану, психозу, шизофренії, депресії, мігрені, розладів сну та наркотичної залежності.
9. Фармацевтична композиція, яка містить фармацевтично прийнятний носій та як активний інгредієнт терапевтично ефективну кількість мигдалевокислої солі за будь-яким з пп. 1-7.
10. Спосіб одержання мигдалевокислої солі за будь-яким з пп. 1-7, який відрізняється тим, що вільну основну форму сполуки формули (І) розчиняють у придатному розчиннику, необов'язково, нагрівають суміш, додають достатню кількість мигдалевої кислоти, охолоджують реакційну суміш та збирають кристалічний матеріал, необов'язково, з подальшим очищенням мигдалевокислої солі перекристалізацією у придатному розчиннику.
Текст
Даний винахід стосується тетрагідрофурану формули (І) нових мигдалевокислих солей заміщених тетрациклічних похідних їхніх N-оксидних форм та стереохімічно ізомерних форм, де R1 та R2 кожний незалежно позначають гідроген чи С1-6-алкіл і R3 та R4 кожний незалежно позначають гідроген чи галоген, а також фармацевтичних композицій, що містять мигдалевокислі солі за винаходом, мигдалевокислих солей за винаходом, призначених для використання як лікарський засіб, способу одержання мигдалевокислих солей за винаходом та використання мигдалевокислих солей і фармацевтичних композицій, що містять мигдалевокислі солі за винаходом, для лікування чи профілактики розладів ЦНС, серцево-судинних розладів та шлунково-кишкових розладів. Сполуки формули (І) відомі з WO99/19317 та WO97/38991. Із зазначених посилань також відомі солі приєднання кислот сполук формули (І), що включають солі на основі винної кислоти (D- та L-форми), хлористоводневої кислоти, бромистоводневої кислоти та яблучної кислоти. Однак, кислотно-адитивні форми сполук формули (І), відомі з попереднього рівня техніки, мають той недолік, що їхня фізико-хімічна стійкість виявилася поганою. При зберіганні чи виготовленні композицій вказаних відомих солей спостерігається їхнє поступове розкладання із сунутним збільшенням кількості та числа домішок. Зрозуміло, ця проблема ще ускладнюється у суворих умовах зовнішнього середовища, таких як дія світла, тепла, вологи, кислотності, лужності та кисню. WO99/19317 та WO97/38991 не містять ніяких згадок про стабільність розкритих у них сполук та про способи забезпечення чи поліпшення стабільності. Несподівано було знайдено, що вищезгадана проблема може бути вирішена шляхом використання мигдалевокислої солі сполук формули (І), їхніх N-оксидних форм та стереохімічно ізомерних форм. Мигдалевокисла сіль є не світочутливою та набагато стабильнішою за солі, відомі з сучасного рівня техніки, при кімнатній температурі, підвищеній температурі та при відносно високій вологості і у водному середовищі. Сполуки за даним винаходом, їхні N-оксидні форми та стереохімічно ізомерні форми, можуть бути загалом представлені формулою (II) де R1 та R2 кожний незалежно позначають гідроген чи С 1-6-алкіл, a R3 та R4 кожний незалежно позначають гідроген чи галоген. У попередніх визначеннях С 1-6-алкіл позначає прямі та розгалужені насичені вуглеводневі радикали, що містять від 1 до 6 атомів карбону, такі як, наприклад, метил, етил, пропіл, бутил, 1-метилпропіл, 1,1-диметилетил, пентил та гексил. У наведених вище визначеннях галоїд є родовою назвою флюору, хлору, брому та йоду. Кращими сполуками є такі, у яких R1 та R2 кожний незалежно позначають гідроген чи метил. Кращими сполуками є такі, у яких R3 та R4 кожний незалежно позначають гідроген чи флюор. Зокрема, кращими є сполуки, у яких: - R1 позначає гідроген, R2 позначає метил, R3 позначає флюор і R4 позначає гідроген (мигдалевокисла сіль 11-флюор-3,3а,8,12b-тетрагідро-N-метил-2Н-дибензо-[3,4:6,7]циклогепта[1,2-b]фуран-2-метанаміну); - R1 позначає гідроген, R2 позначає метил, R3 позначає гідроген і R4 позначає гідроген (мигдалевокисла сіль 3,3а,8,12b-тетрагідро-N-метил-2Н-дибензо-[3,4:6,7]циклогепта[1,2-b]фуран-2-метанаміну); - R1 позначає метил, R2 позначає метил, R3 позначає флюор і R4 позначає флюор (мигдалевокисла сіль 5,11-дифлюор-3,3а,8,12b-тетрагідро-N,N-диметил-2Н-дибензо-[3,4:6,7]циклогепта[1,2-b]фуран-2-метанаміну); - R1 позначає метил, R2 позначає метил, R3 позначає флюор і R4 позначає гідроген (мигдалевокисла сіль 11-флюор-3,3а,8,12b-тетрагідро-N,N-диметил-2Н-дибензо-[3,4:6,7]циклогепта[1,2-b]фуран-2-метанаміну); - R1 позначає метил, R2 позначає метил, R3 позначає гідроген і R4 позначає гідроген (мигдалевокисла сіль 3,3а,8,12b-тетрагідро-N,N-диметил-2Н-дибензо-[3,4:6,7]циклогепта[1,2-b]фуран-2-метанаміну). N-Оксидні форми сполук формули (І) та (II) мають включати такі сполуки формули (І), у яких атом нітрогену окислений до так званого N-оксиду. Термін "стереохімічно ізомерні форми" у тому значенні, що використовується тут, визначає усі можливі ізомерні форми, які можуть мати сполуки формули (І) та (II). Якщо не вказується чи згадується інше, хімічні назви сполук позначають суміші усіх можливих стереохімічно ізомерних форм, причому зазначені суміші містять усі діастереомери та енантіомери базової молекулярної структури. Конкретніше, стереогенні центри можуть мати R- чи S-конфігурацію; замісники на бівалентних циклічних (частково) насичених радикалах можуть мати цис- або транс-конфігурацію. Стереохімічно ізомерні форми сполук формули (І) та (II) безсумнівно мають бути включені до обсягу даного винаходу. У відповідності до номенклатурних правил CAS, якщо у молекулі присутні два стереогенні центри з відомою абсолютною конфігурацією, то дескриптором R чи S позначають (на основі правила черговості КанаІнголда-Прелога) хіральний центр з найменшим порядковим номером, який є опорним центром. Конфігурація другого стереогенного центра вказується за допомогою відносних дескрипторів [R*,R*] чи [R*,S*], де R* завжди визначається як опорний центр, і [R*,R*] позначає центри з однаковою хіральністю, а [R*,S*] позначає центри з різною хіральністю. Наприклад, якщо хіральний центр з найменшим порядковим номером має конфігурацію S, а другий центр - R, то стереодескриптор буде мати вигляд S-[R*,S*]. Якщо використовуються позначення "a" та "b": положення старшого замісника на асиметричному атомі карбону у кільцевій системі, що має меншій номер кільця, завжди довільно визначається як положення "a" середньої площі, утворюваної кільцевою системою. Положення старшого замісника на другому асиметричному атомі карбону у кільцевій системі по відношенню до положення старшого замісника на опорному атомі позначається "a", якщо він· знаходиться з того ж самого боку середньої площі, утворюваної кільцевою системою, або "b", якщо він знаходиться з іншого боку середньої площі, утворюваної кільцевою системою. Для деяких сполук формули (І) та (II) і проміжних сполук, використаних в їхньому синтезі, абсолютну стереохімічну конфігурацію не було експериментально визначено. У цих випадках стереохімічно ізомерну форму, яку було виділено першою, позначають "А", а другу - "В", без додаткового визначення дійсної стереохімічної конфігурації. Однак, зазначені ізомерні форми "А" та "В" можуть бути однозначно охарактеризовані, наприклад, їхнім оптичним обертанням, якщо "А" та "В" є енантіомерами. Фахівець в цій області техніки здатний визначити абсолютну конфігурацію такої сполуки за допомогою відомих фахівцям методів, таких як, наприклад, рентгенівська дифракція. Наприклад, сполука, що має стереохімічний дескриптор A-(2a,3ab,12ba), позначає чистий енантіомер, який має (а) конфігурацію [2R-(2α,3aβ,12bα)], причому атом карбону 2 є базовим атомом, що має Rконфігурацію, замісник -CH2-NR1R2 знаходиться з a-боку середньої площі, атом карбону 3а має Sконфігурацію, оскільки гідрогеновий замісник розташований з іншого боку середньої площі, ніж замісник -CH2NR1R2, і атом карбону 12b має R-конфігурацію, оскільки гідрогеновий замісник розташований з того ж боку середньої площі, що і замісник -CH2-NR1R2, або (b) конфігурацію [2S-(2a,3ab,12ba)], причому атом карбону 2 має S-конфігурацію, атом карбону 3а має R-конфігурацію і атом карбону 12b - S-конфігурацію. Аналогічно, сполука, що має стереохімічний дескриптор А-(2a,Заa,12bb), позначає чистий енантіомер, який має (а) конфігурацію [2R-(2a,3aa,12bb)], причому атом карбону 2 є базовим атомом, що має Rконфігурацію, замісник -CH2-NR1R2 знаходиться з a-боку середньої площі, атом карбону 3а має Rконфігурацію і атом карбону 12b має S-конфігурацію, або (b) конфігурацію [2S-(2a,3aa,12bb)], причому атом карбону 2 має S-конфігурацію, атом карбону 3а має S-конфігурацію і атом карбону 12b має R-конфігурацію. Слід відзначити, що фурановий фрагмент у формулі (І) включає три стереогенні атоми карбону, відповідно, у положеннях 2, 3а та 12b. Тому, формула (І) включає 8 різних ізомерів. Особливо кращими є ізомери, позначені (2a, 3аa, 12bb). Оскільки мигдалева кислота існує у двох ізомерних формах (R- та S-форма), слід вважати, що даний винахід охоплює солі обох ізомерних форм, включаючи будь-яку їхню суміш. Особливо кращою є S-форма мигдалевокислої солі. Сполуки за даним винаходом виявляють спорідненість до рецепторів 5-НТ2, зокрема, до рецепторів 5-НТ2A та 5-НТ2С [за номенклатурою, описаною D.Hoyer у "Serotonine (5-HT) in neurologic and psychiatric disorders", ред. M.D.Ferrari, онублікованою у 1994 p. Boerhaave Commission of the University of Leiden]. Антагоністичні властивості сполук за даним винаходом щодо серотоніну можуть бути продемонстровані за допомогою їхнього інгібуючого ефекту в "тесті з 5-гідрокситриптофаном на щурах", описаному у Drug Dev. Res., 13, 237-244 (1988). Крім того, мигдалевокислі солі за даним винаходом виявляють цікаву фармакологічну активність у "тесті з mСРР на щурах", описаному у WO99/19317, та у "об'єднаному тесті з апоморфіном, триптаміном та норепінефрином (ATN) на щурах", описаному у Arch. Int. Pharmacodyn., 227, 238-253 (1977). Даний винахід, таким чином, стосується також мигдалевокислих солей за винаходом, визначених вище, придатних для використання як лікарський засіб, зокрема, сполуки формули (II) можуть бути використані для виробництва лікарського засобу для лікування розладів ЦНС, таких як тривожний стан, психоз, шизофренія, депресія, мігрень, розлади сну та наркотичну залежність. Зокрема, мигдалевокислі солі за винаходом є корисними як терапевтичні агенти при лікуванні чи профілактиці розладів центральної нервової системи, таких як тривожний стан, депресія та слабка депресія, біполярні розлади, розлади сну та сексуальні розлади, психоз, граничний психоз, шизофренія, мігрень, розлади особистості чи нав'язливо-компульсивні розлади, соціальні фобії чи напади паніки, органічні розумові розлади, розумові розлади у дітей, агресія, розлади пам'яті та розлади поведінки у осіб похилого віку, наркоманія, ожиріння, булімія та подібні розлади. Зокрема, мигдалевокислі солі за винаходом можуть також бути використані як анксіолітичні засоби, антипсихотичні засоби, антидепресанти, протимігреневі засоби та як агенти, що потенційно можуть перебороти наркотичну залежність. Мигдалевокислі солі за винаходом можуть бути також використані як терапевтичні агенти у лікуванні моторних розладів. Може бути зручним використання мигдалевокислих солей за винаходом у комбінації з класичними терапевтичними агентами для таких розладів. Мигдалевокислі солі за винаходом можуть також використовуватися у лікуванні чи профілактиці ураження нервової системи, викликаного травмою, інсультом, нейродегенеративними хворобами і т.п.; серцевосудинних розладів, таких як підвищений кров'яний тиск, тромбоз, інсульт і т.п.; та шлунково-кишкових розладів, таких як дисфункція рухливості шлунково-кишкової системи і т.п. Із зазначеної вище застосовності мигдалевокислих солей за винаходом випливає, що даний винахід також пропонує спосіб лікування > теплокровних тварин, що страждають від таких хвороб, який включає системне введення терапевтичної кількості сполуки формули (II), її N-оксидної форми чи стереохімічно ізомерної форми, ефективної для лікування описаних вище розладів, зокрема, при лікуванні тривожного стану, психозу, шизофренії, депресії, мігрені, розладів сну та наркотичної залежності. Фахівці з лікування таких хвороб можуть визначити ефективну терапевтичну добову кількість з наведених далі результатів випробувань. Ефективна терапевтична добова кількість буде складати від близько 0,01мг/кг до близько 10мг/кг ваги тіла, краще, від близько 0,05мг/кг до близько 1мг/кг ваги тіла. Для зручності введення, можуть бути виготовлені композиції даних сполук у різних фармацевтичних формах, призначених для введення. Для виготовлення фармацевтичних композицій за даним винаходом, терапевтично ефективну кількість певної сполуки, що використовується як активний інгредієнт, з'єднують при ретельному перемішуванні з фармацевтично прийнятним носієм, який може набувати різноманітних форм у залежності від форми препарату, бажаної для введення. Ці фармацевтичні композиції бажано мають вигляд дозованих лікарських форм, придатних, краще, для введення орально, ректально, черезшкірно чи шляхом парентеральної ін'єкції. Наприклад, при виготовленні композиції у дозованій формі для орального введення може бути використане будь-яке звичайне фармацевтичне середовище, таке як, наприклад, вода, гліколі, масла, спирти і т.п. у випадку рідких препаратів для орального введення, таких як суспензії, сиропи, еліксири та розчини; або тверді носії, такі як крохмалі, нукри, каолін, змащувальні речовини, зв'язуючі, рознушувальні агенти і т.п. у випадку порошків, пілюль, капсул та таблеток. Внаслідок зручності введення, таблетки та капсули є найкращими дозованими формами для орального введення, для яких, звичайно, використовуються тверді фармацевтичні носії. Для парентеральних композицій носій буде звичайно включати стерильну воду, принаймні, більшою частиною, хоч можуть бути включені інші інгредієнти, наприклад, для поліпшення розчинності. Можуть бути виготовлені, наприклад, розчини для ін'єкцій, у яких носій включає сольовий розчин, розчин глюкози чи суміш сольового та глюкозного розчинів. Розчини для ін'єкцій, які містять мигдалевокислі солі за винаходом, можуть бути виготовлені як композиції у маслі для забезпечення пролонгованої дії. Придатними для цього маслами є, наприклад, арахісова олія, кунжутна олія, бавовняна олія, кукурудзяна олія, соєва олія, синтетичні складні ефіри. гліцерину з довго ланцюговими жирними кислотами і суміші цих та інших масел. Можуть бути виготовлені також суспензії для ін'єкцій, для яких можуть бути використані відповідні рідкі носії, суспендувальні агенти і т.п. У композиціях, придатних для черезшкірного введення, носій необов'язково включає агент посилення проникності та/або придатний змочувальний агент, необов'язково, у комбінації з придатними добавками будь-якої природи у невеликій кількості, які не викликають істотного шкідливого ефекту для шкіри. Зазначені добавки можуть сприяти введенню до шкіри та/або можуть бути корисними для виготовлення бажаної композиції. Ці композиції можуть бути введені різними способами, наприклад, як трансдермальний пластир, як засіб для місцевого введення чи як мазь. Мигдалевокислі солі, що є кислотноадитивними солями сполук формули (І), завдяки своїй підвищеній розчинності у воді порівняно з відповідною основною чи кислотною формою сполуки, є більш придатними для виготовлення водних композицій. Для збільшення розчинності та/або стабільності сполук формули (II) у фармацевтичних композиціях може виявитися зручним використання a-, b- чи g-циклодекстринів чи їхніх похідних, зокрема, гідроксіалкілзаміщених циклодекстринів, наприклад, 2-гідроксипропіл-b-циклодекстрину. Розчинність та/або стабільність сполук формули (II) у фармацевтичних композиціях можуть також поліпшувати співрозчинники, такі як спирти. Інші зручні способи поліпшення розчинності сполук за даним винаходом у фармацевтичних композиціях описані у WO 97/44014. Конкретніше, можуть бути виготовлені фармацевтичні композиції сполук за даним винаходом, які включають терапевтично ефективну кількість частинок, що складаються з твердої дисперсії, яка включає (a) сполуку формули (II), і (b) один чи кілька фармацевтично прийнятних водорозчинних полімерів. Термін "тверда дисперсія" позначає систему, що знаходиться у твердому стані (на відміну від рідкого чи газоподібного стану) і включає щонайменше два компоненти, у якій один компонент більш чи менш рівномірно диспергований усередині іншого компонента чи компонентів. Якщо зазначена дисперсія компонентів є такою, що система є хімічно та фізично цілком однорідною чи гомогенною або складається з однієї фази, як визначено у термодинаміці, то така тверда дисперсія називається "твердим розчином". Тверді розчини є кращими фізичними системами, тому що компоненти у них є звичайно легко біодоступними для організмів, яким вони вводяться. Термін "тверда дисперсія" включає також дисперсії, які є менш гомогенними, ніж тверді розчини. Такі дисперсії не є хімічно та фізично цілком однорідними або включають більш ніж одну фазу. Водорозчинний полімер у частинках є полімером, що має уявну в'язкість від 1 до 100мПа×с у вигляді 2%ного водного розчину при температурі 20°С. Кращими водорозчинними полімерами є гідроксипропілметилцелюлози чи ГПМЦ (НРМС). Загалом водорозчинними є такі ГПМЦ, що мають ступінь метоксильного заміщення від близько 0,8 до близько 2,5 та молярний ступінь гідроксипропільного заміщення від близько 0,05 до близько 3,0. Ступінь метоксильного заміщення стосується середньої кількості груп метилового простого ефіру на ангідроглюкозну ланку молекули целюлози. Молярне гідроксипропільне заміщення стосується середнього числа молей пропіленоксиду, що прореагували з кожною ангідроглюкозною ланкою молекули целюлози. Визначені вище частинки можуть бути одержані шляхом приготування спочатку твердої дисперсії компонентів, а потім, необов'язково, подрібнення чи помелу цієї дисперсії. Існують різні методики приготування твердих дисперсій, включаючи екструзію з розплаву, розпилювальне сушіння та випарювання розчину, причому кращим є екструзія з розплаву. Найкраще вищезгадані фармацевтичні композиції виготовляють у вигляді дозованих лікарських форм для зручності введення та однаковості доз. Дозована лікарська форма у тому значенні, що використовується в описі та формулі винаходу, стосується фізично розділених одиниць, придатних для використання як разові дози, кожна з яких містить попередньо визначену кількість активного інгредієнта, розраховану на досягнення бажаного терапевтичного ефекту, у поєднанні з бажаним фармацевтичним носієм. Прикладами таких дозованих лікарських форм є таблетки (включаючи таблетки з надрізом чи таблетки з покриттям), капсули, пілюлі, порошки у пакетиках, облатки, розчини чи суспензії для ін'єкцій, 5мл та 15мл дози рідких препаратів у пакетиках і т.п., та їхні кратні частки. Мигдалевокислі солі формули (II) можуть загалом бути одержані шляхом розчинення вільної основи сполуки формули (І) у придатному розчиннику, необов'язково, нагрівання суміші, додавання достатньої кількості мигдалевої кислоти, охолодження реакційної суміші та збирання кристалічного матеріалу. Одержані у такий спосіб відповідні солі можутьбути додатково очищені перекристалізацією у придатному розчиннику. Термін придатний розчинник у тому значенні, що використовується тут у зв'язку з одержанням мигдалевокислих солей та перекристалізацією, визначає будь-який нижчий алканольний чи кетоновий розчинник, у якому сполука формули (І) є розчинною, і включає первинні, вторинні та третинні спирти і відповідні кетони, що містять від 1 до 6 атомів карбону. Придатні нижчі алканольні розчинники включають метанол, етанол, 1-пропанол, 2-пропанол, 1-бутанол, 2-бутанол, 2-метил-1-пропанол, 1,1-диметилетанол, циклогексанол і т.п. Для одержання мигдалевокислих солей за винаходом можуть бути ефективно використані також суміші двох чи більше з вищезгаданих розчинників, а також розчини вказаних розчинників чи їхні суміші з водою. Зокрема, вода може складати до близько 25-35% об. вказаних розчинів. Краще, використаний розчинник є нижчим алканолом, особливо, 2-пропанолом. Сполуки формули (І) можуть бути одержані за методиками, описаними у WO99/19317 та WO97/38991, які включені сюди за посиланням. Загалом, сполуки формули (І) можуть бути одержані шляхом N-алкілування проміжної сполуки формули (III) проміжною сполукою формули (IV), де W позначає придатну відхідну груну, таку як галоїд. У проміжних сполуках (III) та (IV), R1-R4 мають значення, вказані для сполуки формули (І). Зазначене N-алкілування може зручно бути проведене у інертному щодо реакції розчиннику, такому як, наприклад, метанол, тетрагідрофуран, метилізобутилкетон, N,N-диметилформамід чи диметилсульфоксид, необов'язково, у присутності придатної основи. Перемішування та підвищені температури, наприклад, температура кипіння зі зворотним холодильником, можуть збільшити швидкість реакції. За іншим варіантом, зазначене N-алкілування може бути також проведене за методикою, описаною Monkovic et al. [J. Med. Chem. (1973), 16(4), p.403-407], що включає використання як реакційної посудини автоклава. Сполуки формули (І) можуть також бути перетворені одна на одну з використанням відомих фахівцям реакцій перетворення. Крім того, сполуки формули (І) можуть бути перетворені на відповідні N-оксидні форми з використанням відомих фахівцям методик перетворення тривалентного нітрогену на його N-оксидну форму. Зазначена реакція N-оксидації може загалом бути здійснена шляхом проведення реакції вихідного матеріалу формули (І) з відповідним органічним чи неорганічним пероксидом. Відповідні неорганічні пероксиди включають, наприклад, перекис водню, пероксиди лужного металу чи лужноземельного металу, наприклад, пероксид натрію, пероксид калію; відповідні органічні пероксиди можуть включати пероксикислоти, такі як, наприклад, трет-бутилпероксибензоат (benzenecarboperoxoic acid) чи галоїдзаміщений трет-бутилпероксибензоат, наприклад, b-хлор-трет-бутилпероксибензоат, пероксоалканові кислоти, наприклад, надоцтову кислоту, алкілгідропероксиди, наприклад, трет-бутилгідропероксид. Придатними розчинниками є, наприклад, вода, нижчі алканоли, наприклад, етанол і т.п., вуглеводні, наприклад, толуол, кетони, наприклад, 2-бутанон, галогеновані вуглеводні, наприклад, дихлорметан, та суміші таких розчинників. Чисті стереохімічно ізомерні форми сполук формули (І) можуть бути одержані із застосуванням відомих фахівцям методик. Діастереомери можуть бути розділені фізичними методами, такими як селективна кристалізація, та хроматографічними методами, наприклад, протитечійним розподілом, рідинною хроматографією і т.п. Сполуки формули (І), одержані описаними вище способами, є загалом рацемічними сумішами енантіомерів, які можуть бути розділені один від одного з використанням відомих фахівцям методів розділення. Рацемічні сполуки формули (І), які мають в достатньому ступені виражені основні чи кислотні властивості, можуть бути перетворені на відповідні діастереомерні сольові форми за реакцією з придатною хіральною кислотою чи, відповідно, з придатною хіральною основою. Зазначені діастереомерні сольові форми згодом розділяють, наприклад, шляхом селективної чи фракційної кристалізації, і енантіомери вивільняють з них за допомогою луга чи кислоти. Альтернативний спосіб розділення енантіомерних форм сполук формули (І) включає рідинну хроматографію з використанням хіральної нерухомої фази. Зазначені чисті стереохімічно ізомерні форми можуть також бути одержані з відповідних чистих стереохімічно ізомерних форм відповідних вихідних матеріалів, за умови, що реакція проходить стереоспецифічно. Краще, якщо потрібний певний стереоізомер, зазначену сполуку синтезують стереоспецифічними методами. Ці методи краще використовують енантіомерно чисті вихідні матеріали. Згадані вище проміжні сполуки є комерційно доступними чи можуть бути одержані відомими фахівцям методами. Наприклад, проміжні сполуки формули (III) можуть бути одержані за методикою, описаною Monkovic et al. [J. Med. Chem. (1973), 16(4), p.403-407]. Наведені далі приклади мають ілюструвати даний винахід, не обмежуючи його обсяг. Експериментальна частина А. Одержання проміжних сполук a) LiAlH4 (0,0686моль) додають по краплях до суспензії АlСl3 (0,0718моль) у тетрагідрофурані (75мл) та охолоджують на льодяній бані під атмосферою N2. Суміш перемішують протягом 10 хвилин при 0°С. Додають по краплях розчин 2-флюор-5Н-дибензо[а,d]циклогептен-5-ону (0,0653моль, одержаний як описано у DE 3644462) у тетрагідрофурані (75мл) і одержаній реакційній суміші дозволяють нагрітися до кімнатної температури. Потім реакційну суміш перемішують та нагрівають до кипіння зі зворотним холодильником протягом 2 годин. Суміш охолоджують на льодяній бані. Додають воду та СН2Сl2. Органічний шар промивають насиченим водним розчином NaHCO3, осушають, фільтрують і розчинник випаровують, одержуючи 13,16г (96%) 2-флюор-5Н-дибензо[а,d]циклогептену (проміжна сполука 1). b) Метахлорпербензойну кислоту (0,0501моль) розчиняють у СНСl3 (40мл). Органічний розчин осушають, фільтрують і фільтрат додають по краплях до розчину проміжної сполуки 1 (0,0417моль) та 1,4-бензолдіолу (0,26г) у СНСl3 (70мл), перемішують при 60°С. Реакційну суміш перемішують протягом 2,5 годин при 60°С, а потім охолоджують на льодяній бані, промивають 10% водним розчином Na2CO3 та розсолом, осушають, фільтрують і фільтрат випаровують, одержуючи 10,42г 3-флюор-6,10b-дигідро-1аH-дибензо[3,4:6,7]циклогепт[1,2-b]оксирену (проміжна сполука 2). c) Бром-2-пропенілмагній (0,0542моль) додають по краплях до розчину проміжної сполуки 2 (0,04956моль) у тетрагідрофурані (120мл) під атмосферою N2. Реакційну суміш перемішують протягом 30 хвилин при кімнатній температурі, а потім перемішують та нагрівають до кипіння зі зворотним холодильником протягом 2 годин. Реакційну суміш охолоджують на льодяній бані, гасять 20% розчином NH4CI та екстрагують етилацетатом. Органічний шар відокремлюють, осушають, фільтрують і розчинник випаровують. Залишок очищають та розділяють на два регіо-ізомери методом ВЕРХ на силікагелі (елюент: гексани/етилацетат 9/1). Збирають дві групи чистих фракцій і розчинник випаровують, одержуючи 4,79г (36%) (±)-транс-8-флюор-10,11дигідро-11-(2-пропеніл)-5Н-дибензо[а,d]цикло-гептен-10-олу (проміжна сполука 3) та 2,52г (19%) (транс)-2флюор-10,11-дигідро-11-(2-пропеніл)-5Н-дибензо[а,d]циклогептен-10-олу (проміжна сполука 4). d) Трибромід піридинію (0,0175моль) додають порціями до розчину проміжної сполуки 3 (0,0175моль) у СНСl3 (80мл), охолоджують на льодяній бані. Реакційну суміш перемішують протягом однієї години при кімнатній температурі. Додають воду. Суміш перемішують протягом 5 хв. Органічний шар відокремлюють, промивають водою, осушають, фільтрують і розчинник випаровують. Залишок очищають хроматографією на короткій колонці з силікагелем (елюент: гексани/СН2Сl2 4:1, а потім 1:1). Чисті фракції збирають і розчинник випаровують, одержуючи 5,02г (83%) (±)-[(2a,3ab,12ba) + (2a,3аa,12bb)]-2-(бромметил)-11-флюор-3,3а,8,12bтетрагідро-2Н-дибензо-[3,4:6,7]циклогепта[1,2-b]фурану (проміжна сполука 5). У аналогічний спосіб одержують: (±)-[(2a,3аb,12ba) + (2a,3аa,12bb)]-2-(бромметил)-5-флюор-3,3а,8,12b-тетрагідро-2Н-дибензо[3,4:6,7]циклогепта[1,2-b]фуран (проміжна сполука 6), (±)-[(2a,3аb,12ba) + (2a,3аa,12bb)]-2-(бромметил)-3,3а,8,12b-тетрагідро-2Н-дибензо[3,4:6,7]циклогепта[1,2b]фуран (проміжна сполука 7) та (±)-[(2a,3аb,12ba) + (2a,3аa,12bb)]-2-(бромметил)-5,11-дифлюор-3,3а,8,12b-тетрагідро-2Ндибензо[3,4:6,7]циклогепта[1,2-b]фуран (проміжна сполука 8). e) Суміш проміжної сполуки 5 (0,073моль), газоподібного диметиламіну (170г) та СаО (26г) у ТГФ (400мл) нагрівають протягом 16 годин при 125 °С (автоклав) (реакція ´ 2). Суміш промивають насиченим водним розчином NaHCO3, а потім екстрагують СН2Сl2. Відокремлений органічний шар осушають, фільтрують та розчинник випаровують. Залишок розчиняють у діетиловому ефірі та перетворюють на сіль хлористоводневої кислоти (1:1) за допомогою НСl/2-пропанолу (рН < 4). Розчинник випаровують. Залишок перемішують у киплячому 2-пропаноні, збирають на фільтрі та висушують. Вихід: 20,5г (±)-[(2a,3аb,12ba)-11-флюор3,3а,8,12b-тетрагідро-N,N-диметил-2Н-дибензо-[3,4:6,7]циклогепта[1,2-b]фуран-2-метанаміну (проміжна сполука 9). f) Випаровують розчинник з маточного розчину. Залишок очищають методом високоефективної рідинної хроматографії на RP-18 (елюент: (0,5% NH4OAc у H2O)/CH3OH/CH3CN, градієнтне елюювання). Чисті фракції збирають і розчинник випаровують. Вихід: 0,400г (±)-(2a,3аa,12bb)-11-флюор-3,3а,8,12b-тетрагідро-N,Nдиметил-2Н-дибензо[3,4:6,7]циклогепта[1,2-b]фуран-2-метанаміну (проміжна сполука 10). g) Проміжну сполуку 10 (0,00128моль) розділяють на її енантіомери методом хіральної хроматографії на колонці з Chiralpak AD (елюент:гексан/2-пропанол 97/3). Збирають дві групи чистих фракцій і розчинник випаровують. Вихід: 0,201г А (2a,3аa,12bb)-11-флюор-3,3а,8,12b-тетрагідро-N,N-диметил-2Ндибензо[3,4:6,7]циклогепта[1,2-b]фуран-2-метанаміну (проміжна сполука 11) та 0,170г В - (2a,3аa,12bb)-11флюор-3,3а,8,12b-тетрагідро-N,N-диметил-2Н-дибензо[3,4:6,7]циклогепта[1,2-b]фуран-2-метанаміну (проміжна сполука 12). Аналогічно до проміжної сполуки 10 були одержані також такі проміжні сполуки: (±)-(2a,3аa,12bb)-5-флюор-3,3а,8,12b-тетрагідро-N,N-диметил-2Н-дибензо[3,4:6,7]-циклогепта[1,2 b]фуран-2-метанамін (проміжна сполука 13), (±)-(2a,3аa,12bb)-3,3а,8,12b-тетрагідро-N,N-диметил-2Н-дибензо[3,4:6,7]цикло-гепта[1,2-b]фуран-2метанамін (проміжна сполука 14) та (±)-(2a,3аa,12bb)-5,11-дифлюор-3,3а,8,12b-тетрагідро-N,N-диметил-2Н-дибензо-[3,4:6,7]циклогепта[1,2b]фуран-2-метанамін (проміжна сполука 15). d) Використовуючи метиламін (газ.) замість N,N-диметиламіну (газ.), у аналогічний спосіб синтезують монометильні еквіваленти проміжних сполук 13, 14 та 15, одержуючи: (±)-(2a,3аa,12bb)-11-флюор-3,3а,8,12b-тетрагідро-N-метил-2Н-дибензо[3,4:6,7]-циклогепта[1,2-b]фуран-2метанамін (проміжна сполука 16), (±)-(2a,3аa,12bb)-5-флюop-3,3a,8,12b-тeтpaгiдpo-N-мeтил-2H-дибeнзo[3,4:6,7]-циклогепта[1,2-b]фуран-2метанамін (проміжна сполука 17), (±)-(2a,3аa,12bb)-5,11-дифлюор-3,3а,8,12b-тетрагідро-N-метил-2Н-дибензо-[3,4:6,7]циклогепта[1,2b]фуран-2-метанамін (проміжна сполука 18) та (±)-(2a,3аa,12bb)-3,3а,8,12b-тетрагідро-N-метил-2Н-дибензо[3,4:6,7]циклогепта-[1,2-b]фуран-2-метанамін (проміжна сполука 19). В. Одержання мигдалевокислих солей Сполука 1 0,00025моль енантіомера В проміжної сполуки 16 та 0,00025моль S-мигдалевої кислоти розчиняють у 4мл 2-пропанолу, а потім залишають для кристалізації. Осад збирають на фільтрі та висушують (вакуум, 50°С). Вихід: 0,096г мигдалевокислої солі (Сполука 1). Перекристалізовують 5мг сполуки 1 з 1мл 2-пропанолу, що містить 3 краплини етанолу для одержання зразка, придатного для проведення рентгенівського аналізу. У аналогічний спосіб були одержані мигдалевокислі солі В-енантіомерів проміжних сполук 12, 13, 14, 15, 17, 18 та 19. Випробування стабільності Були проведені випробування таких солей: тартрату, дитолуоїлтартрату, цитрату, малонату, сукцинату та манделату В-(2a,3аa,12bb)-11-флюор-3,3а,8,12b-тетрагідро-N-метил-2Н-дибензо-[3,4:6,7]циклогепта[1,2b]фуран-2-метанаміну (Сполука 1). Солі піддавали випробуванням на адсорбцію/десорбцію ними води, на кристалографічну стабільність та на хімічну стабільність. a. Адсорбція та десорбція води Адсорбцію та десорбцію води при 25°С та різних значеннях відносної вологості визначають для ±10мг кожної солі. Реєструють зміну ваги як функцію відносної вологості. Результати представлені на Фігурі 1. Мигдалевокисла сіль є стабільнішою до поглинання вологи в усьому інтервалі значень вологості. Малонатна, бурштиновокисла, виннокисла та (+)-дитолуоїлтартратна солі є менш стабільними, але величина зміни ваги як функції відносної вологості є дуже малою. Лимоннокисла сіль є гігроскопічною та зріджується при високій відносній вологості. b. Кристалографічна стабільність Стабільність кристалічної структури солі досліджують після зберігання сполук протягом двох тижнів при кімнатній температурі (RT) та відносній вологості (RH) 5 %, 75% або 25°С / 60%. Зразки аналізують методами термогравіметрії (ТГА), диференційної скануючої калориметрії (ДСК) та інфрачервоної спектроскопії (14). Результати випробувань представлені у Таблиці 1. Таблиця 1 Результати визначення кристалографічної стабільності Сіль Тартрат Манделат Цитрат (+)дитолуоїлтартрат Умови 0 днів RT /
ДивитисяДодаткова інформація
Назва патенту англійськоюMandelate salts of substituted tetracyclic tetrahydrofuran derivatives
Назва патенту російськоюМиндалевокислые соли замещенных тетрациклических производных тетрагидрофурана
Автори російськоюStokbroekx, Sigrid, Carl, Maria
МПК / Мітки
МПК: A61K 31/343, A61P 25/06, A61P 25/22, A61P 25/18, C07D 307/93, A61P 25/30, A61P 25/20, A61P 25/24
Мітки: солі, заміщених, тетрагідрофурану, тетрациклічних, похідних, мигдалевокислі
Код посилання
<a href="https://ua.patents.su/8-79248-migdalevokisli-soli-zamishhenikh-tetraciklichnikh-pokhidnikh-tetragidrofuranu.html" target="_blank" rel="follow" title="База патентів України">Мигдалевокислі солі заміщених тетрациклічних похідних тетрагідрофурану</a>