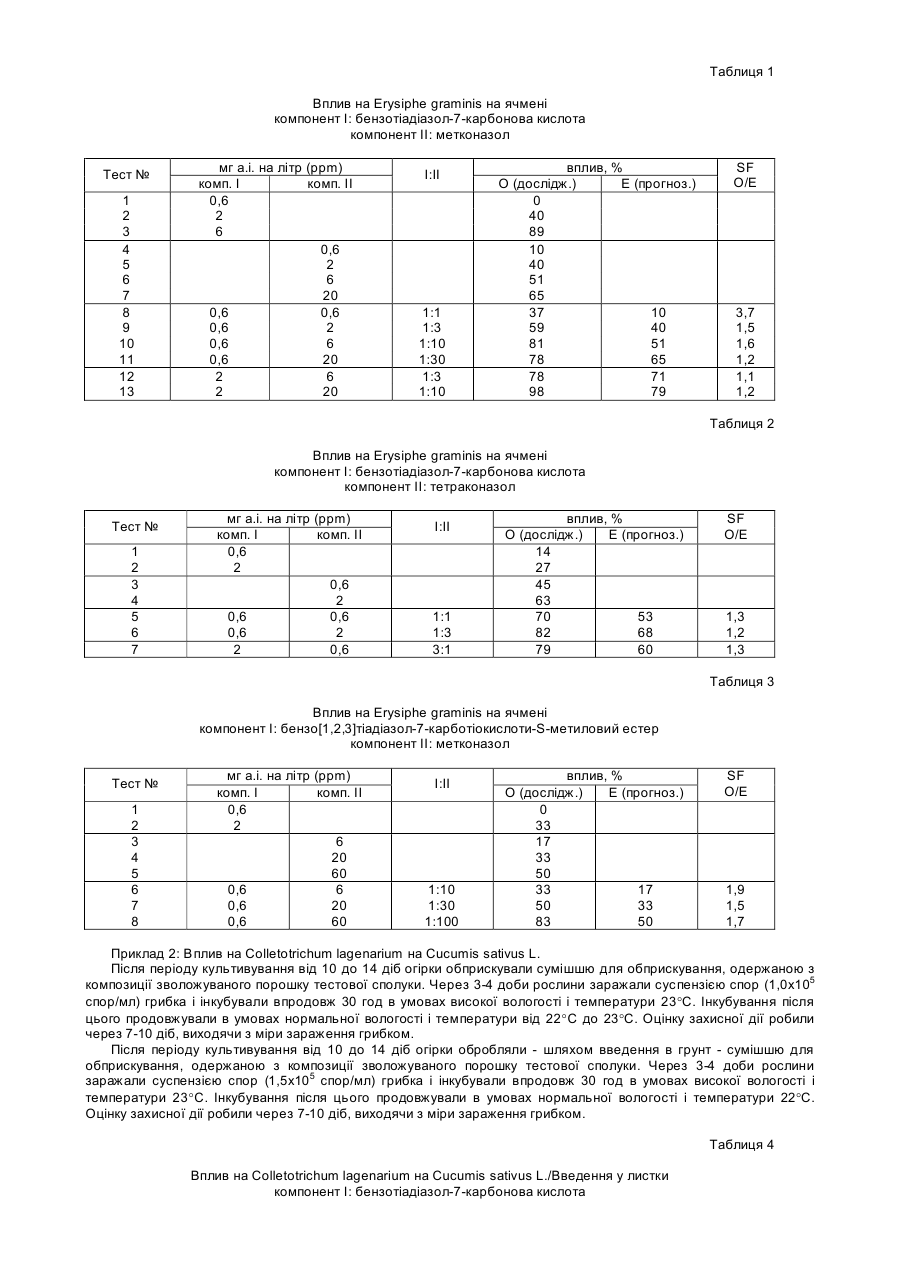
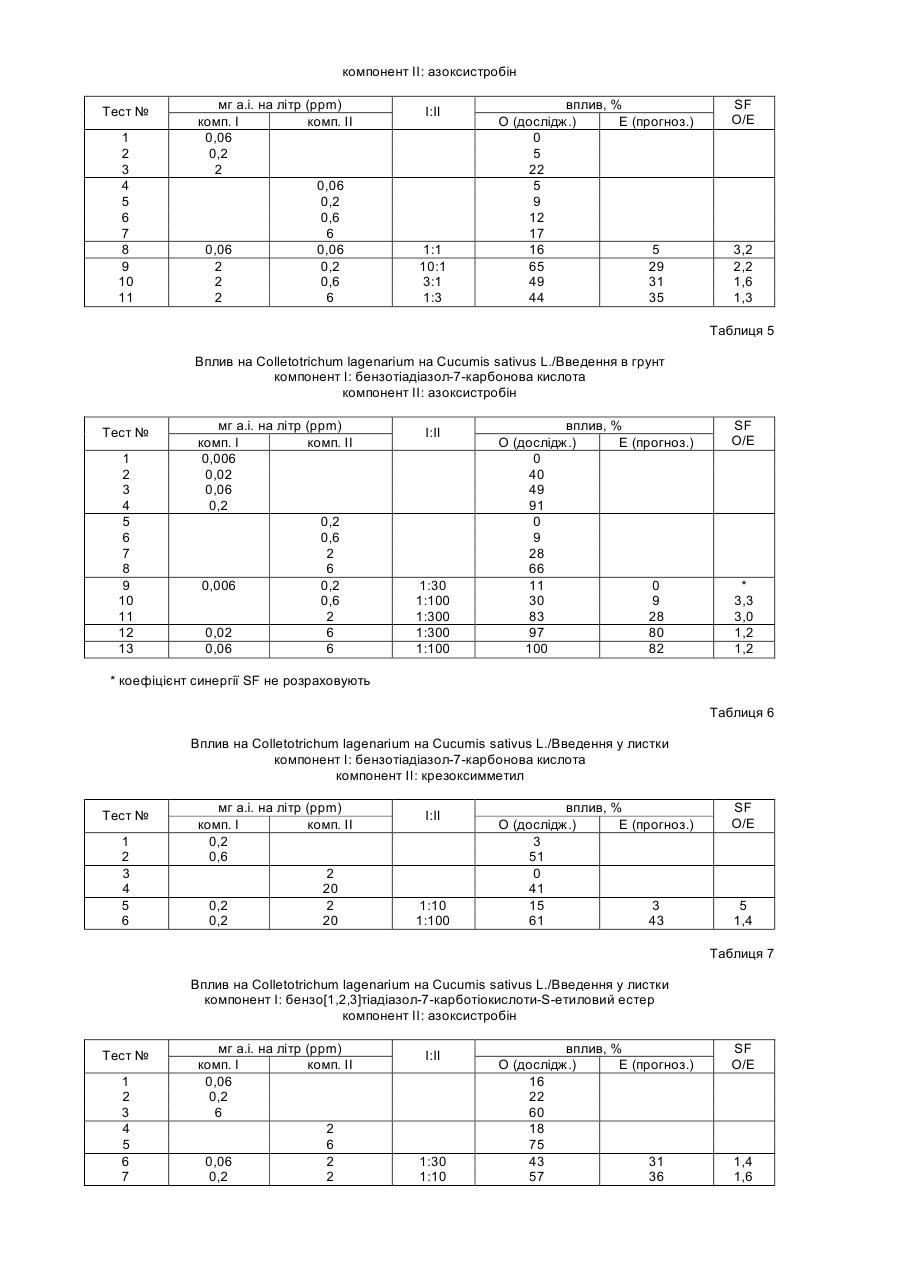
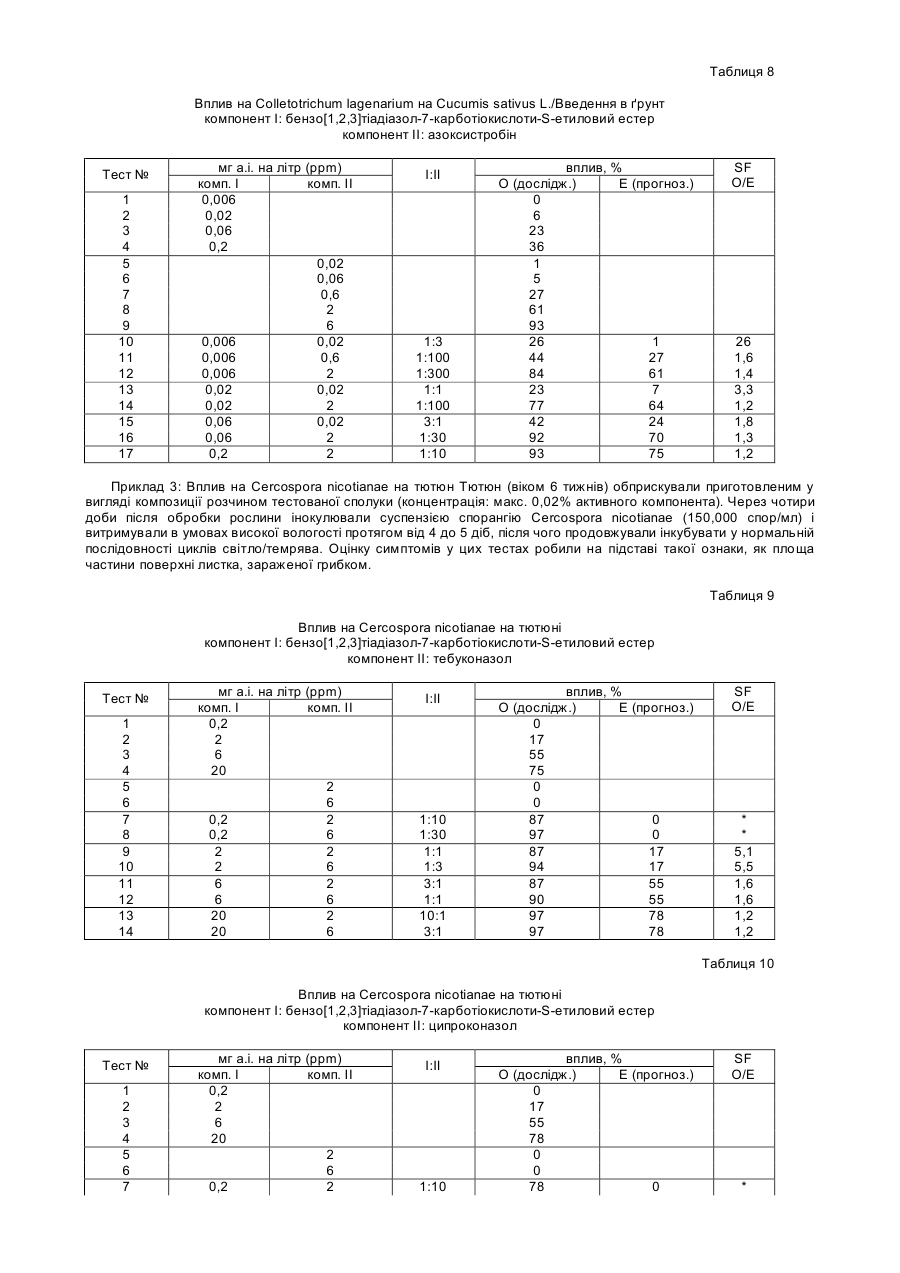
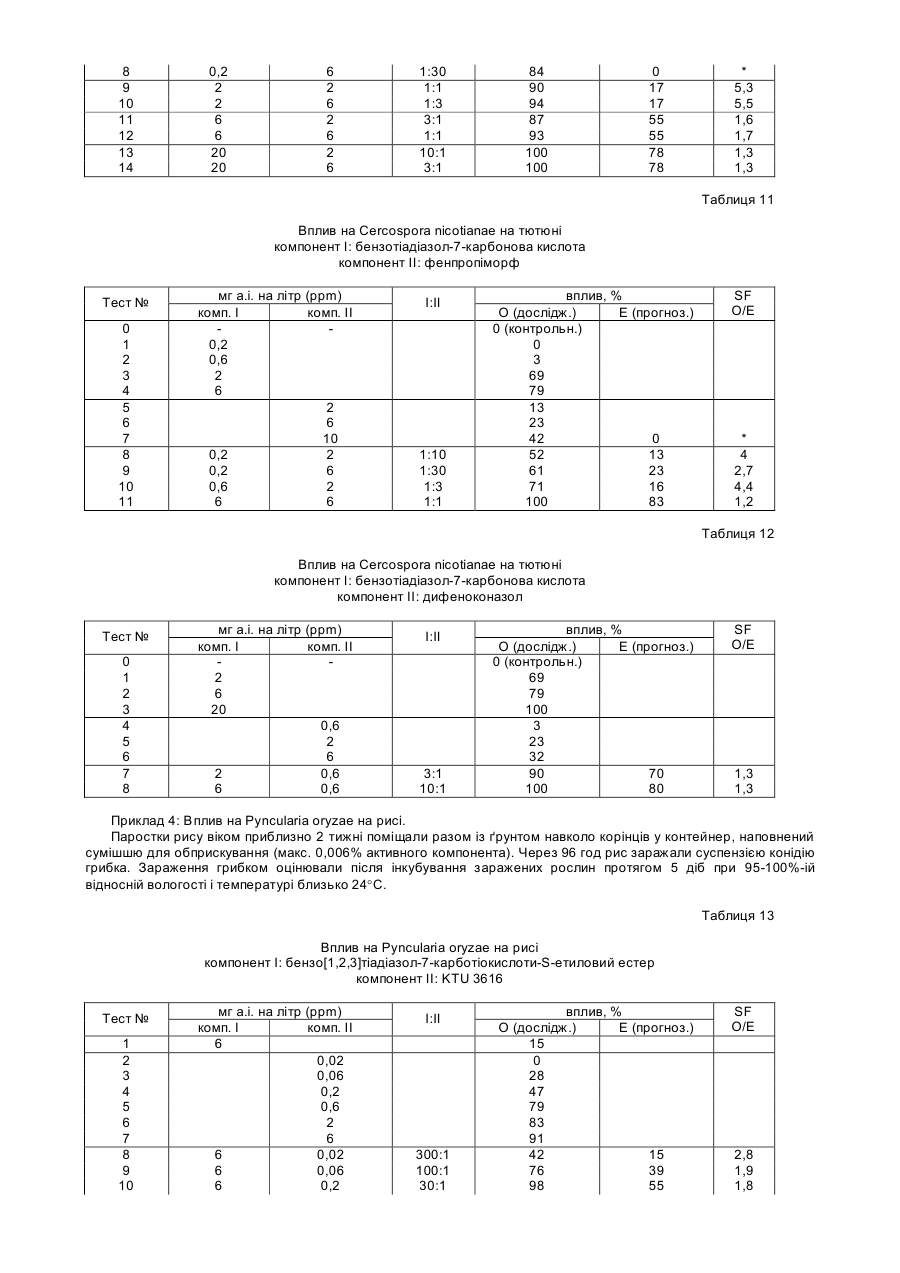
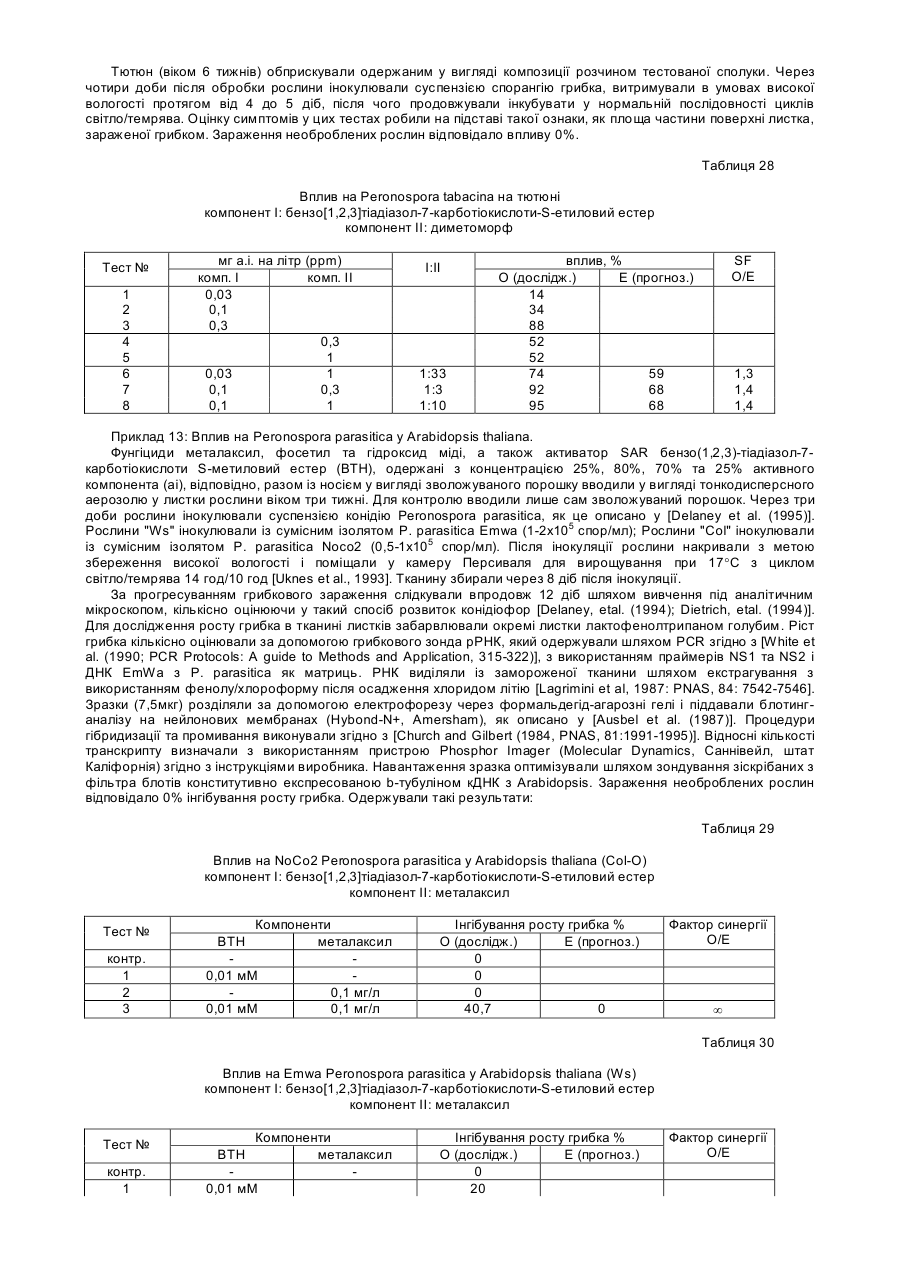
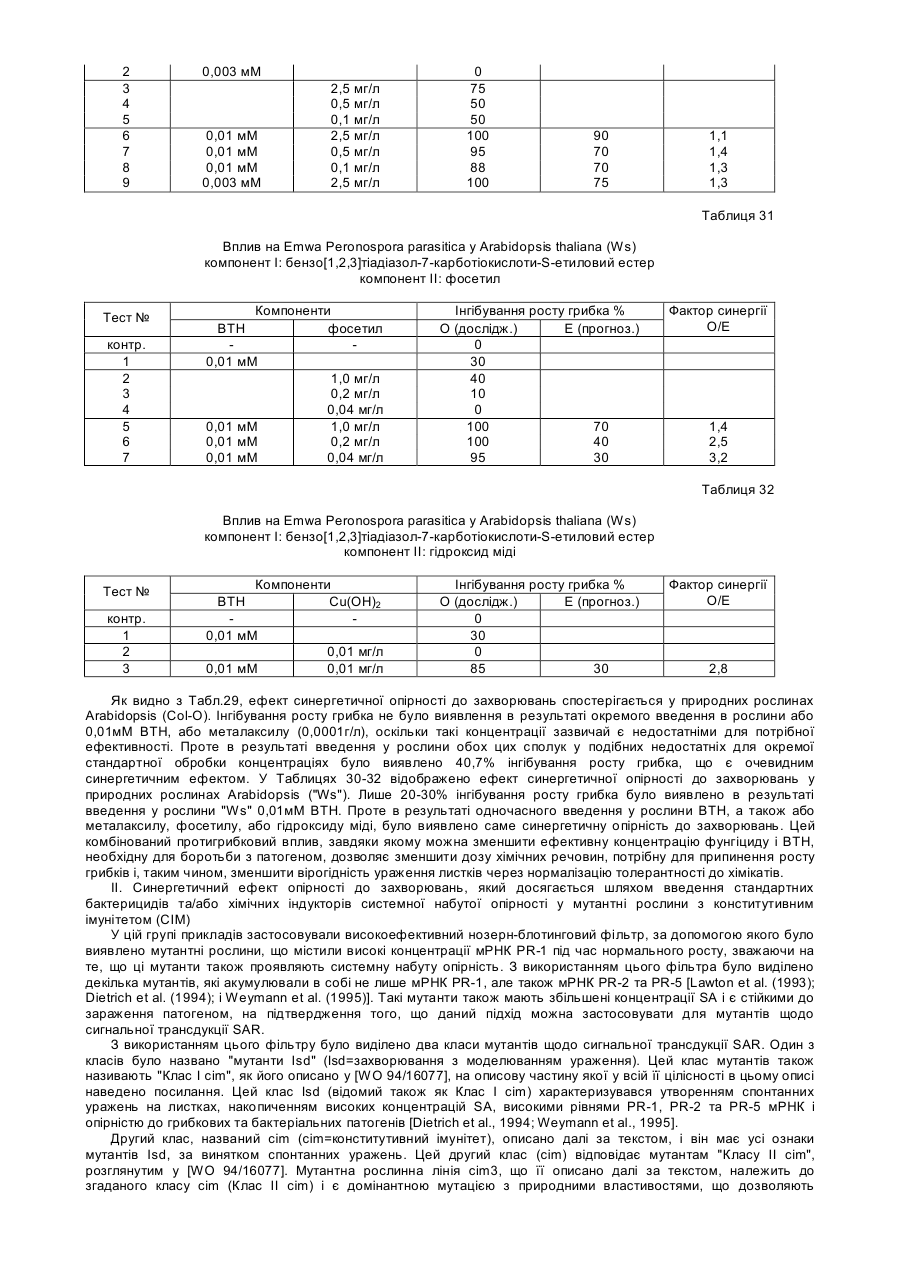
Спосіб захисту рослин від ураження патогенами
Номер патенту: 73714
Опубліковано: 15.09.2005
Автори: Райєлз Джон Ендрю, Моліна Фернандес Антоніо, Юкнес Скотт Джозеф, Фрідріх Леслі Бетардс
Формула / Реферат
1. Спосіб захисту рослини від ураження патогенами шляхом синергетичного підвищення стійкості до захворювання, який включає такі стадії:
а) одержання імуномодульованої рослини, яка має перший рівень стійкості до
захворювання, причому імуномодульована рослина є:
(і) мутантною рослиною, яка несе ген конститутивного імунітету (сіm),
(іі) мутантною рослиною, яка має ген, який обумовлює ураження , яке нагадує хворобу,
(ііі) рослиною, яка отримана шляхом рекомбінантної експресії в рослині гена
системної набутої стійкості (SAR) і
б) обробку імуномодульованої рослини принаймні одним мікробіцидом, який створює другий рівень стійкості до захворювання,
при цьому обробка мікробіцидом імуномодульованої рослини створює синергетично підвищений третій рівень стійкості до захворювання, який перевищує суму першого та другого рівнів стійкості до захворювання.
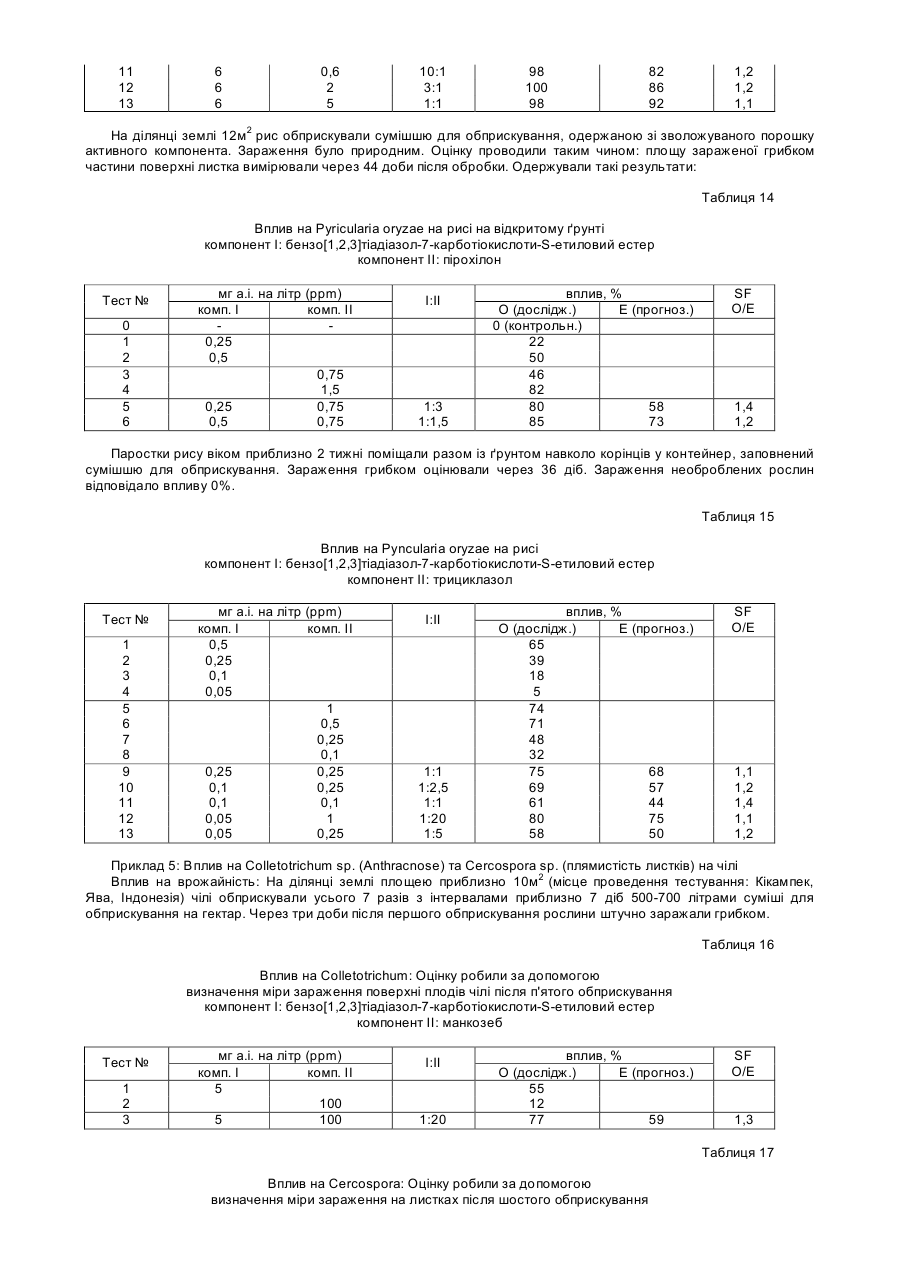
2. Спосіб за п. 1, у якому вказану сim-мутантну рослину вибирають з популяції рослин відповідно до таких стадій:
а) здійснюють оцінку експресії генів SAR у незаражених рослинах, які є фенотипово нормальними, що означає відсутність у вказаних незаражених рослинах фенотипу, який нагадує ураження хворобою і
б) проводять селекцію незаражених рослин, які конститутивно експресують гени SAR при відсутності вірусного, бактеріального чи грибкового зараження.
3. Спосіб за п. 1, у якому мутантну рослину, яка має ураження, яке нагадує хворобу, вибирають з популяції рослин відповідно до таких стадій:
а) здійснюють оцінку експресії генів SAR у незаражених рослинах, які мають фенотип, який нагадує ураження хворобою і
б) проводять селекцію незаражених рослин, які конститутивно експресують гени SAR при відсутності вірусного, бактеріального чи грибкового зараження.
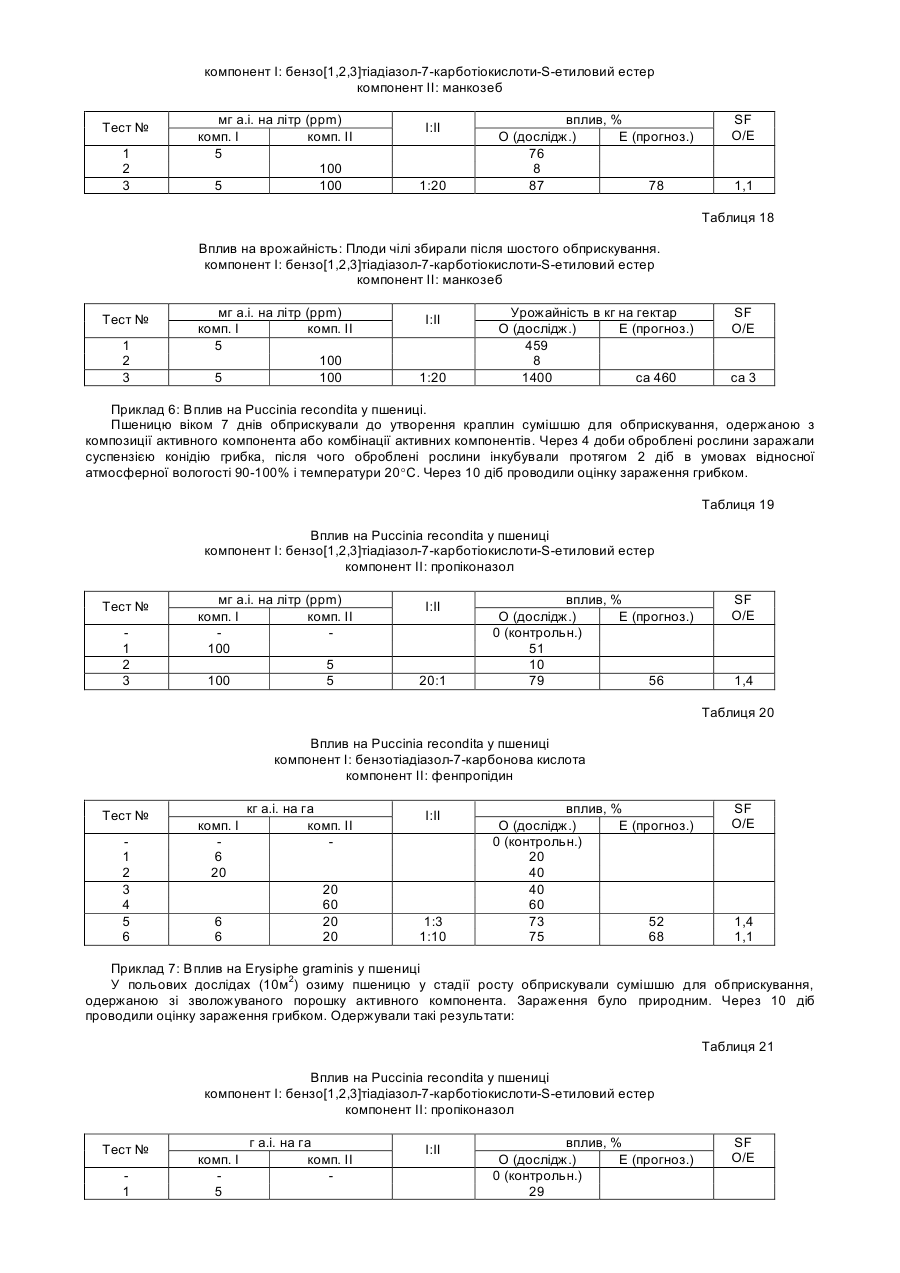
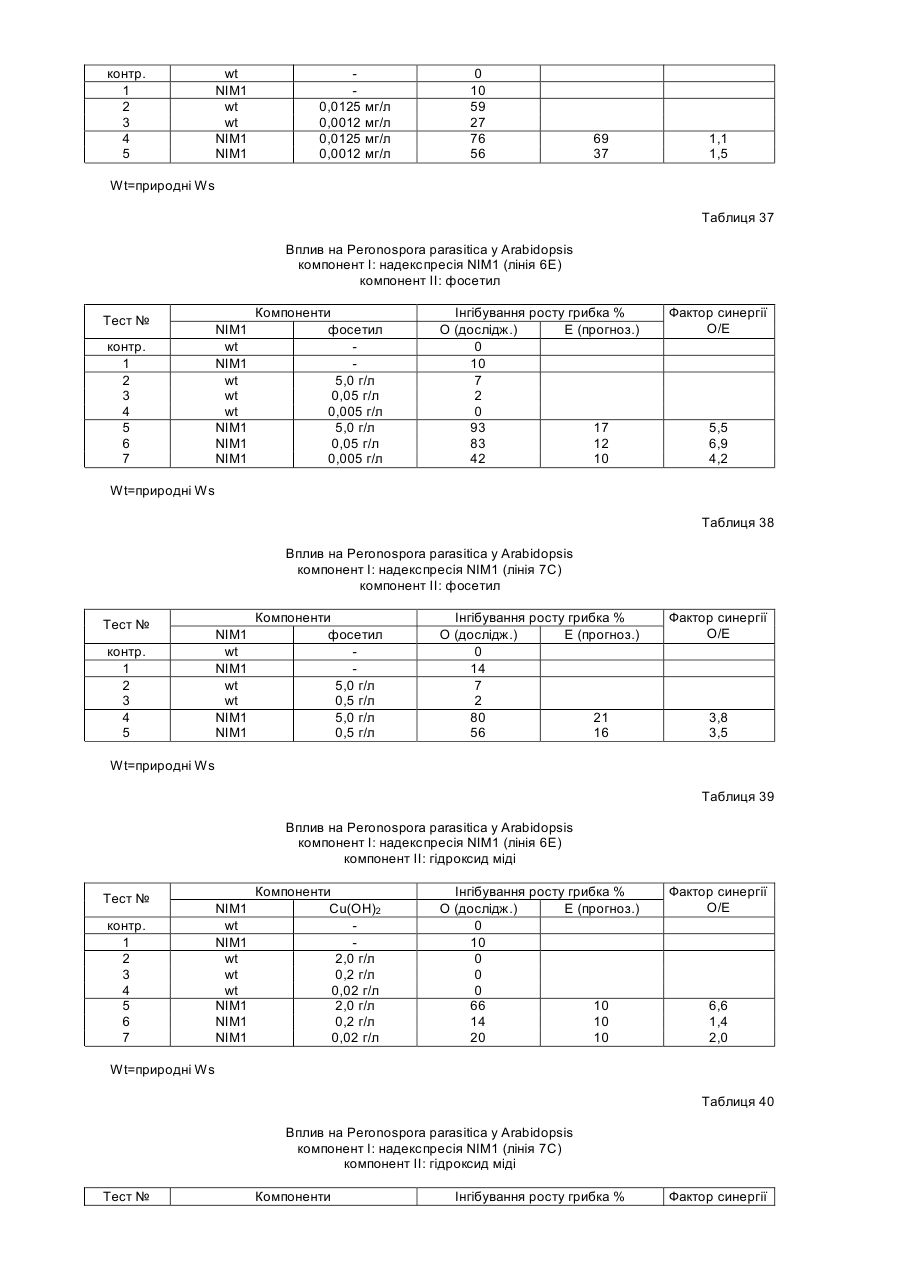
4. Спосіб за п. 1, у якому ген SAR являє собою функціональну форму гена NIM1, який кодує білок NIM1, залучений до шляху трансдукції сигналу, який призводить до створення системної набутої стійкості у рослинах.
5. Спосіб за п. 4, у якому білок NIM1 містить амінокислотну послідовність, представлену в ПОСЛ. ІД №:2.
6. Спосіб за п. 4, у якому ген NIM1 містить кодувальну послідовність, представлену в ПОСЛ. ІД №:1.
7. Спосіб за п. 1, у якому ген SAR кодує змінену форму білка NIM1, що діє як домінантно-негативний регулятор шляху трансдукції сигналу SAR.
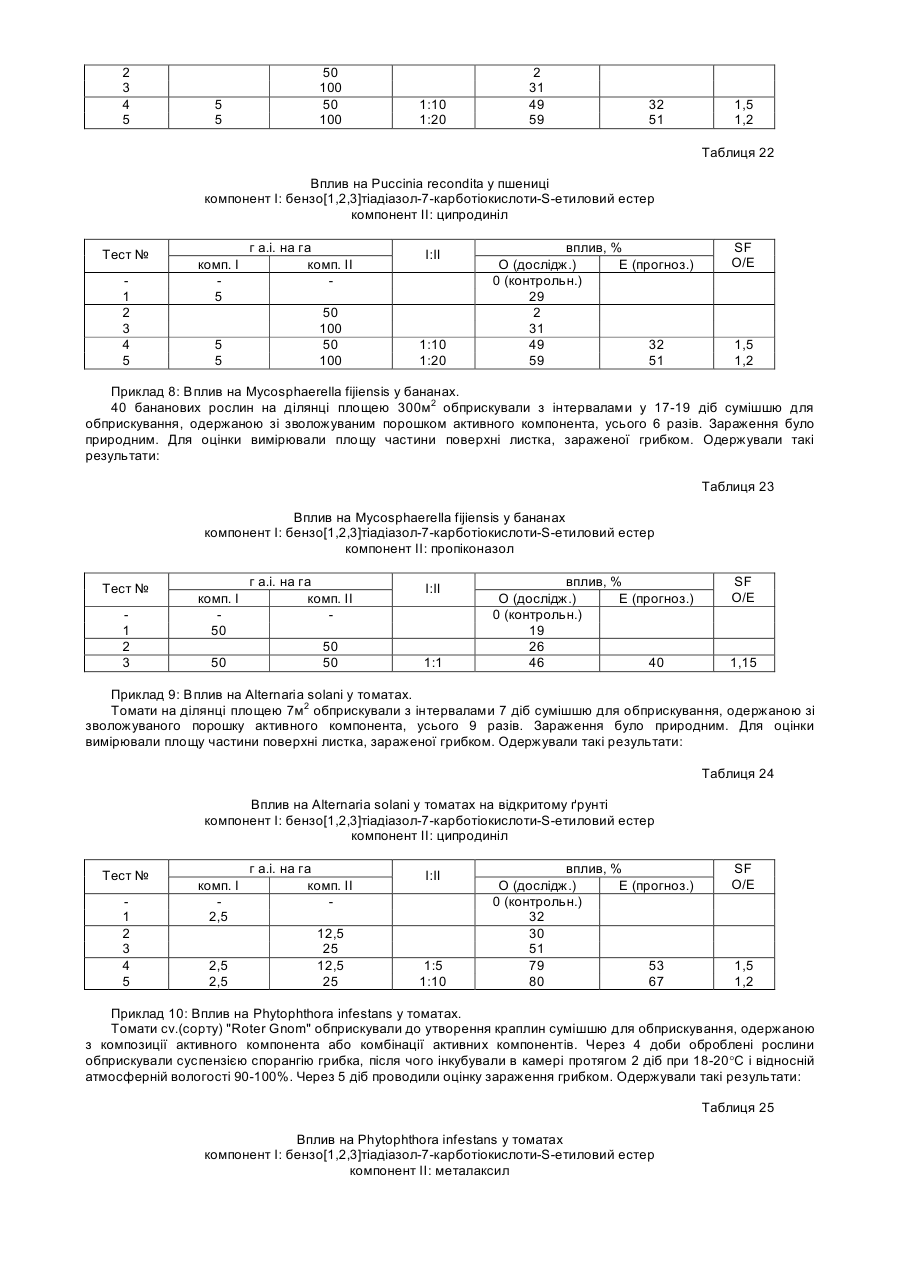
8. Спосіб за п. 7, у якому змінена форма білка NIM1 має залишки аланіну замість залишків серину у положеннях 55 та 59 амінокислотної послідовності, представленої в ПОСЛ. ІД №:2.
9. Спосіб за п. 8, у якому змінена форма білка NIM1 містить амінокислотну послідовність, представлену в ПОСЛ. ІД №:8.
10. Спосіб за п. 8, у якому змінена форма білка NIM1 кодується нуклеотидною послідовністю, представленою в ПОСЛ. ІД №:7.
11. Спосіб за п. 7, у якому змінена форма білка NIM1 має N-кінцеве укорочення амінокислотної послідовності, яке приблизно відповідає положенням амінокислот 1-125 у ПОСЛ. ІД№:2.
12. Спосіб за п. 11, у якому змінена форма білка NIM1 містить амінокислотну послідовність, представлену в ПОСЛ. ІД №:10.
13. Спосіб за п. 11, у якому змінена форма білка NIM1 кодується нуклеотидною послідовністю, представленою в ПОСЛ. ІД №:9.
14. Спосіб за п. 7, у якому змінена форма білка NIM1 має С-кінцеве укорочення амінокислотної послідовності, яке приблизно відповідає положенням амінокислот 522-593 ПОСЛ. ІД №:2.
15. Спосіб за п. 14, у якому змінена форма білка NIM1 містить амінокислотну послідовність, представлену в ПОСЛ. ІД №:12.
16. Спосіб за п. 14, у якому змінена форма білка NIM1 кодується нуклеотидною послідовністю, представленою в ПОСЛ. ІД №:11.
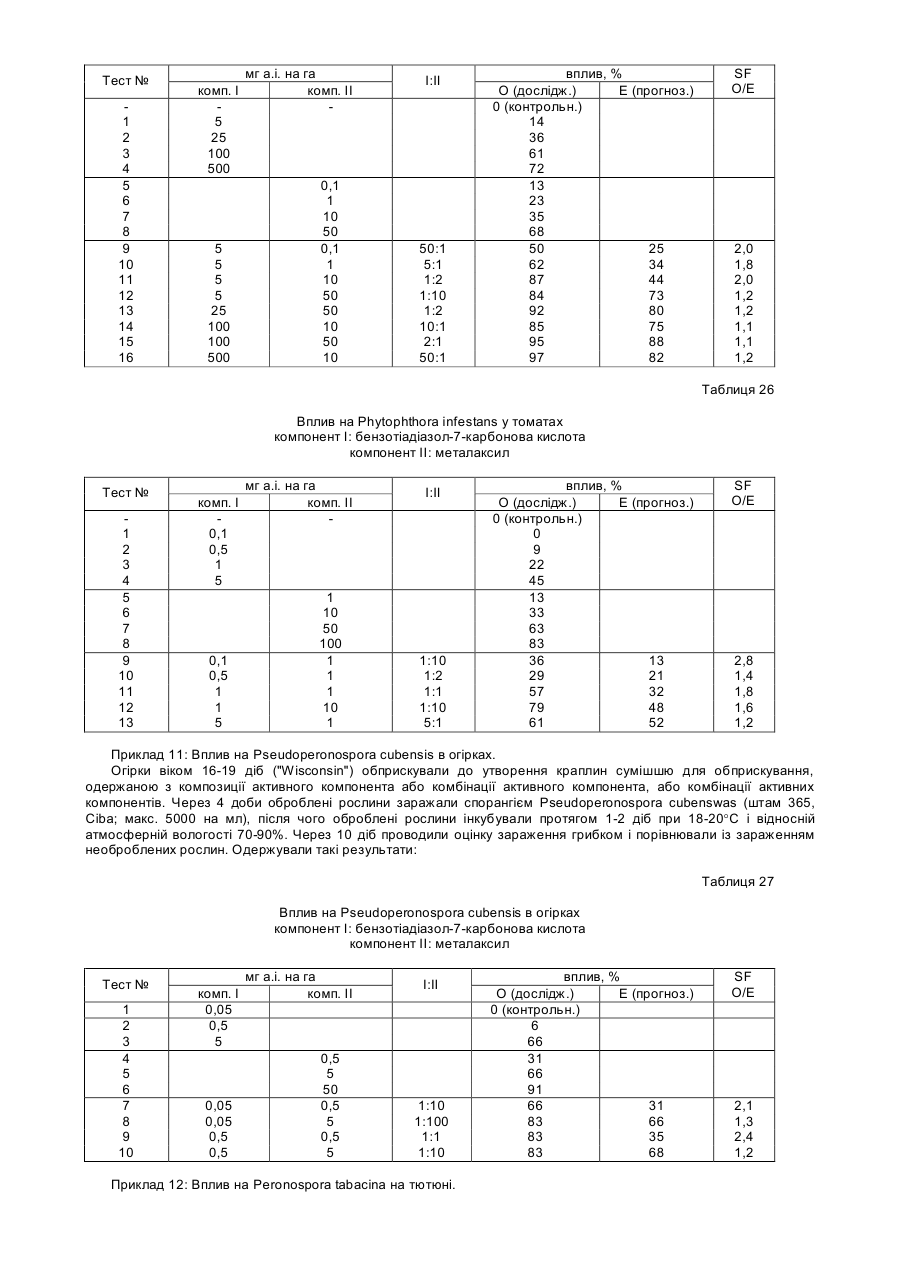
17. Спосіб за п. 7, у якому змінена форма білка NIM1 має N-кінцеве укорочення амінокислотної послідовності, яке приблизно відповідає положенням амінокислот 1-125 у ПОСЛ. ІД №:2, і С-кінцеве укорочення амінокислотної послідовності, яке приблизно відповідає положенням амінокислот 522-593 у ПОСЛ. ІД №:2.
18. Спосіб за п. 17, у якому змінена форма білка NIM1 містить амінокислотну послідовність, представлену в ПОСЛ. ІД №:14.
19. Спосіб за п. 17, у якому змінена форма білка NIM1 кодується нуклеотидною послідовністю, представленою ПОСЛ. ІД №:13.
20. Спосіб за п. 7, у якому змінена форма білка NIM1 складається головним чином з анкіринових мотивів, що приблизно відповідають амінокислотам у положеннях 103-362 ПОСЛ. ІД №:2.
21. Спосіб за п. 20, у якому змінена форма білка NIM1 містить амінокислотну послідовність, представлену в ПОСЛ. ІД №:16.
22. Спосіб за п. 20, у якому змінена форма білка NIM1 кодується нуклеотидною послідовністю, представленою в ПОСЛ. ІД №:15.
23. Спосіб за будь-яким з пунктів 4, 8, 11, 14, 17 та 20, у якому білок NIM1 кодується нуклеотидною послідовністю, яка гібридизується з нуклеотидною послідовністю, представленою в ПОСЛ. ІД №№ 1, 7, 9, 11, 13 або 15 за таких умов:
гібридизація у 1%BSA, 520мМ NaP04, pH 7,2; 7% лаурилсульфат, натрієва сіль, 1мМ ЕДТК, 250 мМ хлорид натрію при 55°С протягом 18-24 год, і промивання в 6-ти кратному розчині хлориду і цитрату натрію протягом 15 хв. (3-кратне промивання), в 3-кратному розчині хлориду і цитрату натрію протягом 15 хв. (1-кратне промивання) при 55°С.
24. Спосіб за будь-яким з пунктів від 1 - 23, у якому мікробіцид являє собою фунгіцид, вибраний з групи, яка включає:
4-[3-(4-хлорфеніл)-3-(3,4-диметоксифеніл)акрилоїл]морфолін ("диметоморф"),
5-метил-1,2,4-триазоло[3,4-b][1,3]бензотіазол ("трициклазол"),
3-алілокси-1,2-бензотіазол-1,1-діоксид ("пробоназол"),
α-[2-(4-хлорфеніл)етил]-α-(1,1-диметилетил)-1Н-1,2,4-триазол-1-етанол ("тебуконазол"),
1-[[3-(2-хлорфеніл)-2-(4-фторфеніл)оксиран-2-іл]метил]-1Н-1,2,4-триазол ("епоксиконазол"),
α-(4-хлорфеніл)-α-(1-циклопропілетил)-1Н-1,2,4-триазол-1-етанол ("ципроконазол"),
5-(4-хлорбензил)-2,2-диметил-1-(1Н-1,2,4-триазол-1-ілметил)-циклопентанол ("метконазол"),
2-(2,4-дихлорфеніл)-3-(1Н-1,2,4-триазол-1-іл)-пропіл-1,1,2,2-тетрафторетиловий ефір ("тетраконазол"),
метил-(Е)-2-{2-[6-(2-ціанофенокси)піримідин-4-ілокси]феніл}-3-метоксіакрилат ("ICI A 5504", "азоксистробін"),
метил-(Е)-2-метоксиміно-2-[![]() -(о-толілокси)-о-толіл]ацетат
-(о-толілокси)-о-толіл]ацетат
("BAS 490 F", "крезоксимметил"),
2-(2-феноксифеніл)-(Е)-2-метоксиміно-N-метилацетамід,
[2-(2,5-диметилфеноксиметил)-феніл]-(Е)-2-метоксиміно-N-метилацетамід,
(1R,3S/1S,3R)-2,2-дихлор-N-[(R)-1-(4-хлорфеніл)етил]-1-етил-3-метилциклопропанкарбоксамід ("KTU 3616"),
етилен-біс-дитіокарбамат-полімерний комплекс марганцю і цинку ("манкозеб"),
1-[2-(2,4-дихлорфеніл)-4-пропіл-1,3-діоксолан-2-ілметил]-1Н-1,2,4-триазол ("пропіконазол"),
1-{2-[2-хлор-4-(4-хлорфенокси)феніл]-4-метил-1,3-діоксолан-2-ілметил}-1Н-1,2,4-триазол ("дифеноконазол"),
1-[2-(2,4-дихлорфеніл)пентил]-1Н-1,2,4-триазол ("пенконазол"),
цис-4-[3-(4-трет-бутилфеніл)-2-метилпропіл]-2,6-диметилморфолін ("фенпропіморф"),
1-[3-(4-трет-бутилфеніл)-2-метилпропіл]-піперидин ("фенпропідин"),
4-циклопропіл-6-метил-N-феніл-2-піримідинамін ("ципродиніл"),
метиловий естер (RS)-N-(2,6-димeтилфeнiл)-N-(мeтoкciaцeтил)-aлaнiнy ("металаксил"),
метиловий естер (R)-N-(2,6-диметилфеніл)-N-(метоксіацетил)-аланіну ("R-металаксил"),
1,2,5,6-тетрагідро-4Н-піроло[3,2,1-ij]хінолін-4-он ("пірохілон") та
кислий етиловий ефір фосфонової кислоти ("фосетил").
25. Спосіб за п. 24, у якому вказаний фунгіцид є металаксилом.
26. Спосіб за будь-яким з пунктів 1-24, у якому вказаний мікробіцид є похідним бензотіадіазолу, похідним ізонікотинової кислоти або похідним саліцилової кислоти.
27. Спосіб за будь-яким з пунктів 1-26, у якому двома мікробіцидами одночасно обробляють імуномодульовану рослину.
28. Спосіб за пунктом 27, у якому один з мікробіцидів є фунгіцидом, вибраним з
групи, яка включає:
4-[3-(4-хлорфеніл)-3-(3,4-диметоксифеніл)акрилоїл]морфолін ("диметоморф"),
5-метил-1,2,4-триазоло[3,4-b][1,3]бензотіазол ("трициклазол"),
3-алілокси-1,2-бензотіазол-1,1-діоксид ("пробоназол"),
α-[2-(4-хлорфеніл)етил]-α-(1,1-диметилетил)-1Н-1,2,4-триазол-1-етанол ("тебуконазол"),
1 -[[3-(2-хлорфеніл)-2-(4-фторфеніл)оксиран-2-іл]метил]-1Н-1,2,4-триазол ("епоксиконазол"),
α (4-хлорфеніл)-α-(1-циклопропілетил)-1Н-1,2,4-триазол-1-етанол ("ципроконазол"),
5-(4-хлорбензил)-2,2-диметил-1-(1Н-1,2,4-триазол-1-ілметил)-циклопентанол ("метконазол"),
2-(2,4-дихлорфеніл)-3-(1Н-1,2,4-триазол-1-іл)-пропіл-1,1,2,2-тетрафторетиловий ефір, ("тетраконазол"),
метил-(Е)-2-{2-[6-(2-ціанофенокси)піримідин-4-ілокси]феніл}-3-метоксіакрилат,
("ICI A 5504", "азоксистробін"),
метил-(Е)-2-метоксиміно-2-[![]() -(о-толілокси)-о-толіл]ацетат
-(о-толілокси)-о-толіл]ацетат
("BAS 490 F","крезоксимметил"),
2-(2-феноксифеніл)-(Е)-2-метоксиміно-N-метилацетамід,
[2-(2,5-диметилфеноксиметил)-феніл]-(Е)-2-метоксиміно-N-метилацетамід,
(1R,3S/1S,3R)-2,2-дихлор-N-[(R)-1-(4-хлорфеніл)етил]-1-етил-3
метилциклопропанкарбоксамід ("KTU 3616"),
етилен-біс-дитіокарбамат-полімерний комплекс марганцю і цинку ("манкозеб"),
1-[2-(2,4-дихлорфеніл)-4-пропіл-1,3-діоксолан-2-ілметил]-1Н-1,2,4-триазол
("пропіконазол"),
1-{2-[2-хлор-4-(4-хлорфенокси)феніл]-4-метил-1,3-діоксолан-2-ілметил}-1Н-1,2,4-триазол ("дифеноконазол"),
1-[2-(2,4-дихлорфеніл)пентил]-1Н-1,2,4-триазол ("пенконазол"),
цис-4-[3-(4-трет-бутилфеніл)-2-метилпропіл]-2,6-диметилморфолін ("фенпропіморф"),
1-[3-(4-трет-бутилфеніл)-2-метилпропіл]-піперидин ("фенпропідин"),
4-циклопропіл 6-метил-N-феніл-2-піримідинамін ("ципродиніл"),
метиловий естер (RS)-N-(2,6-диметилфеніл)-N-(метоксіацетил)-аланіну ("металаксил"),
метиловий естер (R)-N-(2,6-диметилфеніл)-N-(метоксіацетил)-аланіну ("R-металаксил"),
1,2,5,6-тетрагідро-4Н-піроло[3,2,1-ij]хінолін-4-он ("пірохілон") і
кислий етиловий ефір фосфонової кислоти ("фосетил"),
а інший мікробіцид являє собою похідне бензотіадіазолу або похідне ізонікотинової кислоти або похідне саліцилової кислоти.
29. Спосіб за п. 28, у якому фунгіцид являє собою металаксил, а інший мікробіцид являє собою похідне бензотіадіазолу.
Текст
Цей винахід стосується способу захисту рослин від патогенного впливу шляхом створення синергетичної опірності до захворювань, яку створюють за допомогою введення бактерициду в імуномодульовану рослину. Рослини постійно заражаються різноманітними патогенними організмами, включаючи віруси, бактерії, грибкові організми та нематоди. Культурні рослини є особливо вразливими через те, що їх зазвичай вирощують як генетично однорідні монокультури; збитки у випадку виникнення подібних захворювань бувають дуже великими. Проте більшість рослин мають свої власні природні механізми захисту від патогенних організмів. Природні різновиди опірності до рослинних патогенів визначено селекціонерами рослин і патологами та виведено у багатьох культурних рослинах. Ці гени природної опірності до хвороб часто забезпечують досить високі рівні опірності або імунітету до патогенів. Системна набута опірність (SAR) є одним з компонентів складної системи використання самих рослин для самозахисту від патогенів [публікація Hunt and Ryals, публікація Crit. Rev. in Plant Sci. 15, 583-606 (1996), посилання на яку наведено у цьому описі у всій її цілісності; Ryals et al., Plant Cell 8, 1809-1819 (1996), посилання на яку наведено у цьому описі у всій її цілісності). Див. також Патент США № 5,614,395, посилання на який наведено у цьому описі у всій його цілісності]. SAR є особливо важливим аспектом імунних відповідей рослин на вплив патогенів, оскільки вона являє собою індуковану патогеном системну опірність до широкого спектра інфекційних агентів, включаючи віруси, бактерії та грибкові організми. Коли шлях трансдукції сигналу SAR заблокований, рослини стають більш сприйнятливими до патогенів, що зазвичай викликають захворювання, а також стають сприйнятливими до деяких інфекційних агентів, які за нормальних умов не викликали би захворювання [Gaffney et al., Science 261, 754-756 (1993), посилання на яку наведено у цьому описі у всій її цілісності; Delaney et al., Science 266, 1247-1250 (1994), посилання на яку наведено у цьому описі у всій її цілісності; Delaney et al., Proc. Natl. Acad. Sci. USA 92, 6602-6606 (1995), посилання на яку наведено у цьому описі у всій її цілісності; Delaney, Plant Phys. 113, 5-12 (1997), посилання на яку наведено у цьому описі у всій її цілісності; Ві et al., Plant J. 8, 235-245 (1995), посилання на яку наведено у цьому описі у всій її цілісності; MauchMani and Slusarenko, Plant Cell 8, 203-212 (1996), посилання на яку наведено у цьому описі у всій її цілісності]. Ці результати спостережень свідчать про те, що шлях трансдукції сигналу SAR є критичним з погляду на збереження здоров'я рослин. Концептуально імунну відповідь SAR можна розділити на дві фази. У початковій фазі патогенна інфекція розпізнається і вивільнюється сигнал, який проходить через флоему до віддалених тканин. Цей системний сигнал сприймається цільовими клітинами, які реагують шляхом експресії як генів SAR, так і опірності до захворювання. Фаза збереження SAR триває певний період часу, від кількох тижнів до цілого періоду життя рослини, протягом якого рослина знаходиться у напівстійкому становищі, і опірність до захворювання зберігається [Ryals et al., 1996]. Виявляється, що накопичення саліцилової кислоти (SA) є необхідним для трансдукції сигналу SAR. Рослини, які не можуть акумулювати SA через обробку специфічними інгібіторами, епігенетичну репресію ліази фенілаланінового аміаку, або трансгенну експресію саліцилатгідроксилази, яка специфічно розщеплює SA, також не можуть індукувати ні експресію генів SAR, ані опірність до захворювання [Gaffney et al., 1993; Delaney et al., 1994; Mauch-Mani and Slusarenko 1996; Maher et al., Proc. Natl. Acad. Sci. USA 91, 7802-7806 (1994), посилання на яку наведено у цьому описі у всій її цілісності; Pallas et al., Plant J. 10, 281-293 (1996), посилання на яку наведено у цьому описі у всій її цілісності]. Хоча було висловлено припущення стосовно того, що SA можуть відігравати роль системного сигналу, у даний час це є спірним питанням, і на поточний момент часу точно відомо лише те, що якщо SA не може акумулюватися, трансдукція сигналу SAR блокується [Pallas et al., 1996; Shulaev et al., Plant Cell 1, 1691-1701 (1995), посилання на яку наведено у цьому описі у всій її цілісності; Vernooij et al., Plant Cell 6, 959-965 (1994), посилання на яку наведено у цьому описі у всій її цілісності]. Останнім часом з'ясовано, що Arabidopsis відіграє роль системи моделювання для дослідження SAR [Uknes et al., Plant Cell 4, 645-656 (1992), посилання на яку наведено у цьому описі у всій її цілісності; Uknes et al., Моl. Plant-Microbe Interact. 6, 692-698 (1993), посилання на яку наведено у цьому описі у всій її цілісності; Cameron et al., Plant J. 5, 715-725 (1994), посилання на яку наведено у цьому описі у всій її цілісності; Mauch-Mani and Slusarenko, Моl. Plant-Microbe Interact. 7, 378-383 (1994), посилання на яку наведено у цьому описі у всій її цілісності; Dempsey and Klessig, Bulletin de L'lnstitut Pasteur93, 167-186 (1995), посилання на яку наведено у цьому описі у всій її цілісності]. Доведено, що SAR активують в Arabidopsis як патогенами, так і хімічними реагентами, такими як SA, 2,6-дихлорізонікотинова кислота (ΙΝΑ) та бензо[1,2,3]тіадіазолу-7-карботіокислоти-S-метиловий естер (ВТН) [Uknes et al., 1992; Vernooij et al., Моl. Plant-Microbe interact. 8, 228-234 (1995), посилання на яку наведено у цьому описі у всій її цілісності; Lawton et al., Plant J. 10, 71-82 (1996), посилання на яку наведено у цьому описі у всій її цілісності]. Після обробки ΙΝΑ, або ВТН, або зараженням патогеном, принаймні три пов'язані з патогенезом гени білка, а саме PR-1, PR-2 та PR-5, відповідно індукуються одночасно з початком створення [Uknes et al., 1992, 1993]. Для тютюну (найбільш охарактеризовані види) обробка патогеном або імунізаційною сполукою індукує експресію принаймні дев'яти наборів генів [Ward et al., Plant Cell 3, 1085-1094 (1991), посилання на яку наведено у цьому описі у всій її цілісності]. Трансгенні стійкі до захворювань рослини створено шляхом трансформування рослин різними генами SAR [Патент США № 5,614,395]. Було виділено кілька мутантів Arabidopsis, які модифікували сигнал трансдукції SAR [Delaney, 1997] Перші з цих мутантів являли собою так звані мутанти Isd (lesion simulating disease - захворювання, що модулюють ураження) та acd2 (accelerated cell death - прискорена смерть клітин) [Dietrich et al., Cell 11, 565-577 (1994), посилання на яку наведено у цьому описі у всій її цілісності; Greenberg et al., Cell 11, 551-563 (1994), посилання на яку наведено у цьому описі у всій її цілісності]. Для всіх цих мутантів спостерігається деяке утворення спонтанних некротичних уражень на листках, збільшення концентрації SA, накопичення мРНК для генів SAR, a також значне посилення опірності до захворювання. Було виділено і описано принаймні сім різних мутантів Isd [Dietrich et al., 1994; Weymann et al., Plant Cell 1, 2013-2022 (1995), посилання на яку наведено у цьому описі у всій її цілісності]. Інший цікавий клас мутантів - це мутанти cim (constitutive immunity - конститутивний імунітет) [Lawton et al., "The molecular biology of systemic acquired resistance" у Mechanisms of Defense Responses in Plants, B. Fritig and M. Legrand, eds (Dordrecht, The Netherlands: Kluwer Academic Publishers), pp. 422-432 (1993), посилання на яку наведено у цьому описі у всій її цілісності). Див. також Міжнародну заявку РСТ WO 94/16077, посилання на яку наведено у цьому описі у всій її цілісності]. Подібно до мутантів Isd та acd2, мутанти cim посилювали рівень SA та експресію генів SAR, а також опірність, але, на відміну від Isd або acd2, не відзначалися видимими ураженнями на листках. cpr1 (constitutive expresser of PR genes - конститутивний експресор генів PR) може являти собою тип мутанту cim; проте, оскільки не виключається присутність мікроскопічних уражень на листках срr1, срr1 може бути і мутантом типу Isd [Bowling et al., Plant Cell 6, 1845-1857 (1994), посилання на яку наведено у цьому описі у всій її цілісності]. Виділено також мутанти, які блокуються на шляху передачі сигналу SAR. ndr1 (неспецифічна для раси (штаму) опірність до захворювання) є мутантом, який зумовлює ріст як Pseudomonas syringae, що містить різноманітні гени авірулентності, так і звичайні авірулентні штами Peronospora parasitica [Century et al., Proc. Natl. Acad.Sci. USA 92, 6597-6601 (1995), посилання на яку наведено у цьому описі у всій її цілісності]. Очевидно, цей мутант заблокований на самому початку шляху передачі сигналу SAR. npr1 (nonexpresser of PB genes неекспресор генів PR) є мутантом, який не може індукувати експресію шляху передачі сигналу SAR після обробки ΙΝΑ [Cao et al., Plant Cell 6, 1583-1592 (1994), посилання на яку наведено у цьому описі у всій її цілісності]. Мутанти eds (підвищена сприйнятливість до захворювання) було виділено на підставі їхньої властивості підтримувати бактеріальне зараження після інокуляції бактерій у низькій концентрації [Glazebrook et al., Genetics 143, 973-982 (1996), посилання на яку наведено у цьому описі у всій її цілісності; Parker et al., Plant Cell 8, 20332046 (1996), посилання на яку наведено у цьому описі у всій ЇЇ цілісності]. Деякі мутанти eds з погляду на їхній фенотип дуже подібні до npr1, а останнім часом було виявлено, що eds5 та eds53 є алельними до npr1 [Glazebrook et al., 1996]. nim1 (noninducible immunity - неіндукований імунітет) є мутантом, який підтримує ріст P. parasitica (тобто агент, що викликає захворювання несправжньою борошнистою росою) після обробки ΙΝΑ [Delaney et al., 1995; W094/16077]. Хоча nim1 може акумулювати SA після зараження патогеном, він не може індукувати експресію генів SAR або опірність до захворювання, на підставі чого можна зробити припущення про те, що мутація блокує шлях «нижче» від SA. nim1 відзначається також послабленою властивістю реагувати на ΙΝΑ або ВТН, на підставі чого можна зробити припущення про те, що блок існує «нижче» від місця впливу цих хімічних агентів [Delaney et al., 1995; Lawton et al., 1996]. Останнім часом було виділено і описано два алельні гени Arabidopsis, мутанти яких відповідають за фенотипи nim1 та npr1, відповідно [Ryals et al., Plant Cell 9, 425-439 (1997), посилання на яку наведено у цьому описі у всій її цілісності; Cao et al., Cell 88, 57-63 (1997), посилання на яку наведено у цьому описі у всій її цілісності]. Природний генний продукт NIM1 включається до класичного шляху трансдукції сигналу, що призводить як до SAR, так і до опірності до захворювання «ген-на-ген» у Arabidopsis [Ryals et al., 1997]. Ryals et al., 1997 також повідомляють про виділення п'яти додаткових алелів nim1, що відзначаються діапазоном фенотипів - від трохи послаблених через хімічно індуковану генну експресію PR-1 та опірність до грибка - до сильно заблокованих. Трансформація природного гена NPR1 у мутанти npr1 не лише комплементувала мутації, що відновлюють реактивність індукції SAR щодо експресії гена PR та опірності до захворювання, але й робила трансгенні рослини більш опірними до зараження P. syringae за відсутністю індукції SAR [Cao et al., 1997]. Шляхи трансдукції сигналу NF-kΒ/ΙkΒ використовували для створення реакцій опірності до захворювання у діапазоні організмів від Drosophila до ссавців. У ссавців трансдукцію сигналу NF-kΒ/ΙkΒ можна індукувати за допомогою певних стимулюючих засобів, включаючи піддавання клітин впливу ліпополісахариду, фактора пухлинного некрозу, інтерлейкіну 1 (IL-1) або вірусного зараження [Baeuerle and Baltimore, Cell 87, 13-20 (1996); Baldwin, Annu. Rev. Immunol. 14, 649-681 (1996)]. Активізація шляху призводить до синтезу кількох факторів, які беруть участь у запальних та імунних реакціях, такі як IL-2, IL-6, IL-8 та фактора, що стимулює колонії гранулоцитів/макрофагів [deMartin et al., Gene 152, 253-255 (1995)]. У дослідах з трансгенними мишами знищення трансдукції сигналу NF-kB/IkB призводить до дефективної імунної реакції, включаючи посилення сприйнятливості до бактеріальних та вірусних патогенів [Beg and Baltimore, Science 274, 782-784 (1996); Van Antwerp et al., Science 274, 787-789 (1996); Wang et al., Science 274, 784-787 (1996); Baeuerle and Baltimore (1996)]. Для Arabidopsis SAR є функціонально аналогічною запаленню у тих нормальних процесах опірності, які стають можливими після активації SAR, що призводить до посилення опірності до захворювання [Ві et al., 1995; Cao et al., 1994; Delaney et al., 1995; Delaney et al., 1994; Gaffney et al., 1993; Mauch-Mani and Slusarenko 1996; Delaney, 1997]. Крім того, інактивація шляху призводить до посилення сприйнятливості до бактеріальних, вірусних та грибкових патогенів. До речі, було повідомлено про те, що SA блокує активацію NF-kΒ у клітинах ссавців [Корр and Ghosh, Science 265, 956-959 (1994)], у той час як SA активує трансдукцію сигналу в Arabidopsis. Бактеріальне зараження Drosophila активує класичний шлях трансдукції сигналу, що призводить до синтезу кількох протигрибкових білків, таких як церкропін В, дефензин, диптерицин та дрозоміцин [Ір et al., Cell 75, 753-763 (1993); Lemaitre et al., Ce// 86, 973-983 (1996)]. Ця індукція залежить від генного продукту dorsal та dif, двох гомологів NF-kΒ i репресується cactus, гомологом ІkВ, у мух. Мутанти, у яких спостерігається знижений синтез протигрибкових та протибактеріальних білків, відзначаються критично зниженою опірністю до зараження. Незважаючи на безліч проведених досліджень і застосування досить складних та інтенсивних заходів щодо захисту рослин, включаючи генетичне трансформування рослин, збитки через захворювання залишаються дуже значними і становлять мільярди доларів щорічно. Таким чином, існує постійна потреба розробляти та розвивати нові засоби щодо захисту, які ґрунтуються на постійному зростанні розуміння генетичної основи опірності до захворювання у рослин. З погляду на зазначене, у головному аспекті цей винахід стосується нового способу захисту рослин від шкідливого впливу патогенів через синергетичну опірність до захворювання, яку створюють за допомогою введення бактерициду в імуномодульовані рослини. Імуномодульованими рослинами є такі, в яких активують SAR, які зазвичай відзначаються більшою, ніж у природних різновидів, експресією генів SAR і, таким чином, розглядаються як рослини «зі створеною SAR» ("SAR-on"). Імуномодульовані рослини, що їх застосовують для реалізації способу, запропонованого у даному винаході, одержують принаймні трьома різними шляхами: шляхом введення у рослини хімічного індуктора SAR, такого як ВТН, ΙΝΑ or SA; шляхом використання програми селекційного виведення, згідно з яким рослини вибирають на основі конститутивної експресії генів SAR та/або стійкого до захворювань фенотипу; або шляхом застосування генної інженерії рослин через трансформування їх одним чи кількома генами SAR, такими як функціональна форма гена NIM1. Бактерицид, що його вводять у імуномодульовані рослини, може бути або стандартним бактерицидом, таким як фунгіцид металаксил, або - якщо його застосовують до імуномодульованих рослин, що їх одержують шляхом селекційного виведення чи генної інженерії - хімічним індуктором SAR, таким як ВТН, ΙΝΑ або SA. Імуномодулювання забезпечує певний рівень опірності до захворювання у рослині. Так само введення бактерициду в рослину забезпечує певний рівень опірності до захворювання. Очікуваний результат комбінування імуномодулювання із введенням бактерициду і буде являти собою той рівень контролю, що відображає додаткові рівні контролю, які забезпечуються конкретними способами створення опірності до захворювання. Проте за допомогою паралельного введення бактерициду в імуномодульовану рослину опірність до захворювання несподівано синергетично посилюється; отже, рівень опірності до захворювання виявляється більш високим, ніж очікувані додаткові рівні опірності до захворювання. Таким чином, цей винахід стосується культивування імуномодульованих рослин і введення в них відповідної кількості стандартного бактерициду. Найкращі варіанти реалізації винаходу стосуються рослин, що їх обробляють за допомогою способів генної інженерії з метою зробити їх такими, що містять та експресують функціональну форму гена NIM1 або його гомолог чи варіант. Спосіб винаходу дозволяє більш ефективно боротися з патогенами, ніж цього можна досягнути введенням імуномодулювання або бактерициду окремо. Імуномодулювання забезпечує певний рівень опірності до захворювання у рослині. Так само, введення бактерициду до рослини забезпечує певний рівень опірності до захворювання. Очікуваний результат комбінування імуномодулювання із введенням бактерициду і буде являти собою той рівень контролю, що відображає додаткові рівні контролю, які забезпечуються конкретними способами створення опірності до захворювання. Проте за допомогою паралельного введення бактерициду в імуномодульовану рослину, ефективність боротьби з патогенними захворюваннями несподівано синергетично посилюється; отже, рівень боротьби з захворюваннями виявляється більш високим, ніж очікувані додаткові рівні опірності до захворювання. Крім підвищеної опірності до захворювання, іншою перевагою цього винаходу є те, що спосіб цього винаходу для досягнення рівня опірності до захворювання потребує меншої кількості бактерициду, ніж у разі використання звичайних природних рослин. В результаті як знижуються економічні витрати на застосування бактерициду, так і зменшується вірогідність шкідливих для навколишнього середовища наслідків, причиною яких є токсичність деяких бактерицидів. Крім того, спосіб захисту рослини за цим винаходом - шляхом комбінування ефектів імуномодулювання та введення бактерициду - зумовлює продовження терміну протипатогенної дії і разом з цим зростання врожаїв сільськогосподарських культур. Інший перевагою запропонованого способу є те, що ці два об'єднані типи боротьби з патогенами є зовсім різними, і через це загроза розвитку опірності практично виключається. Таким чином, цей винахід стосується способу захисту рослини від шкідливого впливу патогенів через синергетичну опірність до захворювання, включаючи такі стадії як: (а) одержання імуномодульованої рослини, що має перший рівень опірності до захворювання; i (б) введення у згадані імунномодульовані рослини принаймні одного бактерициду, який створює другий рівень опірності до захворювання; (в) відповідне введення згаданого бактерициду в згадану імуномодульовану рослину створює синергетично посилений третій рівень опірності до захворювання, який є більшим, ніж сума першого та другого рівнів опірності до захворювання. Оптимальним є спосіб згідно з цим винаходом, за яким згадана імуномодульована рослина являє собою мутантну рослину з конститутивним імунітетом (cim). Зокрема, оптимальним є спосіб згідно з цим винаходом, за яким згадану мутантну рослину cim вибирають з популяції рослин із застосуванням таких стадій: (а) Оцінка експресії генів SAR у незаражених рослинах, які є з погляду на фенотип нормальними у згаданих незаражених рослинах з браком фенотипу гена-міміка ураження; і (б) Відбирання незаражених рослин, які конституційно експресують гени SAR за відсутності вірусного, бактеріального або грибкового зараження. Також оптимальним є спосіб згідно з цим винаходом, за яким згадана імуномодульована рослина є мутантною рослиною з геном-міміком ураження. Зокрема, оптимальним є спосіб згідно з цим винаходом, за яким згадану мутантну рослину з геном-міміком ураження вибирають з популяції рослин із застосуванням таких стадій:(а) Оцінка експресії генів SAR у незаражених рослинах, що мають фенотип гена-міміка ураження; і (б) Відбирання незаражених рослин, які конституційно експресують гени SAR за відсутності вірусного, бактеріального або грибкового зараження. Також оптимальним є спосіб згідно з цим винаходом, за яким згадану імуномодульовану рослину одержують шляхом рекомбінантної експресії у рослині гена SAR. Зокрема, оптимальним є спосіб згідно з цим винаходом, за яким згаданий ген SAR являє собою функціональну форму гена NIM1. Кращим є спосіб згідно з цим винаходом, за яким згаданий ген NIM1 кодує білок NIM1, залучений до класичного шляху трансдукції сигналу, що призводить до створення системної набутої опірності у рослинах. Найкращим є спосіб згідно з цим винаходом, за яким згаданий білок NIM1 містить амінокислотну послідовність, що її позначено як ПОСЛ. ІД №:2. Найкращим є спосіб згідно з цим винаходом, за яким згаданий ген NIM1 гібридизується у кодувальну послідовність ПОСЛ. ІД №:1 за таких умов: гібридизація у 1%BSA; 520мМ NaPO4, pH7,2; 7% лаурилсульфат, натрієва сіль; 1мМ ЕДТК; 250мМ хлорид натрію при 55°С протягом 18-24год, і промивання в 6XSSC (розчин хлориду та цитрату натрію) протягом 15хв. (Х3) 3XSSC протягом 15хв. (Х1) при 55°С. Найкращим є спосіб згідно з цим винаходом, за яким згаданий ген NIM1 містить кодувальну послідовність ПОСЛ. ІД №:1, і під час гібридизації з нею усіх молекул ДНК використовують помірковано жорсткі умови. Зокрема, оптимальним є спосіб згідно з цим винаходом, за яким згаданий ген SAR кодує змінену форму білка NIM1, що діє як домінантно-негативний регулятор шляху трансдукції сигналу SAR. Кращим є спосіб згідно з цим винаходом, за яким згадана змінена форма білка NIM1 має аланіни замість серпнів у амінокислотних положеннях, що відповідають положенням 55 та 59 ПОСЛ. ІД №:2. Найкращим є спосіб згідно з цим винаходом, за яким згадана змінена форма білка NIM1 містить амінокислотну послідовність, що її позначено як ПОСЛ. ІД №:8. Найкращим є спосіб згідно з цим винаходом, за яким згадана молекула ДНК містить нуклеотидну послідовність, що її позначено як ПОСЛ. ІД №:7, і для гібридизації з нею всіх молекул ДНК використовують помірковано жорсткі умови. Найкращим є спосіб згідно з цим винаходом, за яким згадана молекула ДНК гібридизується з нуклеотидною послідовністю ПОСЛ ІД №:7 за таких умов: гібридизація у 1%BSA; 520мМ NaPO4, pH7,2; 7% лаурилсульфат, натрієва сіль; 1мМ ЕДТК; 250мМ хлорид натрію при 55°С протягом 18-24 год, і промивання в 6XSSC протягом 15мМ. (Х3) 3XSSC протягом 15хв. (Х1) при 55°С. Найкращим є спосіб згідно з цим винаходом, за яким згадана змінена форма білка NIM1 має N-термінальне зрізання амінокислот, що приблизно відповідає положенням амінокислот 1-125 у ПОСЛ. ІД №:2. Найкращим є спосіб згідно з цим винаходом, за яким згадана змінена форма білка NIM1 містить амінокислотну послідовність, що її позначено як ПОСЛ. ІД №:10. Найкращим є спосіб згідно з цим винаходом, за яким згадана молекула ДНК містить нуклеотидну послідовність, що її позначено як ПОСЛ. ІД №:9, і для гібридизації з нею всіх молекул ДНК використовують помірковано жорсткі умови. Найкращим є спосіб згідно з цим винаходом, за яким згадана молекула ДНК гібридизується з нуклеотидною послідовністю ПОСЛ ІД №:9 за таких умов: гібридизація у 1%BSA; 520мМ NaPO4, pH7,2; 7% лаурилсульфат, натрієва сіль; 1мМ ЕДТК; 250мМ хлорид натрію при 55°С протягом 18-24 год, і промивання в 6XSSC протягом 15в. (Х3) 3XSSC протягом 15хв. (Х1) при 55°С. Найкращим є спосіб згідно з цим винаходом, за яким згадана змінена форма білка NIM1 має С-термінальне зрізання амінокислот, що приблизно відповідає положенням амінокислот 522-593 у ПОСЛ. ІД №:2. Найкращим є спосіб згідно з цим винаходом, за яким згадана змінена форма білка NIM1 містить амінокислотну послідовність, що її позначено як ПОСЛ. ІД №:12. Найкращим є спосіб згідно з цим винаходом, за яким згадана молекула ДНК містить нуклеотидну послідовність, що її позначено як ПОСЛ. ІД №:11, і для гібридизації з нею всіх молекул ДНК використовують помірковано жорсткі умови. Найкращим є спосіб згідно з цим винаходом, за яким згадана молекула ДНК гібридизується з нуклеотидною послідовністю ПОСЛ ІД №:11 за таких умов: гібридизація у 1%BSA; 520мМ NaPO4, pH7,2; 7% лаурилсульфат, натрієва сіль; 1мМ ЕДТК; 250мМ хлорид натрію при 55°С протягом 18-24год; і промивання у 6XSSC протягом 15хв. (Х3) 3XSSC протягом 15хв. (Х1) при 55°С. Кращим є спосіб згідно з цим винаходом, за яким згадана змінена форма білка NIM1 має N-термінальне зрізання амінокислот, що приблизно відповідає положенням амінокислот 1-125 ПОСЛ. ІД №:2 і С-термінальне зрізання амінокислот, що приблизно відповідає положенням амінокислот 522-593 ПОСЛ. ІД №:2. Найкращим є спосіб згідно з цим винаходом, за яким згадана змінена форма білка NIM1 містить амінокислотну послідовність, що її позначено як ПОСЛ. ІД №:14. Найкращим є спосіб згідно з цим винаходом, за яким згадана молекула ДНК містить нуклеотидну послідовність, що її позначено як ПОСЛ. ІД №:13 і для гібридизації з нею всіх молекул ДНК використовують помірковано жорсткі умови. Найкращим є спосіб згідно з цим винаходом, за яким згадана молекула ДНК гібридизується з нуклеотидною послідовністю ПОСЛ ІД №:13 за таких умов: гібридизація у 1%BSA; 520мМ NaPO4, pH7,2; 7% лаурилсульфат, натрієва сіль; 1мМ ЕДТК; 250мМ хлорид натрію при 55°С протягом 18-24 год, і промивання в 6XSSC протягом 15хв. (Х3) 3XSSC протягом 15хв. (Х1) при 55°С. Найкращим є спосіб згідно з цим винаходом, за яким згадана змінена форма білка NIM1 складається, головним чином, з анкіринових мотивів, що приблизно відповідають положенням амінокислот 103-362 у ПОСЛ. ІД №:2. Найкращим є спосіб згідно з цим винаходом, за яким згадана змінена форма білка NIM1 містить амінокислотну послідовність, що її позначено як ПОСЛ. ІД №:16. Найкращим є спосіб згідно з цим винаходом, за яким згадана молекула ДНК містить нуклеотидну послідовність, що її позначено як ПОСЛ. ІД №:15, і для гібридизації з нею всіх молекул ДНК використовують помірковано жорсткі умови. Найкращим є спосіб згідно з цим винаходом, за яким згадана молекула ДНК гібридизується з нуклеотидною послідовністю ПОСЛ ІД №:15 за таких умов: гібридизація у 1%BSA; 520мМ NaPO4, pH7,2; 7% лаурилсульфат, натрієва сіль; 1мМ ЕДТК; 250мМ хлорид натрію при 55°С протягом 18-24 год, і промивання в 6XSSC протягом 15хв. (Х3) 3XSSC протягом 15хв. (Х1) при 55°С. Прикладами цільових культур для вказаних зон використання, розкритих у цьому описі, є, крім інших, такі види рослин: злакові (кукурудза, пшениця, ячмінь, жито, овес, рис, сорго та споріднені культури); буряк (цукровий та кормовий); гранати, кісточкові та соковиті плоди (яблука, груші, сливи, персики, мигдаль, вишні, суниці, малина і чорна смородина); бобові рослини (боби, сочевиці, горохові, соєві); олійні рослини (рапс, гірчиця, мак, маслини, соняшники, кокос, рослини-джерела рицинової олії, какао-боби, земляні горіхи); огіркові рослини (кабачки, огірки, дині); волокнисті рослини (бавовна, льон, коноплі, джут); цитрусові плоди (апельсини, лимони, грейпфрути, мандарини); овочі (шпинат, салат, спаржа, капуста, морква, цибуля, помідори, картопля, стручковий червоний перець); лаврові (авокадо, кориця, камфора); або такі рослини, як тютюн, горіхи, кава, цукрова тростина, чай, виноград, хміль, банани та природні каучуконосні рослини, а також декоративні рослини (квіти, кущі, широколисті дерева та вічнозелені рослини, наприклад, хвойні). Цим переліком цільові рослини не обмежуються. Спосіб цього винаходу застосовують для створення опірності до найрізноманітніших рослинних патогенів, до яких належать, крім іншого: віруси або віроїди, такі як мозаїчний вірус тютюну або огірків, вірус кільцевої плямистості або вірус некрозу, вірус скручування листків герані, вірус крапчастості конюшини лугової, вірус затримки росту кущів помідорів та інші віруси; аскоміцетові грибки, такі як роди Venturia, Podosphaera, Erysiphe, Monolinia, Mycosphaerella та Uncinula; базидіоміцетові грибки, такі як представники родів Hemilria, Rhizoctonia та Puccinia; Fungi imperfecti (недосконалі грибки), такі як роди Botrytis, Helminthosporium, Rhynchosponium, Fusarium (тобто F. monoliforme), Septoria, Cercospora, Altemaria, Pyricularia та Pseudocercosporella (тобто F. herpotrichoides); ооміцетові грибки, такі як представники родів Phytophthora (тобто P. parasitica), Peronospora (тобто P. tabacina), Bremia, Pythium та Plasmopara; a також інші грибки, такі як Scleropthora macrospora, Sclerophthora rayissiae, Sclerospora graminicola, Peronosclerospora sorghi, Peronoscterospora philippinensis, Peronosclerospora sacchari та Peronosclerospora maydis, Physopella zeae, Cercospora zeae-maydis, Colletotrichum graminicola, Gibberella zeae, Exserohilum turcicum, Kabatiellu zeae та Bipolahs maydis; бактерії, такі як Pseudomonas syringae, Pseudomonas tabaci та Erwinia stewartir, комахи, такі як попелиці, наприклад, Myzus persicae; лускокрилі, такі як Heliothus spp.; нематоди, такі як Meloidogyne incognita. Одержання імуномодульованих рослин Усі три наведені нижче загальні шляхи одержання імуномодульованих рослин взаємопов'язані тим, що всіх їх пристосовано до моделі шляху трансдукції сигналу SAR, описаного у [Ryals et al., (1996)]. Під час активування шляху трансдукції сигналу SAR з метою досягнення опірності до захворювання «включається» один і той самий набір генів SAR, і опірність до захворювання створюється незалежно від того, який з трьох описаних нижче шляхів обирають. Різниця між цими трьома шляхами полягає лише у тому, яка точка шляху SAR включається; кінцевий результат однаковий для усіх трьох шляхів. Таким чином, аналізи та результати дослідження імуномодульованих рослин, одержаних одним шляхом, можна екстраполювати та застосовувати до імуномодульованих рослин, одержаних іншим шляхом. А. Застосування хімічного індуктора системної набутої опірності (SAR) Перший шлях одержання імуномодульованих рослин передбачає введення у рослину хімічного агента, здатного індукувати SAR. Зокрема, потужними хімічними індукторами SAR є бензотіадіазоли, такі як бензо[1,2,3]тіадіазол-7-карботіокислоти-S-метиловий естер (ВТН). Похідні бензотіадіазолів, що їх далі використовують як регулятори, описано у [патентах США №№ 5,523,311 та 5,614,395, посилання на які наведено у цьому описі]. Індуковану ВТН SAR, яка у польових умовах забезпечує захист від широкого спектру захворювань для різноманітних культурних рослин, детально описано у [Freidrich et al., Plants Journal 10(1), 61-70 (1996); Lawton et al., Plants Journal 10(1), 71-82 (1996); і Gorlach et al., Plant Cell 8, 629-643 (1996), причому посилання на кожну з цих публікацій наведено у тексті цього опису]. До інших хімічних індукторів SAR, що їх використовують для одержання імуномодульованих рослин за способом цього винаходу, належать сполуки ізонікотинової кислоти, такі як 2,6-дихлорізонікотинова кислота (ΙΝΑ) та її нижчі алкільні естери, а також сполуки саліцилової кислоти (SA). Приклади відповідних сполук ΙΝΑ та SA описано у [Патенті США№ 5,614,395]. Б. Відбір мутантних рослин з конститутивним імунітетом (СІМ). Другий шлях одержання імуномодульованих рослин являє собою програму селективного відбору на основі таких ознак, як конститутивна експресія генів SAR та/або стійкий до захворювань фенотип. Численні дані вказують на тісні корелятивні зв'язки між експресією генів SAR та власне системною набутою опірністю [Ward et al. (1991); Uknes et al. (1992); Uknes et al. (1993); Lawton, et al. (1993); і Alexander et al. (1993) PNAS USA 90, 73277331, на які у цьому описі наведено посилання]. У Arabidopsis прикладами добре вивчених генів SAR є PR-1, PR-2 та PR-5, причому PR-1 експресується на максимальному рівні з мінімальним фоном. З метою ідентифікації та відбору рослин, які конституційно експресують гени SAR, проводять нозернблотинговий аналіз, що дозволяє виявити експресію генів SAR. Відомі послідовності ДНК SAR застосовують у експериментах з перехресною гібридизацією, як це описано у [Uknes et al. (1992)]. Способи гібридизації та клонування послідовностей нуклеїнових кислот є добре відомими фахівцям. [Див., наприклад, Molecular Cloning, A Laboratory Manual, 2nd Edition, Vol. 1-3, Sambrook ei ai. (eds.) Cold Spring Harbor Laboratory Press (1989), а також наведені в них посилання]. Було виділено принаймні два класи мутантів сигнальної трансдукції SAR, які конституційно експресують гени SAR. Один з класів було названо мутантами "lsd" (Isd = lesion simulating disease = захворювання з імітацією ураження), що їх також називають мутантами "Клас І cim". [Див. WO 94/16077]. Мутанти Isd (Клас І cim) утворюють спонтанні ураження на листках, сприяють накопиченню високих концентрацій SA, високих рівнів мРНК PR-1, PR-2 та PR-5, а також є опірними до грибкових та бактеріальних патогенів [Dietrich et al., 1994; Weymann et al., 1995]. Другий клас було названо мутантами "cim" (cim = мутанти з конститутивним імунітетом), що їх також називають мутантами "Клас II cim". [Див. WO 94/16077]. cim мутанти мають усі характерні риси мутантів Isd, за винятком спонтанних уражень. Тобто мутанти cim є візуально нормальними щодо фенотипу. Оскільки відбирають рослини, які конституційно експресують гени SAR, їх застосовують у програмах селекції з метою впровадження конститутивної експресії генів SAR та опірності до патогенів у клітинні лінії рослин. Нащадків для подальшого схрещування вибирають на підставі оцінки експресії генів SAR та опірності до захворювання, а також за іншими характеристиками, що мають суттєве значення для створення мутантів та якості цього процесу, відповідно до способів, добре відомих фахівцям у галузі селекції рослин. Наприклад, через те, що мутанти Isd відзначаються утворенням уражень та некрозу, мутантам cim з їхніми нормальними фенотипами віддають перевагу щодо використання у таких програмах відбору і у реалізації способу цього винаходу, хоча за бажанням можна використовувати також мутанти Isd. С. Трансформування рослин генами SAR Третій шлях одержання імуномодульованих рослин являє собою трансформування рослин геном SAR, в оптимальному варіанті функціональною формою гена NIM1. 1. Рекомбінантна експресія природного гена NIM1 Рекомбінантна надекспресія природної форми NIM1 (ПОСЛ. ІД №:1) призводить до утворення трансгенних рослин з фенотипом, що відзначається опірністю до захворювань. [Див. спільну патентну заявку США, реєстраційний номер 08/880,179, посилання на яку наведено у цьому описі]. Підвищені рівні активного білка NIM1 створюють такий самий ефект опірності до захворювання, як і хімічна індукція із залученням таких хімічних агентів, як ВТН, ΙΝΑ та SA. В оптимальному варіанті експресія гена ΝΙΜ1 утримується на рівні, який принаймні у два рази перевищує рівень експресії гена ΝΙΜ1 у природних рослинах, а у кращому варіанті - принаймні у десять разів перевищує рівень природної експресії. У наведеному нижче розділі, названому "Технологія з використанням рекомбінантної ДНК", описано протоколи, що їх використовують для рекомбінантного експресування природного гена ΝΙΜ1 у трансгенних рослинах, на рівнях, вищих ніж природні. В іншому варіанті реалізації винаходу рослини трансформують природним геном NPR1 з метою одержання опірних до захворювань рослин, як це описано у [Cao, et a/. (1997)]. 2. Рекомбінантна експресія зміненої форми гена NIM1. Імуномодульовані рослини, що їх використовують за способом цього винаходу, створюють також за допомогою рекомбінантної експресії зміненої форми гена NIM1, у зв'язку з чим зміна гена NIM1 передбачає як визнання того, що шлях SAR у рослинах відзначається функціональними паралелями зі схемою регуляції NFkΒ/ΙΒ у ссавців та мух, так і виявлення того, що генний продукт NIM1 є структурним гомологом підкласу a фактора ІkВ сигналу трансдукції у ссавців. [Див. спільну заявку РСТ "METHODS OF USING THE NIM1 GENE TO CONFER DISEASE RESISTANCE IN PLANTS", посилання на яку наведено у цьому описі.] Послідовність гена NIM1 (ПОСЛ. ІД №:1) використовували у дослідженнях BLAST, і підхожі ідентифікували на основі таких ознак, як гомологія одного достатньо високостабілізованого домену у послідовності гена NIM1 з доменами що їх було виявлено у цілій низці таких білків, як спектрини, анкірини, NF-ІkВ та ІkВ [Michaely and Bennett, Trends Cell Biol. 2, 127-129 (1992)]. Проводили попарний візуальний аналіз білка NIM1 (ПОСЛ. ІД №:2) з 70 відомими анкірин-вмісними білками, завдяки чому було виявлено разючу подібність до членів класу ІkВa регуляторів транскрипції [Baeuerle and Baltimore 1996; Baldwin 1996]. Як видно на Фіг.1, білок NIM1 (ПОСЛ. ІД №:2) є у значній мірі гомологічним із білками ІkВa з тканин мишей, щурів та свиней (ПОСЛ. ІД №№: 3, 4 та 5, відповідно). NIM1 містить декілька важливих структурних доменів ІkВa по всій довжині білка, включаючи домени анкірину (вказано пунктирним підкресленням на Фіг.1), 2 амінотермінальні серини (амінокислоти 55 та 59 NIM1), пару лізинів (амінокислоти 99 та 100 у NIM1) і кислотний С-термінал. У цілому NIM1 та Іk Вa є ідентичними у 30% залишків і мають консервативні заміщення у 50% залишків. Таким чином, між білками ІkВa та NIM1 спостерігається гомологія із сумарною часткою подібності 80%. Одним зі способів функціонування білка ІkВa у трансдукції сигналу є зв'язування із цитозольним фактором транскрипції NF-kΒ i запобігання його входженню в ядро і зміні транскрипції цільових генів [Baeuerle and Baltimore, 1996; Baldwin, 1996]. Цільові гени NF-kΒ регулюють (стимулюють або інгібують) деякі клітинні процеси, включаючи противірусні, протимікробні та клітинознищувальні реакції [Baeuerle and Baltimore, 1996]. Коли активують шлях трансдукції сигналу, ІkВa фосфорилують у двох серинових залишках (амінокислоти 32 та 36 мишачого ІkВa). Це програмує розповсюдження на подвійному лізині (амінокислоти 21 та 22 мишачого ІkВa). Після розповсюдження комплекс NF-kΒ/ΙkΒ проводять через протеосому, де ІkВa розщеплюють, a NF-ΙkΒ вивільнюється у ядро. Фосфориловані серинові залишки, які є важливими для функції ІkВa, консервують у NIM1 у межах великого суміжного блоку консервованої послідовності від амінокислоти 35 до 84 (Фіг.1). На відміну від ІkВa, де подвійний лізин займає приблизно 15 амінокислот у напрямку до N-терміналу білка, у NIM1 подвійний лізин займає приблизно 40 амінокислот у напрямку до С-термінального закінчення. Крім того високий ступінь гомології існує між NIM1 та ІkВa у збагаченій серином/треоніном карбокси-термінальній ділянці, яка виявилася важливою у головному кругообігу речовини [Sun et al., Моl. Cell. Biol. 16, 1058-1065 (1996)]. Згідно з цим винаходом на підставі аналізу структурної гомології та присутності елементів, відомих як важливі для функції ІkВa, очікується, що NIM1 функціонуватиме як ІkВa, що справляє аналогічний вплив на регуляцію гена рослини. Прогнозують, що рослини, які містять природний ген NIM1, за умови обробки хімічними індукторами матимуть більше генного продукту NIM1 (гомолог ІkВ) або менше фосфорилування генного продукту NIM1 (гомолог ІkВ). Відповідно до цієї моделі, результат полягає у тому, що рослинний гомолог NF-kΒ утримується поза ядром, і з'являється можливість експресії генів SAR та реакцій опірності. У мутантних рослинах nim1 присутній нефункціональний генний продукт NIM1. Таким чином, відповідно до цієї моделі гомолог NF-kΒ може вільно входити у ядро та репресувати опірність та експресію генів SAR. У цілковитому узгодженні з цією ідеєю клітини тварин, що їх оброблено саліциловою кислотою, відзначаються підвищеною стійкістю/відносним вмістом ІkВ та зменшенням активного NF-kΒ у ядрі [Корр and Ghosh, 1994]. Відомими є мутації ІkВ, що діють як суперрепресори або домінант-негативи [Britta-Mareen Traenckner et al., EMBO 14: 2876-2883 (1995); Brown et al., Science 267: 1485-1488 (1996); Brockman et al., Molecular and Cellular Biology 15: 2809-2818 (1995); Wang et al., Science 274: 784-787 (1996)]. Ці мутантні форми ІkВ зв'язуються із NF-kВ, але не фосфорилуються або убіквітинуються і, таким чином, не розщеплюються. NF-kΒ залишається зв'язаним із ІkВ і не може пересуватися в ядро. З погляду на зазначене, можна створювати змінені форми NIM1, що діють як домінантно-негативні регулятори шляху трансдукції сигналу SAR. Рослини, що їх трансформовано цими домінантно-негативними формами NIM1, мають протилежний фенотип щодо мутантних рослин NIM1 у тому розумінні, що рослини, які трансформовано зміненими формами NIM1, відзначаються конститутивною експресією генів SAR і, таким чином, фенотипом СІМ, себто трансгенні рослини імуномодулюються. Через положення, яке ген NIM1 займає в каналі трансдукції сигналу SAR, можна зробити припущення, що певна кількість змін гена, крім конкретно розкритих у цьому описі, призведуть до конститутивної експресії генів SAR і, таким чином, до утворення фенотипу СІМ. У наведеному нижче розділі, названому "Технологія з використанням рекомбінантної ДНК", описано протоколи, що їх використовують для рекомбінантного експресування змінених форм гена NIM1 у трансгенних рослинах, на рівнях, вищих ніж природні. Далі за текстом описано декілька змінених форм гена NIM1, що діють як домінантнонегативні регулятори шляху трансдукції сигналу SAR. а. Зміна залишків серину 55 та 59 на залишки аланіну: Фосфорилування залишків серину у ІkВa з організму людини є необхідним для стимульованого подразником розщеплення ІkВa, який у свою чергу активує NF-kΒ. Мутагенез залишків серину (S32 та S36) у ІkВa з організму людини з утворенням залишків аланіну інгібує індуковане подразником фосфорилування, блокуючи у такий спосіб опосередковане протеосомою розщеплення ІkВa [Traenckner et al, 1995; Brown et al., 1996; Brockman et a/., 1995; Wang et al., 1996]. Ця змінена форма ІkВa може функціонувати як домінантно-негативна форма за рахунок збереження NF-kВ у цитоплазмі, і таким чином, блокування подій шляху передачі сигналу "знизу". На підставі порівняння амінокислотних послідовностей між NIM1 та ІkВ, відображеного на Фіг.1, можна визначати, що серини 55 (S55) та 59 (S59) у NIM1 (ПОСЛ. ІД №:2) є гомологічними щодо S32 та S36 у ІkВa з організму людини. З метою створення домінантно-негативних форм NIM1 серини у положеннях амінокислот 55 та 59 піддають мутагенезу з утворенням залишків аланіну. Таким чином, у оптимальному варіанті реалізації винаходу ген NIM1 змінюють таким чином, щоб кодований продукт мав аланіни замість серпнів у положеннях амінокислот, що відповідають положенням 55 та 59 амінокислотної послідовності NIM1 (ПОСЛ. ІД №:2) у Arabidopsis. б. N-термінальна делеція: Делеція амінокислот 1-36 [Brockman et al., 1995; Sun et al., 1996] або 1-72 [Sun et al., 1996] у ІkВa з організму людини, яка включає лізинові залишки розповсюдження К21 та К22, а також сайти фосфорилування S32 та S36, призводить до утворення домінантно-негативного фенотипу ІkВa у трансфікованих клітинних культурах з організму людини. N-термінальна делеція перших 125 амінокислот генного продукту ΝΙΜ1 видалить вісім лізинових залишків, що можуть слугувати як сайти розповсюдження, а також передбачувані сайти фосфорилування у розглянутих вище S55 та S59. Отже у оптимальному варіанті реалізації винаходу ген ΝΙΜ1 змінюють таким чином, щоб у кодованому продукті пропускалися приблизно перші 125 амінокислоти у порівнянні з нативною амінокислотною послідовністю ΝΙΜ1 з Arabidopsis (ПОСЛ. ІД №:2). в. С-термінальна делеція: Делеція амінокислот 261-317 у ІkВa з організму людини призводить до посилення власної стійкості через блокування конститутивного фосфорилування залишків серину та треоніну у С-терміналі. Передбачається, що ця змінена форма ІkВa функціонуватиме як домінантно-негативна форма. Збагачена серином та треоніном ділянка є присутньою в амінокислотах 522-593 у С-терміналі NIM1. Таким чином, у оптимальному варіанті реалізації винаходу ген NIM1 змінюють таким чином, щоб у кодованому продукті була пропущена ділянка, яка приблизно відповідає С-термінальній його частині, включаючи амінокислоти 522-593, у порівнянні з нативною амінокислотною послідовністю NIM1 у Arabidopsis (ПОСЛ. ІД №:2). г. Химера N-термінальної/С-термінальної делеції і домени анкірину. Змінені форми генного продукту NIM1 також одержують в результаті С-термінальної та N-термінальної сегментарних делецій або химер. В ще одному варіанті реалізації цього винаходу одержують конструкти, що містять домени анкірину з гена NIM1. 3. Рекомбінантна експресія інших генів SAR Імуномодульовані рослини, що їх використовують за способом цього винаходу, створюють також за допомогою рекомбінантної експресії різних генів SAR, таких, як описано у [Ward et al. (1991)]. Див., наприклад, [патент США № 5,614,395], де описано опірні до захворювань рослини, створюваних з використанням надекспресії одного або кількох генів PR-білка. Хоча йдеться конкретно про рекомбінантну експресію форм гена NIM1, у наведеному нижче розділі, названому "Технологія з використанням рекомбінантної ДНК", описано протоколи, що їх використовують також для рекомбінантного експресування інших генів SAR, такі як гени PRбілка у трансгенних рослинах, на рівнях, вищих ніж природні. Технологія з використанням рекомбінантної ДНК Природну або змінену форму гена NIM1, що надає рослинам опірності до захворювань шляхом посилення експресії генів SAR, вводять у клітини рослин за допомогою стандартної рекомбінантної технології ДНК. Зазвичай це передбачає вставлення молекули ДНК, що кодує вибрану форму NIM1, що її описано вище, в експресійну систему, з якою молекула ДНК є гетерологічною (тобто, як правило, не є присутньою), з використанням відомих у галузі стандартних процедур клонування. Вектор містить елементи, які є необхідними для транскрипції та трансляції вставлених послідовностей, що кодують білок. Використовують велику кількість відомих у галузі векторних систем, таких як плазміди, бактеріофагові віруси та інші модифіковані віруси. До відповідних векторів належать, крім іншого, вірусних вектори, такі як лямбда-векторні системи lgtl1, lgtl0 та Charon 4; плазмідні вектори, такі як рВІ121, pBR322, pACYC177, pACYC184, ряд pAR, рКК223-3, pUC8, pUC9, pUC18, pUC19, pLG339, pRK290, pKC37, pKC101, pCDNAII та інші аналогічні системи. Компоненти експресійної системи також модифікують з метою збільшення експресії. Наприклад, застосовують зрізані послідовності, заміщення нуклеотидів або інші модифікації. Експресійні системи, що їх описано у цьому тексті, використовують для трансформування клітини практично будь-якої культурної рослини за відповідних умов. Трансформовані клітини регенерують у цілі рослини, так що вибрана форма гена NIM1 активує SAR у трансгенних рослинах. А. Структура касет експресії рослин Послідовності генів, призначені для експресії у трансгенних рослинах, спочатку об'єднують у касетах експресії за відповідним промотором, придатним для експресії у рослинах. Касети експресії можуть також містити будь-які додаткові послідовності, потрібні або вибрані для експресії трансгена. До таких послідовностей належать, крім іншого, термінатори транскрипції, зовнішні послідовності для посилення експресії, такі як інтрони, життєво важливі послідовності та послідовності, призначені для спрямування генного продукту у специфічні органели та відділи клітин. Ці касети експресії далі легко передаються у вектори трансформації рослин, що їх описано infra. Нижче наведено опис різних компонентів типової касети експресії. 1. Промотори Вибір промотора, використовуваного у касетах експресії, визначатиме просторову та часову характеристику експресії трансгена у трансгенних рослинах. Вибрані промотори експресуватимуть трансгени у специфічних типах клітин (таких як епідермальні клітини листків, мезофільні клітини, клітини кори коріння), або у специфічних тканинах чи органах (наприклад, у корінні, листках або квітках), а вибір відображатиме бажане місце накопичення генного продукту. У іншому варіанті вибраний промотор спрямовує експресію гена за різноманітних умов індукування. Промотори відрізняються за силою свого впливу, тобто властивістю стимулювати транскрипцію. Будь-який з кількох відповідних промоторів використовують залежно до застосовуваної системи клітин-хазяїв. Далі за текстом наведено можливі приклади (якими винахід не обмежується) промоторів, що їх використовують у касетах експресії. а. Конститутивна експресія, промотор CaMV 35S: Структура плазміди pCGN1761 описано в [опублікованій патентній заявці ЕР 0 392 225 (Приклад 23), на яку в цьому тексті наведено посилання]. pCGN1761 містить "подвійний" промотор CaMV 35S та термінатор транскрипції tml, з єдиним сайтом EcoRI між промотором та термінатором, і має основний ланцюг pUC-типу. Конструюють похідну pCGN1761, яка має модифікований полілінкер, що включає сайти Notl та Xhol у додаток до існуючого сайту EcoRI. Цю похідну позначають як pCGN1761ENX. pCGN1761ENX використовують для клонування послідовностей к ДНК або послідовностей генів (включаючи послідовності ORF бактерій) усередині її полілінкера з метою здійснення їхньої експресії під контролем промотора 35S у трансгенних рослинах. Цілу касету термінатора tml послідовності гена-промотора 35S з такою структурою вирізають за допомогою сайтів 5' Hindlll, Sphl, Sall та Xbal (промотор) і сайтів 3і Xbal, BamHI та ВgІІ (термінатор) для перенесення до векторів трансформування, подібних описаним далі за текстом. Крім того, фрагмент подвійного промотора 35S видаляють шляхом ексцизії (вирізання) 5' з використанням Hindlll, Sphl, Sail, Xbal або Pstl та шляхом ексцизії 3' з використанням будь-якого зі сайтів рестрикції полілінкера (EcoRI, Notl або Xhol), з метою заміщення іншим промотором. За бажанням роблять модифікації навколо клонувальних сайтів, шляхом введення послідовностей, що можуть посилювати трансляцію. Це є особливо корисним, якщо виникає потреба у надекспресії. Наприклад, pCGN1761 ENX модифікують шляхом оптимізації сайта ініціації трансляції, як це описано у [Прикладі 37 патенту США № 5,639,949, посилання на який наведено у цьому описі]. б. Експресія з використанням регульованого хімічним способом/патогеном промотора: Подвійний промотор 35S у pCGN1761 ENX заміщують будь-яким іншим вибраним промотором, що призводить до створення відповідно високих рівнів експресії. Як приклад, один з хімічно регульованих промоторів, описаних у [патенті США № 5,614,395], може заміщувати подвійний промотор 35S. Вибраний промотор в оптимальному варіанті вирізають з його джерела за допомогою рестрикційних ферментів, але як варіант можуть ампліфікувати за допомогою полімеразно-ланцюгової реакції (PCR) з використанням праймерів, які мають сайти рестрикції відповідних терміналів. Якщо застосовують ампліфікацію PCR, промотор ресеквенують з метою перевірки на похибки ампліфікації після клонування ампліфікованого промотора у цільовому векторі. Регульований хімічним способом/патогеном промотор PR-1а тютюну розщеплюють (гідролізують) з плазміди рСІВ1004 [структуру див. у прикладі 21 заявки ЕР 0 332 104, на яку в цьому тексті наведено посилання] і переносять до плазміди pCGN1761 ENX [Uknes et at., 1992]. pCIB1004 розщеплюють з використанням Ncol, і одержаний "виступ" 3' лінеаризованого фрагмента "затупляють" шляхом обробки полімеразою ДНК Т4. Фрагмент після цього розщеплюють Hindlll, одержаний фрагмент, що містить промотор PR-1a, очищають гелем і клонують у pCGN1761 ENX, з якої видалено подвійний промотор 35S. Це здійснюють за допомогою розщеплення з використанням Xhol і "затуплення" полімеразою Т4, після чого за допомогою розщеплення з використанням Hindlll і виділення більшого фрагмента, що містить вектор-термінатор, в який клонують фрагмент промотора рСІВ1004. Це призводить до утворення похідної pCGN1761ENX з промотором PR-1а і термінатором tml, і проміжного полілінкера з унікальними сайтами EcoRI та Notl. Вибрану кодувальну послідовність вставляють у цей вектор, і продукти злиття (тобто промотор-ген-термінатор) далі переносять до будь-якого вибраного вектора трансформації, включаючи ті, що їх описано infra. Для індукування експресії вибраної кодувальної послідовності в рослинах, трансформовані згідно з цим винаходом, застосовують різноманітні хімічні регулятори, включаючи бензотіадіазол, ізонікотинову кислоту і сполуки саліцилової кислоти, що їх описано у [патентах США №№ 5,523,311 та 5,614,395]. в. Конститутивна експресія, промотор актину: Відомо, що у переважній більшості типів клітин експресуються декілька ізоформ актину, і, відповідно, промотор актину є добрим варіантом конститутивного промотора. Зокрема був клонований і описаний промотор гена рису Actl [McElroy et al. Plant Cell 2: 163-171 (1990)]. Було виявлено, що фрагмент промотора довжиною 1,3 т.п.н. містить усі регуляторні елементи, необхідні для експресії у протопластах рису. Крім того, численні вектори експресії на основі промотора Actl було створено спеціально для використання в однодольних рослинах [McElroy et al. Моl. Gen. Genet. 231: 150-160 (1991)]. До них належать Actl-інтрон 1, фланкувальна послідовність Adhl 5’ та Adhl-інтрон 1 (з гена дегідрогенази кукурудзяного спирту), а також послідовність з промотора CaMV 35S. Векторами, що відзначалися максимальною експресію, були злиття 35S та інтрону Adhl, або фланкувальної послідовності Adhl5' та інтрону Actl. Оптимізація послідовностей навколо ініціюючої ATG (гена репортера GUS) також посилювали експресію. Касети експресії промотора, що їх описано у [McElroy et al. (Моl. Gen. Genet. 231: 150-160 (1991)] без ускладнень модифікуються для цілей експресії гена і є, зокрема, придатними для використання у однодольних рослинах-хазяях. Наприклад, промотор-вмісні фрагменти видаляють зі структур McElroy і використовують для заміщення подвійного промотора 35S у pCGN1761ENX, яка є після цього доступною для вставлення специфічних послідовностей генів. Створені у такий спосіб гени злиття після цього переносять до відповідних векторів трансформування. У окремому повідомленні згадується про те, що промотор рису Actl зі своїм першим інтроном також зумовлює високий рівень експресії у культивованих клітинах ячменю [Chibbar et al. Plant Cell Rep. 12: 506-509 (1993)]. г. Конститутивна експресія, промотор убіквітину: Відомо, що убіквітин є іншим генним продуктом, який накопичується у клітинах різних типів, і його промотор був клонований з декількох видів з метою використання у трансгенних рослинах (наприклад, соняшнику – [Binet et al. Plant Science 79: 87-94 (1991)] та кукурудзі - [Christensen et al. Plant Molec. Biol. 12: 619-632 (1989)]. Промотор убіквітину кукурудзи розроблено та одержано у системах трансгенних однодольних рослин, і його послідовність та вектори, створені для трансформування однодольних рослин, описано у публікації патенту [ЕР 0 342 926 (виданого Lubrizol)], на яку в цьому описі наведено посилання. Taylor et al. [Plant Cell Rep. 12: 491-495 (1993)] описують вектор (рАНС25), що містить промотор убіквітину кукурудзи та перший інтрон, а також його високу активність у клітинних суспензіях численних однодольних рослин під час введення шляхом бомбардування мікрочастинками. Промотор убіквітину є придатним для експресії гена у трансгенних рослинах, особливо у однодольних рослинах. Відповідними векторами є похідні рАНС25 або будь-якого з векторів трансформування, описаних у цій заявці, модифікованих шляхом введення відповідного промотора убіквітину та/або інтронної послідовності. д. Специфічна експресія у корінні: Іншою характеристикою експресії гена є експресія у корінні. Відповідний промотор коріння описано у [de Framond (FEBS 290 103-106 (1991)] , а також в опублікованій патентній заявці [ЕР 0 452 269], на яку в цьому описі наведено посилання. Цей промотор переносять у відповідний вектор, такий як pCGN1761ENX, з метою вставлення вибраного гена і подальшого перенесення цілої касети промотор-ген-термінатор у потрібний вектор трансформації. e. Промотори, індуковані раною: Індуковані раною промотори є також придатними для експресії гена. Численні подібні промотори описано раніше [наприклад, Xu et al. Plant Molec. ВіоІ. 22: 573-588 (1993), Logemann et al. Plant Cell 1: 151-158 (1989), Rohrmeier & Lehle, Plant Molec. Biol. 22: 783-792 (1993), Firek et al. Plant Molec. Biol. 22: 129-142 (1993), Warner et al. Plant J. 3: 191-201 (1993)] і придатними для використання за способом цього винаходу. Logemann et al. описують розташовані вище послідовності 5' дводольної картоплі гена wunl. Xu ef al. стверджують, що індукований раною промотор з дводольної картоплі (pin2) є активним у однодольному рисі. Крім того, Rohrmeier & Lehle описують клонування кДНК Wipl кукурудзи, індукованої раною і використовуваної для виділення спорідненого за жіночою лінією промотора із застосуванням стандартної технології. Аналогічним чином, Firek et a/, and Warner et а/, описали індукований раною ген з однодольного Asparagus officinafis, який експресується у пораненому місці і у ділянках інвазії патогену. За допомогою технологій клонування, добре відомих фахівцям, ці промотори переносять у відповідні вектори, злиті із генами, що їх використовують згідно із цим винаходом, і використовують для експресування цих генів у поранених ділянках рослин. ж. Селективна експресія у серцевині рослини: У патентній заявці [WO 93/07278], на яку в цьому описі наведено посилання, описано виділення гена trpA кукурудзи, який вибірково експресують у клітинах серцевини. Представлено генну послідовність та промотор, що продовжується до -1726 п.н. від початку транскрипції. За допомогою стандартних технологій молекулярної біології цей промотор або його частини переносять у такий вектор, як pCGN1761, де він може замістити промотор 35S і його використовують для стимулювання вибіркової експресії чужорідного гена з серцевини рослини. На практиці фрагменти, що містять вибраний з серцевини промотор або його частини, переносять у будь-який вектор і модифікують для застосування у трансгенних рослинах. з. Специфічна експресія у листках: Ген кукурудзи, що кодує фосфоенолкарбоксилазу (РЕРС), описано у [Hudspeth & Grula (Plant Molec Biol 12: 579-589 (1989)]. За допомогою стандартних технологій молекулярної біології промотор цього гена використовують для стимулювання специфічної експресії будь-якого гена у листках трансгенних рослин. 2. Термінатори транскрипції Для використання у касетах експресії застосовують різноманітні термінатори транскрипції. Вони відповідають за термінацію транскрипції поза межами трансгена і його коректне поліаденілювання. Відповідними термінаторами транскрипції є ті, про які відомо, що вони функціонують у рослинах і включають термінатор CaMV 35S, термінатор tml, термінатор нопалінсинтази і термінатор rbcS E9 гороху. їх використовують як для однодольних рослин, так і для дводольних. 3. Послідовності для посилення або регулювання експресії Виявлено численні послідовності, що посилюють експресію гена зі середини одиниці транскрипції, і ці послідовності використовують разом із генами цього винаходу для збільшення їхньої експресії у трансгенних рослинах. Доведено, що різноманітні інтронні послідовності посилюють експресію, зокрема у клітинах однодольних рослин. Наприклад, виявлено, що інтрони гена Adhl кукурудзи істотно посилюють експресію природного гена за умов введення спорідненого за жіночою лінією промотора у клітини кукурудзи. Доведено, зокрема, що інтрон 1 виявився ефективним і посилював експресію у конструктах злиття з геном хлорамфеніколацетилтрансферази [Callis et a/., Genes Develop. 1: 1183-1200 (1987)]. У тій самій експериментальній схемі інтрон з гена bronze1 кукурудзи справляв аналогічний вплив щодо посилення експресії. Інтронні послідовності вводили у вектори трансформування рослин стандартним способом, зазвичай усередині нетрансльованої лідерної послідовності. Відомо, що певні нетрансльовані лідерні послідовності, що їх одержують з вірусів, також посилюють експресію і є особливо ефективними у клітинах дводольних рослин. Якщо більш конкретно, ефективними щодо посилення експресії виявилися лідерні послідовності з мозаїчного вірусу тютюну (TMV, "W-послідовність"), крапчастого вірусу хлоротичної кукурудзи (MCMV) та мозаїчного вірусу люцерни (AMV) [наприклад, Gallic et a/. Nucl. Acids Res. 15: 8693-8711 (1987); Skuzeski et a/. Plant Molec. Biol. 15: 65-79 (1990)]. 4. Цільове спрямування генного продукту у клітині Відомо, що у рослинах існують різноманітні механізми цільового спрямування генних продуктів, і послідовності, що контролюють функціонування цих механізмів, описано досить детально. Наприклад, спрямування генних продуктів у хлоропласт контролюється сигнальною послідовністю, виявленою на амінотермінальному закінченні різних білків, яке розщеплюється під час перенесення хлоропласту у дозрілий білок [наприклад, Comai et a/. J. Biol. Chem. 263: 15104-15109 (1988)]. Ці сигнальні послідовності зливають із гетерологічними генними продуктам для здійснення перенесення гетерологічних продуктів у хлоропласт [van den Broeck, et al. Nature 313: 358-363 (1985)]. ДНК, що кодує відповідні сигнальні послідовності, виділяють із закінчення 5’ кислот кДНК, що кодують білок RUBISCO, білок CAB, фермент синтази EPSP, білок GS2 та багато інших білків, відомих як такі, що локалізуються хлоропластом. [Див. також розділ, названий "Експресія за допомогою цільового спрямування у хлоропласт" у Прикладі 37 патенту США № 5,639,949]. Інші генні продукти локалізуються у інших органелах, таких як мітохондрія та пероксисома [наприклад, Unger et al. Plant Molec. Biol. 13: 411-418 (1989)]. Кислотами кДНК, що кодують ці продукти, також можна маніпулювати з метою здійснення спрямування гетерологічних генних продуктів у ці органели. Прикладами таких послідовностей є кодовані у ядрі АТФази і специфічні для мітохондрій ізоформи аспартатамінотрансферази. Цільове спрямування клітинних білкових тілець описано у Rogers et al. [Proc. Natl. Acad. Sci. USA 82: 6512-6516 (1985)]. Крім того, було описано послідовності, які зумовлюють спрямування генних продуктів до інших відділень клітини. Амінотермінальні послідовності відповідають за цільове спрямування у ER (ендоплазматичний ретикулюм), апопласт та позаклітинну секрецію з алейронових клітин [Koehler & Ho, Plant Cell 2: 769-783 (1990)]. До того ж амінотермінальні послідовності разом із карбокситермінальними послідовностями відповідають за вакуолярне цільове спрямування генних продуктів [Shinshi et al. Plant Molec. Biol. 14: 357-368 (1990)]. За допомогою злиття описаних вище відповідних послідовностей, що відповідають за цільове спрямування, із потрібними трансгенними послідовностями, можна спрямувати трансгенний продукт у будь-яку органелу або відділення клітини. Для цільового спрямування у хлоропласт, наприклад, хлоропластову сигнальну послідовність з гена RUBISCO, гена CAB, гена синтази EPSP або гена GS2 зливають у рамці з амінотерміналом ATG трансгена. Вибрана сигнальна послідовність має включати відомий сайт розщеплення, а у створеному злитті слід ураховувати будь-які амінокислоти після сайту розщеплення, які є необхідними для розщеплення. У деяких випадках цю вимогу виконують шляхом додавання невеликої кількості амінокислот між сайтом розщеплення і ATG трансгену, або, у іншому варіанті заміщення, декількох амінокислот у межах трансгенноі послідовності. Створені злиття для хлоропластового перенесення перевіряють на ефективність поглинання хлоропласту шляхом трансляції in vitro транскрибованих in vitro структур і далі шляхом аналізу поглинання хлоропласту in vitro, з використанням технологій, що їх описано у [Bartlett et al. In: Edelmann et al. (Eds.) Methods in Chloroplast Molecular Biology, Elsevier pp 1081-1091 (1982) and Wasmann et al. Моl. Gen. Genet. 205: 446-453 (1986)]. Ці технології структур добре відомі фахівцям і є у рівній мірі застосовуваними для мітохондрій та пероксисом. Описані вище механізми клітинного цільового спрямування застосовують не лише разом із спорідненими за жіночою лінією промоторами, але також разом із гетерологічними промоторами з метою забезпечення специфічної цілі клітинного спрямування в умовах транскрипційної регуляції промотора, що має таку характеристику експресії, яка відрізняється від характеристики промотора, з якого одержується сигнал цільового спрямування. Б. Структура векторів трансформації рослини Численні векторів трансформації, придатні для трансформування рослини, є відомими фахівцям у цій галузі, і гени, створювані за способом цього винаходу, використовують разом із будь-якими подібними векторами. Вибір вектора залежатиме від вибору оптимальної технології трансформування і цільових видів, які піддаватимуть трансформуванню. Для певних цільових видів перевагу віддають певним маркерам селекції антибіотиків або гербіцидів. До стандартних маркерів селекції, що їх використовують для трансформування, належать ген nptll, який створює опірність до канаміцину та споріднених антибіотиків [Messing & Vierra. Gene 19: 259-268 (1982); Bevan et al., Nature 304:184-187 (1983)], ген bar, який створює опірність до гербіциду фосфінотрицину [White et al., Nucl. Acids Res 18: 1062 (1990), Spencer et al. Theor. Appl. Genet 79: 625-631 (1990)], ген hph, який створює опірність до антибіотика гідроміцину [Blochinger & Diggelmann, Моl Cell Biol 4: 2929-2931], ген dhfr, який створює опірність до метатрексату [Bourouis et al., EMBO J. 2(7): 1099-1104 (1983)] і ген EPSPS, який створює опірність до гліфосату [патенти США №№ 4,940,935 та 5,188,642]. 1. Вектори, придатні для трансформування з використанням Agrobacterium Багато векторів є придатними для трансформування з використанням Agrobacterium tumefaciens. Вони зазвичай мають принаймні одну граничну послідовність Т-ДНК і включають такі вектори, як pBIN19 [Bevan, Nucl. Acids Res. (1984)] та pXYZ. Нижче наведено опис структури двох типових векторів, придатних для трансформування з використанням Agrobacterium. а. рСІВ200 та рСІВ2001: Подвійні вектори рСІВ200 та рСІВ2001 застосовують для структури рекомбінантних векторів, призначених для використання із Agrobacterium і одержують наступним способом. pTJS75kan створюють шляхом ферментативного гідролізу Narl вектора pTJS75 [Schmidhauser & Helinski, J. Bacteriol. 164: 446-455 (1985)], дозволяючи відбуватися ексцизії гена опірності до тетрацикліну, далі шляхом вставлення фрагмента АссІ з pUC4K, що має NPTII [Messing & Vierra, Gene 19: 259-268 (1982): Bevan et al., Nature 304: 184-187 (1983): McBride et al., Plant Molecular Biology 14: 266-276 (1990)]. Лінкери Xhol лігують з фрагментом EcoRV з РСІВ7, що містить ліву та праву границі Т-ДНК, селектований у рослині химерний ген nos/nptll та полілінкер pUC (Rothstein et al., Gene 53: 153-161 (1987)], і гідролізований Xhol фрагмент клонують у гідролізований за допомогою Sa// pTJS75kan, створюючи рСІВ200 [див. також ЕР 0 332 104, приклад 19]. рСІВ200 містить такі унікальні сайти рестрикції полілінкера: EcoRI, Sstl, Kpnl, Bglll, Xbal та Sall. рСІВ2001 є похідним рСІВ200, створеного шляхом вставлення у полілінкер додаткових сайтів рестрикції. Унікальними сайтами рестрикції у полілінкері рСІВ2001 є EcoRI, Sstl, Kpnl, Bglll, Xbal, Sall, Mlul, Bcll, Avrll, Apal, Hpal та Stul. pCIB2001, на додачу до того, що містить ці унікальні сайти рестрикції, має також відбір за рослинним та бактеріальним канаміцином, ліву та праву границі Т-ДНК для опосередкованого Agrobacterium трансформування, похідну від RK2 функцію trfA для мобілізації між E. coli та іншим хазяями, а також функції OriT та OriV з RK2. Полілінкер рСІВ2001 є придатним для клонування касет експресії рослин, що мають свої власні регуляторні сигнали. б. РСІВ10 та його похідні як результат відбору за гідроміцином: Подвійний вектор рСІВ10 містить ген, що кодує опірність до канаміцину для відбору у рослинах і ліву та праву граничні послідовності Т-ДНК, і включає послідовності плазміди pRK252, яка зустрічається у найрізноманітніших хазяїв, що дозволяє йому реплікувати як у Е. coli, так і у Agrobacterium. Його структуру описано у [Rothstein et al. (Gene 53: 153-161 (1987))]. Створюють різні похідні вектора рСІВ10, які включають ген для фосфотрансферази гідроміцину В, що його описано у [Gritz et al. (Gene 25: 179-188 (1983))]. Ці похідні роблять можливою селекцію клітин трансгенних рослин тільки за гідроміцином (рСІВ743), або гідроміцином та канаміцином (рСІВ715, рСІВ717). 2. Вектори, придатні для трансформування без використання Agrobacterium. Трансформація без використання Agrobacterium tumefaciens дозволяє обійти вимогу наявності послідовностей Т-ДНК у вибраному векторі трансформації, і, таким чином, з'являється можливість застосовувати вектори, в яких немає цих послідовностей, на додачу до тих описаних вище векторів, що мають послідовності ТДНК. Технологія трансформації, в якій не використовують Agrobacterium, включає трансформування за допомогою бомбардування частинками, поглинання протопласту (наприклад, PEG (поліетиленгліколь) та електропорація) і мікроін'єкція. Вибір вектора в значній мірі залежить від відбору видів, що їх трансформують. Далі за текстом описано структуру типових векторів, придатних для трансформування без використання Agrobacterium. а. рСІВ3064: рСІВ3064 є похідним від pUC вектором, придатним для використання за технологією безпосереднього перенесення гена у комбінації з відбором за впливом гербіциду баста (або фосфінотрицину). Плазміда рСІВ246 містить промотор CaMV 35S у функціональному злитті з геном GUS Е. coli та термінатор транскрипції CaMV 35S, і цю плазміду описано в [опублікованій в РСТ заявці WO 93/07278]. Промотор 35S цього вектора містить дві послідовності 5’ ATG початкового сайту. Ці сайти піддають мутації з використанням стандартної технології PCR, видаляючи у такий спосіб гени ATG і утворюючи сайти рестрикції Sspl and Pvull. Нові сайти рестрикції віддалені на 96 та 37 п.н. від унікального сайту Sall і на 101 та 42 п.н. від реального початкового сайту. Одержану похідну рСІВ246 позначають як рСIВ3025. Ген GUS після цього вирізають з рСІВ3025 за допомогою ферментативного гідролізу з використанням Sall та Sacl, терміналів, що їх затуплено та реліговано з утворенням плазмідного вектора рСІВ3060. Плазміду рJIТ82 одержують від John Innes Centre, Norwich, і фрагмент Smal довжиною 400 п.н., що містить ген bar зі Streptomyces viridochromogenes вирізають і вставляють у сайт Нра/ вектора рСІВ3060 [Thompson et al. EMBO J 6: 2519-2523 (1987)]. Завдяки цьому утворюється рСІВ3064, що містить ген bar під контролем промотора CaMV 35S та термінатора гербіцидної селекції, ген опірності до ампіциліну (для селекції у E соli) та полілінкер з унікальними сайтами Sphl, Pstl, Hindlll та ВаmНІ. Цей вектор є придатним для клонування касет експресії рослини, які містять свої власні регуляторні сигнали. б. pSOG19 та pS0G35: pSOG35 є вектором трансформації, в якому дигідрофолатредуктазу (DFR) гена E. coli використовують як селективний маркер, що надає опірності до метатрексату. PCR застосовують для ампліфікування промотора 35S (-800 п.н.), інтрону 6 з гена кукурудзи Adh1 (-550 п.н.) та 18 п.н. нетрансльованої лідерної послідовності GUS з pSOG1O. Фрагмент 250-п.н., що кодує ген типу II з дигідрофолатредуктазою (E. coli) також ампліфікують за допомогою PCR, і ці два фрагменти PCR збирають у єдину структуру з фрагментом Sacl-Pstl з рВ1221 (Clontech), що містить основний ланцюг вектора pUC19 та термінатор нопалінсинтази. Збирання цих фрагментів в упорядковану структуру призводить до утворення pSOG19, що містить промотор 35S у злитті з послідовністю інтрону 6, лідерною послідовністю GUS, геном DHFR та термінатором нопалінсинтази. Заміщення лідерної послідовності GUS у pSOG19 лідерною послідовністю з крапчастого вірусу хлоротичної кукурудзи (MCMV) призводить до утворення вектора pSOG35. Вектори pSOG19 та pSOG35 містять ген pUC опірності до ампіциліну і мають сайти Hindlll, Sphl, Psrl та EcoRI, придатні для клонування чужорідних речовин. В. Трансформація Оскільки потрібну кодувальну послідовність клоновано у систему експресії, її трансформовано у клітину рослини. Способи трансформації та регенерації рослин є добре відомими у галузі. Наприклад, плазмідні вектори Ті застосовано для доставки чужорідної ДНК, а також безпосереднього поглинання ДНК, ліпосом, електропорації, мікроін'єкції та бомбардування мікрочастинками. Крім того, для трансформування рослинних клітин застосовують бактерії з роду Agrobacterium. Нижче наведено опис основних технологій трансформування як дводольних, так і однодольних рослин. 1. Трансформування дводольних рослин Технологія трансформування дводольних є добре відомою фахівцям і включає способи, які ґрунтуються на використанні Agrobacterium, і способи, в яких Agrobacterium не використовують. Технологія без використання Agrobacterium передбачає поглинання екзогенної генетичної речовини безпосередньо протопластами або клітинами. Це виконують за допомогою PEG або поглинання з проміжним використанням електропорації, доставки за допомогою бомбардування частинками або мікроін'єкції. Приклади цих технологій описано у [Paszkowski et al., ЕМВО J 3: 2717-2722 (1984), Potrykus et а/., Моl. Gen. Genet. 199: 169-177 (1985), Reich et a/., Biotechnology 4: 1001-1004 (1986) та Klein et a/., Nature 327: 70-73 (1987)]. У кожному випадку трансформовані клітини регенерують до повного відновлення рослини з використанням стандартних технологій, відомих фахівцям у цій галузі. Трансформування з використанням Agrobacterium являє собою оптимальну технологію трансформування дводольних рослин завдяки його високій ефективності та широкому застосуванню з багатьма різними видами. Трансформування з використанням Agrobacterium зазвичай передбачає перенесення подвійного вектора, що має потрібну чужорідну ДНК (наприклад, рСІВ200 або рСІВ2001) у відповідний штам Agrobacterium, яке залежить від комплементу генів vir, що переносяться штамом-хазяїном Agrobacterium, або на сорезидентній плазміди Ті, або через хромосоми (наприклад, штам СІВ542 для рСІВ200 для рСІВ2001 [Uknes et a/. Plant Cell 5: 159-169(1993)]. Перенесення рекомбінантного подвійного вектора у Agrobacterium виконують за допомогою процедури потрійного схрещування з використанням E. coli, що має рекомбінантний подвійний вектор, хелперного штаму E. coli, який має таку плазміду, як pRK2013, і який здатний перенести рекомбінантний подвійний вектор у цільовий штам Agrobacterium. У іншому варіанті рекомбінантний подвійного вектор переносять у Agrobacterium шляхом трансформації ДНК [Höfgen & Willmitzer, Nucl. Acids Res. 16: 9877 (1988)]. Трансформування цільового виду рослини рекомбінантним Agrobacterium зазвичай передбачає співкультивування Agrobacterium з експлантатами з рослини, і його виконують за протоколами, добре відомими у галузі. Трансформовану тканину регенерують у селективному середовищі, що має маркер опірності до антибіотика або гербіциду, присутній між границями Т-ДНК бінарної плазміди. Інший підхід до трансформування рослинних клітини геном передбачає активне введення інертних або біологічно активних частинок у рослинних тканинах та клітинах. Цю технологію описано у [патентах США №№ 4,945,050, 5,036,006 та 5,100,792], всі з яких видано Sanford et al. Зазвичай ця процедура передбачає стимулювання інертних або біологічно активних частинок у клітинах в умовах, ефективних для проникнення крізь зовнішню поверхню клітини і сприяння входженню в її внутрішню структуру. В умовах використання інертних частинок вектор вводять у клітину шляхом покриття частинок вектором, що містить потрібний ген. У іншому варіанті цільову клітину оточують вектором таким чином, щоб вектор переносився у клітину потоком частинок. Біологічно активні частинки (наприклад, клітини сухих дріжджів, сухих бактерій або бактеріофагу, кожна з яких містить ДНК, що підлягає введенню) також активно вводять у тканину рослинних клітин. 2. Трансформування однодольних рослин. Трансформування більшості видів однодольних рослин також стало стандартною операцією. Оптимальна технологія передбачає безпосереднє перенесення гена у протопласти з використанням PEG або електропорації та бомбардування частинками усередину тканини напливу. Трансформацію виконують одним видом ДНК або кількома видами ДНК (тобто співтрансформування), і обидві ці технології є придатними для використання згідно з цим винаходом. Співтрансформування має ту перевагу, що надає можливість уникнути повновекторних структур і створювати трансгенні рослини з незв'язаними локусами для потрібного гена і селективного маркера, дозволяючи видалити селективний маркер у наступних поколіннях, якщо у цьому з'являється потреба. Проте, недоліком використання співтрансформування є менш ніж 100%-на частота, з якою окремі види ДНК інтегруються у геном [Schooner etal. Biotechnology 4: 1093-1096 (1986)]. У патентних заявках [ЕР 0 292 435, ЕР 0 392 225 та WO 93/07278] описано технологію напливу (калюсу) і протопластів з елітної інбредної лінії кукурудзи,, трансформування протопластів з використанням PEG або електропорації, а також регенерацію рослинних форм кукурудзи з трансформованих протопластів. [Gordon-Kamm et al. (Plant Cell 2: 603-618 (1990)) and Fromm et al. (Biotechnology 8: 833-839 (1990))] опублікували технологію трансформування похідної від А188 лінії кукурудзи за допомогою бомбардування частинками. Крім того, [WO 93/07278 and Koziel et al. (Biotechnology 11: 194-200 (1993))] також описують технологію трансформування елітних інбредних ліній кукурудзи за допомогою бомбардування частинками. У цій технології використовують недостиглі ембріони кукурудзи довжиною 1,5-2,5мм, що їх було вирізано з кукурудзяного колоса через 14-15 діб після запилення, а також пристрій для бомбардування PDS-1000He Biolistics. Трансформування рису також виконують за допомогою технології безпосереднього перенесення гена з використанням протопластів або бомбардування частинками. Трансформування з використанням протопласту описано для типів Japonica та типів Indica [Zhang et al. Plant Cell Rep 7: 379-384 (1988); Shimamoto et al. Nature 338: 274-277 (1989); Datta ef al. Biotechnology 8: 736-740 (1990)]. Обидва типи також трансформуються стандартним чином з використанням бомбардування частинками [Christou et al. Biotechnology 9: 957-962 (1991))]. У патентній заявці [ЕР 0 332 581] описано технологію розмноження, трансформування та регенерації протопластів Pooideae. Ця технологія дає можливість трансформувати Dactylis та пшеницю. Крім того, трансформування пшениці описано у [Vasil et al. (Biotechnology 10: 667-674 (1992))], з використанням бомбардування частинками клітин калюсу з довготривалою регенерацією типу С, а також у [Vasil et al. (Biotechnology 11: 1553-1558 (1993)) and Weeks et al. (Plant Physiol. 102: 1077-1084 (1993))] з використанням бомбардування частинками незрілих зародків і незрілого утвореного із зародків калюсу. Проте оптимальна технологія трансформування пшениці передбачає трансформування пшениці за допомогою бомбардування частинками незрілих зародків і включає стадію високого рівня сахарози або високого рівня мальтози перед доставлянням гена. Перед бомбардуванням певну кількість ембріонів (довжиною 0,75-1мм) поміщають у середовище MS з 3%-ою сахарозою [Murashiga & Skoog, Physiologia Plantarum 15: 473-497 (1962)] і 3мг/л 2,4-D для індукції соматичних ембріонів, які можна обробляти в темряві. У вибраний день бомбардування ембріони видаляють з індукційного середовища і поміщають на осмотичне середовище (тобто індукційне середовище з сахарозою або мальтозою, доданими у потрібний концентрації, як правило 15%). Ембріонам дають можливість плазмолізуватися протягом 2-3 год, після чого їх бомбардують. Нормою є двадцять ембріонів на цільовий планшет, хоча це некритично. Відповідну ген-вмісну плазміду (таку як рСІВ3064 або pSG35) осаджують на золоті частинки мікронного розміру з використанням стандартних процедур. Кожний планшет ембріонів бомбардують за допомогою гелієвого пристрою DuPont BiolisticsÒ з використанням розривного тиску -1000 psi (70,3кг/см2) за допомогою стандартного фільтрування з розміром отвору фільтра 80меш. Після бомбардування ембріони знову поміщають у темряву для відновлення приблизно на 24 год (також на осмотичне середовище). Через 24 год ембріони видаляють з осмотичного середовища і знову поміщають на індукційне середовище, де вони залишаються приблизно місяць перед регенерацією. Приблизно через місяць експлантати ембріону з ембріогенного калюсу, що розвивається, переносять до середовища регенерації (MS + 1мг/л NAA, 5мг/л GA), яке додатково містить відповідний агент селекції (10мг/л баста - у випадку рСІВ3064, і 2мг/л метатрексату - у випадку pSOG35). Приблизно через місяць розвинуті кільчики переносять до стерильних контейнерів більшого розміру, відомих як "GA7", що містять напівконцентровану MS, 2%-ну сахарозу, і агент селекції у такій самій концентрації. Нещодавно було описано трансформацію однодольних рослин з використанням Agrobacterium. Див. [WO 94/00977 і патент США № 5,591,616], посилання на які наведено у цьому описі . Виведення сортів Імуномодульовані рослини, одержані шляхом трансформування геном SAR, таким як одна з форм гена NIM1, можуть належати до будь-якого з широкого спектру видів рослин, включаючи представників однодольних та дводольних; проте імуномодульовані рослини, використовувані за способом цього винаходу, переважно вибирають з переліку агрономічно важливих цільових культур, що їх називають supra. Експресію вибраної форми гена NIM1 у комбінації з іншими характеристиками, що мають суттєве значення для створення мутантів та їх якості, вводять у клітинні лінії рослин за допомогою селекції. Способи та технологія селекції є відомими у галузі. Див. наприклад, [Welsh J. R., Fundamentals of Plant Genetics and Breeding, John Wiley & Sons, NY (1981); Crop Breeding, Wood D. R. (Ed.) American Society of Agronomy Madison, Wisconsin (1983); Mayo O., The Theory of Plant Breeding, Second Edition, Clarendon Press, Oxford (1987); Singh, D.P., Breeding for Resistance to Diseases and Insect Pests, Springer-Verlag, NY (1986); і Wricke and Weber, Quantitative Genetics and Selection Plant Breeding, Walter de Gruyter and Co., Berlin (1986)]. Генетичні властивості, що їх вводять у описані вище трансгенне насіння та рослини, проходять стадії статевого розмноження або вегетативного росту і таким чином зберігаються та поширюються у нащадках рослин. Загалом згадане збереження та поширення реалізують за допомогою відомих агротехнічних способів, розроблених залежно від конкретної мети, таких як пророщування, висівання або збирання потрібних клітин з культури. Застосовують також спеціалізовані способи, такі як гідропоніка або тепличні технології. Оскільки рослина культура під час росту є уразливою до нападів організмів та ушкоджень з боку комах або інфекцій, а також до жорсткої конкуренції із бур'янами, вдаються до заходів щодо боротьби із такими бур'янами, захворюваннями рослин, комахами, нематодами та іншими шкідливими умовами, що дозволяє покращити врожаї. До них належать заходи механічного характеру, такі як обробка ґрунту або видалення бур'янів та заражених рослин, а також застосування агрохімікатів, таких як гербіциди, фунгіциди, гаметоциди, нематоциди, регулятори росту, агенти дозрівання та інсектициди. Використання кращих генетичних властивостей трансгенних рослин та насіння згідно з цим винаходом продовжують під час виведення рослин, метою якого є створення рослин з покращеними властивостями, такими як толерантність до пестицидів, гербіцидів або стресу, покращена харчова цінність, зростання врожайності або покращення структури, яке зумовлює зменшення збитків від полягання або руйнування посівів. На різних стадіях селекції чітко визначено штучне втручання людини, таке як виведення ліній для схрещування, спрямування запилення батьківських ліній або селекція відповідних нащадків рослин. Залежно від потрібних властивостей вдаються до різних заходів щодо селекції рослин. Відповідні технології є добре відомими фахівцям і включають, крім іншого, схрещування, інбридинг, виведення сортів із зворотним схрещуванням, багатолінійне виведення сортів, різноманітне змішування сортів, міжвидове схрещування, анеуплоїдна технологія тощо. Технологія схрещування також включає стерилізацію рослин з утворенням чоловічих або жіночих стерильних рослин за допомогою механічних, хімічних або біохімічних засобів. Перехресне запилення чоловічих стерильних рослини з пилком іншої лінії гарантує те, що геном чоловічої стерильної, але здатної до відтворення потомства жіночої рослини, буде в однаковій мірі мати властивості обох батьківських ліній. Таким чином, трансгенне насіння та рослини згідно з цим винаходом використовують для виведення рослинних ліній з покращеними властивостями, що, наприклад, підвищує ефективність стандартних способів, таких як обробка гербіцидом або пестицидом, або дозволяє гнучко маніпулювати згаданими способами завдяки їхнім модифікованим генетичним властивостям. У іншому варіанті одержують нові культури з покращеною толерантністю до стресу, які, завдяки їхньому оптимізованому генетичному «оснащенню», дозволяють збирати продукт з кращими властивостями, ніж ті, що спостерігалися у продуктів, які не відзначалися належною толерантністю до порівнюваних шкідливих умов росту. Для одержання насіння суттєвими характеристиками продукту є якість проростання та однаковість насінин, у той час якість проростання та однаковість насінин, що їх збирає та продає фермер, не має жодного значення. Оскільки тяжко вберегти культуру від насіння інших культур та бур'янів, для боротьби із захворюваннями, пов'язаними із насінням, і з метою створення насіння з добрими характеристиками проростання, виробниками, які мають великий досвід у галузі вирощування, для встановлення оптимального режиму та умов продажу насіння розроблено дуже ефективні та добре визначені технології виробництва. Таким чином, фермер, як правило, купляє сертифіковане насіння, що задовольняє конкретним стандартам якості, замість того, щоб використовувати насіння, яке він збирає з власного поля. Насінини, що їх використовують як матеріал для розмноження, зазвичай обробляють захисним покриттям, яке містить гербіциди, інсектициди, фунгіциди, бактерициди, нематоциди, молюскоциди або їх суміші. Зазвичай до використовуваних захисних покриттів належать такі сполуки як каптан, карбоксин, тирам (TMTD*), металаксил (ApronÒ) та піриміфос-метил (ActellicÒ). За бажанням ці сполуки приготовляють разом із додатковими носіями, поверхнево-активними речовинами або стимулюючими під час застосування ад'ювантами, що їх зазвичай використовують у галузі приготування композицій для забезпечення захисту від ушкодження, спричиненого бактеріальними, грибковими або тваринними шкідниками. Захисні покриття застосовують шляхом просочування матеріалу для розмноження рідкою композицією або шляхом покриття комбінацією зволоженої або сухої композиції. Можливі також інші способи застосування, такі як обробка, спрямована безпосередньо на бруньки або плоди. Інший аспект цього винаходу полягає у одержанні нових агротехнічних способів, таких як способи, приклади яких наведено вище, які відзначаються використанням трансгенних рослин, матеріалу трансгенних рослин або трансгенного насіння згідно з цим винаходом. Насіння одержують у мішечках, контейнерах або посудинах, зроблених з відповідного пакувального матеріалу, причому мішечок або контейнер може закриватися. Мішечок, контейнер або посудину розробляють або для короткочасного, або для тривалого зберігання насіння, або і для того, і для іншого. Прикладами відповідного пакувального матеріалу є папір, наприклад, крафт-папір, жорсткий або гнучкий пластик або інші полімерні матеріали, скло або метал. Бажано, щоб мішечок, контейнер або посудина складалися з декількох шарів пакувальних матеріалів, такого ж самого або іншого типу. В одному з варіантів реалізації винаходу мішечок, контейнер або посудину виготовляють таким чином, щоб виключити або обмежити контакт насіння з водою та вологими речовинами. В одному з прикладів мішечок, контейнер або посудину герметизують, наприклад, шляхом герметизації нагріванням, з метою запобігання потраплянню води або вологих речовин. У іншому варіанті матеріали, що поглинають воду, поміщають між шарами пакувального матеріалу або у безпосередньому контакті з ними. В іще одному варіанті реалізації мішечок, контейнер або посудина, або пакувальний матеріал, з якого вони складалися, обробляють з метою обмеження, пригнічення або запобігання захворюванням, забрудненню або іншим шкідливим наслідкам зберігання або транспортування насіння. Прикладом такої обробки є знезаражування, наприклад, за допомогою хімічних засобів або радіаційної обробки. Цим винаходом передбачено застосування фірмового мішечка, в якому міститься насіння трансгенної рослини з однією з форм гена NIM1 або білка NIM1, який експресується у згаданій трансформованій рослині, у концентраціях, вищих, ніж у природних рослинах, разом із відповідним носієм, разом із фірмовими інструкціями з їх використання, що гарантує створення у рослин опірності до широкого спектра захворювань. Введення бактерициду в імуномодульовані рослини Як зазначено вище, спосіб захисту рослин за цим винаходом передбачає дві стадії: першу, тобто активування шляху SAP. з метою одержання імуномодульованої рослини, і другу, тобто введення бактерициду у такі імуномодульовані рослини з метою набуття ними синергетично посиленої опірності до захворювання. А. Стандартні бактерициди. Згідно зі способом цього винаходу будь-який комерційний або стандартний бактерицид застосовують в імуномодульованих рослинах, що їх одержують будь-яким з трьох описаних вище шляхів. До прикладів відповідних бактерицидів належать, крім іншого, такі фунгіциди: 4-[3-(4-хлорфеніл)-3-(3,4диметоксифеніл)акрилоїл]морфолін ("диметоморф"), [посилання: С Tomlin (Редактор): The Pesticide Manual, 10th edition, Famhan; UK, 1994, pages 351-352]; 5-метил-1,2,4-тріазоло[3,4-b][1,3]бензотіазол ("трициклазол"), ([посилання: С. Tomlin (Редактор): The Pesticide Manual, 10th edition, Famham, UK, 1994, pages 1017-1018]; 3алілокси-1,2-бензотіазол-1,1-діоксид ("пробоназол"), [посилання: С Tomlin (Редактор): The Pesticide Manual, 10th edition, Famham, UK, 1994, pages 831-832]; a-[2-(4-хлорфеніл)етил]--a-(1,1-диметилетил)-1Н-1,2,4-тріазол-1етанол, ("тебуконазол"), (посилання: ЕР-А-40 345);1-[[3-(2-хлорфеніл)-2-(4-фторфеніл)оксиран-2-іл]метил]-1Н1,2,4-тріазол, (“епоксиконазол”), [посилання: ЕР-А-196 038]; m-(4-хлорфеніл)-m-(1-циклопропілетил)-1Н-1,2,4тріазол-1-етанол, ("ципроконазол"), (посилання: US-4 664 696); 5-(4-хлорбензил)--2,2-диметил-1--(1Н-1,2,4тріазол-1--ілметил)-циклопентанол, ("метконазол"), [посилання: ЕР-А-267 778]; 2-(2,4-дихлорфеніл)--3-(1Н-1,2,4тріазол-1-іл)-пропіл--1,1,2,2-тетрафторетил-ефір, ("тетраконазол"), [посилання: ЕР-А-234 242]; метил-(Е)-2-{2-[6(2-ціанофенокси)піримідин--4-ілокси]феніл}--3-метоксиакрилат, ("ІСІ А 5504", "азоксистробін"), [посилання: ЕР-А382 375]; метил-(Е)--2-метоксиміно-2-[a-(о-толілокси)--о-толіл]ацетат, ("BAS 490 F", "крезоксимметил"), [посилання: ЕР-А-400 417]; 2-(2-феноксифеніл)-(Е)-2-метоксиміно-N-метилацетамід, [посилання: ЕР-А-398 692]; [2-(2,5-диметилфеноксиметил)-феніл]-(Е)--2-метоксиміно-NІ-метилацетамід, [посилання: ЕР-А-398 692]; (1R,3S/1S,3R)-2,2-дихлор-N-[(R)-1-(4-хлорфеніл)етил]-1-етил-3-метилциклопропанкарбоксамід, ("KTU 3616"), [посилання: ЕР-А-341 475]; мангановий етиленбіс(дитіокарбамат)полімер-цинковий комплекс, ("манкозеб"), [посилання: US 2 974 156]; 1-[2-(2,4-дихлорфеніл)-4-пропіл-1,3-діоксолан-2--ілметил]-1Н-1,2,4-тріазол, ("пропіконазол"), [посилання: GB-1522657]; 1-{2-[2-хлор-4-(4-хлорфенокси)феніл]-4-метил-1,3-діоксолан--2ілметил)--1Н-1,2,4-тріазол, ("дифеноконазол"), [посилання: GB-209860]; 1-[2-(2,4-дихлорфеніл)пентил--1Н-1,2,4тріазол, ("пенконазол"), [посилання: GB-1589852]; цис-4-[3-(4-трет-бутилфеніл)-2-метилпропіл]-2,6диметилморфолін, ("фенпропіморф"), [посилання: DE 2752135]; 1-[3-(4-трет-бутилфеніл)--2-метилпропіл]піперидин, ("фенпропідин"), [посилання: DE2752135]; 4-циклопропіл-6-метил-N-феніл-2-піримідинамін ("ципродиніл") [посилання: ЕР-А-310550]; (RS)-N-(2,6-диметилфеніл--N-(метоксиацетил)-аланін метиловий естер ("металаксил"), [посилання: GB-1500581]; (R)-N-(2,6-диметилфеніл-N-(метоксиацетил)-аланін метиловий естер ("R-металаксил"), [посилання: GB-1500581]; 1,2,5,6-тетрагідро-4Н-піроло[3,2,1-ij]хінолін-4-он ("пірохілон"), [посилання: GB-1394373]; етилгідрофосфонат ("фосетил"), [посилання: С Tomlin (Редактор): The Pesticide Manual, 10th Edition, Famhan, UK, 1994, pages 530-532]; і гідроксид міді [посилання: С. Tomlin (Редактор): The Pesticide Manual, 10th Edition, Famhan, UK, 1994, pages 229-230]. Вибраний бактерицид в оптимальному варіанті вводять у імуномодульовані рослини, що підлягають захисту, у вигляді композиції з додатковими носіями, поверхнево-активними речовинами або іншими стимулюючими під час застосування ад'ювантами, що їх традиційно застосовують у технології приготування композицій. Прийнятні носії та ад'юванти можуть бути твердими або рідкими і являють собою речовини, що їх зазвичай використовують у технології приготування композицій, наприклад, природні або регенеровані мінеральні речовини, розчинники, диспергатори, зволожувальні агенти, речовини для підвищення клейкості, згущувачі, зв'язувачі або заплідники. Оптимальним способом введення бактерицидної композиції є введення у надґрунтові частини рослин, особливо у листки (введення у листки). Частота та об'єм застосування залежать від біологічних та кліматичних умов життя патогена. Проте бактерицид може також проникати у рослину через коріння з ґрунту або з води (системна дія), якщо локус рослини просочується рідкою композицією (наприклад, у рисовій культурі), або якщо бактерицид вводять в ґрунт у твердому вигляді, наприклад, у вигляді гранул (введення в ґрунт). Для обробки насіння бактерицид також застосовують до насінин (покриття), або шляхом просочування бульб чи зерен рідкою композицією бактерициду, або шляхом покриття їх вже комбінованою вологою або сухою композицією. Крім того, у особливих випадках можливі інші способи введення у рослини, наприклад, обробка, спрямована безпосередньо на бруньки або грона плодів. Бактерицид використовують у немодифікованій формі або, в оптимальному варіанті, разом з ад'ювантами, які зазвичай використовують у технології приготування композицій і, отже, приготовляють відомим способом, наприклад, додають до перетворюваних на емульсію концентратів, паст для покриття, безпосередньо розприскуваних або розріджуваних розчинів, розведених емульсій, зволожуваних порошків, розчинюваних порошків, пудр, гранул, або шляхом інкапсулювання у, наприклад, полімерні речовини. Залежно від природи композицій, способи застосування, такі як обприскування, розпилювання, посипання пудрами, розсіювання, покриття або поливання вибирають згідно з наміченими задачами та реальними обставинами. Оптимальні кількості введення бактерициду зазвичай становлять від 50г до 2кг а.і./га, у кращому варіанті від 100г до 1000г а.і./га, найкраще від 150г до 700г а.і./га. У випадку обробки насіння кількості введення становлять від 0,5г до 1000г, краще від 5г до 100г а.і. на 100кг насіння. Композиції одержують відомим способом, наприклад, шляхом гомогенного змішування та/або розмелювання бактерициду з розріджувачами та наповнювачами, наприклад, розчинниками, твердими носіями і, при потребі, поверхнево-активними сполуками (сурфактантами). Придатними розчинниками є: ароматичні вуглеводні, переважно фракції, що містять від 8 до 12 атомів вуглецю, наприклад, ксиленові суміші або заміщені нафталіни, фталати, такі як дибутилфталат або діоктилфталат, аліфатичні вуглеводні, такі як циклогексан або парафіни, спирти і гліколі та їх ефіри та естери, такі як етанол, етиленгліколь, етиленгліколь монометил або моноетиловий ефір, кетони, такі як циклогексанон, сильно поляризовані розчинники, такі як N-метил-2-піролідон, диметилсульфоксид або диметилформамід, а також рослинні олії або епоксидовані рослинні олії, такі як епоксидована кокосова олія або соєва олія; або вода. Твердими носіями, використовуваними, наприклад, для пудр та диспергованих порошків, зазвичай є природні мінеральні наповнювачі, такі як кальцит, тальк, каолін, монтморилоніт або атапульгіт. З метою поліпшення фізичних властивостей можна також додавати тонкодисперсну кремнієву кислоту або тонкодисперсні абсорбувальні полімери. Придатними гранульованими абсорбувальними носіями є носії порових типів, наприклад пемза, бита цегла, сепіоліт або бентоніт, а придатними неабсорбувальними носіями є, наприклад, кальцит або пісок. Крім того, використовують численні попередньо гранульовані речовини неорганічної або органічної природи, зокрема доломіт або розмелені та розсіяні залишки рослин. Залежно від природи бактерициду, придатнимиповерхнево-активними сполуками є неіонні, катіонні та/або аніонні поверхнево-активні речовини, що мають здатність легко перетворюватися на емульсії, диспергуватися та зволожуватися. Термін "поверхнево-активні речовини" слід також розуміти як такий, що включає суміші поверхнево-активних речовин Зокрема, оптимальними стимулюючими під час застосування ад'ювантами є також природні або синтетичні фосфоліпіди цефалінового або лецитинового рядів, наприклад, фосфатиділетаноламін, фосфатиділсерин, фосфатиділгліцерин та лізолецитин. Агрохімічні композиції зазвичай містять від 0,1 до 99%, краще від 0,1 до 95% активного бактерицидного компоненту, від 99,9 до 1%, краще від 99,9 до 5%, твердого або рідкого ад'юванту, і від 0 до 25%, краще від 0,1 до 25%, поверхнево-активної речовини. У той час як для комерційних цілей продукти переважно приготовляють у вигляді концентратів, кінцевий користувач зазвичай використовує розріджені композиції. Б. Бактерициди, що активують рослини У випадку введення в імуномодульовані рослини, що їх одержують другим або третім описаним вище шляхом (селекційне виведення або генетичне конструювання), бактерицид може як варіант являти собою хімічний індуктор SAR (бактерицид, що активує рослини), такий як бензотіадіазол, ізонікотинова кислота або саліцилова кислота, що їх описано у патентах США [№№ 5,523,311 та 5,614,395]. Отже, два способи застосовують імуномодулювання сумісно. За допомогою введення бактерицидів, що активують рослини, в імуномодульовані рослини, одержувані або шляхом селекційного виведення або генетичного конструювання, досягають "екстраімуномодулювання" та синергетичного посилення опірності до захворювань. Як описано далі за текстом, трансгенні імуномодульовані рослини з надекспресією NIM1 реагували значно швидше і на значно нижчі дози ВТН, як видно з експресії гена PR-1 та опірності до P. parasitica, ніж природні рослини. Див. Приклад 35 і результати нозерн-блотингового аналізу на Фіг.3. Синергетичне посилення опірності до захворювання у NIM1 - надекспресорах досягають введенням ВТН у концентрації лише 10мкМ, тобто у концентрації, зазвичай недостатній для будь-якого ефекту взагалі. Зазвичай фітотоксичні або з інших причин небажані концентрації хімічних агентів, що індукують SAR, можна уникнути шляхом використання такої синергії. Крім того, використовуючи зміну часового режиму активації SAR, яка відбувається тоді, коли хімічні індуктори SAR вводять у вже модульовані рослини, такі як надекспресори NIM1. Крім того, можна дістати економічний прибуток завдяки зменшенню використовуваної кількості хімічних індукторів SAR, необхідної для забезпечення заданого рівня захисту рослин. В. Стандартні бактерициди разом із бактерицидами, що активують рослини. З метою досягнення якомога більшої опірності до захворювань, в імуномодульовані рослини, що їх одержують або шляхом селекційного виведення, або за допомогою генетичного конструювання, вводять як стандартний бактерицид, так і бактерицид, що активує рослини. Завдяки цьому одержують значно вищий рівень синергетичної опірності до захворювань у порівнянні з рівнем опірності до захворювань, якого досягають тільки шляхом імуномодулювання, шляхом імуномодулювання сумісно з тільки одним типом бактерициду, або шляхом одночасного введення обох типів бактерицидів (стандартного і того, що активує рослини). Див., наприклад, Табл. 35 у Прикладі 19. Оцінка опірності до захворювань. Оцінку опірності до захворювань виконують за допомогою способів, відомих у галузі. Див. [Uknes et al, (1993) Molecular Plant Microbe Interactions 6: 680-685; Gorlach et al., (1996) Plant Cell 8:629-643; Alexander et al., Proc. Natl. Acad. Sci. USA 90: 7327-7331 (1993)]. Для прикладу далі за текстом описано декілька характерних дослідів з вивчення опірності до захворювань. А. Дослід з вивчення опірності до Phytophthora parasitica (почорніння стебла). Досліди з вивчення опірності до Phytophthora parasitica, організму, що викликає почорніння стебла, проводять на рослинах віком шість тижнів, як це описано у [Alexander et al., Proc. Natl. Acad. Sci. USA 90: 7327-7331 (1993)]. Рослини замочують, дають добре висохнути і далі інокулюють шляхом внесення 10мл суспензії спорангію (300 спорангій/мл) у ґрунт. Інокульовані рослини витримують у теплиці при денній температурі 23-25°С і нічній температурі 20-22°С. Оцінка в'янення, що її використовують для досліду, буває такою: 0=немає симптомів; 1=немає симптомів; 1=деякі ознаки в'янення, з пониженою опухлістю; 2=чіткі ознаки в'янення, але без гниття або затримки росту; 3=чіткі ознаки в'янення із затримкою росту, але без чітких ознак гниття стебла; 4=сильне в'янення, з видимим гниттям стебла та деяким ураженням кореневої системи; 5=так само, як для 4, але рослини гинуть або вже загинули, причому спостерігається значна деградація кореневої системи. Результати усіх дослідів кількісно оцінюються "сліпим способом" на підставі випадкового відбору рослин. Б. Дослід з вивчення опірності до Pseudomonas syringae. Штам Pseudomonas syringae pv. tabaci #551 вводять у два нижні листки кількох рослин віком 6-7 тижнів у концентрації 106 або 3x106 на мл у Н2О. Кожну з шести конкретних рослин оцінюють у конкретний момент часу. Заражені Pseudomonas tabaci рослини оцінюють за п'ятибальною шкалою тяжкості захворювання, причому 5=100%-е омертвіння тканини, 0=немає симптомів. Т-тест (LSD) проводять на підставі оцінок за кожний день, і після оцінки середнього гранично допустимого значення тяжкості захворювання проводять групування рослин за згаданим показником. Значення, за якими стоїть одна і та ж сама літера дня оцінки, статистично мало відрізняються. В. Дослід з вивчення опірності до Cercospora nicotianae. Суспензією спор Cercospora nicotianae (ATCC №18366) (100,000-150,000 спор на мл) за допомогою безперервно діючого пристрою обприскують поверхні листків. Рослини зберігають в умовах 100%-ої вологості впродовж п'яти днів. Після цього рослини зволожують парами води 5-10 разів на добу. Кожну з шести конкретних рослин оцінюють у конкретний момент часу. Ступінь ураження рослин організмом Cercospora nicotianae оцінюють на підставі вимірювання площі поверхні листка, на якій виявлено симптоми захворювання (у %). Т-тест (LSD) проводять на підставі оцінок за кожний день, і після оцінки середнього гранично допустимого значення тяжкості захворювання проводять групування рослин за згаданим показником. Значення, за якими стоїть одна і та ж сама літера дня оцінки, статистично мало відрізняються. Г. Дослід з вивчення опірності до Peronospora parasitica. Досліди з вивчення для опірності до Peronospora parasitica виконують на рослинах у такий спосіб, який описано у [Uknes et al, (1993)]. Рослини інокулюють з активним ізолятом P. parasitica шляхом обприскування суспензією конідію (приблизно 5x104 спор на мілілітр). Інокульовані рослини інкубують в умовах високої вологості при 17°С у камері для вирощування з циклом світло/темрява 14 год на добу/10 год на добу. Рослини досліджують на 3-14 добу, в оптимальному варіанті на 7-12 добу, після інокуляції у присутності конідіофор. Крім того, декілька рослин після кожної обробки вибирають способом випадкового вибору і забарвлюють лактофенол-трипаном голубим [Keogh et al., Trans. Br. Mycol. Soc. 74: 329-333 (1980)], що дозволяє виконати мікроскопічне дослідження. Короткий опис малюнків На Фіг.1 представлено впорядкування послідовності білка NIM1 з ІkВa з тканин мишей, щурів та свиней. Вертикальні штрихи (І) над послідовностями вказують на ідентичність амінокислот між послідовностями NIM1 та ІkВa (матрична оцінка дорівнює 1,5); подвійні крапки (:) над послідовностями вказують на оцінку подібності >0,5; одинарні крапки (.) над послідовностями вказують на оцінку подібності 0,0; оцінка Ρ>0,1), що узгоджується з гіпотезою, за якою cim3 є домінантною, єдиною мутацією гена. Подальший відбір в результаті схрещування підтвердив, що cim3 було успадковано як домінантну мутацію. У випадку cim3 первинні рослини М2 було виявлено під час скринінгу, а популяцію М3 було виявлено з нормальним зовнішнім виглядом. Проте оскільки рослини cim3 самозапилювалися, деякі з ліній, що мають високу експресію, мали низьку здатність щодо репродукування потомства. Після зворотного схрещування з Col-gl1 одержували рослини з нормальними зовнішніми ознаками і здатністю до репродукування, а також з високою експресією PR-1. Під час початкової ідентифікації cim3 відзначалися також деякими ознаками пригнічення росту (карликовості) і тонкими покривленими листками. Проте рослини F2, одержані в результаті схрещування з екотипом СоІ-lg1, зберігали високу експресію генів SAR і не відрізнялися від природних рослин. Цим підтверджується, що фенотип з ознаками карликовості і покривленими листками утворився внаслідок незалежної мутації, не пов'язаної з конститутивною експресією генів SAR. Мутантний фенотип cim3 було також виявлено тоді, коли рослини вирощували у стерильних умовах, і цей факт підтверджує те, що накопичення мРНК PR-1 не викликалося патогеном. Приклад 15: експресія генів SAR. У додаток до PR-1, два інші гени SAR, PR-2 та PR-5, також відзначаються високою експресією у cim3. Рівні експресії генів SAR у різних нащадків відрізнялися один від одного, але завжди були вищими принаймні у 10 разів, ніж рівні експресії у контрольних рослинах, і були того ж самого порядку, що і рівні, одержані в результаті обробки природних рослин ΙΝΑ (0,25мг/мл) з індукуванням опірності. Приклад 16: Аналіз вмісту саліцилової кислоти. Було виявлено, що ендогенні концентрації SA збільшуються внаслідок індукованого патогеном некрозу у Arabidopsis [Uknes et al., 1993, supra]. Саліцилову кислоту та її глюкозний кон'югат аналізували у такий спосіб, який описано у [Uknes et al., 1993]. Тканину листків збирали з 10 рослин cim3 та 10 контрольних рослин віком 4 тижні. Листки з окремих рослини збирали та піддавали аналізу на предмет визначення експресії гена PR-1. Вимірювали рівні SA у рослин, що експресували PR-1. Концентрація вільної SA у cim3 була у 3,4 рази вищою, ніж у незаражених природних Arabidopsis (233±35 у порівнянні з 69±8нг/г ваги сирої речовини, відповідно). Вміст глюкозного кон'югату SA (SAG) був у 13,1 рази вищим у cim3, ніж у незаражених природних Arabidopsis (4519±473 vs. 344±58нг/г ваги сирої речовини, відповідно). Ці підвищені рівні SA та SAG є того ж самого порядку, що й рівні, відомі або для зараженої патогеном тканини, або для мутанта cpr. Приклад 17: Опірність до захворювання. cim3 оцінювали на предмет опірності до Peronospora parasitica (NoCo2), агента, що викликає захворювання несправжньою борошнистою росою у Arabidopsis. Тридцять cim3 (підтверджених експресією РНК PR-1) і тридцять контрольних рослин (екотип Columbia), кожний віком приблизно 4 тижні, інокулювали з P. parasitica, як це описано у [Uknes, et al. 1992, supra]. Через сім діб рослини піддавали аналізу на предмет споруляції і забарвлювали трипаном голубим з метою візуалізації грибкових структур, як описано у [Keogh et al. (1980) Trans. Br. Mycol. Soc. 74, 329-333 та у Koch and Slusarenko (1990) Plant Cell 2, 437-445]. У природних (Col-O) рослинах спостерігався ріст гіфів, конідій та ооспор, у той час як у природних рослинах, оброблених ΙΝΑ (0,25мг/мл), і у рослинах cim3 не було виявлено росту грибків. Зумовлена cim3 опірність зазвичай проявляється у вигляді нечисленної групи клітин, що відмерли, на ділянці зараження патогеном. Цей тип опірності є подібним до того, що спостерігається у мутантах Isd [Dietrich et al., 1994, supra; Weymann et al., 1995, supra] або у природних рослинах, у яких SAR було індуковано [Uknes et al., 1992, supra]. Час від часу виявляли фенотипи з проміжною опірністю, включаючи кінцевий некроз у сліді гіфального кінчика у рослинах cim3. Цей кінцевий некроз подібний до того, який виявлено у природних рослинах, оброблених низькими дозами SA або ΙΝΑ [Uknes et al., 1992, supra; Uknes et al., 1993, supra]. Проте на рослинах cim3 взагалі не було виявлено споруляції, у той час як на контрольних рослинах споруляцію спостерігали. Під час забарвлювання трипаном голубим на листках інокульованих cim3 не було виявлено спонтанних уражень. На додачу до опірності до грибкового патогену P. parasitica, cim3 також мають опірність до зараження бактеріальним патогеном Pseudomonas syringae DC3000. Природні рослини віком шість тижнів (± обробка ΙΝΑ) та рослини cim3 інокулювали з суспензією P. syringae DC3000, і за прогресуванням захворювання слідкували шляхом регулювання росту бактерій, екстрагованих із заражених листків, протягом деякого часу. Різниця між бактеріальними титрами у СоІ-О, СоІ-O+ΙΝΑ та cim3 як у день 0, так і у день 2, була статистично незначною. Проте на четвертий день спостерігали 31-разове зменшення росту колонії бактерій у природних рослинах по відношенню до рослин cim3 (Р
ДивитисяДодаткова інформація
Назва патенту англійськоюA method of protecting plants
Назва патенту російськоюСпособ защиты растений
МПК / Мітки
МПК: A01H 1/00, C12N 15/82, A01N 65/00, A01N 43/82, C12N 15/09, C12N 5/10, A01N 61/00, C07K 14/415
Мітки: ураження, спосіб, захисту, патогенами, рослин
Код посилання
<a href="https://ua.patents.su/82-73714-sposib-zakhistu-roslin-vid-urazhennya-patogenami.html" target="_blank" rel="follow" title="База патентів України">Спосіб захисту рослин від ураження патогенами</a>
Попередній патент: Пристрій сигналізації певного рівня температури в печах графітації
Наступний патент: Корпус апарата
Випадковий патент: Стоматологічна відбиткова ложка