5-[(1-арил-4-хлоро-1н-імідазол-5-іл)метил]-1,3-тіазолідин-2,4-діони, які виявляють гіпоглікемічну активність
Номер патенту: 105424
Опубліковано: 25.03.2016
Автори: Мельник Оксана Ярославівна, Чорноус Віталій Олександрович, Родік Роман Васильович, Ярош Олександр Кузьмич, Денисенко Ольга Миколаївна, Вовк Михайло Володимирович
Формула / Реферат
5-[(1-Арил-4-хлоро-1H-імідазол-5-іл)метил]-1,3-тіазолідин-2,4-діони загальної формули:
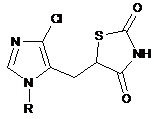 ,
,
де R=Ph (I), 2-MeC6H4 (II), 3-MeC6H4 (III), 4-MeC6H4 (IV), 4-MeOC6H4 (V),
які виявляють гіпоглікемічну активність.
Текст
Реферат: 5-[(1-Арил-4-хлоро-1H-імідазол-5-іл)метил]-1,3-тіазолідин-2,4-діони загальної формули: O Cl S N NH N R O . UA 105424 U (12) UA 105424 U UA 105424 U Корисна модель належить до органічної та фармацевтичної хімії, а саме до нових похідних 5-[(1-арил-4-хлоро-1H-імідазол-5-іл)метил]-1,3-тіазолідин-2,4-діонів загальної формули: O Cl S N NH N O R , 5 10 15 20 25 30 35 40 45 50 де R=Ph (I), 2-MeC6H4 (II), 3-МеС6Н4 (III), 4-МеС6Н4 (IV), 4-МеОС6Н4 (V). Запропоновані нові сполуки, спосіб їх отримання, властивості та застосування в науковій літературі і патентних виданнях не описані. В останні роки цукровий діабет (ЦД) набув безпрецедентних темпів поширення і став однією із найактуальніших проблем охорони здоров'я як у розвинутих країнах, так і країнах, що розвиваються. Якщо ще у 1998 ρ експерти Всесвітньої організації здоров'я (ВОЗ) припускали, що до 2025 ρ число хворих на ЦД у світі складе 380 млн. чоловік [1], то за даними Міжнародної асоціації діабету в 2011 р. чисельність хворих на ЦД вже досягла 366 млн., серед яких біля 90 % страждало на цукровий діабет 2-го типу (ЦД-2). За прогнозами експертів ВОЗ число хворих на цей тип діабету до 2030 р. сягне 552 млн. [2]. Основною причиною високої інвалідизації і смертельності хворих в працездатному віці служать макро- і мікросудинні ускладнення ЦД-2. В патогенезі їх розвитку і прогресування ключова роль належить хронічній гіперглікемії [3], адже навіть межове підвищення рівня глюкози в крові викликає достовірний ріст поширеності серцево-судинної патології. Масштабні рандомізовані дослідження [4-8] виявили значення жорсткого гіпоглікемічного контролю в пониженні ризику розвитку діабетичних судинних ускладнень, що вимагає проведення агресивної тактики лікування ЦД-2 із використанням ефективних і безпечних цукрознижуючих препаратів, що дозволяє досягнути цільового рівня глікемії і попередити прогресування атеросклерозу [9, 10]. В розвитку ЦД-2 приймають участь два основних патофізіологічних дефекти: інсулінорезистентність (IP) та дисфункція β-клітин підшлункової залози [11]. Інсулінорезистентність відноситься до найбільш ранніх метаболічних дефектів і є найпотужнішим фактором розвитку ЦД-2. При адекватній здатності β-клітин компенсувати підвищення рівня глюкози надлишковим продукування інсуліну зберігається стан нормоглікемії. З часом відбувається виснаження інсуліносекреторної здатності β-клітин і концентрація глюкози в крові підвищується. В результаті хронічної гіперглікемії розвивається глюкозотоксичність, яка несприятливо діє на скелетну мускулатуру і β-клітини підшлункової залозі: відбувається посилення наявної IP і подальше порушення секреції інсуліну. Саме IP розглядається як базове патофізіологічне явище, а його корекція набуває провідну роль в терапії ЦД-2. Серед вживаних в даний час пероральних цукрознижуючих препаратів найпотужнішим впливом на інсулінорезистентність відзначаються сполуки ряду тіазоліндіонів (ТЗД), для яких ще використовується узагальнююча назва глітазони. Препарати цієї групи є синтетичними лігандами ядерних γ-рецепторів, які активуються проліфератором пероксисом PPAR γ. Їх основний терапевтичний ефект полягає у збільшенні чутливості периферійних тканин до інсуліну і, як наслідок - поліпшенні утилізації глюкози. Дія препаратів пов'язана із їх впливом на експресію генів в адиноцитах і активізацією диференціювання преадиноцитів в адиноцити, що приводить до утворення популяції чутливих до інсуліну жирових клітин [12]. При цьому терапія ТЗН сприяє зниженню ризику розвитку ускладнення серцево-судинних захворювань: гіперглікемії (пониження рівня глюкозильованого гемоглобіну), гіпертонії (пониження артеріального тиску), дисліпідемії (підвищення рівня холестерину ліпопротеїдів високої щільності), маркерів ендотеліального запалення (пониження рівня С-реактивного білка), маркерів підвищеного тромбоутворення (пониження рівня інгібітора активатора плазміногену-1) [13]. В той же час під впливом глітазонів у пацієнтів можливе підвищення чутливості до інсуліну гепатоцитів та периферійних тканин, зростання інсулінзалежних витрат глюкози, зменшення виведення глюкози із печінки, зниження рівня глюкози, інсуліну і глюкозильованого гемоглобіну у крові. Перераховані факти створюють вагомі підстави для системного пошуку нових біоактивних сполук гіпоглікемічної дії із вищим коефіцієнтом ефективність-безпечність. 1 UA 105424 U Найближчим аналогом за структурою та гіпоглікемічною дією до сполук, які заявляються, є медичний препарат піоглітазон [14-16] (5-{4-[2-(5-етилпіридин-2-іл)етокси]бензил}тіазолідин-2,4діон), якийв даний час застосовується при терапії ЦД-2. O HN O S N O 5 10 15 20 Разом з тим використання піоглітазону в 2012 р. було різко обмежено, оскільки виникли підозри на можливість серйозних побічних кардіоваскулярних ефектів, змін в ліпідному профілі, а також при тривалому застосуванні високого ризику розвитку раку нирок [17] Задачею винаходу є синтез нових ефективних сполук з вираженим гіпоглікемічним ефектом. Зважаючи на широкий спектр біологічної дії похідних імідазолу [18, 19] та 1,3-тіазолідину [20, 21], вирішення поставленого завдання досягається синтезом їх нових гібридних структур - 5-[(1арил-4-хлоро-1H-імідазол-5-іл)метил]-1,3-тіазолідин-2,4-діонів. Для одержання заявлених сполук нами запропонована препаративно зручна двостадійна схема, яка базується на конденсації доступних 1-арил-4-хлоро-5-формілімідазолів [22] із 1,3тіазолідин-4-оном із подальшим гідруванням сформованого екзоциклічного іліденового зв'язку. Показано, що при 2 год. нагріванні 4-хлоро-1-арил-5-формілімідазолів із 1,3-тіазолідин-4-оном в киплячому толуолі в присутності каталітичних кількостей оцтової кислоти та піперидину утворюються відповідні 5-[(1-арил-4-хлоро-1H-імідазол-5-іл)метилен]-1,3-тіазолідин-4-они з виходами 67-80 %. Відновлення їх екзоциклічного СН=С зв'язку магнієм в метанольному розчині приводить до цільових 5-[(1-арил-4-хлоро-1H-мідазол-5-іл)метил]-1,3-тіазолідин-2,4-діонів (I-V) із виходами 67-73 %. CH=O + O N H S N S N N O Cl Cl O NH N O R R O Cl MeOH S N Mg NH N O R I-V , 25 30 де R=Ph (I), 2-MeC6H4 (II), 3-МеС6Н4 (III), 4-МеС6Н4 (IV), 4-МеОС6Н4 (V). Схема ілюструється прикладами синтезу цільових сполук, структура яких підтверджена 1 аналітичними даними і результатами вимірів ІЧ-, ЯМР H та хроматомас-спектрів. Загальний спосіб одержання 5-[(1-арил-4-хлоро-1H-імідазол-5-іл)метилен]-1,3-тіазолідин2,4-онів. До суміші 0.005 моль відповідного 5-форміл-4-хлороімідазолу, 0.59 г (0,005 моль) 1,3тіазолідин-2,4-діону у 20 мл сухого толуолу додають 0.5 мл оцтової кислоти та 0.5 мл піперидину. Суміш нагрівають при кипінні впродовж 2-х год., осад, що утворився, відфільтровують, промивають етанолом, водою та кристалізують із диметилформаміду. Приклад 1 2 UA 105424 U 5 10 15 20 25 30 35 40 45 50 55 5-[(1-Феніл-4-хлоро-1H-імідазол-5-іл)метилен]-1,3-тіазолідин-2,4-діон. Вихід 74 %, т. топл. -1 1 >250 °C. ІЧ спектр, ν, см : 1612 (С=С), 1711 (С=О), 1740 (С=О), 3476 (Ν-Η). Спектр ЯМР H, 2 13 δ,м.ч.: 7.30 с (1Н, НС=), 7.52-7.61 м (5Наром), 8.24 с(1Н, Н імідазол), 12.60 (ΝΗ). СпектрЯМР С, δ, 5 5 м.ч.: 116.82 (СН=), 121.86 (С тіазолідин), 125.65 (С імідазол), 125.72, 129.28, 129.82, 134.86 (С аром.), 4 2 4 2 131.43 (С імідазол), 140.08 (С імідазол), 166.53 (С тіазолідин), 167.72 (С тіазолідин). Знайдено, %: С 51.33; Η + 2.48; Ν 1395.[M+l] 306. C13H8ClN3O2S. Вирахувано, %: С 51.07; Η 2.64; Ν 13.74. Μ 305.74. Приклад 2 5-{[1-(2-Метилфеніл)-4-хлоро-1H-імідазол-5-іл]метилен}-1,3-тіазолідин-2,4-діон. Вихід 76 %, -1 т. топл. >250 °C. ІЧ спектр, ν, см : 1614 (С=С), 1713 (С=О), 1742 (С=О), 3470 (Ν-Η). Спектр ЯМР 1 2 H, δ, м.ч.:2.04с (3Н, СН3), 7.11с (1Н, НС=), 7.44-7.53м (4Наром), 8.16с (1Н, Н імідазол), 12.58 с (1Н, 13 5 5 ΝΗ). Спектр ЯМР С, δ, м.ч.: 16.33 с (3Н, СН 3), 116.00 (СН=), 122.29 (С тіазолідин), 124.43(С імідаол), 2 4 127.04, 128.28, 130.15, 131.39, 133.77, 135.33(Саром.), 140.53(С імідазол), 166.75(С тіазолідин), 167.41 2 + (С тіазолідин). Знайдено, %: С 52.68; Η 3.02; Ν 13.31.[Μ+1] 320. C14H10ClN3O2S. Вирахувано, %: С 52.59; Η3.15; Ν 13.14. Μ 319.76. Приклад 3 5-{[1-(3-Метилфеніл)-4-хлоро-1H-імідазол-5-іл]метилен}-1,3-тіазолідин-2,4-діон. Вихід 76 %, -1 т. топл. >250 °C. ІЧ спектр, ν, см : 1614 (C=С), 1715 (С=О), 1744 (С=О), 3472 (Ν-Η). Спектр ЯМР 1 2 H, δ, м.ч.: 2.39с (3Н, СН3),7.29-7.49 м (5Н, 4Наром+НС=), 8.18с (1Н, Н імідазол), 12.52с (1Н, ΝΗ). 13 5 Спектр ЯМР С, δ, м.ч.: 20.47 (СН3), 18.74 с (3Н, СН3), 116.27 (СН=), 122.73 (С тіазолідин), 5 2 124.17(С імідазол), 126.88, 127.94, 129.86, 131.44, 133.52, 135.70 (Саром.), 140.18 (С імідазол), 166.32 4 2 + (С тіазолідин)9 167.48 (C тіазолідин). Знайдено, %: С 52.32; Η 3.04; N13.29. [МН] 320. C14H10ClN3O2S. Вирахувано, %: С 52.59; Η 3.15; Ν 13.14. Μ 319.76. Приклад 4 5-{[1-(4-Метилфеніл)-4-хлоро-1H-імідазол-5-іл]метилен}-1,3-тіазолідин-2,4-діон. Вихід 80 %, -1 т. топл. >250 °C. ІЧ спектр, ν, см :1611 (С=С), 1710 (С=О), 1742 (С=О), 3475 (Ν-Η). Спектр ЯМР 1 2 H, δ, м.ч.: 2.40 с (3Н, СН3), 7.27 с (1Н, НС=), 7.40 с (4Наром.), 8.19 с (1Н, Н імідазол), 12.58 (1H, ΝΗ). 13 5 5 Спектр ЯМР С, δ, м.ч.: 20.32 (СН3), 116.90 (СН=), 121.85 (С тіазолідин), 125.44 (С імідазол), 125.52, 4 2 4 130.03, 132.29, 139.28 (Саром.), 137.14 (С імідазол), 139.94 (С імідаол), 166.66 (С тіазолідин), 167.42 2 + (С тіазолідин). Знайдено, %: С 52.40; Η 3.32; Ν 13.31. [М+\] 320. C14H10ClN3O2S. Вирахувано, %: С 52.59; Η 3.15; Ν 13.14. Μ 319.76. Приклад 5 5-{[1-(4-Метоксифеніл)-4-хлоро-1H-імідазол-5-іл]метилен}-1,3-тіазолідин-2,4-діон. Вихід -1 67 %, т. топл. 246-247 °C. ІЧ спектр, ν, см : 1614 (С=С), 1708 (С=О), 1745 (С=О), 3478 (Ν-Η). 1 Спектр ЯМР H, δ, м.ч.: 3.84 с (3Н, СН3О), 7.08 д (2Наром., J 8.8 Гц), 7.26 с (1Н, НС=), 7.45 д 2 13 (2Наром., J 8.8 Гц), 8.17 с (1Н, Н імідазол), 12.59с (1Н, ΝΗ). Спектр ЯМР С, δ, м.ч.: 55.36 (СН3О), 5 5 116.71(НС=), 114.62, 127.17, 127.52, 159.89(Саром.), 122.09 (С тіазолідин), 125.08 (С імідазол), 131.13 4 2 4 2 (С імідазол), 140.24 (С імідазол), 166.72 (С тіазолідин), 167.46 (С тіазолідин). Знайдено, %: С 49.83; Η 3.15; + Ν 12.38. [M+l] 336. C14H10ClN3O3S. Вирахувано, %: С 50.08; Η 3.00; Ν 12.52. Μ 335.76. Загальний спосіб одержання 5-[(1-арил-4-хлоро-1H-імідазол-5-іл)метил]-1,3-тіазолідин-2,4діонів (I-V). До 30 мл сухого метанолу при перемішуванні додають 0.12 г (0.005 моль) магнію (стружки) і 1 кристалик йоду, а через 5 хв. 0.001 моль відповідного [(імідазол-5-іл)метилен]-1,3тіазолідин-2,4-діону. Реакційну суміш перемішують до розчинення магнію, фільтрують, фільтрат підкислюють оцтовою кислотою і додають 50 мл води. Органічну фазу екстрагують метиленхлоридом, сушать, випарюють розчинник, залишок кристалізують з етанолу. Приклад 6 5-[(1-Феніл-4-хлоро-1H-імідазол-5-іл)метил]-1,3-тіазолідин-2,4-діон. Вихід 68 %, т. топл. 201-1 1 202 °C. ІЧ спектр, ν, см : 1703 (С=О), 1755 (С=О), 3470, 3482 (Ν-Η). Спектр ЯМР H, δ, м.ч.: 3.18 l 2 l 2 l 2 дд (1Н, J 16.0 Гц, J 5.6 Гц), 3.43 дд (1Н, J 16.0 Гц, J 5.0 Гц), 4.39 дд (1Н, J 10.0 Гц, J 5.0 Гц), 2 13 7.29-7.58 м(5Наром.), 7.86с (1Н, Н імідазол), 12.09 с (1Н, NH). Спектр ЯМР С, δ, м.ч.: 25.98 (СН2), 5 5 4 50.45 (С тіазолідин), 127.71 (С імідазол), 126.02, 129.04, 129.59, 135.33 (Саром.), 128.14 (С імідазол), 2 2 4 136.65 (С імідазол)·. 171.20 (С тіазолідин), 174.67 (С тіазолідин). Знайдено, %: С 50.95; Η 3.09; Ν 13.81. + [М+1] 308. C13H10ClN3O2S. Вирахувано, %: С 50.74; Η 3.28; Ν 13.65. Μ 307.75. Приклад 7. 5-{[1-(2-Метилфеніл)-4-хлоро-1H-імідазол-5-іл]метил}-1,3-тіазолідин-2,4-діон. Вихід 70 %, т. -1 1 топл. 222-223 °C. ІЧ спектр, ν, см : 1700 (С=О), 1752 (С=О), 3470, 3486 (Ν-Η). Спектр ЯМР H, δ, l 2 l 2 l 2 м.ч.: 3.09 дд (1Н, J 15.8 Гц, J 5.2 Гц), 3.41 дд (1Н, J 15.8 Гц, J 5.2 Гц), 4.31 дд ( J 10.4 Гц, J 5.2 2 13 Гц), 7.39-7.49 м (4Наром.), 7.80 с (1Н, Н імідазол), 12.08с (1H, NH). Спектр ЯМР С, δ, м.ч.: 16.88 5 5 (СН3), 25.92 (СН2), 50.36 (С тіазолідин), 122.68 (С імідазол), 128.07, 127.89, 129.83, 131.26, 134.07, 4 2 2 4 135.72 (Саром.), 127.34 (С імідазол), 136.47 (С імідазол), 171.14 (С тіазолідин), 174.88 (С тіазолідин). 3 UA 105424 U + 5 10 15 20 25 30 35 40 45 50 55 Знайдено, %: С 52.54; Η 3.84; Ν 12.87. [Μ+1] 322. C14H12ClN3O2S. Вирахувано, %: С 52.26; Η 3.76; Ν 13.06. Μ 321.78. Приклад 8. 5-{[1-(3-Метилфеніл)-4-хлоро-1H-імідазол-5-іл]метил}-1,3-тіазолідин-2,4-діон. Вихід 69 %, т. -1 1 топл. 190-192 °C. ІЧ спектр, ν, см : 1702 (С=О), 1755 (С=О), 3474, 3489 (Ν-Η). Спектр ЯМР H, δ, l 2 l 2 м.ч.: 2.39 с (3Н, СН3), 3.16 дд (1Н, J 16.2 Гц, J 5.0 Гц), 3.44 дд (1Н, J 16.2 Гц, J 5.0 Гц), 4.39 дд l 2 2 (1Н, J 12.0 Гц, J 5.2 Гц), 7.27-7.48 м (4Наром.), 7.82с (1Н, Н імідазол), 12.44с (1Н, NH). Спектр ЯМР 13 5 5 С, δ, м.ч.: 20.47 (СН3), 25.98 (СН2), 50.05 (С тіазолідин), 122.99 (С імідазол), 122.65, 126.38, 129.61, 4 2 2 129.91, 135.21, 139.61 (Cаром.), 128.05 (С імідазол), 136.53 (С імідазол), 171.16 (С тіазолідин), 174.65 4 + (С тіазолідин). Знайдено, %: С 52.12; Η 3.61; Ν 13.24. [M+l] 322. C14H12C1N3O2S. Вирахувано, %: С 52.26; Η 3.76; Ν 13.06. Μ 321.78. Приклад 9. 5-{[1-(4-Метилфеніл)-4-хлоро-1H-імідазол-5-іл]метил}-1,3-тіазолідин-2,4-діон. Вихід 73 %, т. -1 1 топл. 195-196 °C. ІЧ спектр, ν, см : 1701 (С=О), 1754 (С=О), 3476, 3490 (Ν-Η). Спектр ЯМР H, δ, 1 2 1 2 м.ч.: 2.38 с (3Н, СН3), 3.18 дд (1Н, J 16.0 Гц, J 5.2 Гц), 3.42 дд (1Н, J 16.0 Гц, J 5.2 Гц), 4.40 дд l 2 2 13 (1Н, J 10.0 Гц, J 5.0 Гц), 7.40 с (4Наром.), 7.80 с (1H, Н імідазол), 12.08 с (1Н, NH). Спектр ЯМР С, 5 5 δ, м.ч.: 20.65 (СН3), 26.00 (СН2), 50.24 (С тіазолідин), 122.71 (С імідазол), 125.74, 130.05, 132.82, 4 2 2 4 138.92 (Саром.), 128.00 (С імідазол), 136.57 (С імідазол), 171.15 (С тіазолідин), 174.65 (С тіазолідин). + Знайдено, %: С 52.50; Η 3.85;Ν 13.14. [M+l] 322. C14H12ClN3O2S. Вирахувано, %: С 52.26; Η 3.76; Ν 13.06. Μ 321.79. Приклад 10. 5-{[1-(4-Метоксифеніл)-4-хлоро-1H-імідазол-5-іл]метил}-1,3-тіазолідин-2,4-діон. Вихід 67 %, -1 1 т. топл. 146-147 °C. ІЧ спектр, ν, см : 1703 (С=О), 1757 (С=О), 3472, 3484 (Ν-Η). Спектр ЯМР H, 1 2 1 2 1 δ, м.ч.: 3.14 дд (1Н, J 16.2 Гц, J 5.2 Гц), 3.44 дд (1Н, J 16.2 Гц, J 5.2 Гц), 4.40 дд (1Н, J 9.8 Гц, 2 2 J 5.2 Гц), 7.09 д (2Наром., J 8.6 Гц), 7.43 д (2Наром., J 8.6 Гц), 7.78 с (1Н, Н імідазол), 12.01c (1H, NH). 13 5 5 Спектр ЯМР C, δ, мл.: 25.12 (CH2), 50.17 (С тіазолідин), 55.07 (СН3О), 122.41 (С імідазол), 115.07, 4 2 2 126.93, 127.80, 157.14 (Саром.), 128.74 (С імідазол), 136.44 (С імідазол), 170.64 (С тіазолідин), 172.68 4 + (С тіазолідин). Знайдено, %: С 50.03; Η 3.38; Ν 12.27. [M+l] 338. C14H12ClN3O3S. Вирахувано, %: С 49.78; Η 3.58; Ν 12.44. Μ 337.78. Приклад 11 Дослідження гіпоглікемічної дії 5-[(1-арил-4-хлоро-1H-імідазол-5-іл)метил]-1,3-тіазолідин-2,4діонів (I, III, V). Експериментальні дослідження проводилися in vivo на білих безпородних мишах масою 2030 г. Тварин розділяли на 3 групи: 1) контрольна, мишам якої перорально зондом вводили суміш, яка складалася із 0,1 мл диметилсульфоксиду (ДМСО) (розчинник) з добавкою 3 %-ного крохмального гелю; 2) піддослідна, тваринам якої вводили досліджувану речовину в 0,1 мл ДМСО з добавкою 3 %-ного крохмального гелю; 3) група мишей, яким вводили піоглітазон в 0,1 мл ДМСО з добавкою 3 %-ного крохмального гелю. Спочатку проводили первинний скринінг на гіпоглікемічну активність всіх речовин цього типу з використанням наступних доз: 1, 10 та 100 мг/кг маси тварин. Потім відбирали одну найактивнішу сполуку та ретельно досліджували її дію в дозі 1 мг/кг на 10 мишах. Контроль рівня глюкози в крові мишей здійснювали глюкометром Rightest GM 110 корпорації BIONIME (Швейцарія), зареєстрованим в МОЗ України і дозволеним до застосування в медичній практиці (свідоцтво держ. реєстрації № 7674/2008). Вміст глюкози визначався за допомогою одноразових тест-смужок Rightest GS 300, капіляр яких заповнювався краплею капілярної крові, взятої з надрізу дистального відділу хвоста миші. У кожної миші вимірювали вихідний рівень глюкози в крові в ммоль/л, а потім процедуру повторювали через 1, 3, 5, 8 та 24 год. після введення відповідних розчинів досліджуваних сполук піддослідним тваринам та розчинника - контрольним. У мишей за 1 год. перед початком експерименту вилучали з кліток корм, але залишали вільний доступ до води, а після 8-ми год. голодування в процесі експерименту знову допускали до корму. Одержані результати динаміки рівня глюкози в крові тварин статистично обробляли за методом [23] з використанням програми Microsoft Excel. Експериментальні дані первинного скринінгу (у %) усереднені та представлені в табл. 1. 4 UA 105424 U Таблиця 1 Зміна рівня глюкози в крові мишей (у % до вихідного стану) після введення тваринам сполук (І-ІII) Сполука І III V Еталон (піоглітазон) Контроль 5 Доза, мг/кг 100 10 1 100 10 1 100 10 1 100 10 1 1 -3,9 -17,9 -11,3 -34,4 -19,9 -14,4 -23,3 -20,0 -19,2 -6,0 -4,3 -2,2 -0,5 Час після введення сполуки (І), год. 3 5 8 -48,1 -58,2 -60,3 -43,7 -52,8 -59,2 -40,3 -52,5 -56,8 -43,7 -41,9 -27,4 -40,4 -25,0 -23,5 -30,8 -28,6 -23,1 -36,4 -35,3 -19,4 -36,7 -35,6 -19,1 -32,9 -27,6 -14,9 -18,6 -28,1 -13,3 -18,1 -12,55 -9,7 -11,7 -8,2 -8,3 -10,5 -5,8 -6,1 24 -4,7 -4,5 -13,9 -10,9 8,33 -7,7 -6,4 -6,1 -3,5 1,2 9,1 3,5 -0,02 Отримані результати показують, що речовини (І, III, V) знижують концентрацію глюкози в крові мишей більш ефективно ніж референтний препарат піоглітазон. Серед них сполука (І) за абсолютним значенням концентрації глюкози в крові показала найбільше зниження її рівня. Саме тому вона була вибрана для поглиблених досліджень гіпоглікемічної дії. Отримані абсолютні дані представлені в табл. 2, а відносні (у % до вихідного стану) - на Фіг.1. Таблиця 2 Зміна концентрації глюкози в крові мишей після перорального введення тваринам сполукилідера (І) Час після введення (год.) Показник Вихідний 1 стан Контроль (розчинник) Μ 7,40 7,32 ±m 0,25 0,22 Сполука (І), 1 мг/кг Μ 8,50 7,38* ±m 0,24 0,32 Сполука (І), 10 мг/кг Μ 8,48 7,12* ±m 0,24 0,36 Сполука (І), 100 мг/кг Μ 8,78 7,50* ±m 0,26 0,64 Піоглітазон, 1 мг/кг Μ 7,20 6,95 ±m 0,31 0,29 Піоглітазон, 10 мг/кг Μ 6,46 6,18* ±m 0,37 0,35 Піоглітазон, 100 мг/кг Μ 7,08 6,65 ±m 0,36 0,38 * Ρ < 0,05 відносно вихідного рівня 3 5 8 24 6,62 0,23 6,87 0,27 6,94 0,33 7,38 0,19 6,12* 0,32 5,40* 0,36 6,12* 0,38 7,97 0,54 5,75* 0,41 4,95* 0,32 4,68* 0,32 8,10* 0,22 4,78* 0,38 4,15* 0,34 4,40* 0,34 7,62* 0,70 6,31* 0,30 6,53* 0,37 6,49 0,34 7,41 0,29 5,24* 0,30 5,68* 0,50 5,82* 0,42 6,96 0,27 5,75* 0,43 5,10* 0,49 6,12* 0,54 7,05 0,68 10 5 UA 105424 U 5 10 15 20 25 30 35 40 45 50 55 60 Наведені на Фіг. 1 дані свідчать, що гіпоглікемічна активність сполуки (І) у всіх досліджуваних дозах значно перевершує дію піоглітазону. Так, зниження концентрації глюкози в крові мишей після введення розчину сполуки (І) в дозі 100 мг/кг характеризується досить швидким наростанням ефекту та його тривалістю. Зокрема, через 1 год. рівень глюкози знижується в середньому на 15,7 %, через 3 год. - на 45,6 %, через 5 год. - на 53,1 %. В дозах 10 та 1 мг/кг сполука (І) також проявляє потужну гіпоглікемічну активність, яка значно перевершує дію піоглітазону не тільки в аналогічних дозах, але в дозі 100 мг/кг. Гіпоглікемічний ефект сполуки (І) триває впродовж 24 год., в той час як піоглітазон у всіх досліджених дозах (1, 10 та 100) викликає значно менший вплив на рівень глюкози в крові мишей та тривалість гіпоглікемічного ефекту. Таким чином, синтезовані сполуки можуть бути прототипами для розробки нових високоефективних гіпоглікемічних лікарських засобів. Джерела інформації: st 1. World Health Organization: The World Health Report 1998. Life in 21 Century-a Vizion for All. Geneva: World Health Organization, 1998. 2. Сунцов Ю.И. Современные сахароснижающие препараты, используемые при лечении сахарного диабета 2 типа // Сах. диабет. - 2012. - № 1. - С. 6-10. 3. Cleary P., Orhard Т., Zimman В. Coronary calcification in the diabetes control and complication td trial (DCCT/EDIC) cohort for the DCCT/EDIC study group program and abstract of ADA 63 Annual Scientific sessin; June 13-17 2003; New Orlean, Louisiana. 4. Ярош O.K. "Гіпоенергетичний синдром" як перспектива медикаментозних шляхів профілактики та лікування гіпертонії, діабету, атеросклерозу та ожиріння, що основані на нових поглядах їх етіопатогенезу та взаємозв'язку. // Тези доп. IV національного з'їзду фармакологів України. Фармакологія та лікарська токсикологія. - 2011. - № 5(24). - С. 390-392. 5. UK Prospective Diabetes Study Group: Intensive blood glucose control with sulfonylureas or insulincompard with conventional treatment and risk of complications in patients with type 2 diabetes // Lancet. - 1998. - Vol. 352. - P. 837-852. 6. Kahn S.E., Zimman В., Lachin J.M. A Diabetes Outcome Progressin Trial Study Group. Rosglitazone-associated fractures in type 2 diabetes: an analysis from A Diabetes Outcome Progression Trial // Diabetes Care. - 2008. - Vol. 31. - P. 845-851. 7. Patel Α., MacMahon S., Chalmers J. Advance Collaborative Group. Intensive blood glucose control and vascular outcomes in patients with type 2 diabetes // New Engl. J. Med. - 2008. - Vol. 358. - P. 2560-2572. 8. Wilcox R., Kupfer S., Erdman E. Proactive study investigators. Effects of pioglitazone on major adverse cardiovascular events in high-risk patients with type 2 diabetes: results from prospective pioglitazone clinical trial in macro vascular events//Amer. Heart J. - 2008. - Vol. 155. - P. 712-717. 9. Halmann R.R., Paul S.K., Bethel M.A. 10-year follow-up of intensive glucoze control in types 2 diabetes // New Engl. J. Med. - 2008.0 Vol. 359. - P. 1577-1589. 10. Gaede P., Valentine W.J., Palmer A.J. Costeffectiveness of intensified versus conventional multifactorial intervention in type2 diabetes: results and projections from the Steno-2 study // Diabetes Care.-2008. - Vol. 31. - P. 1510-1515. 11. Аметов А.С. Инсулиносекреция и инсулинорезистентность: две стороны одной медали // Проблемы эндокринологии - 2002. - Т.48, № 3. - С. 31-36. 12. ArnerP. Free fatty acids-do they play a central role in type 2 diabetes? // Diabetes Obes Metab. - 2001. - Vol. 3. - P. 11-19. 13. Kendall D.M., Sobel B.E., Coulston A.M., Peters H.A.L., McLean B.K., Peragallo-Dottko V., Buse J.B., Fonseca V.A., Hill J.O., Nesto R.W., Sunyer F.X. The insulin resistanse syndrom and coronary artery desease // Coron. Artery Des. - 2003. - Vol. 14. - P. 335-348. 14. Ikeda H. Discovery of The Thiazolidinediones Class and its Distinct Futures. Insulin Resistence, Dyslipidemia, and Type 2 Diabetes. Opportunities Offered by the Thiazolidinediones. 36 th Annual Meeting of the European Association for The Study of Diabetes. Report, 2000, 3. 15. Александров Α.Α., Кухаренко С.С, Ядрихинская Μ.Η., Шацкая О.Α., Дроздова Ε.Η. Тиазолидиндионы: "герои нашего времени" // Лечащий врач. - 2012. - № 11. - С. 23-27. 16. Inzucchi S.E. Oral Antigiperglicemic Therapy for Type 2 Diabetes // Journ. Amer. Med. Assoc2002. - Vol. 287, № 3. - P. 360-372. 17. Mannuci E., Monami M., Lamonna C, Gensini G.F., Marchioni N. Pioglitazone and cardiovascular risk. A comprehensive meta-analysis of randomized clinical trials // Diabets Obes Metabolites. 2008.- Vol. 10, № 12, - P. 1221-1235. 18. Middlemis D., Watson. A medical chemistry case study: an account of on angiotensin II antagonist drug discovery programme // Tetrahedron. - 1994. - Vol. 50, № 46. - P. 13049-1380. 6 UA 105424 U 5 10 19. Narasimphan В., Sharma D., Kumar P. Biological importance of imidazole nucleas in the new millenium // Med. Chem. Res. - 2011. - Vol. 20, № 8. - P. 1119-1140. 20. Mendgen Т., Steuer C, Klein C.D. Privileged scaffolds or promiscuous binders: a comparative study on rhodanines and related heterocycles in medicinal chemistry // J. Med. Chem. - 2012. - Vol. 55, N 2. - P. 743-753. 21. Tomasic Т., Masic L.P. Rhodanine as a scaffold in drug discovery: a critical review of its biological activities and mechanisms of target modulation // Expert Opin. Drug Discovery. - 2012. Vol. 7, N7. - P. 549-560. 22. Чорноус Β.Α., Грозав Α.Η., Русанов Э.Б., Нестеренко A.M., Вовк М.В. Полифункциональные имидазолы. II. Синтез и реакции с нуклеофильными реагентами 1замещенных 2,4-дихлоро-1H-имидазол-5-карбальде-гидов// Журн. орг. химии. 2011. - Т. 47, № 5. - С. 699-706/ 22. Монцевичюте-Эрингене Е.В. Упрощенные математико-статистические методы в медицинской исследовательской работе // Патолог, физиология. - 1964. - № 4. - С. 71-78. 15 ФОРМУЛА КОРИСНОЇ МОДЕЛІ 5-[(1-Арил-4-хлоро-1H-імідазол-5-іл)метил]-1,3-тіазолідин-2,4-діони загальної формули: O Cl S N NH N 20 R O , де R=Ph (I), 2-MeC6H4 (II), 3-MeC6H4 (III), 4-MeC6H4 (IV), 4-MeOC6H4 (V), які виявляють гіпоглікемічну активність. Комп’ютерна верстка О. Рябко Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 7
ДивитисяДодаткова інформація
Назва патенту англійською5-[(1-aryl-4-chloro-1h-imidazol-5-yl)methyl]-1,3-thiazolidin-2,4-diones exhibiting hypoglycemic activity
Автори англійськоюVovk Mykhailo Volodymyrovych, Chornous Vitalii Oleksandrovych, Melnyk Oksana Yaroslavivna, Denysenko Olha Mykolaivna, Rodik Roman Vasyliovych, Yarosh Oleksandr Kuzmych
Назва патенту російською5-[(1-арил-4-хлоро-1н-имидазол-5-ил)метил]-1,3-тиазолидин-2,4-дионы, которые проявляют гипогликемическую активность
Автори російськоюВовк Михаил Владимирович, Чорноус Виталий Александрович, Мельник Оксана Ярославна, Денисенко Ольга Николаевна, Родик Роман Васильевич, Ярош Александр Кузьмич
МПК / Мітки
МПК: A61K 31/425, C07D 233/54, A61K 31/395, C07D 277/20
Мітки: гіпоглікемічну, 5-[(1-арил-4-хлоро-1н-імідазол-5-іл)метил]-1,3-тіазолідин-2,4-діони, активність, виявляють
Код посилання
<a href="https://ua.patents.su/9-105424-5-1-aril-4-khloro-1n-imidazol-5-ilmetil-13-tiazolidin-24-dioni-yaki-viyavlyayut-gipoglikemichnu-aktivnist.html" target="_blank" rel="follow" title="База патентів України">5-[(1-арил-4-хлоро-1н-імідазол-5-іл)метил]-1,3-тіазолідин-2,4-діони, які виявляють гіпоглікемічну активність</a>
Попередній патент: Пристрій для управління оптимальний за швидкодією, стійкий до короткочасних впливів, що збурюють
Наступний патент: 5-[(1-арил-4-хлоро-1н-імідазол-5-іл)метилен]-1,3-тіазолідин-2,4-діони, які виявляють гіпоглікемічну активність
Випадковий патент: Клавіатура комп'ютера та спосіб позначення її багатофункціональних клавіш












