1-арил-4-хлоро-5-(трифторометил)-1н-імідазоли, які виявляють протитуберкульозну активність
Номер патенту: 70746
Опубліковано: 25.06.2012
Автори: Тодоріко Лілія Дмитрівна, Єременчук Інга Василівна, Чорноус Віталій Олександрович, Бездудний Андрій Васильович, Демидовська Світлана Анатоліївна, Вовк Михайло Володимирович, Грозав Аліна Миколаївна
Формула / Реферат
1-Арил-4-хлоро-5-(трифторометил)-1Н-імідазоли загальної формули:
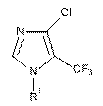 ,
,
де R1=Ph (І); R1=4-ClC6H4 (II); Rl=1-нафтил (III),
які виявляють протитуберкульозну активність.
Текст
Реферат: 1-Арил-4-хлоро-5-(трифторометил)-1Н-імідазоли загальної формули: , 1 1 l де R =Ph (І); R =4-ClC6H4 (II); R =1-нафтил (III), які виявляють протитуберкульозну активність. ЯКІ ВИЯВЛЯЮТЬ UA 70746 U (12) UA 70746 U UA 70746 U Корисна модель належить до органічної хімії та медицини (може бути використана у фтизіатрії, інфектології, для лікування хворих на туберкульоз легень, у тому числі і мультирезистентний), а саме до нових похідних 1-арил-4-хлоро-5-(трифторометил)-1Німідазолів загальної формули: 5 10 15 20 25 30 35 40 45 , 1 1 1 де R =Ph (I); R =4-ClC6H4 (II); R =1-нафтил (III). Запропоновані нові сполуки, спосіб їх отримання, властивості та застосування в науковій літературі і патентних виданнях не описані. В останні десятиліття в Україні, як і в цілому у світі, на тлі стабілізації рівня захворюваності на туберкульоз легень (ТБ) відзначається зростання питомої ваги штамів, резистентних до одного або кількох антимікобактеріальних препаратів (АМБП) препаратів, що є основною причиною зниження ефективності хіміотерапії, збільшення кількості пацієнтів з деструктивними формами, зростання частоти великих залишкових посттуберкульозних змін, розвитку рецидивів захворювання та є несприятливим епідеміологічних чинником щодо подальшого поширення туберкульозної інфекції [2, 4, 10]. Щороку відсоток виникнення нових випадків ТБ з первинною медикаментозною стійкістю збільшується [5]. У світі близько 50 млн. осіб інфіковано резистентними штамами мікобактерій туберкульозу (МБТ) до АМБП [8, 10, 12]. Характерною особливістю мікобактерій туберкульозу є їх надзвичайна мінливість, завдяки якій вони здатні швидко звикати до антибактеріальних препаратів [12, 14]. Як результат, все частіше з'являються хворі, яким класичне лікування вже не допомагає [3, 13]. Основна причина погіршення епідеміологічної ситуації полягає в зміні біологічних властивостей бацил, невдача першого та повторного курсів хіміотерапії, перерване лікування, рецидиви туберкульозу, безуспішне лікування, хронізація туберкульозного процесу, контакт із хворим на хіміорезистентний туберкульоз, недостатня ефективність існуючих АМБП та відсутність оптимізованої хіміотерапії з використанням саме бактерицидних препаратів [2, 9, 14]. Все це є причиною розвитку полі-, мульти- та розширеної резистентності штамів М. tuberculosis до АМБП. Для забезпечення ефективного лікування медики змушені використовувати комбінації різних препаратів, які викликають складні побічні реакції в організмі хворого. Тому, створення нових протитуберкульозних препаратів є актуальною проблемою сучасної медицини. Найближчим аналогом за терапевтичною дією до сполук, які заявляються, є гідразид ізонікотинової кислоти (ізоніазид) [6] - один із найвживаніших недорогих і ефективних лікарських засобів І ряду, що застосовується при терапії туберкульозу. Проте останніми роками суттєво зросла частота хіміо- і мультирезистентного туберкульозу легень зі стійкістю до препарату І ряду - ізоніазиду. Задачею корисної моделі є синтез нових ефективних сполук, що мали б виражену протитуберкульозну дію, зокрема при хіміорезистентному туберкульозі. Зважаючи на потенційну протитуберкульозну активність ряду похідних імідазолу [1], вирішення поставленої задачі досягається синтезом нових функціональних похідних імідазолу. Для одержання заявлених сполук нами розроблена препаративно зручна двостадійна схема, яка базується на використанні доступних 1-арил-4-хлоро-5-формілімідазолів [11]. їх окисненням перманганатом калію у 80 %-ному водному діоксані із виходами 73-82 % отримані 1-арил-4-хлороімідазол-5-карбонові кислоти, які і обробкою тетрафторидом сірки перетворені в цільові 1-арил-4-хлоро-5-(трифторометил)-1Н-імідазоли (І-ІІІ) із виходами 65-69 %. 1 UA 70746 U I-III , де R =Ph (I); R =4-ClC6H4 (II); R1=1-С10Н7 (1-нафтил) (III). Схема ілюструється прикладами синтезу цільових сполук, структура яких підтверджена аналітичними даними і результатами вимірів інфрачервоних (14) спектрів та спектрів ядерного 1 магнітного резонансу (ЯМР Н). 1-Арил-4-хлор-1Н-імідазол-5-карбонові кислоти. До суспензії 0,01 моль альдегіду в 40 мл 80 %-ного водного діоксану при перемішуванні і охолодженні водою додають порціями впродовж 0,5 год. 5,22 г (0,02 моль) перманганату калію, після чого перемішують ще 2 год. Надлишок окисника видаляють додаванням кристалічного тіосульфіту натрію до зникнення фіолетового забарвлення. Реакційну суміш обробляють 50 мл води, фільтрують, фільтрат підкислюють конц. соляною 5 кислотою. Осад, що утворився, відфільтровують, сушать і кристалізують з оцтової кислоти. Приклад 1. 1-Феніл-4-хлоро-1Н-імідазол-5-карбонова кислота. Вихід 80 %, т. топл. 208-210 °C. ІЧ спектр, -1 1 2 см : 2510-2810 (СООН), 1715 (С=О). Спектр ЯМР Н, , мл.: 7,44-7,51 м (5Наром.), 8,04 с (1Н, Н ). 13 5 4 2 Спектр ЯМР С, , м. ч.: 119,25 (С ), 126,19, 128,84, 128,89, 136,63 (САr), 135,79 (С ), 140,48 (С ), 159,23 (СООН). Знайдено, %: С 53,67; Н 3,12; N 12,55. C10H7ClN2O2. Вирахувано, %: С 53,95; Н 3,17; N 12,58. Приклад 2. 4-Хлоро-1-(4-хлорофеніл)-1H-імідазол-5-карбонова кислота. Вихід 82 %, т. топл. 205-207 °C. -1 1 ІЧ спектр, см : 2560-2830 (СООН), 1710 (С=О). Спектр ЯМР Н, , м.ч.: 7.50 д (2Наром., J 8,2 Гц), 2 13 5 7,58 д (2Наром, J 8,2 Гц), 8,28 (1H, Н ). Спектр ЯМР С, , м. ч.: 119,20 (С ), 128,15, 128,75, 4 2 133,43, 133,47 (САr), 135,13 (С ), 140,49 (С ), 159,40 (СООН). Знайдено, %: С 46,57; Н 2,42; N 10,75. C10H6Cl2N2O2. Вирахувано, %: С 46,72; Н 2,35; N 10,90. Приклад 3. 1-(1-Нафтил)-4-хлоро-1Н-імідазол-5-карбонова кислота. Вихід 73 %, т. топл. 227-230 °C. ІЧ -1 1 спектр, см : 2510-2890 (СООН), 1715 (С=О). Спектр ЯМР Н, , м. ч.: 7,22 д (1Наром., J 8,4 Гц), 2 13 5 7,55-8,09 м (6Наром), 8,13с (1Н, Н ). Спектр ЯМР С, , м. ч.: 120,57 (С ), 121,48, 125,05, 125,29, 4 2 126,72, 127,77, 128,20, 129,57, 129,94, 133,28, 133,39 (САr), 135,65 (С ), 141,26 (С ), 158,94 (СООН). Знайдено, %: С 61,42; Н 3,25; N 10,45. C14H9ClN2O2. Вирахувано, %: С 61,66; Н 3,33; N10,27. 1-Арил-5-трифторометил-4-хлоро-1H-імідазоли. В сталевий автоклав об'ємом 100 мл вносять 1 ммоль відповідної 1-арил-4-хлоро-1H-імідазол-5-карбонової кислоти, 0,2 мл води, 10,8 г (10 ммоль) тетрафториду сірки і нагрівають при 110-120 °C впродовж 16 год. Автоклав охолоджують, леткі продукти дегазують, реакційну суміш виливають на лід (50 г), нейтралізують бікарбонатом натрію до рН 7. Органічний шар екстрагують дихлорметаном, сушать над безводним сульфатом натрію, розчинник випарюють, залишок очищають хроматографічно на силікагелі (елюент етилацетат-гексан, 4:1). Приклад 4. 5-Трифторометил-1-феніл-4-хлоро-1Н-імідазол. Вихід 69 %, т. топл. 47-49 °C. Спектр ЯМР 1 2 19 Н, , м. ч.: 121-131 м (2Наром.), 7,51-7,55 м (3Наром), 8,20 с (1Н, Н ). Спектр ЯМР F, , м. ч.: 13 5 2 1 56,07 (CF3). Спектр ЯМР С, , м. ч.: 117,35 к (С , JC-F 38.7 Гц), 119,98 кв (CF3, JC-F 267 Гц), 4 2 126,25, 129,43, 130,07, 135,01 (CAr), 132,80 (С ), 138,61 (С ). Знайдено, %: С 48,55; Н 2,37; N 11,13. C10H6ClF3N2. Вирахувано, %: С 48,70; Н 2,45; N 11,36. Приклад 5. 5-Трифторометил-1-(4-хлорофеніл)-4-хлоро-1H-імідазол. Вихід 67 %, т. топл. 46-48 °C. 1 2 Спектр ЯМР Н, , м. ч.: 7,63 д (2Наром. J 8,1 Гц), 7,68 д (3Наром. J 8,1 Гц), 8,22 с (1Н, Н ). Спектр 19 13 5 2 ЯМР F, , м. ч.: - 56,22 (CF3). Спектр ЯМР С, , м. ч.: 115,69 кв (С , JC-F 37,7 Гц), 119,98 кв 1 4 2 (CF3, JC-F 269,1 Гц), 128,61, 129,46, 133,46, 134,93 (САr), 131,43 (С ), 140,89 (С ). Знайдено, %: С 42,44; Н 1,57; N 9,58. C10H5Cl2F3N2. Вирахувано, %: С 42,73; Н 1,79; N 9,97. 1 5 10 15 20 25 30 35 40 45 50 1 2 UA 70746 U 5 10 15 20 25 30 Приклад 6. 5-Трифторометил-1-(1-нафтил)-4-хлоро-1H-імідазол. Вихід 65 %, т. топл. 72-74 °C. Спектр 1 ЯМР H, , м. ч.: 7,25 д (1Наром. J 7,5 Гц), 7,63-7,74 м (3Наром.), 7,81 м (1Hаром, J 7,5 Гц), 8,12 д 2 19 (1Наром, J 8,0 Гц), 8,22 д (1Наром, J 8,0 Гц), 8,32 (1Н, Н ).Спектр ЯМР F, , м. ч.: - 55,86 (CF3). 13 5 2 1 Спектр ЯМР С, , м. ч.: 116,94 кв (С , JC-F 38,9 Гц), 119,99 кв (CF3, JC-F 267,8 Гц), 121,23, 4 2 125,36, 126,32, 127,25, 128,36, 129,78, 130,97, 133,46 (СAr), 130,73 (С ), 141,83 (С ). Знайдено, %: С 56,47; Н 2,58; N 9,25. C14H8ClF3N2. Вирахувано, %: С 56,68; Н 2,72; N 9,44. Приклад 7. Дослідження протитуберкульозної дії та активності 1-арил-4-хлоро-5-(трифторометил)-1Hімідазолів (І-III). Для приготування розведень використовують хімічно чисті субстанції препаратів, які розводять диметилсульфоксидом та 96 % етиловим спиртом. як живильне середовище використовують середовище Левенштейна-Єнсена. Готують гомогенну бактеріальну суспензію в 0,9 % розчині хлориду натрію. Для цього культуру, що виросла на твердому живильному середовищі Левенштейна-Єнсена, знімають тампоном, попередньо змоченим у стерильному 0,9 % розчині хлориду натрію. Тампон занурюють у пробірку, що містить 2,0 мл стерильного 0,9 % розчину хлориду натрію, культуру змивають у рідину, попередньо розтираючи по внутрішніх стінках пробірки. Пробірку залишають на 30 хв. при кімнатній температурі. Бактеріальну суміш розводять стерильним ізотонічним -2 -4 розчином хлориду натрію до розведень 10 (K1) і 10 (K2). Підігрівають панель з середовищем Левенштейна-Єнсена, що містить досліджувані сполуки, до кімнатної температури, додають по -2 0,1 мл підготовленої суспензії з концентрацією 10 клітин/мл до кожного флакона з середовищем Левенштейна-Єнсена, що містить досліджувані сполуки та в один із контролів K1. -4 У другий контроль додають 0,1 мл суспензії з концентрацією 10 клітин/мл K2. Щільно закриті флакони інкубують при температурі (37±1)°С. Оцінку результатів проводять через 21 день. Визначення активності синтезованих сполук по відношенню до штамів Micobacterium tuberculosis (МБТ) проводили методом пропорцій (метод Канетті) [7], який зводиться до виявлення пропорції між чутливими та стійкими особинами в популяції штаму МБТ, виділеного від хворого. Якщо кількість стійких особин до якогось антибактеріального препарату в популяції буде менше 1,0 %, такий штам вважається чутливим до даного препарату, якщо стійкість особин в популяції більше 1,0 %, - штам вважається стійким до даного препарату. Для дослідження використовували штами МБТ від 10-ти вперше діагностованих хворих на туберкульоз легень. За рекомендаціями ВООЗ досліджували концентрації, при яких визначають стійкість МБТ до ізоніазиду: 1,0 мкг/мл, 0,2 мкг/мл, 0,1 мкг/мл та 0,05 мкг/мл. Таблиця Чутливість штамів МБТ по відношенню до нових синтезованих сполук (І-ІІІ) Сполука І II III Ізоніазид 1 +++ +++ +++ +++ Концентрація в живильному середовищі (мкг/мл) 0,2 0,1 +++ +++ +++ +++ +++ +++ +++ ++ 0,05 +++ +++ +++ + Примітки. +++ - 100 % штамів МБТ виділених від хворих чутливі до сполуки в наведеній концентрації; ++ - 90 % штамів МБТ виділених від хворих чутливі до сполуки; + - 70 % штамів МБТ виділених від хворих чутливі до сполук; 35 40 45 Підсумовані у таблиці результати свідчать, що за своєю протитуберкульозною дією нові трифторометилвмісні імідазоли (І-ІІІ) при концентрації в живильному середовищі 0,05 мкг/мл у 4 рази активніші, ніж використаний в ролі тест-об'єкта препарат ізоніазид. Таким чином, нові синтезовані сполуки можуть бути прототипами для створення нових високоефективних протитуберкульозних лікарських засобів, в тому числі для лікування хіміорезистентних форм туберкульозу легень. Джерела інформації:: 1. Брицун В.Н. Противотуберкулѐзные свойства производных имидазола и бензимидазола / В.Н. Брицун, П.А. Карпов, А.И. Емец, М.О. Лозинский, Я.Б. Блюм // Журн. орган, та фарм. хім.2011. - Т. 9, Вип. 3(35). - с. 3-14. 3 UA 70746 U 5 10 15 20 25 30 35 2. Бялик И.Б. Актуальные вопросы химиотерапии больных мультирезистентным деструктивным туберкулезом легких / И.Б. Бялик // Туберкульоз. Легеневі хвороби. ВІЛінфекція.-2011. - № 1. - с. 13-19. 3. Бялик Й.Б. Сучасні можливості підвищення результатів хіміотерапії хворих на хіміорезистентний туберкульоз легень / Й.Б. Бялик, В.І. Петренко, В.В. Давиденко // Укр. пульмон. журн.-2008. - № 3. - с. 16-17. 4. Дорожкова И.Р. Состав и лекарственная чувствительность микобактериальной популяции у больных с подозрением на туберкульоз / И.Р. Дорожкова // Проблемы туберкульоза и болезней легких.-2005. - № 8. - с. 36-39. 5. Костик О. Організаційно-мікробіологічні аспекти проблеми мультирезистентного туберкульозу на сучасному етапі / О. Костик, М. Пурська, Л. Ільницька // Наук. вісн. нац. мед. унту ім. О.О. Богомольця.-2008. - № 2. - с. 108-109. 6. Машковский М.Д. Лекарственные средства. Пособие для врачей. Т. 2. М.: Новая линия, 2000. - с. 306-308. 7. Наказ МОЗ України № 45 від 06.02.2002. Про затвердження Інструкції з бактеріологічної діагностики туберкульозної інфекції / http://www.moz.gov.ua/ua/portal/dn_20020206_45.html. 8. Пурська М.Б. Динаміка мультирезистентності мікобактерій туберкульозу в період епідемії / М.Б. Пурська // Практ. мед.-2008. - Т. 14, № 3. - с. 137-141. 9. Соколова Г. Клинико-рентгенологические и бактериологические особенности лекарственно-резистентного туберкульоза / Г. Соколова, И. Богадельникова, М. Бирон [и др.] // Проблемы туберкулеза и болезней легких.-2006. - № 12. - с. 16-20. 10. Тодоріко Л.Д. Особливості епідемії та патогенезу хіміорезистентного туберкульозу на сучасному етапі / Л.Д. Тодоріко // Клінічна імунологія. Алергологія. Інфектологія.-2011. - № 4. - с. 38-41. 11. Чорноус В.А. Полифункциональные имидазолы. І. Синтез 1-замещенных 4-хлор-1Нимидазол-5-карбальдегидов Вильсмейеру-Хааку. / В.А. Чорноус, М.К. Братенко, М.В. Вовк // Журн. орган, химии.-2009. - Т. 45, № 8. - с. 1219-1222. 12. Establishing risk groups of multidrug-resistant tuberculosis and planiing its therapeutic approach / L.D Todoriko, A.V Boiko, I.V. Yeremenchuk [et al.] // Бук. мед. вісник.-2011. - № 2. - с. 173-178. 13. Kruuner A. Evaluation of MGIT 960-based antimicrobial testing and determination of critical cincentrations of first-and second-line antimicrobial drugs with drug-resistan clinical strains of Mycobacterium tuberculosis / A. Kruuner, M. D. Yater // J. Clin. Mikrobiol.-2006. - № 44. - P. 811-818. 14. Rusch-Gerdes S. Multi-center laboratory validation of the BACTEC MGIT 960 technique for testing susceptibilities of Mycobacterium tuberculosis to classical second-line drugs and newer antimicrobials / S. Rusch-Gereds, G.E. Pfiffer, M. Casal // J. Clin. Microbiol. 2006. - № 44. - P. 811818. ФОРМУЛА КОРИСНОЇ МОДЕЛІ 40 1-Арил-4-хлоро-5-(трифторометил)-1Н-імідазоли загальної формули: , 1 1 l де R =Ph (І); R =4-ClC6H4 (II); R =1-нафтил (III), які виявляють протитуберкульозну активність. 45 Комп’ютерна верстка А. Крижанівський Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 4
ДивитисяДодаткова інформація
Назва патенту англійською1-aryl-4-chloro-5-(trifluoromethyl)-1h-imidazoles exhibiting antituberculous activity
Автори англійськоюVovk Mykhailo Volodymyrovych, Chornous Vitalii Oleksandrovych, Todoriko Lilia Dmytrivna, Bezdudnyi Andrii Vasyliovych, Hrozav Alina Mykolaivna, Yeremenchuk Inha Vasylivna, Demydovska Svitlana Anatoliivna
Назва патенту російською1-арил-4-хлоро-5-(трифторометил)-1н-имидазолы, проявляющие противотуберкулезную активность
Автори російськоюВовк Михаил Владимирович, Черноус Виталий Александрович, Тодорико Лилия Дмитриевна, Бездудный Андрей Васильевич, Грозав Алина Николаевна, Еременчук Инга Васильевна, Демидовская Светлана Анатольевна
МПК / Мітки
МПК: C07D 235/00, C07D 233/00, C07D 231/00, A61K 31/395
Мітки: активність, виявляють, протитуберкульозну, 1-арил-4-хлоро-5-(трифторометил)-1н-імідазоли
Код посилання
<a href="https://ua.patents.su/6-70746-1-aril-4-khloro-5-triftorometil-1n-imidazoli-yaki-viyavlyayut-protituberkuloznu-aktivnist.html" target="_blank" rel="follow" title="База патентів України">1-арил-4-хлоро-5-(трифторометил)-1н-імідазоли, які виявляють протитуберкульозну активність</a>
Попередній патент: Спосіб визначення тривалості життя хворих на хронічну лімфоцитарну лейкемію
Наступний патент: Тіосемикарбазони 1,2-дизаміщених 4-хлороімідазол-5-карбальдегідів, які виявляють протитуберкульозну активність
Випадковий патент: Спосіб лікування метаболічних порушень при остеоартрозі у пацієнтів з супутньою артеріальною гіпертензією










