Спосіб визначення переважної локалізації та концентрації макро- та мікроелементів біологічних мінералізованих тканин, основною кристалічною фазою яких є апатит
Номер патенту: 114449
Опубліковано: 10.03.2017
Автори: Погорєлов Максим Володимирович, Гордієнко Олена Володимирівна, Калінкевич Олексій Миколайович, Гусак Євгенія Володимирівна, Данильченко Сергій Миколайович
Формула / Реферат
1. Спосіб визначення переважної локалізації та концентрації макро- та мікроелементів біологічних мінералізованих тканин, основною кристалічною фазою яких є апатит, що включає відбір досліджуваного біологічного матеріалу з наступним сушінням до постійної ваги, мінералізацією та розділення на окремі фракції проб досліджуваного біологічного матеріалу, який відрізняється тим, що відбір зразка досліджуваного біологічного матеріалу проводять масою від 0,1 г до 5 г, як зразок відібраного матеріалу використовують кісткову тканину, яку попередньо очищають від м'яких тканин, або кальцифікати м'яких тканин і сушіння цього зразка проводять до постійної ваги на повітрі, після чого зразок відібраного матеріалу відпалюють у муфельній печі протягом 6 годин, з поступовим підвищенням до температури до 450±5 °C, при цьому при відпаленні зразка у вигляді кальцифікатів м'яких тканин для дослідження відокремлюють кальцифіковані пластинки, після закінчення процесу відпалення і зменшення температури зразка до кімнатної здійснюють його гомогенізацію методом розтирання і розділення на окремі фракції здійснюють щонайменше на п'ять частинок, кожну з яких додатково відпалюють у муфельній печі при температурах 600±2 °C, 640±2 °C, 680±2 °C, 720±2 °C, 760±2 °C відповідно, потім після зменшення температури відпалених зразків до кімнатної їх зважують на аналітичних вагах з точністю до 0,01 мг і поміщають кожен в окремі пластикові ємності з бідистильованою водою, де об'єм розчинника, тобто бідистильованої води, складає від 25 до 100 мл при рН 6,6, отримані, таким чином, суспензії обробляють ультразвуком протягом 10 хвилин, проводять їх фільтрування і екстраговані маси порошків, що отримані з кожного відпалу, поміщають у тиглі з 1 мл соляної кислоти з наступним випарюванням до сухого залишку на електричній плитці під витяжною шафою, охолоджують тиглі і після досягнення тиглями кімнатної температури додають до кожного тигля 1 мл азотної кислоти, потім тиглі з сумішшю кислот, в якій розчинені мінеральні речовини, доводять до кипіння на електричній плитці під витяжною шафою, в наступному тиглі охолоджують і розчини переносять в ємності, доводячи кожний розчин бідистильованою водою до 10 мл, отримані фільтрати та розчини аналізують на атомно-абсорбційному спектрометрі в режимі емісії та полуменевої атомізації для визначення концентрації макро- та мікроелементів, а саме склад Na, К, Mg, Ca, визначаючи, таким чином, після калібрування за 3-4 точками, вміст цих елементів в пробі зразка.
2. Спосіб визначення переважної локалізації та концентрації макро- і мікроелементів біологічних мінералізованих тканин, основною кристалічною фазою яких є апатит, за п. 1, який відрізняється тим, що обробку ультразвуком здійснюють в установці УЗДН-А (SELMI, Україна), питома потужність становить приблизно 15-20 Вт/см2 при робочій частоті випромінювача 22 кГц.
3. Спосіб визначення переважної локалізації та концентрації макро- і мікроелементів біологічних мінералізованих тканин, основною кристалічною фазою яких є апатит, за п. 1, який відрізняється тим, що для методу атомної спектроскопії використовують прилад КАС 120.1 (SELMI, Україна).
Текст
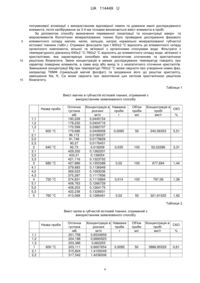
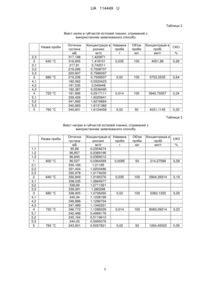
Реферат: Спосіб визначення переважної локалізації та концентрації макро- та мікроелементів біологічних мінералізованих тканин, основною кристалічною фазою яких є апатит, що включає відбір досліджуваного біологічного матеріалу з наступним сушінням до постійної ваги, мінералізацією та розділення на окремі фракції проб досліджуваного біологічного матеріалу. Відбір зразка досліджуваного біологічного матеріалу проводять масою від 0,1 г до 5 г, де як зразок відібраного матеріалу використовують кісткову тканину, яку попередньо очищають від м'яких тканин, або кальцифікати м'яких тканин і сушіння цього зразка проводять до постійної ваги на повітрі, після чого зразок відібраного матеріалу відпалюють у муфельній печі протягом 6 годин, з поступовим підвищенням до температури до 450±5 °C. UA 114449 U (12) UA 114449 U UA 114449 U 5 10 15 20 25 30 35 40 45 50 55 60 Корисна модель належить до експериментальної медицини та біології, зокрема нормальної та патологічної анатомії, фізіології, біологічної хімії та може бути використана для отримання нових даних про іонний обмін та взаємодію між фазою нанокристалів і некристалічним мінеральним оточенням у біоапатитах кальцію різного походження (фізіологічних і патологічних), що має сприяти розширенню сучасних уявлень про особливості нормальної та патологічної мінералізації живої тканини, а також винайденням засобів ефективного впливу на ці процеси. На даний час добре відомо, що слабокристалізований карбонатний апатит є головним мінеральним компонентом нормально кальцинованих твердих тканин людського скелету і багатьох різновидів патологічних біомінералів, таких, наприклад, як кальцифіковані атеросклеротичні бляшки, ектопічні кальцифікати в м'язах та паренхіматозних органах. Однак, деякі невід'ємні ознаки та характеристики біоапатитів фізіологічно і патологічно мінералізованих тканин лишаються не визначеними. Вважається, що структурні недосконалості та властивості поверхні нанокристалів біоапатиту визначають їх кристалохімію і є критичними факторами у процесах формування, резорбції та перебудови біомінералів. Поверхня біокристала відіграє надзвичайну роль як межа поділу мінеральної і органічної складових та місце перебігу головних фізіологічних процесів. Кореляції між структурними дефектами та вмістом рухливих іонів на поверхні кристалу має відображати певні ультраструктурні особливості біоапатиту та спроможність до іонного обміну (1, 2, 3). Тим не менш, поверхня кристалів та їх неапатитне мінеральне оточення як у фізіологічному, так і у патологічному біоапатиті залишаються недостатньо вивченими. Цілком можливо, що лабільне неапатитне оточення біомінералів різного походження може мати деякі відмінності та специфічні особливості, які пов'язані з різним функціональним призначенням. Нові дані про ці відмітні особливості можуть прояснити функціональну роль деяких мінорних елементів у генезисі патологічних чи ектопічних кальцифікатів та прискорити дослідження засобів для їх уповільнення і запобігання (4). Вивчення хімічного складу структурованих поверхневих шарів біоапатиту потребує застосування ряду методів та обладнання з високою чутливістю, селективністю і роздільною здатністю. Метод рентгенівської дифракції дозволяє досліджувати термоактивовані перетворення біомінералу. Після відпалу зразка при 900-950 °C, окрім апатитної фази високої кристалічності. в матеріалі можуть утворюватись додаткові фази, наявність та концентрація яких зумовлені особливостями первісного біологічного апатиту мінералізованої тканини. Зокрема, метод рентгенівської дифракції дозволяє оцінити ступінь заміщення кальцію магнієм у первісному апатиті (5, 6). До обмежень та ускладнень структурних досліджень біологічного апатиту слід віднести те, що зразки, мають крім мінеральної і органічну складову, попередні припущення про фазовий склад зробити досить складно, кількість матеріалу, як правило, обмежена, дефектність структур гранично висока, кристалічність наявних фаз досить відмінна, кристаліти мають розмірні, текстурні і морфологічні особливості та інше. Дані рентгенівського спектрального мікроаналізу (РСМА) кальцифікованих проб показують загальну концентрацію елементів без розподілення по часткам, що належать апатиту та іншим хімічним з'єднанням неапатитного оточення. Останніми можуть бути як вільними іонами металів чи оксидів, солей, карбонатів та карбідів, так і входити до складу другорядних кристалічних фаз, якщо такі наявні. Взаємодоповнюючі дані дифракційних методик (переважно рентгенівської дифракції і/або електронної дифракції) та інфрачервоної спектроскопії з Фур'є перетворенням (FTIR) необхідні для отримання інформації про фазову чистоту, розміри кристалітів та статус карбонатів у мінералі. Додаткові спектроскопічні методи такі як спектроскопія комбінаційного розсіювання (Раманівська спектроскопія), твердотільний ядерний магнітний резонанс (ЯМР) і/або електронний парамагнітний резонанс можуть розглядатися як більш спеціалізовані методики для дослідження іонного неапатитного оточення. Крім того, в останні роки було розвинуто новий досить ефективний підхід, що базується на рентгенівській абсорбційній спектроскопії (XAS), а саме методах аналізу біляпорогової структури спектрів поглинання (XANES) та протяжної тонкої структури спектрів поглинання (EXAFS) (7, 8). Однак, широке застосування цих методів суттєво обмежується необхідністю джерела синхротронного випромінювання, дослідження потребують багато часу, відносно дорогого обладнання і високого рівня кваліфікації персоналу. В умовах малої кількості досліджуваного матеріалу для виявлення природи катіонних заміщень апатиту (Na, Mg, та ін.) і відповідних заміщень у аніонній підрешітці необхідне залучення кількісних методів елементного аналізу, а саме атомно-абсорбційної спектроскопії. Існують сучасні методи озолення (мінералізації) біологічних матеріалів основані на розкладанні органіки термічним способом та за участі суміші окислювальних реагентів. Вони 1 UA 114449 U 5 10 15 20 25 30 35 40 45 50 55 60 дозволяють розкласти органіку і перевести елементи у водорозчинний стан. Недоліком цих методів є те, що досліджуваний біологічний матеріал мінералізується повністю, без розділення органічної та неорганічної фази (9, 10). Одною із модельних методик структурної трансформації біокристалів під дією зовнішніх факторів є їх розчинення у слабких розчинах кислот та ремінералізація в штучних біологічних розчинах (11, 12). Процес розчинення у відповідних середовищах можна розглядати як зворотну модель росту патологічних мінеральних утворень. Дослідження станів рівноваги при поетапному розчиненні мінералітів з визначенням структурних і субструктурних характеристик залишкового мінералу та змін елементного складу розчинника має дати важливу інформацію про будову нормальних біоапатитів та патологічних кальцифікатів, особливо двофазних. Оскільки локалізація іонів в біомінералі не є однозначною, вони можуть знаходитись в структурі апатиту як ізоморфні домішки, або ж за межами кристалічної ґратки в адсорбованому стані чи в надмалих домішкових фазах. Заміщення в решітці можуть бути ізовалентні та гетеровалентні (для компенсації заряду). Усі перелічені домішкові іони можуть також знаходитись на поверхні кристалів у складі структурованого гідратованого шару (так званого "неапатитного оточення") (6, 13). Відомий спосіб визначення концентрації іонів у пробах біологічного матеріалу (14), при якому методом атомно-абсорбційного спектрального аналізу в розділених на окремі фракції водних екстрактах проб біологічного матеріалу визначають абсолютні та відносні показники концентрації вільних і зв'язаних іонів макро- і мікроелементів. Він включає висушування подрібнених проб масою 5,0 г до постійних значень за температури 105 °C, гомогенізацію 3 зразка, центрифугування 0,5 г біологічного зразка у 4,5 см бідистильованої води з отриманням фракції вільних іонів, екстрагування порошку, отримання другої фракції зі зв'язаними іонами з легкорозчинними у воді комплексними сполуками неорганічних та органічних речовин після витримки у бідистильованій воді 24 години, другу екстрагацію порошку та витримку 48 годин у бідистильованій воді, виділення третьої фракції зв'язаних іонів з важкорозчинними у воді комплексними сполуками органічних та неорганічних речовин, третю екстрагацію порошку, 3 витримку її у 2,0 см "царської водки" протягом 24 години, з наступним випарюванням на пісочній бані, спалення залишків екстрагованих проб у муфельній печі за температури 450 °C, 3 розчинення отриманої золи у 4,5 см бідистильованої води, отримання четвертої фракції іонів зв'язаних з нерозчинними у воді комплексними сполуками неорганічних і органічних речовин, аналіз отриманих розчинів методом атомно-абсорбційної спектроскопії. Вищезгаданий спосіб є найбільш близьким по технічній суті та результату, який може бути досягнуто, тому його обрано за прототип. Недоліком цього способу є те, що вищезазначена пробопідготовка не може бути використана для мінералізованих тканин, основною кристалічною фазою яких є апатит, оскільки температури 450 °C не вистачає для повної рекристалізації біологічного апатиту та вивільнення зв'язаних іонів з неапатитного оточення кристалітів, багатоетапність і розтягнення у часі може призвести до значної похибки в отриманих значеннях. Даний спосіб не може бути використаний для визначення місць переважної локалізації макро- та мікроелементів в мінералізованих тканинах. В основу корисної моделі поставлено задачу спростити та зменшити час пробопідготовки мінералізованих тканин, провести повне озолення даного біологічного матеріалу та визначити місця переважної локалізації і відповідні (відносні) концентрації макро- та мікроелементів, що в кінцевому результаті приведе до більш детальної оцінки елементного складу мінералізованих тканин та сприятиме розширенню сучасних уявлень про особливості нормальної та патологічної мінералізації живої тканини, а також винайденням засобів ефективного впливу на ці процеси. Поставлена задача вирішується тим, що у відомому способі визначення концентрації іонів у пробах біологічного матеріалу, що включає відбір зразка з наступним видаленням вологи до постійної ваги, мінералізацією та розділенням іонів на фракції за силою зв'язування, згідно з корисною моделлю, проводиться відбір зразка досліджуваного матеріалу масою від 0,1 г до 5 г. Як відібраний матеріал використовують кісткову тканину, яку попередньо очищають від м'яких тканин, або кальцифікати м'яких тканин. Сушіння зразка проводять до постійної ваги на повітрі. Після чого зразок відібраного матеріалу відпалюють у муфельній печі протягом 6 годин по досягненні температури 450±5 °C, максимальний темп нагрівання муфельної печі 15 °C/хв. При відпаленні зразка, де як його використовують кальцифікати м'яких тканин, в подальшому для дослідження відокремлюють кальцифіковані пластинки. Після закінчення цього процесу і зменшення температури до кімнатної, зразок розтирають, переводячи його в гомогенний стан, і розділяють на окремі фракції щонайменше на п'ять частин, кожну з яких додатково відпалюють у муфельній печі протягом години по досягненні температур 600±2 °C, 640±2 °C, 680±2 °C, 2 UA 114449 U 5 10 15 20 25 30 35 40 45 50 55 60 720±2 °C, 760±2 °C відповідно, максимальний темп нагрівання муфельної печі 15 °C/хв. Після закінчення цього етапу і зменшення температури до кімнатної відпалені зразки зважують на аналітичних вагах з точністю до 0,01 мг і поміщають кожен в окремі пластикові ємності з бідистильованою водою. Об'єм розчинника, тобто бідистильованої води, складає від 25 до 100 мл при рН 6,6. Отримані, таким чином, суспензії обробляють ультразвуком в установці УЗДН-А (SELMI, Україна) протягом 10 хвилин. Озвучені суспензії фільтрують, екстраговані маси порошків, що отримані з кожного відпалу, поміщають у тиглі з 1 мл соляної кислоти. Випарювання проводять до сухого залишку на електричній плитці під витяжною шафою. Після повного охолодження тиглів до кімнатної температури до кожного тигля додають 1 мл азотної кислоти. Після початку кипіння суміші кислот з розчиненими в ній мінеральними речовинами на електричній плитці під витяжною шафою, тиглі охолоджують. Отримані розчини переносять в ємності, доводячи кожний розчин бідистильованою водою до 10 мл мірною піпеткою з 2 класом точності. Фільтрати та розчини кожної температури відпалення аналізують на атомноабсорбційному спектрометрі в режимі емісії та полуменевої атомізації для визначення концентрації макро- та мікроелементів, а саме склад Na, K, Mg, Ca, визначаючи, таким чином, після калібрування за 3-4 точками, вміст цих елементів в пробі зразка. Використання заявлюваного способу з усіма суттєвими ознаками, включаючи відмінні, дозволяє спростити та зменшити час пробопідготовки мінералізованих тканин. Термічна обробка, а саме ступінчасте постадійне відпалювання при заявлених температурах попередньо підготовленого досліджуваного біологічного матеріалу, визначеної маси, у комбінації з ультразвуковою обробкою мінералітів у бідистильованій воді з рН 6,6 здатні забезпечити інформацію про елементний склад твердої кристалічної фази (чи фаз) та мікроелементне оточення кристалічних частинок. рН бідистильованої води не впливає на розчинність біологічного апатиту. Ультразвукова обробка дозволяє забезпечити більш повний перехід мікроелементів зруйнованого гідратованого шару біоапатитів у водорозчинний стан після кожної температурної обробки. Відпалювання за t 600±2 °C показує вміст іонів вільної і зв'язаної з органічними сполуками води та самої органічної фази. Діапазон відпалення у проміжку від 640±2 °C до 760±2 °C відповідає температурі початку рекристалізації з утворенням відносно бездефектних кристалів за рахунок іонного обміну між їх об'ємом і поверхнею (15). При рекристалізації виникають нові кристаліти, які ростуть за рахунок дефектної матриці при утворенні в ній зародків рекристалізації. Процеси росту кристалічної решітки кристалів апатиту супроводжуються виходом катіонів у неапатитне оточення або навпаки їх захопленням (6, 13). Таким чином, заявлюваний спосіб дозволяє вирішити поставлену задачу. Спосіб здійснюють наступним чином. Проводиться відбір зразка досліджуваного матеріалу масою від 0,1 г до 5 г, за який використовують кісткову тканину, яку попередньо очищають від м'яких тканин або кальцифікати м'яких тканин. Сушіння зразка проводять до постійної ваги на повітрі. Після чого зразок відібраного матеріалу відпалюють у муфельній печі протягом 6 годин по досягненні температури 450±5 °C, максимальний темп нагрівання муфельної печі 15 °C/хв. При відпаленні зразка, де за який використовують кальцифікати м'яких тканин, в подальшому для дослідження відокремлюють кальцифіковані пластинки. Після закінчення цього процесу і зменшення температури до кімнатної, зразок розтирають, переводячи його в гомогенний стан, і розділяють на окремі фракції щонайменше на п'ять частинок, кожну з яких додатково відпалюють у муфельній печі протягом години по досягненні температур 600±2 °C, 640±2 °C, 680±2 °C, 720±2 °C, 760±2 °C відповідно, максимальний темп нагрівання муфельної печі 15 °C/хв. Після закінчення цього етапу і зменшення температури до кімнатної відпалені зразки зважують на аналітичних вагах з точністю до 0,01 мг і поміщають кожен в окремі пластикові ємності з бідистильованою водою. Об'єм розчинника, тобто бідистильованої води, складає від 25 до 100 мл при рН 6,6. Отримані, таким чином, суспензії обробляють ультразвуком в установці УЗДН-А (SELMI, Україна) протягом 10 хвилин. Озвучені суспензії фільтрують, екстраговані маси порошків, що отримані з кожного відпалу, поміщають у тиглі з 1 мл соляної кислоти. Випарювання проводять до сухого залишку на електричній плитці під витяжною шафою. Після повного охолодження тиглів до кімнатної температури до кожного тигля додають 1 мл азотної кислоти. Після початку кипіння суміші кислот з розчиненими в ній мінеральними речовинами на електричній плитці під витяжною шафою, тиглі охолоджують. Отримані розчини переносять в ємності, доводячи кожний розчин бідистильованою водою до 10 мл мірною піпеткою з 2 класом точності. Далі фільтрати та розчини на вміст K, Na, та Са аналізують на атомно-абсорбційному спектрометрі в режимі емісії, для чого калібруються за 3-4-ма точками стандартних розчинів відповідного елемента з відповідною довжиною хвилі. Для визначення концентрації Mg в досліджуваних рідинах використовують атомно-абсорбційний спектрометр в режимі 3 UA 114449 U 5 10 15 полуменевої атомізації з використанням відповідної лампи та довжини хвилі досліджуваного елемента, після калібрування за 3-4-ма точками визначається вміст елемента в пробі. За допомогою способу визначення переважної локалізації та концентрації макро- та мікроелементів біологічних мінералізованих тканин було проведене дослідження фазового елементного складу магнію, калію, кальцію, натрію нормально мінералізованої губчастої кісткової тканини (табл.). Отримані фільтрати при t 600±2 °C відносять до елементного складу органічного компонента, вільної та зв'язаної з органічними сполуками води. Фільтрати з температурного діапазону 640±2 °C-760±2 °C відносять до елементного складу води, зв'язаної з кристалітами, яка характеризує іонообмін між неапатитним оточенням та кристалічною решіткою біоапатита. Зміни концентрацій в межах досліджуваних температур говорять про характер поведінки елементів, а саме вхід або вихід їх з неапатитного оточення кристалітів. Зменшення концентрації Mg при температурі 760±2 °C може свідчити про утворення нових фаз, наприклад ТКМФ (трикальцій магній фосфат) та входження його до решітки кристаліту, зменшення Na, K, Са може свідчити про захоплення цих катіонів кристалічною решіткою біоапатиту. Таблиця 1 Вміст магнію в губчастій кістковій тканині, отриманий з використанням заявлюваного способу Назва проби 1,1 1,2 1,3 1 2,1 2,2 2,3 2 3,1 3,2 3,3 3 4,1 4,2 4,3 4 5,1 5,2 5,3 5 600 °C 640 °C 680 °C 720 °C 760 °C Оптична густина мБ 190,228 178,232 170,599 179,686 96,172 91,748 90,27 92,73 429,332 433,21 421,116 427,886 379,683 369,523 375,287 374,831 408,763 408,203 422,238 413,068 Концентрація в Наважка розчині проби мг/л г 0,0440154 0,0404716 0,0382707 0,0408958 0,0085 0,0190027 0,0179829 0,0176451 0,018208 0,035 0,1362201 0,138054 0,1323702 0,1355388 0,02 0,1136949 0,1093036 0,1117856 0,1115884 0,014 0,1266729 0,1264175 0,1328931 0,1286461 0,02 Об'єм проби мл Концентрація в СКО пробі мкг/г % 50 240,56353 5,51 100 52,02286 3,31 100 677,694 1,44 100 797,06 1,36 50 321,61525 1,92 Таблиця 2 Вміст калію в губчастій кістковій тканині, отриманий з використанням заявлюваного способу Назва проби 1,1 1,2 1,3 1 2,1 2,2 600 °C Оптична густина мБ 201,758 204,188 203,386 203,111 315,824 317,542 Концентрація в Наважка розчині проби мг/л г 0,6534859 0,6665923 0,662255 0,6607654 0,0085 1,4100049 1,4236006 4 Об'єм проби мл 50 Концентрація в СКО пробі мкг/г % 3886,85529 0,61 UA 114449 U Таблиця 2 Вміст калію в губчастій кістковій тканині, отриманий з використанням заявлюваного способу Назва проби 2,3 2 3,1 3,2 3,3 3 4,1 4,2 4,3 4 5,1 5,2 5,3 5 640 °C 680 °C 720 °C 760 °C Оптична густина мБ 317,198 316,855 217,81 219,266 220,607 219,228 182,062 181,535 182,387 181,995 339,429 341,692 340,683 340,601 Концентрація в Наважка розчині проби мг/л г 1,420871 1,418151 0,035 0,742511 0,7508707 0,7586097 0,7506507 0,02 0,5520423 0,549448 0,5536495 0,5517111 0,014 1,6025641 1,6216664 1,6131382 1,6124458 0,02 Об'єм проби мл Концентрація в СКО пробі мкг/г % 100 4051,86 0,29 100 3753,2535 0,64 100 3940,79357 0,24 50 4031,1145 0,33 Таблиця 3 Вміст натрію в губчастій кістковій тканині, отриманий з використанням заявлюваного способу Назва проби 1,1 1,2 1,3 1 2,1 2,2 2,3 2 3,1 3,2 3,3 3 4,1 4,2 4,3 4 5,1 5,2 5,3 5 600 °C 640 °C 680 °C 720 °C 760 °C Оптична густина мБ 95,88 96,857 96,845 96,527 330,166 331,404 330,978 330,849 338,035 338,69 339,991 338,905 345,94 346,888 347,489 346,772 242,489 245,164 244,05 243,901 Концентрація в Наважка розчині проби мг/л г 0,0354674 0,0369196 0,0369012 0,0364269 0,0085 1,01185 1,0203486 1,0174209 1,0165376 0,035 1,0664977 1,0711061 1,080298 1,0726265 0,02 1,1228199 1,1296704 1,1340201 1,1288329 0,014 0,4989176 0,5119612 0,5065076 0,5057821 0,02 5 Об'єм проби мл Концентрація в СКО пробі мкг/г % 50 214,27588 0,58 100 2904,39314 0,19 100 5363,1325 0,29 100 8063,09214 0,23 50 1264,45525 0,55 UA 114449 U Таблиця 4 Вміст кальцію в губчастій кістковій тканині, отриманий з використанням заявлюваного способу Назва проби 1 2 3 4 5 5 10 15 20 25 30 35 40 45 600 °C 640 °C 680 °C 720 °C 760 °C Оптична густина мБ 14,799 19,29 16,587 24,94 27,556 Концентрація в розчині мг/л 1,3482113 1,7575411 1,5112072 2,2727586 2,5113383 Наважка проби г 0,023 0,02 0,01 0,017 0,034 Об'єм проби мл 50 50 50 50 50 Концентрація виробі мкг/г 2930,894 4545,88 8873,606 7042,296 3365,243 Запропонований спосіб є детальним та точним, дозволяє визначити переважну локалізацію та роздільну концентрацію макро- та мікроелементів мінералізованих тканин (а) в комплексі органічного компонента з водою вільною та зв'язаною з органічними сполуками та (б) в неапатитному оточенні біокристалів. Цей спосіб простий у виконанні, економічно доцільний і доступний, дозволяє стандартизувати експеримент. Джерела інформації: 1. A Review of Phosphate Mineral Nucleation in Biology and Geobiology Calcified Tissue International. - 2013. - Volume 93. - Issue 4. - Р. 382-396. 2. Nancy S. Krieger, David A. Bushinsky The Relation Between Bone and Stone Formation Calcified Tissue International. - 2013. - Volume 93. - Issue 4. - Р. 374-381. 3. Meiting Wu, Cameron Rementer, Cecilia M. Giachelli Vascular Calcification: An Update on Mechanisms and Challenges in Treatment. Calcified Tissue International. - 2013. - Volume 93. - Issue 4. - Р. 365-373. 4. Melinda Duer & Arthur Veis Bone mineralization: Water brings order Nature Materials 12, 10811082 (2013). 5. Calcium phosphate-based materials containing zinc, magnesium, fluoride and carbonate, Grant US9199005 B2. 6. Danilchenko S.N., Protsenko I.Yu., and Sukhodub L.F. Some features of thermo-activated structural transformation of biogenic and synthetic Mg-containing apatite with β-tricalcium-magnesium phosphate formation. // Cryst. Res. Technol. - 2009. - V.44. - Р.553-560. 7. D. Bazin, С Chappard, С Combes et al. Diffraction techniques and vibrational spectroscopy opportunities to characterise bones. - (2009) Osteoporosis International. - Vol. 20 (n 6). - P. 10651075. 8. D. Bazin and M. Daudon Pathological calcifications and selected examples at the medicinesolid-state physics interface. J. Phys. D: Appl. Phys. - 45 (2012) 383001 (10 рр). 9. Способ исследования органических материалов, патент RU № 2458335 МПК G01N 7/08 2011111829/28, 29.03.2011. 10. Method of sample preparation for atomic spectrometric techniques, Application WO2009071035 A3. 11. Heslop D.D., Bi Y., Baig Α. Α., Otsuka M., Higuchi W.I. A comparative study of the metastable equilibrium solubility behavior of high-crystallinity and low-crystallinity carbonated apatites using pH and solution strontium as independent variables. // Journal of Colloid and Interface Science (2005). Volume: 289. - Issue: 1. - P: 14-25. 12. Zhuang H., Baig A.A., Zhang N., Chhettry Α., Higuchi W.I. Relationships involving metastable equilibrium solubility, surface complexes, and crystallite disorder with carbonated apatites. Calcif Tissue Int. 2001 Dec; 69(6):343-9. 13. Yan Wang, Stanislas Von Euw. Water-mediated structuring of bone apatite // Nature materials. - 2013. - Vol 12, december. - P. 1144-1153. 14. Патент України на корисну модель № 69773, МПК G01N 21/00, G01N 21/41; опубл. 10.05.2012. 15. Mkukuma L.D., Imrie СТ., Skakle J.M.S., Hukins D.W.L., Aspden R.M. Thermal stability and structure of cancellous bone mineral from the femoral head of patients with osteoarthritis or osteoporosis // Material properties of ОA and OP bone mineral. - 2010. - January 16. - P. 222-225. 6 UA 114449 U ФОРМУЛА КОРИСНОЇ МОДЕЛІ 5 10 15 20 25 30 35 40 1. Спосіб визначення переважної локалізації та концентрації макро- та мікроелементів біологічних мінералізованих тканин, основною кристалічною фазою яких є апатит, що включає відбір досліджуваного біологічного матеріалу з наступним сушінням до постійної ваги, мінералізацією та розділення на окремі фракції проб досліджуваного біологічного матеріалу, який відрізняється тим, що відбір зразка досліджуваного біологічного матеріалу проводять масою від 0,1 г до 5 г, як зразок відібраного матеріалу використовують кісткову тканину, яку попередньо очищають від м'яких тканин, або кальцифікати м'яких тканин і сушіння цього зразка проводять до постійної ваги на повітрі, після чого зразок відібраного матеріалу відпалюють у муфельній печі протягом 6 годин, з поступовим підвищенням до температури до 450±5 °C, при цьому при відпаленні зразка у вигляді кальцифікатів м'яких тканин для дослідження відокремлюють кальцифіковані пластинки, після закінчення процесу відпалення і зменшення температури зразка до кімнатної здійснюють його гомогенізацію методом розтирання і розділення на окремі фракції здійснюють щонайменше на п'ять частинок, кожну з яких додатково відпалюють у муфельній печі при температурах 600±2 °C, 640±2 °C, 680±2 °C, 720±2 °C, 760±2 °C, відповідно, потім після зменшення температури відпалених зразків до кімнатної їх зважують на аналітичних вагах з точністю до 0,01 мг і поміщають кожен в окремі пластикові ємності з бідистильованою водою, де об'єм розчинника, тобто бідистильованої води, складає від 25 до 100 мл при рН 6,6, отримані, таким чином, суспензії обробляють ультразвуком протягом 10 хвилин, проводять їх фільтрування і екстраговані маси порошків, що отримані з кожного відпалу, поміщають у тиглі з 1 мл соляної кислоти з наступним випарюванням до сухого залишку на електричній плитці під витяжною шафою, охолоджують тиглі і після досягнення тиглями кімнатної температури додають до кожного тигля 1 мл азотної кислоти, потім тиглі з сумішшю кислот, в якій розчинені мінеральні речовини, доводять до кипіння на електричній плитці під витяжною шафою, в наступному тиглі охолоджують і розчини переносять в ємності, доводячи кожний розчин бідистильованою водою до 10 мл, отримані фільтрати та розчини аналізують на атомно-абсорбційному спектрометрі в режимі емісії та полуменевої атомізації для визначення концентрації макро- та мікроелементів, а саме склад Na, K, Mg, Ca, визначаючи, таким чином, після калібрування за 3-4 точками, вміст цих елементів в пробі зразка. 2. Спосіб визначення переважної локалізації та концентрації макро- і мікроелементів біологічних мінералізованих тканин, основною кристалічною фазою яких є апатит, за п. 1, який відрізняється тим, що обробку ультразвуком здійснюють в установці УЗДН-А (SELMI, Україна), 2 питома потужність становить приблизно 15-20 Вт/см при робочій частоті випромінювача 22 кГц. 3. Спосіб визначення переважної локалізації та концентрації макро- і мікроелементів біологічних мінералізованих тканин, основною кристалічною фазою яких є апатит, за п. 1, який відрізняється тим, що для методу атомної спектроскопії використовують прилад КАС 120.1 (SELMI, Україна). Комп’ютерна верстка Т. Вахричева Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП "Український інститут інтелектуальної власності", вул. Глазунова, 1, м. Київ – 42, 01601 7
ДивитисяДодаткова інформація
МПК / Мітки
МПК: G01N 30/96, G01N 30/12, G01N 1/44, G01N 33/483, G01N 1/34
Мітки: макро, кристалічною, локалізації, фазою, яких, мінералізованих, апатит, біологічних, визначення, тканин, мікроелементів, спосіб, концентрації, переважно, основною
Код посилання
<a href="https://ua.patents.su/9-114449-sposib-viznachennya-perevazhno-lokalizaci-ta-koncentraci-makro-ta-mikroelementiv-biologichnikh-mineralizovanikh-tkanin-osnovnoyu-kristalichnoyu-fazoyu-yakikh-eh-apatit.html" target="_blank" rel="follow" title="База патентів України">Спосіб визначення переважної локалізації та концентрації макро- та мікроелементів біологічних мінералізованих тканин, основною кристалічною фазою яких є апатит</a>
Попередній патент: Складна оркестрова литавра
Наступний патент: Пристрій контролю положення рівня розплаву в пристрої управління ростом монокристалів
Випадковий патент: Спосіб отримання біогазу