Високотемпературний електрохімічний акумулятор і розплавлений сольовий електроліт для високотемпературного електрохімічного акумулятора
Формула / Реферат
1. Высокотемпературный электрохимический аккумулятор, содержащий анод из щелочного металла, находящийся в расплавленном состоянии при рабочей температуре, электролит из расплавленной соли алюминий-галоидного соединения щелочного металла, при этом щелочной металл является тем же самым, что и металл анода, а галоидное соединение включает в себя хлорид, катод в контакте с электролитом, при этом активный материал катода содержит по крайней мере, один из металлов и и сепаратор, разделяющий анод и электролит и представляющий собой твердый проводник ионов щелочного металла анода, отличающийся тем, что электролит содержит 2 - 30мол.% добавки, содержащей по крайней мере, одно из соединений и где - щелочной металл анода.
2. Расплавленный солевой электролит для высокотемпературного электрохимического аккумулятора, содержащий алюминий-галоидное соединение щелочного металла, причем галоидное соединение включает в себя хлорид, отличающийся тем, что он содержит 2 - 30мол.% добавки, представляющей собой по крайней мере одно из соединений и где - щелочной металл анода.
Текст
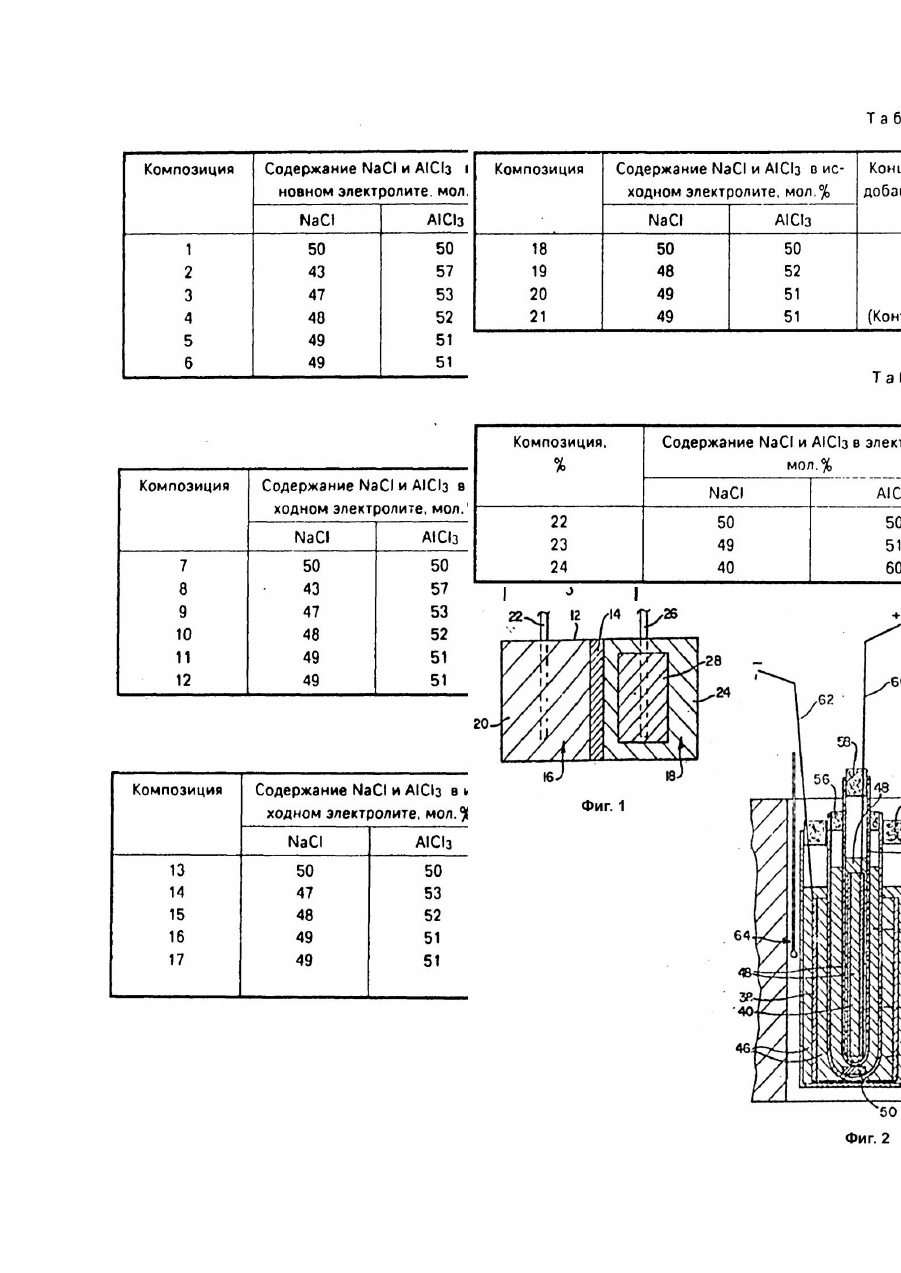
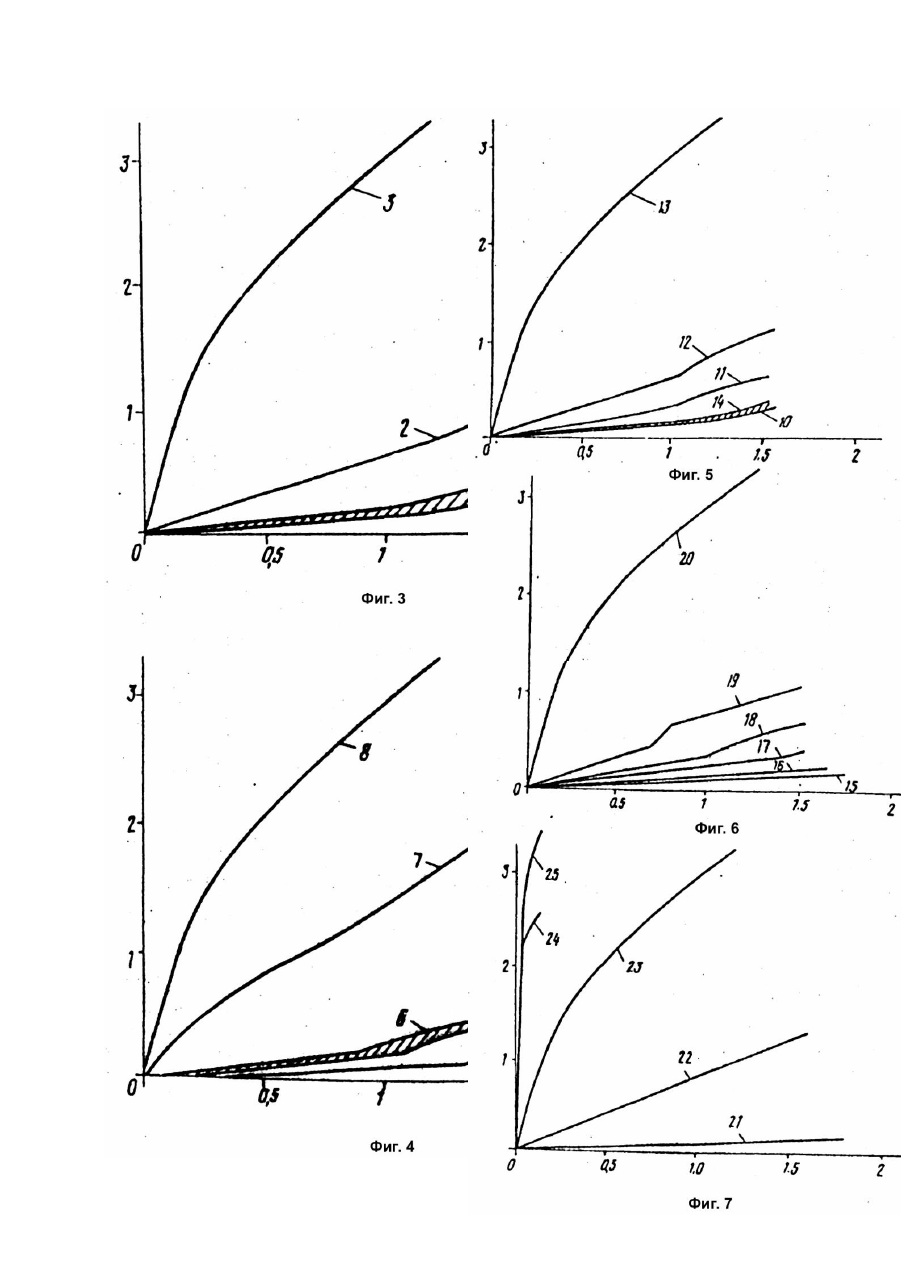
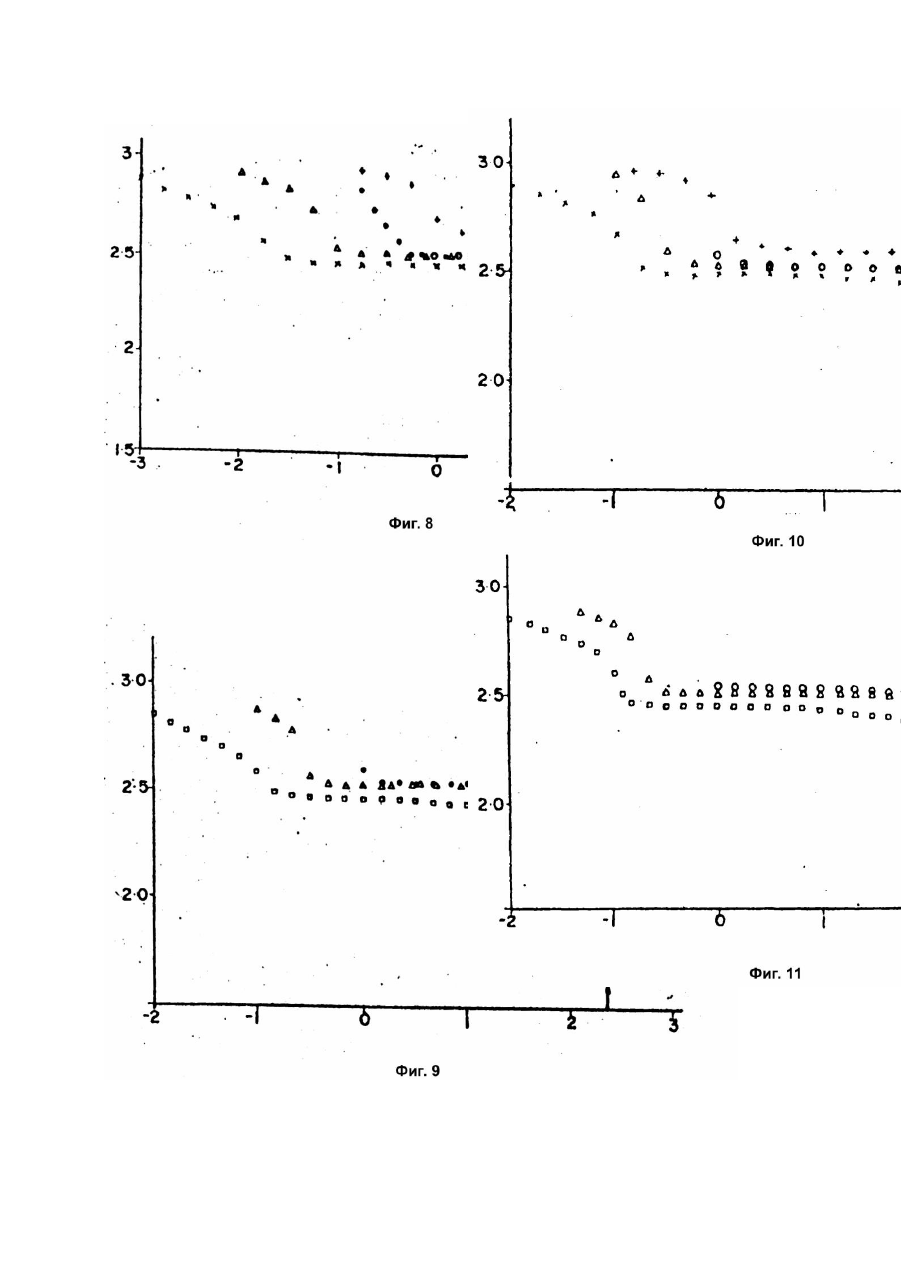
Изобретение относится к области электротехники и может быть использовано при производстве высокотемпературных электрохимических аккумуляторов и расплавленных электролитов для этих аккумуляторов. Известен высокотемпературный электрохимический аккумулятор, содержащий анод из расплавленного щелочного металла, сепаратор из b-оксида алюминия с проводимостью по ионам натрия, расплавленный электролит из соли алюминийгалоидного соединения щелочного металла и катод в контакте с электролитом, активный материал которого содержит по крайней мере один из металлов Fe, Ni, Co, Cr и расплавленный солевой электролит для высокотемпературного электрохимического аккумулятора, содержащий алюминийгалоидное соединение щелочного металла [1]. Недостатком этих аккумулятора и электролита является малая скорость подзарядки из-за отравления электролита. Наиболее близким по технической сущности и достигаемому результату является высокотемпературный электрохимический аккумулятор, содержащий анод из щелочного металла, находящегося при рабочей температуре в расплавленном состоянии, электролит из расплавленной соли алюминийгалоидного соединения щелочного металла, при этом щелочной металл является тем же самым, что и металл анода, а галоидное соединение включает в себя хлорид, катод в контакте с электролитом, при этом активный материал катода содержит по крайней мере один из металлов и и сепаратор, разделяющий анод и электролит, представляющий собой твердый проводник ионов щелочного металла анода и расплавленный солевой электролит для высокотемпературного электрохимического аккумулятора, содержащий алюминийгалоидное соединение щелочного металла, причем галоидное соединение включает в себя хлорид. Для улучшения циклируемости аккумулятор и электролит содержат добавку фторида натрия, который связывает образующиеся яды [2]. Недостатки этих аккумулятора и электролита заключаются в малой скорости подзарядки из-за ограниченного количества фторида натрия. Целью изобретения является повышение скорости подзарядки. Поставленная цель достигается тем, что в известном аккумуляторе, содержащем анод из щелочного металла, находящийся в расплавленном состоянии при рабочей температуре, электролит из расплавленной соли алюминийгалоидного соединения щелочного металла, при этом щелочной металл является тем же самым, что и металл анода, а галоидное соединение включает в себя хлорид, катод в контакте с электролитом, при этом активный материал катода содержит, по крайней мере один из металлов и и сепаратор, разделяющий анод и электролит, представляющий собой твердый проводник ионов щелочного металла анода, электролит дополнительно содержит 2 - 30мол.% добавки, содержащей по крайней мере одно из соединений: и где щелочной металл анода, а в расплавленном солевом электролите для высокотемпературного электрохимического аккумулятора, содержащем алюминийгалоидное соединение щелочного металла, включающее в себя хлорид, дополнительно содержит 2 - 30мол.% добавки, представляющих собой по крайней мере одно из соединений и где - щелочной металл анода. Сопоставительный анализ заявляемых решений с прототипом показывает, что электрохимический аккумулятор и электролит для этого аккумулятора отличаются тем, что электролит содержит добавку. Таким образом, заявляемые аккумулятор и электролит соответствуют критерию изобретения "новизна". При изучении других известных те хнических решений в данной области техники признаки, отличающие заявляемое изобретение от прототипа, не были выявлены и поэтому они обеспечивают заявляемому техническому решению соответствие критерию "существенные отличия". На фиг.1 - вид сбоку с частичным разрезом электроаккумулятора в соответствии с настоящим изобретением; на фиг.2 - вертикальный разрез ячейки для испытания электролитов в виде расплавленных солей в соответствии с настоящим изобретением; на фиг.3 - 6 - график зависимости напряжения (В) от тока (А) в ячейке, изображенной на фиг.2, для различных электролитов в виде расплавленных солей в соответствии с настоящим изобретением; на фиг.7 - график, аналогичный графикам, изображенным на фиг.3 - 6, для известного (контрольного) расплавленного электролита; на фиг.8 - 11 - графики зависимости напряжения (В) для зарядно-разрядных кривых от емкости (А-ч) для аккумуляторов в соответствии с настоящим изобретением типа, изображенного на рис.1. Пример 1. Получение легированного электролита. 1,252кг в виде мелкоизмельченного порошка тщательно смешивали с 0,548кг Смесь нагревали в никелевом тигле при температуре 250 - 300°C в течение примерно 18ч, в результате чего получали расплавленный нелегированный электролит, хлоралюминий натрия с молярным соотношением между и 1 : 1. После этого в приготовленный нелегированный электролит вводили добавку на кг Частично легированный электролит выдерживали в течение примерно 2ч при 250 - 300°C, в результате чего он проходил в равновесное состояние, после чего к расплаву добавляли порошок металлического алюминия (около 5г на кг для удаления остаточного кислого водорода, который может присутствова ть в исходном и полностью легированный электролит выдерживали в течение примерно часа при 250 - 300°C до достижения равновесия. В результате получали легированный электролит в виде расплавленной соли (хлоралюминат натрия, легированный пригодный для использования в вышеописанных аккумуляторах с сепараторами из бета-оксида алюминия и катодами (заряженными) в виде двух или более или смеси хлоридов эти х переходных металлов, и металлический алюминий берут в таких количествах, чтобы молярное соотношение между и в образующемся растворе расплавленной соли нового электролита равнялось 1 : 1. Это условие легко выполнить, если брать исходный в небольшом избытке. Благодаря использованию легированный электролит имеет более низкую льюисову кислотность, чем расплав с в мольном соотношении 1 : 1 (т.е. Полученный таким образом электролит в виде расплавленной соли может использоваться в аккумуляторе типа, изображенного на фиг.1. На фиг.1 цифрой 10 обозначен высокотемпературный, способный перезаряжаться электроаккумулятор в соответствии с настоящим изобретением, включающий корпус 12, разделенный сепаратором 14 из бета-оксида алюминия на анодное 16 и катодное 18 пространства. В анодном пространстве находится активный анод 20 в виде расплавленного натрия и токосборник в виде стержня 22. В катодном пространстве находятся вышеописанный электролит 24 в виде расплавленной соли, хлоралюмината натрия, с добавкой и токосборник в виде стержня 26. Кроме того, в катодном пространстве находится катод 28, включающий проницаемую для электролита пористую матрицу, обладающую электронной проводимостью и насыщенную вышеуказанным электролитом 24, в которую погружен стержень 26. В заряженном состоянии катод 28 содержит диспергированные в нем и контактирующие с матрицей и электролитом 24 один или более вышеупомянутых хлоридов переходных металлов, например или играющих роль активного катодного материала. В процессе разряда аккумулятора натрий переходит из анода 20 в ионной форме через сепаратор 14 и электролит 24 к катоду, на котором разряжается до железа с образованием При последующем заряде происходит обратный процесс, при котором на катоде образуется а железо расходуется на катоде, ионы натрия через электролит 24 и сепаратор 14 проходят назад в анодное пространство, где они принимают электроны и превращаются в расплавленный натрий. Следует отметить, что при мольном соотношении между и в электролите 1 : 1 при полностью заряженном аккумуляторе это соотношение будет сохраняться и в процессе разряда, поскольку при разряде аккумулятора происходит образование в виде твердой фазы, контактирующей с электролитом 24. Поэтому указанное соотношение никогда не может стать меньше 1 : 1 и электролит никогда не будет кислым. Тем не менее, для того, чтобы наверняка исключить возможность возрастания кислотности электролита 24, а матрицу катода аккумулятора когда он находится в полностью заряженном состоянии, можно вводить небольшой избыток в тонкоизмельченной форме. Пример 2. Испытание электролита. Готовили различные электролиты в соответствии с настоящим изобретением. В каждом случае добавку вводили в количестве 3 массовых процентов. Испытывали следующие добавки: карбонат натрия; оксалат натрия - донор оксида]; пирофосфат натрия - так называемая кислота) и буру - сопряженное основание так называемой кислоты). Следует отметить, что оптимизации концентрации добавки в легированных электролитах не проводили, и для определения оптимальной концентрации добавки и ее природы для конкретного аккумулятора необходимо проведение рутинных экспериментов. Испытания проводили в изображенной на фиг.2 ячейке 30 с цилиндрическим корпусом в виде стеклянного стакана 32, помещаемого в вертикальном положении в отверстие 34 печи 36. Полый цилиндрический источник-приемник 38 для катионов натрия расположен концентричне в стакане 32, опираясь на его дно. Состав его описан ниже. Внутри него концентричне размещается второй приемник-источник 40. Внутри приемника-источника 38 смонтированы две тр убки из b"-оксида алюминия. Первая, внешняя, трубка 42 расположена концентрично относительно источника-приемника 38 и опирается на дно стакана 32. Вторая, внутренняя, трубка 44 расположена концентричне внутри трубки 42. Источник-приемник 40 также выполнен в виде полого цилиндра и имеет тот же состав (зависящий, как это будет показано ниже, от состояния его заряда), что и источник-приемник 38. Источник-приемник 40 расположен внутри трубки 44 и опирается на ее дно, не касаясь в то же время внутри цилиндрической стенки трубки. Расплавленный электролит 46 заливается в стакан 32 в количестве, достаточном, чтобы источникприемник 38 был полностью погружен в него. Точно также расплавленный электролит 48 заливается в трубку 44 в количестве, достаточном, чтобы источник-приемник 40 был полностью погружен в него. Нижний конец трубки 44 расположен выше дна трубки 42 на шайбе из aоксида алюминия 50, не обладающего электронной проводимостью. В трубке 42 находится расплавленный электролит 52, окружающий нижнюю часть трубки 44. Уровень электролита 48 выше уровня электролита 52, который в свою очередь выше уровня электролита 46. Сверху стакан 32 закрыт круглой пробкой 54 из керамической ваты с отверстием, через которое проходит тр убка 42. Трубка 42 сверху также закрыта круглой пробкой 56 из с отверстием, через которое проходит трубка 44. И, наконец, трубка 44 сверху закрыта пробкой 58 из Выводы 60 и 62 проходят соответственно через пробку 58, контактируя с источникомприемником 40, и через пробку 54, контактируя с источником-приемником 38. Для контроля температуры в отверстии 34, вне стакана 32, размещается термопара 64. Сборку ячейки 30, ее загрузку и опыты проводили в перчаточном боксе (на рисунке не показан) в атмосфере сухого азота. Источники-приемники 38 и 40 готовили одинаковым образом из спеченных пористых никелевых цилиндров, которые пропитывали для чего их погружали в насыщенный водный раствор и затем высушивали. После этого никель источника-приемника 38 электрохимически хлорировали по реакции для чего он подключался в качестве катода в электрохимической ячейке, в которой он насыщался при погружении в нейтральный электролит, представляющий собой расплавленную соль (эквимолярные количества и Электролит отделялся от смеси никелевого порошка и насыщенной им, с помощью сепаратора из bоксида алюминия. Эта смесь образовала приемник ионов натрия, а после хлорирования источника-приемника 38 натрий, образующийся по вышеуказанной реакции, переходил в ионной форме из источника-приемника 38, который функционировал как источник, в указанную смесь никелевого порошка и которая играла роль приемника для этих ионов. В этом приемнике ионы натрия реагировали с порошкообразным по реакции Хлорирование осуществляли, прикладывая напряжение к электродам ячейки, в результате чего электроны по внешней цепи поступали к порошкобразной смеси через никелевый токосборник и выходили из источника-приемника 38. Таким образом через источник-приемник 38 пропускалось количество электричества 5А-ч. Заряженный таким образом источникприемник 38 помещали затем в ячейку 30, как это показано на фиг.2, где его насыщали электролитом 46. Источник-приемник 40, пропитанный сухим но не хлорированный, помещали непосредственно в трубку 44 ячейки 30, где его насыщали электролитом 48. Оба электролита 46 и 48 представляли собой нейтральный электролит (эквимолекулярная смесь и которому добавляли в достаточном избытке твердый для того чтобы обеспечить его нейтральность на весь период работы ячейки. После этого проводили тренировку ячейки 30, используя в качестве электролита 52 нейтральную расплавленную соль для чего на зажим 60 и 62 подавали такой потенциал, чтобы уменьшить содержание в источникеприемнике 38 и осуществить хлорирование никеля в источнике-приемнике 40. Затем этот потенциал меняли на противоположный, для того, чтобы реакции протекали в обратном направлении и проводили такое цитирование до тех пор, пока источники-приемники 38 и 40 не начинали работать обратимо, при емкости около 2А-ч, достаточно воспроизводимо и без поляризации. При приготовлении расплавленных электролитов всегда исходили из основного (без добавок) электролита, хлоралтомината натрия. Нейтральный (с мольным соотношением между и 50 : 50) электролит испытывали наряду с несколькими основными кислыми электролитами с различным соотношением и причем мольная концентрация была выше, чем концентрация Эти электролиты испытывали в качестве электролита 52 в ячейке 30. Состав нейтральных электролитов 46 и 48 оставался одинаковым во всех опытах. Вначале при работе ячейки 30 с нейтральным электролитом 52, она имела очень низкое внутреннее сопротивление, о чем свидетельствует кривая 21 на фиг.7, которое не зависело от направления тока, протекающего через ячейку. Зависимость между напряжением и током была практически линейной (омическая зависимость) и, хотя сопротивление несколько возрастало во времени, это возрастание было пренебрежимо малым по сравнению с приведенными ниже результатами для кислых электролитов 52. Внутреннее сопротивление на практике было таким, каким его и можно было ожидать, исходя из сопротивлений нейтральных расплавов 46,48 и 52 и трубок 42 и 44 из b"-оксида алюминия. Во всех случаях электролиты с добавками в соответствии с настоящим изобретением готовили путем введения добавки в небольшое количество расплава и смешения ее с ним с помощью ступки и пестика в перчаточном боксе. Эту смесь добавляли затем к остальному электролиту, который предварительно заливали в пространство между тр убками 42 и 44. Для получения различных кислых расплавов к находящемуся в пространстве между трубками 42 и 44 легированному расплаву 52 добавляли соответствующие небольшие количества расплавленного Следует отметить, что для каждой добавки в трубки 42 и 44 заливками свежий электролит. Использовали электролиты с различным мольным соотношением между и а именно: 50 : 50, 9 : 51, 48 : 52, 47 : 53 и 43 : 56. Не все электролиты с этими соотношениями испытывали с каждой добавкой. Прежде всего каждую добавку испытывали с расплавом 50 : 50, как непосредственно, так и (в некоторых, специально оговоренных случаях) через определенные интервалы. После этого добавляли к электролиту необходимое количество для получения расплава с соотношением 48 : 51 и испытывали его непосредственно и через один или несколько интервалов, как это описано ниже. Затем к нему добавляли следующую порцию для получения следующего соотношения (48 : 52) и испытывали таким же образом, и т.д., увеличивая количество добавляемого до получения в конечном счете соотношения 43 : 57, используя в ходе все х испытаний трубки 42 и 44 с электролитом неизменяющегося состава с исследуемой добавкой. Добавка карбонат натрия. С этой добавкой испытывали электролиты различного состава, приведенного в табл.1. В испытаниях, проводившихся в ячейке 30 (фиг.2) во всех опытах использовали одинаковое количество электролита. Напряжение на зажимах 62, 64 увеличивали ступенчато на небольшую величину, измеряя все время ток, проходящий через ячейку. Полученные результаты приведены на фиг.3. Испытания проводили при 300°C, как непосредственно после достижения этой температуры, так и через различные интервалы после нагревания при 300°C. На фиг.3 кривая 1 соответствуе т композиции 1, испытывавшейся сразу же после нагрева ячейки до 300°C; кривая 2 отвечает композиции 2, испытывавшейся после нагревания ее при 300°C в течение 20ч; кривая 3 отвечает композиции 6, испытывавшейся после нагревания ее при 300°C в течение 20ч. Композицию 3 испытывали после выдержки при 300°C в течение 120ч. Композицию 4 испытывали после выдержки при 300°C в течение 20ч. То же самое относится и к композиции 5, а композицию 2 испытывали сразу же после нагревания. Кривые, отвечающие этим четырем опытам, расположены близко одна к другой между кривыми 1 и 4, т.е. в заштрихованной зоне на фиг.3. Добавка оксалат натрия. Те же испытания, что и для карбоната натрия, приводили для оксалата натрия, использующегося в качестве добавки к электролитам, составы которых приведены в табл.2. Полученные результаты приведены на фиг.4, кривая №5 которого относится к композиции №7, испытывавшейся сразу после нагрева до 300°C, кривая №6 - к композиции №8, испытывавшейся сразу после нагрева до 300°C, кривая №7 - к композиции №8, испытывавшейся после нагрева в течение 4ч при 300°C, а кривая №8 - к композиции №12, испытывавшейся после нагрева в течение 20ч при 300°C. Композиции №9, 10 и 11 испытывались после нагрева в течение 20ч при 300°C. Все три кривые, отвечающие этим зависимостям, лежат между кривыми №5 и №9, т.е. в заштри хованной зоне на фиг.4. Добавка пирофосфат натрия Те же испытания, что и для карбоната натрия, проводили для использовавшегося в качестве добавки к электролитам, состав которых приведен в табл.3. Полученные результаты приведены на фиг.5, кривая №10 которого относится к композиции №13, испытывавшейся сразу после нагрева до 300°C, кривая №11 - к композиции №14, испытывавшейся сразу после нагрева до 300°C, кривая №12 - к композиции №14, испытывавшейся после нагрева в течение 20ч при 300°C, а кривая №13 - к композиции №17, испытывавшейся после нагрева в течение 20ч при 300°C. Композиции №15 и 16 испытывались после нагрева в течение 20ч при 300°C. Обе кривые, отвечающие этим композициям, лежат между кривыми №10 и 14, т.е. в заштри хованной зоне на фиг.5. Добавка бура Те же испытания, что и для карбоната натрия, проводили для буры, использовавшейся в качестве добавки в электролитах, состав которых приведен в табл.4. Полученные результаты приведены на фиг.6, кривая №15 которого относится к композиции №18, испытывавшейся сразу же после нагрева до 300°C, кривая №16 - в композиции №20, испытывавшейся сразу же после нагрева до 300°C, кривая №17 - к композиции №20, испытывавшейся после нагрева в течение 20ч при 300°C, кривая №18 - к композиции №19, испытывавшейся сразу же после нагрева до 300°C, кривая №19 - к композиции №19, испытывавшейся после нагрева в течение 20ч при 300°C, а кривая №20 - к композиции №21, испытывавшейся после нагрева в течение 20ч при 300°C. На фиг.3 - 6 видно, что наиболее эффективной добавкой является карбонат натрия в соответствии с фиг.3. Как видно из кривой №2, сравнительно низкое сопротивление возрастает для композиции №2 с мольным соотношением между и 43 : 57, испытывавшейся после нагрева в течение 20ч. В случае композиции №3, испытывавшейся после нагрева в течение 20ч, сопротивление лишь немного выше, чем в случае контрольной композиции (кривая №1) с мольным соотношением между указанными компонентами 50 : 50. Если снова вернуться к оксалату натрия (фиг.4), то можно видеть, что он является эффективной добавкой, присутствие которой делает расплав и/или трубки из b"-оксида алюминия стойким в кислом расплаве, и лишь при мольном соотношении и 43 : 57 (композиция №9, испытывавшаяся после нагрева в течение 4ч, кривая №7) наблюдается заметное возрастание сопротивления. При использовании в качестве добавки пирофосфата натрия (фиг.5) лишь при увеличении содержания до соотношения между и 47 : 53 (кривая №12) наблюдается заметное возрастание сопротивления. Каждая последующая (после первой) добавка вводилась через 20ч после предыдущей, т.е. проходило достаточно времени, чтобы можно было обнаружить небольшое возрастание сопротивления. Как следует из фиг.6, в то время как в случае композиции №20 наблюдалось небольшое возрастание сопротивления (кривые №16 и 17), в случае композиции №19 (кривые №18 и 19) сопротивление возрастало, в частности при проведении испытаний после нагрева в течение 20ч. Тем не менее, в случае композиции №19 были получены гораздо более хорошие результаты, чем для контрольной (без добавок) композиции №21 (кривая №20). Электролиты без добавки (контрольные). Аналогичным образом испытывали различные электролиты без добавок, состав которых приведен в табл.5. Полученные результаты приведены на фиг.7, кривая №21 которого относится к композиции №22, испытывавшейся сразу же после нагрева до 300°C, кривая №22 - к композиции №23, испытывавшейся сразу же после нагрева до 300°C, кривая №23 - к композиции №23, испытывавшейся через 20ч после нагрева до 300°C, кривая №24 - к композиции 24, испытывавшейся сразу же после нагрева до 300°C, и кривая №25 - к композиции №24, испытывавшейся после нагрева в течение 20ч при 300°C. В этом случае даже при мольном соотношении 49 : 51 (композиция №23) сопротивление сразу же существенно возрастает (кривая №22). Через 20ч наблюдается резкое возрастание (кривая №23). Это свидетельствуете том, что на межфазной границе b'-оксид алюминия расплав одновременно, по-видимому, имеют место и отравление, и концентрационная поляризация. В случае расплава с мольным соотношением компонентов 40 : 60 (композиция №24) сопротивление сразу же возрастает настолько, что напряжение на аккумуляторе трудно было измерить даже при очень маленьких токах. Пример 3. Перезарядка аккумулятора. В опытах использовали аккумулятор конструкции, изображенной на фиг.1, с матрицей катода из пористого никеля и в качестве активного катодного материала. В аккумулятор заливали электролит в виде расплавленной соли типа, описанного в примере 1, но с избытком Мольное соотношение между и в электролите составляло 50 : 50. Добавка карбоната натрия 3мас.%. Аккумулятор представлял собой малонагруженный аккумулятор, нагрузка катода которого в полностью разряженном состоянии составляла лишь 0,1А-ч/г - эквивалент Аккумулятор разряжали при 300°C и затем проводили такое количество зарядно-разрядных циклов, которое заведомо приводило к его перезарядке. Конструкция аккумулятора и его зарядка были таковы, что в полностью заряженном состоянии мольное соотношение между и составляло 50 : 50. При перезарядке его на 1А-ч это соотношение составляло 47,7 : 52,3, при перезарядке на 2А-ч 45 : 55, а при перезарядке на 3А-ч - 42,2 - 57,8. В процессе разряда аккумулятора из перезаряженого состояния указанное соотношение возрастало до 50 : 50 при полностью заряженном состоянии и при последующем разряде оставалось практически постоянным. Образующийся в результате реакции разряда нерастворим в электролите и выделяется в твердом виде. Аккумулятор заряжали током 0,5А, что соответствовало плотности тока 10мА/см 2, а разряжали током 1,0А (20мА/см 2). На фиг.2 для нескольких циклов заряда - разряда приведены зависимости напряжения от полной разрядной емкости, характеризующие степень заряда аккумулятора и указана его теоретическая емкость. Сопротивление, равнявшееся 2,889Ом × см 2, оставалось нормальным после перезарядки и находилось, в обычных пределах (2,5 - 3,0Ом ×см 2) для такого типа неперезаряженных аккумуляторов. Примеры 4 - 6. Перезарядка аккумулятора. Повторяли процесс таким же образом, как и в примере 3, но в качестве добавки использовали 3мас.% пример 4; оксалата натрия (пример 5) и буры (пример 6). Полученные результаты в виде аналогичных графиков приведены соответственно на фиг.9 10 (оксалат натрия) и 11 (бура). Графики на фиг. 8 - 11 подтверждают стойкость расплавов с добавкой перезарядке аккумуляторов используемой конструкции. Из результатов, проведенных ранее заявителем опытов в аналогичных аккумуляторах с электролитами без добавки следует, что внутреннее сопротивление аккумулятора значительно возрастает при перезарядке, что согласуется с результатами примера 2 (см. фиг.3 7). Самые хорошие результаты в примерах 3 - 6 были получены при использовании в качестве добавки карбоната натрия в соответствии с примером 3. При перезарядке аккумулятора с электролитом с такой добавкой на 2А-ч (80% перезарядки) сопротивление аккумулятора не возрастало. Возрастание сопротивления наблюдалось лишь при перезарядке более чем на 3А-ч (120% перезарядки). Наименее эффективной оказалась добавка буры (пример 6). Оксалат натрия был эффективнее пирофосфата натрия. При использовании аккумуляторов рассматриваемой конструкции добавки в соответствии с настоящим изобретением присутствие в катодном пространстве кислого расплава является весьма нежелательным. Ранее для предупреждения подкисления электролита (т.е. чтобы мольное соотношение между и не было меньше 1 : 1) заявитель предложил обеспечивать присутствие в расплавленном электролите при любой степени заряжения, в частности при полностью заряженном состоянии, твердого На практике это означает, что ранее емкость аккумулятора определялась количеством (или другого переходного металла, использующегося в качестве активного катодного материала) в разряженном катоде, который желательно использовать в процессе заряжения, Отсюда следует, что в катодном пространстве полностью разряженного аккумулятора в контакте с расплавленным электролитом должно находиться достаточное количество хлорида щелочного металла, например для того, чтобы с одной стороны, обеспечить хлорирование использующегося в качестве активного катодного материала катода переходного металла и, с другой стороны, обеспечить избыток позволяющий предупредить подкисление электролита в процессе перезарядки. Этот избыток или хлорида другого щелочного металла сам по себе создает ряд проблем. Помимо того, что с электрохимической точки зрения он является "мертвым грузом", это должен присутствова ть при перезарядке для хлорирования никеля или другого переходного металла в катодном пространстве в избытке, необходимом для функционирования в аккумуляторе в качестве активного катодного материала. Часто аккумуляторы такого типа имеют токосборник из переходного металла или каркаса в виде проницаемой для электролита пористой матрицы, насыщенной расплавленным электролитом. Если металл матрицы хлорируется при перезарядке, то при последующем разряде аккумулятора могут возникнуть трудности с его восстановлением, что приводит к возрастанию внутреннего сопротивления аккумулятора и постоянной частичной потере емкости. Кроме того, после расходования избытка происходит подкисление электролита. В результате активные катодные материалы, такие как и могут растворяться в нем, следствием чего является эрозия или растворение катода и уменьшение емкости. В случае же настоящего изобретения используется добавка, играющая роль буфера, который регулирует льюисовую кислотность расплавленного электролита, когда мольное соотношение между и становится меньше 1. При этом уже не требуется, чтобы в расплавленном электролите в полностью заряженном аккумуляторе был избыток Тем самым устраняется проблема мертвого груза и замедляется процесс хлорирования никеля или другого переходного металла матрицы или материала каркаса, необходимого для токосборника. Другое существенное преимущество настоящего изобретения состоит в том, что оно позволяет проводить заряжение с более высокой скоростью по сравнению с известными аккумуляторами такого типа, но без добавки. Даже если в таких известных аккумуляторах и принимаются меры для предотвращения отравления электролита при перезарядке путем введения избытка твердого тем не менее в них все же могут происходить подкисление электролита и отравление b"-оксида алюминия или аналогичных твердых электролитов, а также растворение и эрозия катода. Так, при высоких скоростях заряжения отельные участки катода могут исто щаться по и твердый контактирующий с обедненным электролитом уже не может достаточно быстро растворяться и/или диффундировать в эти обедненные зоны для поддержания в них нейтральности кислоты Льюиса. Наличие в катоде этих зон с повышенной кислотностью может поэтому приводить к вышеописанному отравлению b"- или b-оксида алюминия в результате вытравливания из них расплава и эрозии и растворению катода. Введение в расплав растворяющегося в нем буфера для буферирования кислотности Льюиса и добавок в соответствии с настоящим изобретением позволяет полностью или по меньшей мере частично решить эту проблему. Перезарядка аккумулятора рассматриваемого типа может происходить по различным причинам, в частности при соединении их в батареи последовательно и/или параллельно. Авторами настоящего изобретения было установлено, что добавка - каков бы ни был механизм ее действия снижает возрастание внутреннего сопротивления, связанное с перезарядкой и сопутствующему ей подкислению расплавленного электролита. На фиг.3 - 7 с очевидностью следует, что возрастание внутреннего сопротивления происходит на межфазной границе твердый электролит - расплавленный электролит, если расплавленный электролит является кислым. Чем выше кислотность и чем больше времени твердый электролит находится в контакте с расплавленным электролитом при высокой температуре, тем больше возрастает сопротивление. Использование добавок в соответствии с настоящим изобретением позволяет резко снизить скорость возрастания внутреннего сопротивления до значений, лишь незначительно превышающих сопротивление, имеющее место при использовании нейтрального расплавленного электролита с соотношением компонентов 50 : 50. На фиг.8 видно, что при пятом и шестом разрядных циклах после перезарядки соответственно на примерно 1 и 2А-ч напряжение на аккумуляторе практически такое же, как и при четвертом разрядном цикле, протекающем до наступления перезарядки. Только после значительной перезарядке (на 3А-ч выше нормальной емкости аккумулятора) на восьмом разрядном цикле происходило снижение напряжения, что свидетельствует о возрастании внутреннего сопротивления аккумулятора. Аналогично, как видно из фиг.9, при четвертом разрядном цикле после перезарядки на 1А-ч не происходило уменьшения напряжения или увеличения сопротивления по сравнению с третьим разрядным циклом, который проводили до перезарядки. Только после перезарядки на 2А-ч, при пятом разрядном цикле уменьшалось напряжение и возрастало внутреннее сопротивление. Аналогично, как следует из фиг.10, лишь при перезарядке на 2А-ч, при шестом разрядном цикле происходило уменьшение напряжения и возрастало сопротивление. Однако в случае, изображенном на фиг.11, напряжение падало только при перезарядке на 1А-ч. Преимущество изобретения состоит в том, что продуктом его является аккумулятор, электролит и способ эксплуатации аккумулятора, позволяющий предупредить возрастание внутреннего сопротивления при зарядно-разрядных циклах, возникающее, по-видимому, из-за отравления сепаратора в результате обеднения его по под воздействием кислого расплавленного электролита. Предлагаемый способ позволяет также контролировать растворение или эрозию катода, обусловленные воздействием на него кислого электролита. Аккумуляторы конструкции в соответствии с изобретением, т.е. содержащие указанные переходные металлы, которые галогенируются в процессе заряжения, превосходят натрийсернистые аккумуляторы в том, что они в отличие от последних могут пропускать ток и при перезарядке. Предлагаемый способ позволяет лучше использовать способность аккумуляторов с такими катодами из переходных металлов пропускать ток при заведомой перезарядке, поскольку они оказываются более стойкими к случайным перезарядкам, обусловленным действием кислого электролита.
ДивитисяДодаткова інформація
Назва патенту англійськоюHigh-temperature electrochemical accumulator and molten slt electrolyte for high-temperature electrochemical accumulator
Назва патенту російськоюВысокотемпературный электрохимический аккумулятор и расплавленый солевой электролит для высокотемпературного электрохимического аккумулятора
МПК / Мітки
МПК: H01M 10/36
Мітки: електроліт, електрохімічного, високотемпературного, високотемпературний, розплавлений, акумулятор, електрохімічний, сольовий, акумулятора
Код посилання
<a href="https://ua.patents.su/9-18632-visokotemperaturnijj-elektrokhimichnijj-akumulyator-i-rozplavlenijj-solovijj-elektrolit-dlya-visokotemperaturnogo-elektrokhimichnogo-akumulyatora.html" target="_blank" rel="follow" title="База патентів України">Високотемпературний електрохімічний акумулятор і розплавлений сольовий електроліт для високотемпературного електрохімічного акумулятора</a>