Сульфонілований діамін, спосіб його одержання і застосування у каталізі гідрування з перенесенням водню
Номер патенту: 91527
Опубліковано: 10.08.2010
Автори: Медлок Джонатан Алан, Граса Габріела Александра, Цанотті-Джероза Антоніо, Домінгес Беатріс
Формула / Реферат
1. Сульфонілований діамін формули (І)
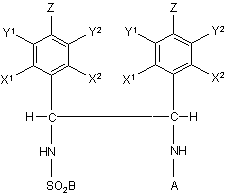 , (І)
, (І)
в якому
А являє собою водень або насичену або ненасичену С1-С20 алкільну групу або арильну групу;
В являє собою заміщену або незаміщену С1-С20 алкільну, циклоалкільну, алкіларильну, арилалкільну або арильну групу або алкіламіногрупу і
щонайменше один з X1, X2, Y1, Y2 і Z є С1-С10 алкільним, циклоалкільним, алкіларильним, арилалкільним або алкокси замісником, і
у випадку, коли X1, X2, Y1, Y2 і Z не є С1-С10 алкільним, циклоалкільним, алкіларильним, арилалкільним або алкокси замісником, тоді X1, X2, Y1, Y2 і Z являють собою водень.
2. Сульфонілований діамін за п. 1, в якому А є воднем.
3. Сульфонілований діамін за п. 1 або 2, в якому В є заміщеною або незаміщеною арильною групою.
4. Сульфонілований діамін за будь-яким з пп. 1-3, в якому X1, X2, Y1 і Y2 є воднями, a Z є С1-С10 алкільним, алкіларильним, циклоалкільним, арилалкільним або алкокси замісником.
5. Сульфонілований діамін за п. 4, в якому Z являє собою метил.
6. Сульфонілований діамін за п. 4, в якому Z являє собою метокси.
7. Сульфонілований діамін за будь-яким з пп. 1-6, в якому діамін є гомохіральним.
8. Спосіб одержання сульфонілованого діаміну формули (І) за будь-яким з пп. 1-7, який включає стадії:
a) утворення заміщеного спіроімідазолу з заміщеного дикетону формули (II),
b) відновлення заміщеного спіроімідазолу до утворення заміщеного діаміну,
с) сульфонілування заміщеного діаміну
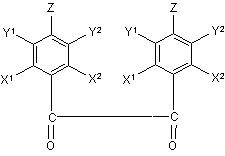 (ІІ).
(ІІ).
9. Спосіб за п. 8, який додатково включає стадію необов'язкового перетворення заміщеного діаміну у енантіомерно збагачену форму.
10. Каталізатор, який містить продукт реакції сульфонілованого діаміну формули (І) за будь-яким з пп. 1-7 і сполуку металу, що вибирають зі списку, який включає Ru, Rh, Ir, Co, Ni, Fe, Pd, Pt.
11. Каталізатор за п. 10, в якому сполукою металу є [МХ2(арен)]2, де M=Rh або Ru і Х=галоген.
12. Застосування каталізатора за п. 10 або 11 для проведення реакції гідрування з перенесенням водню.
13. Застосування каталізатора за п. 12, в якому реакцію гідрування з перенесенням водню проводять з циклічним кетоном.
Текст
1. Сульфонілований діамін формули (І) 2 3 91527 b) відновлення заміщеного спіроімідазолу до утворення заміщеного діаміну, с) сульфонілування заміщеного діаміну Z Z Y1 Y2 Y1 Y2 X1 X2 X1 X2 C C O O (ІІ). Винахід стосується діамінів і особливо заміщених дифенілетилендіамінів, а також каталізаторів, які одержують з них. Такі каталізатори придатні для прискорення реакцій асиметричного гідрування, продукти яких корисні, наприклад, як хімічні проміжні продукти або реагенти для застосування в одержанні високоякісних хімічних реактивів або фармацевтичних проміжних продуктів. Каталітичне асиметричне гідрування включає активацію молекулярного водню хіральними комплексами металів. Однак, органічні молекули також можуть застосовуватися як донор водню у присутності придатного хірального каталізатора у процесі, відомому як гідрування з перенесенням водню. Донор водню, такий як ізопропанол або мурашина кислота, звичайно використовується з каталізаторами типу (сульфонілований діамін)[RuCl(арен)] для відновлення карбонільних груп. Ця технологія забезпечує потужне доповнення до каталітичного асиметричного гідрування. Гідрування з перенесенням водню, фактично, є особливо придатним для асиметричного відновлення кетонів, які являють собою складні субстрати для гідрування, такі як ацетиленові кетони і циклічні кетони. До нашого часу сульфонілований діаміновий компонент каталізаторів гідрування з перенесенням водню був обмежений сульфонілованим дифенілетилендіаміном (Dpen) і циклоалкіл-1,2діамінами, такими як 1,2-циклогексан. Наприклад, гідрування з перенесенням водню застосовували, використовуючи [(тозилDpen)RuCl(арен)]каталізатор для фармацевтичних продуктів, таких як 10-гідрокси-дигідро-дибенз[b,f]азепіни [див. WO 2004/031155]. Сульфоніловані діамінові компоненти, що використовуються до нашого часу, будучи корисними, не є однаково ефективними у всьому діапазоні бажаних субстратів. Таким чином, існує потреба у розширенні ряду діамінів, придатних для використання у каталізі гідрування з перенесенням водню, що забезпечить каталізатори з підвищеною активністю, селективністю і стабільністю. Ми виявили, що стеричні і електронні властивості діамінового компонента можуть бути корисним чином перебу 4 9. Спосіб за п. 8, який додатково включає стадію необов'язкового перетворення заміщеного діаміну у енантіомерно збагачену форму. 10. Каталізатор, який містить продукт реакції сульфонілованого діаміну формули (І) за будь-яким з пп. 1-7 і сполуку металу, що вибирають зі списку, який включає Ru, Rh, Ir, Co, Ni, Fe, Pd, Pt. 11. Каталізатор за п. 10, в якому сполукою металу є [МХ2(арен)]2, де M=Rh або Ru і Х=галоген. 12. Застосування каталізатора за п. 10 або 11 для проведення реакції гідрування з перенесенням водню. 13. Застосування каталізатора за п. 12, в якому реакцію гідрування з перенесенням водню проводять з циклічним кетоном. довані шляхом введення одного або декількох замісників у фенольні кільця дифенілетилендіамінів і шляхом варіювання властивостей сульфонатів. Відповідно, даний винахід забезпечує діамін формули (І) в якій А є воднем або насиченою або ненасиченою С1-С20 алкільною групою або арильною групою; В являє собою заміщену або незаміщену С1-С20 алкільну, циклоалкільну, алкіларильну, арилалкільну або арильну групу або алкіламіно групу і, щонайменше один з X1, X2, Y1, Y2 або Z є С1-С10 алкільним, циклоалкільним, алкіларильним, арилалкільним або алкокси замісником. Винахід, крім того, забезпечує спосіб одержання діаміну формули (І), що включає стадії утворення заміщеного спіроімідазолу із заміщеного дикетону формули (II), де X1, X2, Y1, Y2 і Z є такими, як описано вище, відновлення заміщеного спіроімідазолу з утворенням заміщеного діаміну, необов'язкового перетворення заміщеного діаміну в енантіомерно збагачену форму і сульфонілування заміщеного діаміну. 5 Винахід також забезпечує каталізатор, що містить продукт реакції діаміну формули (І) і придатної сполуки каталітично активного металу. У формулі (І) А є воднем або насиченою або ненасиченою С1-С20 алкільною групою або арильною групою. С1-С20 алкільна група може бути розгалуженою або лінійною, наприклад, може бути метилом, етилом, н-пропілом, ізопропілом, нбутилом, ізобутилом, втор-бутилом, трет-бутилом, пентилом, гексилом, циклогексилом, етилгексилом, ізооктилом, н-нонілом, н-децилом, ізодецилом, трйдецилом, октадецилом та ізооктадецилом. Арильна група може бути незаміщеним або заміщеним фенілом, нафтилом або антрацилфенілом. Придатними замісниками є гідрокси група, галогенід (наприклад, F, СІ, Вr, І), С1-С20 алкокси, аміно, амідо, нітрильна і тіольна групи. Переважно А являє собою водень, метил, етил, пропіл або феніл. Найбільш переважно, коли А є воднем. У формулі (І) В вводиться при сульфонілуванні необов'язково енантіомерно збагаченого заміщеного діаміну. Для внесення зміни у властивості сульфонілованого діаміну формули (І) може бути використаний широкий ряд сульфонілуючих сполук. Відповідно, В може являти собою заміщену або неіаміщену С1-С20 алкільну, циклоалкільну, алкіларильну, арилалкільну або арильну групу, наприклад, таку як описано вище або алкіламіно групу. Під «алкіламіно» ми маємо на увазі, що В може мати формулу -NR'2, де R' являє собою, наприклад, метил, циклогексил або ізопропіл або азот утворює частину алкільної циклічної структури. Можуть використовуватися фторалкільна або фторарильна групи, наприклад, В може бути nCF3-C6H4, C6H5 або CF2CF2CF2CF3 або CF3. Переважно В є арильною групою. Арильна група може бути незаміщеним або заміщеним фенілом, нафтилом або антрацилфенілом або арильною сполукою з гетероатомом, таким як піридил. Придатними замісниками є С1-С20 алкіл, такий як описано вище, трифторметил, гідроксил, галогенід (наприклад, F, СІ, Br, I), C1-C20 алкокси (особливо метокси), аміно, амідо, нітрил, нітро і тіол. Таким чином, В може являти собою, наприклад, онітрофеніл, п-нітрофеніл, трихлорфеніл, триметоксифеніл, триізопропілфеніл, о-амінофеніл, бензил (-СН2С6Н5), 2-фенілетил (С2Н4С6Н5), феніл (С6Н5), толіл (р-СН3-С6Н4), ксиліл ((СН3)2С6Н3), анізил (СН3О-СH4), нафтил або данзил (5-диметиламіно1-нафтил). Переважно В є толілом і сульфонілування проводиться тозилхлоридом (птолуолсульфонілхлоридом). 91527 6 Діамін даного винаходу має два хіральних центри, кожний містить фенольне кільце, яке має, щонайменше, один замісник X1, X2, Y1, Y2 або Z. Замісник X1, X2, Y1, Y2 або Z є С1-С10 алкільною, циклоалкільною, алкіларильною, арилалкільною або алкокси групою. Потрібно розуміти, що для того, щоб задовольнити валентності атомів вуглецю у фенольних кільцях, з якими зв'язаний замісник X1, X2, Y1, Y2 або Z, там де X1, X2, Y1, Y2 або Z не є С1-С10 алкільним, циклоалкільним, алкіларильним, арилалкільним або алкокси замісником, X1, X2, Y , Y або Z буде атомом водню. Таким чином, щонайменше, один з X1, X2, Y1, Y2 або Z може незалежно бути С1-С10 алкільною групою, такою як метил, трифторметил, етил, нпропіл, ізопропіл, н-бутил, ізобутил, втор-бутил, трет-бутил, пентил, циклопентил, гексил, циклоґексил, етил-гексил, ізооктил, н-ноніл, н-децил або ізодецил; алкіларильною групою, такою як бензил або етилфеніл; арильною групою, такою як феніл, толіл або ксиліл; або С1-С10 алкокси групою, такою як метокси, етокси, н-пропокси, ізопропокси, нбутокси, ізобутокси, втор-бутокси, трет-бутокси, циклопентокси, пентокси, гексокси, циклогексокси, етил-гексокси, ізооктокси, н-нонокси, н-децокси або ізодецокси. Переважно кожне фенільне кільце має один або декілька замісників. Фенільні кільця можуть бути заміщені в одному або декількох положеннях, тобто кільця можуть бути моно-, ди-, три-, тетраабо пента- заміщеними. Замісник у фенільному 1 2 1 кільці може знаходитися в орто (X , X ), мета (Y , Y2) або пара (Z) положенні. Однак, коли замісник у фенільному кільці знаходиться у мета-положенні, то це мінімізує електронний ефект, який здійснюється на аміногрупу, що може прискорювати синтез діаміну, який одержують у результаті. Таким чином, в одному варіанті здійснення заміщений діамін є 1,2-ді-(мета-заміщеним феніл)етилендіаміном. Коли є присутніми більше одного замісника, вони переважно є однаковими. Наприклад, в одному варіанті здійснення Y1, Y2 можуть бути воднями, а X1, X2 і Z є кожний переважно алкільним, циклоалкільним, алкіларильним, арилалкільним або алкокси замісником. В альтернативному варіанті здійснення X1, X2 і Z можуть бути воднями, a Y1, Y2 є однаковими переважно алкільними, циклоалкільними, алкіларильними, арилалкільними або алкокси замісниками. У переважному варіанті здійснення X1, X2, Y1, Y2 є воднями, a Z являє собою С1-С10 алкільний, циклоалкільний, алкіларильний, арилалкільний або алкокси замісник. В особливо переважному варіанті здійснення X1, X2, Y1, Y2 є воднями, a Z являє собою метил. В іншому особливо переважному варіанті здійснення X1, X2, Y1, Y2 є воднями, a Z являє собою метокси. Заміщені діаміни даного винаходу можуть бути легко одержані із заміщених дикетонів формули (II), де X1, X2, Y1, Y2 і Z є такими, як описано вище, через спіроімідазол, який потім відновлюється до діаміну і сульфонілується. 7 Заміщені дикетони (бензили) формули (II) можуть бути доступні з комерційних джерел або можуть легко бути одержані із заміщених бензальдегідів формули (III), де X1, X2, Y1, Y2 і Z є такими, як описано вище, за допомогою бензоїнової конденсації з подальшим окисненням бензоїну, одержаного у результаті. Заміщені бензальдегіди можуть бути одержані з комерційних джерел або можуть бути синтезовані, використовуючи відомі реакції заміщення. Реакції бензоїнової конденсації є добре відомими і звичайно виконуються шляхом реакції заміщеного бензальдегіду у придатному розчиннику у присутності ціаніду натрію [див., наприклад, Ide зі співавт. Org. React. 1948,4, 269304]. Окиснення заміщеного бензоїну до дикетону може легко бути виконане, використовуючи ацетат міді і нітрат амонію [див., наприклад, Weiss зі співавт. J. Am. Chem. Soc. 1948, 3666]. Спіроімідазол може бути одержаний обробкою заміщеного дикетону формули (II) оцтовою кислотою, ацетатом амонію і циклогексаноном і кип'ятінням зі зворотним холодильником. Відновлення заміщеного бензоїну, одержаного у результаті, до заміщеного аміну може бути виконане при змішуванні розчину спіроімідазолу з літієвим дротом і рідким амонієм при температурі нижче -60 С, обробляючи суміш етанолом і хлоридом амонію і даючи суміші нагрітися до кімнатної температури. Заміщений діамін сульфонілується, даючи заміщені діаміни даного винаходу. Заміщений діамін може бути потім сульфонілований при обробці заміщеного діаміну у придат 91527 8 ному розчиннику бажаним сульфоніл хлоридом, тобто Cl-SO2-B і основою, такою як триетиламін. Атоми азоту заміщеного діаміну зв'язані з хіральними центрами і, таким чином, заміщений діамін є хіральним. Діамін може бути гомохіральним, тобто (R,R) або (S,S) або мати один (R) і один (S) центр. Переважно, діамін є гомохіральним. Незважаючи на те, що діамін може бути використаний як рацемічна суміш, амін переважно є енантіомерно збагаченим. Розділення хірально заміщеного діаміну може бути виконане, використовуючи хіральну кислоту або будь-який інший спосіб, відомий фахівцям у даній галузі. Незважаючи на те, що розділення може бути проведене на стадії сульфонілованого діаміну формули (І), більш переважно проводити розділення на стадії заміщеного діаміну перед стадією сульфонілування. Наприклад, заміщений діамін може бути оброблений хіральною карбоновою кислотою, такою як дитолуоїлвинною кислотою або дибензоїлвинною кислотою у придатному розчиннику. Розділений заміщений діамін переважно має енантіомерний надлишок (ее %) >70%, більш переважно >90%. Таким чином, цей шлях забезпечує ефективний і рентабельний спосіб одержання енантіомерно збагачених заміщених 1,2дифенілетилендіамінів. Шлях описаний нижче на переважному прикладі, де А, X1, X2, Y1, Y2 є водними, В являє собою, наприклад, p-CH3-C6H5 і Z являє собою С1-С10 алкільний, циклоалкільний, алкіларильний, арилалкільний або алкокси замісник; 9 91527 10 Каталізатори, придатні для виконання асиметричних реакцій гідрування з перенесенням водню можуть бути одержані за реакцією заміщених сульфонілованих діамінів даного винаходу з придатною сполукою каталітично активного металу. Сполука металу переважно є сполукою металів, які вибирають зі списку, що складається з Ru, Rh, Ir, Co, Ni, Fe, Pd або Pt. Переважними сполуками є сполуки Ru, Rh і Ir, особливо Ru або Rh. Придатні сполуки Ru або Rh являють собою [МХ2(арен)]2, де M=Rh або Ru і Х=галоген, більш переважно [RuCl2(apeн)]2. Арени являють собою будь-які придатні ароматичні молекули і включають бензоли і циклопентадієни, наприклад, бензол, пентаметилциклопентадієн і пара-цимен (4-ізопропілтолуол). Особливо придатні сполуки металів для одержання каталізаторів гідрування включають [RhCp*Cl2]2 (де Ср* є СрМе5), [RuCl2(бензол)]2 і [RuCl2(пцимен)]2. Каталізатори можуть бути одержані простим змішуванням діаміну і сполуки металу у придатному розчиннику у м'яких умовах (наприклад, від 0 до 80 С при атмосферному тиску). Придатні розчинники включають вуглеводні, ароматичні вуглеводні, хлоровані вуглеводні, складні ефіри, спирти, прості ефіри, ДМФ і тому подібне. За бажанням реакція може проводитися окремо і каталізатор, одержуваний у результаті, може виділятися, наприклад, при видаленні розчинника під вакуумом. Альтернативно, каталізатор може утворюватися на місці, тобто у присутності субстрату, який треба гідрувати, і джерела водню, знову змішуючи сполуку металу і діамін у присутності реагуючих речовин, які можуть бути розбавлені придатним розчинником. Хіральні каталізатори даного винаходу можуть застосовуватися для реакцій гідрування. Звичайну карбонільну сполуку або імін, джерело водню, основу і розчинник змішують у присутності каталізатора, який може утворюватися на місці. Переважними джерелами водню є ізопропанол або мурашина кислота (або формати). Каталізатори можуть використовуватися для відновлення широкого ряду карбонільних сполук до відповідних хіральних спиртів та імінів до відповідних хіральних амінів. Реакції можуть проводитися у звичайних умовах гідрування з перенесенням водню і у різноманітних придатних розчинниках, відомих фахівцям у даній галузі. Наприклад, реакція може виконуватися у простому ефірі, складному ефірі або диметилформаміді (ДМФ) при температурі 0-75 С. Може бути присутньою вода. З мурашиною кислотою переважно використовуються триетиламін, DBU або інші третинні аміни. З ізопропанолом переважними є t-BuOK, KOH, iPrOK. Винахід ілюструється наступними прикладами. Приклад 1: Одержання діамінових лігандів (І) Утворення спіроімідазолу (перетворення 1 в 2) a) Z=Метил (СН3): Оцтову кислоту (70мл) додавали у колбу, що містить комерційно доступний дикетон 1а (диметилбензил 11,9г, 50ммоль) і ацетат амонію (27г, 350ммоль). Додавали циклогексанон (5,3мл, 51,5ммоль) і реакційну суміш кип'ятили зі зворотним холодильником 1-4 години. Після охолоджування до кімнатної температури суміш виливали у воду і залишали на ніч для кристалізації. Кристали відфільтровували і сушили при зниженому тиску. Перекристалізацію проводили з етилацетату/гексану і одержували 8,22 і 3,32г для виходу 2а і 2. Загальний вихід становив 11,54г, 73%. b) Z=Метокси (CH3O): Оцтову кислоту (100мл) додавали у колбу, що містить комерційно доступний дикетон 1b (диметоксибензил 18,9г, 70ммоль) і ацетат амонію (37,7г, 490ммоль). Додавали циклогексанон (7,45мл, 72,1ммоль) і реакційну суміш кип'ятили зі зворотним холодильником 1-4 години. Після охолоджування до кімнатної температури суміш виливали у воду і залишали на ніч для кристалізації. Кристали відфільтровували і сушили при зниженому тиску. Вихід імідазолу 2b становив 19,22г, 79%. Додаткового очищення можна досягти при перекристалізації з етилацетату/гексану. (II) Відновлення (перетворення 2 в 3) 11 a) Z=Метил (CH3): газоподібний аміак повільно конденсували у розчин спіроімідазолу 2а (6,95г, 22ммоль) у безводному ТГФ (50мл) при -78 С під аргоном. Як тільки об'єм реакційної суміші ставав більше приблизно у два рази, потік газу зупиняли. Літієвий дріт (0,62г, 88ммоль) повільно додавали, будучи впевненими, що температура не перевищує -60 С. Після перемішування протягом 30-60 хвилин додавали етанол (2,6мл) і через 30-60 хвилин хлорид амонію (6,2г). Суміші давали нагрітися до кімнатної температури і додавали воду (приблизно 100мл) і МТВЕ (приблизно 100мл). Шари розділяли, і водний шар двічі екстрагували приблизно 100мл МТВЕ. Об'єднані органічні шари промивали сольовим розчином і випарювали у вакуумі. Масло, що утворювалося у результаті, розчиняли у МТВЕ і додавали 10% НСl (2-3 еквів.). Двофазову суміш перемішували 30-90 хвилин і розбавляли водою. Шари розділяли, і органічний шар екстрагували водою. Об'єднані водні шари промивали дихлорметаном і потім нейтралізували водним КОН доти, доки рН не ставало >10. Неочищений діамін екстрагували дихлорметаном (3 рази). Об'єднані органічні екстракти сушили (Na2SO4) і випарювали до одержання масла або твердої речовини. Вихід рацемічного діаміну За як 19:1 суміші діастереомерів становив 4,96г, 94%. Додаткового очищення можна досягти при перекристалізації з етилацетату/гексану. b) Z=Метокси (CH3O): газоподібний аміак повільно конденсували у розчин спіроімідазолу 2b (6,96г, 20ммоль) у безводному ТГФ (40мл) при 78 С під аргоном. Як тільки об'єм реакційної суміші ставав більше приблизно у два рази, потік газу зупиняли. Літієвий дріт (0,56г, 80ммоль) повільно додавали, будучи впевненими, що температура не перевищує -60 С. Після перемішування протягом 30-60 хвилин додавали етанол (2,4мл) і через 3060 хвилин хлорид амонію (2,8г). Суміші давали нагрітися до кімнатної температури і додавали воду (приблизно 100мл) і МТВЕ (приблизно 100мл). Шари розділяли, і водний шар екстрагували двічі приблизно 100мл МТВЕ. Об'єднані органічні шари промивали сольовим розчином і випарювали у вакуумі. Масло, яке одержували у результаті, розчиняли у МТВЕ і додавали 10% НСl (2-3 еквів.). Двофазову суміш перемішували 30-90 хвилин і розбавляли водою. Шари розділяли, і органічний шар екстрагували водою. Об'єднані водні шари промивали дихлорметаном і потім нейтралізували водним КОН доти, доки рН не ставало >10. Неочищений діамін екстрагували дихлорметаном (3 рази). Об'єднані органічні екстракти сушили (Na2SO4) і випарювали до одержання масла або твердої речовини. Вихід рацемічного діаміну 3b як 19:1 суміші діастереомерів становив 4,69г, 86%. Додаткового очищення можна досягти при перекристалізації з етилацетату/гексану. 91527 12 (III) Хіральне розділення діамінів a) розділення діаміну 3а. Утворення солі з дитолуоїлвинною кислотою у метанолі і перекристалізація з метанолу спочатку давала (R,R) 4a з 94% ее. Він міг бути підвищений до >99% ее при ще одній додатковій перекристалізації. b) розділення діаміну 3Ь. Утворення солі з дитолуоїлвинною кислотою у метанолі і перекриста лізація з метанолу спочатку давала (S,S) 4b з 74% ее. Можливо збільшити ее при додатковій перекристалізації. Утворення солі з дибензоїлвинною кислотою у метанолі і перекристалізація з метанолу спочатку давала 4b з 98% ее. (IV) Синтез моносульфонілованих діамінів а) Тозил-5а (Z=CH3, B=4-CH3-C6H4). Триетиламін (210мкл, 1,5ммоль) додавали до розчину діаміну 4а (180мг, 0,75ммоль) у безводному дихлорметані (8мл), і розчин охолоджували до 0 С. Повільно додавали розчин тозил хлориду (птолуолсульфоніл хлориду, 148мг, 0,77ммоль) у безводному дихлорметані (4мл). Суміш перемішували при 0 С протягом 30-120 хвилин і давали нагрітися до кімнатної температури за 1-24 години. Додавали воду і розділяли шари. Водний шар двічі екстрагували дихлорметаном, і об'єднані органічні шари промивали сольовим розчином, сушили (Na2SO4) і випарювали. Неочищений моносульфонілований діамін може бути очищений колонковою хроматографією. Очищення колонковою хроматографією давало 270мг (91%) Ts-5a у вигляді білої твердої речовини. b) Тозил-5b (Z=OCH3, B=4-CH3-C6H4). Триетиламін (190мкл, 1,3ммоль) додавали до розчину діаміну 4b (175мг, 0,65ммоль) у безводному дихлорметані (8мл), і розчин охолоджували до 0 С. Повільно додавали розчин тозил хлориду (птолуолсульфоніл хлориду, 128мг, 0,67ммоль) у безводному дихлорметані (5мл). Суміш перемішували при 0 С протягом 30-120 хвилин і давали нагрітися до кімнатної температури за 1-24 години. Додавали воду і розділяли шари. Водний шар двічі екстрагували дихлорметаном, і об'єднані органічні шари промивали сольовим розчином, сушили (Na2SO4) і випарювали. Неочищений моносульфонілований діамін може бути очищений колонковою хроматографією. Очищення колонковою хроматографією давало 270мг (91%) Ts-5b у вигляді білої твердої речовини. Приклад 2: Одержання каталізатора гідрування з перенесенням водню Суміш [Ru(п-цимен)Сl2]2 (0,5 еквів.), триетиламіну (2 еквів.), моно-сульфонілованого діаміну (1 еквів.) 5b і безводного ізопропанолу нагрівали при 70-90 С Протягом 1-4 годин в інертній атмосфері. Після охолоджування до кімнатної температури розчин концентрували при зниженому тиску, і оранжеву тверду речовину відділяли фільтруванням. Тверду речовину промивали дегазованою водою і невеликою кількістю метанолу, потім додатково сушили при зниженому тиску. Подальше очищення може бути проведене при осадженні/перекристалізації з гарячого метанолу. Приклад 3: Застосування моносульфонілованих діамінів 5 для асиметричного гідрування з перенесенням водню Тестування каталізаторів гідрування з перенесенням водню на сумішах кетонів Каталізатори гідрування з перенесенням водню, що містять діаміни 5, були одержані на місці і протестовані на заздалегідь складеній суміші кетонів у ДМФ. [Ru(п-цимен)Сl2]2 (0,0025ммоль) або [RhСр*Сl2]2 (0,0025ммоль) і моносульфонілований діамін (0,0055ммоль) 5 у безводному ДМФ (2мл) нагрівали до 40 С протягом 10 хвилин в інертній атмосфері (аргон). Додавали розчин, що містить п'ять кетонів (0,5мл, 1ммоль загалом, по 0,2ммоль кожного) у ДМФ (S/C 40 відносно кожного субстрату), після чого йшло 0,6мл суміші мурашиної кислоти/триетиламіну у співвідношенні 1/1 і 1мл ДМФ. Реакційну суміш нагрівали протягом ночі (20 годин) при 60 С і аналізували методом газової хроматографії (ChiraDex CB колонка, 10 psi He, 100°С 12хв., потім до 180 С при 1,5 С/хв., потім до 200 С при 5 С/хв.). Для довідки: досліджуваними діамінами були наступні конв. - конверсія, ступінь перетворення ее - енантіомерний надлишок Результати показують, що особливо високі ступені перетворення і ее одержують для циклічного кетону, тобто там, де кетон є частиною кільцевої структури, такої як -тетралон. Приклад 4: Активність Ts-DAEN відносно TsDPEN Активність (S,S)-TsDAEN відносно звичайного (S,S)-TsDPEN в асиметричному гідруванні з перенесенням водню перевіряли, використовуючи Діаміновий ліганд Приклад 4 (S,S)-TsDAEN Порівняльний приклад (S,S)-TsDPEN тетралон як субстрат. Реакцію проводили у масштабі 15ммоль, при S/C 500/1, використовуючи [RuСl2(п-цимен)]2 як попередник металу і ДМФ як розчинник при 60 С. Один еквівалент три метиламоній формату додавали на початку реакції і додаткову кількість НСООН додавали під час реакції для підтримки рН при 8,2. Результати, наведені нижче, показують, що (S,S)-TsDAEN є більш активним, ніж (S,S)-TsDPEN. Час (год.) 1,5 5 22 1 2 3 4 6 22 Ступінь перетворення (%) 36 71 90 11 25 31 36 45 70 Ее (%) 98 98 17 Комп’ютерна верстка А. Крижанівський 91527 Підписне 18 Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюSulphonylated diphenylethylenediamines, method for their preparation and use in transfer hydrogenation catalysis
Автори англійськоюDominguez Beatriz, Zanotti-Gerosa Antonio, Grasa Gabriela Alexandra, Medlock Jonathan Alan
Назва патенту російськоюСульфонилированный диамин, способ его получения и применение в катализе гидрирования с перенесением водорода
Автори російськоюДомингес Беатрис, Цанотти-Джероза Антонио, Граса Габриэла Александра, Медлок Джонатан Алан
МПК / Мітки
МПК: B01J 31/16, C07C 311/16, C07B 41/00
Мітки: водню, спосіб, каталізі, застосування, одержання, перенесенням, діамін, гідрування, сульфонілований
Код посилання
<a href="https://ua.patents.su/9-91527-sulfonilovanijj-diamin-sposib-jjogo-oderzhannya-i-zastosuvannya-u-katalizi-gidruvannya-z-perenesennyam-vodnyu.html" target="_blank" rel="follow" title="База патентів України">Сульфонілований діамін, спосіб його одержання і застосування у каталізі гідрування з перенесенням водню</a>
Попередній патент: Застосування композиції для полегшення пологів у людей
Наступний патент: Удосконалення схеми високошвидкісного пакетного доступу по висхідному каналу
Випадковий патент: Спосіб виробництва концентрату сироватки












