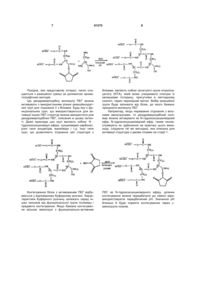
Дендример-пег з чотирма гілками для кон’югування з білками і пептидами
Номер патенту: 91575
Опубліковано: 10.08.2010
Автори: Рамон Ернандес Хосе Анхел, Фернандес Санчес Едуардо, Кастро Одіо Фідель Рауль, Саєс Мартінес Вівіан Марія, Паєс Мейрелес Роландо
Формула / Реферат
1. Полімерна дендримероподібна структура, що включає чотири гілки монометоксиполіетиленгліколю, яка може бути представлена як:
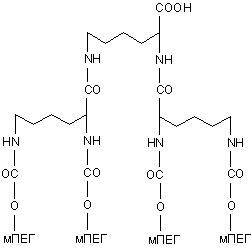 ,
,
для одержання кон'югатів, які мають фармацевтичний інтерес.
2. Полімерна структура за п. 1, де молекулярна маса кожного ПЕГ-ланцюга знаходиться між 5000 і 30000 Д, а загальна молекулярна маса знаходиться між 20000 і 120000 Д.
3. Дендримероподібна структура, що включає чотири гілки монометоксиполіетиленгліколю, яка може бути представлена як:
 ,
,
активована для кон'югування з нуклеофільними групами, отримана функціональною активацією карбоксильної групи шляхом використання реагенту, вибраного з групи, яка складається з сукцинімідилсукцинату, сукцинімідилкарбонату, п-нітрофенілкарбонату, сукцинімідилпропіонату і сукцинімідилбутаноату.
4. Кон'югат, що включає полімерну структуру за п. 1 або п. 3 і нуклеофільну групу.
5. Кон'югат за п. 4, де нуклеофільна група міститься в біомолекулі, вибраній з групи, яка складається з білків, пептидів і поліпептидів.
6. Кон'югат за п. 5, де білок вибраний з групи, яка складається з інтерферону альфа 2-b, стрептокінази, гранулоцитарного колонієстимулюючого фактора, еритропоетину і епідермального фактора росту.
Текст
1. Полімерна дендримероподібна структура, що включає чотири гілки монометоксиполіетиленгліколю, яка може бути представлена як: 3 Даний винахід належить до дендримерподібної полімерної структури з чотирма гілками з поліетиленгліколю (ПЕГ) для отримання кон'югатів, що представляють фармацевтичний інтерес. Добре відомі сприятливі ефекти кон'югування терапевтичних білків з поліетиленгліколем відносно деяких фармакологічних властивостей. Наприклад, збільшується час напівжиття в крові, завдяки різним причинам, серед яких: полімерний залишок може запобігати атакам протеаз і розпізнаванню ліків імунною системою, а істотно більший гідродинамічний об'єм кон'югата по відношенню до вихідного білка значно знижує фільтрацію через нирки. Хоч в багатьох випадках модифікація молекулами ПЕГ (ПЕГилювання) впливає на біологічну активність білка in vitro, істотне збільшення часу життя в крові робить більш ефективним його терапевтичну дію [Harris J. М. у Chess R. В. (2003) Effect of pegylation on pharmaceuticals. Nat. Rev. DrugDiscov. 2:214-21]. ПЕГилювання також стерично блокує шляхи деградації, що викликаються гідрофобними взаємодіями і утворює стеричні неспецифічні перешкоди, які зменшують внутрішньомолекулярні взаємодії, залучені до термічної нестабільності біліків. В результаті всього цього модифіковані ПЕГ білки мають більш високу фізичну стабільність, ніж немодифіковані молекули, - дуже корисна властивість для розробки кінцевого фармацевтичного препарату [Harris J. M. у Chess R. В. (2003) Effect of pegylation on pharmaceuticals. Nat. Rev. Drug Discov. 2:214-21]. Реагент, який звичайно використовується для кон'югування білків являє собою поліетиленгліколь, метильований по одному з своїх кінців, відомий як монометоксиполіетиленгліколь (мПЕГ). Те, що метильна група захищає один з кінців ПЕГланцюга, дозволяє її активацію тільки по одному іншому кінцю, даючи монофункціональний реагент. Це є дуже важливим для кон'югування терапевтичних білків, оскільки їх кон'югування з біфункціональними реагентам звичайно приводить до перехресного зшивання, яке впливає на біологічну активність білка. Молекули мПЕГ завжди мають невелику фракцію неметильованого полімеру, діольну фракцію. Діольна фракція присутня в більшій мірі в мПЕГ з високою молекулярною вагою через те, що більш важко контролювати процес полімеризації для дуже довгих ланцюгів [Roberts M. J., Bentley M. D., Harris J. M. (2002) Chemistry for peptide and protein PEGylation. Adv. DrugDeliv. Reviews 54:459-76]. Однією з перших молекул-похідних ПЕГ була синтезована в реакції з ціаноген хлоридом. Але експерименти по кон'югуванню з цим реагентом викликали зайве ПЕГилювання. Це небажано для терапевтичних білків, оскільки високий ступінь ПЕГилювання викликає раптове падіння біологічної активності через пряме блокування активних ділянок або топологічних змін, які приховують ці ділянки від відкритої поверхні білка. Звичайно бажаний кон'югат являє собою той, де присутня тіль 91575 4 ки одна молекула ПЕГ на кожну молекулу білка; таку молекулу називають моно-ПЕГильованою. На початку 1980 pp. почали використовувати «більш м'які» активні групи. У основному це Nгідроксисукцинімідні ефіри, хоч також використовували і інші групи. Трьома найбільш популярними групами є: сукцинімідил-сукцинат, трезилат і сукцинімідил-карбонат. Це покоління активованих ПЕГ відоме як перше покоління [Roberts M. J., Bentley M. D., Harris J. M. (2002) Chemistry for peptide and protein PEGylation. Adv. DrugDeliv. Reviews 54:459-76]. У другій половині 1990 pp. з'явилося друге покоління активованих ПЕГ. У них було дві важливих переваги: групи, які дозволяли більш вибіркове ПЕГилювання (наприклад: альдегідні групи, які утворюють кон'югати переважно з N-кінцем білків) і розгалужені структури [Roberts M. J., Bentley M. D., Harris J. M. (2002) Chemistry for peptide and protein PEGylation. Adv. DrugDeliv. Reviews 54:459-76]. Прикладами розгалужених ПЕГ є монофункціональні з двома гілками (US 5932462), тетрафункціональні з чотирма гілками і октафункціональні з вісьмома гілками. Більш використовувані активовані ПЕГ для кон'югування з терапевтичними білками являють собою монофункціональні, оскільки вони дозволяють уникнути перехресного зшивання між білком і полімером. Розгалужені ПЕГ також мають зонтичні структури, які дозволяють кращий захист поверхні білка. Монофункціональні ПЕГ з двох гілок дозволили отримати кон'югат з інтерфероном альфа 2а, який, як було показано, мав кращі результати в клінічному застосуванні, ніж природний білок [Rajender Reddy K., Modi M.W., Pedder S. (2002) Use of peginterferon alfa-2a (40 KD) (Pegasys) for the treatment of hepatitis C. Adv. DrugDeliv. Reviews 54:571-86]. За допомогою існуючої на сьогоднішній день методики синтезу мПЕГ можна отримати ланцюги розміром тільки 30кД, що є причиною, по якій реагенти з двома гілками дозволяють отримати молекулярну масу максимум 60кД. Бажано мати структури з монофункціональним ПЕГ з більш високою молекулярною масою, що дозволить дослідити більш широкий діапазон кон'югатів, щоб отримати оптимальну величину у деяких білків. Однак ні в одній з раніше описаних статей не і застосовувався, не був охарактеризований або згаданий реагент для ПЕГилювання, який би був монофункціональним і з більш ніж двома ПЕГ-ланцюгами. У випадку, якщо отриманий реагент з більш ніж двома ПЕГ-ланцюгами, можна отримати кон'югати з більш високою молекулярною масою, і в доповнення до раніше згаданої переваги це може дозволити використовувати більш короткі лінійні ланцюги мПЕГ для створення реагентів для ПЕГилювання з молекулярною масою, схожою на структури з двома ланцюгами. Ці гілки меншого розміру будуть мати меншу діольну фракцію, роблячи процес синтезу легшим. Даний винахід вирішує згадану вище проблему, надаючи монофункціональну дендримерподіб 5 91575 6 ну структуру, яка має 4 гілки мПЕГ. Ця структура дозволяє отримувати кон'югати з полімерними залишками до 120кД. Цей факт дозволяє дослідити кон'югати з великими варіаціями молекулярної маси, включаючи високомолекулярні. Більш того з використанням цього підходу можуть бути отримані молекули ПЕГ з молекулярною масою, схожою на молекулярну масу інших розгалужених монофункціональних реагентів, але з більш низькомолекулярними лінійними ланцюгами. У переважному варіанті даного винаходу отримана полімерна структура, де молекулярна маса ПЕГ-ланцюга знаходиться між 5000 і 30000Д, і загальна молекулярна маса знаходиться між 20000 і 120000Д. Використання низькомолекулярний лінійних ланцюгів дозволило практично повністю усунути діольное забруднення, типове для більш великих лінійних молекул ПЕГ. Несподівано, але кон'югати зі структурою, запропонованою авторами, мали набагато більш високу фізико-хімічну стабільність (стійкість до високих температур і деградації протеазами), ніж кон'югати зі схожою молекулярною масою, але отриманими зі структурами з тільки двох ланцюгів. Також несподівано вони мали більш високий час життя в крові. Іншим несподіваним результатом був той, що кон'югати із запропонованою авторами дендримерподібною структурою були більш гомогенними з меншою кількістю позиційних ізомерів, ніж ті, що були отримані з кон'югатами зі схожою молекулярною масою, але тільки з двома ланцюгами. Дендримерподібний з чотирма гілками монофункціональний ПЕГ отримують в двох основних стадіях. Перша стадія являє собою синтез похідних з двома гілками шляхом з'єднання двох молекул ПЕГ з ядром, яким може бути, наприклад, лізин. Схожий процес використовувався іншими авторами з хорошими результатами (US 5932462). Друга стадія являє собою об'єднання двох молекул повідних з двома гілками з ядром, аналогічним попередньому, щоб отримати похідні з чотирма гілками. Для того, щоб об'єднати дві лінійні ПЕГгілки з ядром в першій стадії, вони повинні мати активну групу. Цю групу можна вибрати з ряду відомих в даній галузі. Наприклад, сукцинімідилсукцинат, сукцинімідилкарбонат, nнітрофенілкарбонат, сукцинімідилпропіонат, сукцинімідилбутаноат серед інших. Переважний лінійний активований ПЕГ в даному винаході являє собою сукцинімідилкарбонат. Це так через головні різні причини: хороший вихід реакції між цим реагентом і ядрами з вільними аміногрупами і легкість способу отримання цього реакційноздатного ПЕГ. Спосіб цього синтезу [Miron T., Wilchek M. (1993) А Simplified Method for the Preparation of Succinimidyl Carbonate Polyethylene Glycol for Coupling to Proteins. Bioconjugate Chem. 4:568-69] відомий фахівцям в даній галузі: Як тільки отриманий лінійний активований ПЕГ, перша стадія легко виконується шляхом введення його в реакцію з молекулою, вибраною як ядро. У переважному варіанті здійснення цього винаходу ядро являє собою L-лізин через його біологічно сумісну природу, з двома вільними аміногрупами і карбоксильною групою, яку можна використати пізніше для активації. Похідні з двома гілками легко очистити з реакційної суміші хроматографічними методами. Це похідне з двома гілками активують для подальшої реакції з молекулою ядра і синтезу похідного з чотирма гілками. Цей продукт може бути активований різними шляхами, але переважним завдяки його ефективності і легкості є утворення Nгідроксисукцинімідного ефіру. Цю методику успішно застосовували для активації карбоксильних груп зі структурами, що містять ПЕГ-ланцюги, як N -гідроксисукцинімідний ефір (US 4732863 і US 5932462). Друга стадія отримання похідного з чотирма гілкамискладається з реакції похідного з двома гілками з ядерною молекулою, де також як і в першій стадії цього винаходу, переважний варіант здійснення цього винаходу являє собою L-лізин як ядро. 7 91575 8 Похідне, яке представляє інтерес, легко очищається з реакційної суміші за допомогою хроматографічних методів. Цю дендримерподібну молекулу ПЕГ можна активувати з використанням різних реакційноздатних груп для з'єднання її з білками. Будь-яку з функціональних груп, що використовуються для активації інших ПЕГ-структур можна використати для дендримерподібних ПЕГ, описаних в цьому патенті. Деякі приклади цих груп являють собою: N гідроксисукцинімідні ефіри, сукцинімідил-карбонат, різні типи альдегідів, малеїміди і т.д. Інші типи груп, що дозволяють з'єднання цієї структури з білками, являють собою хелатуючі групи нітрилоацетату (NTA), який може утворювати сполуки із залишками гістидину, присутніми в пептидному скелеті, через перехідний метал. Вибір реакційної групи буде залежати від білка, до якого бажано приєднати молекулу ПЕГ. Наприклад, якщо переважне з'єднання з вільними аміногрупами, то дендримерподібний полімер можна активувати як N-гідроксисукцинімідний ефір. N-гідроксисукцинімідний ефір, таким чином, отримують як здійснення на практиці цього винаходу, слідуючи тій же методиці, яка описана для активації структури з двома гілками на стадії 1. Кон'югування білка з активованим ПЕГ відбувається у відповідному буферному розчині. Характеристики буферного розчину залежать серед інших чинників від функціональної групи полімеру і предмета кон'югування. Якщо бажане кон'югування вільних аміногруп з функціонально-активним ПЕГ як N-гідроксисукцинімідного ефіру, ділянки кон'югування можна передбачити до певної міри, використовуючи передбачений рН. Значення рН близько 9 буде сприяти кон'югуванню через аміногрупи лізинів. 9 Іншим прикладом є те, що в кон'югуванні з альдегідами, сильно кислотний і рН дозволяє, щоб ПЕГилювання відбувалося переважно на N-кінці білка. Подальше очищення кон'югата, що представляє інтерес, можна провести за допомогою різних хроматографічних методик. У практичному здійсненні винаходу описані кон'югати, де нуклеофільна група міститься в біомолекулі, вибраній з групи, яка складається з білків, пептидів і поліпептидів. Деякі хімічні, фізичні і біологічні властивості кон'югатів повинні бути проаналізовані для досягнення найбільш повної характеристики очищеного кон'югата. Наприклад, концентрація кон'югата може бути звичайно визначена за допомогою УФспектроскопії (поглинання при 280нм), оскільки ПЕГ-залишок практично не впливає на коефіцієнт поглинання білка. Чистота очищеного продукту повинна бути визначена, переважно, за допомогою електрофорезу в додецилсульфат натрієвому поліакриламідному гелі (ДСН-ПААГ), оскільки методи хроматографії можуть погано розділяти сигнали, які відповідають кон'югату, що представляє інтерес, і домішкам. Інші фізико-хімічні властивості можна вивчити за допомогою звичайних методів. Як результат даної роботи, переважне виконання на практиці цього винаходу описує отримання кон'югатів, де білок вибраний з групи, яка складається з інтерферон альфа 2b, стрептокінази, гранулоцитарного колонієстимулюючого фактора, еритропоетину і епідермального фактора росту. Фіг.1. Захист проти деградації протеазами. На осі X представлений час в годинах, а на осі Y кількість недеградованого білка, представленого в процентах від кількості в нульовій часовій точці. Фіг.2. Температурна стійкість. На осі X представлений час в днях, а на осі Y - кількість недеградованого білка, представленого в процентах від кількості в нульовій часовій точці. Приклад 1 Синтез ПЕГ, активованого як N гідроксисукцинімідний ефір Отримання структури і активація Отримання сукцинімідилкарбонату монометоксиполіетиленгліколю (СК-ПЕГ). П'ятнадцять грам монометоксиполіетиленгліколю з молекулярною масою 12000Д (мПЕГ12К) розчинили в 500мл толуолу і азеотропно висушили протягом 3 годин. Після цього часу об'єм поменшав до 250мл, і суміш вихолодили до кімнатної 91575 10 температури. До розчину додали наступні реагенти: 60мл сухого дихлорметану, 2г дисукцинімідилкарбонату (DSC), розчиненого в 15мл сухого ацетону, і 1г диметиламінопіридину, розчиненого в 10мл 3:1 суміші толуол:DCM. Реакцію проводили протягом ночі (16 год) при перемішуванні. Реакційну суміш осаджували 1л холодного діетилового ефіру, і осад збирали фільтруванням. Цей продукт перекристалізовували три рази, розчиняючи в ацетоні і осаджуючи діетиловим ефіром. Кінцевий продукт висушували під високим вакуумом і зберігали під азотом при -20 С. Кінцевий вихід реакції був вищим 90%. Фракцію активованого ПЕГ визначали за допомогою реакції з гліцил-гліцином і кількісним визначенням вільних аміногруп за допомогою реакції з TNBS. Отримання біПЕГильованого лізину (Lys2ПЕГ) Дванадцять грам СК-ПЕГ12К вводили в реакцію з 46мг L-(+)-лізину, розчиненого при концентрації 0,2мг/мл в 100мМ боратному буфері, рН 8,5. Реакція відбувалася при кімнатній температурі, при перемішуванні протягом 16 годин. Після цього часу реакційну суміш розводили 5 разів в бідистильованій воді, і доводили рН соляною кислотою. Екстрагували ПЕГ три рази одним об'ємом DCM. Об'єднані три екстракційні фракції висушували над безводним сульфатом натрію і фільтрували. Розчин ПЕГ в DCM концентрували до 20мл на роторному випарнику. Концентрат осаджували 120мл холодного діетилового ефіру, збирали фільтруванням і висушували під високим вакуумом. Lys2ПЕГ відділяли від компонентів реакційної суміші, які залишилися, за допомогою іон-обмінної хроматографії на DEAE-сефарозі. Колонку, що містить 1 літр хроматографічного носія, врівноважували 3 обємами 100мМ розчину боратного буфера при рН 7,5 і потім промивали 5 об'ємами бідистильованої води. Наносили десять грамів реакційної суміші, розчиненої в бідистильованій воді при концентрації 5мг/мл. ПЕГ, який не прореагував, видаляли, промиваючи колонку двома об'ємами бідистильованої води, і елюювали Lys-2ПЕГ 1мМ розчином хлориду натрію. рН цієї фракції доводили до 3 соляною кислотою і екстрагували три рази одним об'ємом DCM. Об’єднані три екстракційні фракції висушували над безводним сульфатом натрію і потім фільтрували. Розчин ПЕГ в DCM концентрували до 10мл в роторному випарнику. Концентрат осаджували 60мл холодного діетилового ефіру, відділяли фільтруванням і 11 висушували під високим вакуумом. Ступінь чистоти визначали за допомогою ДСН-ПААГ, фарбування гелю 5% розчином хлориду барію і 100мМ йодом. Молекулярна маса, визначена за допомогою MALDI-TOF, була 23,0-24,5кД. Загальний вихід методу був вищим ніж 40%. Активація біПЕГильованого лізину як Nгідроксисукцинімідного ефіру (ПЕГ2,12K-NHS) Шість грамів Lys-2ПЕГ розчинили в 20мл сухого DCM і додали 60мг N-гідроксисукциніміду і 250мг N, N -дициклогексилкарбодііміду (DCC). Реакцію перемішували протягом 24 годин при кімнатній температурі. Суміш фільтрували і концентрували на роторному випарнику до 5мл. Продукт осаджували 20мл холодного діетилового ефіру і кристалізували три рази, розчиняючи в ацетоні і осаджуючи діетиловим ефіром. Кінцевий продукт висушували під високим вакуумом і зберігали під азотом при -20 С. Загальний вихід методу був вищим ніж 95%. Фракцію активованого ПЕГ визначали за допомогою реакції з гліцил-гліцином, а число аміногруп кількісно визначали за допомогою реакції з TNBS. Отримання дендргтерподібного ПЕГ з чотирма гілками П'ять грамів ПЕГ2,12K-NHS вводили в реакцію з 7мг L-(+)-лізину, розчиненого в концентрації 0,1мг/мл в 100мМ розчині боратного буфера, рН 8,5. Реакція проходила при кімнатній температурі з перемішуванням протягом 16 годин. Після цього часу реакційну суміш розводили 5 разів бідистильованою водою і доводили рН до 3 соляною кислотою. ПЕГ екстрагували три рази одним об'ємом DCM. Об'єднані три екстракційні фракції висушували над безводним сульфатом натрію і фільтрували. Розчин ПЕГ в DCM концентрували до 5мл в роторному випарнику. Концентрат осаджували 30мл холодного діетилового ефіру, відділяли фільтруванням і висушували під високим вакуумом. Дендримерподібний ПЕГ з чотирма гілками очищали за допомогою гель-фільтрації в колонці G3000PW. рН фракції, що містить бажану структуру доводили до З соляною кислотою і екстрагували три рази одним об'ємом DCM. Об'єднані три екстракційні фракції висушували над безводним сульфатом натрію і потім фільтрували. Розчин ПЕГ в DCM концентрували до 5мл в роторному випарнику. Концентрат осаджували 30мл холодного діетилового ефіру, відділяли фільтруванням і висушували під високим вакуумом. Ступінь чистоти визначали за допомогою ДСН-ПААГ, забарвлюючи гель 5% розчином хлориду барію і 100мМ йодом, і вона була вищою ніж 98%. Молекулярна маса, визначена за допомогою MALDI-TOF, була 45,5-50кД. Загальний вихід методу був вищим ніж 30%. Функціональна активація дендримерподібного ПЕГ з чотирма гілками як N-гідроксисукцинімідного ефіру (ПЕГ4,12K-NHS) Один з половиною грамів дендримерподібного ПЕГ з чотирма гілками розчинили в 5мл сухого DCM і додали 9мг N-гідроксисукциніміду і 37мг N, N -дипиклогексилкарбодііміду. Реакцію перемішували протягом 24 годин при кімнатній 91575 12 температурі. Продукт відфільтровувати і осаджували 20мл холодного діетилового ефіру. Осад перекристалізовували три рази, розчиняючи в ацетоні і осаджуючи діетиловим ефіром. Кінцевий продукт висушували під високим вакуумом і зберігали під азотом при -20 С. Загальний вихід методу був вищим ніж 95%. Фракцію активованого ПЕГ визначали за допомогою реакції з гліцил-гліцином, а число аміногруп визначали за допомогою реакції з TNBS. Приклад 2 Отримання IFN- 2b, кон'югованого з ПЕГ4,12KNHS Реакція кон 'югування Чотири грами дендримерподібного ПЕГ з чотирма гілками, активованих як Nгідроксисукцинімідний ефір (ПЕГ4,12K-NHS), додали до розчину, що містить 1 грам IFN- 2b в концентрації 6мг/мл в 120мМ розчині боратного буфера, рН 8,5. Реакцію проводили 1 годину при 4 С при м'якому перемішуванні і потім зупиняли, розводячи в 50 раз 10мМ буферним розчином ацетату натрію, рН 4. Вихід реакції визначали за допомогою денситометричного аналізу фарбування ДСНПААГ за допомогою барвника Coomassie Brilliant Blue R-250. Фракція моноПЕГильованого IFN- 2b з дендримерподібним ПЕР з чотирма гілками була вищою 40%. Очищення моноПЕГильованого IFN- 2b з дендримерподібним ПЕГ з чотирма гілками Колонку ХК 50/60 (від компанії Pharmacia), яка містить 500мл Fractogel EMD 650 (М) СОО-, врівноважували 3 об'ємами 10мМ ацетатного буферного розчину, рН 4, при швидкості потоку 40мл/хв. Розчин, що містить реакційну суміш, наносили на колонку при тій же швидкості. ПЕГ, який не прореагував, і кон'югати з більш ніж одним залишком ПЕГ видаляли протягом 2-го динного промивання 40мМ ацетатним буферним розчином, рН 4, з 25мМ хлориду натрію. МоноПЕГильований кон'югат елюювали 50мМ буферним розчином ацетату натрію, рН 4, з 150мМ хлоридом натрію. Чистота була вищою 96%, і основні забруднення являли собою немодифікований інтерферон і біПЕГильований кон'югат. Фракцію, що представляє інтерес, концентрували до 200мл і наносили на колонку ХК 50/60 (від компанії Pharmacia), що містить 1л Sephadex G-25, урівноважену 50мМ фосфатним буферним розчином, рН 7, з 100мМ хлоридом натрію. МоноПЕГильований інтерферон з дендримерподібним ПЕГ з чотирма гілками відфільтровувати через целюлозоацетатну мембрану з розміром пор 0,2мкм і зберігали при 4 С. Приклад 3 Фізико-хімічна характеристика ПЕГ4,12K-IFN- 2b Визначення концентрації кон'югата Концентрацію кон'югата, як функцію білкового залишку, визначали УФ-поглинанням при 280нм. Вважали, що одна одиниця поглинання дорівнює концентрації 1мг/мл. Визначення молекулярної маси кон'югата Молекулярну масу кон'югата визначали за допомогою MALDI-TOF. Середня молекулярна маса, очікувана для дендримерподібного ПЕГ з чотирма гілками, становила 48000Д, а для IFN- 2b 13 91575 19200Д, таким чином, теоретична маса кон'югата була 67200Д. Обчислена маса для ПЕГ4,12K-IFN2b була 64000-70000Д. Приклад 4 Біологічна характеристика кон'югата ПЕГ4-12KIFN- 2b Імунологічний ідентифікація кон'югата в твердофазному імуноферментному аналізі (ELISAmun) Приклади кон'югата в різних концентраціях, а також негативний контроль, наносили на мікротитрувальний планшет для ELISA, покритий моноклональними антитілами проти IFN- 2b. Потім, додавали інше моноклональне антитіло, яке розпізнає інший епітоп з IFN- 2b, кон'юговане з пероксидазою хріну. Вважали, що зразки розпізнаються імунологічно, коли поглинання в ямках із зразками кон'югатів було вищим, ніж середнє поглинання в ямках з негативними зразками плюс трикратне стандартне відхилення цих значень. Антитіла розпізнавали зразки у всіх випадках. 14 Противірусна активність in vitro Противірусну активність in vitro визначали за допомогою інгібування цитопатичного ефекту, що проводиться менговірусом на клітини Нер-2 (АТСС № CCL23). Серійне розведення (1:2) кон'югата в мінімальному необхідному середовищі з 2% фетальною бичачою сироваткою і 40мкг/мл гентаміцину змішували з моношарами клітин в 96-ямкових мікротитрувальних планшетах. Плаіншети інкубували при 37 С протягом 24 годин при 3% атмосфері діоксиду вуглецю і відносній вологості 95%. Додавали вірус (107 TCID), і планшети інкубували до очевидного цитопатичного ефекту (90% лізису клітин). Рівень руйнування клітин вимірювали фарбуванням клітин кристалічним фіолетовим. Активність кожного зразка виражали в міжнародних одиницях (МО), що оцінюють IFN- 2b по міжнародному стандарту 69/19 від Всесвітньої Організації Охорони здоров'я, а отримані результати представлені в таблиці 1. Таблиця 1 Противірусна активність in vitro вихідного IFN- 2b та кон'югованого з дендримерподібним ПЕГ з чотирма гілками Зразок Вихідний інтерферон Інтерферон, модифікований ПЕГ з чотирма гілками цендримерподібним Антипроліферативна активність in vitro Антипроліферативну активність in vitro вимірювали за допомогою здатності кон'югованого IFN2b інгібувати ріст клітин Дауді (лімфоми Беркіта). Результати показали, що активність in vitro ПЕГ4,12К-IFN- 2b дорівнювала до 5% від активності немодифікованого IFN- 2b. Приклад 5 Фізико-хімічна стабільність ПЕГ4,12К-IFN- 2b Стійкість до деградації протеазами Сорок мікролітрів 4% розчину бікарбонату натрію, рН 8, який містить 400мкг/мл нативного IFN2b, кон'югованого з ПЕГ з двома або чотирма гілками зі схожими молекулярними масами, змішували з 10мкл з 160мкг/мл розчину трипсину. Зразок інкубували при 37 С певний час. Реакцію зупиняли 10мкл трифтороцтової кислоти. Залишкову кількість білка (кон'югованого або ні) оцінювали по зникненню смужки на ДСН-ПААГ, забарвленому Coomassie Brilliant Blue. Результати (Фіг.1) показують, що захист, який приносить структура ПЕГ з чотирма ланцюгами (▲), від деградації кон'югата IFN- 2b є чудовим по відношенню до того, що дає структура з двома гілками зі схожою молекулярною масою (●). Термічна стабільність Для того, щоб визначити стабільність кон'югата IFN- 2b з дендримерподібними ПЕГ з чотирма гілками, зразки нативного і кон'югованого білка інкубували при 60 С в фосфатно-сольовому буферному розчині. Зразок IFN- 2b, кон'югований з Препарат 1 2 3 Противірусна активність (МО/мг) 2,0 108 1,1 107 0,9 107 1,2 107 ПЕГ с двома гілками, використовували як контроль. Зразки діставали через визначений час, і оцінювали залишкову кількість білка (кон'югованого або ні) по зникненню смужки на ДСН-ПААГ, забарвленому Coomassie Brilliant Blue. Результати (Фіг.2) показують, що термічна стабільність кон'югата зі структурою з чотирма гілками (▲) є вищою, ніж стабільність кон'югата в двох інших випадках нативний IFN ( ), IFN, кон'югований зі структурою з двома гілками (●)]. Приклад 6 Фармакокінетика ПЕГ4,12К-IFN- 2b Порівняльне фармакокінетичне дослідження між немодифікованим інтгрфероном і білком, кон'югованим з дендримерподібним ПЕГ з чотирма гілками, проводили на новозеландських кроликах з середньою вагою 2кг. Як контроль використовували зразок IFN- 2b, кон'югований з ПЕГ з двома гілками. Біологічно активні молекули вводили за допомогою підшкірної ін'єкції в кількості 150мкг на кг ваги. Відбирали зразки крови в інтервалі 144 години в визначених часових точках. Зразки центрифугували, і сироватку відділяли і зберігали при -20 С до проведення аналізу. Концентрацію IFN- 2b, кон'югованого або ні, визнавали за допомогою твердофазного імуноферментного аналізу (ELISA-тип) з моноклональними антитілами, специфічними до цього цитокіну. Інтерпретація результатів була основана на класичній компартментальній моделі. Результати представлені в таблиці 2. 15 91575 16 Таблиця 2 Порівняння фармакокінетики вихідного IFN- 2b і кон'югованого з ПЕГ з двома гілками і з ПЕГ4,12К-IFN- 2b Параметр АUC, мкг.ч/мл t1/2, год MRT, год Вихідний IFN- 2b 339,12 2,38 4,33 Приклад 7 Кон'югування інших терапевтичних білків з дендримерподібним ПЕГ з чотирма гілками Кон'югували інші терапевтичні білки, такі як рекомбінантна стрептокіназа (r-SK), еритропоетин (ЕРО), гранулоцитарний колонієстимулюючий фактор (G-CSF) і епідермальний фактор росту (EGF), з дендримерподібним ПЕГ з чотирма гілками. Оцінювали ефект кон'югування на швидкість деградації протеазами. Кон'югування дендримерподібного ПЕГ з чотирма гілками, активованого як Nгідроксисукцинімідний ефір 100 міліграмів дендримерподібного ПЕГ з чотирма гілками, активованого як Nгідроксисукцинімідний ефір (ПЕГ4,12К-NHS), додали до розчину, що містить 25мг терапевтичного білка в концентрації 6мг/мл в 120мМ розчині боратного буфера, рН 8,5. Реакцію проводили 1 годину при 4 С при м'якому перемішуванні. Реакцію зупиняли 50-кратним розведенням в 10мМ буферному розчині ацетату натрію, рН 4. Вихід реакції визначали денситометричним аналізом ДСН-ПААГ зразків, забарвленого за допомогою барвника Coomassie Brilliant Blue R-250. Фракція моноПЕГильованого білка з дендримерподібним ПЕГ з чотирма гілками була вищою 30% у всіх випадках. Кон'югування дендримерподібного ПЕГ, активованого як альдегід 100 міліграмів дендримерподібного ПЕГ з чотирма гілками, активованого як альдегід (ПЕГ4,12КАLD), додали до розчину, що містить 15мг терапе IFN-ПЕГ с двома гілками 74907,38 50,48 90,68 ПЕГ4,12К-IFN- 2b 88952,15 63,58 105,23 втичного білка в концентрації 4мг/мл в 100мМ розчині ацетатного буфера, рН 5, з 20мМ ціаноборгідриду натрію. Реакція тривала 24 години при 4 С з м'яким | перемішуванням, і її зупиняли 20-кратним розведенням 1мМ НСl. Вихід реакції визначали за допомогою денситометричного аналізу ДСН-ПААГ зразків, забарвлених Coomassie Brilliant Blue R250. Фракція моноПЕГильованого білка з дендримерподібним ПЕГ з чотирма гілками була вищою 30% у всіх випадках. Ефект кон'югування дендримерподібного ПЕГ з чотирма гілками на деградацію білків протеазами Сорок мікролітрів 4% розчину бікарбонату, рН 8, що містить 400мкг/мл нативного білка або кон'югованого з ПЕГ з чотирма гілками змішували з 10мкл розчину трипсину з концентрацією 160мкг/мл. Зразок інкубували при 37 С протягом 4 годин з м'яким перемішуванням. Після цього часу реакцію зупиняли 10мкл трихлороцтової кислоти. Отриману в результаті кількість білка (кон'югованого або ні) оцінювали по зникненню смуги на ДСН-ПААГ, забарвленому Coomassie Brilliant Blue R-250. Результати (таблиця 3) вказують на те, що кон'югація з дендримерподібним ПЕГ з чотирма гілками захищає кон’юговані білки від деградації трипсином. У всіх випадках більш ніж 35% білка не розщеплювалося після 4 часів реакції з трипсином, незалежно від застосованого хімічного способу кон'югування. Однак ніяких слідів нативних білків не було виявлено після цього часу. Таблиця 3 Фракція (%) нерозщепленого білка по відношенню до кількості білка перед реакцією Білок r-SK ЕРО G-CSF EGF Нативний 0% 0% 0% 0% Кон'югований з ПЕГ4,12КNHS 38,2 1,5% 39,8 2,3% 45,6 3,4% 35,1 4,4% Кон'югований з ПЕГ4,12КALD 41,5 0,9% 37,5 1,7% 42,1 2,9% 37,6 4,8% 17 Комп’ютерна верстка А. Крижанівський 91575 Підписне 18 Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюFour branched dendrimer-peg for conjugation to proteins and peptides
Автори англійськоюRamon Hernandez Jose Angel, Castro Odio Fidel Raul, Saez Martinez Vivian Maria, Paez Meireles Rolando, Fernandez Sanchez Eduardo
Назва патенту російськоюДендример-пег с четырьмя ветвями для коньюгирования с белками и пептидами
Автори російськоюРамон Эрнандес Хосе Анхел, Кастро Одио Фидель Рауль, Саес Мартинес Вивиан Мария, Паес Мейрелес Роландо, Фернандес Санчес Эдуардо
МПК / Мітки
МПК: A61K 47/48
Мітки: пептидами, чотирма, гілками, білками, дендример-пег, кон'югування
Код посилання
<a href="https://ua.patents.su/9-91575-dendrimer-peg-z-chotirma-gilkami-dlya-konyuguvannya-z-bilkami-i-peptidami.html" target="_blank" rel="follow" title="База патентів України">Дендример-пег з чотирма гілками для кон’югування з білками і пептидами</a>
Попередній патент: Герметично запечатаний мішок для рідини з приварним штуцером для пиття або дозування
Наступний патент: Гамма-, рентгеночутливий діод шотткі
Випадковий патент: Спосіб і пристрій для перетворення теплової енергії у механічну