Антитіла до людського tweak та їхнє застосування
Номер патенту: 105520
Опубліковано: 26.05.2014
Автори: Нівьонер Йєнс, Бенер Моніка, Кньотген Хендрік
Формула / Реферат
1. Антитіло, що зв'язується з людським TWEAK, яке відрізняється тим, що містить
a) CDR1H, послідовність якого представлена у SEQ ID NO:22, CDR2H, послідовність якого представлена у SEQ ID NО:23, CDR3H, послідовність якого представлена у SEQ ID NО:24, і CDR1L, послідовність якого представлена у SEQ ID NО:18, CDR2L, послідовність якого представлена у SEQ ID NO: 19, CDR3L, послідовність якого представлена у SEQ ID NО:20; або
b) CDR1H, послідовність якого представлена у SEQ ID NО:22, CDR2H, послідовність якого представлена у SEQ ID NО:74, CDR3H, послідовність якого представлена у SEQ ID NО:24, і CDR1L, послідовність якого представлена у SEQ ID NО:18, CDR2L, послідовність якого представлена у SEQ ID NО:19, CDR3L, послідовність якого представлена у SEQ ID NО:20; або
c) CDR1H, послідовність якого представлена у SEQ ID NО:22, CDR2H, послідовність якого представлена у SEQ ID NО:75, CDR3H, послідовність якого представлена у SEQ ID NО:24, і CDR1L, послідовність якого представлена у SEQ ID NО:18, CDR2L, послідовність якого представлена у SEQ ID NО:19, CDR3L, послідовність якого представлена у SEQ ID NО:20.
2. Антитіло, що зв'язується з людським TWEAK, яке відрізняється тим, що містить комбінацію варіабельних областей, вибраних із групи, що включає варіабельні області легкого й важкого ланцюгів, які мають послідовності SEQ ID NО:57 і SEQ ID NО:68; SEQ ID NО:57 і SEQ ID NО:69; SEQ ID NO:57 і SEQ ID NО:70; SEQ ID NО:57 і SEQ ID NО:71; SEQ ID NО:57 і SEQ ID NО:72; SEQ ID NО:57 і SEQ ID NО:73; SEQ ID NО:58 і SEQ ID NО:68; SEQ ID NO:58 і SEQ ID NО:69; SEQ ID NО:58 і SEQ ID NО:70; SEQ ID NO:58 і SEQ ID NO:71; SEQ ID NО:58 і SEQ ID NО:72; SEQ ID NO:58 і SEQ ID NО:73.
3. Антитіло, що зв'язується з людським TWEAK, яке відрізняється тим, що містить CDR1Н, послідовність якого представлена у SEQ ID NО:22, CDR2H, послідовність якого представлена у SEQ ID NО:74, CDR3H, послідовність якого представлена у SEQ ID NО:24, і CDR1L, послідовність якого представлена у SEQ ID NО:18, CDR2L, послідовність якого представлена у SEQ ID NО:19, CDR3L, послідовність якого представлена у SEQ ID NО:20.
4. Антитіло, що зв'язується з людським TWEAK, яке відрізняється тим, що містить комбінацію варіабельних областей, вибраних із групи, що включає варіабельні області легкого й важкого ланцюгів, які мають послідовності SEQ ID NО:58 і SEQ ID NО:68.
5. Фармацевтична композиція, яка відрізняється тим, що містить антитіло за пп. 1-4.
6. Застосування антитіла за пп. 1-4 для приготування фармацевтичної композиції.
7. Антитіло за пп. 1-4 для використання для лікування раку.
8. Антитіло за пп. 1-4 для використання для лікування раку ободової кишки, легенів або підшлункової залози.
Текст
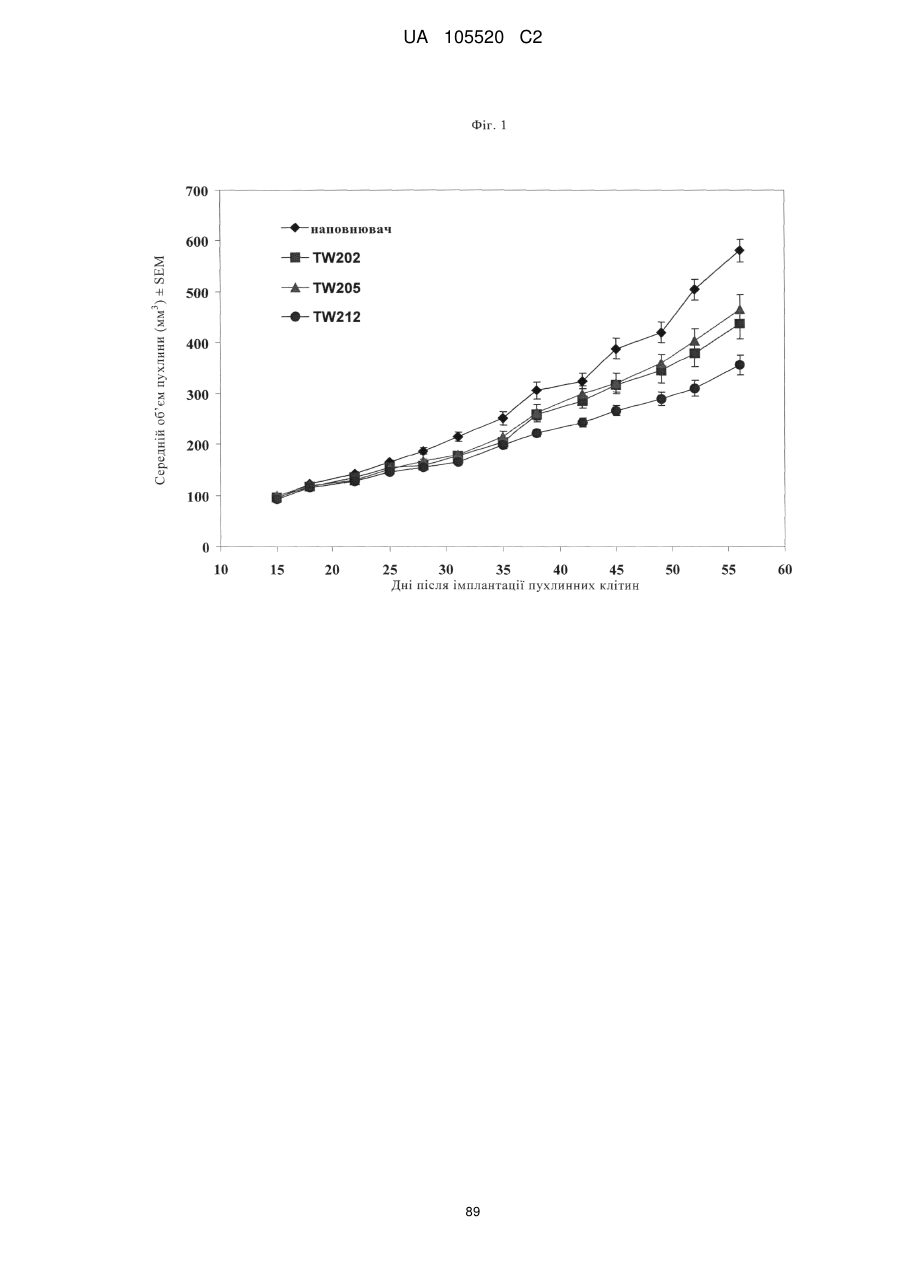
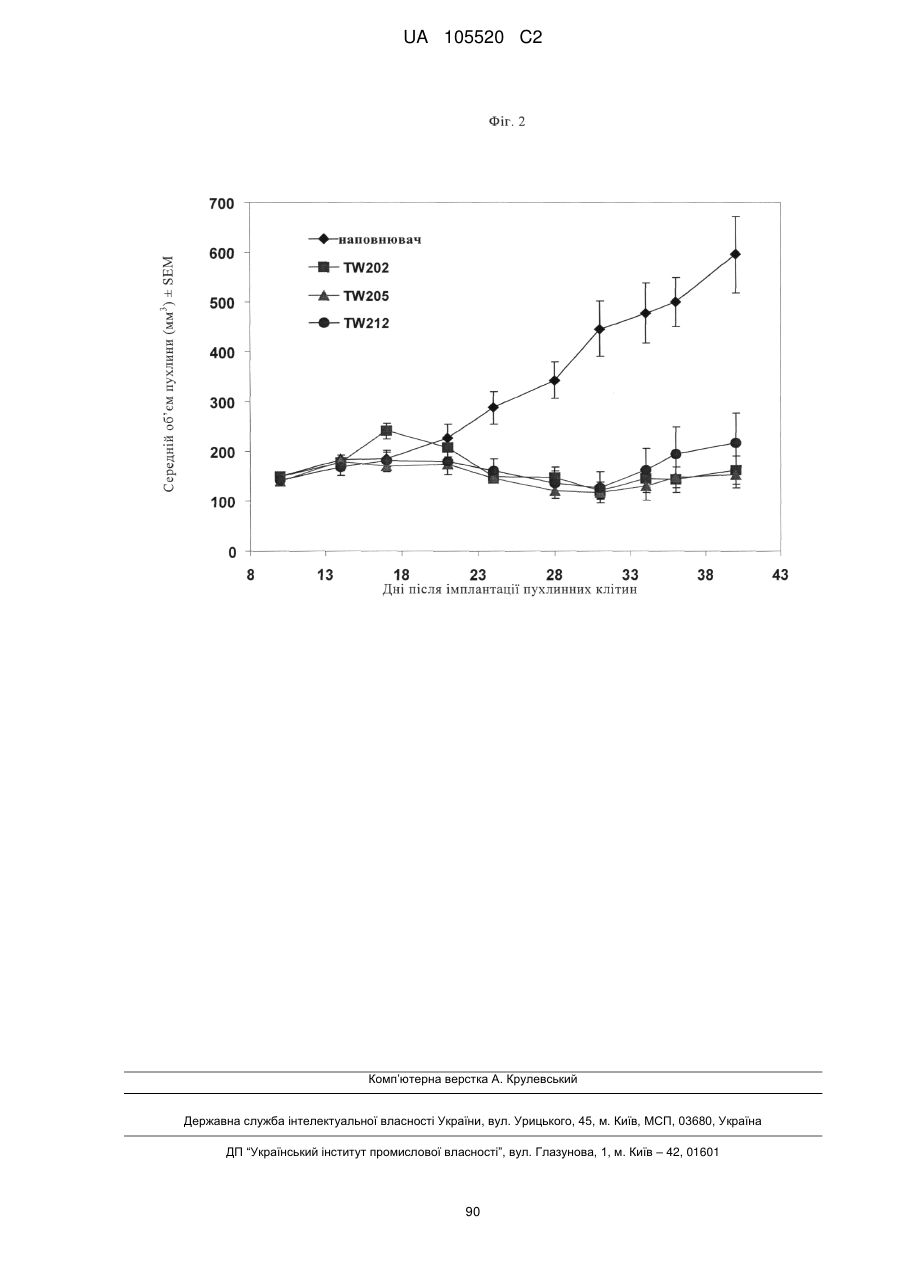
Реферат: Винахід стосується антитіла, що зв'язується з TWEAK, фармацевтичної композиції, що містить це антитіло, та його застосування. UA 105520 C2 (12) UA 105520 C2 UA 105520 C2 5 10 15 20 25 30 35 40 45 50 55 60 Даний винахід відноситься до антитіл до людського TWEAK (антитіла до TWEAK), способів їх одержання, фармацевтичних композицій, що містять ці антитіла, та їх застосування. Передумови створення винаходу Людський TWEAK (UniProtKB O43508, TNF-подібний слабкий індуктор апоптозу) являє собою асоційований з клітинною поверхнею трансмембранний білок типу II. TWEAK описаний у Chicheportiche Y. та ін., J. Biol. Chem. 272, 1997, сс. 32401-32410; Marsters S.A. та ін., Curr. Biol. 8, 1998, сс. 525-528; Lynch C.N та ін., J. Biol. Chem. 274, 1999, сс. 8455-8459. Активна форма TWEAK являє собою розчинний гомотример. Домени людського і мишачого TWEAK, які зв’язують рецептор, мають 93%-ву ідентичність послідовностей. TWEAK-рецептор Fn14 (який індукований фактором росту фібробластів білок 14 кДа) являє собою трансмембранний білок, що складається з 129 амінокислот, типу I, що складається з одного багатого цистеїном домену у лігандсполучній області. Передача сигналів TWEAK відбувається шляхом активації NF-KBшляху. мРНК TWEAK експресується у широкій розмаїтості тканин і найбільшою мірою в основних органах типу серця, головного мозку, кістякових м'язів і підшлункових залоз, тканинах, пов'язаних із імунною системою, типу селезінки, лімфатичних вузлів і тимусі. мРНК Fn14 виявлена у серці, головному мозку, легені, плаценті, судинних епітеліальних клітинах (EC) і гладком’язових клітинах. Миші з «виключеними» TWEAK (TWEAK-нуль) і Fnl4 (Fnl4-нуль) є життєздатними, здоровими й фертильними й мають більше високий рівень природних клітинкіллерів і мають посилену вроджену запальну відповідь. TWEAK бере участь в апоптозі, проліферації, ангіогенезі, розвитку «ішемічної півтіні», набряку головного мозку, розсіяного склерозу. Антитіла до TWEAK описані у WO 1998/005783, WO 2000/042073, WO 2003/086311, WO 2006/130429, WO 2006/130374, WO 2006/122187, WO 2006/089095, WO 2006/088890, WO 2006/052926. Короткий виклад сутності винаходу Винахід відноситься до антитіла, що зв'язується з людським TWEAK, яке відрізняється тим, що воно містить в якості CDR3-ділянки варіабельної області важкого ланцюга (CDR3H) послідовність, вибрану з групи, що включає SEQ ID NO: 8, 16 або 24. У винаході запропонований химерний, гуманізований або той, що має «виснажений» (елімінований) Т-клітинний епітоп, варіант антитіла, що містить варіабельну область легкого ланцюга, послідовність якого представлена у SEQ ID NO:1, і варіабельну область важкого ланцюга, послідовність якого представлена у SEQ ID NO: 5, варіант антитіла, що містить варіабельну область легкого ланцюга, послідовність якого представлена у SEQ ID NO: 9, і варіабельну область важкого ланцюга, послідовність якого представлена у SEQ ID NO: 13, або варіант антитіла, що містить варіабельну область легкого ланцюга, послідовність якого представлена у SEQ ID NO: 17, і варіабельну область важкого ланцюга, послідовність якого представлена у SEQ ID NO: 21. Краще антитіло відрізняється наявністю CDR1H, послідовність якого представлена у SEQ ID NO: 6, CDR2H, послідовність якого представлена у SEQ ID NO:7, і CDR3H, послідовність якого представлена у SEQ ID NO: 8. Краще антитіло відрізняється наявністю CDR1H, послідовність якого представлена у SEQ ID NO: 14, CDR2H, послідовність якого представлена у SEQ ID NO: 15, і CDR3H, послідовність якого представлена у SEQ ID NO: 16. Краще антитіло відрізняється наявністю CDR1H, послідовність якого представлена у SEQ ID NO: 22, CDR2H, послідовність якого представлена у SEQ ID NO: 23, і CDR3H, послідовність якого представлена у SEQ ID NO: 24. Краще антитіло відрізняється наявністю CDR1H, послідовність якого представлена у SEQ ID NO: 22, CDR2H, послідовність якого представлена у SEQ ID NO: 74, і CDR3H, послідовність якого представлена у SEQ ID NO: 24. Краще антитіло відрізняється наявністю CDR1H, послідовність якого представлена у SEQ ID NO: 22, CDR2H, послідовність якого представлена у SEQ ID NO: 75, і CDR3H, послідовність якого представлена у SEQ ID NO: 24. Краще антитіло відрізняється наявністю CDR1H, послідовність якого представлена у SEQ ID NO: 6, CDR2H, послідовність якого представлена у SEQ ID NO:7, CDR3H, послідовність якого представлена у SEQ ID NO: 8, і CDR1L, послідовність якого представлена у SEQ ID NO: 2, CDR2L, послідовність якого представлена у SEQ ID NO: 3, CDR3L, послідовність якого представлена у SEQ ID NO:4. Краще антитіло відрізняється наявністю CDR1H, послідовність якого представлена у SEQ ID NO: 14, CDR2H, послідовність якого представлена у SEQ ID NO: 15, CDR3H, послідовність якого представлена у SEQ ID NO: 16, і CDR1L, послідовність якого представлена у SEQ ID NO: 10, 1 UA 105520 C2 5 10 15 20 25 30 35 40 45 50 55 60 CDR2L, послідовність якого представлена у SEQ ID NO: 11, CDR3L, послідовність якого представлена у SEQ ID NO: 12. Краще антитіло відрізняється наявністю CDR1H, послідовність якого представлена у SEQ ID NO: 22, CDR2H, послідовність якого представлена у SEQ ID NO: 23, CDR3H, послідовність якого представлена у SEQ ID NO: 24, і CDR1L, послідовність якого представлена у SEQ ID NO: 18, CDR2L, послідовність якого представлена у SEQ ID NO: 19, CDR3L, послідовність якого представлена у SEQ ID NO: 20. Краще антитіло відрізняється наявністю CDR1H, послідовність якого представлена у SEQ ID NO: 22, CDR2H, послідовність якого представлена у SEQ ID NO: 74, CDR3H, послідовність якого представлена у SEQ ID NO: 24, і CDR1L, послідовність якого представлена у SEQ ID NO: 18, CDR2L, послідовність якого представлена у SEQ ID NO: 19, CDR3L, послідовність якого представлена у SEQ ID NO: 20. Краще антитіло відрізняється наявністю CDR1H, послідовність якого представлена у SEQ ID NO: 22, CDR2H, послідовність якого представлена у SEQ ID NO: 75, CDR3H, послідовність якого представлена у SEQ ID NO: 24, і CDR1L, послідовність якого представлена у SEQ ID NO: 18, CDR2L, послідовність якого представлена у SEQ ID NO: 19, CDR3L, послідовність якого представлена у SEQ ID NO: 20. Краще антитіло відрізняється наявністю як послідовність варіабельної області легкого ланцюга послідовності, вибраної з групи, що включає SEQ ID NO: 1, 9, 17, 32, 33, 34, 35, 44, 45, 46, 47, 55, 56, 57, 58, 59 і 60. Краще антитіло відрізняється наявністю як послідовність варіабельної області важкого ланцюга послідовності, вибраної з групи, що включає SEQ ID NO: 5, 13, 21, 36, 37, 38, 39, 40, 41, 42, 43, 48, 49, 50, 51, 52, 53, 54, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72 і 73. Краще антитіло відрізняється наявністю як послідовність варіабельної області легкого ланцюга послідовності, вибраної з групи, що включає SEQ ID NO: 1, 32, 33, 34, 35, і як послідовність варіабельної області важкого ланцюга послідовності, вибраної з групи, що включає SEQ ID NO: 5, 36, 37, 38, 39, 40, 41, 42, 43. Краще антитіло відрізняється наявністю як послідовність варіабельної області легкого ланцюга послідовності, вибраної з групи, що включає SEQ ID NO: 9, 44, 45, 46, 47, і як послідовність варіабельної області важкого ланцюга послідовності, вибраної з групи, що включає SEQ ID NO: 13, 48, 49, 50, 51, 52, 53, 54. Краще антитіло відрізняється наявністю як послідовність варіабельної області легкого ланцюга послідовності, вибраної з групи, що включає SEQ ID NO: 17, 55, 56, 57, 58, 59, 60, і як послідовність варіабельної області важкого ланцюга послідовності, вибраної з групи, що включає SEQ ID NO: 21, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73. Кращою є комбінація варіабельних областей легких і важких ланцюгів, вибрана з групи, що включає: 1/5, 1/36, 1/37, 1/38 1/39, 1/40, 1/41, 1/42, 1/43, 32/5, 32/36, 32/37, 32/38, 32/39, 32/40, 32/41, 32/42, 32/43, 33/5, 33/36, 33/37, 33/38, 33/39, 33/40, 33/41, 33/42, 33/43, 34/5, 34/36, 34/37, 34/38 34/39, 34/40, 34/41, 34/42, 34/43, 35/5, 35/36, 35/37, 35/38, 35/39, 35/40, 35/41, 35/42, 35/43; 9/13, 9/48, 9/49; 9/50, 9/51, 9/52, 9/53, 9/54, 44/13, 44/48, 44/49; 44/50, 44/51, 44/52, 44/53, 44/54, 45/13, 45/48, 45/49; 45/50, 45/51, 45/52, 45/53, 45/54, 46/13, 46/48, 46/49; 46/50, 46/51, 46/52, 46/53, 46/54, 47/13, 47/48, 47/49; 47/50, 47/51, 47/52, 47/53, 47/54; 17/21, 17/61, 17/62, 17/63, 17/64, 17/65, 17/66, 17/67, 17/68, 17/69, 17/70, 17/71, 17/72, 17/73, 55/21, 55/61, 55/62, 55/63, 55/64, 55/65, 55/66, 55/67, 55/68, 55/69, 55/70, 55/71, 55/72, 55/73, 56/21, 56/61, 56/62, 56/63, 56/64, 56/65, 56/66, 56/67, 56/68, 56/69, 56/70, 56/71, 56/72, 56/73, 57/21, 57/61, 57/62, 57/63, 57/64, 57/65, 57/66, 57/67, 57/68, 57/69, 57/70, 57/71, 57/72, 57/73, 58/21, 58/61, 58/62, 58/63, 58/64, 58/65, 58/66, 58/67, 58/68, 58/69, 58/70, 58/71, 58/72, 58/73, 59/21, 59/61, 59/62, 59/63, 59/64, 59/65, 59/66, 59/67, 59/68, 59/69, 59/70, 59/71, 59/72, 59/73, 60/21, 60/61, 60/62, 60/63, 60/64, 60/65, 60/66, 60/67, 60/68, 60/69, 60/70, 60/71, 60/72, 60/73 (наприклад, 47/52 означає, що антитіло містить варіабельну область легкого ланцюга, послідовність якого представлена у SEQ ID NO: 47, і варіабельну область важкого ланцюга, послідовність якого представлена у SEQ ID NO: 52). Найбільше кращим є антитіло, запропоноване у винаході, що містить комбінацію варіабельних областей, вибраних із групи, що включає варіабельні області легкого й важкого ланцюгів, які мають послідовності SEQ ID NO: 57 і SEQ ID NO: 68; SEQ ID NO: 57 і SEQ ID NO: 69; SEQ ID NO: 57 і SEQ ID NO: 70; SEQ ID NO: 57 і SEQ ID NO: 71; SEQ ID NO: 57 і SEQ ID NO: 72; SEQ ID NO: 57 і SEQ ID NO: 73; SEQ ID NO: 58 і SEQ ID NO: 68; SEQ ID NO: 58 і SEQ ID NO: 69; SEQ ID NO: 58 і SEQ ID NO: 70; SEQ ID NO: 58 і SEQ ID NO: 71; SEQ ID NO: 58 і SEQ ID NO: 72; SEQ ID NO: 58 і SEQ ID NO: 73. Іншим варіантом здійснення даного винаходу є варіабельна область важкого ланцюга або 2 UA 105520 C2 5 10 15 20 25 30 35 40 45 50 55 60 легкого ланцюга, вибрана з групи, що включає варіабельну область важкого або легкого ланцюга, яка має послідовність, представлену у SEQ ID NO: 32, 33, 34, 35,36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73. Зазначену варіабельну область важкого ланцюга або легкого ланцюга можна використовувати як проміжний продукт при створенні антитіла, запропонованого у винаході. Краще антитіло, що зв'язується з TWEAK і відрізняється наявністю вищевказаних амінокислотних послідовностей і фрагментів амінокислотних послідовностей, являє собою людське антитіло IgG1-ізотипу. Для антитіла, запропонованого у винаході, характерно, що час напівжиття комплексу, що складається з розчинного людського TWEAK (амінокислоти 99-249) і антитіла, становить 53 хв або менше (переважно 20 хв і менше і найбільше переважно від 10 до 20 хв) при 25°C при оцінці за допомогою Biacore-аналізу. Антитіла до TWEAK зі зазначеним коротким часом напівжиття найбільше переважно застосовувати для лікування пухлинних захворювань. Антитіло, запропоноване у винаході, специфічно зв'язується з людським TWEAK та інгібує взаємодію між людським TWEAK і Fn14, що характеризується значенням IC 50 15 нг/мл або менше. Антитіло переважно являє собою людське антитіло IgG1-ізотипу. Краще антитіло являє собою гуманізоване або людське антитіло. У контексті даного опису мається на увазі, що значення IC50 означає кількість антитіла, яке блокує на 50% взаємодію між людським TWEAK і Fn14. Для антитіла, запропонованого у винаході, час напівжиття комплексу, що складається з розчинного мишачого TWEAK (амінокислоти 81-225) і антитіла, переважно становить 70 хв або менше (переважно від 40 до 70 хв) при 25°C при оцінці за допомогою Biacore-аналізу, і воно зв'язується з мишачим TWEAK та інгібує взаємодію між мишачим TWEAK і Fn14, що характеризується значенням IC50 40 нг/мл або менше. Наступним варіантом здійснення винаходу є фармацевтична композиція, що містить антитіло, запропоноване у винаході. Наступним варіантом здійснення винаходу є застосування антитіла, запропонованого у винаході, для готування фармацевтичної композиції. Наступним варіантом здійснення винаходу є застосування антитіла, запропонованого у винаході, для лікування раку, переважно раку ободової кишки, легенів або підшлункової залози. Наступним варіантом здійснення винаходу є спосіб одержання фармацевтичної композиції, що містить антитіло, запропоноване у винаході. Наступним варіантом здійснення винаходу є нуклеїнова кислота, яка кодує варіабельну область важкого ланцюга й/або варіабельну область легкого ланцюга антитіла, запропонованого у винаході. Винахід відноситься також до експресійних векторів, які містять нуклеїнову кислоту, запропоновану у винаході, що мають здатність експресувати нуклеїнову кислоту у прокаріотичній або еукаріотичній клітині-хазяїні, і до клітин-хазяїнів, що містять зазначені вектори, які призначені для рекомбінантного виробництва антитіла. Винахід відноситься також до прокаріотичної або еукаріотичної клітини-хазяїна, що містить вектор, запропонований у винаході. Винахід відноситься також до способу одержання рекомбінантного людського або гуманізованого антитіла, запропонованого у винаході, який відрізняється тим, що експресують нуклеїнову кислоту, запропоновану у винаході, у прокаріотичній або еукаріотичній клітині-хазяїні й виділяють антитіло з клітини або супернатанту клітинної культури. Винахід відноситься також до антитіла, яке можна одержувати за допомогою методу рекомбінації. Антитіла, запропоновані у винаході, роблять сприятливу дію на пацієнтів, які мають потребу у терапії, спрямованій на TWEAK. Антитіла, запропоновані у винаході, мають нові й патентоспроможні властивості, обумовлені сприятливою дією на пацієнта, що страждає пухлинним захворюванням, насамперед страждаючого раком ободової кишки, легенів або підшлункової залози. Винахід відноситься також до способу лікування пацієнта, що страждає раком, насамперед раком ободової кишки, легенів або підшлункової залози, який полягає у тому, що вводять пацієнтові, в якого діагностовано таке захворювання (і який тому має потребу у зазначеній терапії) в ефективній кількості запропоноване у винаході антитіло, що зв'язується з TWEAK. Антитіло вводять переважно у складі фармацевтичної композиції. Наступним варіантом здійснення винаходу є спосіб лікування пацієнта, що страждає раком, насамперед раком ободової кишки, легенів або підшлункової залози, який полягає у тому, що вводять пацієнтові антитіло, запропоноване у винаході. Винахід відноситься також до застосування антитіла, запропонованого у винаході, для 3 UA 105520 C2 5 10 15 20 25 30 35 40 45 50 55 60 лікування пацієнта, що страждає раком, насамперед раком ободової кишки, легенів або підшлункової залози, і до готування фармацевтичної композиції, запропонованої у винаході. Крім того, винахід відноситься до способу готування фармацевтичної композиції, запропонованої у винаході. Винахід відноситься також до фармацевтичної композиції, що містить антитіло, запропоноване у винаході, необов'язково у сполученні з буфером і/або ад’ювантом, який можна застосовувати для готування препаративної форми антитіл для фармацевтичних потреб. Винахід відноситься також до фармацевтичної композиції, що містить антитіло, запропоноване у винаході, у фармацевтично прийнятному носії. В одному з варіантів здійснення винаходу фармацевтична композиція може бути включена у виріб або набір. Докладний опис винаходу Поняття «антитіло» відноситься до різних форм структур антитіл, включаючи (але, не обмежуючись ними) повні антитіла, біспецифічні антитіла й фрагменти антитіл. Антитіло, запропоноване у винаході, переважно являє собою гуманізоване антитіло, химерне антитіло або також створене за допомогою генної інженерії антитіло, якщо воно зберігає відмітні ознаки, запропоновані у винаході. Поняття «фрагменти антитіла» відноситься до частини повнорозмірного антитіла, переважно до його варіабельної області або щонайменше до його антигенсполучному центру. Прикладами фрагментів антитіл є димерні антитіла (діабоди), молекули одноланцюгових антитіл і мультиспецифічні антитіла, утворені з фрагментів антитіл. Антитіла формату scFv описані, наприклад, у Houston J.S., Methods in Enzymol. 203, 1991, сс. 46-88. Крім того, фрагменти антитіла являють собою одноланцюгові поліпептиди, які мають характеристики VHобласті, а саме, мають здатність поєднуватися з VL-областю, або VL-області, що зв'язується з TWEAK, а саме, мають здатність поєднуватися з VH-областю з утворенням функціонального антигенсполучного центра. Поняття «моноклональне антитіло» або «композиція моноклонального антитіла» у контексті даного опису відносяться до препарату, що містить молекули антитіла, які мають однаковий склад амінокислот. Поняття «гуманізоване антитіло» відноситься до антитіл, у яких каркасна ділянка або «гіперваріабельні ділянки» (CDR) модифіковані таким чином, що вони містять CDR імуноглобуліну з інших видів у порівнянні з батьківським імуноглобуліном. У кращому варіанті здійснення винаходу CDR хом'ячка трансплантують у каркасну ділянку людського антитіла, одержуючи «гуманізоване антитіло» (див., наприклад, Riechmann L. та ін., Nature 332, 1988, сс. 323-327; і Neuberger M.S. та ін., Nature 314, 1985, сс. 268-270). Поняття «химерне антитіло» відноситься до моноклонального антитіла, що містить мишачу варіабельну область, тобто єднальну область, і щонайменше одну частину константної області з іншого джерела або інших видів, як правило, отриману за допомогою методів рекомбінантної ДНК. Химерні антитіла містять, наприклад, мишачу варіабельну область і людську константну область. Такі мишачі/людські химерні антитіла являють собою продукт експресованих генів імуноглобуліну, які містять ДНК-сегменти, що кодують варіабельні області щурячого імуноглобуліну, і ДНК-сегменти, що кодують константні області людського імуноглобуліну. Інші форми 20 «химерних антитіл», що підпадають під обсяг даного винаходу, являють собою такі форми, в яких клас або підклас модифіковані або замінені щодо вихідного антитіла. Такі «химерні» антитіла позначають також як «антитіла переключеного класу». Методи одержання химерних антитіл включають загальноприйняті методи, засновані на застосуванні рекомбінантної ДНК і генної трансфекції, які у цей час гарно відомі у даній галузі (див., наприклад, Morrison S.L. та ін., Proc. Natl. Acad Sci. USA 81, 1984, сс. 6851-6855; US 5202238 і US 5204244). Поняття «антитіло з «виснаженим» (елімінованим) Т-клітинним епітопом відноситься до антитіл, які були модифіковані з метою усунення або зниження імуногенності шляхом видалення людських T-клітинних епітопів (пептидні послідовності у білках, які мають здатність зв'язуватися з молекулами класу II ГКГ). За допомогою цього методу ідентифікують взаємодії між бічними ланцюгами амінокислот пептиду й специфічних «кишень», які зв'язуються з єднальним жолобком молекул класу II ГКГ. Ідентифіковані імуногенні області піддають мутаціям для елімінації імуногенності. Такі методи у цілому описані, наприклад, у WO 98/52976. Поняття «варіабельна область» (варіабельна область легкого ланцюга (V L), варіабельна область важкого ланцюга (VH)) у контексті даного опису у кожному випадку означає кожну з пари областей легких і важких ланцюгів, які безпосередньо беруть участь у зв'язуванні антитіла з антигеном. Домени варіабельних областей легких і важких ланцюгів мають деяку загальну структуру, і кожний домен містить 4 каркасних ділянки (FR), послідовності яких є 4 UA 105520 C2 5 10 15 20 25 30 35 40 45 50 55 60 висококонсервативними, зв'язаних трьома «гіперваріабельними ділянками» (або областями, CDR, що визначають комплементарність). Каркасні ділянки адоптовані до -складчастої конформації, а CDR-ділянки можуть формувати петлі, що з'єднують -складчасту структуру. CDR у кожному ланцюзі підтримуються у вигляді тривимірної структури за допомогою каркасних ділянок і формують з CDR-ділянками іншого ланцюга антигенсполучний центр. CDR3-ділянки важкого й легкого ланцюга антитіла грають дуже важливу роль у специфічності зв'язування/афінності антитіл, запропонованих у винаході, і внаслідок цього є додатковим об'єктом винаходу. Поняття «антигенсполучна ділянка (центр) антитіла» у контексті даного опису відноситься до амінокислотних залишків антитіла, які відповідальні за зв'язування з антигеном. Антигенсполучна ділянка антитіла містить амінокислотні залишки з «гіперваріабельних ділянок» або «CDR». «Каркасні» або «FR»-ділянки являють собою ділянки варіабельної області, залишки яких відмінні від залишків гіперваріабельної ділянки, як вони визначені у даному описі. Таким чином, варіабельні області легких і важких ланцюгів антитіла містять у напрямку від N- до Cкінця домени FR1, CDR1, FR2, CDR2, FR3, CDR3 і FR4. CDR3 важкого ланцюга являє собою основну ділянку, що забезпечує головним чином зв'язування з антигеном і визначає властивості антитіла. До CDR- і FR-ділянок відносяться ділянки, які визначають відповідно до стандартного принципу Кебота та ін. (Sequences of Proteins of Immunological Interest, 5-е вид., вид-во Public Health Service, National Institutes of Health, Bethesda, MD, 1991) і/або залишки з «гіперваріабельної петлі». Поняття «CDR1H» відноситься до CDR1-ділянки варіабельної області важкого ланцюга, визначеної згідно Кеботу. CDR2L, CDR3H тощо означають відповідні ділянки важкого (H) або легкого (L) ланцюга. Наприклад, антитіло, яке відрізняється тим, що містить CDR1H, послідовність якого представлена у SEQ ID NO: 6, означає, що антитіло містить цю амінокислотну послідовність в якості CDR1-ділянки варіабельної області важкого ланцюга у своєї варіабельній області важкого ланцюга. Наприклад, антитіло, яке відрізняється тим, що містить CDR1H, послідовність якого представлена у SEQ ID NO: 6, CDR2H, послідовність якого представлена у SEQ ID NO: 7, CDR3H, послідовність якого представлена у SEQ ID NO: 8, означає, що антитіло містить в його важкому ланцюзі як послідовність CDR1 SEQ ID NO: 6, як послідовність CDR2 SEQ ID NO: 7 і як послідовність CDR3 SEQ ID NO: 8. Поняття «нуклеїнова кислота» або «молекула нуклеїнової кислоти» у контексті даного опису відносяться до молекул ДНК і молекул РНК. Молекула нуклеїнової кислоти може бути одноланцюговою або дволанцюговою, але переважно являє собою дволанцюгову ДНК. Поняття «амінокислота» у контексті даного опису означає групу карбоксі--амінокислот, що зустрічаються у природних умовах, таких як аланін (трибуквений код: ala, однобуквений код: A), аргінін (arg, R), аспарагін (asn, N), аспарагінова кислота (asp, D), цистеїн (cys, C), глутамін (gln, Q), глутамінова кислота (glu, E), гліцин (gly, G), гістидин (his, H), ізолейцин (ile, I), лейцин (leu, L), лізин (lys, K), метіонін (met, M), фенілаланін (phe, F), пролін (pro, P), серин (ser, S), треонін (thr, T), триптофан (trp, W), тирозин (tyr, Y) і валін (val, V). Нуклеїнова кислота «функціонально зв'язана», коли вона перебуває у функціональному зв'язку з іншою нуклеїновою кислотою. Наприклад, ДНК передпослідовності або лідерної секреторної послідовності функціонально пов'язана з ДНК поліпептиду, якщо при її експресії утворюється передбілок, що бере участь у секреції поліпептиду; промотор або енхансер функціонально пов'язаний з кодуючою послідовністю, якщо він впливає на транскрипцію послідовності; або сайт зв'язування рибосом функціонально пов'язаний з кодуючою послідовністю, якщо він розташований так, що полегшує трансляцію. Як правило, поняття «функціонально зв'язана» означає, що послідовності ДНК, будучи зв'язані, є колінеарними, а у випадку лідерної секреторної послідовності, суміжними у рамці зчитування. Однак не потрібно, щоб енхансери були суміжними. Зв'язування здійснюють шляхом лігування у відповідних сайтах рестрикції. Якщо такі сайти не існують, то відповідно до прийнятої практики застосовують синтетичні олігонуклеотидні адаптори або лінкери. У контексті даного опису поняття «клітина», «клітинна лінія» і «клітинна культура» використовуються взаємозамінно, і всі такі визначення включають потомство. Так, поняття «трансформанти» і «трансформовані клітини» відносяться до первинної розглянутої клітини й отриманих з неї культур безвідносно до кількості пересівань. Варто розуміти також, що все потомство може не бути повністю ідентичним за складом ДНК через навмисні або випадкові мутації. Під обсяг винаходу підпадає варіант потомства, що має таку ж функцію або біологічну активність, яка виявлена у вихідної трансформованої клітини. «Fc-фрагмент» антитіла не бере участь безпосередньо у зв'язуванні антитіла з антигеном, але має різні ефекторні функції. Поняття «Fc-фрагмент антитіла» добре відоме фахівцеві у 5 UA 105520 C2 5 10 15 20 25 30 35 40 45 50 55 60 даній галузі та його визначають на основі розщеплення антитіл папаїном. Залежно від амінокислотної послідовності константної області важких ланцюгів антитіла або імуноглобуліни розділяють на наступні класи: IgA, IgD, IgE, IgG і IgM і деякі з них можна додатково підрозділяти на підкласи (ізотипи), наприклад, IgG1, IgG2, IgG3 і IgG4, IgA1 і IgA2. На основі будови константних областей важких ланцюгів різні класи імуноглобулінів позначають як , , , і відповідно. Fc-фрагмент антитіл безпосередньо бере участь в ADCC (антитіло-обумовлена клітиннозалежна цитотоксичність) і CDC (комплементзалежна цитотоксичність) у результаті активації комплементу, зв'язування C1q і зв'язування Fc-рецептора. Активація комплементу (CDC) ініціюється зв'язуванням фактора системи комплементу C1q з Fc-фрагментом більшості антитіл підкласів IgG. Хоча вплив антитіла на систему комплементу залежить від певних умов, зв'язування з C1q обумовлене певними сайтами зв'язування у Fc-фрагменті. Такі сайти зв'язування відомі у даній галузі та описані, наприклад, Boakle R.J. та ін., Nature 282, 1979, сс. 742-743; Lukas T.J. та ін., J. Immunol. 127, 1981, сс. 2555-2560; Brunhouse R. і Cebra J.J., Mol. Immunol. 16, 1979, сс. 907-917; Burton D.R. та ін., Nature 288, 1980, сс. 338-344; Thommesen J.E. та ін., Mol. Immunol. 37, 2000, сс. 995-1004; Idusogie E.E. та ін., J. Immunol. 164, 2000, сс. 41784184; Hezareh M. та ін., J. Virology 75, 2001, сс. 12161-12168; Morgan A. та ін., Immunology 86, 1995, сс. 319-324; EP 0307434. Зазначені сайти зв'язування являють собою, наприклад, L234, L235, D270, N297, E318, K320, K322, P331 і P329 (нумерація згідно EU-нумерації за Кеботом, див. нижче). Антитіла підкласів IgG1, IgG2 і IgG3, як правило, обумовлюють активацію комплементу й зв'язування C1q і C3, у той час як IgG4 не активує систему комплементу, не зв'язується з C1q і С3. Антитіло, запропоноване у винаході, переважно містить Fc-фрагмент людського походження, що являє собою Fc-фрагмент людського антитіла підкласу IgG1. Антитіло, запропоноване у винаході, переважно відрізняється тим, що константні області ланцюга одержують з людських антитіл. Такі константні області ланцюга добре відомі у даній галузі, наприклад, описані у Кебота (див., наприклад, Johnson G. і Wu T.T., Nucleic Acids Res. 28, 2000, сс. 214-218). Наприклад, застосовувана людська константна область важкого ланцюга містить амінокислотну послідовність, представлену у SEQ ID NO:27 або 28. Наприклад, застосовувана людська константна область легкого ланцюга містить амінокислотну послідовність константної області легкого каппа-ланцюга, представлену у SEQ ID NO:25. Переважно також антитіло одержують з антитіла хом'ячка, і воно містить послідовність варіабельної області у рамці антитіла хом'ячка відповідно до номенклатури Кебота (див., наприклад,. Sequences of Proteins of Immunological Interest, Kabat E.A. та ін., 5-е вид., вид-во DIANE Publishing, 1992). Винахід відноситься до способу лікування пацієнта, що має потребу у терапії, який полягає у тому, що вводять пацієнтові у терапевтично ефективній кількості антитіло, запропоноване у винаході. Винахід відноситься до застосування антитіла, запропонованого у винаході, у терапії. Винахід відноситься до застосування антитіла, запропонованого у винаході, для готування лікарського засобу, призначеного для лікування раку. Винахід відноситься до застосування антитіла, запропонованого у винаході, для лікування запальних захворювань, переважно для лікування раку, насамперед раку ободової кишки, легенів або підшлункової залози. Наступним варіантом здійснення винаходу є спосіб одержання антитіла до TWEAK, який полягає у тому, що вбудовують послідовність нуклеїнової кислоти, яка кодує важкий ланцюг антитіла, запропонованого у винаході, і нуклеїнової кислоти, яка кодує легкий ланцюг зазначеного антитіла, в один або два експресійний(их) вектор(и), зазначений(і) вектор(и) вбудовують в еукаріотичну клітину-хазяїна, експресують кодоване антитіло й виділяють з клітини-хазяїна або супернатанту. Антитіла, запропоновані у винаході, переважно одержують методами рекомбінації. Такі методи широко відомі у даній галузі та являють собою експресію білків у прокаріотичних і еукаріотичних клітинах із наступним виділенням поліпептиду антитіла й, як правило, очищення до фармацевтично прийнятної чистоти. Для експресії білка нуклеїнові кислоти, які кодують легкі й важкі ланцюги або їхні фрагменти, вбудовують в експресійні вектори стандартними методами. Експресію здійснюють у придатних прокаріотичних або еукаріотичних клітинах-хазяїнах типу CHO-клітин, NS0-клітин, SP2/0-клітин, HEK293-клітин, COS-клітин, клітин дріжджів або клітин E.coli, і антитіло виділяють з клітин (супернатант або клітини після лізису). Рекомбінантне одержання антитіл добре відоме у даній галузі та описане, наприклад, в оглядових статтях Makrides S.C., Protein Expr. Purif. 17, 1999, сс. 183-202; Geisse S. та ін., Protein Expr. Purif. 8, 1996, сс. 271-282; Kaufman R.J., Mol. Biotechnol. 16, 2000, сс. 151-161; 6 UA 105520 C2 5 10 15 20 25 30 35 40 45 50 55 60 Werner R.G. та ін., Drug Res., 48, 1998, сс. 870-880. Антитіла можуть бути присутніми у цілих клітинах, у клітинному лізаті або у частково очищеній або повністю очищеній формі. Очищення здійснюють для видалення інших клітинних компонентів або інших забруднювачів, наприклад, інших клітинних нуклеїнових кислот або білків, стандартними методами, які включають обробку лугом/ДСН, CsCl-бендинг, хроматографію на колонках, електрофорез в агарозному гелі та інші методи, добре відомі у даній галузі (див. у Current Protocols in Molecular Biology, під ред. Ausubel F., та ін., вид-во Greene Publishing and Wiley Interscience, New York, 1987). Експресія у NS0-клітинах описана, наприклад, у Barnes L.M. та ін., Cytotechnology 32, 2000, сс. 109-123; і Barnes L.M. та ін., Biotech. Bioeng. 73, 2001, сс. 261-270. Короткочасна експресія описана, наприклад, у Durocher Y. та ін., Nucl. Acids. Res. 30, 2002, с. E9. Клонування варіабельних областей описане в Orlandi R. та ін., Proc. Natl. Acad. Sci. USA 86, 1989, сс. 38333837; Carter P. та ін., Proc. Natl. Acad. Sci. USA 89, 1992, сс. 4285-4289; і Norderhaug L. та ін., J. Immunol. Methods 204, 1997, сс. 77-87. Краща система короткочасної експресії (HEK 293) описана у Schlaeger E.-J. і Christensen K., у Cytotechnology 30, 1999, сс. 71-83 і у Schlaeger E.-J. в J. Immunol. Methods 194, 1996, сс. 191-199. Моноклональні антитіла можна відокремлювати від культурального середовища за допомогою загальноприйнятих методів очищення імуноглобулінів, таких, наприклад, як хроматографія на білок A-сефарозі, хроматографія на гідроксилапатиті, гель-електрофорез, діаліз або афінна хроматографія. ДНК і РНК, які кодують моноклональні антитіла, можна легко виділяти й секвенувати за допомогою загальноприйнятих методів. Клітини гібридом можуть служити джерелом таких ДНК і РНК. Після виділення ДНК можна вбудовувати в експресійні вектори, якими потім трансфектують клітини-хазяїни, такі як клітини HEK 293, CHO-клітини або клітини мієломи, які інакше не можуть продукувати білок імуноглобуліну, для синтезу рекомбінантних моноклональних антитіл у клітинах-хазяїнах. Молекули нуклеїнових кислот, які кодують варіанти амінокислотних послідовностей антитіла до TWEAK, одержують за допомогою різних відомих у даній галузі методів. Ці методи включають (але, не обмежуючись тільки ними) виділення з природного джерела (у випадку варіантів амінокислотних послідовностей, що зустрічаються у природних умовах) або одержання шляхом опосередкованого олігонуклеотидом (або сайтнаправленного) мутагенезу, ПЛР-мутагенезу й касетного мутагенезу раніше отриманої варіантної або неваріантної версії гуманізованого антитіла до TWEAK. Варіабельні області важкого й легкого ланцюга, запропоновані у винаході, поєднують з послідовностями промотору, ініціації трансляції, константної області, з 3'-нетрансльованою послідовністю, послідовностями поліаденілювання й термінації транскрипції з одержанням конструкцій експресійних векторів. Конструкції для експресії важкого й легкого ланцюга можна поєднувати в одному векторі, їх можна застосовувати для котрансфекції, серійної трансфекції або роздільної трансфекції клітин-хазяїнів, які потім можна зливати з одержанням індивідуальної клітини-хазяїна, що експресує обидва ланцюги. Наступним об'єктом даного винаходу є композиція, наприклад, фармацевтична композиція, що містить одне або комбінацію моноклональних антитіл або їх антигенсполучних ділянок, запропонованих у винаході, приготовлена у сполученні з фармацевтично прийнятним носієм. У контексті даного опису поняття «фармацевтично прийнятний носій» відноситься до будьякого й до всіх розчинників, диспергуючих середовищ, покриттів, антибактеріальних і протигрибкових агентів, агентів, що регулюють ізотонічність і сповільнюють абсорбцію/ресорбцію, і подібних речовин, які є фізіологічно сумісними. Переважно носій повинен бути придатний для ін'єкції або інфузії. Композицію, запропоновану у даному винаході, можна вводити різними методами, відомими у даній галузі. Як повинно бути очевидно фахівцеві у даній галузі, шлях і/або механізм введення повинен варіюватися залежно від необхідних результатів. Фармацевтично прийнятні носії являють собою стерильні водні розчини або дисперсії й стерильні порошки, призначені для готування стерильних ін'єкованих розчинів або дисперсії. Застосування зазначених середовищ і агентів для фармацевтичних діючих речовин відоме у даній галузі. Крім води носій може являти собою, наприклад, ізотонічний забуферений фізіологічний розчин. Поза залежністю від обраного шляху введення сполуки, запропоновані у даному винаході, які можна застосовувати у прийнятній гідратованій формі, і/або фармацевтичні композиції, запропоновані у даному винаході, готують у вигляді фармацевтично прийнятних лікарських форм за допомогою загальноприйнятих методів, відомих фахівцям у даній галузі. Фактичні рівні доз діючих речовин у фармацевтичних композиціях, запропонованих у даному 7 UA 105520 C2 5 10 15 20 винаході, можуть варіюватися так, щоб одержувати кількість діючої речовини, яка є ефективною для одержання необхідної терапевтичної відповіді у конкретного пацієнта при використанні конкретної композиції й шляху введення, не будучи при цьому токсичними для пацієнта (ефективна кількість). Вибраний рівень доз повинен залежати від різноманітних фармакокінетичних факторів, таких як активність конкретних застосовуваних композицій, запропонованих у даному винаході, або їх складних ефірів, солей або амідів, шлях введення, час введення, швидкість екскреції конкретної застосовуваної сполуки, інші лікарські засоби, сполуки й/або матеріали, які застосовують у сполученні з конкретними композиціями, вік, стать, вага, загальний стан здоров'я й попередня історія хвороби пацієнта, що підлягає лікуванню, і подібних факторів, які добре відомі у медицині. Винахід відноситься також до застосування антитіл, запропонованих у винаході, для лікування пацієнта, що страждає раком, насамперед раком ободової кишки, легенів або підшлункової залози. Винахід відноситься також до способу лікування пацієнта, що страждає зазначеним захворюванням. У винаході запропонований також спосіб готування фармацевтичної композиції, що містить антитіло, запропоноване у винаході, в ефективній кількості у сполученні з фармацевтично прийнятним носієм, і застосування антитіла, запропонованого у винаході, у такому способі. Даний винахід відноситься також до застосування антитіла, запропонованого у винаході, в ефективній кількості для готування фармацевтичного агента, переважно у сполученні з фармацевтично прийнятним носієм, призначеного для лікування пацієнта, що страждає раком, насамперед раком ободової кишки, легенів або підшлункової залози. Опис послідовностей Таблиця 1 Антитіло 202 Легкий ланцюг антитіла хом'ячка CDR1L CDR2L CDR3L Важкий ланцюг антитіла хом'ячка CDR1H CDR2H CDR3H Гуманізований варіант легкого ланцюга 202-LC1 Гуманізований варіант легкого ланцюга 202-LC2 Гуманізований варіант легкого ланцюга 202-LC3 Гуманізований варіант легкого ланцюга 202-LC4 Гуманізований варіант важкого ланцюга 202-HC1 Гуманізований варіант важкого ланцюга 202-HC2 Гуманізований варіант важкого ланцюга 202-HC3 Гуманізований варіант важкого ланцюга 202-HC4 Гуманізований варіант важкого ланцюга 202-HC5 Гуманізований варіант важкого ланцюга 202-HC6 Гуманізований варіант важкого ланцюга 202-HC7 Гуманізований варіант важкого ланцюга 202-HC8 SEQ ID NO: 1 SEQ ID NO: 2 SEQ ID NO: 3 SEQ ID NO: 4 SEQ ID NO: 5 SEQ ID NO: 6 SEQ ID NO: 7 SEQ ID NO: 8 SEQ ID NO: 32 SEQ ID NO: 33 SEQ ID NO: 34 SEQ ID NO: 35 SEQ ID NO: 36 SEQ ID NO: 37 SEQ ID NO: 38 SEQ ID NO: 39 SEQ ID NO: 40 SEQ ID NO: 41 SEQ ID NO: 42 SEQ ID NO: 43 25 Таблиця 2 Антитіло 205 Легкий ланцюг антитіла хом'ячка CDR1L CDR2L CDR3L Важкий ланцюг антитіла хом'ячка CDR1H SEQ ID NO: 9 SEQ ID NO: 10 SEQ ID NO: 11 SEQ ID NO: 12 SEQ ID NO: 13 SEQ ID NO: 14 8 UA 105520 C2 Таблиця 2 Антитіло 205 Легкий ланцюг антитіла хом'ячка CDR2H CDR3H Гуманізований варіант легкого ланцюга 205-LC1 Гуманізований варіант легкого ланцюга 205-LC2 Гуманізований варіант легкого ланцюга 205-LC3 Гуманізований варіант легкого ланцюга 205-LC4 Гуманізований варіант важкого ланцюга 205-HC1 Гуманізований варіант важкого ланцюга 205-HC2 Гуманізований варіант важкого ланцюга 205-HC3 Гуманізований варіант важкого ланцюга 205-HC4 Гуманізований варіант важкого ланцюга 205-HC5 Гуманізований варіант важкого ланцюга 205-HC6 Гуманізований варіант важкого ланцюга 205-HC7 SEQ ID NO: 9 SEQ ID NO: 15 SEQ ID NO: 16 SEQ ID NO: 44 SEQ ID NO: 45 SEQ ID NO: 46 SEQ ID NO: 47 SEQ ID NO: 48 SEQ ID NO: 49 SEQ ID NO: 50 SEQ ID NO: 51 SEQ ID NO: 52 SEQ ID NO: 53 SEQ ID NO: 54 Таблиця 3 Антитіло 212 Легкий ланцюг антитіла хом'ячка CDR1L CDR2L CDR3L Важкий ланцюг антитіла хом'ячка CDR1H CDR2H_NPS CDR2H_NPA CDR2H_SPS CDR3H Гуманізований варіант легкого ланцюга 212-LC1 Гуманізований варіант легкого ланцюга 212-LC2 Гуманізований варіант легкого ланцюга 212-LC3 Гуманізований варіант легкого ланцюга 212-LC4 Гуманізований варіант легкого ланцюга 212-LC5 Гуманізований варіант легкого ланцюга 212-LC6 Гуманізований варіант важкого ланцюга 212-HC5 Гуманізований варіант важкого ланцюга 212-HC6 Гуманізований варіант важкого ланцюга 212-HC7 Гуманізований варіант важкого ланцюга 212-HC8 Гуманізований варіант важкого ланцюга 212-HC9 Гуманізований варіант важкого ланцюга 212-HC10 Гуманізований варіант важкого ланцюга 212-HC11 Гуманізований варіант важкого ланцюга 212-HC6NPA Гуманізований варіант важкого ланцюга 212-HC6SPS Гуманізований варіант важкого ланцюга 212-HC7NPA Гуманізований варіант важкого ланцюга 212-HC7SPS Гуманізований варіант важкого ланцюга 212-HC9NPA Гуманізований варіант важкого ланцюга 212-HC9SPS 9 SEQ ID NO: 17 SEQ ID NO: 18 SEQ ID NO: 19 SEQ ID NO: 20 SEQ ID NO: 21 SEQ ID NO: 22 SEQ ID NO: 23 SEQ ID NO: 74 SEQ ID NO: 75 SEQ ID NO: 24 SEQ ID NO: 55 SEQ ID NO: 56 SEQ ID NO: 57 SEQ ID NO: 58 SEQ ID NO: 59 SEQ ID NO: 60 SEQ ID NO: 61 SEQ ID NO: 62 SEQ ID NO: 63 SEQ ID NO: 64 SEQ ID NO: 65 SEQ ID NO: 66 SEQ ID NO: 67 SEQ ID NO: 68 SEQ ID NO: 69 SEQ ID NO: 70 SEQ ID NO: 71 SEQ ID NO: 72 SEQ ID NO: 73 UA 105520 C2 Таблиця 4 Людські константні області Людський легкий каппа-ланцюг Людський легкий лямбда-ланцюг Людський IgG1 (кавказький алотип) Людський IgG1 (афроамериканський алотип) Людський IgG1 LALA-мутант (кавказький алотип) Людський IgG4 Людський IgG4 SPLE-мутант 5 10 15 20 25 30 35 40 45 SEQ ID NO: 25 SEQ ID NO: 26 SEQ ID NO: 27 SEQ ID NO: 28 SEQ ID NO: 29 SEQ ID NO: 30 SEQ ID NO: 31 Наведені нижче приклади, перелік послідовностей і креслення дані з метою кращого розуміння даного винаходу, справжній обсяг якого представлений у прикладеній формулі винаходу. Варто розуміти, що у викладені процеси можна вносити модифікації без відхилення від сутності винаходу. Опис креслень На кресленнях показано: на фіг. 1 - вплив антитіл до TWEAK на ріст ксенотрансплантата людської карциноми підшлункової залози лінії Panc1; на фіг. 2 - вплив антитіл до TWEAK на ріст ксенотрансплантата людської карциноми нирки лінії ACHN. Приклад 1 Опис імунізації Імунізація вірменських (мишеподібних) хом'ячків людським/мишачим TWEAK Вірменських хом'ячків імунізували, використовуючи 50 мкг рекомбінантного людського розчинного TWEAK (амінокислоти 99-249) у день 0 у повному ад’юванті Фрейнда, у день 28 і день 56 (в обох випадках у неповному ад’юванті Фрейнда) і 50 мкг рекомбінантного мишачого розчинного TWEAK (амінокислоти 81-225) у день 84 у неповному ад’юванті Фрейнда, шляхом внутрішньочеревинної ін'єкції. Зразки крові відбирали у дні 108 і 91 і одержували сироватку, яку застосовували для визначення титру за допомогою ELISA (див. нижче). Відбирали тварин із найвищими титрами для повторної імунізації у день 112 шляхом внутрішньовенної ін'єкції 50 мкг рекомбінантного мишачого розчинного TWEAK, і відбирали антитіла на основі їх здатності зв'язуватися з людським або мишачим TWEAK (приклад 2), здатності нейтралізувати взаємодію людських і мишачих TWEAK/Fn14 (приклади 4 і 5) і здатності інгібувати секрецію IL8 (приклад 6). Крім того, оцінювали час напівжиття комплексу антитіло-TWEAK (приклад 3). Протипухлинну ефективність антитіл оцінювали з використанням ксенотрансплантатів людської карциноми підшлункової залози лінії Panc1 і ксенотрансплантатів людської карциноми нирки лінії ACHN. Приклад 2 Зв'язування з людським і мишачим TWEAK (ELISA) Зв'язування антитіл до TWEAK з людським і мишачим TWEAK оцінювали за допомогою ELISA. Людський або мишачий рекомбінантний TWEAK іммобілізували на 384-ямковому планшеті Nunc Maxisorp у дозі 1 мкг/мл, 25 мкл/ямку в 0,5M карбонатному буфері для сенсибілізації, pH 9,5, шляхом інкубації протягом ночі при 2-8°C. Після блокади планшета за допомогою ЗФР/1% БСА протягом 1 год при кімнатній температурі здійснювали дві стадії відмивання (0,1% Tween® 20 у ЗФР) та інкубацію з антитілами до TWEAK у різних концентраціях у блокуючому буфері або з супернатантами гібридоми антитіл протягом 1 год при кімнатній температурі. Після ще чотирьох відмивань антитіла ідентифікували за допомогою кон’югованого антитіла до HRР хом'яка, розведеного у співвідношенні 1:5000 у блокуючому буфері протягом 1 год при кімнатній температурі. Сигнал виявляли шляхом додавання ABTS® (фірма Roche Diagnostics GmbH) протягом 10-30 хв після ще чотирьох стадій відмивання. Абсорбцію зчитували при 405 нм. Приклад 3 Визначення часу напівжиття комплексів антитіло-TWEAK за допомогою Biacore-аналізу Застосовували пристрій Biacore 2000 у сполученні зі сенсибілізованим стрептавідином сенсором Biacore, що входить у систему. Використовували вхідний у систему буфер HBS-ET (10 мМ HEPES, pH 7,4, 150 мМ NaCl, 1 мМ ЕДТК, 0,05% Tween® 20) зі швидкістю потоку 100 мкл/хв. Буфер для зразка являв собою вхідний у систему буфер. Біотинілований людський розчинний TWEAK і біотинілований мишачий розчинний TWEAK іммобілізували на різних проточних 10 UA 105520 C2 5 10 осередках на SA-сенсорі з розрахунку 150 RU (одиниць відповіді) кожний. Проточний осередок FC1 використовували як контрольну референс-комірку. Кожне антитіло ін’єкували у систему у вигляді аналізованої речовини у концентрації 100нМ зі швидкістю 100 мкл/хв протягом 2 хв для оцінки часу асоціації. Моніторинг дисоціації імунокомплексів здійснювали протягом 5 хв. Поверхню сенсора відмивали HBS-ET протягом 10 с і регенерували, використовуючи 2×2 хв ін'єкції10мМ гліцину, pH 2,25. Цю процедуру здійснювали при 25°C. Стадію фази дисоціації комплексів, що має найменшу кінетичну швидкість, в інтервалі [240 с - 300 с] використовували для розрахунку швидкості реакції дисоціації kd [1/с] (програма Biacore Evaluation Software 4.0). Виходячи з рівняння t1/2 дис. = ln(2) / (60 × kd) розраховували час напівжиття (напівдисоціації) імунокомплексів у хв. Результати представлені у таблицях 5 і 6б. Таблиця 5 Людський TWEAK, t/2 дис. [хв] 25°C 53 н.о. 30 н.о. 20 13 Антитіло TW202 TW202chi TW205 TW205chi TW212 TW212chi 1) 15 20 25 30 35 40 45 хом’ячкове 1) химерне хом’ячкове 1) химерне хом’ячкове 1) химерне : людський легкий каппа-ланцюг SEQ ID NO: 25 і людський IgG1 SEQ ID NO: 27. Приклад 4 Нейтралізація взаємодії (людських) TWEAK-Fn14 Блокаду взаємодії людський TWEAK/людський Fn14 оцінювали за допомогою ELISA, призначеного для вивчення взаємодії з рецептором. 96-ямкові планшети Maxisorp® (фірма Nunc) сенсибілізували, використовуючи по 100 мкл/ямку взятого у концентрації 1 мкг/мл комплексу людський Fn14:Fc (позаклітинний домен людського Fn14 (амінокислоти 1-75), злитий з Fc-областю людського IgG1) у ЗФР, протягом 1,5 год при кімнатній температурі й блокували за допомогою 5%-ого розчину FBS у ЗФР протягом 30 хв при кімнатній температурі при струшуванні. Паралельно інкубували мічений за допомогою Flag розчинний TWEAK (амінокислоти 106-249) у концентрації 2,5 нг/мл у розчині, що блокує, з антитілами до TWEAK у різних концентраціях або супернатантом гібридоми протягом 2 год при кімнатній температурі при струшуванні. Після однократного відмивання сенсибілізованого Fn14 планшета за допомогою буфера для відмивання (0,1% Tween® 20 у ЗФР) 100 мкл розчину антитіла до TWEAK переносили у кожну ямку, і планшет інкубували протягом 1 год при кімнатній температурі з наступними чотирма відмиваннями буфером для відмивання. У ямки вносили 100 мкл ідентифікуючого антитіла до FLAG-HRP, розведеного у співвідношенні 1:5000 блокуючим буфером та інкубували протягом 1 год при кімнатній температурі. Після чотирьох додаткових стадій відмивання сигнал виявляли шляхом додавання 100 мкл розчину 3,3,5,5тетраметилбензидину (TMB) протягом приблизно 10 хв. Реакцію припиняли, додаючи 100 мкл 1н. HCl, і абсорбцію оцінювали при 450 нм (референс-хвиля 620 нм). Результати представлені у таблиці 6. Приклад 5 Нейтралізація взаємодії (мишачих) TWEAK-Fn14 Взаємодію мишачий TWEAK/мишачий Fn14 оцінювали за допомогою ELISA відповідно до принципу, аналогічному описаному для людських білків, але з використанням іншої системи виявлення, оскільки мишачий розчинний TWEAK не мітили. У цілому, метод полягав у наступному: планшети типу Maxisorp сенсибілізували комплексом мишачий Fn14:Fc (позаклітинний домен мишачого Fn14 (амінокислоти 1-75), злитий з Fc-областю людського IgG1) відповідно до методу, описаному для людського комплексу Fn14:Fc, з наступною блокадою й відмиванням. Мишачий розчинний TWEAK у концентрації 4 нг/мл попередньо інкубували з антитілами до TWEAK або супернатантом гібридоми у блокуючому буфері і 100 мкл суміші вносили в ямку сенсибілізованого Fn14 планшета. Після інкубації протягом 1 год при кімнатній температурі й чотирьох відмивань додавали протягом 1 год при кімнатній температурі біотиніловане антитіло до мишачого TWEAK у концентрації 125 нг/мл у блокуючому буфері, після чого здійснювали ще чотири стадії відмивання. Антитіло до TWEAK виявляли інкубацією з 11 UA 105520 C2 5 10 15 комплексом стрептавідин-HRP, розведеним у співвідношенні 1:5000 у блокуючому буфері протягом 30 хв при кімнатній температурі. Одержували сигнал і оцінювали абсорбцію відповідно до описаного вище методу. Результати представлені у таблиці 6. Приклад 6 Оцінка секреції IL-8 за допомогою ELISA Блокаду активності TWEAK за допомогою антитіл до TWEAK у клітинній системі оцінювали шляхом аналізу секреції IL-8 з використанням клітин меланоми лінії A375. По 10000 клітин лінії A375 (ATCC №CRL1619) висівали в ямку 96-ямкового планшета для культур клітин в 100 мкл живильного середовища (середовище DMEM, доповнене 4,5 г/л глюкози, піруватом і GlutaMAX™/10% FBS) та інкубували при 37°C/5% CO2 протягом 48 год. Людський рекомбінантний розчинний TWEAK у концентрації 300 нг/мл попередньо інкубували з антитілами до TWEAK у різних концентраціях у живильному середовищі протягом 30 хв при кімнатній температурі. Потім 50 мкл суміші додавали у кожну ямку планшета для клітин із наступною 48-годинною інкубацією, що забезпечувало секрецію IL-8. Відбирали 20 мкл клітинного супернатанту після центрифугування планшета протягом 5 хв при 200×g і змішували з 980 мкл каліброваного розріджувача RD5P, що входить у набір «CXCL8 Quantikine ELISA» (фірма R&D Systems). IL-8 виявляли за допомогою ELISA відповідно до інструкцій виробника. Результати представлені у таблиці 6. Таблиця 6a Антитіло TW-202 TW-202chi TW-205 TW-205chi TW-212 TW-212chi хом’ячкове химерне хом’ячкове химерне хом’ячкове химерне Інгібування взаємодії Людський TWEAK Мишачий TWEAK IC50 [нг/мл] IC50 [нг/мл] 9,2 9,0 11,8 11,8 8,8 5,1 11,8 5,9 15,1 4,6 13,4 5,7 Секреція IL-8 IC50 [нг/мл] 146 269 151 195 112 111 20 Таблиця 6б Інгібування взаємодії Антитіло 15 16 17 18 19 20 21 22 23 24 25 26 Секреція IL-8 Людський TWEAK IC50 [нг/мл] Мишачий TWEAK IC50 [нг/мл] IC50 [нг/мл] 14 22 14 16 15 35 12 17 13 20 42 94 5 7 6 6 7 14 5 5 6 8 18 36 141 163 146 189 253 401 224 249 242 165 475 222 12 Biacore-аналіз Людський TWEAK, t/2 дис. [хв] 25°C 18 15 18 16 17 15 17 14 17 15 17 16 UA 105520 C2 Таблиця 6в Антитіл о 15 16 17 18 19 20 21 22 23 24 25 26 5 10 15 Послідовність варіабельної області легкого ланцюга SEQ ID NO:57 SEQ ID NO: 57 SEQ ID NO: 57 SEQ ID NO: 57 SEQ ID NO: 57 SEQ ID NO: 57 SEQ ID NO:58 SEQ ID NO: 58 SEQ ID NO: 58 SEQ ID NO: 58 SEQ ID NO: 58 SEQ ID NO: 58 Послідовність варіабельної області важкого ланцюга SEQ ID NO: 68 SEQ ID NO: 69 SEQ ID NO: 70 SEQ ID NO: 71 SEQ ID NO: 72 SEQ ID NO: 73 SEQ ID NO: 68 SEQ ID NO: 69 SEQ ID NO: 70 SEQ ID NO: 71 SEQ ID NO: 72 SEQ ID NO: 73 Приклад 7 Протипухлинна ефективність антитіл до TWEAK відносно росту ксенотрансплантата людської карциноми підшлункової залози лінії Panc1 7 Схема досліду: Клітини лінії Panc1 (1×10 клітин/мишу) імплантували sc мишам з важким комбінованим дефіцитом з уродженою відсутністю природних клітин-кіллерів (SCID-beige) у день досліду 0 у комбінації з матригелем (1:1). Обробку починали у день 15 після імплантації. Дослід закінчували у день 56. Групи - Наповнювач, ip, 2×/тиждень, n=10 - 20 мг/кг TW202, ip, 2×/тиждень, n=10 - 20 мг/кг TW205, ip, 2×/тиждень, n=10 - 20 мг/кг TW212, ip, 2×/тиждень, n=10 Наприкінці досліду оцінювали кожну пухлину індивідуально. Результати представлені у таблиці 7. Таблиця 7 Panc1 наповнювач TW202 TW205 TW212 20 25 30 Середній об'єм 3 пухлин [мм ] 580,51 437,20 456,40 356,60 SD (середньоквадратичне відхилення) + 69,74 + 95,83 + 90,84 + 62,50 SEM (стандартна помилка) + 22,05 + 30,30 + 28,72 + 19,76 Дані про об'єми пухлин залежно від днів після імплантації пухлинних клітин представлені на фіг. 1. Приклад 8 Ефективність антитіл до TWEAK відносно росту ксенотрансплантата ниркової карциноми лінії ACHN 7 Схема досліду: Клітини лінії ACHN (1×10 клітин/мишу) імплантували sc у комбінації з матригелем (1:1) бестимусним «голим» мишам у день 0 досліду. Обробки починали у день 10 після імплантації. Дослід закінчували у день 40. Групи - Наповнювач ip, 2×/тиждень, n=10 - 20 мг/кг TW202, ip, 2×/тиждень, n=10 - 20 мг/кг TW205, ip, 2×/тиждень, n=10 - 20 мг/кг TW212, ip, 2×/тиждень, n=10 Наприкінці досліду визначали середній об'єм пухлин. Результати представлені у таблиці 8. 13 UA 105520 C2 Таблиця 8 ACHN Наповнювач TW202 TW205 TW212 Середній об'єм 3 пухлин [мм ] 596,04 161,28 151,64 217,12 SD (середньоквадратичне відхилення) +241,68 + 89,44 + 82,46 + 189,73 SEM (стандартна помилка) + 76,43 + 28,28 + 26,08 + 60,00 Дані про об'єми пухлин залежно від днів після імплантації пухлинних клітин представлені на фіг. 2. 5 ФОРМУЛА ВИНАХОДУ 10 15 20 25 30 35 40 1. Антитіло, що зв'язується з людським TWEAK, яке відрізняється тим, що містить a) CDR1H, послідовність якого представлена у SEQ ID NO:22, CDR2H, послідовність якого представлена у SEQ ID NО:23, CDR3H, послідовність якого представлена у SEQ ID NО:24, і CDR1L, послідовність якого представлена у SEQ ID NО:18, CDR2L, послідовність якого представлена у SEQ ID NO:19, CDR3L, послідовність якого представлена у SEQ ID NО:20; або b) CDR1H, послідовність якого представлена у SEQ ID NО:22, CDR2H, послідовність якого представлена у SEQ ID NО:74, CDR3H, послідовність якого представлена у SEQ ID NО:24, і CDR1L, послідовність якого представлена у SEQ ID NО:18, CDR2L, послідовність якого представлена у SEQ ID NО:19, CDR3L, послідовність якого представлена у SEQ ID NО:20; або c) CDR1H, послідовність якого представлена у SEQ ID NО:22, CDR2H, послідовність якого представлена у SEQ ID NО:75, CDR3H, послідовність якого представлена у SEQ ID NО:24, і CDR1L, послідовність якого представлена у SEQ ID NО:18, CDR2L, послідовність якого представлена у SEQ ID NО:19, CDR3L, послідовність якого представлена у SEQ ID NО:20. 2. Антитіло, що зв'язується з людським TWEAK, яке відрізняється тим, що містить комбінацію варіабельних областей, вибраних із групи, що включає варіабельні області легкого й важкого ланцюгів, які мають послідовності SEQ ID NО:57 і SEQ ID NО:68; SEQ ID NО:57 і SEQ ID NО:69; SEQ ID NO:57 і SEQ ID NО:70; SEQ ID NО:57 і SEQ ID NО:71; SEQ ID NО:57 і SEQ ID NО:72; SEQ ID NО:57 і SEQ ID NО:73; SEQ ID NО:58 і SEQ ID NО:68; SEQ ID NO:58 і SEQ ID NО:69; SEQ ID NО:58 і SEQ ID NО:70; SEQ ID NO:58 і SEQ ID NO:71; SEQ ID NО:58 і SEQ ID NО:72; SEQ ID NO:58 і SEQ ID NО:73. 3. Антитіло, що зв'язується з людським TWEAK, яке відрізняється тим, що містить CDR1Н, послідовність якого представлена у SEQ ID NО:22, CDR2H, послідовність якого представлена у SEQ ID NО:74, CDR3H, послідовність якого представлена у SEQ ID NО:24, і CDR1L, послідовність якого представлена у SEQ ID NО:18, CDR2L, послідовність якого представлена у SEQ ID NО:19, CDR3L, послідовність якого представлена у SEQ ID NО:20. 4. Антитіло, що зв'язується з людським TWEAK, яке відрізняється тим, що містить комбінацію варіабельних областей, вибраних із групи, що включає варіабельні області легкого й важкого ланцюгів, які мають послідовності SEQ ID NО:58 і SEQ ID NО:68. 5. Фармацевтична композиція, яка відрізняється тим, що містить антитіло за пп. 1-4. 6. Застосування антитіла за пп. 1-4 для приготування фармацевтичної композиції. 7. Антитіло за пп. 1-4 для використання для лікування раку. 8. Антитіло за пп. 1-4 для використання для лікування раку ободової кишки, легенів або підшлункової залози. 14 UA 105520 C2 15 UA 105520 C2 16 UA 105520 C2 17 UA 105520 C2 18 UA 105520 C2 19 UA 105520 C2 20 UA 105520 C2 21 UA 105520 C2 22 UA 105520 C2 23 UA 105520 C2 24 UA 105520 C2 25 UA 105520 C2 26 UA 105520 C2 27 UA 105520 C2 28
ДивитисяДодаткова інформація
Назва патенту англійськоюAntibodies against human tweak and uses thereof
Автори англійськоюBaehner, Monika, Knoetgen, Hendrik, Niewoehner, Jens
Автори російськоюНивьонер Йенс
МПК / Мітки
МПК: A61K 39/395, C07K 16/28, A61P 35/00
Мітки: tweak, антитіла, застосування, їхнє, людського
Код посилання
<a href="https://ua.patents.su/92-105520-antitila-do-lyudskogo-tweak-ta-khneh-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Антитіла до людського tweak та їхнє застосування</a>
Попередній патент: Спосіб репродукування клітинної тканини із jatropha curcas
Випадковий патент: Спосіб виплавляння сталі