Спосіб активації ендотелію ізольованого фрагмента судини у моделюванні ендотелійзалежних процесів та пристрій для їх моделювання
Номер патенту: 104363
Опубліковано: 27.01.2014
Автори: Паталах Ірина Іванівна, Таланов Сергій Олександрович, Сагач Вадім Федорович
Формула / Реферат
1. Спосіб активації ендотелію ізольованого фрагмента судини у моделюванні ендотелійзалежних процесів, який відрізняється тим, що ізолюють фрагмент судини, відмивають буферним розчином та фіксують в системі замкнутої циркуляції, після чого здійснюють пряму перфузію внутрішньої поверхні фрагмента судини зі збереженим моношаром ендотелію спершу біологічним розчином, потім - із додаванням прозапальних біохімічних агентів, наприклад пероксиду водню або тромбіну, із реєстрацією клітинної відповіді по накопиченню в перфузаті інтерлейкіну IL-6.
2. Пристрій для моделювання ендотелійзалежних процесів, який відрізняється тим, що містить непроточну муфту, в яку вставляється зафіксований на вхідному та вихідному штуцерах фрагмент судини, та втулки і затискачі для герметичного закріплення муфти на зовнішніх кінцях штуцерів, пристрій також містить контейнер з перфузатом, який разом із муфтою розміщений у водяній бані, а також перистальтичний насос, де для забезпечення прямої перфузії внутрішньої поверхні фрагмента судини елементи пристрою з'єднано з утворенням замкнутої системи циркуляції за допомогою еластичних трубок, при цьому контейнер з перфузатом з'єднано з вихідним штуцером.
Текст
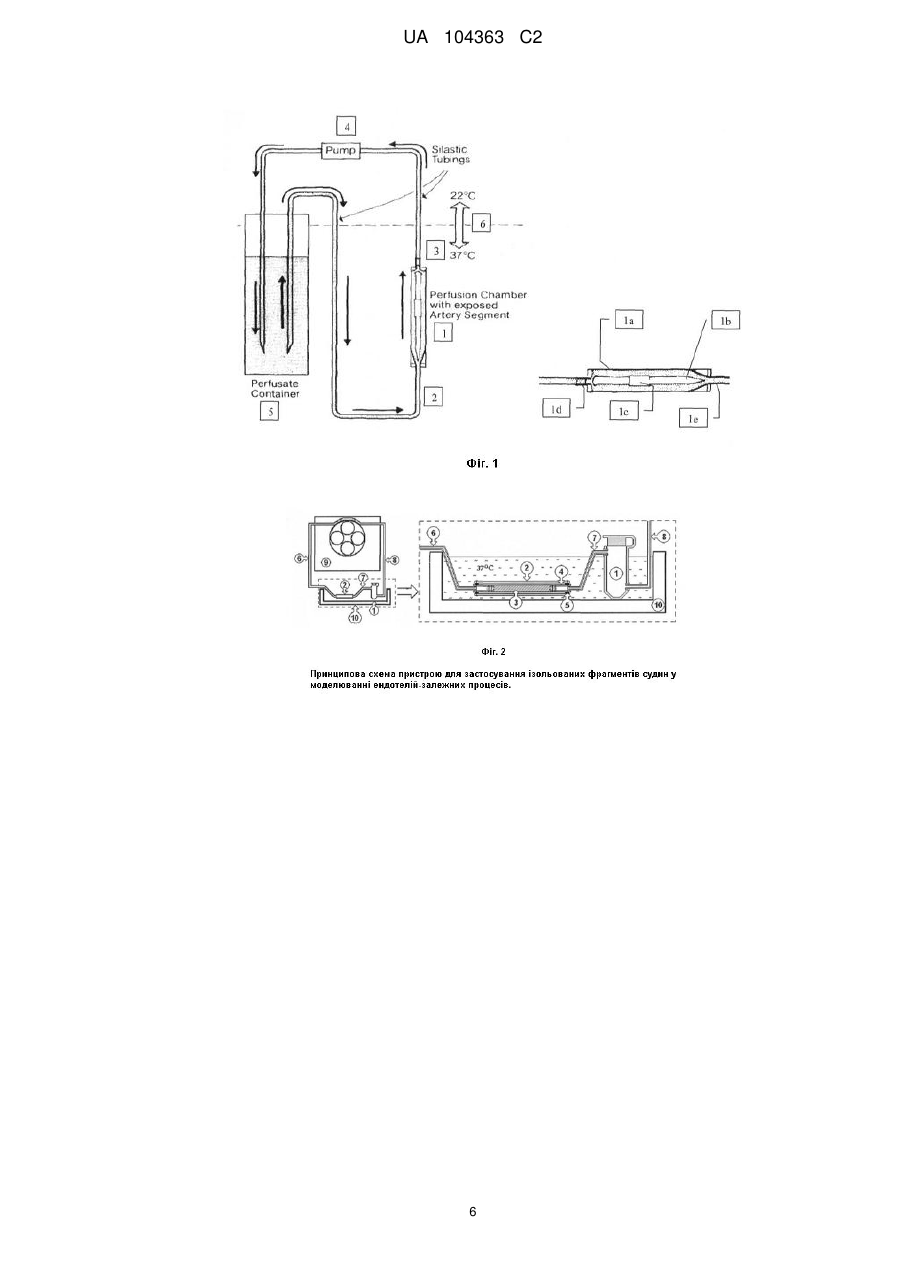
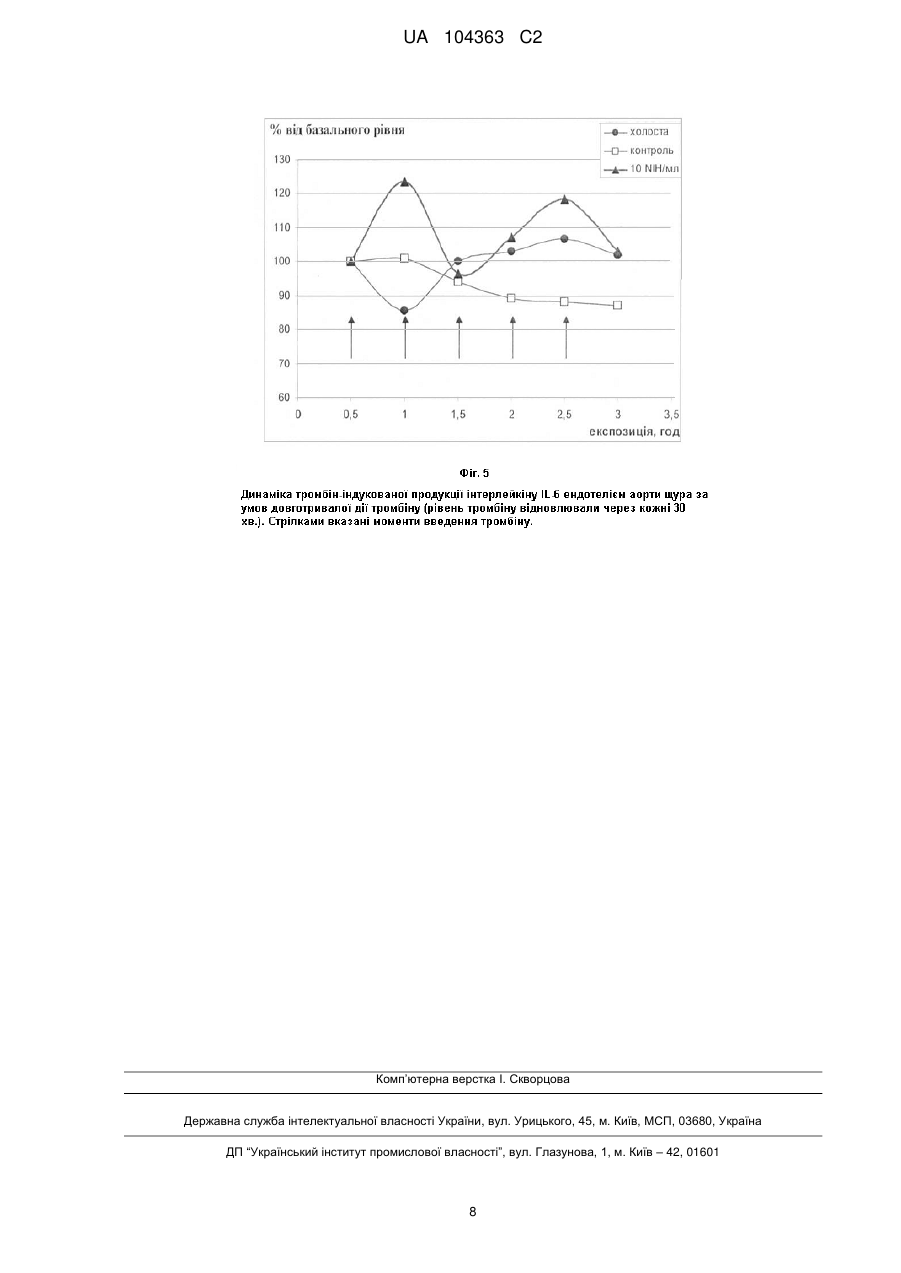
Реферат: UA 104363 C2 (12) UA 104363 C2 Винахід належить до галузі експериментальної медицини та лабораторної техніки і стосується відтворення механізму фізіологічної активації ендотелію для моделювання ендотелійзалежних процесів, таких як запалення, тромбоутворення і тромболізис у судинному руслі. За заявленим способом ізольований фрагмент судини відмивають буферним розчином та фіксують в системі замкнутої циркуляції, після чого здійснюють пряму перфузію внутрішньої поверхні фрагмента судини зі збереженим моношаром ендотелію спершу біологічним розчином, потім - із додаванням прозапальних біохімічних агентів, наприклад пероксиду водню або тромбіну, процес контролюють за динамікою накопичення в перфузаті інтерлейкіну-6. Заявлений пристрій містить непроточну муфту, в яку вставляється зафіксований на штуцерах фрагмент судини та яка герметично закріплюється на зовнішніх кінцях вказаних штуцерів, для забезпечення прямої перфузії внутрішньої поверхні фрагмента судини елементи пристрою з'єднано з утворенням замкнутої системи циркуляції за допомогою еластичних трубок, при цьому контейнер з перфузатом з'єднано з вихідним штуцером. UA 104363 C2 5 10 15 20 25 30 35 40 45 50 55 60 Винахід, що заявляється, стосується галузі експериментальної медицини та лабораторної техніки і може бути застосований для медико-біологічних досліджень участі ендотелію у фізіології кровообігу, загальній біохімії крові та системи гемостазу, а також у патологічних порушеннях кооперативності взаємодій клітинної й плазмової складових процесу тромбоутворення чи тромболізису. Згідно з сучасною науковою парадигмою патогенез тромбоутворення тісно пов'язаний із розвитком запалення в судинному руслі. Патогенез атеросклерозу також базується на уявленнях про запалення як основну етіологічну подію, яка провокує його виникнення та розвиток [1]. Поштовхом до ініціації запалення є активація ендотелію, що ініціює локальну адгезію лейкоцитів, тромбоцитів та ліпопротеїнів низької щільності (ЛНЩ), які прикріплюються до ендотелію в зоні пошкодження [2]. Активовані ендотеліоцити змінюють свій фенотип, втрачаючи захисні функції, та починають продукувати прозапальні молекули, інгібітори та активатори гемостазу, складні мультикомпонентні білкові комплекси тощо [3, 4]. Отже, активований ендотелій є необхідним чинником розвитку процесу запалення, а також регуляції обох ланок гемостазу, клітинної й гуморальної окрім коагуляції та запалення, ендотеліоцити залучаються до виконання таких важливих функцій як регуляція тонусу судин, проникність судинної стінки та ангіогенез [5]. Необхідність вивчення цих функцій потребує розробки методів дозованої активації ендотелію та контролю його стану за норми або за патологічних змін. Методи, відомі на сьогодні, пристосовані для роботи з клітинними лініями ізольованих ендотеліоцитів, які дозволяють легко змінювати діапазон експериментальних умов та реєструвати пряму клітинну відповідь на прозапальний стимул. Втім, ці методи непридатні для вивчення тих функцій ендотелію, які погребують участі інших клітин та позаклітинного матриксу судинної стінки. Певною мірою відтворюючи аутокринні взаємодії між ендотеліоцитами, такі методи не здатні моделювати ефекти паракринних кооперативних зв'язків між структурно зв'язаними компонентами судинної стінки (гладенько-м'язових клітин та фібробластів, колагенів субендотелію), які in vivo відіграють вирішальну роль у розвитку та підтримці процесів запалення, тромбоутворення та ремодулювання судинної стінки. Найбільш близьким до способу, що заявляється, вибрано спосіб залучення ізольованого фрагмента судини до моделювання процесів, локалізованих на поверхні судинної стінки, який описано в [6]. Даний спосіб був розроблений для вивчення взаємодій між тромбоцитами і адгезивними поверхнями судинної стінки (субендотелій або колагенові субстрати), він також дозволяє вивчати вплив реологічних параметрів або внесок різних структурних компонентів клітинної стінки у взаємодію клітин крові з поверхнею судини. В способі-прототипі фрагмент судини вивертають, видаляють моношар ендотелію та натягують інвертований фрагмент на стержень, вставлений в перфузійну камеру, приєднану до системи замкненої циркуляції біологічного розчину (перфузату), що забезпечує довготривалий (протягом 48 годин) контакт компонентів перфузату з субендотеліальними структурами судинної стінки та здійснюють стимуляцію клітин субендотелію за допомогою фізичних, біологічних та біохімічних стимулів; наявність впливу стимулюючого фактора реєструють за змінами морфології та функціональної активності клітин інвертованої судинної стінки. Спосіб передбачає наступну послідовність експериментальних процедур: 1. Через торакальний відділ аорту кроля інтенсивно промивають холодним фосфатним буфером (PBS), pН 7,4, видаляючи кров та моношар ендотелію, відділяють абдомінальну ділянку аорти та занурюють її в склянку з охолодженим PBS. 2. Ретельно видаляють сполучну та жирову тканини з зовнішньої поверхні фрагмента аорти. 3. Закріплюють один з кінців фрагмента на стержні товщиною 3,5 мм. 4. Вивертають судину, насуваючи її на стержень, що забезпечує вільний доступ до інтими. Майже повне "злущення" ендотеліальних клітин під час цієї маніпуляції відкриває доступ до субендотелію. 5. Відрізають інвертований фрагмент артерії від закріпленого кінця та пересувають на середню частину стержня. 6. Видаляють залишки ендотелію з поверхні судини серією дотиків смужками фільтрувального паперу та додатковою промивкою охолодженим PBS. 7. Стержень з надягнутим фрагментом аорти вносять в перфузійну камеру, яку приєднують до системи циркуляції. 8. Встановлюють робочий діапазон тиску в системі та здійснюють стимуляцію клітин шляхом зміни гідравлічного тиску чи внесенням адгезивних компонентів (клітин чи молекул). 9. По закінченні досліду фрагмент піддають фіксації у 2,5 % розчині глутарового альдегіду в 0,1 М диметиларсиновокислому (какодилатному) буфері. 1 UA 104363 C2 5 10 15 20 25 30 35 40 45 50 55 60 10. Після фіксації фрагмента судини оцінюють анатомічні і функціональні зміни стану ендотелію методами мікроскопії (електронної, скануючої, конфокальної), включаючи підрахунок клітин для якісної диференціації етапів адгезії та тромбоутворення. Основним недоліком даного способу застосування ізольованого фрагмента судини є повна відсутність ендотеліальних клітин на поверхні судинної стінки, що обумовлює його непридатність для вивчення ендотелій-залежних процесів. Крім того, даний спосіб передбачає реєстрацію клітинної відповіді однократно, після завершення терміну експозиції та погано пристосований для дослідження динаміки процесів взаємодії ендотелію з компонентами перфузату. Для здійснення способу-прототипу застосовується пристрій [6], який є найближчим аналогом пристрою, що заявляється. Як показано на фіг. 1, пристрій-прототип [6] є системою замкненої перфузії, яка складається з основного блока - герметичної перфузійної камери 1, де розміщено інвертований фрагмент судини 1с, та допоміжних елементів - з'єднувальних силіконових трубок 2 і 3, перистальтичного насоса 4, відкритого контейнера з перфузатом 5 та водяної бані 6. Перфузійна камера 1 складається з зовнішнього циліндра 1а та центрального стержня 1b завдовжки 75 мм і діаметром 3,5 мм. Через зовнішній і внутрішній порти (із поперечним перерізом 3 мм) відповідно 1d та 1е, камера 1 послідовно з'єднується вхідною трубкою 2 та вихідною трубкою 3 з контейнером 5, в якому знаходиться перфузат (кров з антикоагулянтами або суспензія відмитих клітин крові), вихідна трубка 3 з'єднана також з перистальтичним насосом 4, який забезпечує циркуляцію перфузату. Перфузат подається через вхідний порт 1d через чотири отвори в дископодібній основі стержня і тече між зовнішньою стінкою циліндра і поверхню стержня, омиваючи надягнутий на стержень інвертований фрагмент судини 1с. Фізіологічну температуру (37 °C) підтримує водяна баня 6, в яку занурюються контейнер 5 та перфузійна камера 1. Об'єм перфузату для рециркуляції складає приблизно 20 мл. Умови, які забезпечує даний тип камери, дозволяють працювати у фізіологічному діапазоні тисків і температур. Недоліком даного пристрою є його придатність виключно для інкубації інвертованих фрагментів судини, що досягається шляхом перфузії камери, в якій знаходиться стержень із зафіксованим на ньому фрагментом судини. Даний пристрій не може бути використаний для експериментів на ендотелії, який у неушкодженому вигляді повинен зберігатися на внутрішній поверхні судинної стінки. Ще одним недоліком пристрою є завеликий робочий об'єм, що обмежує можливості використання високовартісних тест-систем та реагентів (зокрема, високоочищених білків крові). Задачею способу, що заявляється., є розробка способу використання ізольованих фрагментів судини зі збереженим моношаром клітин ендотелію, які залишаються структурною складовою судинної стінки, щоб забезпечити більш коректне відтворення в модельній системі in vitro таких ендотелійзалежних подій як запалення чи оклюзія судини, які відбуваються в судинному руслі in vivo. Поставлена задача вирішується тим, що в способі, що заявляється, фрагмент судини, на внутрішній поверхні якого зберігається моношар нативного ендотелію, піддають прямій перфузії в системі замкненої циркуляції біологічного розчину (перфузату) та здійснюють стимуляцію нативного ендотелію протягом 1,5-3 годин шляхом однократного чи періодичного внесення в циркуляторне русло через спеціальний вхідний контейнер біохімічних прозапальних агентів; процес стимуляції контролюють за динамікою накопичення в перфузаті молекулярного маркера запалення інтерлейкіну-6, який ендотеліальні клітини секретують у відповідь на стимулюючу дію прозапального агента. Концентрацію інтерлейкіну в біологічних зразках оцінюють за допомогою такого високочутливого методу як твердофазний імуноферментний аналіз (ELISA). Задача винаходу, що заявляється, є також удосконалення пристрою для моделювання процесів, локалізованих на внутрішній поверхні ізольованого фрагмента судини, на якій збережено нативний ендотелій. Технічним результатом винаходу є можливість відтворювати механізм фізіологічної активації ендотелію для моделювання процесів запалення, тромбоутворення і тромболізису в судинному руслі. Поставлена задача вирішується тим, що пристрій, який заявляється (фіг. 2), на відміну від пристрою-прототипу дозволяє здійснювати пряму перфузію ендотелію ізольованого фрагмента судини, що дозволяє вивчати контакти ендотелію, з одного боку, з агентами, що циркулюють у перфузаті, а з другого - з компонентами інтими та медії судинної стінки; пристрій забезпечує збереження структури і функцій ендотелію за рахунок захисту ізольованого фрагмента спеціальною муфтою, а також за рахунок зміни функціонального призначення та форми контейнера: його мініатюризація, герметизація кришкою та максимальне наближення до муфти з фрагментом судини забезпечує можливість стимуляції клітин ендотелію та наступну 2 UA 104363 C2 5 10 15 20 25 30 35 40 45 50 55 60 реєстрацію клітинної відповіді без втручання в судинний простір; зменшення загального робочого об'єму системи циркуляції дозволяє здійснювати стимуляцію ендотелію низькими (фізіологічними) концентраціями біохімічних прозапальних агентів, що значно здешевлює модельну систему та наближує її умови до фізіологічних. Пристрій, що заявляється, (фіг. 2) є системою замкненої перфузії, яка складається з основного блоку та допоміжних елементів. В основний блок входять близько з'єднані герметичний вхідний контейнер 1 та непроточна силіконова муфта 2 з нативним фрагментом судини 3. Допоміжні елементи представлені системою з'єднувальних трубок 6, 7 та 8, перистальтичним насосом 9, а також водяною банею 10. Вхідний контейнер 1 має об'єм 1,5 мл та призначений для заповнення системи перфузатом, для внесення індукторів запалення, активаторів чи інгібіторів зсідання крові та інших гуморальних факторів, а також для відбору проб. В прозору силіконову муфту 2 із внутрішнім діаметром 5 мм розміщують фрагмент судини 3. На відміну від прототипу розчин Кребса вводять в замкнений об'єм муфти 2, де він не циркулює, а лише змочує зовнішню поверхню фрагменту судини та підтримує гомеостатичні умови його інкубації. Досягають герметичності захисної силіконової муфти 2 шляхом її закріплення металевими затискачами на гумових втулках 5 з зовнішнім діаметром 0,5 мм. Для з'єднання фрагмента 3 судини з системою циркуляції застосовують жорсткі конічні пластикові штуцери 4, на яких фрагмент судини закріплено лігатурами. Замкнута система еластичних трубок 6, 7 і 8 загальною довжиною 750 мм із внутрішнім діаметром 1,5 мм забезпечує перфузію фрагмента судини 3 довжиною 30 мм. Циркуляцію перфузату в системі забезпечують за допомогою перистальтичного насоса 9. Конструкція пристрою передбачає також використання багатоканального перистальтичного насоса, що дозволяє одночасно працювати з 2-3 фрагментами судин, що, в свою чергу, дає змогу стандартизувати умови для контрольних і дослідних варіантів. Даний пристрій, подібно до прототипу, дозволяє регулювати швидкість потоку та вивчати вплив реологічних факторів на досліджувані показники. Муфту 2 з фрагментом судини 3 і контейнером 1 розміщують у водяній бані 10, в якій підтримують фізіологічну температуру (t=37 °C). Дана конструкція перфузійної системи дозволяє зберігати функціональну активність ендотелію судинної стінки протягом 3-х годин і більше. Дана конструкція забезпечує оптимальне співвідношення між площею внутрішньої поверхні судинного фрагмента та робочим об'ємом рідини в камері, що дозволяє реєструвати динаміку накопичення у розчині ендотеліальних факторів у відповідь на дію прозапальних індукторів. Спосіб та пристрій, що заявляються, можуть мати й більш широке застосування, наприклад, ендотелій, активований за даним способом і з використанням наведеного пристрою, може бути застосований для імітації окремих стадій тромбоутворення та тромболізису або для вивчення впливу ендотеліальних факторів на коагуляцію та фібриноліз. Для відтворення послідовності подій, що приймають участь у розвитку і формуванні тромба, в модельну систему після активації ендотелію слід дозовано внести активатори чи інгібітори зсідання крові та дослідити вплив ендотелію на систему гемостазу безпосередньо, як матрикс для збирання примембранних білкових комплексів, здатних суттєво впливати на швидкість утворення фібрину, або опосередковано, як джерело секреції білків-регуляторів системи гемостазу (зокрема, тканинного активатора плазміногену (tPA) та інгібітора тканинного активатора плазміногену типу 1 (РАІ-1). Для пояснення суті розробки, що заявляється, нижче наведено приклади конкретного застосування запропонованих способу та пристрою для активації ендотелію ex vivo. Приклад 1. Моделювання гострої та хронічної прозапальної дії пероксиду водню на ендотелій аорти щура. 1. Відпрепаровують фрагмент аорти щура після введення тварині наркозу за стандартною процедурою. З цією метою на аорту вище фрагмента, що буде вилучений, накладають лігатуру та роблять розріз в верхній ділянці судини. Потім в розріз аорти встромляють пластикову канюлю, з'єднану гнучкою трубкою з медичним шприцом, заповненим розчином Кребса, нагрітим до 37 °C. На 4 см нижче першого розрізу роблять другий, після чого за допомогою медичного шприца обережно вводять теплий розчин Кребса у кількості, достатній для відмивання від крові ділянки, яка буде відпрепарована. 2. Після відмивання канюлю прибирають та відділяють фрагмент аорти по попередніх розрізах, притримуючи пінцетом за кінці та мінімально порушуючи шар сполучної тканини на його зовнішній поверхні. На пластикові штуцери обережно надягають судину та закріплюють її кінці лігатурами. З іншого кінця на відстані 5 мм від кінців судини на штуцера надягають гумові втулки та фіксують на них муфту після надягання її на судину. Фрагмент судини розміщують в силіконовій муфті, попередньо надягнутої на вхідну з'єднувальну трубку. Ізольований у муфті 3 UA 104363 C2 5 10 15 20 25 30 35 40 45 50 55 фрагмент через зовнішні кінці штуцерів приєднують через контейнер 1 до системи циркуляції та розміщують у водяній бані 10. Фрагмент орієнтують, враховуючи проксимальний та дистальний кінці, так, щоб відтворити фізіологічний напрямок току рідини. Подібним чином готують ще один, контрольний, фрагмент судин. 3. Підключають систему трубок до багатоканального насоса. Третій канал перистальтичного насоса використовують для холостої проби (замість судини використовують фрагмент трубки подібного діаметра та довжини). 4. За допомогою перистальтичного насоса 9 через контейнер 1 у систему циркуляції кожного фрагмента та в канал без фрагмента вносять 2,6-2,8 мл (що дорівнює робочому об'ємові даної перфузійної системи) дослідної рідини. Заповнюючи кожну систему циркуляції слідкують, щоб з неї було повністю витиснене повітря. Після заповнення контейнер 1 кожної системи герметично закривають. Вмикають перистальтичний насос та встановлюють робочу швидкість потоку. 5. Для стабілізації стану фрагментів судин забезпечують циркуляцію перфузату протягом 20 хв. 6. Через контейнер 1 замінюють розчин Кребса робочим розчином. Як робочий розчин (перфузату) використовують аутологічну сироватку щура у розведенні 1:1, яку отримують з крові, відібраної з аорти після розтину. Це може бути також фізіологічний розчин або буферна система, аутологічна плазма або сироватка піддослідного щура, плазма або сироватка людини, а також суспензія відмитих клітин крові щурів чи людини. Інкубують фрагмент судини в режимі циркуляції робочого розчину протягом 10 хв. 7. Припинивши циркуляцію розчину, швидко відбирають з камери контрольні (фонові) проби. 8. Для моделювання гострого впливу через контейнер однократно вносять 30 мкл 1 мМ розчину пероксиду водню, отримуючи кінцеву концентрацію 1-12 мкМ. Вмикають перистальтичний насос, фіксуючи час. Першу пробу відбирають на 30-й хв., з третьої по четверту - з інтервалом в 0,5 год. Для моделювання хронічного впливу вносять аналогічні об'єми пероксиду водню через 15, 30, 60, 90 та 120 хв. одразу після відбору проби. Розчин Н2О2 додають разом з сироваткою, коли відновлюють її рівень в системі після чергового відбору проби (0,1 мл). Кожний дослід виконують протягом двох годин. 9. Активацію ендотелію визначають за накопиченням в циркулюючому розчині інтерлейкіну 6 (IL-6) - прозапального маркера активації ендотеліоцитів. Відібрані проби (по 0,1 мл) короткотерміново зберігають при -20 °C у замороженому стані до проведення аналізу на вміст IL-6. Концентрацію IL-6 визначають методом твердофазного імуноферментного аналізу з використанням тест-системи "Rat IL-6 ELISA" (Bender MedSystem GmbH, Austria). Результати прикладу 1 подано на фіг. 3. Спосіб та пристрій, що заявляються, дозволяють за одноразового введення Н 2О2 підтримувати активований стан ендотелію протягом 60 хв., після чого відбувається поступове затухання активаційного сигналу. За періодичного введення Н2О2 встановлення максимального рівня продукції IL-6 прискорюється (40 хв.), а активований стан ендотелію підтримується не менш ніж 2 год. Приклад 2. Моделювання гострої та хронічної прозапальної дії тромбіну людини на ендотелій аорти щура. 1. Здійснюють препарування фрагментів аорти щура та підготовку перфузійної камери так, як описано в пунктах 1-3 прикладу 1. 2. Замінюють розчин Кребса робочим розчином (0,05 М трис-НСІ буфер, рН 7,4). Інкубують фрагмент судини в режимі циркуляції робочого розчину протягом 10 хв. Припинивши циркуляцію розчину, швидко відбирають з контейнера контрольні (фонові) проби, вносять робочу дозу тромбіну і знов вмикають систему, фіксуючи час. Тромбін людини, для якого властива самостійна прозапальна дія, в даному експерименті вводять з метою активації судинного ендотелію, який у відповідь на сигнал запалення здатен підсилювати секрецію прозапальних агентів. 3. Реакцію ендотелію на прозапальну дію тромбіну відстежують за накопиченням в циркулюючому розчині інтерлейкіпу 6 (IL-6) (див. пункт 7 прикладу 1). Для цього проби (по 0,2 мл) відбирають протягом трьох годин через кожні півгодини та короткотерміново зберігають у замороженому стані за температури -20 °C до проведення аналізу на вміст IL-6. За допомогою способу та пристрою, що заявляються, було з'ясовано, що у відповідь на однократне введення тромбіну ендотелій повільно підсилює подукцію IL-6 протягом першої години. Через 1,5 год. після введення тромбіну рівень IL-6 досягає максимальних значень, а потім швидко спадає (фіг. 4). Подібна реакція ендотелію розвивалась у відповідь на дію тромбіну людини в концентрації 7 NIH/мл, вдвічі зменшена доза (3,5 NIH/мл) була за межами 4 UA 104363 C2 5 10 15 20 25 30 35 40 45 порогу активації, бо рівень маркеру активації ендотелію майже не відрізнявся від фонового протягом всього часу експозиції, (фіг. 4). За умов періодичного введення тромбіну (п'ятикратне, з інтервалом 0,5 год., концентрація 10 NIH/мл) реакція ендотелію набуває періодичного характеру, про що свідчить два піка секреції IL-6 - через 0,5 год. та через 2 год. після введення тромбіну (фіг. 5). Отже, запропонований спосіб та пристрій для його здійснення дозволяють змінювати характер вхідного стимулюючого сигналу за природою, інтенсивністю та терміном дії, а також отримати кількісну оцінку відповіді інтактного ендотелію за допомогою IL-6, маркера активації ендотеліальних клітин. Фізичні параметри системи дозволяють реєструвати зростання концентрації IL-6 в межах 10-30 % від фонового рівня. За допомогою заявленого способу і пристрою для його здійснення можна відтворювати механізм фізіологічної активації ендотелію для моделювання процесів запалення, тромбоутворення і тромболізису в судинному руслі. Джерела інформації: 1. Fazel S., Weisel R.D., Verma S. A novel technique to assess flow-mediated vasodilation. // J. Am. Coll. Cardiol., 2004; 44:1478-1480. 2. Semeraro N., Colucci M. Changes in the coagulation-fibrinolysis balance of endothelial cells and mononuclear phagocytes: role in disseminated intravascular coagulation associated with infectious diseases // Intern. J. Clinic. & Lab. Research. - Vol. 21, N 2-4. - P. 214-220. 3. Simoncini S, Njock MS, Robert S, Camoin-Jau L, Sampol J, Harle JR, et al. TRAIL/Apo2L mediates the release of procoagulant endothelial microparticles induced by thrombin in vitro: a potential mechanism linking inflammation and coagulation. Circ Res 2009; 104:943-951. 4. Sironi M, Breviario F, Proserpio P, Biondi A, Vecchi A, Van Damme J, Dejana E, Mantovani A. IL-1 stimulates IL-6 production in endothelial cells. // J. Immunol. - 1989. - 142(2). - P. 549-53. 5. Ross, R. The smooth muscle cell. II. Growth of smooth muscle in culture and formation of elastic fibers. // J. Cell Biol-1971. - 50. - P. 172-186. 6. Sakariassen K.S., Muggli R., Baumgartner H. R. Measurements of Platelet Interaction with Components of the Vessel Wall in Flowing Blood // Methods in enzymology. 1989. - Vol. 169. - P. 3770. ФОРМУЛА ВИНАХОДУ 1. Спосіб активації ендотелію ізольованого фрагмента судини у моделюванні ендотелійзалежних процесів, який відрізняється тим, що ізолюють фрагмент судини, відмивають буферним розчином та фіксують в системі замкнутої циркуляції, після чого здійснюють пряму перфузію внутрішньої поверхні фрагмента судини зі збереженим моношаром ендотелію спершу біологічним розчином, потім - із додаванням прозапальних біохімічних агентів, наприклад пероксиду водню або тромбіну, із реєстрацією клітинної відповіді по накопиченню в перфузаті інтерлейкіну IL-6. 2. Пристрій для моделювання ендотелійзалежних процесів, який відрізняється тим, що містить непроточну муфту, в яку вставляється зафіксований на вхідному та вихідному штуцерах фрагмент судини, та втулки і затискачі для герметичного закріплення муфти на зовнішніх кінцях штуцерів, пристрій також містить контейнер з перфузатом, який разом із муфтою розміщений у водяній бані, а також перистальтичний насос, де для забезпечення прямої перфузії внутрішньої поверхні фрагмента судини елементи пристрою з'єднано з утворенням замкнутої системи циркуляції за допомогою еластичних трубок, при цьому контейнер з перфузатом з'єднано з вихідним штуцером. 5 UA 104363 C2 6 UA 104363 C2 7 UA 104363 C2 Комп’ютерна верстка І. Скворцова Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 8
ДивитисяДодаткова інформація
Автори англійськоюSahach Vadym Fеdоrоvусh
Автори російськоюСагач Вадим Федорович
МПК / Мітки
МПК: G09B 23/28
Мітки: судині, ендотелію, ендотелійзалежних, ізольованого, пристрій, спосіб, моделюванні, моделювання, фрагмента, активації, процесів
Код посилання
<a href="https://ua.patents.su/10-104363-sposib-aktivaci-endoteliyu-izolovanogo-fragmenta-sudini-u-modelyuvanni-endotelijjzalezhnikh-procesiv-ta-pristrijj-dlya-kh-modelyuvannya.html" target="_blank" rel="follow" title="База патентів України">Спосіб активації ендотелію ізольованого фрагмента судини у моделюванні ендотелійзалежних процесів та пристрій для їх моделювання</a>
Попередній патент: Чорний керамічний пігмент
Наступний патент: Спосіб одержання рекомбінантних штамів дріжджів saccharomyces cerevisiae з підвищеною активністю лужної фосфатази
Випадковий патент: Спосіб прогнозування зрощення перелому