Інгібітор впливу амілоїдних білків
Формула / Реферат
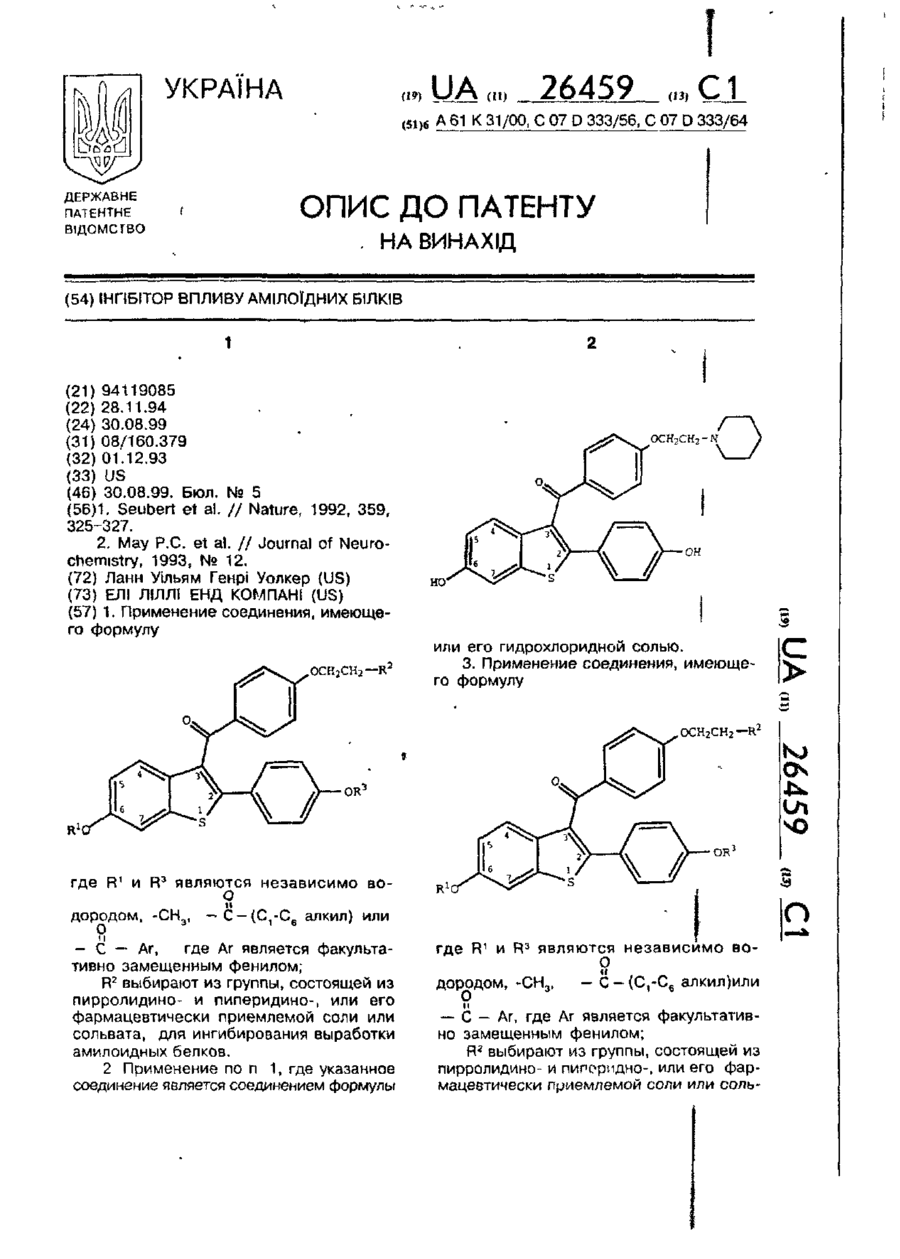
1. Применение соединения, имеющего формулу
где R1 и R3 являются независимо водородом, где Ar является факультативно замещенным фенилом;
R2 выбирают из группы, состоящей из пирролидино- и пиперидино-, или его фармацевтически приемлемой соли или сольвата, для ингибирования выработки амилоидных белков.
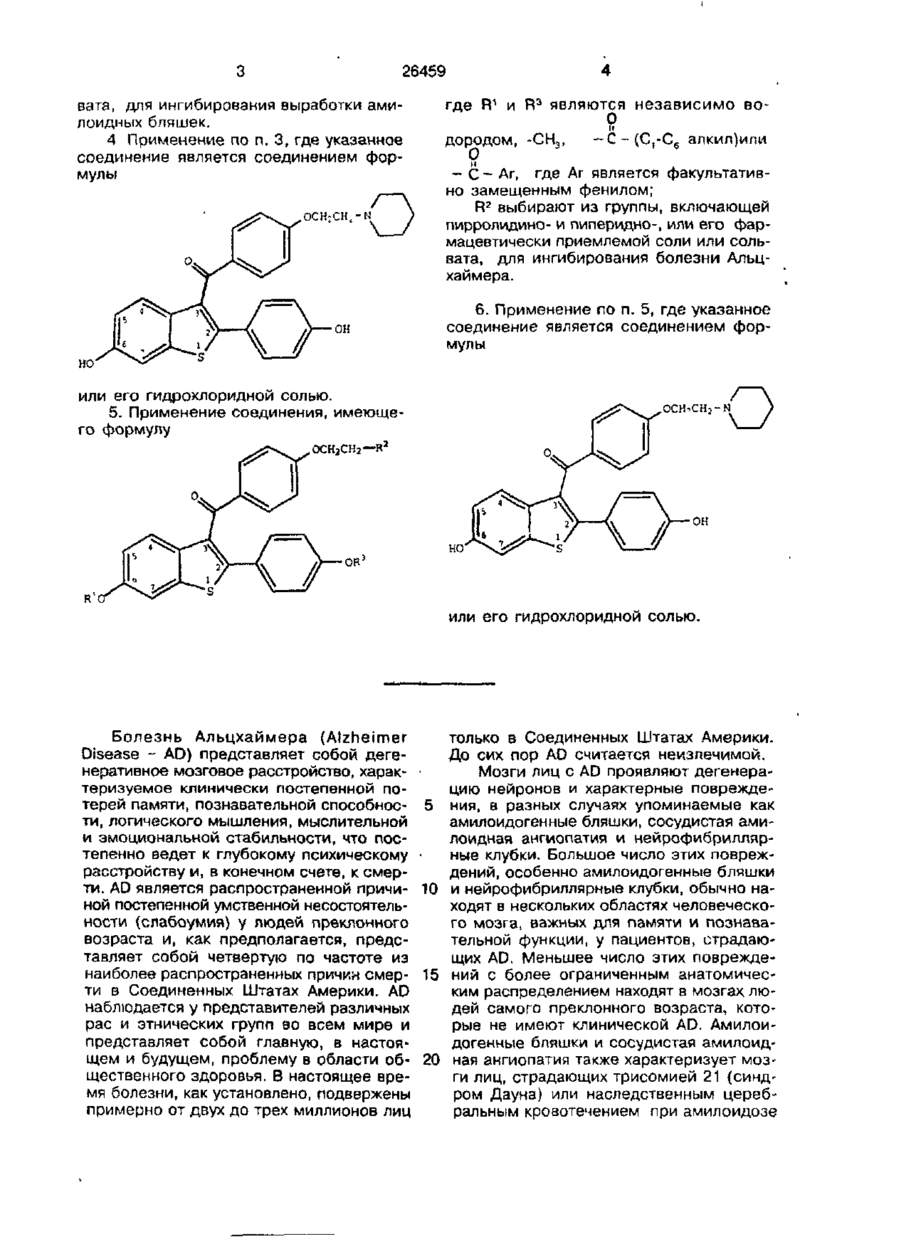
2. Применение по п.1, где указанное соединение является соединением формулы
или его гидрохлоридной солью.
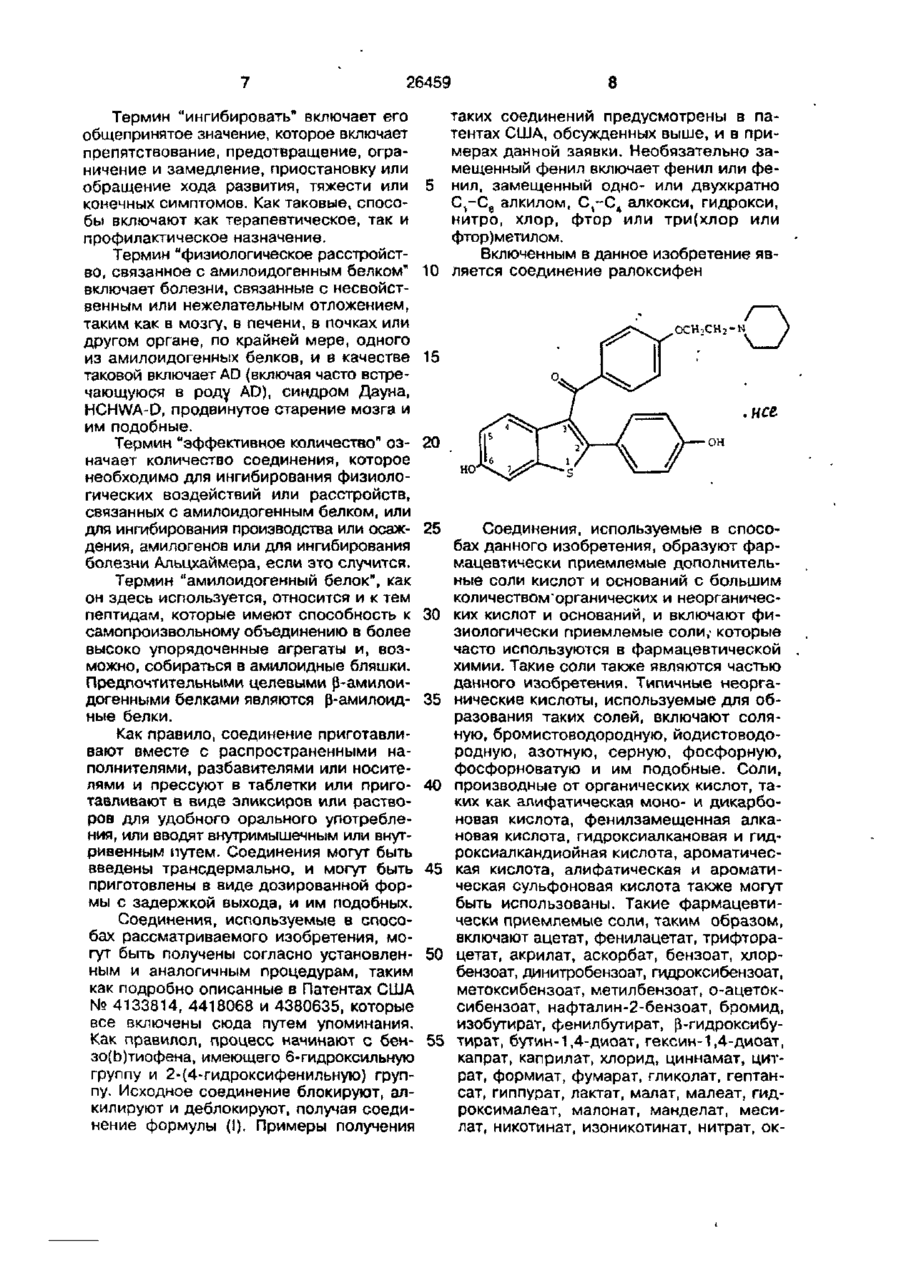
3. Применение соединения, имеющего формулу
где R1 и R3 являются независимо водородом, где Ar является факультативно замещенным фенилом;
R2 выбирают из группы, состоящей из пирролидино- и пиперидино-, или его фармацевтически приемлемой соли или сольвата, для ингибирования выработки амилоидных бляшек.
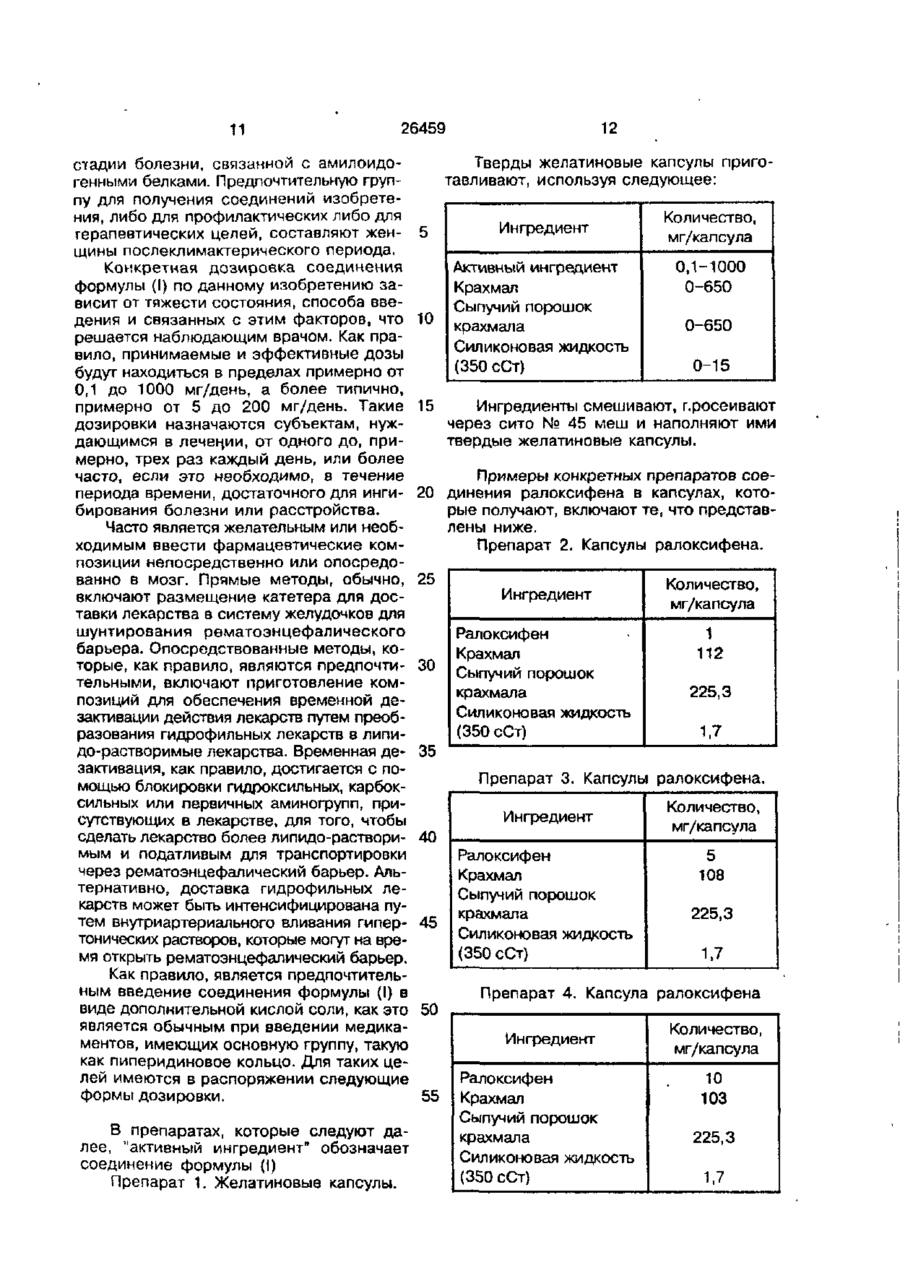
4. Применение по п.3, где указанное соединение является соединением формулы
или его гидрохлоридной солью.
5. Применение соединения, имеющего формулу
где R1 и R3 являются независимо водородом, где Ar является факультативно замещенным фенилом;
R2 выбирают из группы, включающей пирролидино- и пиперидино-, или его фармацевтически приемлемой соли или сольвата, для ингибирования болезни Альцхаймера.
6. Применение по п.5, где указанное соединение является соединением формулы
или его гидрохлоридной солью.
Текст
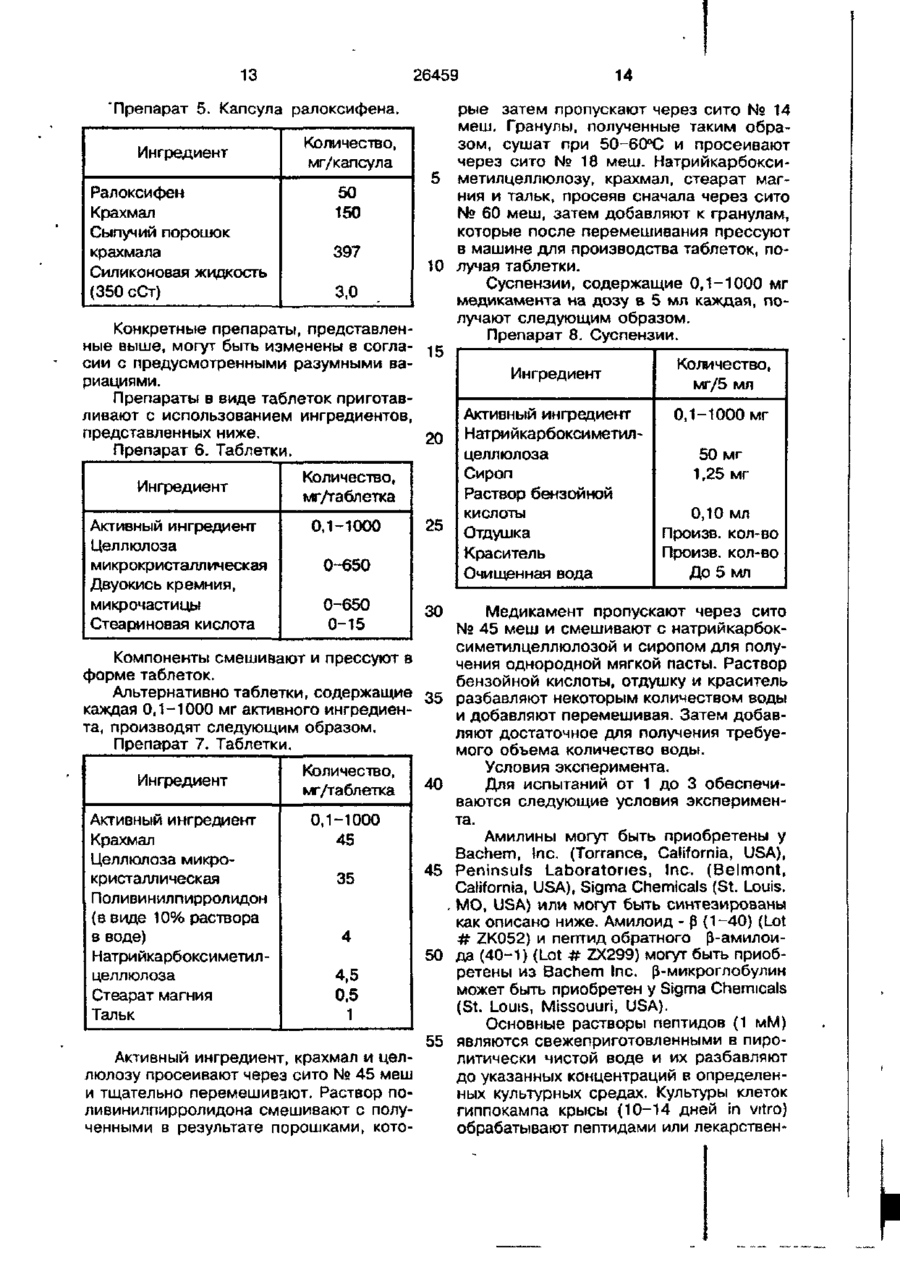
1. Применение соединения, имеющего формулу ОСК2СН2—R' или его гидрохлоридной солью. 3. Применение соединения, имеющего формулу осн 2 сн 2 — .и OR' где R1 и R3 являются независимо во о О и дородом, -СН3, — С-(С,-С 6 алкил) или и - С — Аг, где Аг является факультативно замещенным фенилом; R2 выбирают из группы, состоящей из пирролидино- и пиперидино-, или его фармацевтически приемлемой соли или сольвата, для ингибирования выработки амилоидных белков. 2 Применение по п 1, где указанное соединение является соединением формулы где R1 и R3 являются независимо во о дородом, -СН3, II - С - (С,-С6 алкил)или — С — Аг, где Аг является факультативно замещенным фенилом; R2 выбирают из группы, состоящей из пирролидино- и пипоридно-, или его фармацевтически приемлемой соли или соль 26459 где R1 и R3 являются независимо во вата, для ингибирования выработки амилоидных бляшек. 4 Применение по п. 3, где указанное соединение является соединением формулы о If дородом, -СН3, ~ С - ( С Г С 6 алкил)или - С - Аг, где Аг является факультативно замещенным фенилом; R2 выбирают из группы, включающей пирролидино- и пиперидно-, или его фармацевтически приемлемой соли или сольвата, для ингибирования болезни Альцхаймера. OCH:CH,-N 6. Применение по п. 5, где указанное соединение является соединением формулы или его гидрохлоридной солью. 5. Применение соединения, имеющего формулу ,ОСН 2 СН 2 —R 3 или его гидрохлоридной солью. Болезнь Альцхаймера (Alzheimer Disease - AD) представляет собой дегенеративное мозговое расстройство, характеризуемое клинически постепенной потерей памяти, познавательной способности, логического мышления, мыслительной и эмоциональной стабильности, что постепенно ведет к глубокому психическому расстройству и, в конечном счете, к смерти. AD является распространенной причиной постепенной умственной несостоятельности (слабоумия) у людей преклонного возраста и, как предполагается, представляет собой четвертую по частоте из наиболее распространенных причин смерти в Соединенных Штатах Америки. AD наблюдается у представителей различных рас и этнических групп во всем мире и представляет собой главную, в настоящем и будущем, проблему в области общественного здоровья. В настоящее время болезни, как установлено, подвержены примерно от двух до трех миллионов лиц 5 10 15 20 только в Соединенных Штатах Америки. До сих пор AD считается неизлечимой. Мозги лиц с AD проявляют дегенерацию нейронов и характерные повреждения, а разных случаях упоминаемые как амилоидогенные бляшки, сосудистая амилоидная аигиопатия и нейрофибриллярные клубки. Большое число этих повреждений, особенно амилоидогенные бляшки и нейрофибриллярные клубки, обычно находят в нескольких областях человеческого мозга, важных для памяти и познавательной функции, у пациентов, страдающих AD. Меньшее число этих повреждений с более ограниченным анатомическим распределением находят в мозгах людей самого преклонного возраста^ которые не имеют клинической AD. Амилоидогенные бляшки и сосудистая амилоидная ангиопатия также характеризует мозги лиц, страдающих трисомией 21 (синдром Дауна) или наследственным церебральным кровотечением при амилоидозе 5 26459 Датч-типа (Hereditary Cerebral Hemorrhage with Amyloidosis of the Dutch-Type HCHWA-D). В настоящее время, окончательный диагноз AD обычно требует наблюдения упомянутых выше повреждений в 5 ткани мозга пациентов, которые умерли от болезни или, реже, в малых образцах ткани мозга, полученных с помощью биопсии во время инвазивной нейрохирургической процедуры. 10 0) OR Несколько линий доказательств показывают, что постепенное отложение в головном мозге конкретных амилоидогенных белков, р-амилоидных белков (р- 15 где R1 ий 3 являются, независимо водоamyloid protein - (SAP), играет основополаО о гающую роль в патогенезе AD и может родом -СИ,, - С - (СгСв-алкил) или -с-An быть предшественником симптомов утраI ты познавательной способности спустя гогде Аг является необязательно замещенды или десятилетия (см. Selkoe, 1991, 20 ным фенилом; Neuron, 6:487). Недавно было показано, R2 выбирают из группы, содержащей что рАР выходит из нейронных клеток, пирролидино-, гексаметиленемино- и пивыращиваемых в культуре, и присутствует перидино-, или их фармацевтически в спинномозговой жидкости (cerebrosptnaf приемлемую соль или сольват. fluid — CSF) как нормальных людей, так и 25 Данное изобретение также предусматлюдей, страдающих AD (см. Seubert et at. ривает способ ингибирования выработки // Nature, 1992, 359; 325-327). амилоидогенного белка, включающий назВ дополнение к болезни Альцхаймера начение человеку, нуждающемуся в этом, и другим состояниям с амилоидогеннымиэффективного количества соединения форпептидами J3AP, существуют состояния, 30 мулы (I). связанные с другими амилоидогенными Данное изобретение также предусматпептидами, которые подобны по структуривает способ ингибирования осаждения ре рАР, но которые не разделяют гомоамилоидных бляшек, включающий назналогической последовательности с рАР. чение человеку, нуждающемуся в этом, Недавние исследования продемонстриро- 35 эффективного количества соединения форвали функциональную взаимозаменяемулы (I). мость многих из этих амилоидогенных пепДанное изобретение предусматривает тидов по отношению к нейротоксичности также способ ингибирования болезни (May P.C. et a/. // Journal of Neurochemtstry, Альцхаймера (AD), включающий назначедекабрь 1993), поданная одновременно с 40 ние человеку, нуждающемуся в этом, данной заявкой (U. S. Patent Application эффективного количества соединения 08/109, 782, зарегистрированная 19 авформулы (I) густа 1993, Docket X-9?42). Рассматриваемое изобретение отноНесмотря на прогресс, полученный в сится к открытию, что выделенная группа понимании фундаментальных механизмов 45 бензотиофенов, которые соответствуют AD и других болезней, связанных с амиформуле (I), являются пригодными для ислоидогенными белками, остается необхопользования при ингибировании действия димость разработки композиций и спосоамилоидогенных белков, и, в частности, к бов лечения этих болезней Способы лесоединениям, ингибирующим образование чения должны, преимущественно, быть ос- 50 амилоидогенных белков. нованы на лекарствах, которые дают возможность ингибирования дегенерации или Изобретение указывает использования, действия амилоидогенных белков. осуществляемые путем назначения человеку, нуждающемуся в этом, дозы соедиДанное изобретение указывает способы для ингибирования физиологичес- 55 нения формулы (I), или его фармацевтически приемлемой соли или сольвата, кого расстройства, связанного с амилоидоэффективной для ингибирования физиогенными белками, каковой способ вклюлогического расстройства, связанного с чает назначение человеку, нуждающемуамилоидогенными белками, и, предпочтися в этом, эффективного количества соетельно, с (S-амилоидными белками динения формулы 26459 Термин "ингибировать" включает его общепринятое значение, которое включает препятствование, предотвращение, ограничение и замедление, приостановку или обращение хода развития, тяжести или конечных симптомов. Как таковые, способы включают как терапевтическое, так и профилактическое назначение. Термин "физиологическое расстройство, связанное с амилоидогенным белком" включает болезни, связанные с несвойственным или нежелательным отложением, таким как в мозгу, в печени, в почках или другом органе, по крайней мере, одного из амилоидогенных белков, и в качестве таковой включает AD (включая часто встречающуюся в роду AD), синдром Дауна, HCHWA-D, продвинутое старение мозга и им подобные. Термин "эффективное количество" означает количество соединения, которое необходимо для ингибирования физиологических воздействий или расстройств, связанных с амилоидогенным белком, или для ингибирования производства или осаждения, амилогенов или для ингибирования болезни Альцхаймера, если это случится. Термин "амилоидогенный белок", как он здесь используется, относится и к тем пептидам, которые имеют способность к самопроизвольному объединению в более высоко упорядоченные агрегаты и, возможно, собираться в амилоидные бляшки. Предпочтительными целевыми р-амилоидогенными белками являются р-амилоидные белки. Как правило, соединение приготавливают вместе с распространенными наполнителями, разбавителями или носителями и прессуют в таблетки или приготавливают в виде эликсиров или растворов для удобного орального употребления, или вводят внутримышечным или внутривенным путем. Соединения могут быть введены трансдермально, и могут быть приготовлены в виде дозированной формы с задержкой выхода, и им подобных. Соединения, используемые в способах рассматриваемого изобретения, могут быть получены согласно установленным и аналогичным процедурам, таким как подробно описанные в Патентах США № 4133814, 4418068 и 4380635, которые все включены сюда путем упоминания. Как правилол, процесс начинают с бензо(Ь)тиофена, имеющего 6-гидроксильную группу и 2-(4-гидроксифенильную) группу. Исходное соединение блокируют, алкилируют и деблокируют, получая соединение формулы (I). Примеры получения 8 таких соединений предусмотрены в патентах США, обсужденных выше, и в примерах данной заявки. Необязательно замещенный фенил включает фенил или фе5 нил, замещенный одно- или двухкратно С^-Св алкилом, С 1 -С 4 алкокси, гидрокси, нитро, хлор, фтор или три(хлор или фтор) метил ом. Включенным в данное изобретение яв10 ляется соединение ралоксифен OCH2CH2-N 15 .нее 20 25 30 35 40 45 50 55 Соединения, используемые в способах данного изобретения, образуют фармацевтически приемлемые дополнительные соли кислот и оснований с большим количествоморганических и неорганических кислот и оснований, и включают физиологически приемлемые соли/ которые часто используются в фармацевтической химии. Такие соли также являются частью данного изобретения. Типичные неорганические кислоты, используемые для образования таких солей, включают соляную, бромистоводородную, йодистоводородную, азотную, серную, фосфорную, фосфорноватую и им подобные. Соли, производные от органических кислот, таких как алифатическая моно- и дикарбоновая кислота, фенилзамещенная алкановая кислота, гидроксиалкановая и гидроксиалкандиойная кислота, ароматическая кислота, алифатическая и ароматическая сульфоновая кислота также могут быть использованы. Такие фармацевтически приемлемые соли, таким образом, включают ацетат, фенилацетат, трифторацетат, акрилат, аскорбат, бензоат, хлорбензоат, динитробензоат, гидроксибензоат, метоксибензоат, метилбензоат, о-ацетоксибензоат, нафталин-2-бензоат, бромид, изобутират, фенилбутират, [3-гидроксибутират, бутин-1,4-диоат, гексин-1,4-диоат, капрат, каприлат, хлорид, циннамат, цитрат, формиат, фумарат, гликолат, гептансат, гиппурат, лактат, малат, малеат, гидроксималеат, малонат, манделат, месилат, никотинат, изоникотинат, нитрат, ок 26459 салат, фталат, тетрафталат, фосфат, моногидрофосфат, дигидрофосфат, метафосфат, пирофосфат, пропиолат, пропионат, фенилпропионат, салицилат, себакат, сукцинат, суберат, сульфат, бисульфат, пиросульфат, сульфит, бисульфит, сульфонат, бензолсульфонат, р-бромфенилсульфонат, хлорбензосульфонат, этансульфонат, 2-гидроксиэтансульфонат, метансульфонат, нафталин-t-сульфонат, нафталин2-сульфонат, р-толуолсульфонат, ксилолсульфонат, тартрат и им подобные. Предпочтительной солью является гидрохлоридная соль. Дополнительные фармацевтически приемлемые соли, как правило, образуются путем реакции соединения формулы (I) с эквимолярным или избыточным количеством кислоты. Реагирующие вещества, как правило, объединяют в общем растворителе, таком как диэтиловый эфир или бензол. Обычно соль выпадает в осадок из раствора за время примерно от 1 ч до 10 дней и может изолирована путем фильтрования или растворитель может быть снят обычными средствами. Основания, повсеместно используемые для получения солей, включают гидроксид аммония, гидроксиды и карбонаты щелочных и щелочноземельных металлов, так же как и алифатические и ароматические амины, алифатические диамины гидроксиалкиламины. Основания, особенно пригодные для использования при получении дополнительных солей, включает гидроксид аммония, карбонат калия, бикарбонат натрия, гидроксид кальция,. метиламин, диэтиламин, циклогексиламин и этаноламин. Фармацевтически приемлемые соли, как правило, имеют повышенные характеристики' растворимости по сравнению с соединениями, от котопых они являются производными, и, таким образом, являются часто более податливыми для приготовления в виде жидкостей или эмульсий. Фармацевтические препараты могут быть приготовлены с помощью процедур, известных по литературе. Например, соединения могут быть приготовлены с распространенными наполнителями, разбавителями или носителями, сформированы в таблетки, капсулы, суспензии, порошки и так далее. Примеры наполнителей, разбавителей и носителей, которые являются пригодными для таких препаратов, включают следующие: наполнители и начинка, такие как крахмал, сахар, маннитол и кремнивые производные: вяжущие вещества, такие как карбоксиметилцеллюлоза и 10 другие производные целлюлозы, альгинаты, желатин и поливинилпирролидон, увлажняющие вещества, такие как глицерол, дезинтегрирующие вещества, такие 5 как агар-агар, карбонат кальция и бикарбонат натрия, вещества для замедления растворения, такие как парафин, ускорители повторной адсорбции, такие как продукты замещения аммония, поверхност10 но-активные вещества, такие как этиловый спирт, глицеролмоностеарат, адсорбционные носители, такие как коалин и бентонит, смазки, такие как тальк, стеарат кальция и магния, и твердые полиэтиленгликоли. 15 Соединения также могут быть приготовлены в виде эликсиров или растворов для удобного орального приема, или в виде растворов, пригодных для паренте20 рального введения, например, внутримышечным, подкожным или внутривенным путем. Дополнительно, соединения являются очень удобными для дозированных форм с задержкой выхода и им подоб25 ных. Препараты могут быть так составлены, что они выпускают активный ингредиент только или предпочтительно в конкретной части кишечного тракта, возможно, после заданного периода времени. 30 Покрытия, оболочки и защитные матрицы могут быть сделаны, например, из полимерных веществ или парафина. 35 40 45 50 55 Соединения формулы (1) могут быть назначены для профилактического и/или терапевтического лечения болезней, связанных с отложением одного или более амилоидогенных белков, таких как болезнь Альцхаймера, синдром Дауна и далеко зашедшее старение мозга. В терапевтических приложениях объединения назначают людям, уже страдающим от болезни. Соединения назначают в количествах, достаточных для ингибирования физиологических воздействий или расстройств, связанных с амилоидогенным белком, особенно, с (5-амилоидными белками. Для профилактических применений соединения формулы (I) назначают людям, предрасположенным к болезни, связанной с амилоидогенными белками, предпочтительно, к болезни Альцхаймера, но не страдающим еще от такой болезни. Такие люди могут быть определены путем генетического скриннинга и клинического анализа, как описано в медицинской литературе. (Goate), Nature, 1991, 349; 704-706). Соединения будут ингибировать бляшки амилоидных белков на симптоматически ранней стадии, предпочтительно, предотвращая даже начальные 11 26459 стадии болезни, связанной с амилоидогенными белками. Предпочтительную группу для получения соединений изобретения, либо для профилактических либо для терапевтических целей, составляют женщины послеклимактерического периода. Конкретная дозировка соединения формулы (I) по данному изобретению зависит от тяжести состояния, способа введения и связанных с этим факторов, что решается наблюдающим врачом. Как правило, принимаемые и эффективные дозы будут находиться в пределах примерно от 0,1 до 1000 мг/день, а более типично, примерно от 5 до 200 мг/день. Такие дозировки назначаются субъектам, нуждающимся в лечеции, от одного до, примерно, трех раз каждый день, или более часто, если это необходимо, в течение периода времени, достаточного для ингибирования болезни или расстройства. 12 Тверды желатиновые капсулы приготавливают, используя следующее: 5 Ингредиент 10 Активный ингредиент Крахмал Сыпучий порошок крахмала Силиконовая жидкость (350 сСт) 15 Количество, мг/капсула 0,1-1000 0-650 0-650 0-15 Ингредиенты смешивают, просеивают через сито № 45 меш и наполняют ими твердые желатиновые капсулы. Примеры конкретных препаратов сое20 динения ралоксифена в капсулах, которые получают, включают те, что представЧасто является желательным или необлены ниже. ходимым ввести фармацевтические комПрепарат 2. Капсулы ралоксифена. позиции непосредственно или опосредованно в мозг. Прямые методы, обычно, 25 Количество, включают размещение катетера для досИнгредиент мг/капсула тавки лекарства в систему желудочков для шунтирования рематоэнцефалического Ралоксифен 1 барьера. Опосредствованные методы, ко112 Крахмал торые, как правило, являются предпочти- 30 Сыпучий порошок тельными, включают приготовление комкрахмала 225,3 позиций для обеспечения временной дезактивации действия лекарств путем преобСиликоновая жидкость разования гидрофильных лекарств в липи(350 сСт) 1,7 до-растворимые лекарства. Временная де- 35 зактивация, как правило, достигается с поПрепарат 3. Капсулы ралоксифена. мощью блокировки гидроксильных, карбоксильных или первичных аминогрупп, приКоличество, сутствующих в лекарстве, для того, чтобы Ингредиент мг/капсула сделать лекарство более лип идо-раствори- 40 мым и податливым для транспортировки Ралоксифен 5 через рематоэнцефалический барьер. Аль108 Крахмал тернативно, доставка гидрофильных леСыпучий порошок карств может быть интенсифицирована путем внутри артериального вливания гипер- 45 крахмала 225,3 тонических растворов, которые могут на вреСиликоновая жидкость мя открыть рематоэнцефалический барьер. (350 сСт) 1,7 Как правило, является предпочтительным введение соединения формулы (I) в Препарат 4. Капсула ралоксифена виде дополнительной кислой соли, как это 50 является обычным при введении медикаКоличество, ментов, имеющих основную группу, такую Ингредиент мг/капсула как пиперидиновое кольцо. Для таких целей имеются в распоряжении следующие Ралоксифен 10 формы дозировки. 55 Крахмал 103 Сыпучий порошок В препаратах, которые следуют дакрахмала 225,3 лее, "активный ингредиент" обозначает Силиконовая жидкость соединение формулы (I) (350 сСт) 1,7 Препарат 1. Желатиновые капсулы. 13 "Препарат 5. Капсула ралоксифена. 26459 14 рые затем пропускают через сито № 14 меш. Гранулы, полученные таким обраКоличество, зом, сушат при 50-60°С и просеивают Ингредиент через сито № 18 меш. Натрийкарбоксимг/капсула м етил целлюлозу, крахмал, стеарат магРалоксифен 50 ния и тальк, просеяв сначала через сито № 60 меш, затем добавляют к гранулам, Крахмал 150 которые после перемешивания прессуют Сыпучий порошок в машине для производства таблеток, по397 крахмала лучая таблетки. 10 Силиконовая жидкость Суспензии, содержащие 0,1-1000 мг (350 сСт) 3,0 медикамента на дозу в 5 мл каждая, получают следующим образом. Конкретные препараты, представленПрепарат 8. Суспензии. ные выше, могут быть изменены в согла- 15 сии с предусмотренными разумными ваКоличество, Ингредиент риациями. мг/5 мл Препараты в виде таблеток приготавАктивный ингредиент 0,1-1000 мг ливают с использованием ингредиентов, представленных ниже. Натри йкарбокси метил 20 Препарат 6. Таблетки. целлюлоза 50 мг Сироп 1,25 мг Количество, Ингредиент Раствор бензойной мг/таблетка кислоты 0,10 мл Активный ингредиент 0,1-1000 25 Отдушка Произв. кол-во Целлюлоза Произв. кол-во Краситель микрокристаллическая 0-650 До 5 мл Очищенная вода Двуокись кремния, микрочастицы 0-650 Медикамент пропускают через сито 30 Стеариновая кислота 0-15 № 45 меш и смешивают с натрийкарбоксиметилцеллюлозой и сиропом для полуКомпоненты смешивают и прессуют в чения однородной мягкой пасты. Раствор форме таблеток. бензойной кислоты, отдушку и краситель Альтернативно таблетки, содержащие 35 разбавляют некоторым количеством воды каждая 0,1-1000 мг активного ингредиени добавляют перемешивая. Затем добавта, производят следующим образом. ляют достаточное для получения требуеПрепарат 7. Таблетки. мого объема количество воды. Условия эксперимента. Количество, Для испытаний от 1 до 3 обеспечи40 Ингредиент мг/таблетка ваются следующие условия эксперимента. Активный ингредиент 0,1-1000 Амилины могут быть приобретены у Крахмал 45 Bachem, Inc. (Torrance, California, USA), Целлюлоза микро45 Peninsuls Laboratories, Inc. (Belmont, 35 кристаллическая California, USA), Sigma Chemicals (St. Louis. Поливинилпирролидон MO, USA) или могут быть синтезированы (в виде 10% раствора как описано ниже. Амилоид - р (1-40) (Lot 4 # ZK052) и пептид обратного р-амилоив воде) 50 да (40-1) (Lot # ZX299) могут быть приобНатри йкарбоксиметилретены из Bachem Inc. (J-микроглобулин 4,5 целлюлоза может быть приобретен у Sigma Chemicals Стеарат магния 0,5 (St. Louis, Missouuri, USA). Тальк 1 Основные растворы пептидов (1 мМ) 55 являются свежеприготовленными в пиролитически чистой воде и их разбавляют Активный ингредиент, крахмал и целдо указанных концентраций в определенлюлозу просеивают через сито № 45 меш ных культурных средах. Культуры клеток и тщательно перемешивают. Раствор погиппокампа крысы (10-14 дней in vitro) ливинилпирролидона смешивают с полуобрабатывают пептидами или лекарственченными в результате порошками, кото 15 26459 ной средой в течение 4 дней. Жизнеспособность культуры кортикальных клеток крысы наблюдают визуально с помощью фазово-контрастной микроскопии и количественно оценивают путем измерения (концентрации) лактадегидрогеназы (lactate dehydrogenase - LDH) поступающей в культурную среду. Культуры кортикальных клеток человека (12-22 дня in vitro) обрабатывают пептидами или лекарственной средой в течение 3 дней. Жизнеспособность клеток оценивают визуально с помощью фазово-контрастной микроскопии и количественно оценивают по уменьшению (концентрации) тетразолииной соли ХТТ. Специалисты могут понять, что жизнеспособность клеток и, следовательно, токсичность могут быть измерены с использованием других методов, таких как мониторинг уровня кальция. Методики измерения LDM и ХТТ, также как и испытания с мониторингом уровня кальция, описаны ниже. Испытание 1. Испытание нейротоксичности с измерением уровня кальция. Аликвоту кортикальных клеток ED 18 высевают в покрытые полиэтиленимином чашки для культуры ткани в течение 3-5 дней in vitro перед обработкой 25 мкмМ раствором р-амилоидного пептида, либо свежерастворенного ( в основном, в конформационном состоянии "клубок"), либо состаренного (7 дней, в основном, в рскладчатой конформации). Это испытание на нейротоксичность проводят с химически определенной DEME (среда Игла, модифицированная по способу Дульбекко), с HEPES-буфером и с подпиткой фетальной телячьей сывороткой. После инкубации в течение двух дней с р-амилоидным пептидом определяют подъем концентрации цитосомного кальция (Са*г)после введения импульса глютамата, используя флюоресцентный краситель, чувствительный к кальцию (Wahl J., et al. // Journal of Neurochemistry, 1989, 53:1316). Подъем внутриклеточных уровней Са+2 подвергают риску целостность клеток. Все вышеупомянутое повторяют, однако, с соединением данного изобретения. Активность соединения иллюстрируется уменьшением внутриклеточных уровней Са +г по сравнению с первой серией опытов. Испытание 2. Испытание нейротоксичности с измерением ХТТ. Аликвоту кортикальных клеток ED 18 высевают в покрытые полиэтиленимином 5 10 15 20 25 30 35 40 45 50 55 16 чашки для культуры тканей в течение 3 5 дней in vitro перед обработкой 25 мкМ раствором р-амилоидного пептида, либо свежерастворенного (в основном, в конформационном состоянии "клубок"), либо состаренного (7 дней, в основном, в рскладчатой конформации). Это испытание проводят с химически определенной DEME с HEPES-буфером и с подпиткой фетальной телячьей сывороткой. Эти клетки инкубируют в течение от 3 до 5 дней in vitro перед обработкой 25 мкмМ раствором р-амилоидного пептида, либо свежерастворенного (в основном, в конформационном состоянии "ю.убок"), либо состаренного (7 дней, в основном, в Р-складчатой конформации). После двух дней инкубации жизнеспособность клеток наблюдается путем измерения уменьшения (концентрации) тетразолииной соли ХТТ [2,3-бис(2-метокси-4-нитро-5-сульфофенил)-2Н-тетразолин-5 карбоксианилидная внутренняя соль], как описано Rochm N. et ai. //Journal of ImmunoJogical Methods, 1992, 142; 257. Вышеуказанное повторяют вновь, однако с соединением данного изобретения. Активность соединения иллюстрируется увеличением жизнеспособности клеток по сравнению с первой серией опытов. Испытание 3. Испытание нейротоксичности с измерением. Лактатдегидрогеназу (LDH) измеряют в 20 мкл аликвотах кондиционированной определенной DEME с использованием стандартного кинетического испытания LDH на длине волны 340 нм (Sigma Catalog Number # 228-20) в формате с 96 лунками. Испытания производят при 37°С в управляемом персональным компьютером планшет-ридере EL 340 Microplate Biokinetics (Bio-tek Instruments) с использованием программного обеспечения Delta Soft 11 (v. 3. ЗОВ, Bio Metallics, Inc) для обработки данных. Стандарты контроля качества, содержащие нормальные и повышенные уровни сывороточной LDH (например, Sigma Enzyme Controls 2N и 2Е), используют в каждом испытании. Соединение данного изобретения добавляют при различных концентрациях к порциям в лунках. Результаты выражают в виде единиц LDH/L, где L-единица определяется как количество фермента, которое катализирует образование 1 мкмоль никотинамидаденинового динуклеотида в минуту при условиях испытания. Активность индуцируется с помощью уменьшения уровней индикатора нейротоксичности по сравнению с контролем. 26459 17 Испытание 4. Клетки, инфицированные УУ:99 или УУ:42, которые способны образовывать амилоидные образования (как описано в WO 91/04339, опубликованном 4 апреля 1991 года), помещают на микротитровальный планшет с 96 лунками. Для осуществления соответствующих разбавлений и добавлений используют автоматическую пипетку для введения соединения формулы (I), которое нужно испытывать, в клетки. Ряд концентраций соединения инкубируют в инкубаторе культур тканей {или предварительно инкубируют) с клетками при 37°С в течение заранее заданного периода времени, или альтернативно в течение от 3 до 72 ч. Следом за инкубацией, культурную среду удаляют и клетки приготавливают для измерения лре-амилоидов следующим образом. Клетки фиксируют для иммуноцитохимической окраски с антителами к амилоидам. Первичные антитела вводят с последующей инкубацией с меченными вторичными антителами, и измеряют уровень связывания между первичными и вторичными антителами, используя планшетридер EL ISA для регистрации оптической плотности меченых антител. Меньшая регистрируемая оптическая плотность, по сравнению с контрольным образом, клеток, выращенных в отсутствии испытываемого лекарства, показывает на способность этого лекарства ингибировать отложение амилоидов. Эта процедура может быть модифицирована, чтобы сделать возможным детектирование обратного растворения пре-амилоидов с использованием коррелятивного ферментного маркера. Активность соединения формулы (I) иллюстрируется с помощью уменьшения изме 5 10 15 20 25 30 35 18 ренных (концентраций) пре-амилоидов по сравнению с контролем. Испытание 5, От пяти до пятидесяти женщин выбирают для клинических испытаний. Женщины находятся в послеклимактерическом возрасте, то есть, у них прекратились менструации за 6-12 месяцев до начала исследований, у них был поставлен диагноз - ранняя стадия болезни Альцхаймера (AD) в период испытаний, но, в остальном, общее состояние их здоровья хорошее. В исследованиях принимает участие контрольная группа с плацебо, т.е. женщин разделили на две группы, одна из которых получала активное вещество данного изобретения, а вторая получала плацебо. Пациенты тестируются на память, познавательную способность, логическое мышление и другие симптомы, связанные с AD. Женщины из тестирующей группы получают 50-200 мг активного вещества в день путем орального приема. Они продолжают это терапевтическое лечение в течение 6-36 месяцев. Поддерживают аккуратную регистрацию тестируемых симптомов в обеих группах и в конце испытаний эти результаты сравнивают. Результаты сравнивают как между членами каждой группы, так и результаты каждого пациента сравнивают с симптомами, зарегистрированными у каждого пациента перед началом испытаний. Активность испытываемого лекарства иллюстрируется с помощью ингибирования какого-либо одного или более симптомов AD у пациентов, принимавших ирпытываемое лекарство. Полезность соединений формулы (!) 40 доказывается с помощью активности в по крайней мере одном из приведенных выше испытаний. Упорядник Техред М. Келемеш Коректор О.Обручар Замовлення 508 Тираж Підписне Державне патентне відомство України, 254555, ГСП, Київ-53, Львівська пл.. 8 Відкрите акціонерне товариство "Патент", м. Ужгород, вул Гагаріна, 101
ДивитисяДодаткова інформація
МПК / Мітки
МПК: A61P 25/00, A61P 25/28, A61K 31/40, A61K 31/445, A61K 31/381, A61K 31/55, C07D 333/56, A61K 31/38
Мітки: амілоїдних, впливу, інгібітор, білків
Код посилання
<a href="https://ua.patents.su/10-26459-ingibitor-vplivu-amilodnikh-bilkiv.html" target="_blank" rel="follow" title="База патентів України">Інгібітор впливу амілоїдних білків</a>
Попередній патент: Спосіб монтажу оптичного кабеля у повітряній лінії електропередачі
Наступний патент: Спосіб одержання таблеткового препарату на основі метронідазолу
Випадковий патент: Пристрій для контролю полум'я