Фармацевтична препаративна форма цефаклору та спосіб її одержання
Текст
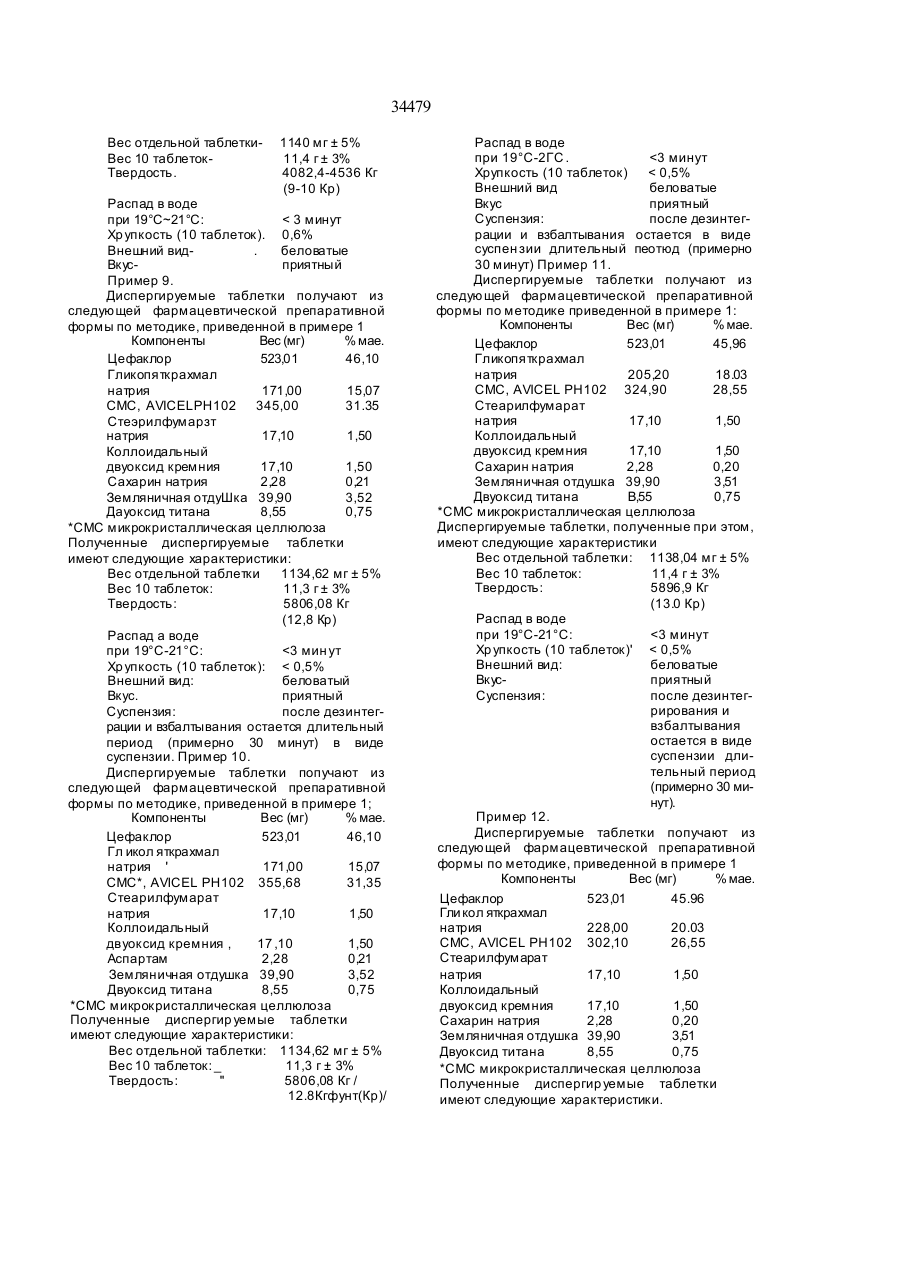
1 Фармацевтическая препаративная форма цефакпорз для промышленного получения дис пергируемых табле ток прямым прессованием, отличающаяся тем, что она содержит це факлор в количестве от 35% до 50% Мае о т общей мас сы препара ти вной фо рмы и при годные эксципиенты и соадъюванты 2 Фармацевтическая препаративная форма по п 1, о тли чающаяся тем, что при годные эксци пиенты и соадъюванты включают дезинтеграто ры, разба ви тели , смазывающие ве ще ства , ан тиадгезивные средства, подслащивающие ве щества, о тдушки и, необязательно, вкусовые до бавки, ве щества, дела ющие ма териал непроз рачным и красители 3 Фармацевтическая препаративная форма по п 2 , о тли чающаяся тем, что дезинтегра то ром является гшколяткрахмап натрия, акриловые производные, смеси гликоляткрахмала натрия и карбоксиметилцеллюлозы и предпочтительно крословидон 4 Фармацевтическая препаративная форма по п 3 , о тли чающаяся тем, что включает гликоПЯткрахмап натрия в количестве от 5% до 21% мае от общей массы препаративной формы 5 Фармацевтическая препаративная форма по п 3 , о тли ча ющаяся тем, что включае т акрило вые произ водные в коли честве примерно 10% мае от общей массы препаративной формы 6 Фармацевтическая препаративная форма по п 3, о тличающаяся тем, что включае т кросповидон в количестве примерно 10% мае о т общей массы препаративной формы 7 Фармацевтическая препаративная форма по п 3 , о тли чающая ся тем что включае т сме сь /і/ гликоляткрахмала натрия в количестве примерно 14% мае от общей массы препаративной формы и Ш карбоксимети лцеллюлшы в количестве примерно 10% мае от общей массы препаративной формы в качестве дезинтегратора 8 Фармацевти ческая препаративная форма по п 2, отличающаяся тем , что включае т в качестве разбавителя микрокристаллическую целлюло зу, сухой текучий крахмал и их смеси 9 Фармацевти ческая препаративная форма по п 8 , о тли ча ющаяся тем, что включае т микрок ристаллическую целлюлозу в количестве от 24% до 46% мае о т общей Массы пр епара ти вной формы 10 Фармацевтическая препаративная форма по п 9 , о тли чающаяся тем, что вы ше наз ванн ая микрокристалличе ская целлюлоза имее т сре д ний размер частиц примерно 90 микрон. 11 Фармацевтическая препаративная форма па л 8, о тлича ющаяся тем, что включает сухой те кучий кра хмал в количестве примерно 39% мае от общей массы препаративной формы 12 Фармацевтическая препаративная форма по п 2, отличающаяся тем , что включае т в качест ве смазывающего вещества стеарилфумзрат натрия в количе стве менее 2% мае о т обще й массы препаративной формы 13 Фармацевтическая препаративная форма по п 2, о тли чающаяся тем. что в каче стве ан тиад гезивного средства включает коллоидальный двуоксид кремния в количестве менее 5% мае от общей массы препаративной формы 14 Фармацевтическая препаративная форма по п 2, о тли чающаяся тем, что в каче стве подсла щивающи х веществ включает аспартам, сахарин натрия или их смеси в количестве менее 1% мае от общей массы препаративной формы 15 Фармацевтическая препаративная форма по п 14, о тли чающаяся тем, что включае т са харин натрия в количестве о т 0 ,1% до 0,4% мае о т об щей массы препаративной формы 16 Фармацевтическая препаративная форма по п 1 4, о тли ча ющаяся тем, что включае т а спартэм в количестве от 0,2% до 0 ,7% мае от общей массы препаративной формы. 17 Фармацевтическая препаративная форма по п 2 , о тли чающаяся тем, что включае т земля ничн ую о тдушк у в количе стве от 3% до 5% мае от общей массы препаративной формы ш 34479 18 Фармацевтическая препаративная форма по п 2. отличающаяся тем, что а качестве вкусо вой добавки включает безводную лимонную кис лоту в количестве о т 2% до 4% мае от общей массы препаративной формы 19 Фармацевтическая препаративная форма по п. 2, о тличающаяся тем, что включае т в качест ве ве щества, делающе го материал непрозрач ным, двуоксид ти тана в ко личе стве менее 2% мае от общей массы препарагивной формы 20. Фармацевтическая препаративная форма по п 2. отличающаяся тем, что включает в качестве красителя красный F, D и С - эритрозин № 3 в количестве менее 1% мае. от общей массы препаративной формы 21 Фармацевтическая препаративная форма по п 1, отличающаяся тем, что включает пару соединений, продуцирующих вспенивающий эффект. 22 Фармацевтическая препаративная форма по п 21 , о тли чающаяся тем, что вы шеназ ванная вспенивающая пара содержит лимонную кислоту и карбонат кальция. Изобретение относится к фармацевтическим формам применения цефаклора, пригодных для промышленного получения твердых фармацевтических составов для орального введения В частности изобретение описывает фармацевтические прапарэтивные формы и диспергируемые таблетки, содержащие цефаклор, и их способ промышленного получения Известно, что цефаклор или З-хяор-7-Д(фенилглицинамид)-3-цефем-4-карбоновая кислота является полусинтетическим цефалоспориновым антибиотиком (патент США № 3925372 и патент ФРГ № ДЕ 2408698) Его бактерицидное действие основано на его способности интбировать синтез стенок клетки Цефаклор пригоден для лечения инфекций, обусловленных чувствительными штаммами многочисленных организмов, особенно Streptococcus и Staphyiococcus. Фармацевтические формы, обычно применяемые для введения цефаклора, включают капсулы, таблетки замедленного действия И суспензии, как в пузырьках, так и в виде в сухих форм. При использовании капсул имеется следующий ряд ограничений и недостатков - их введение пациентам может быть огра ничено, так как у некоторы х имеются проблемы при их загла тывании, особенно у детей и пожи лых, которые даже не в состоянии сделать это; и - они да ют возможность ввести только единичную дозу. С другой стороны недостатком введения цефаклора в виде суспензии (сухая форма) является то, что вследствие содержания сахарозы его потенциальное использование ограничивается для пациентов-диабетиков, которые должны соблюдать меры предосторожности. Кроме того, дополнительно к этому недостатку, обусловленному содержанием сахарозы, введение це факло ра в суспензии (п узырек) имеет дополнительные недостатки, которые могут быть суммированы следующим образом. - риск случайной передозировки вследст вие неконтролируемого потребления, особенно в случае детей, и - тр удности обработки и транспортировки из-за заключенного объема, что ведет к некоторому риску не провести полную терапию с сопутствующей потерей эффективности. Таблетки замедленного действия имеют недостаток, который заключается в том, что невозможно ввести двойную дозу продукта, кроме того, они не пригодны для пациентов, испытывающи х тр удности при заглатывании твердой формы препарата Существующие формы введения цефаклора не полностью удовлетворяют некоторым требованиям, необходимым для лечения бактериальных инфекций, например, применение их любыми пациентами при обеспечении полного лечения, тем самым повышая их эффективность. Таким образом, требованием для новых фармацевтических форм введения цефаклора, которые решат эти проблемы, является обеспечение легкости введения препарата пациентам и возможность использования препаратов диабетическими больными без дополнительных затруднений, повы шая таким образом эффективность лечения. Это изобретение дает решение эти х проблем с помощью представления новых фармацевтических препаративных форм, содержащих цефаклор, которые пригодны для промышленного получения диспергируемых таблеток Диспергируемые таблетки являются фармацевтическими формами для орального введения, которые должны распадаться в воде при 1921°С менее, чем за три минуты и равномерно диспергироваться в воде. Испытание на однородность дисперсии включает помещение двух Таблеток в 100 мл воды, встряхивание их до те х пор пока они полностью не разрушаться, они должны диспергироваться так, чтобы проходить через сито с номинальным размером ячейки сита 710 микрон (British Pharmacopea, Vol H, 1988). Известны диспергируемые таблетки, содержащие антибиотики, относящиеся к группе синтетических пенициллинов (амоксициллин), и противовоспалительные препараты (лирокси 23 Твердая препаративная форма по пп. 1-22 в виде диспергируемой таблетки цефаклора, полу чаемой прямым прессованием фармацевтичес кой препаративной формы по любому из пунктов 1-22 24. Способ получения диспергируемых таблеток, содержащих це факлор, отличающийся тем, что проводят смешение цефаклора в количестве от 35% до 50% мае от общей массы препаративной формы с пригодным эксципиентом и соадъювантом с последующим прямым прессованием фармацевтической препаративной формы по любому из пп. 1-22. 34479 кам), но диспергируемые таблетки, содержащие антибиотик, относящийся к группе синтетического цефалоспорина, такой как цефаклор, неизвестны Задачей этого изобретения являются новые фармацевтические препаративные формы, содержащие цефаклор, пригодные дпя промышленного получения диспергируемых таблеток. Дополнительным объектом этого изобретения являются такие диспергируемые таблетки, содержащие цефаклор, и их способ промышленного получения Получение препарати в нь;х форм, пригодных для промышленного получения диспергируемых таблеток, требует как изучения физико-химической совместимости активного ингредиента, так и поиска оптимальных эксципиентов, делая возможным соответствие требованиям различных фармакопий. Должна также приниматься во внимание методика, используемая для получения таких диспергируемых таблеток, так как выбор эксципиентов и соадъювантов препаративной формы будет в большей степени зависеть от способа, выбранного для получения таких диспергируемых таблеток. По причинам, упомянутым в дальнейшем, для промышленного получение таблеток выбран способ прямого прессования. Параметры диспергируемых таблеток следующие: і) их высокая скорость разрушения в воде и. іі) однородное распределение частиц, на которые они распадаются Скорость распада и однородность дисперсии также зависят и от соадъювантов, и от активного ингредиента Таким образом распад, определяемый как высвобождение активного ингредиента из прессованных фармацевтических препаратов, является критическим параметром при разработке диспергируемых форм. Таким образом, выбор соадъювантов в препарате диспергируемых таблеток является важной частью изучения галеновых препаратов Свойства и качество конечных таблеток зависят в значительной степени от соадъювантов, поэтому большое значение имеет правильный выбор соз пъювантов, огромную важность имеет способ получения таблеток, так как тип соадьюванта может быть выбран в зависимости от используемого метода. Новые фармацевтические формы применения цефаклора, пригодные для получения диспергируемых таблеток, предложенные этим изобретением, учи тывают эти моменты и кроме активного ингредиента содержат адекватные количества дезинтегратора, разбавителей, смазывающи х ве ществ, антиадгезивных средств, подслащивающи х ве ществ, отдушек и, необязательно, вкусовых добавок, окрашивающих ве ществ и красителей. Кроме того, в особом осуществлении этого изобретения предлагаются новые фарма-1 цевтические препаративные формы цефаклора, которые содержат пару шип учи х веществ. Цефаклор является активным ингредиентом препаративных форм данного изобретения. Используемый в этом описании термин "цефаклор" имеет ввиду не только форму свободной кислоты, но таюке ее гидраты и фармацевтичес ки приемпемые соли. Цефаклор может присутствова ть в препаративной форме в количестве между 35% и 50% мае от общей массы препаративной формы. Цефаклор может быть получен, как описано, например, в пат США Ня 3925372 и в пат ФРГ № ДЕ 2408698 (Eli Lilly S Co ). Так как критическим параметром диспергируемых таблеток является их скорость дезинтеграции (распада) в воде, то выбор правильного дезинтегратора является одной из наиболее важных стадий Йспольпуемый в этом описании термин "дезинтегратор" относится к агенту, который вызывает такое увеличение поверхности, что активный ингредиент из таблетки высвобождается очень быстро При годными дезинте гра торами для препаративных форм этого изобретения являются гликоля т кра хмала на трия , о дин или вместе с карбоксиметилцеллюлозой, полимерные производные акриловой кислоты и, предпочтительно, кросповидон. Гликоляткрахмал натрия может использоваться в количестве 5% и более мае от общей массы препаративной формы и преимущественно в концентрации между 10% и 21% Кроме того, смеси гпиколяткрахмала натрия и карбоксиметилцеллюлоэы натрия могут использоваться в количества х приблизительно 14 мас.% гликоляткрэхмала натрия и приблизительно 10% карбоксиметилцелпюлоэы натрия, причем в обои х случаях относительно общей массы препаративной формы. Полимерное производное акриловой кислоты может иметь среднюю или высокую вязкость, предпочтительно высокую, и может использоваться в копичестве примерно 10 мас.% от общей массы препаративной формы. Предпочтительным дезинтегратором является кросповидон (нерастворимый поливинилпирролидон [PVP], полученный полимеризацией винилпирролидона). Этот полимер может включаться в препаративную форму в количестве прибпизительно 10 мас.% от общего веса препаративной формы. Попагают, что высокое дезинтегрирующее действие сетчатого и нерастворимого PVP является следствием его гидратирующей способности (адсорбция воды), которая означает, что очень высокая скорость дезинтеграции таблеток достигается с рез ультирующим улучшенным растворением цефаклора в воде. С другой стороны, выбор техники прямого прессования для производства диспергируемых таблеток вызывает дополнительные преимущества в выборе эксципиентов, Возможность использования дезинтегратора а экстрэгранулированной форме повышает его набухающее действие, так как дезинтегрирующее действие не изменяется или смачиванием, Или высушиванием Используемый в этом описании термин "разбавители" включает эксципиенты, которые облегчают прессование порошкообразных материалов и приводят к прочным таблеткам. Пригодными разбавителями являются микрокристаллическая целлюлоза и сухой текучий крахмал, и их смеси. Далее представлены примеры пригодных разбавителей для препаративных форм этого изобретения: 34479 1) Микрокристаллическая целлюлоза, кото рая обеспечивает порошкообразную смесь с вы соко соответствующими характеристиками теку чести и сжимаемости Этот разбавитель делает возможным получение таблеток высокой степени чистоты при использовании техники прямого прессования Он также действует в качестве свя зующего ве щества, давая прочные таблетки при годной твердости, в то время как его абсорбцион ная способность способствует короткому време ни распада Из различных типов микрокристалли ческой целлюлозы, коммерчески доступных, предпочтителен AVICEL PH102 (средний размер частиц 90 микрон); в то время как другие имеют подобные характеристики по их способности об легчать прямое прессование AVICEL PH102 дает прямое прессование благодаря текучести он при годен для смеси, вследствие его размера частиц, он облегчает прямое прессование мелких порош кообразных смесей (как в препаративньїх формах этого изобретения) Микрокристаллическая цел люлоза может присутство вать в препаративной форме в количестве от 24% до 46% мае от общей массы препаративной формы и 2) сухой тек учий кра хмал вследствие его способности разбавлять и связывать в процессе прямого прессования Он может присутствова ть в препаративной форме в количестве примерно 39% мае от общей массы препарати вной фор мы Однако, таблетки, полученные с использова нием разбавителя, не очень твердые, и это влияе т на и х хр упкость о трица тельно по этой причине таблетки, содержащие в качестве разба вителя микрокристаллическую целлюлозу, пред почтительны Вследствие очень высокого процента микрокристалличе ской целлюлозы (между 24% и 46% мае от общей массы препаративной формы) таблетки могут бы ть получены с весом от 1140 до 1150 мг в случае высокого процентного содержания целлюлозы, порядка 38%-46%, в то время как в случае сравнительно более низкого процентного содержания целлюлозы, порядка 35%-3б%, весом порядка 1125 мг каждая Наконец, если процентное содержание микрокристаллической целлюлозы составляет примерно 28%, то таблетки могут быть получены с конечным весом порядка 1130-1140 мг Используемый в этом описании термин "смазывающее вещество (смазка)" включает эксципиенты, которые снижают трение между частицами внутри таблетки, уменьшая реакционные силы, проявляющиеся на стенках матрицы В качестве смазывающего вещества для препаративных форм этого изобретения может быть использован предпочтительно стеарилфумарат натрия гидрофильное смазывающее вещество Этот соадъювант может добавляться к препаративным формам в этом изобретении в дозе менее 2% мае относительно общей массы препаративной формы, предпочти тельно от 0 4% до 1 ,5% мае от общей массы препаративной формы Включение этого эксципиента повышает скольжение препаративной формы при прессовании Он также обеспечивает одинаковое заполнение пространства в матрице так, что имеются очень небольшие отклонения в весе таблеток Стандартные соли стеариновой кислоты не пригодны, так как например, стеарат магния не адсорбирует воду, давая раствор большей частью неприятного вида с образованием "ореола" на поверхности Используемый в этом описании термин "антиадгезивное средство" включает эксципиенты, которые предупреждают адгезию частиц, таким образом избегая или снижая уплотнение и ограничивая трение между частицами В качестве пригодного адгезивного средства для препаративных форм в этом изобретении может использоваться коллоидальный двуоксид кремния: вследствие своей большой удельной поверхности этот материал является очень хорошим регулятором текучести порошка и действуе т также как адсорбент, нейтрализующий влажность которая поглощается цефаклором, таким образом замедляя гидролиз активного ингредиента Этот соадъювант может включаться в количество менее 5% мае от общей массы препаративной формы, предпочтительно от 0,2% до 1,5%. Препаративные формы этого изобретения могут также содержать подслащивающие вещества, душистые вещества (отдушки) и вкусовые добавки В качестве синтетического подслащивающего вещества может использоваться сахарин натрия в количестве менее 1% мае от общей массы препаративной формы, предпочтительно от 0,1% до 0,4% мае или аспартам в количестве менее 1% мае от общей массы препаративной формы, предпочтительно от 0,2% до 0,75% мае относительно общей массы препаративной формы В качестве отдушки может использоваться земляничная отдушка, например идентифицированная как 52312 АР05 15 Firmentch, в количестве от 3% до 6% мае от общей массы препаративной формы В качестве вкусовой добавки может использоваться безводная лимонная кислота в количестве от 2% до 4% мае от общей массы препаративной формы Дополнительно и необязательно, препаративные формы этого изобретения могут содержать окрашивающий агент и краситель или комбинацию красителей для повышения физического вида раствора при получении и для создания однородного окрашивания В качестве вещества, делающего материал непрозрачным может использоваться двуоксид титана (Е-171) в количестве менее 2% мае, от общей массы препаративной формы, предпочтительно примерно 1 5% мае от общей массы препаративной формы Однако использование этого материала не является необходимым Индивидуальные красители или их комбинации могут использоваться для получения красно-розовых растворов, которые могут ассоциировать с применяемой в таблетках отдушкой (земляника) и которые также обеспечивают суспензию приятного вида Эти цели могут быть достигн уты включе нием менее 1% мае Red F, D b С № 3 - эри троз ина (Е-127 ) кра си те ля [Merck Index, 11th Edition, 1989, Rabway, N J США]. 34479 С другой стороны, в чэстнсм и альтернативном воплощении этого изобретения предлагаются новые препаративные формы цефаклора которые включают также пару соединений, которые дают вспенивающий эффект При включении пары веществ, дающей вспенивающий эффект, скорость распада таблеток может быть увеличена Вообще вспенивающая пара состоит из вспенивающего основания такого как карбонаты или бикарбонаты щелочных или щелочноземельных металлов, и кислоты, которая реагирует с вспенивающим основанием и продуцирует двуокись углерода Для новых препаративных форм цефаклора этого изобретения может использоваться любая вспенивающая пара, обычно используемая для получения вспенивающи хся таблеток, предпочтительно, чтобы пара содержала лимонную кислоту и карбонат кальция Препарзгизньге формы цефаклора этого изобретения могут быть получены пегко просеиванием соответствующи х количеств различных эксципиентов и соадьювантов и помещением в пригодный смеситель Затем добавляется активный иніредиеит и смесь перемешивается до гомогенного состояния, при этом получают свободно текучий порошок Такие новые препаративные формы могут использоваться для получения диспергируемых таблеток, содержащих в качестве активного ингредиента цефаклор Как уже сказано, процесс получения таблеток имеет очень большое значение в разработке фармацевтической препаративной формы Образование корпуса таблетки может быть основано на грануляте (агломерированный материал делают из частиц порошка, к которым добавляют связывающий а гент) или на предварительно необработанной порошкообразной смеси (прямое прессование) Соадъюванты выбирают со гласно выбранной методике Так как диспергируемые таблетки очень чувстви тельны к влажности и их стабильность подвергается риску при операциях гранулирования, предпочтительной методикой является прямое прессование, которое обеспечивает наибольшие преимущества 1 с одной стороны это производство я вляете- быстрым, не зависящим ни от грануляции, ни от сушки, с др угой стороны процесс избегает возможного разложения (вследствие гидролиза) активного ингредиента при грануляции Снижается также риск загрязнений Однако, существуе т возможно более значительное преимущество, это то, что таблетки, полученные при прямом прессовании, обычно распадаются более быстро, чем таблетки, полученные методом мокрой грануляции, который требуе т добавления связ ующего а гента , что снижает скорость дезинтеграции В то время как обычно прямое прессование может вызывать некоторые недостатки, такие как проблемы однородности смеси и дозы, текучесть и сжимаемость, неожиданно, в препаративных формах этого изобретения ни одна из этих проблем не возника е т Дей стви те льно , табле тки очень незначительно варьируют по весу и содержанию активного ингредиента Прессуемостъ приемлема и твердость табле ток находи тся в требуемых пределах. Диспергируемые таблетки, содержащие цефаклор, могут быть получены стандартными способами, например на обычной роторной или внецентрической таблетирующей машине которая прессует приготовленную и просеенную фармацевтическую препаративную форму, подаваемую на машину Диспергируемые таблетки, содержащие цефаклор, предлагаемые этим изобретением, являются твердыми, предназначенными для орального применения, однородного вида с приемлемой механической прочностью, выдерживающей возможный ущерб о т хранения и транспортировки Активный ингредиент однородно распределяется в фармацевтической препаративной форме и скорость распада в воде - высокая {в пределах тре х минут в воде при 19°С-21°С) Аналогично, приемлемым является уровень дезинтеграции (или степень дисперсности частиц, на которые продукт распадается) в соответствии с требованиями различных фармакопий. Использование диспергируемых таблеток, содержащих це факлор, дает ряд преимуще ств над известными и привычными формами введения этого активного ингредиента, включая следующие ~ От пригодны для лечения пациенто в с нарушением способности заглатывать твердые формы, - Они могут использова ться пациентами, которые больны диабетом, так как они не содер жат сахарозы, - Дозирование - ги бкое и до ста то чно точ ное после растворений в объеме воды , требуе мом пациентом - Результир ующий раствор имеет пригод ные органолептические характеристики, прием лемые пациентами - Их форма, размер и сниженный о бъем позволяет держать их в п узырьках, которые удобны для пациенто в, повы шая легкость обра щения с ними и обеспечивая тем самым возмож ность для пациента закончить терапию , тем са мым повышая эффективность лечения; и - Риск острой интоксикации вследствие пе редозировки меньший, что делает диспергир уе мые таблетки менее опасными, особенно для де тей Следующие примеры иллюстрируют специфические осуществления изобретения, но не ограничивают изобретение Названные примеры используют сухой текучий крахмал {GORMASOJ, кросповидон {KOLUDON CL® )[BASF] и микрокр и ста лли ческ ую це ллюлоз у {AVIC EL РН 102*HFMC FORET] Акриловые производные как с высотой так и со средней вязкостью содержат сополимер метакриловой кислоты и метилметакрилата в соотношении примерно 7 3. полученных ROHM PH AR MA Разница между двумя типами акриловых производных обусловлена различной вязкостью геля, который они образуют. Пример 1. Диспергируемые таблетки получают из сле дующей фармацевтической препаративной формы: Компоненты Вес (мг) % мае. Цефаклор 523,01 37,36 Гликоляткрахмал натрия 70 ,00 6,00 34479 C M C ' , A VI C EL P H 1 02 61 2, 99 43, 7 8 С теа ри л фу м зра т натр ия 14, 00 t , 00 Ко л л ои д ал ьн ы й дв у окс и д кре м н ия 70, 00 5, 00 Ас пар та м 10, 00 0, 71 З е мл я н ич на я от ду шк а 50, 00 3, 58 Безв од ная ли м он ная кис лот а 50, 00 3. 58 C M C м икр ок рис т а л лич ес ка я це л л ю ло за С пос о б на ч и н аю т с в з в е ш и в ан и й в с ех ис х од ны х м ат ер иа л ов от де ль но , зат е м пр ос е ива ю т их д ля на д е жн ос т и из м ер е ни я П ос ле п рос еи в а н ия экс ц ип ие нт ы по м е щ а ю т в пр иг о дн ы й с мес и те ль , зат е м д об ав ля ю т це ф ак л ор и по в то рн о - пе ре м е ш ив а ю т до го м ог ен но го с ос т оян ия С мес ев ой по р о ш ок пр опу с к а ют нес к о льк о ра з ч е р ез с и то с от в е рс ти я м и0, 7 м м П р ов о дя т пр ес с ов а ни е с пер и од ич ес к и м ко нт ро л е м в теч -е ни е про ц ес с а, от м еч ая ре зу ль т ат ы, по лу ч ен ны е на с вя за н н ы х ко н тр о ль н ы х кар т ах П ор о ш о к те ч ет у до в п етв о ри те ль н о и пр ес с ов а н ие прох о д ит б ез за тру д н ен и й В ко н це п ро ц ес с а по ка з ат е ль ны е п ро бы о тб ир а ю т д л я ана л из а {из нач а ла, с ере ди ны и ко н ца па рт и и ) пр и исп о льз ов а ни и ста тис т ич ес к ой ме то д ик и пр об о от бо р а Д ис пе рг иру е мы е та бл етк и, полу ч ен ны е при Э то м, им ею т с ле ду ю щ и е х арак тер ис т ики . Вес и нд ив и ду а ль ной таб летки 1 140 0 мг ± 5 % В ес 10 та б л ет ок: 14 г ± 3 % Т в е р дос ть 317 5, 2 к г (7 кг фу нт и ли 7 Кр ) Вы с ота: при м е рн о 5, 6 м м Ди а ме тр : 17, 15 м м Рас па д в в од е пр и 19° -2 1°С ; < 3 м ин у т Вн е шн ий в и д: бе л ого ц в е та с некото ры м и пятн а ми про зр ач н о й пов е рх нос ти Вк у с: пр и я тн ы й (с о в е рш е нн о не йт р ал ь ны й) С у с п ен з ия ' пос л е де з ин те гр а ц ии и вз б а л * Тыв ан ия ост а ется в ви де суспен зи и пр и ме р но 2 М ину ты. П р и м е р 2. ч Д ис п ер ги ру е м ы е та б л етк и получают из с л е ду ю щ е й ф а р ма ц ев т ичес ко й пре п ар ат и вн о й ф о р м ы по м ет о д ике, пр ив е де нн ой в пр и м ер е 1: Ком поненты Вес (мг) % ма е. Ц е ф ак лор 523, 01 41, 84 Гл ик о ля ткр ах м а л Н атрия 62, 50 5, 00 C M C ', AVI C EL P H 1 0 2 544, 4 9 43, 56 С т еа ри л ф у м ар ат нат рия 12, 50 1, 00 К ол л о и да ль ны й дв у окс и д кре м н ия 62, 50 5, 00 Ас па рт а м 5, 00 0, 40 З е м лян ич на я от ду шк а 40, 0 0 3, 20 C M C мик р окр ис т а л ли чес к ая ц е л л ю ло за П о л у ч ен н ы е д ис пе р ги ру е м ы е т аб л е тк и и мею т с л еду ю щ и е х а ра кт ер ис т ик и : В ес от де ль н ой т аб л ет ки: 125 0 мг ± 5 % Вес 1 0 таб л ет ок: 12, 5 г ± 3 % Т в ер дос ть: 35 38 1 кг (7, 6 К р) Вы с о та: при ме рн о 5, 5 м м 17, 15 м м Ди а мет р Рас п ад в ро де п р и 1 9° С < 3 м ину т пр ия тн ы й 2 Г С - Вку с (с ове р ш ен но не йт ра ль ны й) С у с пенз ия: пос л е д ез и нт ег р аци и и вз ба л ты ва ни я ос таетс я в виде с ус пе нз ии п ри м е рн о 2 м ину ты . П р и м е р 3. Д ис п е рг иру е м ы е та б ле тк и по лу ч а ют из с л е ду ю щ е й фа р м а це вт ич ес к о й пре п ар ат ив н ой ф о р м ы по м ет о д ике, пр ив е де нн ой в пр и м ер е 1. Ком поненты Вес (мг) % мае. Ц е ф акл ор 523, 01 41, 84 Гл ик о л ятк р ах м а л на тр и я 62, 5 0 5, 00 C M C ', A VI C E L PH 1 02 57 4, 49 45, 9 6 С те ар и л фу м а ра т нат ри я 12, 50 1, 00 Ко л л ои д ал ьн ы й дв у окс и д кре м н ия 12, 50 1, 00 С ах ар ин нат рия 5, 00 0, 40 З е м ля ни ч н ая о т ду шк а 6 0, 00 4, 8 0 C M C м ик рок р ис т а лл ич ес к ая ц е л лю л оз а П олу ч е нн ы е д ис п ерг и ру е м ы е та б ле тк и и ме ют с л е ду ю щ и е х ара кт ер ис ти ки. Вес от д е ль н ой т аб л етк и: 12 50 мг ± 5 % Вес 10 та б лет ок. 12, 5 г ± 3 % Т в ер дос ть: 36 28, 8 Кг (В К р) Вы с ота при мер но 5, 2 м м Ди а мет р 17, 15 м м Рас па д а в о де при 19° С -21 ° С : < 3 м ину т Вне шн ий в мд: бе л ов ат ы е Вкус 1 при ят ны й С у с пензия: пос л е де зи нт егра ц ии и в з б а л ты в ан ия ос та ет с я в в иде су с пензии пр и ме рн о 2 м ину ты . П р и м ер 4. Д ис п е рг иру е м ы е та б ле тк и по лу ч а ют и з с л е ду ю щ е й ф ар м а ц ев ти чес к о й пр еп а ра т ив но й ф о р м ы п ри ис по л ьз о ва н и и м ет о д ик и , пр и ве д е н но й в пр и ме ре 1: Ком поненты Вое (мг) % ма е. Ц е ф акл ор 52 3, 00 41, 8 4 Гл ико л ятк рах м а л натри я 62, 50 5, 00 C M C ', A VI C EL P H 10 2 56 2, 0 0 44, 9 8 С т еа ри л ф у м ар ат натри я 12, 50 1, 00 Ко л л ои д ал ьн ы й дв у окс и д кре м н ия 12, 50 1, 00 С ах а ри н натр ия 5, 00 0, 40 З е м ля ни ч н ая о т ду шк а 60, 00 4, 8 0 Дв у ок с и д ти та на 12, 50 1, 00 C M C м икр ок р ис т а л л ич ес ка я ц е л л ю л оз а П о лу ч е нн ы е д ис п ер г и ру е м ы е т а б л ет к и и ме ю т с л еду ю щ и е х а ра кт ер ис т ик и : В ес от де ль н ой т аб л ет ки: 125 0 мг ± 5 % Вес 10 та б лет ок: 12, 5 г ± 3 % Т в ер дос ть: 45 3 6 К г (1 0 К р) Вы с ота: при мер но 5, 1 м м 34479 Диаметр. 17,15 мм Распад в воде при 19°С-21°С. < 3 минут беловатые Внешний вид: приятный после дезинтеграВкус: ции и взбалтывания остается Суспензия: в виде суспензии длительный период (примерно 30 минут). Пример 5. Диспергируемые таблетки получают из следующей фармацевтической препаративной формы по методике, приведенной в примере 1. Компоненты Вес (мг) % мае. Цефаклор 523,01 45,49 Гликоляткрахмал натрия 115,00 10,00 Сухой текучий крахмал 445,00 38,70 Стезрилфумарат натрия 6,25 0,54 Коллоидальный диоксид кремния 6,25 0,54 Сахарин натрия 3,00 0,27 Земляничная отдушка 45,00 3,92 . Двуоксид титана 6,25 0,54 Полученные диспергир уемые табле тки имеют следующие характеристики: Вес отдельной таблетки: 1149,76 мг ± 5% Вес 10 таблеток: 11,5 г ± 3% Твердость: 3628.8 Кг (8 Кр) Распад в воде при 19°С-21°С: < 3 минут Хр упкость (10 таблеток): 0,9% Внешний вид:' беловатые Вкус: приятный Суспензия: после дезинте грации и взбалтывания остается в виде суспензии дли тельный период (примерно 30 минут). Пример 6 . Диспергируемые таблетки получают из следующей фармацевтической препаративной формы по методике, приведенной в примере 1: Компоненты Вес {мг) % мае. Цефаклор 523,01 48,29 'л. Гликоляткрахмал натрия 163,00 15,05 CMC, AVICEL PH102 345,00 31,85 Стеарилфумарат натрия 5,60 0,52 Коллоидальный двуоксид кремния 2,20 0,20 Сахарин натрия 3,00 0,28 Земляничная отДушка 38,00 3,51 Двуоксид титана 3,30 0,30 *СМС микрокристаллическая целлюлоза Полученные диспергир уемые табле тки имеют следующие характеристики. Вес отдельной таблетки: 1083,11 мг ± 5% Вес 10 таблеток: 10,8 г 3% Твердость: 3628,8-4082,4 Кг (8-9 Кр) Распад в воде при 19°С-21°С:
ДивитисяДодаткова інформація
Назва патенту англійськоюPharmaceutical formulation of cefaclor and method for its industrial production
Автори англійськоюArhe Mendisabal Flavia
Назва патенту російськоюФармацевтическая препаративная форма цефаклора и способ ее получения
Автори російськоюАрхе Мендисабаль Флавия
МПК / Мітки
МПК: A61K 31/545, A61K 31/16
Мітки: препаративна, спосіб, фармацевтична, цефаклору, одержання, форма
Код посилання
<a href="https://ua.patents.su/10-34479-farmacevtichna-preparativna-forma-cefakloru-ta-sposib-oderzhannya.html" target="_blank" rel="follow" title="База патентів України">Фармацевтична препаративна форма цефаклору та спосіб її одержання</a>
Попередній патент: Спосіб одержання чавуну
Наступний патент: Склад регулятора росту рослин в твердій формі
Випадковий патент: Спосіб ведення конвертерної плавки і пристрій для його здійснення