Спосіб одержання препарату, який містить фактор
Формула / Реферат
(57) 1. Способ получения препарата, содержащего фактор (G-CSF), стимулирующий рост колоний гранулоцитов, отличающийся тем, что смешивают G-CSF при температуре от 1 до 30°С по меньшей мере с одним веществом, выбранным из группы, включающей фармацевтически приемлемое поверхностно-активное вещество, сахарид, белоки высокомолекулярное соединение в соответствующих указанному порядку перечисления количества: 1-10000 мас.ч., 1-10000мас.ч., 1-20000 мас.ч. и 1-20000 мас.ч. на 1 ч.G-CSF, затем смесь растворяют в буферном растворе, при этом упомянутый фактор G-CSF обладает следующими физико-химическими свойствами:
а) молекулярный вес около 19000±1000, измеренный методом электрофореза через додецилсульфат натрия-полиакриламидный гель;
б) изоэлектрическая точка: имеет по меньшей мере одну из трех изоэлектрических точек р1=5.5±0,1; р1=5.8±0,1 и р1=6,1±0,1;
в) ультрафиолетовое поглощение: имеет максимальное поглощение при 280 нм и минимальное поглощение при 250 нм.
2. Способ по п.1, отличающийся тем, что берут аминокислотную последовательность 21 остатка от N-терминала: H2N-ThZ-Pro-Leu-Glu-Pro-Ala-Ser-Ser-Leu-Fro-Zeh-Ser-Phe-Leu-Leu-Lys-Cys-Leu-Zlu-Zbh-Val - поверхностно-активное вещество выбрано из группы, содержащей сложный эфир сорбитана и алифатической кислоты, сложный эфир алифатической кислоты и полиоксиэтиленсорбитана, простой алки-ловый эфир полиоксизтиленполиок-сипропилена, полиоксиэтилированное отвержденное касторовое масло, соль ал-килсульфата и лецитин, сахарид выбран из группы, включающий глицерин, ксилит, маннит, глюкуроновую кислоту, неймариновую кислоту, кетогликолевую кислоту, гепарин, хитин, хитозан, декстрин и альгиновую кислоту, белок выбран из группы, включающей альбумин человеческой сыворотки, глобулин сыворотки человека, обработанный кислотой или щелочью, желатин и коллаген, высокомолекулярное соединение выбрано из группы, включающей гидроксипропилцеллюлозу, гидроксиметилцеллюлозу, натрий-карбоксиметилцеллюлозу, гидро-ксиэтилцеллюлозу, полиэтиленгликоль и поливинилпирролидон, буферный раствор выбран из группы, включающей фосфатный буфер, ацетатный буфер и цитратофосфатный буфер.
Текст
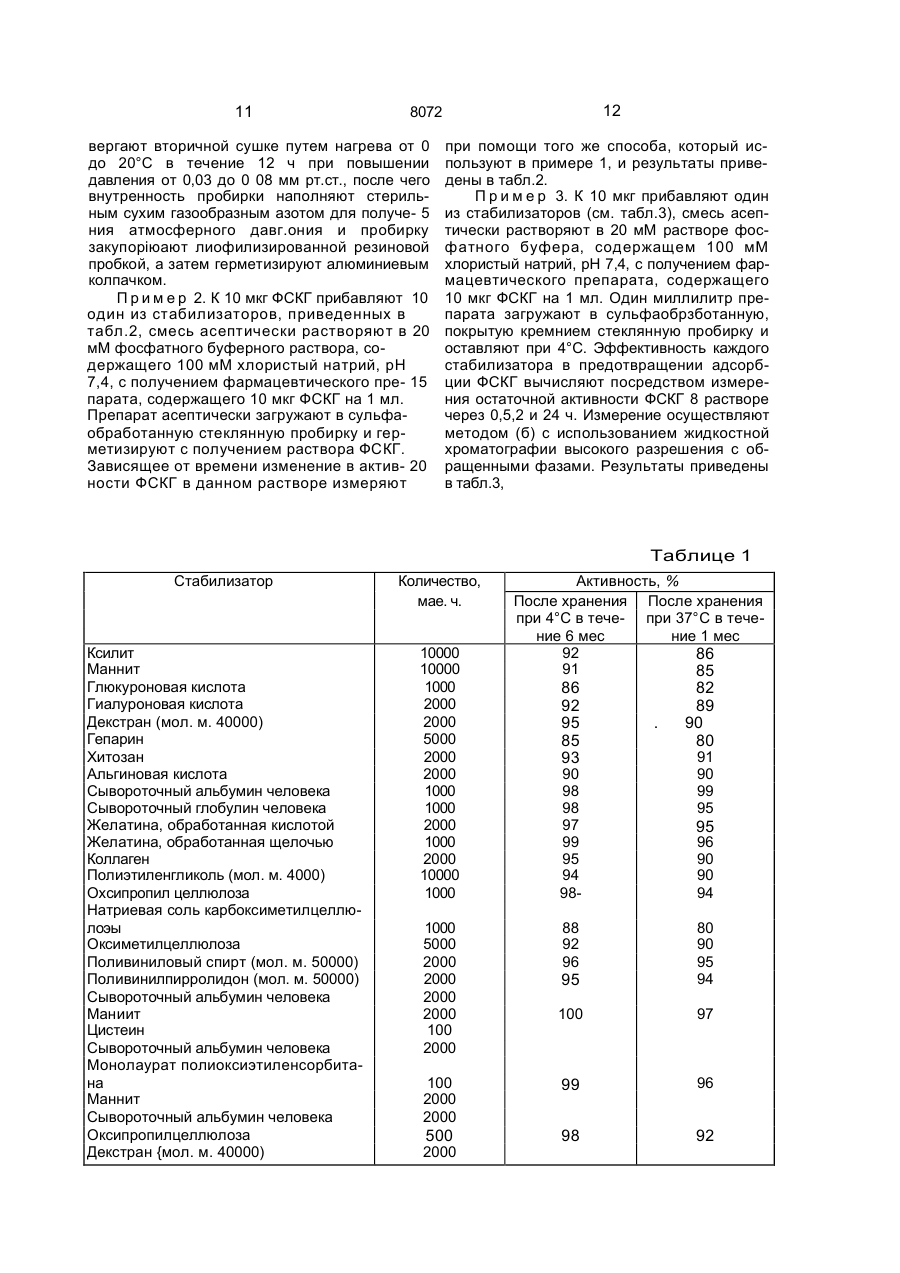
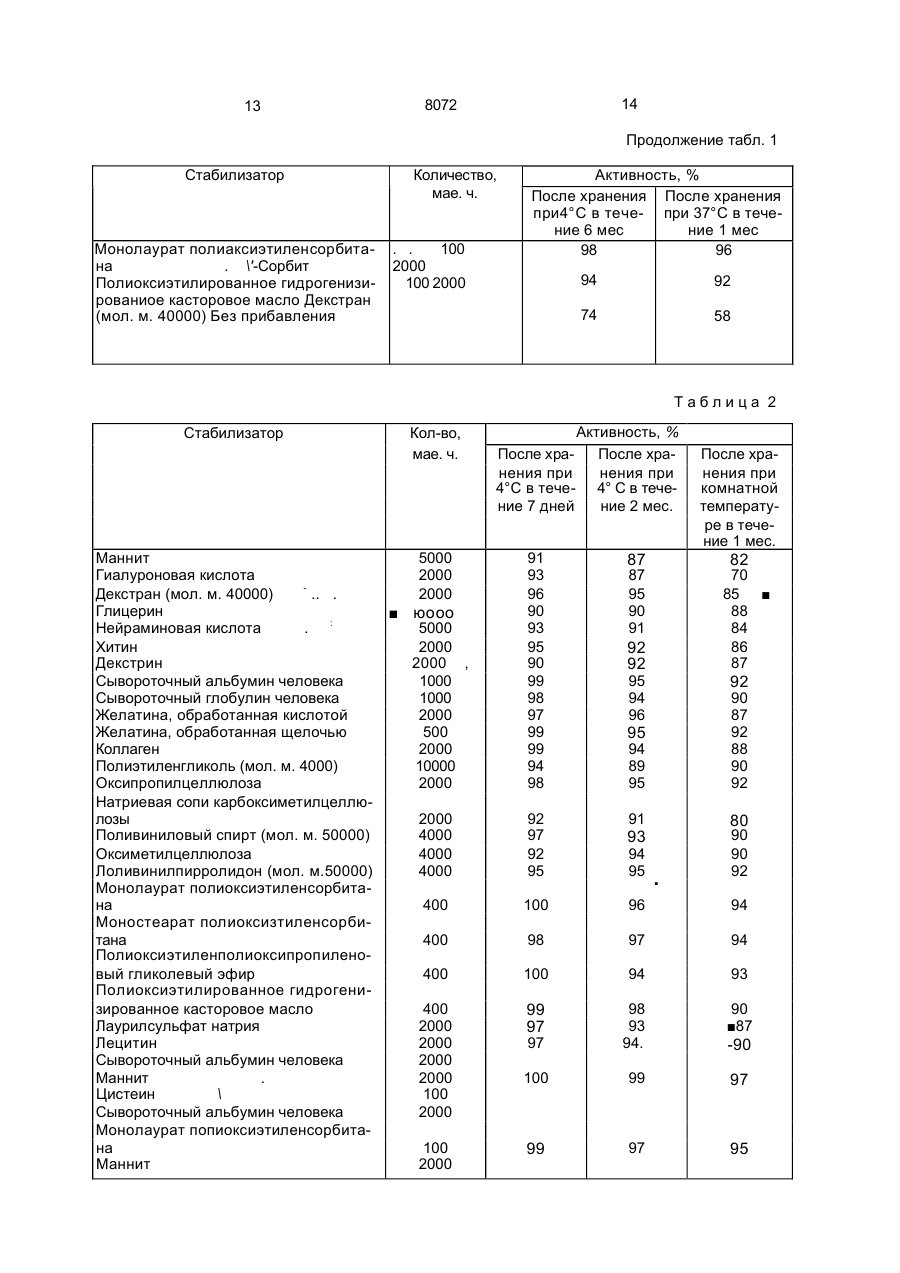
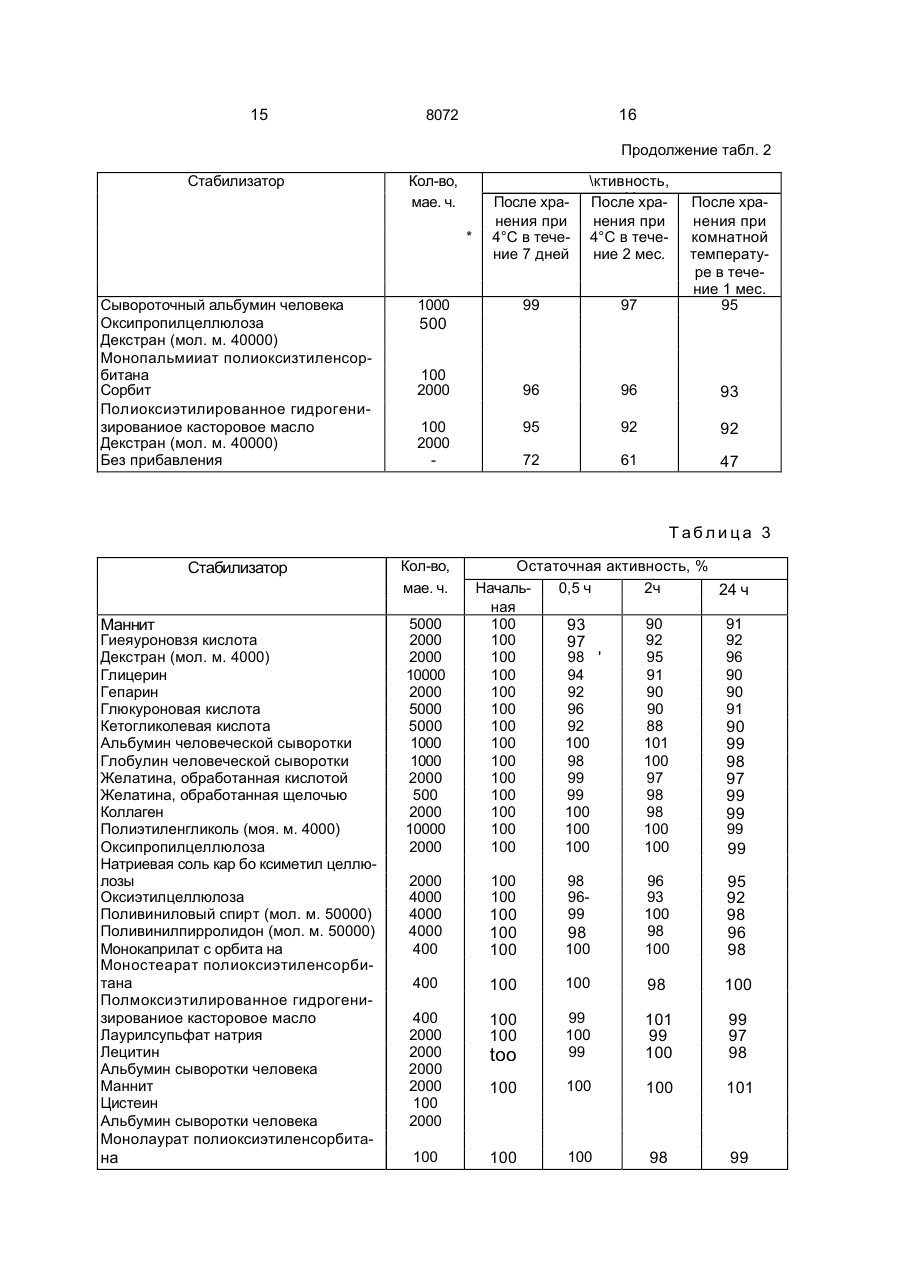
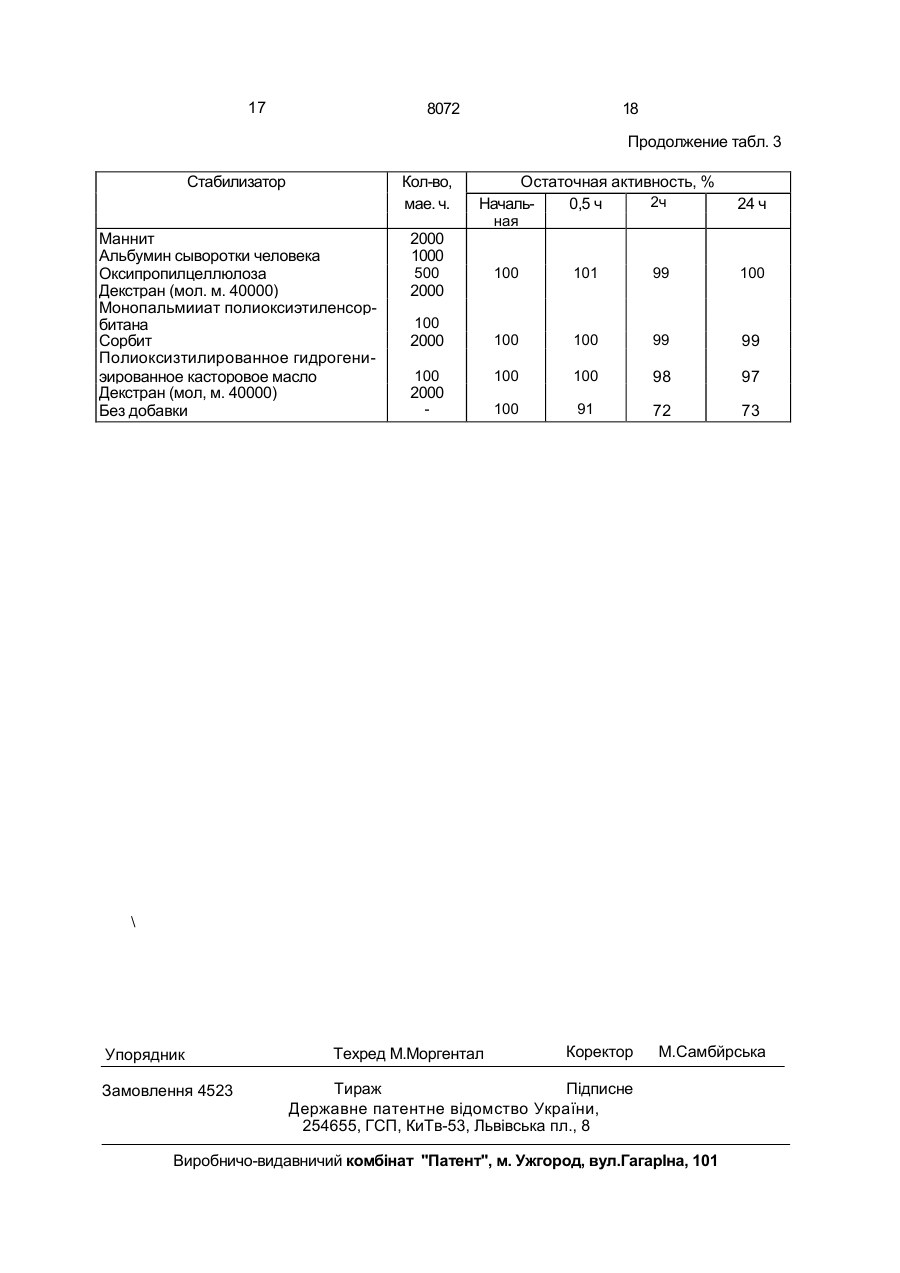
1. Способ получения препарата, содер жащего фактор (G-CSF), стимулирующий рост колоний гранулоцитов, о т л и ч а ю щ и й с я тем, что смешивают G-CSF при темпера туре от 1 до 30°С по меньшей мере с одним веществом, выбранным из группы, включа ющей фармацевтически приемлемое повер хностно-активное вещество, сахарид, белок и высокомолекулярное соединение в соот ветствующих указанному порядку перечис ления количества: 1-10000 мас.ч., 1-10000 мас.ч., 1-20000 мас.ч. и 1-20000 мас.ч. на 1 ч. G-CSF, затем смесь растворя;от в буферном растворе, при этом упомянутый фактор GCSF обладает следующими физико-химиче скими свойствами: а) молекулярный вес около 19000^:1000, измеренный методом электрофореза через додецил сульфат натрия-полиакриламидный гель; б)изоэлектрическая точка: имеет по меньшей мере одну из трех изоэлектрических точек р1-5.5±0, 1: р1«5. 8±0, 1 ир1«6,1±0,1; в) ультрафиолетовое поглощение: имеет максимальное поглощение при 280 им и минимальное поглощение при 250 нм. 2. Способ по п.1, о т л и ч а ю щ и й с я тем, что берут аминокислотную последовательность 21 остатка от N-терминала: HaNThZ-Pro-Leu-G!u-Pro-Afa-5er-Ser-teu-Fr6Zeh-Ser-Phe-Leu-Leu-Lys-Cys-Leu-Zlu-ZbhVa! - поверхностно-активное вещество аыбрано из группы, содержащей сложный эфир сорбитана и алифатической кислоты, сложный эфир алифатической кислоты і; полиоксизтияенсорбитана, простой алкиловый эфир полиоксизтиленполиоксипропилена, полиоксиэтилированное отвержденное касторовое масло, соль алкилсульфата и лецитин, сахарид выбргн из группы, включающий глицерин, ксилит, маннит, глюкуроноиую кислоту, неймариновую кислоту, кетогликолевую кислоту, гепарин, хитин, хитозан, декстрин и ал^гиновую кислоту, белок выбран из группы, включающей альбумин человеческой сыворотки, глобулин сыворотки человека, обработанный кислотой или щелочью, желатин и коллаген, высокомолекулярное соединение выбрано из группы, включающей гидроксипрогшлцеллюлозу, гидроксимегилцеллюлсзу, натрий-карбоксиметилцелпюлозу, гидроксиэтилцеллюлозу, пол и этилен гликоль и поливинилпирролидон, буферный раствор выбран из группы, включающей фосфатный буфер, ацетатный буфер и цитратбфосфатный буфер. S С 00 о 8072 Изобретение относится к химико-фармгцешичєской промышленности и касается сьгсоба получения препарата, содержащего фактор (G-CSF) стимулирующий рост колонии гранулоцигов(ФСКГ). Целью изобретения является повышение стабильности. Практикуемая в настоящее время химиотерапия заключает о себе различные неизбежные проблемы, предпринимаются интенсивные усилил с том,чтобы использовать лекарственное вещество, способное актипиросагь профилактические функции хозяина или субъекта, который заражен. ФСКГ проявляет способность активировать профилактические функции хозяина, кроме того, обнаружено, что ФСКГ показывает более высокие терапевтические эффекты в клинических применениях, если он используется в комбинации с веществом, которое активирует профилактические возможности хозяина. ФСКГ используется в очень малом количестве, фармацевтический препарат, содержащий 0,1-500 мкг (предпочтительно 5-50) ФСКГ, обычно вводят с интенсивностью дозировки 1-7 раз в неделю на взрослого пациента. Однако ФСКГ имеет склонность адсорбироваться на стенке емкости, например ампула для инъекции или шприц. Следовательно, если лекарство используется в виде инъекции в виде водного раствора, оно будет адсорбироваться на стенке емкости, например ампула или шприц. Это приводит к неспособности ФСКГ полностью проявлять активность в качестве фармацевтического средства, либо влечет за собой сведение ФСКГ в более чем необходимом количестве, принимая во внимание его воз1 можнук потерю вследствие адсорбции. Кроме того, ФСКГ является лабильным и чрезвычайно восприимчивым к окружающим факторам, например температура, влажность, кислород и ультрафиолетовые лучи. Под действием таких факторов ФСКГ испытывает физические и химические изменения: сооциация, полимеризация и окисление - и терпит большие потери в активности. Эти явления затрудняет осуществление полного выполнения терапевтического действия введением очень малого количества ФСКГ строгим образом. Поэтому существует необходимость разработки устойчивого фармацевтического препарта ФСКГ, который полностью защищен от лотери активности его эффективного ко понента. Это является основной целью и обретения, которое предлагает уотойчиві фармацевтический препграт ФСКГ. В способе приведены интенсивные исследования с целью повышения устойчивости ФСКГ. Цель может быть эффективно достигнута при помощи прибавления фармацевти5 чески приемлемого поверхностно-активного вещества, сахзрида, протеина или высокомолекулярного соединения. Следовательно, устойчиоый фармацевтический препарат, содержащий ФСКГ, от10 личается содержанием ФСКГ и по крайней мере одного вещества, выбранного из группы фармацевтически приемлемых поверхности о-актирного вещества, с а хари да, протеина или высокомолекулярного соеди15 нения. ФСКГ, содержащийся в фармацевтическом препарате настоящего изобретения, может быть получен любым из известных способов, которые описаны в патентах Япо20 нии №NM53273{1984),269455(1985), 270838 (1985) и 270839 (1985). Пол уч енный рг.т вор, сод ерж ащ ий ФСКГ, можно хранить в замороженном состоянии после дальнейшей его очистки и 25 концентрации с использованием любой известной методики. Альтернативно раствор можно хранить после его дегидратации такими способами, как, например, лиофилизация. 30 Вс е полученные таким образом ФСКГ могут быть обработаны, чтобы получить устойчивые ФСКГсодержащие фармацевтические препараты. 35 Типичные примеры поверхностно-активного вещества, которое используют для получения устойчивого ФСКГсодержащего Фармацевтического препарата настоящего иообретения, перечислены ниже. Неионоген40 ные поверхностно-активные вещества с Н1В 6-18; такие как сорбитановые сложные эфиры алифатической кислоты (например, сорбитанмонокаприлат, сорбитанмонолаурат и сорбитанмонопальмитет). глицериновые сложные 45 зфиры алифатической кислоты (например, глицеринмонокаприлат, глицеринмономиристат и глицеринмоностеарат), полиглицериновые сложные эфиры алифатической кислоты (например, декаглицерилмоностеарат, дека 50 глицерилдистеарат и декаглицерилмонолинолеат), полиоксиэтиленсорбитановые сложные эфиры алифатической кислоты (например, пол иоксиэтилен сорбитанмонолаурат, полно ксиэтиленсорбитанмоноолеат, 55 полиоксиэтил енсорбитанмоностеарат, полиоксиэтиленсорбитанмонопальминат, полиоксиэтиленсорбитантриолеат и полиоксиэтилексорбитантристеарат), полиоксиэтиленсорбитовые сл ожные эф иры алифатической кислоты (например, полиок 8072 сиэтиленсорбиттетрастеарат и полиоксиэтилснсорбиттетраолеат), полиэтиле и гл и ц е р ино в ы е сложные э ф и р ы алифатической кислоты (например, полиоксиэтиленглицерилмопостеарат), поли- 5 этиле игл и коле вые сложные эфиры алифатической кислоты (например, полиэтилен гликольдистеарат), полиоксизтиленовые простые алкиловые зфиры (например, полиоксиэтиленлауриновый эфир), полиоксиэтм- 10 ленполиоксилропиленовые простые алкиловые эфиры (например, полиоксиэтиленполиаксипропиленгликолевый эфир, полиоксиэтиленполиоксипропиленпропило-вый эфир и полиоксиэтиленполиоксипропи- 15 ленцетиловый эфир), полиоксиэтиленовые простые алкилфеноловые эфиры (например, полиоксиэтиленнонилфениловый эфир), полиоксиэтилированное касторовое масло, полиоксиэтилированное отвержденное 20 касторовое масло (полиоксиэтилированное гидрогенизированное касторовое масло), полиоксиэтилированные производные пчелиного воска (например, пчелиный воск полиоксиэтилированного сорбита), произ- 25 водные полиоксиэтиленланолина (например, полиоксиэтиленланолин) и полиоксиэтиленовые алифатические амиды (например, полиэтиленовый амид стеариновой кислоты). Анионогенные поверхностно- 30 активные вещества, такие как соли алкилсерной кислоты, имеющие Сю-Сі8-алкильную группу (например, цетилсульфат натрия, лаурилсульфзт натрия и олеилсуль-фат натрия), соли серной кислоты полиокси- 35 этиленового простого алкиловаго эфира, где среднее молярное число присоединения окиси этилена составляет 2-4 и алкильная группа содержит 10-18 атомов углерода (например, полиоксиэтиленовый лаурилсуль- 40 фат натрия), соли алкиловых сложных эфиров сульфосукцината, где алкильная группа содержит 8-18 атомов углерода (например, сложный эфир лаурилсульфосукцината натрия). А также природные по- 45 верхностно-активные вещества, такие как лецитин, глицерофосфолипид, сфингофосфолипид (например, сфингомиелин) и сложные эфиры алифатической кислоти сахарозы, где алифатическая кислота имеет 50 12-18 атомов углерода. Эти поверхностноактивные вещества, конечно, могут быть использованы либо самостоятельно, либо в смеси. Поверхностно-активные вещества, при- 55 веденные выше, предпочтительно использовать в количествах 1-1000 мас.ч. на мас.ч. ФСКГ. Сахарид, используемый при получении устойчивого ФСКГсодержащего фармацев тического препарата настоящего изобретения, может быть выбран из числа моносахаридов, олигосахаридов и полисахаридов, а также сложных эфиров и их нуклеотидных производных при условии, что они фармацевтически являются приемлемыми. Типичные примеры приведены ниже' трехатомные и высшие сахаридные спирты, такие как глицерин, эритрит, арабит, ксилит, сорбит и маннит, кислотные сахара, такие как глюкуроковая кислота, идуроновая кислота, нейраминовая кислота, галактуроновая кислота, глюкоиовая кислота, маннуроновая кислота, кетогликолевая кислота, кетогалактонооая кислота, кетогулоновая кислота, гиалуроновая кислота и ее соли, хондроитинсульфат и его соли, гепарин, инулин, хитин и его производные, хитозан и его производные, декстрин, декстран со средними м.мас. 5000-150000, альгиновзя кислота и ее соли. Все эти сахариды могут быть использованы с преимуществом либо самостоятельно, либо в смеси. Сахаридм, приведенные выше, предпочтительно использовать в количествах 110000 мас.ч. на мас.ч. ФСКГ. Типичными примерами протеина, используемого при получении устойчивого ФСКГсодержащего фармацевтического препарата настоящего изобретения, являются сывороточный альбумин человека, сывороточный глобулин человека, желатина, желатина, обработанная кислотой (средняя мол.м. 7000-100000), желатина, обработанная щелочью (средняя мол.м. 7000-100000), а также коллаген, Эти протеины могут быть использованы как самостоятельно, так и в смеси. Указанные протеины предпочтительно использовать в количествах 1-20000 мас.ч. на мас.ч. ФСКГ. Типичные примеры высокомолекулярного соединения, используемого при получении устойчивого ФСКГсодержащего фармацевтического препарата настоящего изобретения, включают природные полимеры, такие как оксипропилцеллюлоза, оксиметилцеллюлоза, натриевая соль карбоксиметилцеллюлозы и оксиэтилцеллюлоаа, а также синтетически полимеры, такие как полизтиленгликоль (мол.м. 300-6000), поливиниловый спирт (мол.м. 20000-100000] и поливинилпирролидон (мол.м, 20000100000), Эти высокомолекулярные соединения могут быть использованы и самостоятельно, и в комбинации. Высокомолекулярные соединения, приведенные выше, желательно использовать в количествах 1-20000 мас.ч. на мас.ч. ФСКГ, Чтобы составить устойчивый ФСКГсодержащий фармацевтический препарат на 8072 стоящего изобретения в пригодной дозировзгм-кні форме, могут быть введены один или более следующих агентов' разбавитель, растворяющее вспомогательное вещество, из-отоническое вещество, инертный наполнитель, модификатор рН, мягчитель и буфер. Стабилизированный ФСКГ фармацевтический препарат настоящего изобретения может быть приготовлен либо для перорального введения, либо для парентерального введения, например, путем инъекции, вводимой различными путями; большое разнообразие ф орм д озировки зависит от специфического режима сведения. Типичные формы дозировки: для перорального введения, такие как таблетки, пилюли, капсулы, гранулы и суспензии, растворы, суспензии и лиофилизированные препараты, предназначенные для внутренней инъекции, и для трансмукозного введения (через слизистую), такие как ректальные суппозитории, назальные лекарства и вагинальные супозитории. В соответствии с настоящим изобретением по крайней мере одно вещество, выбранно е и з груп пы , сос тоя щ ей и з поверхностно-активного вещества, сахарида, протеина или высокомолекулярного соединения, добавляют в ФСКГсодержащий фармацевтический препарат с тем, чтобы он был предохранен от адсорбирования на стенке его емкости или шприца и в то же время оставался устойчивым в течение продолжительного периода времени, Подобный механизм, посредством которого указанные вещества стабилизируют ФСКГ или предохраняют его от адсорбирования, ЄШЙ по известен. В присутствии поверностне-активного вещества поверхность ФСКГ, предоставляющего собой гидрофобный протеин, была бы защищена поверхностно-активным веществом от того, чтобы быть растворенной, так что ФСКГ, присутствующий в следовых количествах, эффективно предохранен от адсорбирования на стенке его емкости или шприца. Сахарид или гидрофильное высокомолекулярное соединение могли бы образовать гидратированный слой между ФСКГ и адсорбирующей Стенкой его емкости или шприца, тем самым эффективно предупреждая адсорбцию ФСКГ. Протеин мог бы конкурировать с ФСКГ из-за адсорбции на стенке его емкости или шприца, эффективно ингибируя адсорбцию ФСКГ. Кроме п ред отвращ ения адсорбции ФСКГ, упомянутые вещества могли бы также способствовать предотвращению ассоциации или полимеризации молекул ФСКГ. В присутствии поверхностно-активного веще 5 10 15 20 25 30 35 40 8 ства, сахарида, протеина или высокомолекулярного соединения отдельные молекулы ФСКГ диспергируют в этих веществах и взаимодействие между молекулами ФСКГ значительно ум еньшается, что вызывает значительное снижение вероятности их ассоциации или полимеризации. Кроме того, эти вещества могли бы затормозить самоокисление ФСКГ, которое ускоряется при высокой температуре или влажности, или предотвратить ассоциацию или полимеризацию ФСКГ в результате его самоокисления . Эти эфф екты ингиб ирооан ия самоокисления ФСКГ или предохранения его от ассоциации или полимеризации можно было бы усилить еще путем прибавления аминокислоты, серного восстановителя или антиокислителя. Описанные проблемы достойны особого внимания при использовании растворов для инъекции и суспензий, однако они также встречаются во время процессов составления ФСКГ в любых дозировочных формах, например таблетки. Прибавление поверхностно-активных веществ, протеинов, сахаридов или высокомолекулярных соединений эффективно и в этом последнем случае. Посредством прибавления по крайней мере одного вещества, выбранного из группы, состоящей из поверхностно-активного вещества, сахарида, протеина или высокомолекулярного соединения, ФСКГ является высокостабилизированным и сохраняет свою активность в течение продолжительного периода времени. Для достижения этих результатов количество каждого из этих веществ, в особенности его нижний предел, является решающим, желательны следующие интервалы: 1-10000 мас.ч. поверхностно-активного вещества, 1-10000 мэс.ч. сахарида, 1-20000 мас.ч. протеина и 120000 мас.ч. высокомолекулярного соединения на 1 мзе.ч. ФСКГ. 45 В соответствии с изобретением поверхностно-активное вещество, сахарид, протеин и/или высокомолекулярное соединение используют в точно определенной концентрации, которая эффективна не только для 50 предотвращения ФСКГ от адсорбирования на стенке емкости или шприца, но также в повышении устойчивости ФСКГсодержзщего фармацевтичес кого препарата. Как результат становится возможным гаранти55 ровать введение малой, однако, чрезвычайно точной дозы ФСКГ пациентам, поскольку ФСКГявляется дорогим препаратом, его эффективное использование приведет к более низким расходам на получение ФСКГсодержащих фармацевтических препаратов. 9 8072 Следующие примеры предлагаются для дальнейшей Иллюстрации настоящего изобретения. В этих примерах остаточная активность ФСКГ была определена одним из следующих способов. (а). Метод мягкого агара с использованием клеток костного мозга мышей. Лошадиную сыворотку (0,4 мл), 0,1 мл пробы, 0,1 мл суспензии клеток костного мозга мышей (самки) СЗН (Не) 0,5-1 х 105 ядерных клеток и 0,4 мл модифицированного культу рал ьного раствора McCoy'S 5A, содержащего 0,75% агара, смешивают, выливают о пластмассовую чашку для тканевой культуры (диаметр 35 мм), коагулируют и культивируют в течение 5 дней при 37°С в смеси 5% СОг и 95% воздуха при 100%-й влажности. Подсчитывают число образовавшихся колоний (одна колония состоит из по крайней мере 50 клеток), активность определяют из расчета одна единица соответствует активности для образования одной колонии. Модифицированный культуральный раствор McCoy'S 5A, используемый в методе 10 (а), получают при помощи следующих методик. Модифицированный культуральный раствор McCoy'S 5A (двойная концентрация). 12 г культурального раствора McCoy'S 5А (Gfbco), 2,55 г MEM среды аминокислота10 витамин (Nlssul Selyoku Co., Ltd), 2,10 г бикарбоната натрия и 50000 ед. калиевого ленициллинаЄ растворяют дважды & 500 мл дистиллированной воды, раствор асептически фильтруют через миллипоропый фильтр 15 (0,22 мкм). (б). Жидкостная хроматография высокого разрешения с обращенными фазами. Используя колонку С8 с обращенными «л фазами (4,6 мм х 300 мм, 5 мкм) и смесь нпропанол/трифторуксусная кислота в качестве подвижной фазы, определяют остаточную активность ФСКГ (введенного в количестве, эквивалентном 1 мкг) в следуюусловиях градиента. 25 Время, с 0 15 25 Растворитель(А) 0% 100% Определение проводят при длине волны 2І0 нм, процентное содержание остаточной активности ФСКГ вычисляют по следующей 35 Формуле: Остаточное количество ФСКГ по истечении определенного времени х 100 начальное количество ФСКГ Остаточное количество ФСКГ, опреде ленное данным методом, очень хорошо со гласуется с результатом, полученным при измерении методом мягкого агара (а) с ис- 45 пользованием клеток костного мозга мы шей, і П р и м е р 1.К5 мкг ФСКГ прибавляют один из стабилизаторов, приведенных в табл.1, смесь септически растворяют в 50 20 мМ буферном растворе, содержащем Активность /%/ Градиент Линейный Линейный 30 Растворитель (А): 30%-Й н-пропал и 0,1%-я трифторуксусная кислота. Растворитель (В): 60%-й н-пропанол и 0,1 %-я трифторуксусная кислота. Остаточная активность ФСК/0/ Растворитель (В) 0% 100% 100 мМ хлористый натрий, рН 7,4, с получением фармацевтического препарата, содержащего 5 мкг ФСКГ на 1 мл, который затем лиофилиэируют. Зависящее от времени изменение в активности ФСКГ измеряют методом (а), результаты приведены в табл.1 Активность (%) обозначает остаточную активность ФСКГ относительно первоначальной единицы и определяется по следующей формуле: единица активности по истечении определенного времени первоначальная единица активности Лиофилизацию осуществляют следующим образом. Раствор ФСКГ, содержащий стабилизатор, помещают в стерильную сульфаоб работа мну ю стеклянную пробирку, за х100. мораживают При -40°С или ниже в течение 4 ч, подвергают первичной сушке пут^м нагрева от -40°С до ОС за 48 ч при повышении давления от 0,03 до 0,1 мм рт.ст. Затем под 11 12 8072 вергают вторичной сушке путем нагрева от 0 до 20°С в течение 12 ч при повышении давления от 0,03 до 0 08 мм рт.ст., после чего внутренность пробирки наполняют стерильным сухим газообразным азотом для получе- 5 ния атмосферного давг.ония и пробирку закупоріюают лиофилизированной резиновой пробкой, а затем герметизируют алюминиевым колпачком. П р и м е р 2. К 10 мкг ФСКГ прибавляют 10 один из стабилизаторов, приведенных в табл.2, смесь асептически растворяют в 20 мМ фосфатного буферного раствора, содержащего 100 мМ хлористый натрий, рН 7,4, с получением фармацевтического пре- 15 парата, содержащего 10 мкг ФСКГ на 1 мл. Препарат асептически загружают в сульфаобработанную стеклянную пробирку и герметизируют с получением раствора ФСКГ. Зависящее от времени изменение в актив- 20 ности ФСКГ в данном растворе измеряют при помощи того же способа, который используют в примере 1, и результаты приведены в табл.2. П р и м е р 3. К 10 мкг прибавляют один из стабилизаторов (см. табл.3), смесь асептически растворяют в 20 мМ растворе фосфатного буфера, содержащем 100 мМ хлористый натрий, рН 7,4, с получением фармацевтического препарата, содержащего 10 мкг ФСКГ на 1 мл. Один миллилитр препарата загружают в сульфаобрзботанную, покрытую кремнием стеклянную пробирку и оставляют при 4°С. Эффективность каждого стабилизатора в предотвращении адсорбции ФСКГ вычисляют посредством измерения остаточной активности ФСКГ 8 растворе через 0,5,2 и 24 ч. Измерение осуществляют методом (б) с использованием жидкостной хроматографии высокого разрешения с обращенными фазами. Результаты приведены в табл.3, Таблице 1 Стабилизатор Количество, мае. ч. Ксилит Маннит Глюкуроновая кислота Гиалуроновая кислота Декстран (мол. м. 40000) Гепарин Хитозан Альгиновая кислота Сывороточный альбумин человека Сывороточный глобулин человека Желатина, обработанная кислотой Желатина, обработанная щелочью Коллаген Полиэтиленгликоль (мол. м. 4000) Охсипропил целлюлоза Натриевая соль карбоксиметилцеллюлоэы Оксиметилцеллюлоза Поливиниловый спирт (мол. м. 50000) Поливинилпирролидон (мол. м. 50000) Сывороточный альбумин человека Маниит Цистеин Сывороточный альбумин человека Монолаурат полиоксиэтиленсорбитана Маннит Сывороточный альбумин человека Оксипропилцеллюлоза Декстран {мол. м. 40000) 10000 10000 1000 2000 2000 5000 2000 2000 1000 1000 2000 1000 2000 10000 1000 1000 5000 2000 2000 2000 2000 100 2000 Активность, % После хранения После хранения при 4°С в тече- при 37°С в течение 6 мес ние 1 мес 92 86 91 85 86 92 95 85 93 90 98 98 97 99 95 94 98 91 90 99 95 95 96 90 90 94 95 80 90 95 94 100 97 100 2000 2000 99 96 500 98 92 2000 88 92 96 . 82 89 90 80 13 14 8072 Продолжение табл. 1 Стабилизатор Монолаурат полиаксиэтиленсорбитана . \'-Сорбит Полиоксиэтилированное гидрогенизированиое касторовое масло Декстран (мол. м. 40000) Без прибавления Количество, мае. ч. . . 100 2000 100 2000 Активность, % После хранения После хранения при4°С в тече- при 37°С в течение 6 мес ние 1 мес 98 96 94 92 74 58 Таблица 2 Стабилизатор Маннит Гиалуроновая кислота Декстран (мол. м. 40000) .. . Глицерин Нейраминовая кислота . : Хитин Декстрин Сывороточный альбумин человека Сывороточный глобулин человека Желатина, обработанная кислотой Желатина, обработанная щелочью Коллаген Полиэтиленгликоль (мол. м. 4000) Оксипропилцеллюлоза Натриевая сопи карбоксиметилцеллюлозы Поливиниловый спирт (мол. м. 50000) Оксиметилцеллюлоза Лоливинилпирролидон (мол. м.50000) Монолаурат полиоксиэтиленсорбитана Моностеарат полиоксизтиленсорбитана Полиоксиэтиленполиоксипропиленовый гликолевый эфир Полиоксиэтилированное гидрогенизированное касторовое масло Лаурилсульфат натрия Лецитин Сывороточный альбумин человека Маннит . Цистеин \ Сывороточный альбумин человека Монолаурат попиоксиэтиленсорбитана Маннит Кол-во, мае. ч. 5000 2000 2000 юооо 5000 2000 2000 , 1000 1000 2000 500 2000 10000 2000 2000 4000 4000 4000 После хранения при 4°С в течение 7 дней 91 93 96 90 93 95 90 99 98 97 99 99 94 98 92 97 92 95 Активность, % После хранения при 4° С в течение 2 мес. 87 После хранения при комнатной температуре в течение 1 мес. 82 87 95 90 91 70 85 88 84 86 87 92 92 95 94 96 92 94 89 95 90 87 92 88 90 92 91 80 95 90 90 92 93 94 95 400 100 96 94 400 98 97 94 400 100 94 93 400 2000 2000 2000 2000 100 2000 99 97 90 87 97 98 93 94. 100 99 97 99 97 95 100 2000 -90 15 16 8072 Продолжение табл. 2 Стабилизатор Кол-во, мае. ч. * Сывороточный альбумин человека Оксипропилцеллюлоза Декстран (мол. м. 40000) Монопальмииат полиоксизтиленсорбитана Сорбит Полиоксиэтилированное гидрогенизированиое касторовое масло Декстран (мол. м. 40000) Без прибавления После хранения при 4°С в течение 7 дней \ктивность, У После хранения при 4°С в течение 2 мес. 99 97 После хранения при комнатной температуре в течение 1 мес. 95 96 96 93 95 92 92 72 61 47 1000 500 100 2000 100 2000 Табли ца 3 Стабилизатор Маннит Гиеяуроновзя кислота Декстран (мол. м. 4000) Глицерин Гепарин Глюкуроновая кислота Кетогликолевая кислота Альбумин человеческой сыворотки Глобулин человеческой сыворотки Желатина, обработанная кислотой Желатина, обработанная щелочью Коллаген Полиэтиленгликоль (моя. м. 4000) Оксипропилцеллюлоза Натриевая соль кар бо ксиметил целлюлозы Оксиэтилцеллюлоза Поливиниловый спирт (мол. м. 50000) Поливинилпирролидон (мол. м. 50000) Монокаприлат с орбита на Моностеарат полиоксиэтиленсорбитана Полмоксиэтилированное гидрогенизированиое касторовое масло Лаурилсупьфат натрия Лецитин Альбумин сыворотки человека Маннит Цистеин Альбумин сыворотки человека Монолаурат полиоксиэтиленсорбита на Кол-во, мае. ч. 5000 2000 2000 10000 2000 5000 5000 1000 1000 2000 500 2000 10000 2000 Остаточная активность, % Началь0,5 ч 2ч 24 ч ная 100 90 91 93 100 92 92 97 100 98 ' 95 96 100 94 91 90 100 92 90 90 100 96 90 91 100 92 88 90 100 100 101 99 100 98 100 98 100 99 97 97 100 99 98 99 100 100 98 99 100 100 100 99 100 100 100 99 2000 4000 4000 4000 400 100 100 100 100 100 400 98 9699 100 96 93 100 98 100 95 92 98 96 98 100 100 98 100 400 2000 2000 2000 2000 100 2000 100 100 too 99 100 99 101 99 100 99 97 98 100 100 100 101 100 100 100 98 99 98 17 8072 18 Продолжение табл. 3 Стабилизатор Кол-во, мае. ч. Маннит Альбумин сыворотки человека Оксипропилцеллюлоза Декстран (мол. м. 40000) Монопальмииат полиоксиэтиленсорбитана Сорбит Полиоксизтилированное гидрогениэированное касторовое масло Декстран (мол, м. 40000) Без добавки Остаточная активность, % 2ч Началь0,5 ч 2000 1000 500 ная 24 ч 100 101 99 100 2000 100 100 99 99 100 100 100 98 97 100 91 72 73 2000 100 2000 \ Упорядник Замовлення 4523 Техред М.Моргентал Коректор М.Самбйрська Тираж Підписне Державне патентне відомство України, 254655, ГСП, КиТв-53, Львівська пл., 8 Виробничо-видавничий комбінат "Патент", м. Ужгород, вул.ГагарІна, 101
ДивитисяДодаткова інформація
МПК / Мітки
МПК: A61P 39/00, A61K 38/22
Мітки: фактор, спосіб, одержання, містить, препарату
Код посилання
<a href="https://ua.patents.su/10-8072-sposib-oderzhannya-preparatu-yakijj-mistit-faktor.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання препарату, який містить фактор</a>
Попередній патент: Гербіцидна композиція
Наступний патент: Пристрій для розподілу газу та утримання каталізатора в каталітичних шарах радіальних або аксіально-радіальних реакторів
Випадковий патент: Динамічна дробарка