Штам дріжджів pichia pastoris ps107(ppic9habil-2), що є продуцентом гібридного білка, який складається з альбуміну плазми крові людини та інтерлейкіна-2 людини, рекомбінантна плазміда pріс9наbil-2 і спосіб її конструювання
Номер патенту: 89249
Опубліковано: 11.01.2010
Автори: Падкіна Маріна Владіміровна, Самбук Єлєна Вікторовна, Смірнов Міхаіл Ніколаєвіч, Зіновьєва Юлія Грігорьєвна
Формула / Реферат
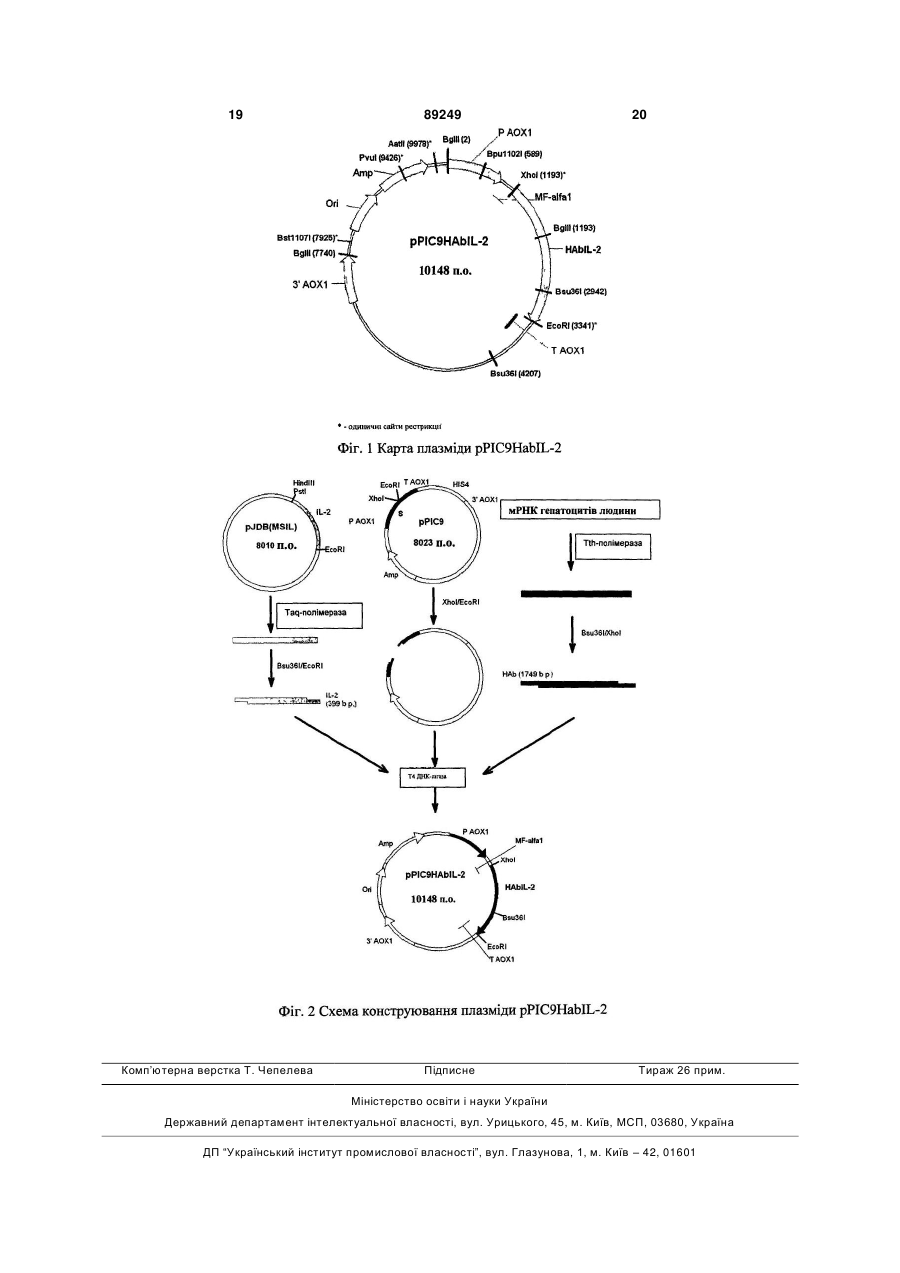
1. Рекомбінантна плазміда pPIC9HAblL-2, яка забезпечує біосинтез і секрецію гібридного білка, що складається з альбуміну плазми крові людини та ІЛ-2 людини, трансформованими нею клітинами дріжджів, яка має розмір 10148 п.о. і яка складається з наступних елементів:
- EcoR1-Xho1 - фрагмента плазмідної ДНК біфункціонального бактерійно-дріжджового вектора рРІС9 розміром 8,00 т.п.о., обмеженого сайтами рестрикції EcoR1-Xho1 і що включає бактерійний ген стійкості до ампіциліну; бактерійну область ініціації реплікації; ген HIS4 дріжджів; фрагмент 5'-некодуючої області дріжджового гена АОХ1 розміром 0, 95 т.п.о., що містить область, яка забезпечує активацію транскрипції цього гена у присутності метанолу як джерело вуглецю в культуральному середовищі; препрообласть гена MF![]() дріжджів Saccharomyces cerevisiae розміром 0,27 т.п.о., що забезпечує секрецію гібридного білка, що складається з альбуміну плазми крові людини та ІЛ-2 людини, в культуральне середовище; фрагмент гена АОХ1 розміром 0,33 т.п.о., що містить область термінації транскрипції цього гена; і фрагмент 3'-нетрансльованої області гена АОХ1 розміром 0,76 т.п.о.;
дріжджів Saccharomyces cerevisiae розміром 0,27 т.п.о., що забезпечує секрецію гібридного білка, що складається з альбуміну плазми крові людини та ІЛ-2 людини, в культуральне середовище; фрагмент гена АОХ1 розміром 0,33 т.п.о., що містить область термінації транскрипції цього гена; і фрагмент 3'-нетрансльованої області гена АОХ1 розміром 0,76 т.п.о.;
- Xho1-Bsu36l - фрагмента розміром 1749 п.о., що містить кодуючу частину гена альбуміну плазми крові людини за винятком області, що кодує сигнальний пептид, і термінуючого кодону;
- Bsu36l-EcoR1 - фрагмента розміром 399 п.о., що містить кодуючу частину гена ІЛ-2 людини за винятком області, що кодує сигнальний пептид.
2. Штам дріжджів Pichia pastoris PS107(pPIC9HAblL-2) - продуцент гібридного білка, що складається з альбуміну плазми крові людини та ІЛ-2 людини, що є штамом Pichia pastoris PS99 (his4 рер4::РНО85), трансформованим плазмідою pPIC9HAblL-2 за п. 1.
3. Спосіб конструювання рекомбінантної плазміди pPIC9HAblL-2 за п. 1, при якому
ген альбуміну плазми крові людини за винятком області, що кодує сигнальний пептид, і термінуючого кодону одержують за допомогою зворотної ПЦР з використанням матриці мРНК, одержаної з гепатоцитів людини, прямого праймера SEQ ID NO: 1, що містить сайт для рестриктази Хhо1, зворотного праймера SEQ ID NO: 2, що містить сайт для рестриктази Mstll;
ген ІЛ-2 людини за винятком області, що кодує сигнальний пептид, одержують за допомогою ПЦР з використанням матриці плазміди pJDB(MSIL), прямого праймера SEQ ID NO: 3, що містить сайт для рестриктази Bsu36l, зворотного праймера SEQ ID NO: 4, що містить сайт для рестриктази EcoR1;
одержаний ген альбуміну плазми крові людини обробляють рестриктазами Xho1 і Mstll;
одержаний ген ІЛ-2 людини обробляють рестриктазами Bsu36l і EcoR1;
лігують гени альбуміну плазми крові людини і ІЛ-2 людини, оброблені як вказано вище, з плазмідою рРІС9, заздалегідь обробленою рестриктазами Xho1 і EcoR1, і
одержаною лігазною сумішшю трансформують клітини Escherichia coli і відбирають клони, що містять рекомбінантну плазміду рРІС9НАblL-2.
Текст
1. Рекомбінантна плазміда pPIC9HAblL-2, яка забезпечує біосинтез і секрецію гібридного білка, що складається з альбуміну плазми крові людини та ІЛ-2 людини, трансформованими нею клітинами дріжджів, яка має розмір 10148 п.о. і яка складається з наступних елементів: - EcoR1-Xho1 - фрагмента плазмідної ДНК біфункціонального бактерійно-дріжджового вектора рРІС9 розміром 8,00 т.п.о., обмеженого сайтами рестрикції EcoR1-Xho1 і що включає бактерійний ген стійкості до ампіциліну; бактерійну область ініціації реплікації; ген HIS4 дріжджів; фрагмент 5'некодуючої області дріжджового гена АОХ1 розміром 0, 95 т.п.о., що містить область, яка забезпечує активацію транскрипції цього гена у присутності метанолу як джерело вуглецю в культуральному середовищі; препрообласть гена MF дріжджів Saccharomyces cerevisiae розміром 0,27 т.п.о., що забезпечує секрецію гібридного білка, що складається з альбуміну плазми крові людини та ІЛ-2 людини, в культуральне середовище; фрагмент гена АОХ1 розміром 0,33 т.п.о., що містить область термінації транскрипції цього гена; і фрагмент 3'-нетрансльованої області гена АОХ1 розміром 0,76 т.п.о.; - Xho1-Bsu36l - фрагмента розміром 1749 п.о., що містить кодуючу частину гена альбуміну плазми 2 (19) 1 3 Винахід відноситься до біотехнології, до генної інженерії, мікробіологічної і медичної промисловості і є дріжджовим штамом - продуцент гібридного білку, що складається з альбуміну плазми крові людини й інтерлейкіну-2 (ІЛ-2) людини, що містить сконструйовану in vitro плазміду, яка забезпечує синтез і секрецію даного гібридного білку. Даний винахід частково заснований на виявленні того факту, що гібридні білки, що містять альбумін плазми крові людини, приєднаний до цільового білку, володіють покращуваними фармакокінетичними властивостями, такими як триваліший час напівжиття (Yeh P et al. - Proc. Natl. Acad .Sci. - 1992. V.89. - P.1904-1908; Smith В. et al. - Bioconjugate Chem. - 2001 - V.12. - P.750-756; Halpern W. et al. Pharm. Res. - 2002. - V.19. - P.1720-1729). ІЛ-2 продукується Т-лімфоцитами у відповідь на антигенну і мітогенну стимуляцію або під впливом ІЛ-1 (Gillis S. et al. - J. Immunol. - 1978. - V.120. - P.2027-2032). Основна функція ІЛ-2 полягає в забезпеченні клітинної складової адаптивного імунітету. ІЛ-2 є чинником зростання і диференціювання Тлімфоцитів, NK-клітин, забезпечує диференціювання Т-кілерів і сприяє прояву функціональної активності Т- хелперів. Він також впливає на моноцити, експресуючі рецептор ІЛ-2, і підсилює синтез імуноглобулінів заздалегідь активованими Влімфоцитами (Smith K. - Science. - 1988. - V.240. Р.1169-1176). Широкий спектр біологічних активностей ІЛ-2 виявився могутнім стимулом для використання його як лікарського препарату і для створення рекомбінантних штамів мікроорганізмів - продуцентів цього цитокіну. В даний час в Росії зареєстровані і застосовуються два рекомбінантні ІЛ-2 людини: «Пролейкін» (Chiron Corp., США) і «Ронколейкін» (Біотех, Росія). Діючим початком «Пролейкіну» є ІЛ-2 людини, синтезований в клітинах Е. соlі. Рекомбінантний білок не гліколізований і є мутеїном, у нього відсутній N- кінцевий аланін і цистеїн в 125 положенні заміщений серином. Значні побічні ефекти, що супроводжують клінічне застосування «Пролейкіну», а також висока вартість препарату обмежують його широке використання. «Ронколейкін» є ІЛ-2 людини, синтезований в клітинах дріжджів S. cerevisiae. Відомими вживаними штамами є ВКПМ Y-791 (М'ясників А. Н. і ін., SU 17703359) і ВКПМ Y-3079 (Смирнов М. Н. і ін., SU 2230781). Рекомбінантний білок, як і у разі «Пролейкіну», накопичується усередині клітин у відновленому стані у вигляді "тілець включення" і не містить вуглеводного компоненту. Але, на відміну від «Пролейкіну», в молекулі «Ронколейкіна» відсутні амінокислотні заміни, і він не є мутеїном. Істотним недоліком ІЛ-2 є короткий період напівжиття, тому в процесі лікування необхідні часті ін'єкції препарату. Це робить більш дорогим лікування, може супроводжуватися побічними ефектами і негативно позначатися на якості життя пацієнтів (Winkelhake J., Gauny S. - Pharmacol. Rev. 1990. - V.42. - P.1-28; Nadeau R. et al., Drug Metabol. Dispos. - 1995. - V.23. - P.904-909). 89249 4 Для збільшення періоду напівжиття рекомбінантних білків використовують модифікацію молекули білка, яка полягає в ковалентному скріпленні активного білку з поліетиленгліколем (ПЕГ) або альбуміном. Пегілування ІЛ-2 супроводжується збільшенням періоду напівжиття препарату, уповільненням виведення, пониженням токсичності та імуногенності (Katre N. et al. - Proc. Natl. Acad. Sci. - 1987. V.84. - P.1487-1491; Knauf M. et al. - J. Biol. Chem. 1988. - V.263. - P.15064-15070; Chapes S. et al. - J. Appl. Physiol. - 1999. - V.86. - P.: 2065-2076). Проте ПЕГ- коньюгати не позбавлені недоліків, серед яких слід зазначити залежність активності білка від структури ПЕГ (Veronese F. - Biomaterials. - 2001 V.22. - P.405-417). Особливий інтерес представляє модифікація рекомбінантних білків за рахунок їх злиття з молекулою альбуміну людини. Альбумін є основним білком плазми крові людини. Період напівжиття альбуміну близько 19 днів. Він володіє рядом цінних властивостей, головною з яких є його здатність зв'язувати і транспортувати ендо- і екзогенні ліганди (у тому числі і білки). Альбумін грає роль природного стабілізатора і переносчика білків плазми крові. Він широко використовується як стабілізуючий агент при формулюванні лікарських препаратів, створених на основі білків (Peters Т. - All about albumin. - 1996. - Academic Press). Все вищевикладене свідчить про необхідність у створенні штамів мікроорганізмів - продуцентів гібридного білку, що складається з альбуміну плазми крові людини та ІЛ-2 людини. Використання для гетерологічної експресії метилотрофних дріжджів Pichia pastoris представляє особливий інтерес. Глікопротеїни, що секретуються дріжджами Pichia pastoris, не містять манозних залишків, зв'язаних 1,3-зв'язками і що є сильними антигенними детермінантами, що дозволяє одержувати разом з внутрішньоклітинними автентичні секреторні форми рекомбінантних білків (Montesino R. et al. - Protein Expr. Purif. - 1998. V.14. - P.197-207). Отримання секреторного продуценту гібридного білку, що складається з альбуміну плазми крові людини та ІЛ-2 людини, було б особливо актуальним. Природний ІЛ-2 є секреторним білком і лише в процесі секреції відбувається правильне замикання внутрішньомолекулярного дисульфідного зв'язку і гліколізування білку. Від коректного замикання дисульфідного зв'язку залежить біологічна активність ІЛ-2, а приєднання вуглеводних залишків підвищує стабільність молекули і збільшує час її циркуляції в кровотоці (Robb R. et al. - Proc. Natl. Acad. Sci. USA. - 1984. - V.81. P.6486-6490). Накопичення рекомбінантного білку в культуральній рідині значно спрощує процедуру його очищення. Таким чином, в завдання даного винаходу входило створення штаму, бажано, дріжджів Pichia pastoris, що синтезує гібридний білок, який складається з альбуміну плазми крові людини та ІЛ-2 людини, і що секретує даний гібридний білок в культуральну рідину, створення плазміди, яка дозволила б синтезувати згаданий гібридний білок в 5 89249 6 дріжджах Pichia pastoris, a також пропозиція споПлазміду pJDB(MSIL) (М'ясників та ін. А. с. SU собу конструювання такої плазміди. 17703359 А1. - МКИ С12N15/26, 1/19. - 1989) викоВказане завдання вирішено пропозицією пларистовують як матриці для ампліфікації гену ІЛ-2 зміди рРІС9НАbІL-2, яка забезпечує синтез і секлюдини за допомогою ПЦР. Послідовність фрагрецію гібридного білку, що складається з альбуміменту плазміди pJDB(MSIL), використана як матну плазми крові людини та ІЛ-2 людини, риця в ПЦР для отримання гену ІЛ-2 людини за трансформованими нею клітинами дріжджів, що винятком області, що кодує сигнальний пептид, складається з наступних елементів: представлена як SEQ ID NO:6. Курсивом приведе- EcoR1-Xho1 - фрагмента плазмідної ДНК біна послідовність гену ІЛ-2 людини за винятком функціонального бактерійно-дріжджового вектора області, що кодує сигнальний пептид. Виділені рРІС9 розміром 8,00т.п.о., що включає бактерійний послідовності, комплементарні прямому праймеру ген стійкості до ампіциліну, бактерійну область (SEQ ID NO:3) і зворотному праймеру (SEQ ID ініціації реплікації, ген HIS4 дріжджів; фрагмент 5'NO:4) для ПЦР. Підкреслені сайти для рестриктази некодуючої області дріжджового гену АОХ1 розміMstll і для рестриктази EcoR1. Як прямий праймер ром 0,95т.п.о., що містить область, яка забезпечує служить олігонуклеотид 5'активацію транскрипції цього гену у присутності caagctgccttaggcttagcacctacttcaagt (SEQ ID NO:3), метанолу як джерело вуглецю в культуральному що містить сайт для рестриктази Bsu36l. Як зворосередовищі; препрообласть гену MF дріжджів тний праймер використовують олігонуклеотид 5'ggaattcttaagtcagtgttgagatg (SEQ ID NO:4), який місSaccharomyces cerevisiae розміром 0,27т.п.о., що тить сайт для рестриктази EcoR1. Синтезований забезпечує секрецію гібридного білку, який склаген ІЛ-2 людини розміром 399п.о. виділяють за дається з альбуміну плазми крові людини і ІЛ-2 допомогою електрофорезу в 0,7% агарозному гелі, людини, в культуральне середовище; фрагмент обробляють рестриктазами Bsu36l і EcoR1. гену АОХ1 розміром 0,33т.п.о., що містить область Для отримання гену альбуміну людини застотермінації транскрипції цього гену; фрагмент 3'совують метод зворотної ПЦР, як матрицю виконетранслюємої області гену АОХ1 розміром ристовують мРНК, виділену з культури гепатоцитів 0,76т.п.о.; людини. Послідовність мРНК з гепатоцитів люди- Xho1-Bsu36І - фрагмента розміром 1749.п.о., ни, використана як матриця в реакції зворотної що містить кодуючу частину гену альбуміну плазПЦР для отримання гену альбуміну плазми крові ми крові людини за винятком області, що кодує людини за винятком області, що кодує сигнальний сигнальний пептид, і термінуючого кодону; пептид, і термінуючого кодону, представлена як - Bsu36І-EcoR1 - фрагмента розміром 399п.о., SEQ ID NO:5. Виділені послідовності, комплеменщо містить кодуючу частину гену ІЛ-2 людини за тарні прямому праймеру (SEQ ID NO:1) і зворотвинятком області, що кодує сигнальний пептид; ному праймеру (SEQ ID NO:2) для реакції зворотщо містить унікальні сайти розпізнавання наної ПЦР. Підкреслені сайти для рестриктази Xhol і ступних рестриктаз: Xho1 - 1193п.о.; EcoR1 для рестриктази Mstll. Прямим праймером є оліго3341п.о.; Bst1107І - 7925п.о.; Pvul - 9426п.о.; Aatll нуклеотид 5'-ccgctcgagaaaagagatgcacacaagagt 9978п.о. (SEQ ID NO:1), що містить сайт для рестриктази Схема плазміди рРІС9НАbIL-2 з рестрикційXho1, зворотним праймером служить олігонуклеоною картою зображена на Фіг.1. Загальний розмір тид 5'-tgaagtaggtgctaagcctaaggcagcttg (SEQ ID плазміди 10148.п.о. NO:2), що містить сайт для рестриктази Mstll. СинЗгідно винаходу також запропонований спосіб тезований ген альбуміну людини розміром конструювання плазміди pPIC9HAbIL-2. Схема 1749.п.о., виділяють за допомогою електрофорезу вказаного способу приведена на Фіг.2. в 0,7% агарозному гелі, обробляють рестриктазаУ запропонованому способі ген альбуміну плами Xho1 і Mstll. зми крові людини за винятком області, що кодує Одержані фрагменти ДНК, що містять ген ІЛ-2 сигнальний пептид, і термінуючого кодону одерлюдини і ген альбуміну людини, лігують з плазміжують за допомогою зворотної ПЦР з використандою рРІС9 («Invitrogen»), заздалегідь обробленою ням матриці мРНК, одержаної з гепатоцитів людирестриктазами Xho1 і EcoR1. ни, прямого праймера SEQ ID NO: 1, що містить Одержаною лігазною сумішшю трансформусайт для рестриктази Xho1, зворотного праймера ють клітини штаму DH5 Escherichia coli (F'/endA1 SEQ ID NO: 2, що містить сайт для рестриктази Mstll; ген ІЛ-2 людини за винятком області, що коhsdR17 (rk- mk+) supE44 thi-1 recA1 gyrA (Nalr ) дує сигнальний пептид, одержують за допомогою relA1 (lacZYA-argF)U169 deoR ПЦР з використанням матриці плазміди (( 80dlac (lacZ)M15), за допомогою рестрикційноpJDB(MSIL), прямого праймера SEQ ID NO: 3, що го аналізу відбирають трансформанти, що містять містить сайт для рестриктази Bsu36l, зворотного плазміду pPIC9AbFN. Для доказу ідентичності гену праймера SEQ ID NO: 4, що містить сайт для ресІЛ-2 і гену альбуміну, ампліфікованих за допомотриктази EcoR1; одержаний ген альбуміну плазми гою ПЦР, природним аналогам проводять визнакрові людини обробляють рестриктазами Xho1 і чення їхньої нуклеотидної послідовності (Sanger Mstll, одержаний ген ІЛ-2 людини обробляють ресF.S. et al. Proc. Natl. Acad. Sci. - 1977. - V.74. триктазами Bsu36l і EcoR1 і лігують з плазмідою Р.5463-5467). рРІС9, заздалегідь обробленою рестриктазами Таким чином, плазміда рРІС9НАbIL-2 створена Xho1 i EcoR1, потім лігазною сумішшю трансфорна основі човникового бактерійно-дріжджового мують клітини Escherichia coli і відбирають клони, інтеграційного вектору рРІС9 (є у продажу що містять рекомбінантну плазміду рРІС9НАbIL-2. ("Invitrogen"). В результаті трансформації лінеаризованою плазмідою і подальшої гомологічної ре 7 89249 8 комбінації відбувається вбудовування експресійної Морфологічні ознаки. касети в хромосому дріжджів Pichia pastoris, що Клітини округлої, злегка овальної форми, роззабезпечує стабільну підтримку клонованого гібміром 5-10мкм, частина клітин має на поверхні ридного гену, який складається з тих, що знахонирки або з'єднана з дочірніми клітинами. дяться в одній рамці прочитування гену альбуміну Культуральні ознаки. людини без термінуючого кодону і гену ІЛ-2 людиКлітини добре ростуть на повному органічному ни. Перевагою такої інтеграційної системи експресередовищі YEPD - 2% пептону, 1% дріжджового сії є також відсутність в геномі дріжджів інтегрантів екстракту, 2% глюкози або 1% гліцерину. фрагментів бактерійної ДНК і генів стійкості до Крім того, клітини добре ростуть на мінеральантибіотиків, що запобігає небезпеці горизонтальному середовищі SC: 1,34% Yeast Nitrogen Base ного перенесення цих генів. До складу плазміди («Difco», США), а також на інших синтетичних севходить ген HIS4 дріжджів, що дозволяє селективредовищах для дріжджів, що містять як джерело но відбирати трансформанти при використанні в вуглецю глюкозу (2%) або гліцерин (1%). якості реципієнтів штами дріжджів з мутаціями в Клітини штаму відрізняються слабким зросцьому гені. танням на середовищах, що містять як джерело Експресія гібридного гену, який складається з вуглецю метанол (0,5%-1%). тих, що знаходяться в одній рамці прочитування При зростанні на твердих середовищах клітигену альбуміну людини без термінуючого кодону, і ни утворюють гладкі, круглі колонії з матовою погену ІЛ-2 людини, у складі плазміди pPIC9HAblL-2 верхнею, ясно-кремового кольору, край нерівний. знаходиться під контролем промотора гену АОХ1, При зростанні в рідких середовищах утворющо містить області, які забезпечують активацію ють інтенсивну рівну суспензію. Культура має хатранскрипції у присутності метанолу в культуральрактерний запах метилотрофних дріжджів. ному середовищі, а також область ініціації транскФізіолого-біохімічні ознаки. рипції. Промотор гену АОХ1 належить до найбільш Клітини ростуть в межах від 4 до 37°С. Оптисильних дріжджових промоторів. Рівень експресії мальною температурою вирощування є 30°С. При генів, що знаходяться під контролем АОХ1 промозростанні в аеробних умовах клітини трохи закистора, ефективно регулюється джерелами вуглецю. люють середовище. Транскрипція гену АОХ1 повністю блокована при Оптимум рН для зростання складає 4,5-6,5. вирощуванні дріжджів на середовищі з глюкозою, Як джерело вуглецю клітини можуть викорисна середовищі з гліцерином спостерігається тільки товувати багато простих сполук, такі як: глюкоза, базальний рівень експресії гену. Використання гліцерин, метанол. метанолу як єдиного джерела вуглецю значно підЯк джерело азоту клітини можуть використосилює експресію гену АОХ1 і, отже, генів, що знавувати мінеральні солі в амонійній формі, амінокиходяться під контролем АОХ1 промотора. Це дослоти, сечовину. зволяє регулювати синтез гібридного гену, який Клітини здібні до аеробного і анаеробного зроскладається з тих, що знаходяться в одній рамці стання. прочитування гену альбуміну людини без терміІстотними ознаками штаму є відсутність потнуючого кодону, і гену ІЛ-2 людини в клітинах дріреби в гістидині. жджів. Регульована експресія клонованого гену Спосіб отримання EcoR1-Xho1 - фрагмента дозволяє істотно понизити метаболічне навантаплазмідної ДНК рРІС9 проілюстрований наступним ження на клітину дріжджів. Наявність у складі плаприкладом. зміди препрообласті гену MF дріжджів Приклад 1. Клітини бактерій Escherichia coli, що містять Saccharomyces cerevisiae забезпечує секрецію плазміду рРІС9, вирощують при 37°С протягом синтезованого гібридного білку, який складається з ночі в 1л живильного середовища LB (1% пептону, альбуміну людини і ІЛ-2 людини, в культуральну 0,5% дріжджового екстракту, 1% хлористого нарідину. трію), що містить ампіцилін в концентрації 50мг/л. Як продуцент гібридного білку, який складаКлітини збирають центрифугуванням при ється з альбуміну людини та ІЛ-2 людини, викори5000об/хв протягом 10 хвилин при 4°С, суспендустовують штам PS107(pPIC9HAblL-2). Штам ють в 20мл 25мМ трис-хлоридного буферу (рН8,0), PS107(pPIC9HAblL-2) одержаний трансформацією що містить 10мМ ЕДТА і 50мМ глюкози, додають штаму дріжджів PS99 (his4 pep4::PHO85) плазмі30 міліграм лізоциму та інкубують 10 хвилин при дою рРІС9НАbIL-2. Штам PS99 несе мутацію в гені кімнатній температурі. Далі додають 40мл 0,2М HIS4, що дозволяє селективно відбирати трансгідроокису натрію, що містить 1% додецилсульфаформантів, що несуть плазміду pPIC9HAblL-2. Мута натрію, обережно перемішують та інкубують тація в гені РЕР4 приводить до відсутності активпротягом 10 хвилин при 4°С. Розчин нейтралізуності протеаз А і В, а також карбоксипептидази Y в ють додаванням 30мл 3М ацетату натрію (рН5,0) і клітинах дріжджів, що супроводжується підвищенвитримують протягом 10 хвилин при 4°С. Після ням стабільності гетерологічних рекомбінантних цього центрифугують при 14000об/хв протягом 40 білків (Hisch H. H. et al. In: Walton E. F., Yarranton хвилин при 4°С. До супернатанту додають 0,6 G. T., Eds., Molecular and Cell Biology of Yeast. об'єму ізопропілового спирту, витримують 20 хви1989. - P.134-200). лин при кімнатній температурі і центрифугують Штам дріжджів Pichia pastoris при 14000об/хв протягом 20 хвилин при 20°С. PS107(pPIC9HAblL-2) характеризується наступниОдержаний осад промивають 70% етиловим спирми ознаками. том, висушують у вакуумі і розчиняють в 4мл дистильованої води. Далі додають 4,2г хлористого 9 89249 10 цезію і 0,36мл розчину бромистого етидію ggaattcttaagtcagtgttgagatg, який містить сайт для (10мг/мл). Одержаний розчин витримують протярестриктази EcoR1. Проба для ПЦР містить 5мкл гом 1 години при 4°С, потім центрифугують при матриці, 30рМ кожного праймера, 10мкл 1015000об/хв протягом 15 хвилин. Супернатант кратного розчину дезоксинуклеотидтрифосфатів центрифугують при 70000об/хв протягом 16 годин (дНТФ), що містить 1,25мМ кожного дНТФ (дАТФ, в центрифузі TL100 («Beckman»). Після центрифудТТФ, дГТФ, дЦТФ), 10мкл 10-кратного буфера гування відбирають смугу плазмідной ДНК (нижню для ПЦР (100mМ KСl, 100mМ (NH4)2SO4, 200mМ з двох флюоресцируючих в ультрафіолетовому Трис-НСl, рН8,8, 20mM MgSO4, 1% тритон Х-100). світлі смуг), двічі екстрагують бромистий етидій У пробу додається дистильована Н2О до кінцевого рівним об'ємом ізоамілового спирту, розбавляють об'єму 100мкл. в два рази дистильованою водою і осаджують Далі пробу прогрівають 5хв. при 95°С, охолоплазмідну ДНК двома об'ємами етилового спирту і джують, додають 2,5од. Вент-ДНК-полімерази 1/15 об'єму 3М ацетату натрію (рН5,0). Осад зби(«BioLabs») і проводять 50 циклів ПЦР в наступних рають центрифугуванням при 10000об/хв протяумовах: гом 10 хвилин, промивають 70% етиловим спир1хв. при 95°С (плавлення ланцюгів ДНК), 1хв. том і розчиняють в 0,5-1мл буфера ТІ (10мМ триспри 46°С (віджиг праймерів), 1хв. при 72°С (поліхлоридний буфер, рН 8,0, що містить 1мМ ЕДТА). меразна реакція). Після закінчення ПЦР пробу Концентрацію плазмідної ДНК визначають за погінкубують при 72°С 5хв. линанням розчину при довжині хвилі 260нм. ЧисРеакційну суміш вносять в лунки в 0,7% агарототу препарату контролюють за допомогою електзного гелю в буфері ТВЕ і проводять розділення рофорезу в 0,7% агарозному гелі в буфері ТВЕ одержаних фрагментів ДНК. Після закінчення роз(0,1М трис-боратний буфер, рН8,3, що містить ділення вирізують смужку гелю, ДНК, що містить 1мМ ЕДТА). фрагмент, розміром 399п.о., відповідний гену ІЛ-2 Гідроліз одержаної плазміди рРІС9 рестрикталюдини. Виділення ДНК з агарозного гелю провозами Xho1 і EcoR1 проводять в 10мМ трисдять за описаною вище методикою фірми хлоридному буфері (рН7,5), що містить 50мМ хлоQIAGEN. Гідроліз фрагменту ДНК, що містить амристого натрію, 10мМ хлористого магнію і 1мМ пліфікований ген ІЛ-2 людини, рестриктазами дитіотреітолу. До 5мкг плазмідної ДНК в об'ємі Bsu36l і EcoR1 проводять в умовах, описаних для 20мкл додають по 5од. кожної рестриктази, після розщеплювання плазміди рРІС9. чого пробу інкубують протягом 25 годин при 37°С. Спосіб отримання гену альбуміну людини проРеакційну суміш вносять в лунки в 0,7% агароілюстрований наступним прикладом. зного гелю в буфері ТВЕ і проводять розділення Приклад 3. одержаних фрагментів ДНК. Після закінчення розГен альбуміну людини одержують методом ділення вирізують смужку гелю, ДНК, що містить зворотної полімеразної ланцюгової реакції, викофрагмент, розміром 8т.п.о., відповідний лінеариристовуючи як матрицю мРНК, одержану з клітин зованому Xho1-EcoR1 фрагменту плазміди рРІС9. печінки людини. Клітини печінки людини (банк кліВиділення ДНК з агарозного гелю проводять за тинних культур Інституту цитології РАН, Санктметодикою, розробленою фірмою QIAGEN. СмужПетербург) культивують в середовищі Ігла, що ку гелю з фрагментом ДНК поміщають в пробірку і містить 2-глутамін і 10% ембріональну сироватку додають розчин QX1 (300мкл на 100 міліграм гевеликої рогатої худоби, до щільності 0,5лю), додають реактив QIAEX (10мкл на 5мкг ДНК) 1,0 105клітин/мл. Знімають клітини, використовута інкубують при 50°С протягом 10 хвилин, періоючи 0,02% версен, що містить хімотрипсину дично перемішуючи. Далі центрифугують 30 се(0,1міліграм/мл), двічі промивають клітини середокунд при 15000об/хв, супернатант відкидають, вищем Ігла, що містить 2-глутамін, 10% ембріонаосад двічі екстрагують розчинами QX2 і QX3, вильну сироватку великої рогатої худоби і осаджують даляють супернатант центрифугуванням при клітини центрифугуванням (800об/хв, 10хв.). Далі 15000об/хв протягом 30 секунд. Осад висушують клітини двічі промивають ізотонічним розчином, на повітрі, розчиняють в 20мкл буфера ТІ, вільним від РНКаз і ресуспендують в 100мкл розцентрифугують 30 секунд при 15000об/хв, суперчину, 4М, що містить, гуанідин тіоционат, 25мМ натант переносять в нову пробірку. цитрат натрію, рН7.0, 0,5% саркозил натрію, 0,1М Спосіб отримання гену ІЛ-2 людини проілюст2-меркаптоетанол і 0,3М ацетату натрію (рН4). рований наступним прикладом. Одержану суміш струшують на "Vortex" протягом Приклад 2. 10хв, центрифугують 5хв. при 12000об/хв., відбиГен ІЛ-2 людини ампліфікують за допомогою рають водну фазу, додають до неї рівний об'єм ПЦР. Як матриці використовують плазміду суміші фенол:хлороформ (1:1), урівноваженої буpJDB(MSIL). Виділення плазміди pJDB(MSIL) профером, що містить 25мМ цитрат натрію, рН7.0, водять в умовах, аналогічних для плазміди рРІС9. 0,5% саркозил натрію, 0,1М 2-меркаптоетанол і До 0,1мкг плазміди pJDB(MSIL), розчиненої в 0,3М ацетату натрію (рН4), струшують на "Vortex" 5мкл буферу ТІ, додають 1мкл 0,5М NaOH і нагріпротягом 5хв., центрифугують 5хв. при вають при 85°С протягом 3 хвилин. Потім пробу 12000об/хв. Відбирають водну фазу і повторюють швидко переносять в лід, додають 1мкл 0,5М НСl і екстракцію сумішшю фенол:хлороформ, центридалі використовують в ПЦР. фугують 5хв. при 12000об/хв. До водної фази доЯк прямий праймер служить олігонуклеотид 5'дають рівний об'єм ізопропілового спирту. Для caagctgccttaggcttagcacctacttcaagt, що містить сайт осадження поміщують суміш на -20°С на ніч. Після для рестриктази Bsu36l. Як зворотний праймер центрифугування (12000об/хв, 5хв.) осад промивикористовують олігонуклеотид 5'вають холодним 70% етанолом, підсушують і роз 11 89249 12 чиняють в 20мкл деіонізованої води, вільної від тих же умовах і суспендують в 1мл 75мМ хлорисРНКаз. того кальцію. До суспензії компетентних клітин Одержану РНК використовують як матрицю додають гліцерин до кінцевої концентрації 15%, для синтезу кДНК гену альбуміну людини за допорозділяють на аліквоти і зберігають при -70°С. Пемогою зворотної ПЦР з використанням Tthред трансформацією суспензію компетентних кліполімерази. Прямим праймером служить олігонуктин розморожують в крижаній лазні, додають лігалеотид 5'-ccgctcgagaaaagagatgcacacaagagt, що зну суміш та інкубують в крижаній лазні протягом містить сайт для рестриктази Xho1, зворотним 40 хвилин. Далі клітини піддають дії теплового праймером служить олігонуклеотид 5'шоку при 42°С протягом 2 хвилин, після чого інкуtgaagtaggtgctaagcctaaggcagcttg, що містить сайт бують в 1,5мл середовища LB при 37°С протягом 1 для рестриктази Mstll. Проба для проведення ПЦР години. Клітини збирають центрифугуванням при містить 1мкл матриці (приблизно 5мкг), 30рМ кож5000об/хв протягом 10 хвилин і висівають на чашного праймера, 10мкл 10-кратного розчину дезоки Петрі з середовищем LB, що містить 2% агару і ксинуклеотидтрифосфатів (дНТФ), що містить 50мг/л ампіциліну. Чашки інкубують при 37°С про1,25мМ кожного дНТФ (дАТФ, дТТФ, дГТФ, дЦТФ), тягом 12-16 годин. 10мкл 10-кратного буфера (500mM NaCl, 500mМ З окремих клонів трансформантів, що виросТрис-НСl, рН 9,0, 100mМ МgСl2), 5 од. Tthли, виділяють плазмідну ДНК за допомогою метополімерази. У пробу додається дистильована Н2О дики, використаної для отримання плазміди рРІС9, до кінцевого об'єму 50мкл. Стадію зворотної ПЦР за винятком того, що клітини Escherichia coli випроводять при 70°С протягом 3хв., потім 50хв при рощують в 10мл LB, і, відповідно, об'єми всіх роз42°С і 2хв при 94°С. чинів зменшують в 100 разів. Крім того, замість Одержану кДНК гену альбуміну людини викостадії центрифугування в градієнті щільності хлористовують як матрицю для ампліфікації цього ристого цезію проводять обробку ДНК панкреатичгену за допомогою ПЦР, яку проводять в наступною РНКазою. Для цього нуклеїнові кислоти, осаному режимі: 30сек. при 94°С, 30сек. при 58°С і джені ізопропіловим спиртом, розчиняють в 30сек. при 72°С. Повторюють цей цикл 45 разів, 100мкл буфера ТІ, додають 10мкл розчину РНКази після чого інкубують пробу при 72°С 5хв. Синтезо(1мг/мл) та інкубують 30 хвилин при 37°С. ваний ген альбуміну людини розміром 1749п.о. Далі проводять гідроліз одержаної плазмідної виділяють з агарозного гелю за описаною вище ДНК рестриктазами EcoR1 і Xho1 або Bglll. При методикою фірми QIAGEN. Гідроліз фрагменту рестрикції шуканої плазміди рРІС9НАbIL-2 і подаДНК, альбуміну людини рестриктазами, що містить льшому електрофорезі в 0,7% агарозному гелі в ампліфікований ген Xho1 і Mstll проводять в умопершому випадку виявляються фрагменти вах, описаних для розщеплювання плазміди 2,148п.о. і 8,0т.п.о., в другому - фрагменти рРІС9. 1911п.о., 2410п.о. і 5827п.о. З виявленого таким Спосіб отримання плазміди рРІС9НАbIL-2 прочином клону препаративно виділяють плазміду ілюстрований наступним прикладом. рРІС9НАbIL-2 так само, як описано для плазміди Приклад 4. рРІС9, і гідролізують рестриктазами Bst11071 і Для отримання плазміди рРІС9НАblL-2 провоAatll в умовах, описаних для розщеплювання пладять лігування Xho1-EcoR1 фрагмента плазміди зміди рРІС9. рРІС9 (отримання якого описано в прикладі 1), Bst11071-Aatll фрагмент плазміди pPIC9HAblLBsu36l -EcoR1 фрагмента гену ІЛ-2 людини (отри2, розміром 8,1т.п.о, виділяють за описаною вище мання якого описано в прикладі 2) і Xho1 -Mstll методикою фірми QIAGEN і використовують його фрагмента гену альбуміну людини (отримання для трансформації клітин дріжджів, як описано в якого приведено в прикладі 3). прикладі 5. Для цього змішують еквімолярні кількості ДНК Приклад 5. плазміди і ампліфікованих генів в 10мкл 40мМ Для отримання штаму дріжджів Pichia pastoris трис-хлоридного буфера (рН7,8), що містить 10мМ - продуцента гібридного білку, що складається з дитіотреітолу, 10мМ хлористого магнію, 0,5мМ альбуміну плазми крові людини та ІЛ-2 людини, АТФ, додають 5 од. ДНК-Лігази фага Т4 та інкубуклітини дріжджів штаму PS99 трансформують плають при 14°С протягом ночі. змідою pPIC9HAblL-2. Одержаною лігазною сумішшю трансформуКлітини дріжджів вирощують в 100мл середоють клітини штаму DH5 Escherichia coli (F’/endA1 вища YEPD при 30°С до досягнення культурою оптичної щільності, відповідної 2-4од. поглинання hsdR17 (rk- mk+) supE44 thi-1 recA1 gyrA (Nalr ) при довжині хвилі 600нм. Клітини двічі промивають relA1 (lacZYA-argF)U169 deoR стерильною водою, після чого суспендують в ( 80dlac (lacZ)M15). Для цього клітини 0,3мл 100мМ розчину ацетату літію та інкубують Escherichia coli вирощують в 100мл середовища при 30°С протягом 30 хвилин. До 50мкл одержаної LB при 37°C до досягнення культурою густини клісуспензії клітин додають 0,1-1мкг плазмідної ДНК, тинної суспензії, відповідної 0,4-0,6од. оптичної 50мкг ДНК сперми лосося, заздалегідь денатурощільності при довжині хвилі 550нм. Клітинну суваної нагріванням (10 хвилин при 100°С) і 0,3мл спензію охолоджують в крижаній лазні, центрифурозчину 100мМ ацетату літію, що містить 40% погують при 5000об/хв протягом 10 хвилин при 4°С. ліетиленгліколя 4000. Далі пробу інкубують 30 Клітини супендують в 100мл 10мМ хлористого хвилин при 30°С і 20 хвилин при 42°С, поміщають натрію, збирають центрифугуванням в тих же умона 15 секунд в крижану лазню і центрифугують 10 вах. Далі клітини суспендують в 50мл 75мМ хлосекунд при 10000об/хв. Клітини суспендують в 1мл ристого кальцію, витримують в крижаній лазні простерильної води і висівають на тверде середовитягом 40 хвилин, осаджують центрифугуванням в 13 89249 14 ще SC. Клони трансформантів зростають через 2натрію, що містить, 0,05% твін-20, 1% бичачого 3 діб. Клони, що виросли, пересівають на чашки з сироваткового альбуміну) протягом 2 годин при середовищем SC, що містить 2% глюкозу, окре37°С. Потім поміщують мембрану в той же буфер, мими колоніями, потім передруковують на середощо містить розведені в 500 разів кролячі полікловище MM (1,34% Yeast Nitrogen Base («Difco», нальні антитіла до ІЛ-2 людини, мічені біотином США), 0,5% метанолу, 2% агару («Difco», США) («NatuTec» Німеччина), та інкубують 2 години при для відбору трансформантів, що відрізняються 37°С. Далі тричі промивають мембрану буфером слабким зростанням на середовищі з метанолом, TBST та інкубують 1 годину при 37°С з розбавлещо свідчить про інтеграцію гібридного гену, що ним в 3000 разів конъюгатом стрептавідину з лужскладається з гену ІЛ-2 людини і гену альбуміну ною фосфатазою («Силекс М», Москва). Після людини, в локус АОХІ (фенотип Mets). відмивання мембрани буфером PBST (58мМ двоДля аналізу продукції гібридного білку, що заміщеного фосфату натрію, 17мМ однозаміщеноскладається з альбуміну плазми крові людини і ІЛго фосфату натрію, 68мМ хлористого натрію, 0,1% 2 людини, клітинами трансформантів фенотипу твін-20) додають розчин субстратів для лужної Mets їх вирощують при 30°С в 100мл рідкого серефосфатази 0,56мМ ВСІР (5-бром-4-хлор-3довища BMGY (2% пептону, 1% дріжджового екстіндолілфосфата р-толуідинова сіль), 0,48мМ NBT ракту, 1% гліцерину, 10мл 1М калій-фосфатного (нітротетрозоліум синій) в 10мМ трис-хлоридному буфера, рН6,0, 1,34% Yeast Nitrogen Base («Difco», буфері (рН9,2), що містить 59,3мМ хлористого США) до стаціонарної фази зростання протягом 2 магнію. Паралельно забарвлюють гелі 0,15% роздіб. Клітини збирають центрифугуванням при чином кумаси G250 в 25% ізопропанолі та 10% 5000об/хв протягом 10 хвилин, супернатант злиоцтовій кислоті і відмивають в 10% оцтовій кислоті. вають і переносять всю біомасу в 20мл рідкого При порівнянні спектру білків двох штамів у штамі середовища BMMY (2% пептону, 1% дріжджового PS107(pPIC9HAblL-2) виявляють появу додаткової екстракту, 0,5% метанолу, 10мл 1М калійбілкової смуги з молекулярною масою 82кДа, що фосфатного буфера, рН6,0, 1,34% Yeast Nitrogen дає чітку позитивну реакцію з антитілами до ІЛ-2 Base («Difco», США) для індукції експресії гібридлюдини. Молекулярна маса цього секретуємого ного білка, що складається з альбуміну плазми білку співпадає з теоретично очікуваною молекукрові людини та ІЛ-2 людини. Індукцію проводять лярною масою гібридного білку, що складається з при 30°С протягом 4 діб. Після закінчення індукції альбуміну плазми крові людини та ІЛ-2 людини. культуральне середовище відокремлюють від кліРівень синтезу гібридного білку, що складається з тинної біомаси центрифугуванням при 5000об/хв альбуміну плазми крові людини та ІЛ-2 людини протягом 10 хвилин. У культуральному середовищі визначають, порівнюючи інтенсивність забарвленвизначають вміст гібридного білку, що складається ня смуги рекомбінантного білка із смугою стандарз альбуміну плазми крові людини і ІЛ-2 людини, за тного білка. допомогою електрофореза в поліакриламідному Згідно з одержаними даними, клітини дріжджів гелі у присутності додецилсульфата натрію і подаштаму PS107(pPIC9HAblL-2) синтезують і секрельшої гібридизації з антитілами до ІЛ-2 людини. тують близько 5 міліграм гібридного білку, що Розділення білків проводять в 15% поліакриламідскладається з альбуміну плазми крові людини та ному гелі в стандартній системі буферів (електроІЛ-2 людини, на літр культури дріжджів. Гібридний дний буфер: 25мМ трис, 192мМ гліцин, 0,1% додебілок володіє біологічною активністю, характерною цилсульфат натрію, рН8,3; буфер для гелю: ІЛ-2 людини. 375мМ трис-хлоридний буфер, рН8,8). ПаралельПідсумовуючи вищесказане можна зробити но проводять розділення білків контрольного штависновок, що одержаний штам дріжджів Pichia му, вирощеного в ідентичних умовах. Як стандарти pastoris PS107(pPIC9HAblL-2) синтезує і секретує гібридний білок, що складається з альбуміну пламолекулярної маси використовують зми крові людини та ІЛ-2 людини, в кількості, досгалактозидазу (116,0кДа), бичачий сироватковий татній для його очищення в лабораторному масшальбумін (66,2кДа), овальбумін (45,0кДа), лактаттабі. В результаті такого очищення можуть бути дегідрогеназу (35,0кДа), ендонуклеазу рестрикції одержані препарати гібридного білка, придатні для Bsp98l (25,0кДа), -лактоглобулін (18,4кДа), лізодослідження його біологічних властивостей і терацим (14,4кДа). Після закінчення електрофорезу певтичної цінності. Перевагою даного продуценту білки ренатурують, витримуючи гелі 15 хвилин в є велика стабільність одержуваного рекомбінант10мМ трис-хлоридному буфері (рН7,5), 4М, що ного білка, що містить рІЛ-2 людини, в порівнянні з містить, сечовину, 20мМ ЕДТА, і переносять на продуктом штамів-прототипів (ВКПМ Y-791, ВКПМ нітроцелюлозну мембрану в 25мМ трис-192мМ Y-3079), що пов'язано з гліколізуванням його могліциновому буфері (рН8,3), що містить 20% метилекули і зшиванням з альбуміном плазми крові лового спирту, при 30-40В, протягом 1,5 годин. людини, а також спрощена процедура очищення, Далі мембрану витримують в буфері TBST (10мМ обумовлена секрецією рекомбінантного білку. трис-хлоридний буфер (рН8,0), 150мМ хлористого 15 89249 16 17 89249 18 19 Комп’ютерна верстка Т. Чепелева 89249 Підписне 20 Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюYeast strain pastoris ps107(ppic9habil-2), which is the producer of hybrid protein, consisting of albumin of human plasma and human interleukin-2, recombinant plasmid ppic9habil-2 and the method for designing thereof
Автори англійськоюPadkina Marina Vladimirovna, Zinovieva Yuliia Hrihorievna, Sambuk Yeliena Viktorovna, Smirnov Mikhail Nikolaievich
Назва патенту російськоюШтамм дрожжей рисниа pastoris ps107(ppic9habil-2), который является продуцентом гибридного белка, стостоящего из альбумина плазмы крови человека и интерлейкина-2 человека, рекомбинантная плазмида ppic9habil-2 и способ ее конструирования
Автори російськоюПадкина Марина Владимировна, Зиновьева Юлия Григорьевна, Самбук Елена Викторовна, Смирнов Михаил Николаевич
МПК / Мітки
МПК: C12N 1/19, C12N 15/81, C12N 15/62, C12R 1/84
Мітки: pріс9наbil-2, pastoris, штам, pichia, білка, ps107(ppic9habil-2, людини, плазміда, складається, продуцентом, альбуміну, крові, гібридного, плазми, інтерлейкіна-2, спосіб, дріжджів, рекомбінантна, конструювання
Код посилання
<a href="https://ua.patents.su/10-89249-shtam-drizhdzhiv-pichia-pastoris-ps107ppic9habil-2-shho-eh-producentom-gibridnogo-bilka-yakijj-skladaehtsya-z-albuminu-plazmi-krovi-lyudini-ta-interlejjkina-2-lyudini-rekombinantna.html" target="_blank" rel="follow" title="База патентів України">Штам дріжджів pichia pastoris ps107(ppic9habil-2), що є продуцентом гібридного білка, який складається з альбуміну плазми крові людини та інтерлейкіна-2 людини, рекомбінантна плазміда pріс9наbil-2 і спосіб її конструювання</a>
Попередній патент: Ультразвуковий пристрій системи охоронної сигналізації
Наступний патент: Спосіб підвищення ефективності розробки підводних родовищ корисних копалин
Випадковий патент: Циклопептидні антагоністи cxcr4