Блістерна упаковка для застосування в інгаляторах
Номер патенту: 95063
Опубліковано: 11.07.2011
Автори: Крюгер Міхаель, Трунк Міхаель, Метцгер Буркхард, Шіве Йоерг
Формула / Реферат
1. Блістерна упаковка, яка є інтегральним компонентом готового до застосування порошкового інгалятора та вибрана із групи, яка включає блістерні стрічки або блістерні диски, і яка має основний елемент із принаймні двома відкритими принаймні з одного боку відділеними одна від одної перемичкою порожнинами, які містять чутливий до впливу вологи інгаляційний склад і принаймні один отвір, який герметично закритий, яка відрізняється тим, що принаймні частина стінки основного елемента виконана зі зневоднювального матеріалу, де зневоднювальний матеріал являє собою полімерний склад, що включає один термопластичний полімер або декілька термопластичних полімерів; один еластомер або декілька еластомерів; один зневоднювальний засіб або декілька зневоднювальних засобів; необов'язково синтетичні, рослинні або тваринні волокна та необов'язково один або декілька пластифікаторів, стабілізаторів, барвників або пігментів; в якій кількість одного зневоднювального засобу або декількох зневоднювальних засобів становить не більше 30 мас. % в перерахунку на масу зневоднювального матеріалу.
2. Блістерна упаковка за п. 1, яка відрізняється тим, що зневоднювальний матеріал містить силікагель, активоване вугілля, цеоліти, оксид алюмінію, сульфат магнію або молекулярне сито.
3. Блістерна упаковка за п. 1, яка відрізняється тим, що один термопластичний полімер або декілька термопластичних полімерів вибрані з полістиролів, поліолефінів, поліамідів, полівінілхлоридів, поліуретанів, поліетилену, полікарбонату, складного поліефіру, поліпропілену або поліетилентерефталату.
4. Блістерна упаковка за п. 1, яка відрізняється тим, що один еластомер або декілька еластомерів вибрані із групи, яка включає бутадієн-стирольні каучуки, співполімери стиролу, етилену, бутилену та стиролу, бутилкаучуки, етилен-пропіленові каучуки, етилен-пропілен-дієнові каучуки, співполімери етилену та вінілацетату, співполімери етилену та акрилату, співполімери акрилонітрилу та бутадієну, полінорборнени, поліізопрени, поліхлоропрени та полібутадієни.
5. Блістерна упаковка за п. 1, яка відрізняється тим, що полімерний склад містить пластифікатори, стабілізатори, барвники або пігменти.
6. Блістерна упаковка за п. 1, яка відрізняється тим, що інгаляційний склад містить моногідрат тіотропійброміду.
7. Блістерна упаковка за п. 1, яка відрізняється тим, що містить як додатковий елемент тверде тіло зі зневоднювального матеріалу.
8. Блістерна упаковка за п. 1 або п. 7, яка відрізняється тим, що являє собою блістерний диск.
9. Блістерна упаковка за п. 1 або п. 7, яка відрізняється тим, що являє собою дископодібну блістерну упаковку висотою до 5 мм і діаметром до 15 см, з зовнішнього краю якої перпендикулярно її площині виконані заглибини або отвори, які закриті однією або декількома плівками.
10. Блістерна упаковка за п. 1 або п. 7, яка відрізняється тим, що являє собою здатну до проколювання блістерну упаковку.
11. Блістерна упаковка за п. 1 або п. 7, яка відрізняється тим, що являє собою блістерну упаковку у вигляді еластичної смуги з пакетиками з лікарським препаратом, яка складається із принаймні двох стрічок матеріалу, які можуть бути відокремлені одна від одної.
12. Блістерна упаковка за п. 11, яка відрізняється тим, що стрічки матеріалу мають багатошарову структуру з алюмінію та зневоднювального матеріалу, визначеного в будь-якому з пп. 1-6.
13. Блістерна упаковка за п. 1, яка відрізняється тим, що зневоднювальний засіб містить молекулярне сито.
14. Блістерна упаковка за п. 13, яка відрізняється тим, що має коефіцієнт проникності води, яка може потрапити в блістерну упаковку, що становить від 0,1 до 100 мг/рік при відкритому зберіганні при 40 °С та відносній вологості 75 %.
15. Блістерна упаковка за п. 1, яка відрізняється тим, що кількість одного зневоднювального засобу або декількох зневоднювальних засобів становить до 25 мас. % в перерахунку на масу зневоднювального матеріалу.
16. Інгалятор з поміщеною в нього блістерною упаковкою за п. 1, який містить одну або декілька разових доз.
Текст
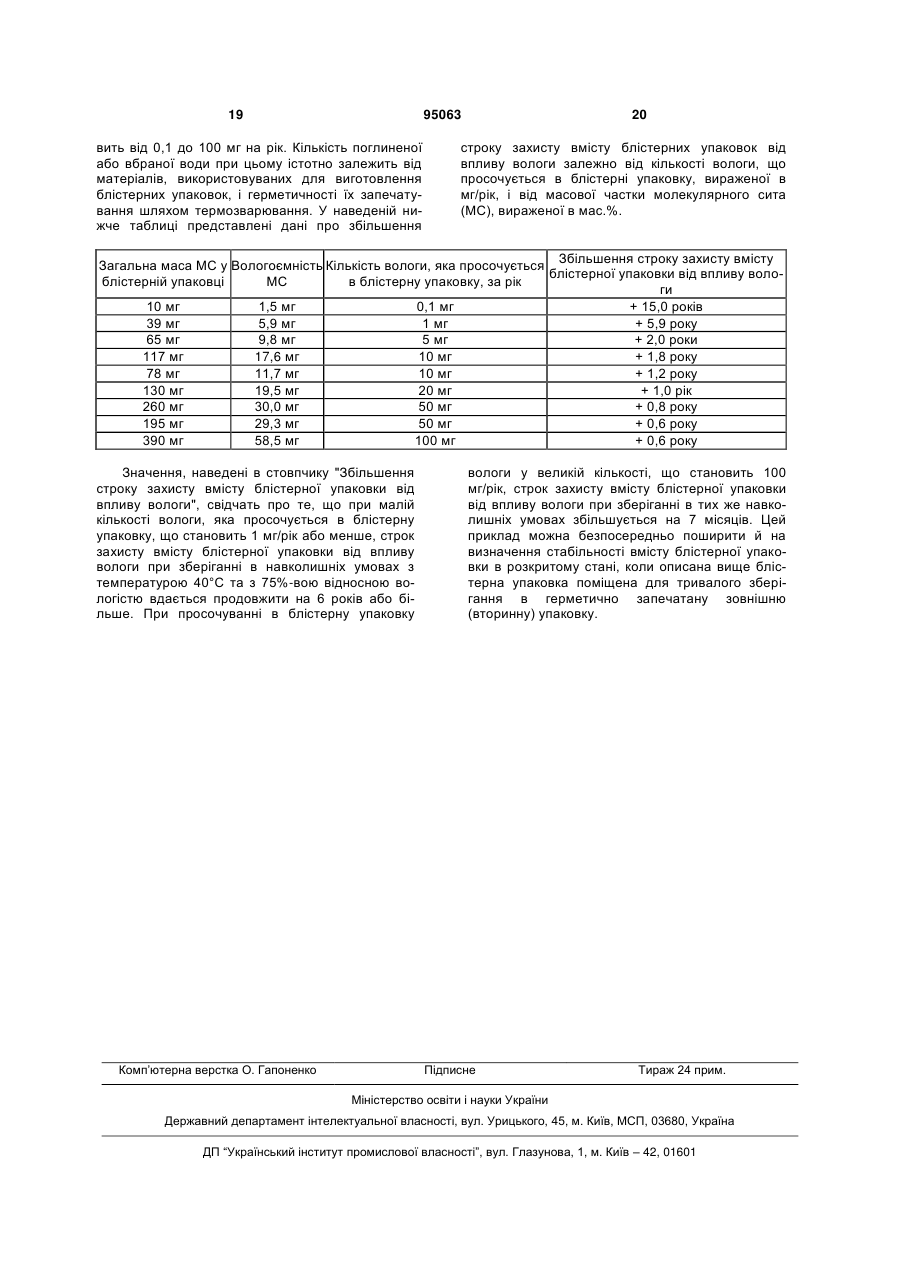
1. Блістерна упаковка, яка є інтегральним компонентом готового до застосування порошкового інгалятора та вибрана із групи, яка включає блістерні стрічки або блістерні диски, і яка має основний елемент із принаймні двома відкритими принаймні з одного боку відділеними одна від одної перемичкою порожнинами, які містять чутливий до впливу вологи інгаляційний склад і принаймні один отвір, який герметично закритий, яка відрізняється тим, що принаймні частина стінки основного елемента виконана зі зневоднювального матеріалу, де зневоднювальний матеріал являє собою полімерний склад, що включає один термопластичний полімер або декілька термопластичних полімерів; один еластомер або декілька еластомерів; один зневоднювальний засіб або декілька зневоднювальних засобів; необов'язково синтетичні, рослинні або тваринні волокна та необов'язково один або декілька пластифікаторів, стабілізаторів, барвників або пігментів; в якій кількість одного зневоднювального засобу або декількох зневоднювальних засобів становить не більше 30 мас. % в перерахунку на масу зневоднювального матеріалу. 2. Блістерна упаковка за п. 1, яка відрізняється тим, що зневоднювальний матеріал містить силікагель, активоване вугілля, цеоліти, оксид алюмінію, сульфат магнію або молекулярне сито. 3. Блістерна упаковка за п. 1, яка відрізняється тим, що один термопластичний полімер або декілька термопластичних полімерів вибрані з полісти 2 (19) 1 3 95063 4 14. Блістерна упаковка за п. 13, яка відрізняється тим, що має коефіцієнт проникності води, яка може потрапити в блістерну упаковку, що становить від 0,1 до 100 мг/рік при відкритому зберіганні при 40 °С та відносній вологості 75 %. 15. Блістерна упаковка за п. 1, яка відрізняється тим, що кількість одного зневоднювального засобу або декількох зневоднювальних засобів становить до 25 мас. % в перерахунку на масу зневоднювального матеріалу. 16. Інгалятор з поміщеною в нього блістерною упаковкою за п. 1, який містить одну або декілька разових доз. Даний винахід стосується первинної упаковки для інгаляційних складів, яка є інтегральним компонентом готового до застосування порошкового інгалятора та призначена насамперед для зберігання лікарських препаратів або складів, які містять моногідрат тіотропійброміду. Рівень техніки У лікуванні численних захворювань легенів важливу роль відіграє аерозольтерапія, заснована на інгаляційному введенні лікарських препаратів у дихальні шляхи та легені за допомогою аерозольних розпилювачів (небулайзерів), дозувальних аерозольних інгаляторів або інгаляторів сухих порошків. У цей час відомі однодозові та багатодозові порошкові інгалятори. В однодозових порошкових інгаляторах використовуються, наприклад, окремі капсули, кожна з яких містить порошковий склад у разовій дозі. Порошковий склад містить діючу речовину в мікронізованому вигляді (з розміром частинок приблизно від 1 до 5 мкм) і звичайно одну або декілька допоміжних речовин. Після поміщення використовуваної як витратна ємність капсули в порошковий інгалятор вона безпосередньо перед інгаляцією розкривається шляхом її проколювання, здавлювання або надрізання, після чого пацієнту необхідно зробити вдих, при якому порошок захоплюється потоком повітря з розкритої капсули та перетворюється на аерозоль, що переноситься повітрям та вдихується пацієнтом. Порошкові інгалятори підрозділяються на багатодозові порошкові інгалятори, які містять певний запас порошкового складу, який відбирається при кожній інгаляції в разовій дозі за допомогою вбудованого дозатора, і однодозові порошкові інгалятори, призначені для інгаляції порошкового складу, вже попередньо розфасованого у відповідну упаковку в разових дозах, які або спільно попередньо поміщаються в інгалятор і зберігаються в ньому, або окремо поміщаються в інгалятор перед кожним його використанням. Відповідно до даного винаходу особливий інтерес являють багатодозові порошкові інгалятори, призначені для інгаляції порошкових складів, попередньо розфасованих у разових дозах у блістерну упаковку у вигляді стрічки (блістерну стрічку) або диска (блістерний диск). У кожному випадку вирішальне значення для якості продукту й тим самим його придатності для інгаляційного застосування часто мають умови, у яких порошковий склад присутній в інгаляторі в упакованому вигляді. Приклади інгаляторів, робота яких заснована на двох вищевказаних принципах, відомі з рівня техніки. Так, зокрема, у DE 3348370 і DE 3336486 описані інгалятори, які містять дископодібну блістерну упаковку з декількома розташованими по окружності порожнинами. Кожна окрема порожнина містить по одній дозі призначеного для інгаляції лікарського порошку. По обидва боки порожнини закриті, наприклад, термічно привареною плівкою. Для інгаляції лікарського порошку порожнину, що його містить, розкривають. Розкрита порожнина повітряним каналом з'єднується з мундштуком інгалятора. Нижче як приклад більш докладно розглянутий інгалятор, описаний в DE 3336486. Такий інгалятор має корпус із розташованою в ньому камерою (витратною камерою), яка має впускний отвір для повітря й у якій знаходиться дископодібна, кругла блістерна упаковка із заповненими лікарським порошком заглибинами (кишенями). Блістерна упаковка рухомо з'єднана із круглим, обертаним диском. По окружності диска виконані отвори, які в осьовому напрямку сполучені із заповненими лікарським порошком заглибинами, тобто заповнені лікарським порошком заглибини та отвори в диску розташовуються одна над, відповідно під одним. Камера в корпусі інгалятора має також випускний отвір для повітря. Сам інгалятор оснащений, крім того, пробійником, розташованим таким чином, що він дозволяє розкривати кожну із заповнених лікарським порошком заглибин шляхом прибивання її стінки, через утворюваний в якій отвір лікарський порошок вивільняється в камеру в корпусі інгалятора, з якої його потім можна вдихати через мундштук. Щодо цього можна послатися на креслення зазначеної патентної заявки, відповідно патенту США. В DE 4106379 описаний інгалятор, у який можна помістити блістерну або аналогічну упаковку з лікарським порошком. Використовувана в такому інгаляторі блістерна упаковка складається із двох відокремлюваних одна від одної стрічок, які утворюють між собою принаймні одну ємність (порожнину), заповнену лікарським порошком. Інгалятор оснащений спеціальним механізмом, який для розкриття заповненої лікарським порошком ємності відокремлює одна від одної обидві стрічки на відповідній позиції розкриття. Розкрита ємність виявляється з'єднаною з випускним елементом, наприклад, мундштуком, через який користувач може вдихати з розкритої ємності лікарський порошок, який містяться в ній. Одна з утворюючих подібну блістерну упаковку стрічок може виконувати функції при цьому несучої стрічки з декількома заглибинами, а інша стрічка - закриваючої стрічки. У цьому випадку кожна з заглибин несучої стрічки й частина закриваючої стрічки, яка примикає до 5 неї, утворюють між собою по ємності. На позиції розкриття може бути передбачений привідний механізм, який відокремлює одна від одної несучу й закриваючу стрічки. Такий привідний механізм складається, наприклад, із двох привідних коліс (зокрема, зубчастих коліс), між якими при їх приведенні в обертання утримується закриваюча стрічка. Кожна окрема заглибина блістерної упаковки й у цьому випадку утворює в інгаляторі свого роду витратну камеру, що сполучається через повітряний канал з мундштуком. Упаковку лікарських порошків підрозділяють на первинну та вторинну. Характерна риса первинної упаковки полягає в тому, що вона безпосередньо контактує з інгаляційним складом. У деяких випадках первинна упаковка може бути укладена в другу, зовнішню захисну упаковку, так називану вторинну упаковку. Первинна упаковка може являти собою при цьому, наприклад, капсулу, тверду або гнучку блістерну упаковку з порожнинами або диск із порожнинами. Однак відповідно до даного винаходу капсули виключені з його обсягу. Вторинна упаковка може являти собою блістерну упаковку, кожух, пакет або іншу ємність. Вторинна упаковка при цьому звичайно повністю охоплює первинну упаковку. Вторинні упаковки використовують головним чином у тих випадках, коли первинна упаковка не забезпечує достатнього захисту лікарського порошку від впливу вологи. Первинні упаковки можуть виготовлятися із синтетичних полімерів, таких як поліетилен, полікарбонат, складний поліефір, поліпропілен, поліетилентерефталат і інші матеріали. Для виготовлення первинних упаковок придатні також, наприклад, комбіновані матеріали з полімеру та алюмінію або тільки алюміній. Функція первинної упаковки та використовуваної в деяких випадках вторинної упаковки полягає в захисті діючої речовини, а також усього інгаляційного складу від хімічної або фізичної зміни. До фізичних змін при цьому належать насамперед зміни, які можуть привести до відхилення вдихуваної дози високодисперсних частинок від заданої. Під дозою високодисперсних частинок при цьому мається на увазі кількість високодисперсних частинок, які потрапляють у легенів пацієнта. На дозу високодисперсних частинок впливають взаємодії частинок мікронізованої діючої речовини між собою, а також з допоміжними речовинами. Подібні взаємодії, як було встановлено, можуть змінюватися, особливо в результаті зміни рівня вологості усередині упаковки, у настільки значному ступені, при якому доза високодисперсних частинок помітно змінюється, насамперед зменшується. Подібні зміни при цьому так само можуть бути обумовлені й проникненням вологи усередину упаковку, і видаленням вологи з упаковки. Тому основна задача упаковки полягає в підтримуванні постійного хімічного складу атмосфери, яка переважає усередині неї, для запобігання фізичних або хімічних змін діючої речовини, відповідно для забезпечення стабільності інгаляційного складу. Щодо цього розрізняють короткочасну стабільність, яку повинен мати сам інгаляційний склад, навіть коли він не достатньо захищений 95063 6 матеріалом упаковки (так називана "стабільність при застосуванні"), і довгострокову стабільність, тобто стабільність, яка повинна забезпечуватися, поки інгаляційний склад знаходиться в не розкритій упаковці. Упаковки інгаляційного складу повинна, таким чином, забезпечувати його довгострокову стабільність. Первинну упаковку, матеріал і конструктивне виконання якої не здатні забезпечити довгострокову стабільність розфасованого в неї інгаляційного складу, необхідно поміщати у вторинну упаковку. Вибір придатної для виготовлення первинної упаковки матеріалу визначається двома факторами. По-перше, такий матеріал повинен бути здатний виконувати розглянуту вище захисну функцію. По-друге, подібний матеріал повинен мати властивості, які дозволяють надавати первинній упаковці, що виготовляється з нього, необхідну для її застосування в порошковому інгаляторі форму і які забезпечують можливість виконання виготовленою з нього первинною упаковкою передбаченої для неї функції. Як матеріали для виготовлення первинної упаковки бажано використовують полімери із групи термопластичних полімерів (термопластів), наприклад, полістироли, поліолефіни, поліаміди, полівінілхлориди або поліуретани. Такі матеріали мають необхідну для виконання механічних функцій первинної упаковки жорсткість, відповідно рухливість. Недолік же цих матеріалів полягає в їх двобічній проникності для вологи, що міститься у повітрі. Тим самим у даній галузі існує необхідність у підвищенні здатності упаковок зберігати стабільним упакований у них інгаляційний порошок. За спостереженнями несподівано було встановлено, що фармацевтичні склади або композиції, які як діючу речовину містять моногідрат тіотропійброміду, реагують на зміну ступеня вологості зміною своїх фізико-хімічних властивостей. Одне з рішень цієї проблеми могло б полягати в застосуванні як первинної упаковки матеріалів з введеним у них зневоднювальним засобом. Стислий опис винаходу З урахуванням сказаного вище в даному винаході пропонуються блістерні упаковки у вигляді стрічки (блістерної стрічки) або диска (блістерного диска), які призначені для зберігання інгаляційних порошків, що містять чутливу до впливу вологи лікарську речовину або являють собою чутливий до впливу вологи склад, і для застосування як інтегральний компонент готового до застосування порошкового, інгалятора і які забезпечують ефективний захист лікарської речовини або складу від поглинання ним вологи (наприклад, від поглинання води). Подібні упаковки повинні, крім того, зводити до мінімуму обмін матерією між їх внутрішньою частиною та навколишнім середовищем. У кращому варіанті блістерну упаковку виконують із пластмаси, у яку введений зневоднювальний матеріал, наявність якого дозволяє істотно поліпшити хімічну та фізичну стабільність фармацевтичного складу, який знаходиться в блістерній упаковці. Ще одна задача винаходу полягала у тому, щоб запропонувати таку упаковку попередньо ро 7 зділюваних на разові дози інгаляційних складів, які містять чутливу до впливу вологи лікарську речовину, яка при її знаходженні в багатодозовому порошковому інгаляторі сповільнювала б у порівнянні з відомими з рівня техніки ємностями проникнення вологи в інгаляційний склад. Докладний опис винаходу У даному винаході пропонується блістерна упаковка у вигляді блістерних стрічок або блістерних дисків, яка призначена для упаковки інгаляційних складів, що містять чутливу до впливу вологи лікарську речовину або являють собою чутливий до впливу вологи лікарський склад, і яка насамперед має основний елемент, виконаний з термопластичної пластмаси та має принаймні дві відділені одна від одної перемичкою порожнини. Ці порожнини відкриті принаймні з одного боку, але можуть бути також відкриті й із двох протилежних боків. У готовій до застосування блістерній упаковці отвори її порожнин закриті, наприклад, міцно з'єднаною з основним елементом термозварюванням, закриваючою плівкою. Кращими блістерними упаковками є блістерні диски. У порожнинах блістерної упаковки знаходиться інгаляційний порошок. Блістерна упаковка з розфасованим у її порожнини інгаляційним порошком і закритими або запечатаними порожнинами є інтегральним компонентом готового до застосування порошкового інгалятора. Пропонована у винаході блістерна упаковка відрізняється тим, що принаймні частина стінки її основного елемента виконана зі зневоднювального матеріалу. Форма пропонованої у винаході блістерної упаковки визначається порошковим інгалятором, для застосування в якому вона призначена. Основний елемент пропонованої у винаході блістерної упаковки може безпосередньо або опосередковано контактувати з фармацевтичним складом. Пропонована у винаході блістерна упаковка забезпечує кращий у порівнянні з відомими з рівня техніки, порівнянними з нею блістерними упаковками захист упакованого в неї інгаляційного складу, що містить чутливий до впливу вологи антихолінергічний засіб, який у деяких випадках може знаходитися в аморфному стані, і який до моменту його застосування (інгаляції) повинен протягом порівняно тривалого проміжку часу зберігатися в порошковому інгаляторі, від проникнення вологи ззовні, тобто із зовнішнього навколишнього середовища. Завдяки зниженому проникненню вологи усередину блістерної упаковки поліпшується довгострокова стабільність інгаляційного складу та його стабільність у розкритому стані. Довгострокову стабільність інгаляційного складу вимірюють при його знаходженні в герметично запечатаній блістерній упаковці або в упакованому й запечатаному порошковому інгаляторі шляхом тривалого зберігання, визначаючи збільшення строку, протягом якого блістерна упаковка забезпечує захист інгаляційного складу від впливу вологи, залежно від кількості просочуваної в блістерну упаковку, відповідно упакований порошко 95063 8 вий інгалятор вологи, вираженої в мг/рік, і від масової частки молекулярного сита. Стабільність інгаляційного складу в розкритому стані вимірюють на вже більше не упакованому та не запечатаному (тобто розкритому) порошковому інгаляторі або на витягнутій із блістерної упаковки капсулі. У цьому випадку вимірюють ті ж параметри, що й при визначенні довгострокової стабільності при зберіганні. Довгострокову стабільність і стабільність у розкритому стані вимірюють, наприклад, при 30-40°С та 75%-вій вологості на заповнених інгаляційним порошком і на не заповнених ним блістерних упаковках, відповідно на порошкових інгаляторах із заповненими інгаляційним порошком і не заповненими ним блістерними упаковками. Відповідно до винаходу всі стінки порожнини не обов'язково, але бажано виконувати з одного і того самого матеріалу. У пропонованій у винаході блістерній упаковці принаймні стінка, що закриває отвір її порожнини, може бути виконана з матеріалу, відмінного від матеріалу, з якого виконані інші стінки порожнини. Під інгаляційним складом бажано мається на увазі фармацевтичний (лікарський) порошковий склад, який як активний інгредієнт містить антихолінергічний засіб і частинки якого мають розмір менше 100 мкм. Вираз "інтегральний компонент готового до застосування інгалятора" означає, що блістерна упаковка являє собою розташований усередині інгалятора елемент, без якого поміщення в інгалятор лікарського складу (інгаляційного складу) для його інгаляції неможливе, відповідно не передбачене. Цей елемент у готовому до застосування стані може бути нерознімно та міцно з'єднаний з інгалятором і тим самим не може бути без свого руйнування або без ушкодження інгалятора витягнутий з нього або він може бути рухомо, відповідно рознімно з'єднаний з інгалятором і може бути без свого руйнування витягнутий з нього. Вираз "готовий до застосування" означає, що пропонована у винаході ємність (блістерна упаковку) вставлена в інгалятор. При необхідності така ємність механічно розкривається відповідними деталями інгалятора і/або переміщається в інгаляторі до місця вивільнення з її інгаляційного складу. Обидві ці стадії можуть виконуватися й у зворотній послідовності. Як матеріал для виготовлення основного елемента пропонованої у винаході блістерної упаковки краще використовувати полімерні склади, які містять принаймні один термопластичний полімер, принаймні один зневоднювальний засіб і необов'язково принаймні один еластомер і/або при необхідності пластифікатор і/або інші волокна. До складу подібного матеріалу, з якого виготовляється основний елемент пропонованої у винаході блістерної упаковки, не входять при цьому ні желатин, ні целюлоза або крохмаль або їх похідні. Кращі полімерні склади містять, наприклад, один або декілька термопластичних полімерів у кількості від 50 до 80 мас.%, один або декілька зневоднювальних засобів у кількості від 20 до 50 мас.%, один або декілька еластомерів у кількості 9 від 2 до 8 мас.% і необов'язково синтетичні і/або рослинні і/або тваринні волокна довжиною від 0,5 до 4 мм у кількості від 1 до 4 мас.%. Зневоднювальний засіб краще використовувати в кількості не більше 30 мас.%, найбільш бажано в кількості аж до 25 мас.%. Як полімерний компонент пластмаси використовують насамперед термопластичні полімери, такі, наприклад, як полістироли, поліолефіни, поліаміди, полівінілхлориди або поліуретани. Як полімерний компонент особливо краще використовувати поліетилен, насамперед поліетилен із 3 густиною в межах від 900 до 1000 кг/м , бажано від 3 940 до 980 кг/м , найбільш бажано із густиною 3 960кг/м (поліетилен високої густини), полікарбонат, складний поліефір, поліпропілен або поліетилентерефталат. Як приклад зневоднювальних засобів можна назвати силікагелі, активоване вугілля, цеоліти, оксид алюмінію, сульфат магнію, молекулярні сита й аналогічні матеріали. Як еластомери полімерні склади можуть містити, наприклад, одну або декілька речовин із групи, яка включає бутадієн-стирольні каучуки (СКС), співполімери стиролу, етилену, бутилену та стиролу (СЕБС), бутилкаучуки, етилен-пропіленові каучуки (СКЕП), співполімери етилену, пропілену та дієну (СКЕПТ), співполімери етилену та вінілацетату (ЕВА), співполімери етилену й акрилату, співполімери акрилонітрилу та бутадієну, полінорборнени, поліізопрени, поліхлоропрени та полібутадієни. Крім цього полімерний склад може також містити й інші неорганічні або органічні добавки, які можуть виконують функцію пластифікатора, стабілізатора, барвника, пігменту або іншу аналогічну функцію. Краще використовувати зневоднювальні пластмаси, тобто пластмаси, які містять зневоднювальний засіб, які можна переробляти литтям під тиском або видувним формуванням. Кращі, крім того, пластмаси, для переробки яких не потрібно використовувати антиадгезійне мастило для виймання з форми, яке (мастило) могло б привести до прилипання вмісту порожнини блістерної упаковки до стінки порожнини. Обумовлена відсутністю антиадгезійного мастила перевага полягає в тому, що внутрішність ємності, тобто порожнини блістерної упаковки, не вимагає її очищення від антиадгезійного мастила, наприклад, для дотримання офіційних приписань (зокрема, зазначених у німецькій фармакопеї), які обмежують застосування антиадгезійних мастил при виготовленні первинних упаковок. В одному із кращих варіантів зневоднювальна пластмаса не має яскраво виражених адгезійних властивостей, що виключає прилипання до неї фармацевтично-хімічних речовин, насамперед дрібних частинок, здатних завдяки своїм розмірам проникати в легені, і забезпечує можливість повного спорожнювання порожнини блістерної упаковки при її застосуванні в інгаляторі. Завдяки цьому підвищується точність дозування насамперед проникаючої в легені високодисперсної фракції частинок фармацевтичного порошкового складу. 95063 10 Більш докладну інформацію відносно складу або переробки зневоднювальних пластмас можна знайти в рівні техніки, насамперед в ЕР 599690, ЕР 432438 або ЕР 400460. В одному з варіантів стінка блістерної упаковки може мати зони з різними кількісними співвідношеннями між полімером і зневоднювальним засобом. Відповідно до цього варіанта ті ділянки ємності (блістерної упаковки), до яких прикладається зусилля передбачених у самому інгаляторі засобів для розкриття порожнини, можна виконувати з матеріалу, відмінного від матеріалу іншої стінки порожнини. Так само відповідно до цього варіанта зневоднювальні засоби можна передбачати тільки на тих ділянках блістерної упаковки, які не контактують безпосередньо з інгаляційним складом. В інших варіантах стінку порожнини виконують принаймні двошаровою із внутрішнім шаром і принаймні одним розташованим поверх нього зовнішнім шаром. При цьому внутрішній шар безпосередньо утворює стінку порожнини й тим самим контактує з інгаляційним складом. У цьому випадку внутрішній шар краще виконувати з полімерного складу, який не містить зневоднювальний засіб. Другий шар, який оточує цей внутрішній шар, що не контактує безпосередньо з інгаляційним складом, виконують із полімерного складу, що містить зневоднювальний засіб. При цьому полімери для виконання внутрішнього та принаймні одного другого шарів можна вибирати таким чином, щоб їх можна було з'єднувати один з одним без використання присадного матеріалу або за допомогою його. У ще одному варіанті основний елемент блістерної упаковки пропонується виконувати з матеріалу без зневоднювального засобу й наносити на нього після заповнення порожнин інгаляційним складом і їх запечатування закриваючою плівкою шар з полімерного складу, що містить зневоднювальний засіб. Переваги пропонованої у винаході блістерної упаковки найбільш яскраво проявляються насамперед при необхідності захисту діючих речовин, допоміжних речовин або складів головним чином від поглинання ними води. Сказане стосується, наприклад, інгаляційних порошків, одержаних розпилювальним сушінням, і/або діючих речовин, допоміжних речовин і складів, які знаходяться в аморфному стані. Пропоновану у винаході блістерну упаковку краще використовувати для захисту від впливу вологи діючих речовин, ефективних при їх введенні в організм шляхом інгаляції. Щодо цього особливо краще застосування лікарських речовин, вибраних із групи, яка включає антихолінергічні засоби, бетаміметики, стероїди, інгібітори фосфодіестерази IV (PDE IV), антагоністи LTD4, інгібітори EGFR-кінази, триптани, CGRPантагоністи, інгібітори фосфодіестерази V (PDE V), а також комбінації із двох або більше таких діючих речовин, наприклад, комбінацію з бетаміметику й антихолінергічного засобу або комбінацію із двох або більше лікарських засобів з однієї й тієї ж гру 11 пи, наприклад, комбінацію із двох або більше антихолінергічних засобів. Нижче наведені конкретні приклади біологічно активних компонентів або їх солей. Застосовувані антихолінергічні засоби краще вибирати із групи, яка включає тіотропій, відповідно тіотропійбромід, окситропійбромід, флутропійбромід, іпратропійбромід, солі глікопіронію, троспійхлорид, толтеродин, метобромід тропенолового ефіру 2,2-дифенілпропіонової кислоти, метобромід скопінового ефіру 2,2-дифенілпропіонової кислоти, метобромід скопінового ефіру 2-фтор-2,2дифенілоцтової кислоти, метобромід тропенолового ефіру 2-фтор-2,2-дифенілоцтової кислоти, метобромід тропенолового ефіру 3,3',4,4'тетрафторбензилової кислоти, метобромід скопінового ефіру 3,3',4,4'-тетрафторбензилової кислоти, метобромід тропенолового ефіру 4,4'дифторбензилової кислоти, метобромід скопінового ефіру 4,4'-дифторбензилової кислоти, метобромід тропенолового ефіру 3,3'-дифторбензилової кислоти, метобромід скопінового ефіру 3,3'дифторбензилової кислоти, метобромід тропенолового ефіру 9-гідроксифлуорен-9-карбонової кислоти, метобромід тропенолового ефіру 9фторфлуорен-9-карбонової кислоти, метобромід скопінового ефіру 9-гідроксифлуорен-9-карбонової кислоти, метобромід скопінового ефіру 9фторфлуорен-9-карбонової кислоти, метобромід тропенолового ефіру 9-метилфлуорен-9карбонової кислоти, метобромід скопінового ефіру 9-метилфлуорен-9-карбонової кислоти, метобромід циклопропілтропінового ефіру бензилової кислоти, метобромід циклопропілтропінового ефіру 2,2-дифенілпропіонової кислоти, метобромід циклопропілтропінового ефіру 9-гідроксиксантен-9карбонової кислоти, метобромід циклопропілтропінового ефіру 9-метилфлуорен-9-карбонової кислоти, метобромід циклопропілтропінового ефіру 9метилксантен-9-карбонової кислоти, метобромід циклопропілтропінового ефіру 9-гідроксифлуорен9-карбонової кислоти, метобромід циклопропілтропінового ефіру метилового ефіру 4,4'дифторбензилової кислоти, метобромід тропенолового ефіру 9-гідроксиксантен-9-карбонової кислоти, метобромід скопінового ефіру 9гідроксиксантен-9-карбонової кислоти, метобромід тропенолового ефіру 9-метилксантен-9-карбонової кислоти, метобромід скопінового ефіру 9метилксантен-9-карбонової кислоти, метобромід тропенолового ефіру 9-етилксантен-9-карбонової кислоти, метобромід тропенолового ефіру 9дифторметилксантен-9-карбонової кислоти та метобромід скопінового ефіру 9гідроксиметилксантен-9-карбонової кислоти, необов'язково у вигляді їх рацематів, енантіомерів або діастереомерів і необов'язково у вигляді їх кислотно-адитивних солей, сольватів і/або гідратів. Застосовувані бетаміметики бажано вибирати із групи, яка включає албутерол, бамбутерол, бітолтерол, броксатерол, карбутерол, кленбутерол, фенотерол, формотерол, гексопреналін, ібутерол, індакатерол, ізоетарин, ізопреналін, левосалбутамол, мабутерол, мелуадрин, метапротеренол, 95063 12 оркипреналін, пірбутерол, прокатерол, репротерол, римітерол, ритодрин, салметерол, салмефамол, сотеренот, сульфонтерол, тіарамід, тербуталін, толубутерол, CHF-1035, HOKU-81, KUL-1248, 3-(4-{6-[2-гідрокси-2-(4-гідрокси-3гідроксиметилфеніл)етиламіно]гексилокси}бутил)бензолсульфонамі д, 5-[2-(5,6-діетиліндан-2-іламіно)-1-гідроксіетил]8-гідрокси-1Н-хінолін-2-он, 4-гідрокси-7-[2-{[2-{[3(2-фенілетокси)пропіл]сульфоніл}етил]аміно}етил]2(3Н)-бензотіазолон, 1-(2-фтор-4-гідроксифеніл)-2[4-(1-бензімідазоліл)-2-метил-2-бутиламіно]етанол, 1-[3-(4-метоксибензиламіно)-4-гідроксифеніл]-2-[4(1-бензімідазоліл)-2-метил-2-бутиламіно]етанол, 1[2Н-5-гідрокси-3-оксо-4Н-1,4-бензоксазин-8-іл]-2[3-(4-N,N-диметиламінофеніл)-2-метил-2пропіламіно]етанол, 1-[2Н-5-гідроксі-3-оксо-4Н-1,4бензоксазин-8-іл]-2-[3-(4-метоксифеніл)-2-метил-2пропіламіно]етанол, 1-[2Н-5-гідрокси-3-оксо-4Н1,4-бензоксазин-8-іл]-2-[3-(4-н-бутилоксифеніл)-2метил-2-пропіламіно]етанол, 1-[2Н-5-гідрокси-3оксо-4Н-1,4-бензоксазин-8-іл]-2-{4-[3-(4метоксифеніл)-1,2,4-триазол-3-іл]-2-метил-2бутиламіно}етанол, 5-гідрокси-8-(1-гідроксі-2ізопропіламінобутил)-2Н-1,4-бензоксазин-3-(4Н)он, 1-(4-аміно-3-хлор-5-трифторметилфеніл)-2трет-бутиламіно)етанол і 1-(4етоксикарбоніламіно-3-ціано-5-фторофеніл)-2(трет-бутиламіно)етанол, необов'язково у вигляді їх рацематів, енантіомерів або діастереомерів і необов'язково у вигляді їх фармакологічно прийнятних кислотно-адитивних солей, сольватів і/або гідратів. Застосовувані стероїди бажано вибирати із групи, яка включає преднізолон, преднізон, бутиксокортпропіонат, RPR-106541, флунісолід, беклометазон, триамцинолон, будесонід, флутиказон, мометазон, циклесонід, рофлепонід, ST-126, дексаметазон, (S)-фторметиловий ефір 6,9дифтор-17-[(2-фуранілкарбоніл)окси]-11гідрокси-16-метил-3-оксоандроста-1,4-дієн-17карботіонової кислоти, (S)-(2оксотетрагідрофуран-3S-іловий) ефір 6,9дифтор-11-гідрокси-16-метил-3-оксо-17пропіонілоксіандроста-1,4-дієн-17-карботіонової кислоти та етипреднол-дихлорацетат (ΒΝΡ-166), необов'язково у вигляді їх рацематів, енантіомерів або діастереомерів і необов'язково у вигляді їх солей і похідних, їх сольватів і/або гідратів. Застосовувані інгібітори PDE IV бажано вибирати із групи, яка включає енпрофілін, теофілін, рофлуміласт, арифло (циломіласт), СР-325,366, ΒΥ343, D-4396 (Sch-351591), AWD-12-281 (GW842470), N-(3,5-дихлор-1-оксотридин-4-іл)-4дифторметокси-3-циклопропілметоксибензамід, NCS-613, пумафентин, (-n-[(4аR*,10bS*)-9-етокси1,2,3,4,4а,10b-гексагідро-8-метокси-2метилбензо[s][1,6]нафтиридин-6-іл]-N,Nдіізопротлбензамід, (R-(+)-1-(4-бромбензил)-4-[(3циклопентилокси)-4-метоксифеніл]-2-піролідон, 3(циклопентилокси-4-метоксифеніл)-1-(4-N'-[N-2ціано-S-метилізотіоуреїдо]бензил)-2-піролідон, цис-[4-ціано-4-(3-циклопентилокси-4метоксифеніл)циклогексан-1-карбонову кислоту], 2-карбометокси-4-ціано-4-(3-циклопропілметокси 13 4-дифторметоксифеніл)циклогексан-1-он, цис-[4ціано-4-(3-циклопропілметокси-4дифторметоксифеніл)циклогексан-1-ол], (R)-(+)етил[4-(3-циклопентилокси-4метоксифеніл)піролідин-2-іліден]ацетат, (S)-(-)етил[4-(3-циклопентилокси-4метоксифеніл)піролідин-2-іліден]ацетат, CDP840, Вау-198004, D-4418, PD-168787, Т-440, Т-2585, арофілін, атизорам, V-11294A, СI-1018, CDC-801, CDC-3052, D-22888, YM-58997, Z-15370, 9циклопентил-5,6-дигідро-7-етил-3-(2-тієніл)-9Нпіразоло[3,4-с]-1,2,4-триазоло[4,3-а]піридин і 9циклопентил-5,6-дигідро-7-етил-3-(трет-бутил)-9Hпіразоло[3,4-с]-1,2,4-триазоло[4,3-а]піридин, необов'язково у вигляді їх рацематів, енантіомерів або діастереомерів і необов'язково у вигляді їх фармакологічно прийнятних кислотно-адитивних солей, сольватів і/або гідратів. Застосовувані антагоністи LTD4 бажано вибирати із групи, яка включає монтелукаст, 1-(((R)-(3(2-(6,7-дифтор-2-хінолініл)етеніл)феніл)-3-(2-(2гідрокси-2-пропіл)феніл)тіо)метилциклопропан оцтову кислоту, 1-(((1(R)-3-(3-(2-(2,3дихлортієно[3,2-b]піридин-5-іл)-(Е)-етеніл)феніл)3-(2-(1-гідрокси-1метилетил)феніл)пропіл)тіо)метил)циклопропаноцтову кислоту, пранлукаст, зафірлукаст, [2-[[2-(4-третбутил-2-тіазоліл)-5бензофураніл]оксиметил]феніл]оцтову кислоту, МСС-847 (ZD-3523), MN-001, MEN-91507 (LM1507). VUF-5078, VUF-K-8707 і L-733321, необов'язково у вигляді їх рацематів, енантіомерів або діастереомерів і необов'язково у вигляді їх фармакологічно прийнятних кислотно-адитивних солей, а також необов'язково у вигляді їх солей і похідних, їх сольватів і/або гідратів. Застосовувані інгібітори EGFR-кінази бажано вибирати із групи, яка включає цетуксимаб, трастузумаб, ABX-EGF, Mab ICR-62, 4-[(3-хлор-4фторфеніл)аміно]-6-{[4-(морфолін-4-іл)-1-оксо-2бутен-1-іл]аміно}-7-циклопропілметоксихіназолін, 4-[(R)-(1-фенілетил)аміно]-6-{[4-(морфолін-4-іл)-1оксо-2-бутен-1-іл]аміно}-7циклопентилоксихіназолін, 4-[(3-хлор-4фторфеніл)аміно]-6-{[4-((R)-6-метил-2оксоморфолін-4-іл)-1-оксо-2-бутен-1-іл]аміно}-7[(S)-(тетрагідрофуран-3-іл)окси]хіназолін, 4-[(3хлор-4-фторфеніл)аміно]-6-[2-((S)-6-метил-2оксоморфолін-4-іл)етокси]-7-метоксихіназолін, 4[(3-хлор-4-фторфеніл)аміно]-6-({4-[N-(2метоксіетил)-N-метиламіно]-1-оксо-2-бутен-1іл}аміно)-7-циклопропілметоксихіназолін, 4-[(R)-(1фенілетил)аміно]-6-({4-[N-(тетрагідропіран-4-іл)-Nметиламіно]-1-оксо-2-бутен-1-іл}аміно)-7циклопропілметоксихіназолін, 4-[(3-хлор-4фторфеніл)аміно]-6-({4-[N-(2-метоксіетил)-Nметиламіно]-1-оксо-2-бутен-1-іл}аміно)-7циклопентилоксихіназолін, 4-[(3-хлор-4фторфеніл)аміно]-6-{[4-(N,N-диметиламіно)-1-оксо2-бутен-1-іл]аміно}-7-[(R)-(тетрагідрофуран-2іл)метокси]хіназолін, 4-[(3-етинілфеніл)аміно]-6,7біс-(2-метоксіетокси)хіназолін, 4-[(R)-(1фенілетил)аміно]-6-(4-гідроксифеніл)-7Нпіроло[2,3-d]піримідин, 3-ціано-4-[(3-хлор-4 95063 14 фторфеніл)аміно]-6-{[4-(N,N-диметиламіно)-1-оксо2-бутен-1-іл]аміно}-7-етоксихінолін, 4-[(R)-(1фенілетил)аміно]-6-{[4-((R)-6-метил-2оксоморфолін-4-іл)-1-оксо-2-бутен-1-іл]аміно}-7метоксихіназолін, 4-[(3-хлор-4-фторфеніл)аміно]-6{[4-(морфолін-4-іл)-1-оксо-2-бутен-1-іл]аміно}-7[(тетрагідрофуран-2-іл)метокси]хіназолін, 4-[(3етинілфеніл)аміно]-6-{[4-(5,5-диметил-2оксоморфолін-4-іл)-1-оксо-2-бутен-1іл]аміно}хіназолін, 4-[(3-хлор-4-фторфеніл)аміно]6-{2-[4-(2-оксоморфолін-4-іл)піперидин-1іл]етокси}-7-метоксихіназолін, 4-[(3-хлор-4фторфеніл)аміно]-6-(транс-4-аміноциклогексан-1ілокси)-7-метоксихіназолін, 4-[(3-хлор-4фторфеніл)аміно]-6-(транс-4метансульфоніламіноциклогексан-1-ілокси)-7метоксихіназолін, 4-[(3-хлор-4-фторфеніл)аміно]-6(тетрагідропіран-3-ілокси)-7-метоксихіназолін, 4[(3-хлор-4-фторфеніл)аміно]-6-{1-[(морфолін-4іл)карбоніл]піперидин-4-ілокси}-7метоксихіназолін, 4-[(3-хлор-4-фторфеніл)аміно]-6(піперидин-3-ілокси)-7-метоксихіназолін, 4-[(3хлор-4-фторфеніл)аміно]-6-[1-(2ацетиламіноетил)піперидин-4-ілокси]-7метоксихіназолін, 4-[(3-хлор-4-фторфеніл)аміно]-6(тетрагідропіран-4-ілокси)-7-етоксихіназолін, 4-[(3хлор-4-фторфеніл)аміно]-6-{транс-4-[(морфолін-4іл)карбоніламіно]циклогексан-1-ілокси}-7метоксихіназолін, 4-[(3-хлор-4-фторфеніл)аміно]-6{1-[(піперидин-1-іл)карбоніл]піперидин-4-ілокси}-7метоксихіназолін, 4-[(3-хлор-4-фторфеніл)аміно]-6(цис-4-{N-[(морфолін-4-іл)карбоніл]-Nметиламіно}циклогексан-1-ілокси)-7метоксихіназолін, 4-[(3-хлор-4-фторфеніл)аміно]-6(транс-4-етансульфоніламіноциклогексан-1ілокси)-7-метоксихіназолін, 4-[(3-хлор-4фторфеніл)аміно]-6-(1-метансульфонілпіперидин4-ілокси)-7-(2-метоксіетокси)хіназолін, 4-[(3-хлор-4фторфеніл)аміно]-6-[1-(2метоксіацетил)піперидин-4-ілокси]-7-(2метоксіетокси)хіназолін, 4-[(3-етинілфеніл)аміно]6-(тетрагідропіран-4-ілокси]-7-метоксихіназолін, 4[(3-хлор-4-фторфеніл)аміно]-6-(цис-4-{N[(піперидин-1-іл)карбонiл]-Nметиламіно}циклогексан-1-ілокси)-7метоксихіназолін, 4-[(3-хлор-4-фторфеніл)аміно]-6{цис-4-[(морфолін-4-іл)карбоніламіно]циклогексан1-ілокси}-7-метоксихіназолін, 4-[(3-хлор-4фторфеніл)аміно]-6-{1-[2-(2-оксопіролідин-1іл)етил]піперидин-4-ілокси}-7-метоксихіназолін, 4[(3-етинілфеніл)аміно]-6-(1-ацетилпіперидин-4ілокси)-7-метоксихіназолін, 4-[(3етинілфеніл)аміно]-6-(1-метилпіперидин-4-ілокси)7-метоксихіназолін, 4-[(3-етинілфеніл)аміно]-6-(1метансульфонілпіперидин-4-ілокси)-7метоксихіназолін, 4-[(3-хлор-4-фторфеніл)аміно]-6(1-метилпіперидин-4-ілокси)-7-(2метоксіетокси)хіназолін, 4-[(3-етинілфеніл)аміно]6-{1-[(морфолін-4-іл)карбоніл]піперидин-4-ілокси}7-метоксихіназолін, 4-[(3-хлор-4-фторфеніл)аміно]6-{1-[(Ν-метил-Ν-2метоксіетиламіно)карбоніл]піперидин-4-ілокси}-7метоксихіназолін, 4-[(3-хлор-4-фторфеніл)аміно]-6(1-етилпіперидин-4-ілокси)-7-метоксихіназолін, 4[(3-хлор-4-фторфеніл)аміно]-6-[цис-4-(N 15 метансульфоніл-N-метиламіно)циклогексан-1ілокси]-7-метоксихіназолін, 4-[(3-хлор-4фторфеніл)аміно]-6-[цис-4-(N-ацетил-Nметиламіно)циклогексан-1-ілокси]-7метоксихіназолін, 4-[(3-хлор-4-фторфеніл)аміно]-6(транс-4-метиламіноциклогексан-1-ілокси)-7метоксихіназолін, 4-[(3-хлор-4-фторфеніл)аміно]-6[транс-4-(N-метансульфоніл-Nметиламіно)циклогексан-1-ілокси]-7метоксихіназолін, 4-[(3-хлор-4-фторфеніл)аміно]-6(транс-4-диметиламіноциклогексан-1-ілокси)-7метоксихіназолін, 4-[(3-хлор-4-фторфеніл)аміно]-6(транс-4-{N-[(морфолін-4-іл)карбоніл]-Nметиламіно}циклогексан-1-ілокси)-7метоксихіназолін, 4-[(3-хлор-4-фторфеніл)аміно]-6[2-(2,2-диметил-6-оксоморфолін-4-іл)етокси]-7-[(S)(тетрагідрофуран-2-іл)метокси]хіназолін, 4-[(3хлор-4-фторфеніл)аміно]-6-(1метансульфонілпіперидин-4-ілокси)-7метоксихіназолін, 4-[(3-хлор-4-фторфеніл)аміно]-6(1-ціаноптеридин-4-ілокси)-7-метоксихіназолін і 4[(3-хлор-4-фторфеніл)аміно]-6-{1-[(2метоксіетил)карбоніл]піперидин-4-ілокси}-7метоксихіназолін, необов'язково у вигляді їх рацематів, енантіомерів або діастереомерів і необов'язково у вигляді їх фармакологічно прийнятних кислотно-адитивних солей, їх сольватів і/або гідратів. Для інгаляції використовуються лікарські засоби, що містять перераховані вище діючі речовини, а також їх солі, складні ефіри та комбінації цих діючих речовин, солей і складних ефірів. Інгаляційні порошки одержують відомими з рівня техніки методами, але насамперед методом розпилювального сушіння. Інгаляційні порошки, що упаковуються, відповідно, розфасовуються в пропоновані у винаході блістерні упаковки, поряд з діючою речовиною переважно містять також принаймні одну допоміжну речовину. Така допоміжна речовина може складатися з однорідної з погляду середнього розміру її частинок фракції (наприклад, із частинок розміром від 15 до 80 мкм) або при необхідності являти собою суміш із фракції частинок з більшим середнім розміром, що становить від 15 до 80 мкм, і фракції частинок з меншим середнім розміром, що становить від 1 до 9 мкм. При використанні допоміжної речовини у вигляді суміші із фракції частинок з більшим розміром і фракції частинок з меншим розміром на частку фракції частинок допоміжної речовини з меншим розміром повинно припадати від 1 до 20% від усієї кількості допоміжної речовини. Як приклад фізіологічно нешкідливих допоміжних речовин можна назвати моносахариди (наприклад, глюкозу або арабінозу), дисахариди (наприклад, лактозу, сахарозу, мальтозу), оліго- і полісахариди (наприклад, декстрани), поліспирти (наприклад, сорбіт, маніт, ксиліт), солі (наприклад, хлорид натрію, карбонат кальцію) або суміші цих допоміжних речовин між собою. Краще використовувати моно- або дисахариди, при цьому особливо бажане застосування лактози або глюкози, насамперед, але не винятково, у вигляді їх гідратів. Особливо кращим відповідно до винаходу є засто 95063 16 сування як допоміжної речовини лактози, найбільш бажано моногідрату лактози. Описані вище блістерні упаковки звичайно являють собою первинні упаковки, які можуть мати форму циліндричного диска або еластичної смуги (стрічки). Пропоновані у винаході блістерні упаковки для вивільнення з їх порожнин інгаляційного складу, що міститься в них, можна розкривати, як більш докладно описано нижче, або проколюванням стінок порожнин відповідним проколювальним елементом (пробійником), або відділенням стрічок матеріалу одна від іншої. Пропоновані у винаході блістерні упаковки можуть бути розраховані на упаковку в них однієї або декількох разових доз інгаляційного складу. Пропоновані у винаході блістерні упаковки можна також додатково оснащати полімерним і/або алюмінієвим шаром. Готовий до застосування інгалятор можна також зберігати в запечатаному зварюванням пакеті або мішку з полімеру або алюмінієвої фольги. Застосування вторинної упаковки пов'язане з різними перевагами. По-перше, завдяки вторинній упаковці пропоновані у винаході первинні упаковки й насамперед зневоднювальні засоби довше зберігають свої функціональні властивості, оскільки первинна упаковка починає проявляти свою бар'єрну дію, яка спрямована на захист її вмісту від проникнення вологи і яка обмежена в часі, лише після розкриття вторинної упаковки, що дозволяє додатково продовжити збереження продуктом своєї якості. Подруге, вторинна упаковка у своєму не розкритому стані дозволяє збільшити строк захисту продукту, що міститься в первинній упаковці, від впливу вологи при тривалому зберіганні й відкритому зберіганні завдяки поглинанню проникаючої у вторинну упаковку вологи зневоднювальною пластмасою. Пропонований у винаході блістерний диск може являти собою циліндричний диск висотою до 5 мм і діаметром до 15 см. У диску перпендикулярно до його площини виконані заглибини або отвори (порожнини). Такі заглибини або отвори бажано виконувати біля зовнішнього краю диска і їх можна закривати однією або декількома плівками. У заглибленнях або отворах знаходиться інгаляційний склад. Корпус диска виконаний при цьому із застосовуваного відповідно до винаходу матеріалу. Подібний диск можна використати, наприклад, в інгаляторі, описаному в DE 3348370 або DE 3336486. Такий інгалятор має корпус, у якому знаходиться дископодібна, кругла блістерна упаковка з розфасованим у її заглибини (кишені) лікарським порошком. Інгалятор оснащений, зокрема, пробійником, розташованим таким чином, що він дозволяє розкривати кожну із заповнених лікарським порошком заглибин шляхом пробивання її стінки, через отвір, що утворився в якій, лікарський порошок вивільняється в камеру в корпусі інгалятора, з якої його потім можна вдихати через мундштук. В іншому варіанті пропонована у винаході блістерна упаковка являє собою блістерну упаковку у вигляді еластичної смуги або стрічки з розфасованим у її заглибини (кишені) лікарським препаратом типу тієї, яка описана в DE 4106379. Така блістерна упаковка складається із принаймні двох відокремлюваних одна від одної стрічок, що утворю 17 ють між собою принаймні дві ємності (порожнини), кожна з яких заповнена лікарським порошком. Стрічки, які утворюють подібну блістерну упаковку можна при цьому виготовляти із застосовуваного відповідно до винаходу матеріалу, що описаний вище. У різних модифікаціях цього варіанта здійснення винаходу під первинною упаковкою мається на увазі порівнянна з відомою блістерна упаковка, у якої виготовлена із пропонованого у винаході матеріалу полімерна плівка покрита з одного боку шаром алюмінієвої фольги. При цьому до інгаляційного складу може бути напрямлений й контактувати з ним або покритий, або не покритий алюмінієвою фольгою бік оснащеної зневоднювальним засобом полімерної плівки. В інших варіантах полімерна плівка зі зневоднювальним засобом може бути з обох своїх боків покрита алюмінієвою фольгою з утворенням багатошарової структури з наступним розташуванням шарів: алюміній/полімер/алюміній. Інгалятор, для застосування в якому призначена подібна блістерна упаковка, оснащений спеціальним механізмом, який для розкриття блістерної упаковки відокремлює одна від одної обидві стрічки, що утворюють її, на відповідній позиції розкриття. Розкрита порожнина блістерної упаковки виявляється з'єднана з випускним елементом, наприклад, мундштуком, через який користувач може вдихати із цієї розкритої порожнини лікарський порошок, що міститься в ній. Одна з стрічок, що утворює подібну блістерну упаковку може виконувати функції при цьому несучої стрічки з декількома заглибинами, а інша стрічка - закриваючої стрічки. У цьому випадку кожна з заглибин у несучій стрічці й частина закриваючої стрічки, яка примикає до неї, утворюють між собою по ємності. На позиції розкриття може бути передбачений привідний механізм, що відокремлює одну від одної несучу та закриваючу її стрічки. Такий привідний механізм складається, наприклад, із двох привідних коліс (зокрема, зубчастих коліс), між якими при їх приведенні в обертання утримується закриваюча стрічка. Кожна окрема заглибина блістерної упаковки й у цьому випадку утворює в інгаляторі свого роду витратну камеру, яка з'єднується через повітряний канал з мундштуком. В іншому варіанті здійснення винаходу до інгаляційних складів пропонується домішувати тверді тіла з описаного вище полімерного матеріалу зі зневоднювальними властивостями. Розмір таких твердих тіл повинен при цьому перевищувати розмір найбільш великих частинок лікарського порошкового складу, щоб ці тверді тіла можна було шляхом просівання відокремити від частинок лікарського порошкового складу. Необхідність відсівання подібних твердих тіл під час інгаляції обумовлена необхідністю уникнути їх вдихання разом із частинками лікарського порошкового складу. Для цього мундштуки або інші частини інгаляторів можна оснащати відповідною сіткою або відповідним фільтром. В інших варіантах тверді тіла можна міцно з'єднувати всередині порожнин блістерної упаковки із принаймні однією стінкою кожної із цих порожнин. У ще одному варіанті тверді тіла можна виконувати досить важкими, відповідно 95063 18 досить великої маси, щоб у процесі інгаляції виключити будь-яку можливість їх захвату потоком вдихуваного повітря разом із частинками лікарського порошкового складу. Зневоднювальну пластмасу можна також у вигляді одного порівняно великого твердого тіла або у вигляді декількох більш дрібних твердих тіл поміщати в капсулу. При використанні більше одного твердого тіла в одну капсулу можна поміщати тверді тіла однакової або різної форми. Краще використовувати тверді тіла сферичної або обертально-еліпсоїдної форми. У цьому випадку основний елемент або основну частину блістерної упаковки немає необхідності виготовляти з полімеру, що містить зневоднювальний засіб. В одному з варіантів з вільно рухливим твердим тілом з матеріалу, що містить зневоднювальний засіб, лікарський порошковий склад і тверде тіло можна поміщати в капсулу, яка складається із двох частин, що телескопічно вставляються одна в іншу, та яка може використовуватися у відповідних інгаляторах. Подібні капсули описані, наприклад, у публікації ЕР 1100474, яка тим самим у повному обсязі включена в даний опис як посилання. Бажано при цьому використовувати капсули розміру 3. Як приклад інгалятора, придатного для використання в ньому таких капсул, можна назвати інгалятор марки HandiHaler, описаний, зокрема, в ЕР 1342483. У цьому аспекті в кращому варіанті здійснення винаходу в ньому пропонується комбінація або набір з інгалятора, призначеного для інгаляції порошкових лікарських препаратів, і капсули, яка складається із двох частин та яка містить тверде тіло із пропонованого у винаході матеріалу. Такий інгалятор відрізняється наявністю а) відкритої догори стаканоподібної нижньої корпусної деталі, у бічній стінці якої є два розташованих один проти одного віконця та на верхньому краї отвору якої є перший шарнірний елемент, б) пластини, яка закриває отвір нижньої корпусної деталі та має другий шарнірний елемент, в) камери, яка призначена для поміщення в неї капсули з інгаляційним складом і яка виконана з поверненого до нижньої корпусної деталі боку пластини перпендикулярно її площини та оснащена рухомою проти зусилля пружини натискною кнопкою із двома заточеними голками, г) верхньої корпусної деталі з виконаним за одне ціле з нею мундштуком і із третім шарнірним елементом, а також д) кришки, оснащеної четвертим шарнірним елементом, при цьому нижня корпусна деталь, пластина, верхня корпусна деталь і кришка з'єднані між собою відповідними, наявними в них шарнірними елементами. Приклад 1 У цьому прикладі наведені дані про збільшення строку захисту вмісту блістерних упаковок від проникнення в них вологи при тривалому та відкритому зберіганні при 40°С та 75%-вій відносної вологості (порожнини блістерних упаковок заповнені інгаляційним порошком, який являє собою суміш із тіотропію та лактози). За результатами відповідних вимірювань було встановлено, що кількість проникаючої в блістерні упаковки води при тривалому й відкритому зберіганні при 40°С і 75%-вій відносної вологості стано 19 95063 вить від 0,1 до 100 мг на рік. Кількість поглиненої або вбраної води при цьому істотно залежить від матеріалів, використовуваних для виготовлення блістерних упаковок, і герметичності їх запечатування шляхом термозварювання. У наведеній нижче таблиці представлені дані про збільшення 20 строку захисту вмісту блістерних упаковок від впливу вологи залежно від кількості вологи, що просочується в блістерні упаковку, вираженої в мг/рік, і від масової частки молекулярного сита (МС), вираженої в мас.%. Збільшення строку захисту вмісту Загальна маса МС у Вологоємність Кількість вологи, яка просочується блістерної упаковки від впливу волоблістерній упаковці МС в блістерну упаковку, за рік ги 10 мг 1,5 мг 0,1 мг + 15,0 років 39 мг 5,9 мг 1 мг + 5,9 року 65 мг 9,8 мг 5 мг + 2,0 роки 117 мг 17,6 мг 10 мг + 1,8 року 78 мг 11,7 мг 10 мг + 1,2 року 130 мг 19,5 мг 20 мг + 1,0 рік 260 мг 30,0 мг 50 мг + 0,8 року 195 мг 29,3 мг 50 мг + 0,6 року 390 мг 58,5 мг 100 мг + 0,6 року Значення, наведені в стовпчику "Збільшення строку захисту вмісту блістерної упаковки від впливу вологи", свідчать про те, що при малій кількості вологи, яка просочується в блістерну упаковку, що становить 1 мг/рік або менше, строк захисту вмісту блістерної упаковки від впливу вологи при зберіганні в навколишніх умовах з температурою 40°С та з 75%-вою відносною вологістю вдається продовжити на 6 років або більше. При просочуванні в блістерну упаковку Комп’ютерна верстка О. Гапоненко вологи у великій кількості, що становить 100 мг/рік, строк захисту вмісту блістерної упаковки від впливу вологи при зберіганні в тих же навколишніх умовах збільшується на 7 місяців. Цей приклад можна безпосередньо поширити й на визначення стабільності вмісту блістерної упаковки в розкритому стані, коли описана вище блістерна упаковка поміщена для тривалого зберігання в герметично запечатану зовнішню (вторинну) упаковку. Підписне Тираж 24 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюBlister for inhalers
Автори англійськоюKrueger Michael, Metzger Burkhard, Trunk Michael, Schiewe Joerg
Назва патенту російськоюБлистерная упаковка для применения в ингаляторах
Автори російськоюКрюгер Михаель, МЕТЦГЕР БУРКХАРД, Трунк Михаэль, Шиве Йоерг
МПК / Мітки
МПК: B65D 83/06, A61M 15/00, A61J 1/00
Мітки: застосування, упаковка, блістерна, інгаляторах
Код посилання
<a href="https://ua.patents.su/10-95063-blisterna-upakovka-dlya-zastosuvannya-v-ingalyatorakh.html" target="_blank" rel="follow" title="База патентів України">Блістерна упаковка для застосування в інгаляторах</a>