Застосування пертузумабу, трастузумабу і хіміотерапії на основі карбоплатину для неоад’ювантного лікування нer2-позитивного раку молочної залози ранньої стадії у пацієнта
Номер патенту: 116095
Опубліковано: 12.02.2018
Автори: де Толедо Пелізон Крістіна Х., Кларк Емма Л., Алаваттам Срідхара, Ратнаяк Джаянтха, Беньюнс Марк К., Квонг Гловер Зефаніа В., Амлер Лукас К., Росс Грехам А., Уокер Ру-Амір, Мітчелл Лада
Формула / Реферат
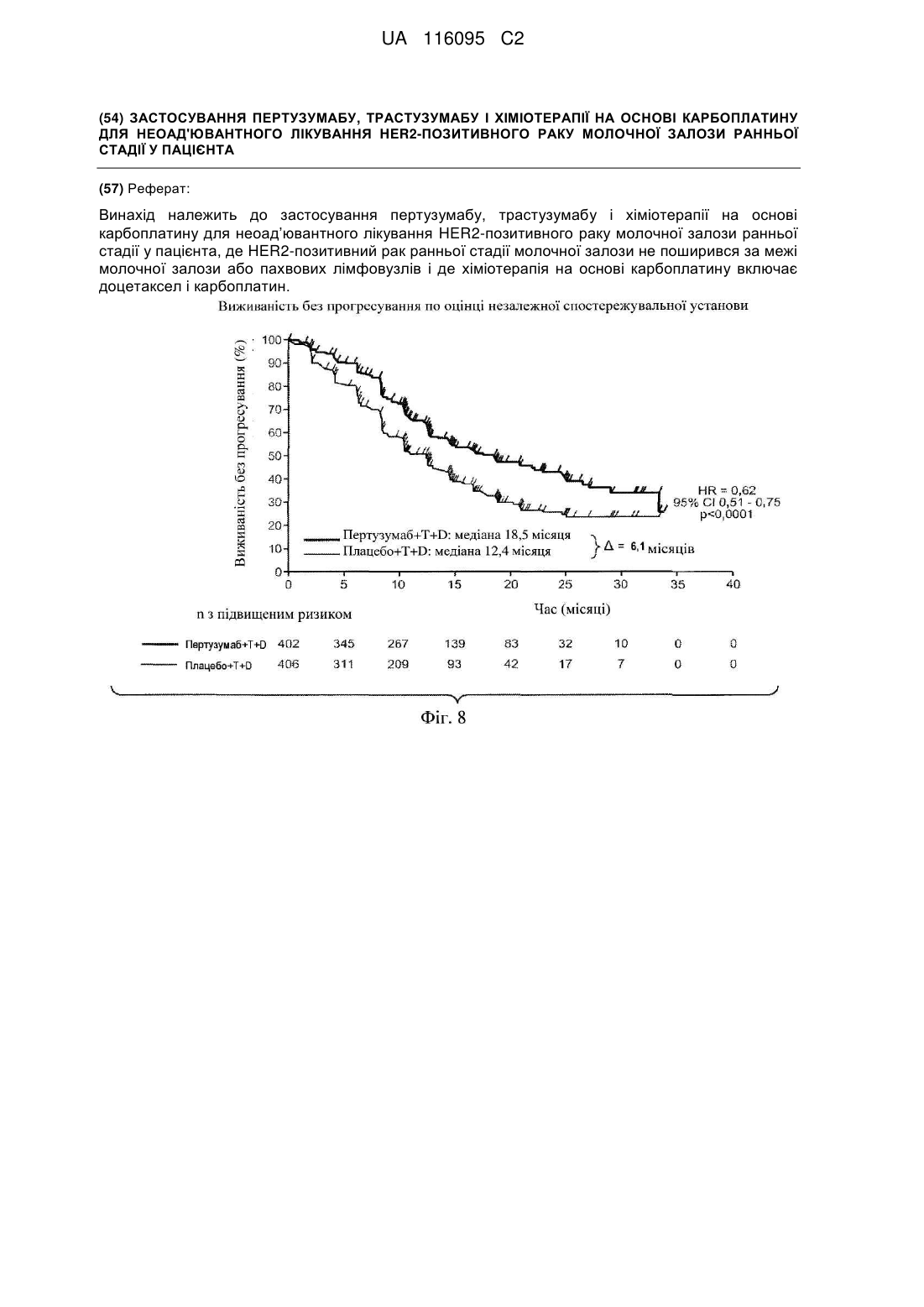
1. Застосування пертузумабу, трастузумабу і хіміотерапії на основі карбоплатину для неоад’ювантного лікування HER2-позитивного раку молочної залози ранньої стадії у пацієнта, де HER2-позитивний рак ранньої стадії молочної залози не поширився за межі молочної залози або пахвових лімфовузлів і де хіміотерапія на основі карбоплатину включає доцетаксел і карбоплатин.
2. Застосування за п. 1, де пертузумаб вводять одночасно з хіміотерапією на основі карбоплатину.
Текст
Реферат: Винахід належить до застосування пертузумабу, трастузумабу і хіміотерапії на основі карбоплатину для неоад’ювантного лікування HER2-позитивного раку молочної залози ранньої стадії у пацієнта, де HER2-позитивний рак ранньої стадії молочної залози не поширився за межі молочної залози або пахвових лімфовузлів і де хіміотерапія на основі карбоплатину включає доцетаксел і карбоплатин. UA 116095 C2 5 10 15 20 25 30 35 40 45 50 55 60 Ця непопередня заявка, подана згідно з 37 CFR § 1.53(b), відповідно до 35 USC § 119(e) вимагає пріоритет по попередній патентній заявці США із серійним № 61/547535, поданій 14 жовтня 2011 року, попередній патентній заявці США із серійним № 61/567015, поданій 5 грудня 2011 року, попередній патентній заявці США із серійним № 61/657669, поданій 8 червня 2012 року, попередній патентній заявці США із серійним № 61/682037, поданій 10 серпня 2012 року, і попередній патентній заявці США із серійним № 61/694584, поданій 29 серпня 2012 року, зміст яких включено в даний документ шляхом посилання у всій своїй повноті. Галузь винаходу Даний винахід стосується застосування пертузумабу як промислових виробів і промислових виробів, що включають у себе пертузумаб, найкращий у своєму класі інгібітор димеризації HER2. Зокрема, винахід стосується продовження виживаності без прогресування в популяції пацієнтів з HER2-позитивним раком молочної залози; сполучення двох антитіл проти HER2 для лікування HER2-позитивного раку без підвищення кардіотоксичності; лікування ранньої стадії HER2-позитивного раку молочної залози; лікування HER2-позитивного раку шляхом спільного введення суміші пертузумабу і трастузумабу з одного пакета для внутрішньовенного введення; лікування HER2-позитивного метастатичного раку шлунка; лікування HER2-позитивного раку молочної залози пертузумабом, трастузумабом і вінорелбіном; лікування HER2-позитивного раку молочної залози пертузумабом, трастузумабом і інгібітором ароматази; і лікування злоякісної пухлини яєчника з низьким рівнем HER3, первинної перитонеальної злоякісної пухлини або злоякісної пухлини фаллопієвих труб. Винахід також стосується промислового виробу, який включає флакон з пертузумабом усередині і вкладиш в упаковку, що надає дані по безпеці і/або дані по ефективності; способу виробництва промислового виробу і способу для забезпечення безпечного й ефективного застосування пертузумабу, що належить до виробу. Крім того, винахід стосується пакета для внутрішньовенного (в/в) введення, що містить стабільну суміш пертузумабу і трастузумабу, придатну для введення пацієнту з раком. Попередній рівень техніки Члени сімейства рецепторів тирозинкіназ HER являють собою важливі медіатори клітинного росту, диференціювання і виживання. Сімейство рецепторів включає чотири окремих члени, у тому числі рецептор епідермального фактора росту (EGFR, ErbB1 або HER1), HER2 (ErbB2 або neu p185 ), HER3 (ErbB3) і HER4 (ErbB4 або tyro2). Члени сімейства рецепторів залучені в різні типи злоякісних новоутворень людини. Рекомбінантна гуманізована версія мишачого антитіла до HER2 4D5 (huMAb4D5-8, rhuMAb HER2, трастузумаб або ГЕРЦЕПТИН®; патент США № 5821337) є клінічно активною у пацієнтів з метастатичними видами раку молочної залози з підвищеною експресією HER2, які раніше одержували додаткову протипухлинну терапію (Baselga et al, J. Clin. Oncol. 14:737-744 (1996)). Трастузумаб одержав дозвіл на продаж від Управління по контролю за харчовими продуктами і лікарськими засобами (FDA) 25 вересня 1998 року для лікування пацієнтів з метастатичним раком молочної залози, у яких пухлини надекспресують білок HER2. На даний час трастузумаб схвалений для застосування як окремої речовини або в комбінації з хіміотерапією або гормональною терапією в умовах метастазування і як окремої речовини або в комбінації з хіміотерапією як ад'ювантне лікування для пацієнтів з ранньою стадією HER2позитивного раку молочної залози. Терапія на основі трастузумабу на сьогодні є рекомендованим лікуванням для пацієнтів з ранньою стадією HER2-позитивного раку молочної залози, у яких немає протипоказань до його застосування (Герцептин®, інструкція з застосування; рекомендації Національної онкологічної мережі США (NCCN), версія 2.2011). Трастузумаб плюс доцетаксел (або паклітаксел) являє собою зареєстрований стандарт терапії першої лінії для лікування метастатичного раку молочної залози (метастатичний РМЗ) (Slamon et al. N. Engl. J. Med. 2001, 344(11):783-792; Marty et al. J. Clin. Oncol. 2005, 23(19):4265-4274). Хоча введення трастузумабу приводить до чудових результатів при лікуванні раку молочної залози, нещодавні дані клінічного випробування лапатинібу, очевидно, дозволяють передбачити, що навіть при введенні трастузумабу HER2 відіграє активну роль у біології пухлини (Geyer et al., N. Engl. J. Med. 2006, 355:2733-2743). Пацієнти, яких лікували антитілом до HER2 трастузумабом, були вибрані для терапії на основі експресії HER2. Див., наприклад, WО 99/31140 (Paton et al.), US 2003/0170234A1 (Hellmann S.) і US 2003/0147884 (Paton et al.); а також WO 01/89566, US 2002/0064785 і US 2003/0134344 (Mass et al.). Див., також, патент США № 6573043, патент США № 6905830 і US 2003/0152987, Cohen et al., відносно імуногістохімії (IHC) і флуоресцентної гібридизації in situ (FISH) для виявлення ампліфікації і надекспресії HER2. Таким чином, оптимальна тактика 1 UA 116095 C2 5 10 15 20 25 30 35 40 45 50 55 60 терапії метастатичного раку молочної залози на даний час бере до уваги не тільки загальний стан пацієнта, історію хвороби (анамнез) і статус рецепторів, але також і статус HER2. Пертузумаб (також відомий як рекомбінантне гуманізоване моноклональне антитіло 2C4 (rhuMAb 2C4); Genentech, Inc., South San Francisco) є найкращим у новому класі речовин, відомих як інгібітори димеризації HER (HDI), і діє, інгібуючи здатності HER2 формувати активні гетеродимери або гомодимери з іншими рецепторами HER (такими як EGFR/HER1, HER2, HER3 і HER4). Див., наприклад, Harari and Yarden Oncogene, 19:6102-14 (2000); Yarden and Sliwkowski. Nat. Rev. Mol. Cell. Biol. 2:127-37 (2001); Sliwkowski Nat. Struct. Biol. 10:158-9 (2003); Cho et al. Nature, 421:756-60 (2003); і Malik et al. Pro. Am. Soc. Cancer. Res. 44:176-7 (2003). Блокада пертузумабом утворення гетеродимерів HER2-HER3 у пухлинних клітинах була продемонстрована для інгібування дуже важливого сигнального шляху в клітині, результатом якого є проліферація і виживання пухлини (Agus et al. Cancer. Cell. 2:127-37 (2002)). Пертузумаб тестували як одиночний препарат у клініці в дослідженні фази I у пацієнтів з розповсюдженими злоякісними пухлинами й у дослідженнях фази II у пацієнтів з раком яєчників і раком молочної залози, а також раком легені і раком передміхурової залози. У фазі I дослідження, пацієнтів з місцеворозповсюдженими, рецидивуючими або метастатичними солідними пухлинами, що не піддаються лікуванню, які прогресували під час або після стандартної терапії, лікували, вводячи внутрішньовенно пертузумаб кожні 3 тижні. Пертузумаб, як правило, добре переносився. Була досягнута регресія пухлини у 3 з 20 пацієнтів з можливістю оцінки відповіді. У двох пацієнтів була підтверджена часткова відповідь. Стабільний перебіг захворювання в період 2,5 місяця спостерігали у 6 з 21 пацієнта (Agus et al. Pro. Am. Soc. Clin. Oncol. 22:192 (2003)). При дозах 2,0-15 мг/кг фармакокінетика пертузумабу була лінійною, і середній період напіввиведення знаходився в діапазоні від 2,69 до 3,74 мл/добу/кг, середній кінцевий період напіввиведення знаходився в діапазоні від 15,3 до 27,6 дня. Антитіла до пертузумабу виявлені не були (Allison et al. Pro. Am. Soc. Clin. Oncol. 22:197 (2003)). US 2006/0034842 описує способи лікування злоякісної пухлини, експресуючої ErbB, за допомогою комбінацій антитіл до ErbB2. US 2008/0102069 описує застосування трастузумабу і пертузумабу для лікування HER2-позитивної метастатичної злоякісної пухлини, такої як рак молочної залози. Baselga et al., J. Clin. Oncol., 2007, ASCO Annual Meeting Proceedings Part I, Col. 25, № 18S (June 20 Supplement), 2007:1004, повідомляє про лікування комбінацією трастузумабу і пертузумабу пацієнтів з раніше лікованим HER2-позитивним раком молочної залози, що прогресував під час лікування трастузумабом. Portera et al., J. Clin. Oncol., 2007, ASCO Annual Meeting Proceedings Part I. Vol. 25, № 18S (June 20 Supplement), 2007:1028, оцінює ефективність і безпеку комбінованого лікування трастузумаб + пертузумаб у пацієнтів з HER2позитивним раком молочної залози, у яких було прогресування захворювання при терапії на основі трастузумабу. Автори зробили висновок, що потрібна додаткова оцінка ефективності комбінованого лікування для того, щоб визначити ризик загалом і перевагу цієї схеми лікування. Пертузумаб оцінювали в дослідженнях фази II у комбінації з трастузумабом у пацієнтів з HER2-позитивним метастатичним раком молочної залози, які раніше одержували трастузумаб для метастатичного захворювання. Одне дослідження, проведене Національним інститутом раку (NCI), включало 11 пацієнтів з раніше лікованим HER2-позитивним метастатичним раком молочної залози. Два з 11 пацієнтів продемонстрували часткову відповідь (PR) (Baselga et al., J. Clin. Oncol. 2007, ASCO Annual Meeting Proceedings; 25:18S (20 June Supplement): 1004. Результати фази II неоад'ювантного дослідження, яке оцінює дію нової комбінованої схеми лікування пертузумабом і трастузумабом плюс хіміотерапія (доцетаксел) у жінок з ранніми стадіями HER2-позитивного раку молочної залози, представлені на CTRC-AACR San Antonio Breast Cancer Symposium (SABCS), 8-12 грудня, 2010, показали, що два антитіла до HER2 плюс доцетаксел, які давали за схемою неоад'ювантного лікування перед хірургічним втручанням, значно поліпшували рівень повного зникнення пухлини (частота повної патологічної відповіді, pCR, 45,8 відсотка) у молочній залозі більше ніж наполовину в порівнянні з трастузумабом плюс доцетаксел (pCR 29 відсотків), p=0,014. Патентні публікації відносно антитіл до HER2 включають: патенти США №№ 5720937; 5720954; 5725856; 5770195; 5772997; 6165464; 6387371; 6399063; 6015567; 6333169; 4968603; 5821337; 6054297; 6407213; 6639055; 6719971; 6800738; 8075890; 5648237; 7018809; 6267958; 6685940; 6821515; 7060268; 7682609; 7371376; 6127526; 6333398; 6797814; 6339142; 6417335;6489447; 7074404; 7531645; 7846441; 7892549; 8075892; 6573043; 6905830; 7129051; 7344840; 7468252; 7674589; 7919254; 6949245; 7485302; 7498030; 7501122; 7537931; 7618631; 7862817; 7041292; 6627196; 7371379; 6632979; 7097840; 7575748; 6984494; 7279287; 7811773; 7993834; 8076066; 8044017; 7435797; 7850966; 7485704; 7807799; 8142784; 7560111; 7879325; 8241630; 7449184; 8163287; 7700299; 7981418; 8247397; і US 2010/0016556; US 2005/0244929; 2 UA 116095 C2 5 10 15 20 25 30 35 40 45 50 55 60 US 2001/0014326; US 2003/0202972; US 2006/0099201; US 2010/0158899; US 2011/0236383; US 2011/0033460; US 2008/0286280; US 2005/0063972; US 2006/0182739; US 2009/0220492; US 2003/0147884; US 2004/0037823; US 2005/0002928; US 2007/0292419; US 2008/0187533; US 2011/0250194; US 2012/0034213; US 2003/0152987; US 2005/0100944; US 2006/0183150; US 2008/0050748; US 2009/0155803; US 2010/0120053; US 2005/0244417; US 2007/0026001; US 2008/0160026; US 2008/0241146; US 2005/0208043; US 2005/0238640; US 2006/0034842; US 2006/0073143; US 2006/0193854; US 2006/0198843; US 2011/0129464; US 2007/0184055; US 2007/0269429; US 2008/0050373; US 2006/0083739; US 2009/0087432; US 2006/0210561; US 2002/0035736; US 2002/0001587; US 2008/0226659; US 2002/0090662; US 2006/0046270; US 2008/0108096; US 2007/0166753; US 2008/0112958; US 2009/0239236; US 2012/0034609; US 2012/0093838; US 2004/0082047; US 2012/0065381; US 2009/0187007; US 2011/0159014; US 2004/0106161; US 2011/0117096; US 2004/0258685; US 2009/0148402; US 2009/0099344; US 2006/0034840; US 2011/0064737; US 2005/0276812; US 2008/0171040; US 2009/0202536; US 2006/0013819; US 2012/0107391; US 2006/0018899; US 2009/0285837; US 2011/0117097; US 2006/0088523; US 2010/0015157; US 2006/0121044; US 2008/0317753; US 2006/0165702; US 2009/0081223; US 2006/0188509; US 2009/0155259; US 2011/0165157; US 2006/0204505; US 2006/0212956; US 2006/0275305; US 2012/0003217; US 2007/0009976; US 2007/0020261; US 2007/0037228; US 2010/0112603; US 2006/0067930; US 2007/0224203; US 2011/0064736; US 2008/0038271; US 2008/0050385; US 2010/0285010; US 2011/0223159; US 2008/0102069; US 2010/0008975; US 2011/0245103; US 2011/0246399; US 2011/0027190; US 2010/0298156; US 2011/0151454; US 2011/0223619; US 2012/0107302; US 2009/0098135; US 2009/0148435; US 2009/0202546; US 2009/0226455; US 2009/0317387; US 2011/0044977; US 2012/0121586. Суть винаходу У першому аспекті, винахід стосується способу продовження виживаності без прогресування в популяції пацієнтів з HER2-позитивним раком молочної залози на 6 місяців або більше, який включає введення пацієнтам з популяції пертузумабу, трастузумабу і хіміотерапії (наприклад, таксану, такого як доцетаксел). Необов'язково спосіб приводить до частоти об'єктивних відповідей 80 % або більше у пацієнтів у популяції. Рак молочної залози являє собою необов'язково метастатичний або місцеворецидивуючий, нерезектабельний рак молочної залози, або IV стадію захворювання, що виникло de novo. В одному з варіантів здійснення пацієнти в популяції: не одержували лікування раніше або переносили рецидив після ад'ювантної терапії, мали фракцію викиду лівого шлуночка (ФВЛШ) 50 % від вихідного рівня і/або мали показник загального стану 0 або 1 відповідно до Східної об'єднаної онкологічної групи (ECOG PS). Необов'язково, HER2-позитивний рак молочної залози визначений імуногістохімією (IHC) як 3+ і/або флуоресцентною гібридизацією in situ (FISH) з коефіцієнтом ампліфікації 2,0. Необов'язково, спосіб знижує ризик смерті приблизно на 34 % або більше у порівнянні з пацієнтом, якого лікували трастузумабом і хіміотерапією. В іншому аспекті винахід стосується способу сполучення двох антитіл до HER2 для лікування HER2-позитивного раку без збільшення кардіотоксичності в популяції пацієнтів з HER2-позитивною злоякісною пухлиною, який включає введення пертузумабу, трастузумабу і хіміотерапії пацієнтам у популяції. Необов'язково, кардіотоксичність у популяції пацієнтів контролюють на виникнення симптоматичної систолічної дисфункції лівого шлуночка (СДЛШ) або застійної серцевої недостатності (ЗСН) або зниження фракції викиду лівого шлуночка (ФВЛШ). HER2-позитивна злоякісна пухлина являє собою необов'язково рак молочної залози, наприклад метастатичний або місцеворецидивуючий, нерезектабельний рак молочної залози, або IV стадію захворювання, що виникло de novo. В іншому аспекті винахід стосується промислового виробу, який містить флакон з пертузумабом усередині і вкладиш в упаковку, де вкладиш в упаковку надає дані по безпеці з таблиці 3 або таблиці 4 і/або дані по ефективності з таблиці 2, таблиці 5, фігури 8 або фігури 10. Винахід додатково стосується способу виготовлення промислового виробу, який включає спільну упаковку флакона з пертузумабом усередині і вкладиша в упаковку, де вкладиш в упаковку надає дані по безпеці з таблиці 3 або таблиці 4 і/або дані по ефективності з таблиці 2, таблиці 5, фігури 8 або фігури 10. У спорідненому аспекті винахід стосується способу забезпечення безпечного й ефективного застосування пертузумабу, який включає спільну упаковку флакона з пертузумабом усередині і вкладиша в упаковку, де вкладиш в упаковку надає дані по безпеці з таблиці 3 або таблиці 4 і/або дані по ефективності з таблиці 2, таблиці 5, фігури 8 або фігури 10. Необов'язково, промисловий виріб містить флакон з однократною дозою, що містить приблизно 420 мг пертузумабу. Необов'язково, вкладиш в упаковку додатково містить рамку з попередженням із прикладу 4. 3 UA 116095 C2 5 10 15 20 25 30 35 40 45 50 55 60 Необов'язково, вкладиш в упаковку додатково надає дані по ефективності відносно загальної виживаності (OS) із прикладу 9 або таблиці 14. В іншому аспекті винахід стосується способу лікування ранніх стадій HER2-позитивного раку молочної залози, який включає введення пацієнту з раком молочної залози пертузумабу, трастузумабу і хіміотерапії, де хіміотерапія включає хіміотерапію на основі антрацикліну (наприклад, 5-фторурацил, епірубіцин і циклофосфамід (FEC)) або хіміотерапію на основі карбоплатину (наприклад, доцетаксел і карбоплатин). Необов'язково, пертузумаб вводять одночасно з хіміотерапією на основі антрацикліну або хіміотерапією на основі карбоплатину. В одному з варіантів здійснення цього способу, введення пертузумабу не збільшує кардіотоксичність у порівнянні з лікуванням без пертузумабу. Таке лікування ранніх стадій HER2-позитивного раку молочної залози необов'язково включає неоад'ювантну або ад'ювантну терапію. Винахід додатково стосується способу лікування HER2-позитивного раку у пацієнта, який включає спільне введення пацієнту суміші пертузумабу і трастузумабу в одному пакеті для внутрішньовенного введення. Такий спосіб необов'язково додатково включає введення пацієнту хіміотерапії. У спорідненому аспекті винахід стосується пакета для внутрішньовенного (в/в) введення, що містить стабільну суміш пертузумабу і трастузумабу, придатну для введення пацієнту з раком. Суміш необов'язково знаходиться у фізіологічному розчині, який, наприклад, містить приблизно 0,9 % NaCl або приблизно 0,45 % NaCl. Пакет для в/в введення необов'язково являє собою поліолефіновий або полівінілхлоридний пакет для інфузій з 250 мл 0,9 % фізіологічного розчину. В одному з варіантів здійснення пакет для в/в введення містить суміш приблизно 420 мг або приблизно 840 мг пертузумабу і приблизно від 200 мг до приблизно 1000 мг трастузумабу. В одному з варіантів здійснення суміш залишається стабільною аж до 24 годин при 5 °C або 30 °C. Стабільність суміші можна оцінювати одним або декількома аналізами, вибраними з: колір, опис і прозорість (CAC), аналіз концентрації і каламутності, аналіз частинок, ексклюзійна хроматографія (SEK), іонообмінна хроматографія (IEC), капілярний зонний електрофорез (CZE), капілярне ізоелектричне фокусування з детекцією у капілярі (iCIEF) або аналіз ефективності антитіла. Даний винахід стосується нової схеми лікування раку шлунка. Зокрема, даний винахід стосується лікування HER2-позитивного раку шлунка у людей за допомогою сполучення трастузумабу, пертузумабу і щонайменше одного хіміотерапевтичного препарату. В одному з аспектів винахід стосується способу лікування HER2-позитивного раку шлунка у людини, який включає введення індивідууму пертузумабу, трастузумабу і хіміотерапії. В одному з аспектів винахід стосується способу лікування раку шлунка у людей, який включає введення пертузумабу індивідууму з раком шлунка, де пертузумаб вводять у дозі 840 мг у всіх циклах лікування. В іншому аспекті винахід стосується способу поліпшення виживаності у людини з HER2позитивним раком шлунка, який включає введення індивідууму пертузумабу, трастузумабу і хіміотерапії. У ще одному аспекті винахід стосується застосування пертузумабу для лікування HER2позитивного раку шлунка у людини в комбінації з трастузумабом і хіміотерапією. У додатковому аспекті винахід стосується використання пертузумабу в лікарському препараті для лікування HER2-позитивного раку шлунка, де лікування включає введення пертузумабу в комбінації з трастузумабом і хіміотерапією. Ще в одному додатковому аспекті винахід стосується використання пертузумабу в лікарському препараті для лікування HER2-позитивного раку шлунка, де лікування включає введення трастузумабу в комбінації з пертузумабом і хіміотерапією. В іншому аспекті винахід стосується набору, який містить контейнер, що містить пертузумаб і інструкції для введення пертузумабу, для лікування HER2-позитивного раку шлунка у індивідуума в комбінації з трастузумабом і хіміотерапією. У ще одному аспекті винахід стосується набору, який містить контейнер, що містить трастузумаб і інструкції для введення трастузумабу, для лікування HER2-позитивного раку шлунка у індивідуума в комбінації з пертузумабом і хіміотерапією. У всіх аспектах рак шлунка може бути, наприклад, нерезектабельним місцеворозповсюдженим раком шлунка або метастатичним раком шлунка, або розповсюдженим післяопераційним рецидивуючим раком шлунка, який може не піддаватися радикальній терапії відомими способами. У всіх аспектах, рак шлунка включає в себе аденокарциному шлунка або шлунково-стравохідного з'єднання. У всіх аспектах, у конкретному варіанті здійснення пацієнт не одержував попереднього протипухлинного лікування для метастатичного раку шлунка. У всіх 4 UA 116095 C2 5 10 15 20 25 30 35 40 45 50 55 60 аспектах у конкретному варіанті здійснення хіміотерапія включає в себе введення препарату платини і/або фторпіримідину. У визначених варіантах здійснення препарат платини являє собою цисплатин. В інших варіантах здійснення фторпіримідин включає капецитабін і/або 5фторурацил (5-ФУ). У всіх аспектах, статус HER2-позитивного пацієнта може, наприклад, бути IHC 3+ або IHC 2+/ISH+. У всіх аспектах у конкретних варіантах здійснення лікування поліпшує виживаність, у тому числі загальну виживаність (OS) і/або виживаність без прогресування (PFS), і/або ефективність терапії (RR). У всіх аспектах, у конкретних варіантах здійснення пацієнт має ECOG PS 0-1. У всіх аспектах, цикли лікування, як правило, відділені один від одного чотирма тижнями або менше або трьома тижнями або менше, або двома тижнями або менше, або одним тижнем або менше. У конкретному аспекті винахід стосується способу лікування HER2-позитивної нерезектабельної або метастатичної аденокарциноми шлунка або шлунково-стравохідного з'єднання у пацієнта-людини, що до цього не одержував хіміотерапію для метастатичного захворювання, за винятком попередньої ад'ювантної або неоад'ювантної терапії, завершеної більше ніж за шість місяців до даного лікування, який включає введення пацієнту пертузумабу, трастузумабу, цисплатину і капецитабіну і/або фторурацилу (5-ФУ) у кількості, необхідній для поліпшення виживаності без прогресування (PFS) і/або загальної виживаності (OS), де пацієнт має ECOG PS 0-1. У конкретному варіанті здійснення пацієнт не одержував попереднього лікування препаратами платини. В іншому аспекті винахід стосується способу поліпшення виживаності без прогресування у пацієнта з HER2-позитивною нерезектабельною або метастатичною аденокарциномою шлунка або шлунково-стравохідного з'єднання, який включає введення пацієнту пертузумабу в комбінації з трастузумабом і хіміотерапією. У ще одному додатковому аспекті винахід стосується способу лікування HER2-позитивного раку молочної залози у пацієнта, який включає введення пацієнту пертузумабу, трастузумабу і вінорелбіну. Необов'язково пертузумаб і трастузумаб вводять пацієнту спільно з одного пакета для внутрішньовенного введення. Рак молочної залози є необов'язково метастатичним або місцеворозповсюдженим. В одному з варіантів здійснення пацієнт попередньо не одержував системної негормональної протипухлинної терапії за схемою лікування метастатичних форм. В іншому аспекті винахід стосується способу лікування HER2-позитивного раку молочної залози у пацієнта, який включає введення пацієнту пертузумабу, трастузумабу й інгібітору ароматази (наприклад, анастразолу або летрозолу). Необов'язково, рак молочної залози являє собою позитивний по рецепторах гормонів розповсюджений рак молочної залози, де рецептор гормону є, наприклад, рецептором естрогену (ER) і/або рецептором прогестерону (PgR). По цьому варіанті здійснення винаходу, пацієнт попередньо не одержував системної негормональної протипухлинної терапії за схемою лікування метастатичних форм. Крім того, пацієнт необов'язково одержував індукційну хіміотерапію (яка, наприклад, включає таксан). У додатковому варіанті здійснення винахід стосується способу лікування пацієнта зі злоякісною пухлиною, який включає введення пацієнту початкової дози пертузумабу 840 мг із наступним введенням кожні три тижні дози пертузумабу 420 мг, і додатково включає повторне введення пацієнту дози пертузумабу 840 мг, якщо час між двома послідовними дозами 420 мг складає 6 тижнів або більше. Необов'язково, спосіб додатково включає введення 420 мг пертузумабу кожні 3 тижні після повторного введення дози 840 мг. В одному з варіантів здійснення у пацієнта зі злоякісною пухлиною HER2-позитивний рак молочної залози. У додатковому аспекті винахід стосується способу лікування HER2-позитивного метастатичного або місцеворецидивуючого раку молочної залози у пацієнта, який включає введення пацієнту пертузумабу, трастузумабу і таксану (наприклад, доцетакселу, паклітакселу або nab-паклітакселу), де пацієнта раніше лікували трастузумабом і/бо лапатинібом як ад'ювантною або неоад'ювантною терапією. У ще одному додатковому аспекті винахід стосується способу лікування раку яєчника з низьким рівнем HER3, первинного перитонеального раку або раку фаллопієвих труб у пацієнта, який включає введення пацієнту пертузумабу і хіміотерапії, де хіміотерапія включає таксан (наприклад, паклітаксел) або топотекан. У додатковому аспекті винахід стосується способу лікування раку яєчника з низьким рівнем HER3, первинного перитонеального раку або раку фаллопієвих труб у пацієнта, який включає введення пацієнту пертузумабу і хіміотерапії, де рак з низьким рівнем HER3 експресує мРНК HER3 з показником концентрації, що дорівнює або менше, ніж приблизно 2,81, при оцінці за допомогою полімеразної ланцюгової реакції (ПЛР). В одному з варіантів здійснення хіміотерапія включає гемцитабін, карбоплатин, паклітаксел, доцетаксел, топотекан або пегильований ліпосомальний доксорубіцин (PLD). Необов'язково, хіміотерапія включає паклітаксел або 5 UA 116095 C2 5 10 15 20 25 30 35 40 45 50 55 топотекан. В одному з варіантів здійснення злоякісна пухлина являє собою епітеліальний рак яєчників, що стійкий до лікування платиною або не піддається лікуванню платиною. Короткий опис креслень На фіг. 1 представлене схематичне зображення структури білка HER2 і амінокислотні послідовності для доменів I-IV (SEQ ID NО:1-4, відповідно) його позаклітинного домену. Фіг. 2A і 2B показують вирівнювання амінокислотних послідовностей варіабельного домену легкого ланцюга (VL) (фіг. 2A) і варіабельного домену важкого ланцюга (VH) (фіг. 2B) моноклонального антитіла миші 2C4 (SEQ ID NO:5 і 6, відповідно); VL- і VH-домени варіанта 574/пертузумаб (SEQ ID NO:7 і 8, відповідно) і консенсусної послідовності каркаса VL і VH людини (hum κ1, легкий ланцюг каппа підгрупа I; hum III, важкий ланцюг підгрупа III) (SEQ ID NO:9 і 10, відповідно). Зірочки позначають відмінності між варіабельними доменами пертузумабу і мишачого моноклонального антитіла 2C4 або між варіабельними доменами пертузумабу і каркасними областями людини. Області, що визначають комплементарність (CDR), знаходяться в дужках. Фіг. 3A і 3B показують амінокислотні послідовності легкого ланцюга (фіг. 3A; SEQ ID NO:11) і важкого ланцюга (фіг. 3B; SEQ ID NO:12) пертузумабу. CDR виділені жирними. Розраховані молекулярні маси легкого ланцюга і важкого ланцюга складають 23526,22 Да й 49216,56 Да (цистеїни у відновленій формі). Вуглеводна група приєднана до Asn 299 важкого ланцюга. Фіг. 4A і 4B показують амінокислотні послідовності легкого ланцюга (фіг. 4A; SEQ ID NО:13) і важкого ланцюга (фіг. 4B; SEQ ID NO:14) трастузумабу, відповідно. Границі варіабельних доменів легкого і важкого ланцюгів вказані стрілками. Фіг. 5A і 5B показують варіантну послідовність легкого ланцюга пертузумабу (фіг. 5A; SEQ ID NO:15) і варіантну послідовність важкого ланцюга (фіг. 5B; SEQ ID NO:16) пертузумабу, відповідно. На фіг. 6 представлена схема дослідження з прикладу 1. ECOG = Східна об'єднана онкологічна група; PD = прогресуюче захворювання. Примітки: трастузумаб, пертузумаб і цисплатин вводять за допомогою внутрішньовенного вливання в день 1 кожного 3-тижневого циклу. Капецитабін вводять перорально двічі на добу, починаючи з вечора дня 1 до ранку дня 15 кожного 3-тижневого циклу, (a) HER2-позитивна пухлина визначена або як IHC 3+, або як IHC 2+ у комбінації з ISH+ (тобто IHC 3+/ISH+ або ICH 2+/ISH+); (b) трастузумаб в ударній дозі 8 мг/кг для циклу 1 і в дозі 6 мг/кг для наступних циклів; (c) пертузумаб у день 1 кожного циклу, в ударній дозі 840 мг для циклу 1 і в дозі 420 мг для циклів 2-6. Фіг. 7 показує відбір у дослідження, популяцію по призначеному лікуванню і популяцію по оцінці безпеки, і виключення пацієнтів з дослідження в прикладі 3. Фіг. 8 являє собою криву Каплана-Мейєра для виживаності без прогресування (PFS) по оцінці незалежної аналітичної установи (IRF) для дослідження в прикладі 3. Фіг. 9 показує PFS субгрупи пацієнтів для дослідження в прикладі 3. Фіг. 10 показує загальну виживаність для дослідження в прикладі 3. Фіг. 11 являє собою загальний огляд режиму дозування у пацієнтів з HER2-позитивним, неоад'ювантним раком молочної залози з низькими кардіологічними факторами ризику в прикладі 5. Додаткова променева терапія, гормональна терапія і хіміотерапія після хірургічного втручання і під час ад'ювантного лікування трастузумабом були дозволені, якщо дослідник вважав це необхідним. Фіг. 12 показує середню зміну у ФВЛШ (центральні читання) для дослідження в прикладі 5. На фіг. 13 представлена повна патологічна відповідь (pCR) для дослідження в прикладі 5. Фіг. 14 показує повну патологічну відповідь (pCR)по статусу рецепторів гормонів у дослідженні в прикладі 5. Фіг. 15 показує профіль SEK пертузумабу в суміші пертузумаб/трастузумаб (840 мг) при 30C у 0,9 % фізіологічному розчині в поліолефінових пакетах для в/в введень (1) Час = 0; (2) Час = 24 години. Розгорнутий вигляд; повний вигляд (вставка). На фіг. 16 представлений профіль SEK трастузумабу в суміші пертузумаб/трастузумаб (840 мг) при 30C у 0,9 % фізіологічному розчині в поліолефінових пакетах для в/в введень (1) Час = 0; (2) Час = 24 години. Розгорнутий вигляд; повний вигляд (вставка). На фіг. 17 представлений IEC-профіль пертузумабу в суміші пертузумаб/трастузумаб (840 мг) при 30 °C у 0,9 % фізіологічному розчині в поліолефінових пакетах для в/в введень (1) Час = 0; (2) Час = 24 години. Повний вигляд. Фіг. 18 показує IEC-профіль трастузумабу в суміші пертузумаб/трастузумаб при 30 °C у 0,9 % фізіологічному розчині в ПО-пакетах для в/в введень (1) Час = 0; (2) Час = 24 години. Розгорнутий вигляд; повний вигляд (вставка). 6 UA 116095 C2 5 10 15 20 25 30 35 40 45 50 55 60 Фіг. 19 показує CE-SDS LIF-профіль невідновленої суміші пертузумаб/трастузумаб при 30 °C у 0,9 % фізіологічному розчині в ПО-пакетах для в/в введень (1) Час = 0; (2) Час = 24 години. Розгорнутий вигляд. На фіг. 20 представлений CE-SDS LIF-профіль відновленої суміші пертузумаб/трастузумаб при 30 °C у 0,9 % фізіологічному розчині в ПО-пакетах для в/в введень (1) Час = 0; (2) Час = 24 години. Розгорнутий вигляд. Фіг. 21 являє собою CZE суміші пертузумаб/трастузумаб при 30 °C у 0,9 % фізіологічному розчині в ПО-пакетах для в/в введень (1) Час = 0; (2) Час = 24 години. Повний вигляд. На фіг. 22 представлене iCIEF суміші пертузумаб/трастузумаб при 30 °C у 0,9 % фізіологічному розчині в ПО-пакетах для в/в введень (1) Час = 0; (2) Час = 24 години. Повний вигляд. На фіг. 23 представлені криві активності доза-відповідь (мкг/мл відносно ВОФ) суміші пертузумаб/трастузумаб, пертузумабу окремо і трастузумабу окремо в 0,9 % фізіологічному розчині в ПО-пакетах для в/в введень (1) Час = 0; (2) Час = 24 години. Фіг. 24 показує профіль SEK пертузумабу в суміші пертузумаб/трастузумаб (1560 мг) у 0,9 % фізіологічному розчині в пакетах для в/в введень (1) ПО 5 °C T0 годин; (2) ПО 5 °C T24 години; (3) ПО 30 °C T0 годин; (4) ПО 30 °C T24 години; (5) ПВХ 5 °C T0 годин; (6) ПВХ 5 °C T24 години; (7) ПВХ 30 °C T0 годин; (8) ПВХ 30 °C T24 години. Розгорнутий вигляд; повний вигляд (вставка). На фіг. 25 представлений профіль SEK трастузумабу в суміші пертузумаб/трастузумаб (1560 мг) у 0,9 % фізіологічному розчині в пакетах для в/в введень (1) ПО 5 °C T0 годин; (2) ПО 5 °C T24 години; (3) ПО 30 °C T0 годин; (4) ПО 30 °C T24 години; (5) ПВХ 5 °C T0 годин; (6) ПВХ 5 °C T24 години; (7) ПВХ 30 °C T0 годин; (8) ПВХ 30 °C T24 години. Розгорнутий вигляд; повний вигляд (вставка). На фіг. 26 представлений IEC-профіль пертузумабу (швидка IEC) суміші пертузумаб/трастузумаб (1560 мг) у 0,9 % фізіологічному розчині в пакетах для в/в введень (1) ПО 5 °C T0 годин; (2) ПО 5 °C T24 години; (3) ПО 30 °C T0 годин; (4) ПО 30 °C T24 години; (5) ПВХ 5 °C T0 годин; (6) ПВХ 5 °C T24 години; (7) ПВХ 30 °C T0 годин; (8) ПВХ 30 °C T24 години. Повний вигляд. На фіг. 27 представлений IEC-профіль трастузумабу суміші пертузумаб/трастузумаб (1560 мг) у 0,9 % фізіологічному розчині в пакетах для в/в введень (1) ПО 5 °C T0 годин; (2) ПО 5 °C T24 години; (3) ПО 30 °C T0 годин; (4) ПО 30 °C T24 години; (5) ПВХ 5 °C T0 годин; (6) ПВХ 5 °C T24 години; (7) ПВХ 30 °C T0 годин; (8) ПВХ 30 °C T24 години. Повний вигляд. Фіг. 28 показує схему дослідження з прикладу 7. На фіг. 29 представлений дизайн дослідження з прикладу 8. На фіг. 30 представлений дизайн дослідження для частини 1 з прикладу 11. На фіг. 31 представлений дизайн дослідження для частини 2 з прикладу 11. На фіг. 32 представлені узяті зразки і часові точки для дослідження фази IIa раку шлунка (РШ) у прикладі 1. На фіг. 33 представлені демографічні показники популяції пацієнтів у двох групах по дослідженню РШ, яких лікували 420 мг (група A) або 840 мг (група B) пертузумабу. На фіг. 34 представлена історія хвороби пацієнтів із РШ у групах A і B, відповідно. На фіг. 35 представлений розподіл пацієнтів з РШ у групах A і B, відповідно. На фіг. 36 представлена сумарна ефективність терапії в групах A і B з дослідження РШ, відповідно. На фіг. 37 представлені результати оцінки концентрації пертузумабу в день 42 при раку шлунка (РШ) у порівнянні з метастатичним раком молочної залози (метастатичний РМЗ). Залишкова концентрація в день 42 була 37 % при РШ (JOSHUA 840/420 мг) у порівнянні з метастатичним РМЗ (CLEO 840/420 мг). Обидві схеми лікування JOSHUA 840/420 мг і 840/840 мг привели до залишкової концентрації в день 42≥20 мкг/мл у 90 % пацієнтів. Схема лікування JOSHUA 840/840 мг привела до залишкової концентрації в день 42 при РШ, порівнянної зі спостережуваними залишковими концентраціями при метастатичному РМЗ (CLEO 840/420 мг). Докладний опис переважних варіантів здійснення Словник деяких скорочень, використаних у даному документі: небажана реакція на лікарський засіб (ADR), небажана подія (AE), лужна фосфатаза (ЛФ), абсолютне число нейтрофілів (ANC), площа під кривою концентрація-час (AUC), капілярний зонний електрофорез (CZE), колір, зовнішній вигляд і прозорість (CAC), клінічна оцінка пертузумабу і трастузумабу (CLEOPATRA), довірчий інтервал (CI), хромогенна гібридизація in situ (CISH), максимальна концентрація (Cmax), повна відповідь (CR), індивідуальна реєстраційна карта (CRF), комп'ютерна томографія (КТ), загальна термінологія критеріїв для небажаних явищ (CTCAE), доцетаксел (D), лімітуюча дозу токсичність (DLT), комітет з етики (EC), епірубіцин, цисплатин і 5-фторурацил 7 UA 116095 C2 5 10 15 20 25 30 35 40 45 50 55 60 (ECF), ехокардіограма (ЕхоКГ), рецептор епідермального фактора росту (EGFR), Європейський Союз (ЄС), рецептор естрогену (ER), 5-фторурацил, метотрексат і доксорубіцин (FAMTX), флуоресцентна гібридизація in situ (FISH), 5-фторурацил (5-ФУ), співвідношення ризиків (HR), рецептор епідермального фактора росту людини (EGFR), рак шлунка (РШ), належна клінічна практика (GCP), рецептор епідермального фактора росту 2 людини (HER2), іонообмінна хроматографія (IEC), імуногістохімія (IHC), незалежна спостережувальна установа (IRF), експертна рада організації (IRB), гібридизація in situ (ISH), внутрішньовенний (в/в), капілярне ізоелектричне фокусування з детекцією у капілярі (iCIEF), фракція викиду лівого шлуночка (ФВЛШ), мітоміцин C, цисплатин і 5-фторурацил (MCF), магнітно-резонансне зображення (MRI), метастатичний рак молочної залози (МРМЗ), радіоізотопна вентрикулографія (MUGA), незначимий (NS), загальна виживаність (OS), повна патологічна відповідь (pCR), поліолефін (ПО), полівінілхлорид (ПВХ), прогресування захворювання (PD), виживаність без прогресування (PFS), фармакокінетичний (ФК), часткова відповідь (PR), рецептор прогестерону (PgR), критерії оцінки відповіді при солідних пухлинах (RECIST), серйозний побічний ефект (SAE), ексклюзійна хроматографія (SEK), стабільне захворювання (SD), група організації дослідження (SMT), стерильна вода для ін'єкцій (SWFI), час досягнення максимальної концентрації в плазмі (t max), верхня границя норми (ULN). I. Визначення Застосовуваний у даному документі термін "хіміотерапія" стосується лікування, яке включає введення хіміотерапії, як визначено в даному документі нижче. "Виживаність" стосується пацієнта, що залишається живим, і включає в себе загальну виживаність, а також виживаність без прогресування. "Загальна виживаність" або "OS" стосується пацієнта, що залишається живим протягом визначеного періоду часу, такого як 1 рік, 5 років і т. п., з часу постановки діагнозу або початку лікування. Для цілей клінічного випробування, описаного в прикладі, загальну виживаність (OS) визначають як час від дати рандомізації популяції пацієнтів до дати смерті від будь-якої причини. "Виживаність без прогресування" або "PFS" стосується пацієнта, що залишається живим без погіршення стану або прогресування злоякісної пухлини. Для цілей клінічного випробування, описаного в прикладі, виживаність без прогресування (PFS) визначають як час від дати рандомізації досліджуваної популяції до першого документально підтвердженого прогресування захворювання або неконтрольованої токсичності, або смерті від будь-якої причини, щоб не відбулося першим. Прогресування захворювання може бути документально підтверджене будьякими клінічно прийнятними способами, такими як, наприклад, рентгенографічне прогресування захворювання, документально підтверджене Критеріями оцінки відповіді солідних пухлин (RECIST) (Therasse et al., J. Natl. Ca. Inst. 2000; 92(3):205-216), карциноматозний менінгіт, діагностований шляхом цитологічного дослідження спинномозкової рідини, і/або медична фотографія для контролю повторного виникнення підшкірних бляшок стінок грудної клітки. Під "збільшенням виживаності" мають на увазі збільшення загальної виживаності або виживаності без прогресування у пацієнта, якого лікували відповідно до даного винаходу, у порівнянні з нелікованим пацієнтом і/або в порівнянні з пацієнтом, якого лікували одним або декількома схваленими протипухлинними агентами, але який не одержував лікування відповідно до даного винаходу. У конкретному прикладі, "збільшення виживаності" означає тривалу виживаність без прогресування (PFS) і/або загальну виживаність (OS) пацієнтів зі злоякісною пухлиною, що одержують комбіноване лікування за даним винаходом (наприклад, лікування комбінацією пертузумабу, трастузумабу і хіміотерапії), у порівнянні з пацієнтами, яких лікували тільки трастузумабом і хіміотерапією. В іншомуконкретному прикладі, "збільшення виживаності" означає тривалу виживаність без прогресування (PFS) і/або загальну виживаність (OS) пацієнтів зі злоякісною пухлиною, що одержують комбіноване лікування за даним винаходом (наприклад, лікування комбінацією пертузумабу, трастузумабу і хіміотерапії), у порівнянні з пацієнтами, яких лікували тільки пертузумабом і хіміотерапією. "Об'єктивна відповідь" стосується вимірюваної відповіді, включаючи повну відповідь (CR) або часткову відповідь (PR). Під "повною відповіддю" або "CR" мають на увазі зникнення всіх ознак злоякісної пухлини у відповідь на лікування. Це не завжди означає, що злоякісна пухлина була вилікувана. "Часткова відповідь" або "PR" стосується зменшення розміру однієї або декількох пухлин або утворень або зменшення поширення злоякісної пухлини в організмі у відповідь на лікування. "Рецептор HER" являє собою рецептор протеїнтирозинкінази, що належить до сімейства рецепторів HER і включає рецептори EGFR, HER2, HER3 і HER4. Рецептор HER, як правило, 8 UA 116095 C2 5 10 15 20 25 30 35 40 45 50 55 60 містить позаклітинний домен, що може зв'язуватися з лігандом HER і/або димеризуватися з іншою молекулою рецептора HER; ліпофільний трансмембранний домен; консервативний внутрішньоклітинний тирозинкіназний домен і карбоксикінцевий сигнальний домен, який містить декілька залишків тирозину, що можуть бути фосфориловані. Рецептор HER може являти собою "нативну послідовність" рецептора HER або його "варіантну амінокислотну послідовність". Переважно рецептор HER являє собою нативну послідовність рецептора HER людини. Вирази "ErbB2" і "HER2" використовуються взаємозамінно в даному документі і стосуються білка людини HER2, описаного, наприклад, у Semba et al., PNAS (USA), 82:6497-6501 (1985), і Yamamoto et al. Nature, 319:230-234 (1986) (Genebank, номер доступу X03363). Термін "ЕrbB2" neu стосується гена, що кодує ErbB2 людини, і "neu" стосується гена, що кодує pl85 щура. Переважно HER2 являє собою нативну послідовність HER2 людини. У даному документі "позаклітинний домен HER2" або "HER2 ECD" стосується домену HER2, що знаходиться зовні клітини або приєднаний до клітинної мембрани, або знаходиться в циркуляції, включаючи його фрагменти. Амінокислотна послідовність HER2 показана на фіг. 1. В одному з варіантів здійснення позаклітинний домен HER2 може містити чотири домени: "Домен I" (амінокислотні залишки приблизно від 1 до 195; SEQ ID NO:1), "Домен II" (амінокислотні залишки приблизно від 196 до 319; SEQ ID NO:2), "Домен III" (амінокислотні залишки приблизно від 320 до 488: SEQ ID NO:3) і "Домен IV" (амінокислотні залишки приблизно від 489 до 630; SEQ ID NO:4) (нумерація залишків без сигнального пептиду). Див. Garrett et al. Mol. Cell. 11:495505 (2003), Cho et al. Nature All: 756-760 (2003), Franklin et al. Cancer. Cell. 5:317-328 (2004), і Plowman et al. Proc. Natl. Acad. Sci. 90:1746-1750 (1993), а також фіг. 6 у даному документі. "HER3" або "ErbB3" у даному документі стосуються рецептора, описаного, наприклад, у патентах США №№ 5183884 і 5480968, а також Kraus et al. PNAS (USA), 86:9193-9197 (1989). Злоякісна пухлина з "низьким HER3" являє собою пухлину, що експресує HER3 на рівні, який менше, ніж середній рівень експресії HER3 у даному типі злоякісної пухлини. В одному з варіантів здійснення злоякісна пухлина з низьким HER3 являє собою епітеліальну злоякісну пухлину яєчників, очеревини або фаллопієвої труби. Можна оцінювати рівень ДНК, білка і/або мРНК HER3 у злоякісній пухлині для того, щоб визначити, чи є злоякісна пухлина пухлиною з низьким HER3. Див., наприклад, патент США № 7981418 для додаткової інформації про злоякісну пухлину з низьким HER3. Необов'язково, проводять аналіз експресії мРНК HER3 для того, щоб визначити, чи є злоякісна пухлина пухлиною з низьким HER3. В одному з варіантів здійснення рівень мРНК HER3 у злоякісній пухлині оцінюють, наприклад, за допомогою полімеразної ланцюгової реакції (ПЛР), такої як кількісна ПЛР зі зворотною транскрипцією (qRTПЛР). Необов'язково, злоякісна пухлина експресує HER3 у співвідношенні концентрацій, що дорівнює або менше, ніж приблизно 2,81, по оцінці qRT-ПЛР, наприклад, з використанням приладу COBAS z480®. "Димер HER" у даному документі являє собою нековалентно зв'язаний димер, що містить щонайменше два рецептори HER. Такі комплекси можуть формуватися, коли клітина, експресуюча два або більше рецепторів HER, піддається впливу ліганду HER, і їх можна виділити за допомогою імунопреципітації і досліджувати за допомогою SDS-PAGE, як описано, наприклад, у Sliwkowski et al, J. Biol. Chem., 269(20):14661-14665 (1994). З димером можуть бути зв'язані інші білки, такі як субодиниця рецептора цитокінів (наприклад, gp130). Переважно, димер HER включає HER2. "Гетеродимер HER" у даному документі являє собою нековалентно зв'язаний гетеродимер, що містить щонайменше два різних рецептори HER, такий як гетеродимери EGFR-HER2, HER2HER3 або HER2-HER4. "Антитіло до HER" являє собою антитіло, що зв'язується з рецептором HER. Необов'язково, антитіло до HER додатково заважає активації або функціонуванню HER. Переважно, антитіло до HER зв'язується з рецептором HER2. Антитілами до HER2, що представляють інтерес, у даному документі є пертузумаб і трастузумаб. "Активація HER" стосується активації або фосфорилування будь-якого одного або декількох рецепторів HER. Як правило, результатом активації HER є передача сигналу (наприклад, викликана за допомогою внутрішньоклітинного кіназного домену рецептора HER, фософорилуючого тирозинові залишки в рецепторі HER або поліпептиді субстрату). Активація HER може бути опосередкована зв'язуванням ліганду HER з димером HER, який складається з рецептора HER, що представляє інтерес. Зв'язування ліганду HER з димером HER може активувати кіназний домен одного або декількох рецепторів HER у димері і, таким чином, приводити до фосфорилування тирозинових залишків в одному або декількох рецепторах HER і/або 9 UA 116095 C2 5 10 15 20 25 30 35 40 45 50 55 60 фосфорилування тирозинових залишків у додатковому поліпептиді(ах) субстрату, такому як внутрішньоклітинні кінази Akt або MAPK. "Фосфорилування" стосується додавання однієї або декількох фосфатних груп у білок, такий як рецептор HER або його субстрат. Антитіло, яке "інгібує димеризацію HER", являє собою антитіло, яке інгібує або перешкоджає утворенню димеру HER. Переважно, таке антитіло зв'язується з HER2 в його гетеродимерній ділянці зв'язування. Найбільш переважним антитілом, інгібуючим димеризацію, у даному документі є пертузумаб або MAb 2C4. Інші приклади антитіл, які інгібують димеризацію HER, включають антитіла, що зв'язуються з EGFR і інгібують його димеризацію з одним або декількома іншими рецепторами HER (наприклад, моноклональне антитіло 806 до EGFR, MAb 806, що зв'язується з активованим або "вільним" EGFR; див. Johns et al., J. Biol. Chem. 279(29):30375-30384 (2004)); антитіла, що зв'язуються з HER3 і інгібують його димеризацію з одним або декількома іншими рецепторами HER; і антитіла, що зв'язуються з HER4 і інгібують його димеризацію з одним або декількома іншими рецепторами HER. "Інгібітор димеризації HER2" являє собою агент, що інгібує утворення димеру або гетеродимеру, що включає в себе HER2. "Гетеродимерна ділянка зв'язування" на HER2 стосується області позаклітинного домену HER2, яка контактує або взаємодіє з областю позаклітинного домену EGFR, HER3 або HER4 при утворенні димеру з ними. Ця область знаходиться в домені II HER2 (SEQ ID NO:15). Franklin et al. Cancer. Cell. 5:317-328 (2004). Антитіло до HER2, яке "зв'язується з гетеродимерною ділянкою зв'язування" HER2, зв'язується з залишками в домені II (SEQ ID NO:2) і необов'язково також зв'язується з залишками в інших доменах позаклітинного домену HER2, таких як домени I і III (SEQ ID NO:1 і 3), і може просторово перешкодити, щонайменше до деякої міри, утворенню гетеродимеру HER2-EGFR, HER2-HER3 або HER2-HER4. Franklin et al. Cancer. Cell. 5:317-328 (2004), характеризує кристалічну структуру HER2-пертузумаб, що зберігається в базі даних білків RCSB (ID Code IS78), ілюструючи приклад антитіла, що зв'язується з гетеродимерною ділянкою зв'язування HER2. Антитіло, яке "зв'язується з доменом II" HER2, зв'язується з залишками в домені II (SEQ ID NO:2) і необов'язково із залишками в іншому домені(ах) HER2, такому як домени I і III (SEQ ID NO:1 і 3, відповідно). Переважно, антитіло, що зв'язується з доменом II, зв'язується зі з'єднанням між доменами I, II і III HER2. Для цілей даного документа "пертузумаб" і "rhuMAb 2C4", які використовують взаємозамінно, стосуються антитіла, що містить амінокислотні послідовності варіабельного легкого і варіабельного важкого ланцюгів з SEQ ID NO:7 і 8, відповідно. Коли пертузумаб являє собою інтактне антитіло, він переважно включає антитіло IgG1, що, в одному з варіантів здійснення, включає амінокислотну послідовність легкого ланцюга з SEQ ID NO:11 або 15 і амінокислотну послідовність важкого ланцюга з SEQ ID NO:12 або 16. Антитіло необов'язкове виробляється рекомбінантними клітинами китайського хом'ячка (CHO). Терміни "пертузумаб" і "rhuMAb 2C4" у даному документі включають біоеквівалентні версії лікарського засобу з найменуванням препарату по довіднику національних непантентованих назв США (US AN) або міжнародною непатентованою назвою (INN): пертузумаб. Для цілей даного документа "трастузумаб" і "rhuMAb 4D5", що використовують взаємозамінно, стосуються антитіла, що містить амінокислотні послідовності варіабельного легкого і варіабельного важкого ланцюгів з SEQ ID NО:13 і 14, відповідно. Коли трастузумаб являє собою інтактне антитіло, він переважно включає антитіло IgG1, що, в одному з варіантів здійснення, включає амінокислотну послідовність легкого ланцюга з SEQ ID NO:13 і амінокислотну послідовність важкого ланцюга з SEQ ID NO:14. Антитіло необов'язкове виробляється рекомбінантними клітинами китайського хом'ячка (CHO). Терміни "трастузумаб" і "rhuMAb 4D5" у даному документі включають біоеквівалентні версії лікарського засобу з найменуванням препарату по довіднику національних непантентованих назв США (US AN) або міжнародною непатентованою назвою (INN): трастузумаб. Термін "антитіло" у даному документі застосовується в найбільш широкому розумінні і конкретно включає моноклональні антитіла, поліклональні антитіла, поліспецифічні антитіла (наприклад, біспецифічні антитіла) і фрагменти антитіл, за умови, що вони виявляють бажану біологічну активність. "Гуманізовані" форми антитіл, що не належать людині (наприклад, гризунів), являють собою химерні антитіла, що містять мінімальну послідовність, одержану з імуноглобуліну, що не належить людині. Переважно, гуманізовані антитіла являють собою імуноглобуліни людини (реципієнтне антитіло), у яких залишки з гіперваріабельної області реципієнта заміщені 10 UA 116095 C2 5 10 15 20 25 30 35 40 45 50 55 60 залишками з гіперваріабельної області видів, що не є людиною (донорне антитіло), таких як миша, щур, кролик або примати, що не є людиною, які мають бажану специфічність, афінність і потенціал. У деяких випадках, залишки каркасної області (FR) імуноглобуліну людини заміщені відповідними залишками, що не належать людині. Крім того, гуманізовані антитіла можуть містити залишки, яких немає в реципієнтному антитілі або в донорному антитілі. Ці модифікації здійснені для додаткового поліпшення продуктивності антитіла. Як правило, гуманізоване антитіло містить по суті всі з щонайменше одного і, як правило, двох варіабельних доменів, у яких всі або по суті всі гіперваріабельні петлі відповідають петлям імуноглобуліну, що не належить людині, і всі або по суті всі з FR є FR з послідовності імуноглобуліну людини. Гуманізоване антитіло необов'язкове також містить щонайменше частину константної області імуноглобуліну (Fc), як правило, з імуноглобуліну людини. Більш докладно, див. Jones et al. Nature, 321:522-525 (1986); Riechmann et al. Nature, 332:323-329 (1988); і Presta, Curr. Op. Struct. Biol. 2:593-596 (1992). Гуманізовані антитіла до HER2 конкретно включають трастузумаб (ГЕРЦЕПТИН®), як описано в таблиці 3 патенту США 5821337, прямо включеного в даний документ як посилання, і як визначено в даному документі; і гуманізовані антитіла 2C4, такі як пертузумаб, як описано і визначено в даному документі. "Інтактне антитіло" у даному документі являє собою антитіло, що містить дві антигенз'язувальні області і Fc-область. Переважно, інтактне антитіло має функціональну Fcобласть. "Фрагменти антитіл" включають частину інтактного антитіла, що переважно містить його антигенз'язувальну область. Приклади фрагментів антитіл включають фрагменти Fab, Fab', F(ab')2 і Fv; діатіла; лінійні антитіла; молекули одноланцюжкового антитіла і поліспецифічні антитіла, утворені з фрагмента антитіла (антитіл). "Нативні антитіла" являють собою, як правило, гетеротетрамерні глікопротеїни масою приблизно 150000 Дальтон, що складаються з двох однакових легких (L) ланцюгів і двох однакових важких (H) ланцюгів. Кожен легкий ланцюг зв'язаний з важким ланцюгом за допомогою одного ковалентного дисульфідного зв'язку, хоча кількість дисульфідних зв'язків варіює у важких ланцюгах різних ізотипів імуноглобулінів. Кожен важкий і легкий ланцюг також має через однакові проміжки внутрішньоланцюжкові дисульфідні містки. Кожен важкий ланцюг має на одному кінці варіабельний домен (VH), з наступним рядом константних доменів. Кожен легкий ланцюг має варіабельний домен на одному кінці (VL) і константний домен на іншому кінці. Константний домен легкого ланцюга змикається з першим константним доменом важкого ланцюга, і варіабельний домен легкого ланцюга змикається з варіабельним доменом важкого ланцюга. Як вважають, конкретні амінокислотні залишки утворюють границю між легким ланцюгом і варіабельними доменами важких ланцюгів. Термін "гіперваріабельна область", використовуваний у даному документі, стосується амінокислотних залишків антитіла, що відповідають за зв'язування з антигеном. Гіперваріабельна область, в основному, містить амінокислотні залишки з "області, що визначає комплементарність", або "CDR" (наприклад, залишки 24-34 (L1), 50-56 (L2) і 89-97 (L3) у варіабельному домені легкого ланцюга і 31-35 (H1), 50-65 (H2) і 95-102 (H3) у варіабельному th домені важкого ланцюга; Kabat et al. Sequences of Proteins of Immunological Interest, 5 Ed. Public Health Service, National Institutes of Health, Bethesda, MD. (1991)) і/або такі залишки з "гіперваріабельної петлі" (наприклад, залишки 26-32 (L1), 50-52 (L2) і 91-96 (L3) у варіабельному домені легкого ланцюга і 26-32 (H1), 53-55 (H2) і 96-101 (H3) у варіабельному домені важкого ланцюга; Chothia і Lesk, J. Mol. Biol. 196:901-917 (1987)). Залишки "каркасної області" або "FR" являють собою залишки варіабельного домену, інші ніж залишки гіперваріабельної області, визначені в даному документі. Термін "Fc-область" у даному документі застосовують для визначення C-кінцевої області важкого ланцюга імуноглобуліну, включаючи нативну послідовність Fc-області і варіантну Fcобласть. Хоча границі Fc-області важкого ланцюга імуноглобуліну можуть варіювати, Fcобласть важкого ланцюга IgG людини, як правило, визначають як таку, що тягнеться від амінокислотного залишку в положенні Cys226, або від Pro230 до карбоксильного кінця. Cкінцевий лізин Fc-області (залишок 447 відповідно до системи нумерації EU) може бути видалений, наприклад, під час виробництва або очищення антитіла або шляхом рекомбінантної інженерії нуклеїнової кислоти, що кодує важкий ланцюг антитіла. Таким чином, композиція інтактних антитіл може містити популяції антитіл із усіма видаленими залишками K447, популяції антитіл з невидаленими залишками K447 і популяції антитіл, що включають суміш антитіл з залишком або без залишку K447. Якщо не зазначено інакше, у даному документі нумерація залишків у важкому ланцюзі імуноглобуліну відповідає індексу EU, як у Kabat et al. Sequences of Proteins of Immunological 11 UA 116095 C2 th 5 10 15 20 25 30 35 40 45 50 55 Interest, 5 Ed. Public Health Service, National Institutes of Health, Bethesda, MD (1991), прямо включеному в даний документ як посилання. "Індекс EU, як у Kabat" належить до Європейської нумерації залишків антитіла IgG1 людини. "Функціональна Fc-область" має "ефекторну функцію" нативної послідовності Fc-області. Типові "ефекторні функції" включають зв'язування з Clq; обумовлену комплементом цитотоксичність; зв'язування з Fc-рецептором; антитілозалежну клітинну цитотоксичність (ADCC); фагоцитоз; негативну регуляцію рецепторів клітинної поверхні (наприклад, B-клітинного рецептора; BCR) і т. д. Такі ефекторні функції, в основному, вимагають сполучення Fc-області зі зв'язувальним доменом (наприклад, варіабельним доменом антитіла) і можуть бути оцінені з використанням різних аналізів, описаних, наприклад, у даному документі. "Нативна послідовність Fc-області" містить амінокислотну послідовність, ідентичну амінокислотній послідовності Fc-області, що зустрічається в природі. Нативна послідовність Fcобласті людини включає в себе нативну послідовність Fc-області IgG1 людини (не-A і A алотипи), нативну послідовність Fc-області IgG2 людини, нативну послідовність Fc-області IgG3 людини і нативну послідовність Fc-області IgG4 людини, а також їх природні варіанти. "Варіантна Fc-область" містить амінокислотну послідовність, що відрізняється від нативної послідовності Fc-області за рахунок щонайменше однієї амінокислотної модифікації, переважно заміни однієї або декількох амінокислот. Переважно, варіантна Fc-область має щонайменше одну амінокислотну заміну в порівнянні з нативною послідовністю Fc-області або в порівнянні з Fc-областю батьківського поліпептиду, наприклад приблизно від однієї до приблизно десяти замін амінокислот і переважно приблизно від однієї до приблизно п'яти замін амінокислот у нативній послідовності Fc-області або в Fc-області батьківського поліпептиду. Варіантна Fcобласть у даному документі переважно має щонайменше приблизно 80 % гомологію з нативною послідовністю Fc-області і/або з Fc-областю батьківського поліпептиду і найбільш переважно щонайменше приблизно 90 % гомологію з ними, більш переважно щонайменше приблизно 95 % гомологію з ними. Залежно від амінокислотної послідовності константного домену їх важких ланцюгів, інтактні антитіла можуть бути віднесені до різних "класів". Існує 5 головних класів інтактних антитіл: IgA, IgD, IgE, IgG і IgM, і деякі з них можуть бути додатково розділені на "підкласи" (ізотипи), наприклад, IgG1, IgG2, IgG3, IgG4, IgA і IgA2. Константні домени важкого ланцюга, що відповідають різним класам антитіл, називаються α, δ, ε, γ і μ, відповідно. Структура субодиниць і тривимірні конфігурації різних класів імуноглобулінів добре відомі. "Голе антитіло" являє собою антитіло, що не кон'юговане з гетерологічною молекулою, такою як цитотоксична функціональна група або радіоактивна мітка. "Афінно зріле" антитіло являє собою антитіло з однією або декількома змінами в його одній або декількох гіперваріабельних областях, що приводить до поліпшення спорідненості антитіла до антигену, у порівнянні з батьківським антитілом, що не має таких змін. Переважно афінно зрілі антитіла мають наномолярні або навіть пікомолярні афінності до цільового антигену. Афінно зрілі антитіла виробляють відомими в даній галузі способами. Marks et al. Bio/Technology, 10:779-783 (1992), описує дозрівання афінності шляхом випадкового перемішування VH- і VL-доменів. Випадковий мутагенез CDR і/або каркасних залишків описаний у Barbas et al. Proc. Nat. Acad. Sci, USA, 91:3809-3813 (1994); Schier et al. Gene, 169:147-155 (1995); Yelton et al. J. Immunol. 155:1994-2004 (1995); Jackson et al, J. Immunol. 154(7):3310-9 (1995); і Hawkins et al. J. Mol. Biol. 226:889-896 (1992). "Дезамідоване" антитіло являє собою антитіло, у якому один або декілька аспарагінових залишків були перетворені в похідне, наприклад в аспарагінову кислоту, сукцинімід або ізоаспарагінову кислоту. Терміни "злоякісна пухлина" і "злоякісний" стосуються фізіологічного стану або описують фізіологічний стан у ссавців, який, як правило, характеризується нерегульованим клітинним ростом. "Рак шлунка" конкретно включає метастатичний або місцеворозповсюджений нерезектабельний рак шлунка, у тому числі, без обмежень, гістологічно підтверджену аденокарциному шлунка або гастроезофагального з'єднання з неоперабельним (нерезектабельним) місцеворозповсюдженим або метастатичним захворюванням, що не піддається лікувальній терапії, і післяопераційний рецидивуючий розповсюджений рак шлунка, такий як аденокарцинома шлунка або гастроезофагального з'єднання, у випадку, коли метою операції було лікування захворювання. "Розповсюджена" злоякісна пухлина являє собою пухлину, що поширилася за межі органа або місця утворення, або шляхом місцевої інвазії, або шляхом метастазування. Таким чином, 12 UA 116095 C2 5 10 15 20 25 30 35 40 45 50 55 60 термін "розповсюджена" злоякісна пухлина включає як місцеворозповсюджене, так і метастатичне захворювання. "Рефрактерна" злоякісна пухлина являє собою пухлину, що прогресує навіть незважаючи на протипухлинний препарат, такий як хіміотерапія, який вводять пацієнту з раком. Прикладом рефрактерної злоякісної пухлини є пухлина, яка стійка до платини. "Рецидивуюча" злоякісна пухлина являє собою пухлину, що виросла знову, або в початковому місці, або на відстані, після відповіді на початкову терапію, таку як хірургічне втручання. "Місцеворецидивуюча" злоякісна пухлина являє собою злоякісну пухлину, що виникла знову після лікування на тому ж місці, що і раніше лікована злоякісна пухлина. "Неоперабельну" або "нерезектабельну" злоякісну пухлину неможливо видалити (резектувати) шляхом хірургії. "Рання стадія раку молочної залози" у даному документі стосується раку молочної залози, що не поширюється за межі молочної залози або пахвових лімфовузлів. Таку злоякісну пухлину, в основному, лікують за допомогою неоад'ювантної або ад'ювантної терапії. "Неоад'ювантна терапія" стосується системної терапії, що проводиться перед операцією. "Ад'ювантна терапія" стосується системної терапії, що проводиться після операції. "Метастатична" злоякісна пухлина стосується злоякісної пухлини, що поширилася з однієї частини організму (наприклад, молочної залози) в іншу частину організму. У даному документі, "пацієнт" або "індивідуум" є пацієнтом-людиною. Пацієнт може бути "пацієнтом зі злоякісною пухлиною", тобто пацієнтом, що має ризик розвитку або страждає від одного або декількох симптомів злоякісної пухлини, зокрема раку шлунка або раку молочної залози. "Популяція пацієнтів" стосується групи пацієнтів зі злоякісною пухлиною. Такі популяції можна використовувати для демонстрації статистично значимої ефективності і/або безпеки лікарського засобу, такого як пертузумаб. Пацієнт із "рецидивом" являє собою пацієнта, у якого є ознаки або симптоми злоякісної пухлини після ремісії. Необов'язково, у пацієнта виникає рецидив після ад'ювантної або неоад'ювантної терапії. Злоякісна пухлина або біологічний зразок, що "демонструє експресію, ампліфікацію або активацію HER", являє собою той, котрий у діагностичному тесті експресує (у тому числі надекспресує) рецептор HER, ампліфікує ген HER і/або іншим способом демонструє активацію або фосфорилування рецептора HER. Злоякісна пухлина або біологічний зразок, що "демонструє активацію HER", являє собою той, котрий в діагностичному тесті демонструє активацію або фосфорилування рецептора HER. Таку активацію можна визначати прямо (наприклад, шляхом вимірювання фосфорилування HER за допомогою ELISA) або побічно (наприклад, шляхом визначення профілю генної експресії або шляхом виявлення гетеродимерів HER, як описано в даному документі). Злоякісна клітина з "надекспресією або ампліфікацією рецептора HER" являє собою клітину, що має значно більш високі рівні рецептора, білка або гена HER у порівнянні з незлоякісною клітиною такого ж типу тканини. Така надекспресія може бути викликана ампліфікацією гена або підвищеною транскрипцією або трансляцією. Надекспресію або ампліфікацію рецептора HER можна визначати в діагностичному або прогностичному аналізі шляхом оцінки підвищених рівнів білка HER, присутнього на поверхні клітини (наприклад, за допомогою імуногістохімічного аналізу, IHC). Альтернативно, або додатково, можна вимірювати в клітині рівні нуклеїнової кислоти, що кодує HER, наприклад, шляхом гібридизації in situ (ISH), у тому числі флуоресцентної гібридизації in situ (FISH; див. WО 98/45479, опубліковано у жовтні 1998) і хромогенної гібридизації in situ (CISH; див., наприклад, Tanner et al., Am. J. Pathol. 157(5):14671472 (2000); Bella et al., J. Clin. Oncol. 26: (May 20 suppl; abstr 22147) (2008)), саузерн-блотингу або способами полімеразної ланцюгової реакції (ПЛР), такими як кількісна ПЛР у реальному часі (qRT-ПЛР). Можна також досліджувати надекспресію або ампліфікацію рецептора HER шляхом вимірювання антигену, що "злущується" з поверхні клітини (наприклад, позаклітинного домену HER), у біологічній рідині, такій як сироватка (див., наприклад, патент США № 4933294, виданий 12 червня 1990 року; WO 91/05264, опубліковано 18 квітня 1991 року; патент США № 5401638, виданий 28 березня 1995 року; і Sias et al. J. Immunol. Methods 132:73-80 (1990)). Крім вищевказаних аналізів, фахівцю в даній галузі доступні різні аналізи in vivo. Наприклад, можна піддавати клітини в організмі пацієнта впливу антитіла, що необов'язково помічене детектованою міткою, наприклад радіоактивним ізотопом, і можна оцінювати зв'язування антитіла з клітинами пацієнта, наприклад, шляхом зовнішнього сканування радіоактивності або шляхом аналізу біопсії, узятої у пацієнта, що раніше піддавався впливу антитіла. 13 UA 116095 C2 5 10 15 20 25 30 35 40 45 50 55 "HER2-позитивна" злоякісна пухлина містить злоякісні клітини, що мають рівні HER2 вище, ніж нормальні. Приклади HER2-позитивного раку включають HER2-позитивний рак молочної залози і HER2-позитивний рак шлунка. Необов'язково, HER2-позитивна злоякісна пухлина має імуногістохімічний (IHC) показник 2+ або 3+ і/або співвідношення ампліфікації ≥2,0 при гібридизації in situ (ISH). У даному документі, "протипухлинний препарат" стосується лікарського засобу, застосовуваного для лікування злоякісної пухлини. Необмежувальні приклади протипухлинних препаратів у даному документі включають препарати для хіміотерапії, інгібітори димеризації HER, антитіла до HER, антитіла, спрямовані проти антигенів, асоційованих з пухлинами, протигормональні сполуки, цитокіни, лікарські засоби проти EGFR, антиангіогенні засоби, інгібітори тирозинкінази, засоби й антитіла, інгібуючі ріст, цитотоксичні засоби, антитіла, які індукують апоптоз, інгібітори COX, інгібітори фарнезилтрансферази, антитіла, які зв'язуються з онкофетальним білком CA125, вакцини проти HER2, інгібітори Raf або ras, ліпосомальний доксорубіцин, топотекан, таксен, комбінацію з двох інгібіторів тирозинкінази, TLK286, EMD-7200, пертузумаб, трастузумаб, ерлотиніб і бевацизумаб. "Епітоп 2C4" являє собою область у позаклітинному домені HER2, з яким зв'язується антитіло 2C4. Для відбору антитіл, що зв'язуються переважно з епітопом 2C4, можна проводити звичайний перехресний конкурентний аналіз, такий, як описаний у Antibodies, A Laboratory Manual, Cold Spring Harbor Laboratory, Ed Harlow і David Lane (1988). Переважно антитіло блокує опосередковане 2C4 зв'язування з HER2 приблизно на 50 % або більше. Альтернативно, картування епітопів можна проводити для оцінки, чи зв'язується антитіло до HER переважно з епітопом 2C4 на HER2. Епітоп 2C4 включає залишки з домену II (SEQ ID NO:2) у позаклітинному домені HER2. 2C4 і пертузумаб зв'язуються з позаклітинним доменом HER2 у місці з'єднання з доменами I, II і III (SEQ ID NO:1, 2, і 3, відповідно). Franklin et al. Cancer. Cell. 5:317-328 (2004). "Епітоп 4D5" являє собою область у позаклітинному домені HER2, з яким зв'язуються антитіло 4D5 (ATCC CRL 10463) і трастузумаб. Цей епітоп розташований поруч із трансмембранним доменом HER2 і усередині домену IV HER2 (SEQ ID NO:4). Для відбору антитіл, що зв'язуються переважно з епітопом 4D5, можна проводити звичайний перехресний конкурентний аналіз, такий, як описаний у Antibodies, A Laboratory Manual, Cold Spring Harbor Laboratory, Ed Harlow і David Lane. Альтернативно, картування епітопів можна проводити для оцінки, чи зв'язується антитіло до HER переважно з епітопом 4D5 на HER2 (наприклад, будьякий один або декілька залишків в області приблизно від залишку 529 до приблизно залишку 625, включаючи ECD HER2; нумерація залишків, включаючи сигнальний пептид). "Лікування" стосується як терапевтичного, так і профілактичного лікування або превентивних мір. Ті, хто потребує лікування, включають тих, у кого вже є злоякісна пухлина, а також тих, у кого необхідно запобігти злоякісній пухлині. Таким чином, пацієнт, якого потрібно лікувати, у даному документі може мати діагноз "злоякісна пухлина" або може бути схильний або сприйнятливий до злоякісної пухлини. Термін "ефективна кількість" стосується кількості лікарського засобу, ефективної для лікування злоякісної пухлини у пацієнта. Ефективна кількість лікарського засобу може зменшувати число злоякісних клітин; зменшувати розмір пухлини; інгібувати (тобто уповільнювати до деякої міри і переважно зупиняти) інфільтрацію злоякісних клітин у периферичні органи; інгібувати (тобто уповільнювати до деякої міри і переважно зупиняти) метастазування пухлини; інгібувати, до деякої міри, ріст пухлини і/або полегшувати до деякої міри один або декілька симптомів, пов'язаних зі злоякісною пухлиною. Залежно від міри, у якій лікарський засіб може запобігати росту і/або убивати існуючі злоякісні клітини, він може бути цитостатичним і/або цитотоксичним. Ефективна кількість може продовжити виживаність без прогресування (наприклад, виміряна за допомогою Критеріїв оцінки відповіді при солідних пухлинах, RECIST, або змін CA-125), приводячи до об'єктивної відповіді (включаючи часткову відповідь, PR, або повну відповідь, CR), збільшити час загальної виживаності і/або поліпшити один або декілька симптомів злоякісної пухлини (наприклад, по оцінці FOSI). Застосовуваний у даному документі термін "цитотоксичний засіб" стосується речовини, що інгібує або запобігає функціонуванню клітин і/або викликає руйнування клітин. Термін має на 211 131 125 90 186 188 153 212 увазі включення радіоактивних ізотопів (наприклад, At , I , I , Y , Re , Re , Sm , Bi , 32 P і радіоактивних ізотопів Lu), хіміотерапевтичних засобів і токсинів, таких як низькомолекулярні токсини або ферментативно активні токсини бактеріального, грибкового, рослинного або тваринного походження, у тому числі їх фрагментів і/або варіантів. "Хіміотерапія" являє собою застосування хімічної сполуки, придатної для лікування злоякісної пухлини. 14 UA 116095 C2 5 10 15 20 25 30 35 40 45 50 55 60 Приклади хіміотерапевтичних засобів, застосовуваних у хіміотерапії, включають алкілувальні засоби, такі як тіотепа і CYTOXAN® циклофосфамід; алкілсульфонати, такі як бусульфан, імпросульфан і піпосульфан; азиридини, такі як бензодопа, карбоквон, метуредопа й уредопа; етиленіміни і метиламеламіни, у тому числі алтретамін, триетиленмеламін, триетиленфосфорамід, триетилентіофосфорамід і триметилоломеламін; TLK 286 (TELCYTA™); ацетогеніни (зокрема, булатацин і булатацинон); дельта-9-тетрагідроканабінол (дронабінол, MARINOL®); бета-лапахон; лапахол; колхіцини; бетулінову кислоту; камптотецин (у тому числі синтетичний аналог топотекан (ГІКАМТИН®), CPT-11 (іринотекан, КАМПТОСАР®), ацетилкамптотецин, скополектин і 9-амінокамптотецин); бріостатин; калістатин; CC-1065 (включаючи його синтетичні аналоги адоцелезин, карцелезин і біцелезин); подофілотоксин; подофілінову кислоту; теніпозид; криптофіцини (зокрема, криптофіцин 1 і криптофіцин 8); доластатин; дуокарміцин (у тому числі синтетичні аналоги, KW-2189 і CB1-TM1); елеутеробін; панкратистатин; саркодиктиїн; спонгістатин; азотисті іприти, такі як хлорамбуцил, хлорнафазин, холофосфамід, естрамустин, іфосфамід, мехлоретамін, мехлоретаміну оксиду гідрохлорид, мелфалан, новембіхін, фенестерин, преднімустин, трофосфамід, урацилу іприт; нітрозосечовини, такі як кармустин, хлорзотоцин, фотемустин, ломустин, німустин і ранімустин; бісфосфонати, такі як клодронат; антибіотики, такі як енедіїнові антибіотики (наприклад, каліхеаміцин, особливо каліхеаміцин гама1I і каліхеаміцин омегаІ1 (див., наприклад, Agnew, Chem Intl. Ed. Engl., 33:183-186 (1994)); і антрацикліни, такі як анаміцин, AD32, алкарубіцин, даунорубіцин, декспазоксан, DX-52-1, епірубіцин, GPX-100, ідарубіцин, KRN5500, меногарил, динеміцин, включаючи динеміцин A; еспераміцин; а також хромофор неокарциностатин і подібні до нього хромофори хромопротеїнових енедіїнових антибіотиків, аклациномізини, актиноміцин, аутраміцин, азасерин, блеоміцини, кактиноміцин, карабіцин, карміноміцин, карцинофілін, хромоміцини, дактиноміцин, деторубіцин, 6-діазо-5-оксо-L-норлейцин, доксорубіцин АДРІАМІЦИН® (включаючи, морфолінодоксорубіцин, ціаноморфолінодоксорубіцин, 2піролінодоксорубіцин, ліпосомальний доксорубіцин і дезоксидоксорубіцин), езорубіцин, марцеломіцин, мітоміцини, такі як мітоміцин C, мікофенолову кислоту, ногаламіцин, оливоміцини, пепломіцин, потфіроміцин, пуроміцин, квеламіцин, родорубіцин, стрептонігрин, стрептозоцин, туберцидин, убенімекс, зиностатин, зорубіцин; аналоги фолієвої кислоти, такі як деноптерин, птероптерин і триметрексат; аналоги пуринів, такі як флударабін, 6-меркаптопурин, тіаміприн, тіогуанін; аналоги піримідинів, такі як анцитабін, азацитидин, 6-азауридин, кармофур, цитарабін, дидезоксіуридин, доксифлуридин, еноцитабін, флоксуридин; андрогени, такі як калустерон, дромостанолону пропіонат, епітіостанол, мепітіостан, тестолактон; антиадреналові речовини, такі як аміноглутетимід, мітотан і трилостан; компенсатор нестачі фолієвої кислоти, такий як фолінова кислота; ацеглатон; протифолатні протипухлинні препарати, такі як АЛІМТА®, LY231514 пеметрексед, інгібітори дигідрофолатредуктази, такі як метотрексат, антиметаболіти, такі як 5-фторурацил (5-ФУ) і їх неактивні форми, такі як UFT, S-l і капецитабін, і інгібітори тимідилатсинтази й інгібітори гліцинамідрибонуклеотидформілтрансферази, такі як ралтитрексед (ТОМУДЕКС™, TDX); інгібітори дигідропіримідиндегідрогенази, такі як енілурацил; альдофосфаміду глікозид; амінолевулінову кислоту; амсакрин; бестрабуцил; бісантрен; едатраксат; дефофамін; демекольцин; діазиквон; ельфорнітин; еліптинію ацетат; епотилон; етоглуцид; нітрат галію; гідроксисечовину; лентинан; лонідаїнін; майтанзиноїди, такі як майтанзин і ансамітоцини; мітогуазон; мітоксантрон; мопіданмол; нітраерин; пентостатин; фенамет; пірарубіцин; лозоксантрон; 2-етилгідразид; прокарбазин; полісахаридний комплекс PSK® (JHS Natural Products, Eugene, OR); разоксан; ризоксин; сизофіран; спірогерманій; тенуазонову кислоту; триазиквон; 2,2',2"-трихлортриетиламін; трихотецени (особливо токсин T2, веракурин A, роридин A і ангвідин); уретан; віндезин (ЕЛДИЗИН®, ФІЛДЕЗИН®); дакарбазин; маномустин; мітобронітол; мітолактол; піпоброман; гацитозин; арабінозид ("Ara-C"); тіотепу; таксани, хлоранбуцил; гемцитабін (ГЕМЗАР®); 6-тіогуанін; меркаптопурин; платину; аналоги платини або аналоги на основі платини, такі як цисплатин, оксаліплатин і карбоплатин; вінбластин (ВЕЛБАН®); етопозид (VP-16); іфосфамід; мітоксантрон; вінкристин (ОНКОВІН®); алкалоїд барвінку; вінорелбін (НАВЕЛБІН®); новантрон; едатрексат; дауноміцин; аміноптерин; кселоду; ібандронат; інгібітор топоізомерази RFS 2000; дифторметилорнітин (DMFO); ретиноїди, такі як ретиноєва кислота; фармацевтично прийнятні солі, кислоти або похідні будьякого з зазначених вище; а також сполучення двох або більше із зазначених вище, такі як CHOP, скорочення для сумісної терапії з циклофосфаміду, доксорубіцину, вінкристину і преднізолону, і FOLFOX, скорочення для схеми лікування оксаліплатином (ЕЛОКСАТИН™), у сполученні з 5-ФУ і лейковорином. Також у це визначення включені протигормональні засоби, що діють як регулятори або інгібітори дії гормону на пухлини, такі як антиестрогенні препарати і селективні модулятори 15 UA 116095 C2 5 10 15 20 25 30 35 40 45 50 55 рецептора естрогену (SERM), у тому числі, наприклад, тамоксифен (включаючи тамоксифен НОЛВАДЕКС®), ралоксифен, дролоксифен, 4-гідрокситамоксифен, триоксифен, кеоксифен, LY117018, онапристон і тореміфен ФАРЕСТОН®; інгібітори ароматази і антиандрогенні препарати, такі як флутамід, нілутамід, бікалутамід, леупролід і гозерелін; а також троксацитабін (1,3-діоксолановий аналог нуклеозиду цитозин); антисмислові олігонуклеотиди, зокрема ті, котрі інгібують експресію генів шляху передачі сигналу, залучених в аномальну клітинну проліферацію, такі як, наприклад, ФКC-альфа, Raf, H-Ras, і рецептор епідермального фактора росту (EGF-R); вакцини, такі як генотерапевтичні вакцини, наприклад вакцина ALLOVECTIN®, вакцина LEUVECTIN® і вакцина VAXID®; PROLEUKIN® rIL-2; інгібітор топоізомерази 1 LURTOTECAN®; ABARELIX® rmRH; і фармацевтично прийнятні солі, кислоти або похідні будь-яких перерахованих вище речовин. "Таксан" являє собою хіміотерапію, яка інгібує мітоз і перешкоджає утворенню мікротрубочок. Приклади таксанів включають паклітаксел (ТАКСОЛ®; Bristol-Myers Squibb Oncology, Princeton, N.J.); склад паклітакселу з наночастинок, зв'язаних з альбуміном, без кремофору або nab-паклітаксел (АБРАКСАН™; American Pharmaceuticals Partners, Schaumberg, Illinois); і доцетаксел (ТАКСОТЕР®; Rhone-Poulenc Rorer, Antony, France). "Антрациклін" являє собою антибіотик, що виробляється грибом Streptococcus peucetius, приклади включають: даунорубіцин, доксорубіцин і епірубіцин, і т. д. "Хіміотерапія на основі антрацикліну" стосується хіміотерапевтичної схеми лікування, що складається з одного або декількох або включає один або декілька антрациклінів. Приклади включають 5-ФУ, епірубіцин і циклофосфамід (FEC); 5-ФУ, доксорубіцин і циклофосфамід (FAC); доксорубіцин і циклофосфамід (AC); епірубіцин і циклофосфамід (EC); і т. д. Для цілей даного документа "хіміотерапія на основі карбоплатину" стосується хіміотерапевтичної схеми лікування, яка складається з одного або декількох або включає один або декілька карбоплатинів. Прикладом є TCH (доцетаксел/ТАКСОЛ®, карбоплатин і трастузумаб/ГЕРЦЕПТИН®). "Інгібітор ароматази" інгібує фермент ароматазу, що регулює вироблення естрогену в надниркових залозах. Приклади інгібіторів ароматази включають: 4(5)-імідазоли, аміноглютетимід, MEGASE® мегестролу ацетат, АРОМАЗИН® екземестан, форместан, фадрозол, RIVISOR® ворозол, ФЕМАРА® летрозол і АРИМІДЕКС® анастрозол. В одному з варіантів здійснення інгібітор ароматази в даному документі являє собою летрозол або анастрозол. "Антиметаболітна хіміотерапія" являє собою використання речовини, що структурно подібна з метаболітом, але не може використовуватися організмом продуктивним чином. Багато які з антиметаболітних хіміотерапій заважають продукції нуклеїнових кислот, РНК і ДНК. Приклади антиметаболітних хіміотерапевтичних засобів включають гемцитабін (ГЕМЗАР®), 5-фторурацил (5-ФУ), капецитабін (КСЕЛОДА™), 6-меркаптопурин, метотрексат, 6-тіогуанін, пеметрексед, ралтитрексед, арабінозилцитозин ARA-C цитарабін (ЦИТОЗАР-U®), дакарбазин (DTIC-DOME®), азоцитозин, дезоксицитозин, піриміден, флударабін (FLUDARA®), кладрабін, 2-дезокси-Dглюкозу і т. д. Під злоякісною пухлиною, "стійкою до хіміотерапії", мається на увазі, що злоякісна пухлина у пацієнта прогресує, незважаючи на одержання хіміотерапевтичної схеми лікування (тобто пацієнт "не піддається хіміотерапії"), або пухлина прогресувала протягом 12 місяців (наприклад, протягом 6 місяців) після завершення хіміотерапевтичної схеми лікування. Термін "препарат платини" застосовують у даному документі для позначення хіміотерапії на основі платини, включаючи, без обмежень, цисплатин, карбоплатин і оксаліплатин. Термін "фторпіримідин" застосовують у даному документі для позначення антиметаболітної хіміотерапії, включаючи, без обмежень, капецитабін, флоксуридин і фторурацил (5-ФУ). "Фіксована" або "постійна" доза терапевтичного засобу в даному документі стосується дози, яку вводять пацієнту-людині безвідносно маси (WT) або площі поверхні тіла (BSA) пацієнта. 2 Фіксовану або постійну дозу, таким чином, дають не у вигляді дози мг/кг або дози мг/м , а скоріше у вигляді абсолютної кількості терапевтичного засобу. "Ударна" доза в даному документі, в основному, включає початкову дозу терапевтичного засобу, що вводиться пацієнту, з наступною однією або декількома підтримуючими дозами. В основному, вводять одиничну ударну дозу, але в даному документі розглядаються багаторазові ударні дози. Як правило, величина ударної дози (або доз), що вводиться, перевищує величину підтримуючої дози (або доз), що вводиться, і/або ударну дозу або дози вводять більш часто, ніж підтримуючу дозу або дози, для того, щоб досягти бажаної рівноважної концентрації 16 UA 116095 C2 5 10 15 20 25 30 35 40 45 50 55 терапевтичного засобу раніше, ніж вона може бути досягнута за допомогою підтримуючої дози або доз. "Підтримуюча" доза в даному документі стосується однієї або декількох доз терапевтичного засобу, що вводяться пацієнту протягом періоду лікування. Як правило, підтримуючі дози вводять через визначені інтервали в лікуванні, такі як приблизно кожен тиждень, приблизно кожні 2 тижні, приблизно кожні 3 тижні або приблизно кожні 4 тижні, переважно кожні 3 тижні. "Вливання" або "проводити вливання" стосується введення в організм через вену розчину, що містить лікарський засіб, з терапевтичними цілями. Як правило, цього досягають за допомогою пакета для внутрішньовенного (в/в) введення. "Пакет для внутрішньовенного введення" або "пакет для в/в введення" являє собою пакет, що може містити розчин, який можна вводити через вену пацієнта. В одному з варіантів здійснення розчин являє собою фізіологічний розчин (наприклад, приблизно 0,9 % або приблизно 0,45 % NaCl). Необов'язково, пакет для в/в введення вироблений з поліолефіну або полівінілхлориду. Під "спільним введенням" мають на увазі внутрішньовенне введення двох (або більше) лікарських засобів під час одного введення, а не послідовні вливання двох або більше лікарських засобів. Як правило, це включає сполучення двох (або більше) лікарських засобів в одному пакеті для в/в вливання перед їх спільним введенням. "Кардіотоксичність" стосується будь-якого токсичного побічного ефекту, що виник у результаті введення лікарського засобу або комбінації лікарських засобів. Кардіотоксичність можна оцінювати на основі будь-якої однієї або декількох ознак з: частоти виникнення симптоматичної лівошлуночкової систолічної дисфункції (СДЛШ) або застійної серцевої недостатності (ЗСН) або зниження фракції викиду лівого шлуночка (ФВЛШ). Фраза "без збільшення кардіотоксичності" для комбінації лікарських засобів, що включає пертузумаб, стосується частоти зустрічальності кардіотоксичності, яка дорівнює або менше спостережуваної у пацієнтів, яких лікували лікарськими засобами, іншими ніж пертузумаб, у комбінації лікарських засобів (наприклад, дорівнює або менше, ніж викликана введенням трастузумабу і хіміотерапії, наприклад доцетакселу). "Флакон" являє собою контейнер, придатний для зберігання рідкого або ліофілізованого препарату. В одному з варіантів здійснення флакон являє собою флакон для одноразового 3 застосування, наприклад флакон об'ємом 20 см для одноразового застосування з пробкою. "Вкладиш в упаковку" являє собою інструкцію, яка, за вимогою Управління по контролю за продуктами і лікарськими засобами (FDA) або іншого регулюючого органу, повинна бути поміщена усередину упаковки кожного рецептурного лікарського засобу. Інструкція, в основному, включає торгову назву для лікарського засобу, назву його дженеріка і його механізм дії; визначає показання, протипоказання, попередження, запобіжні заходи, несприятливі впливи і лікарські форми; і містить інструкції з рекомендованої дози, часу і шляху введення. Вираз "дані по безпеці" стосується даних, одержаних у контрольованому клінічному випробуванні, що показує поширеність і тяжкість побічних ефектів, щоб зорієнтувати користувача щодо безпеки лікарського засобу, у тому числі керівництво про те, як контролювати і попереджати побічні реакції лікарського засобу. Таблиця 3 і таблиця 4 у даному документі надають дані по безпеці для пертузумабу. Дані по безпеці включають будь-яку одну або декілька (наприклад, дві, три, чотири або більше) найбільш розповсюджених небажаних подій (AE) або небажаних реакцій (ADR) у таблицях 3 і 4. Наприклад, дані по безпеці містять інформацію про нейтропенію, фебрильну нейтропенію, діарею і/або кардіотоксичність, як описано в даному документі. Вираз "дані по ефективності" стосується даних, одержаних у контрольованому клінічному випробуванні, які показують, що лікарський засіб ефективно лікує захворювання, таке як злоякісна пухлина. Дані по ефективності для пертузумабу представлені в прикладах у даному документі. Дані по ефективності для пертузумабу відносно HER2-позитивного метастатичного або місцеворецидивуючого неоперабельного раку молочної залози знаходяться в таблиці 2, таблиці 5, на фігурі 8 і фігурі 10 у даному документі. Дані по безпеці включають будь-яку одну або декілька (наприклад, дві, три, чотири або більше) первинних кінцевих точок (виживаність без прогресування, PFS, по оцінці IRF) і/або вторинних кінцевих точок (загальна виживаність (OS); виживаність без прогресування (PFS) по оцінці дослідника; частота об'єктивних відповідей (ORR), у тому числі повної відповіді (CR), часткової відповіді (PR), стабільність захворювання (SD) і прогресування захворювання (PD) і/або тривалість відповіді) у таблиці 2, таблиці 5, на фігурі 8 і фігурі 10. Наприклад, дані по ефективності включають інформацію про виживаність без прогресування (PFS) і/або загальну виживаність (OS), як описано в даному документі. 17 UA 116095 C2 5 10 15 20 25 30 35 40 45 50 55 60 "Стабільна суміш" стосовно суміші двох або більше лікарських засобів, таких як пертузумаб і трастузумаб, означає, що кожний з лікарських засобів у суміші по суті зберігає свою хімічну і фізичну стабільність при оцінці за допомогою одного або декількох аналітичних аналізів. Типові аналітичні аналізи для цієї мети включають: колір, зовнішній вигляд і прозорість (CAC), аналіз концентрації і каламутності, аналіз частинок, ексклюзійну хроматографію (SEK), іонообмінну хроматографію (IEC), капілярний зонний електрофорез (CZE), капілярне ізоелектричне фокусування з детекцією у капілярі (iCIEF) і аналіз активності. В одному з варіантів здійснення суміш демонструє стабільність аж до 24 годин при 5 °C або 30 °C. Лікарський засіб, який вводять "одночасно" разом з одним або декількома іншими лікарськими засобами, вводять протягом того ж циклу лікування, у той же самий день лікування, що й один або декілька інших лікарських засобів, і, необов'язково, у той же самий час, що й один або декілька інших лікарських засобів. Наприклад, для терапії злоякісної пухлини, що проводиться кожні три тижні, лікарські засоби, що вводяться одночасно, вводять кожний в день 1 тритижневого циклу. II. Композиції антитіл і хіміотерапевтичних препаратів Антиген HER2, застосовуваний для виробництва антитіл, може являти собою, наприклад, розчинну форму позаклітинного домену рецептора HER2 або його частини, що містить бажаний епітоп. Альтернативно, для виробництва антитіл можна використовувати клітини, експресуючі HER2 на своїй поверхні (наприклад, клітини NIH-3T3, трансформовані для надекспресії HER2; або клітинна лінія карциноми, така як клітини SK-BR-3, див. Stancovski et al. PNAS (USA), 88:8691-8695 (1991)). Інші форми рецептора HER2, придатні для одержання антитіл, будуть очевидні для фахівців у даній галузі. Різні способи одержання моноклональних антитіл у даному документі відомі в даній галузі. Наприклад, моноклональні антитіла можна виробляти за допомогою гібридомного способу, вперше описаного Kohler et al. Nature, 256:495 (1975), за допомогою способів рекомбінантної ДНК (патент США № 4816567). Антитіла до HER2, застосовувані відповідно до даного винаходу, трастузумаб і пертузумаб, є комерційно доступними. (і) Гуманізовані антитіла Способи для гуманізування антитіл, що не належать людині, описані в даній галузі. Переважно, гуманізоване антитіло має один або декілька амінокислотних залишків, введених у нього з джерела, що не належить людині. Ці амінокислотні залишки, що не належать людині, часто позначають як "імпортні" залишки, які, як правило, узяті з "імпортного" варіабельного домену. Гуманізація по суті може бути виконана наступним способом Winter і колег (Jones et al. Nature, 321:522-525 (1986); Riechmann et al. Nature, 332:323-327 (1988); Verhoeyen et al. Science, 239:1534-1536 (1988)) шляхом заміщення послідовностями гіперваріабельної області відповідних послідовностей антитіла людини. Таким чином, такі "гуманізовані" антитіла являють собою химерні антитіла (патент США № 4816567), де по суті менше ніж інтактний варіабельний домен людини заміщений відповідною послідовністю видів, що не є людиною. На практиці, гуманізовані антитіла, як правило, являють собою антитіла людини, у яких деякі залишки гіперваріабельної області і, можливо, деякі залишки FR заміщені залишками з аналогічних ділянок антитіл гризуна. Вибір варіабельних доменів людини, як на легкому, так і на важкому ланцюзі, для використання у виробництві гуманізованих антитіл є дуже важливим для зниження антигенності. Згідно з так званим способом "максимальної відповідності", послідовність варіабельного домену антитіла гризунів відбирають у зіставленні з повною бібліотекою відомих послідовностей варіабельного домену людини. Послідовність людини, що є найбільш близькою до послідовності гризуна, приймається як каркасна область (FR) людини для гуманізованого антитіла (Sims et al. J. Immunol. 151:2296 (1993); Chothia et al. J. Mol. Biol, 196:901 (1987)). Інший спосіб використовує конкретну каркасну область, одержану з консенсусної послідовності всіх антитіл людини конкретної підгрупи легких або важких ланцюгів. Цей же каркас можна використовувати для декількох різних гуманізованих антитіл (Carter et al. Proc. Natl Acad. Sci. USA, 89:4285 (1992); Presta et al, J. Immunol. 151:2623 (1993)). Крім того, важливо, що антитіла повинні бути гуманізовані зі збереженням високої афінності до антигену й інших сприятливих біологічних властивостей. Для досягнення цієї мети, відповідно до переважного способу, гуманізовані антитіла одержують у процесі аналізу послідовностей і різних концептуальних гуманізованих продуктів з використанням тривимірних моделей батьківської і гуманізованої послідовностей. Тривимірні моделі імуноглобулінів широко доступні і добре відомі фахівцям у даній галузі. Доступні комп'ютерні програми, що ілюструють і відображають можливі тривимірні конформаційні структури вибраних кандидатних 18 UA 116095 C2 5 10 15 20 25 30 35 40 45 50 55 60 послідовностей імуноглобулінів. Вивчення цих зображень дозволяє аналізувати можливу роль залишків для функціонування кандидатної імуноглобулінової послідовності, тобто аналізувати залишки, що впливають на здатність кандидатного імуноглобуліну зв'язуватися з його антигеном. Таким чином, можна вибирати залишки FR з реципієнтної і імпортної послідовностей і комбінувати таким чином, щоб одержати бажану характеристику антитіла, таку як підвищена афінність до цільового антигену(ів). Як правило, залишки гіперваріабельної області безпосередньо і найбільш суттєво беруть участь у впливі на зв'язування антигену. Патент США № 6949245 описує одержання типових гуманізованих антитіл до HER2, що зв'язуються з HER2 і блокують лігандну активацію рецептора HER. Гуманізовані антитіла до HER2 конкретно включають трастузумаб (ГЕРЦЕПТИН®), як описано в таблиці 3 патенту США № 5821337, безпосередньо включеного в даний документ як посилання, і як визначено в даному документі; і гуманізовані антитіла2C4, такі як пертузумаб, як описано і визначено в даному документі. Гуманізовані антитіла в даному документі можуть, наприклад, містити залишки гіперваріабельної області, що не належить людині, які включені у варіабельний домен важкого ланцюга людини, і можуть додатково містити заміну в каркасній області (FR) у положенні, вибраному з групи, що складається з 69H, 71H і 73H, з використанням системи нумерації варіабельного домену, викладеної в Kabat et al. Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD (1991). В одному з варіантів здійснення гуманізоване антитіло містить заміни FR у двох або всіх положеннях 69H, 71H і 73H. Типове гуманізоване антитіло, що представляє інтерес, у даному документі містить залишки, що визначають комплементарність варіабельного домену важкого ланцюга GFTFTDYTMX (SEQ ID NO:17), де X є переважно D або S; DVNPNSGGSIYNQRFKG (SEQ ID NO:18) і/або NLGPSFYFDY (SEQ ID NO:19), необов'язково містить амінокислотні модифікації цих залишків CDR, наприклад модифікації, що по суті підтримують або поліпшують афінність антитіла. Наприклад, варіантні антитіла для застосування в способах за даним винаходом можуть містити приблизно від однієї до приблизно семи або приблизно п'яти замін амінокислот у вищевказаних послідовностях CDR варіабельного домену важкого ланцюга. Такі варіанти антитіл можна одержувати за допомогою дозрівання афінності, наприклад, як описано нижче. Гуманізоване антитіло може містити залишки, що визначають комплементарність 1 × 2 × 3 1 варіабельного домену легкого ланцюга KASQDVSIGVA (SEQ ID NO:20); SASYX , де X є 2 3 переважно R або L, X є переважно Y або E, і X є переважно T або S (SEQ ID NO:21); і/або QQYYIYPYT (SEQ ID NO:22), наприклад, на доповнення до цих залишків CDR варіабельного домену важкого ланцюга в попередньому абзаці. Такі гуманізовані антитіла необов'язково містять амінокислотні модифікації вищевказаних залишків CDR, наприклад модифікації, що по суті підтримують або поліпшують афінність антитіла. Наприклад, варіантні антитіла, що представляють інтерес, можуть містити приблизно від однієї до приблизно семи або приблизно п'яти замін амінокислот у вищевказаних послідовностях CDR варіабельного домену легкого ланцюга. Такі варіанти антитіл можна одержувати за допомогою дозрівання афінності, наприклад, як описано нижче. Дана заявка також стосується афінно зрілих антитіл, що зв'язуються з HER2. Батьківське антитіло може являти собою антитіло людини або гуманізоване антитіло, наприклад антитіло, що містить варіабельні послідовності легкого ланцюга і/або варіабельні послідовності важкого ланцюга з SEQ ID NO:7 і 8, відповідно (тобто, містить VL і/або VH пертузумабу). Афінно зрілий варіант пертузумабу переважно зв'язується з рецептором HER2 з афінністю, кращою ніж мишаче 2C4 або пертузумаб (наприклад, афінність поліпшена приблизно в два або приблизно в чотири рази, до приблизно в 100 разів або приблизно 1000 разів, наприклад, по вимірюваннях з використанням позаклітинного домену (ECD) HER2 (ELISA)). Приклади залишків CDR варіабельного домену важкого ланцюга для заміни включають H28, H30, H34, H35, H64, H96, H99 або комбінацію двох або більше (наприклад, два, три, чотири, п'ять, шість або сім) цих залишків. Приклади залишків CDR варіабельного домену легкого ланцюга, що можуть бути змінені, включають L28, L50, L53, L56, L91, L92, L93, L94, L96, L97 або комбінацію двох або більше (наприклад, від двох до трьох, чотирьох, п'яти або аж до приблизно десяти) цих залишків. Гуманізація мишачого антитіла 4D5 для створення його гуманізованих варіантів, у тому числі трастузумабу, описана в патентах США №№ 5821337, 6054297, 6407213, 6639055, 6719971 і 6800738, а також Carter et al. PNAS (USA), 89:4285-4289 (1992). HuMAb 4D5-8 (трастузумаб) зв'язувалося з антигеном HER2 у три рази сильніше, ніж мишаче антитіло 4D5, і мало вторинну імунну функцію (ADCC), що дає можливість для спрямованої цитотоксичної 19 UA 116095 C2 5 10 15 20 25 30 35 40 45 50 55 60 активності гуманізованого антитіла в присутності ефекторних клітин людини. HuMAb 4D5-8 містило залишки CDR варіабельного домену легкого ланцюга (VL), вставлені в консенсусну послідовність каркаса VLκ підгрупи I, і залишки CDR варіабельного домену важкого ланцюга (VH), вставлені в консенсусну послідовність каркаса VH підгрупи III. Антитіло додатково містило заміни в каркасній області (FR) у положеннях: 71, 73, 78 і 93 у VH (нумерація залишків FR по Kabat); і заміни в FR у положенні 66 у VL (нумерація залишків FR по Kabat). Трастузумаб містить Fc-область γ1 людини не-A алотипу. Розглядаються різні форми гуманізованого антитіла або афінно зрілого антитіла. Наприклад, гуманізоване антитіло або афінно зріле антитіло може являти собою фрагмент антитіла. Альтернативно, гуманізоване антитіло або афінно зріле антитіло може являти собою інтактне антитіло, таке як інтактне антитіло IgG1. (ii) Композиції пертузумабу В одному з варіантів здійснення композиції антитіла до HER2, композиція містить суміш основних видів антитіла пертузумаб і одного або декількох його варіантів. Переважний варіант здійснення в даному документі основних видів антитіла пертузумаб являє собою антитіло, що містить амінокислотні послідовності варіабельного легкого і важкого ланцюгів з SEQ ID NO:7 і 8 і найбільш переважно містить амінокислотну послідовність легкого ланцюга з SEQ ID NO:11 і амінокислотну послідовність важкого ланцюга з SEQ ID NO:12 (включаючи дезаміновані і/або окислені варіанти таких послідовностей). В одному з варіантів здійснення композиція містить суміш основних видів антитіла пертузумаб і амінокислотну послідовність його варіанта, що містить аміноконцевий лідерний подовжуючий сегмент. Переважно, аміноконцевий лідерний подовжуючий сегмент знаходиться на легкому ланцюзі варіантних антитіл (наприклад, на одному або двох легких ланцюгах варіантних антитіл). Основні види антитіл до HER2 або варіантних антитіл можуть являти собою повнорозмірне антитіло або фрагмент антитіла (наприклад, Fab із фрагментів F(ab')2), але переважно обидва є повнорозмірними антитілами. Варіантні антитіла в даному документі можуть містити аміноконцевий лідерний подовжуючий сегмент на будь-якому одному або декількох важких або легких ланцюгах. Переважно, аміноконцевий лідерний подовжуючий сегмент знаходиться на одному або двох легких ланцюгах антитіла. Амінокінцевий лідерний подовжуючий сегмент переважно містить або складається з VHS-. Присутність аміноконцевого лідерного подовжуючого сегмента у композиції можна виявляти за допомогою різних аналітичних способів, включаючи, як необмежувальні приклади, аналіз N-кінцевої послідовності, аналіз гетерогенності зарядів (наприклад, катіонообмінна хроматографія або капілярний зонний електрофорез), мас-спектрометрія і т. д. Кількість варіантних антитіл у композиції, в основному, знаходиться в діапазоні від кількості, що складає межу детекції будь-якого аналізу (переважно аналізу N-кінцевої послідовності), застосовуваного для детекції варіанта, до кількості, меншої ніж кількість основних видів антитіла. В основному, приблизно 20 % або менше (наприклад, приблизно від 1 % до приблизно 15 %, наприклад, від 5 % до приблизно 15 %) молекул антитіла в композиції містять амінокінцевий лідерний подовжуючий сегмент. Такі процентні кількості переважно визначають з використанням кількісного аналізу N-кінцевої послідовності або катіонообмінного аналізу (переважно з використанням високорозрізнювальної колонки зі слабкою катіонообмінною смолою, такої як катіонообмінна колонка PROPAC WCX-10™). Крім варіанта з амінокінцевим лідерним подовжуючим сегментом розглядаються додаткові зміни амінокислотної послідовності основних видів антитіл і/або варіанта, включаючи, як необмежувальні приклади, антитіло, що містить C-кінцевий залишок лізину на одному або обох важких ланцюгах, дезамінований варіант антитіла і т. д. Крім того, основні види антитіла або варіант можуть додатково містити зміни глікозилування, необмежувальні приклади яких включають антитіло, що містить олігосахаридну структуру G1 або G2, приєднану до Fc-області, антитіло, що містить вуглеводну групу, приєднану до легкого ланцюга (наприклад, одну або дві вуглеводних групи, такі як глюкоза або галактоза, приєднані до одного або двох легких ланцюгів антитіла, наприклад приєднані до одного або декількох залишків лізину), антитіло, що містить один або два неглікозиловані важкі ланцюги, або антитіло, що містить сіалований олігосахарид, приєднаний до одного або двох важких ланцюгів, і т. д. Композиція може бути одержана з генно-інженерної клітинної лінії, наприклад клітинної лінії китайського хом'ячка (CHO), експресуючої антитіло до HER2, або може бути одержана шляхом пептидного синтезу. Для подальшої інформації відносно прикладів композицій пертузумабу див. патенти США №№ 7560111 і 7879325, а також US 2009/0202546A1. (iii) Композиції трастузумабу 20 UA 116095 C2 5 10 15 20 25 30 35 40 45 50 55 60 Композиція трастузумабу, в основному, містить суміш основних видів антитіл (що містять послідовності легкого і важкого ланцюгів з SEQ ID NO:13 і 14, відповідно) і їх варіантні форми, зокрема кислі варіанти (включаючи дезаміновані варіанти). Переважно, кількість таких кислих варіантів у композиції складає приблизно менше ніж 25 % або приблизно менше ніж 20 %, або приблизно менше ніж 15 %. Див. патент США № 6339142. Див. також, Harriset al., J. Chromatography, B 752:233-245 (2001) відносно форм трастузумабу, розділюваних за допомогою катіонообмінної хроматографії, включаючи пік A (Asn30, дезамінований до Asp в обох легких ланцюгах); пік B (Asn55, дезамінований до ізоAsp в одному важкому ланцюзі); пік 1 (Asn30, дезамінований до Asp в одному легкому ланцюзі); пік 2 (Asn30, дезамінований до Asp в одному легкому ланцюзі, і Asp102, ізомеризований до ізоAsp в одному важкому ланцюзі); пік 3 (основна пікова форма або основні види антитіла); пік 4 (Asp102, ізомеризований до ізоAsp в одному важкому ланцюзі); і пік C (Asp102 сукцинімід (Asu) в одному важкому ланцюзі). Такі варіантні форми і композиції включені у винахід у даному документі. (iv) 5-ФУ і цисплатин Не існує однієї стандартної всесвітньо визнаної схеми хіміотерапевтичного лікування для розповсюдженого раку шлунка, але 5-фторурацил (5-ФУ) плюс цисплатин широко використовуються для цього показання. У дослідженнях фази II у пацієнтів без попередньої хіміотерапії, 5-ФУ + цисплатин дають частоту відповідей приблизно 40 % і медіану загальної виживаності 7-10,6 місяця (Lacave A.J., Baron F.J., Anton L.M. et al. Ann Oncol. 1991; 2:751-754; Rougier P., Ducreux M., Mahjoubi M. et al. Eur. J. Cancer. 1994; 30A:1263-1269; Vanhoefer U., Wagner T., Lutz M. et al. Eur. J. Cancer. 2001; 37 Suppl 6:abstract S27). (v) Капецитабін Капецитабін широко досліджувався у пацієнтів з розповсюдженим раком шлунка. Результати ефективності з фази II для монотерапії капецитабіном показують частоту відповідей 19 % і 26 % і загальну виживаність 8,1 і 10 місяців у дослідженнях Koizumi et al. 2003 (Koizumi W., Kurihara M., Sasai T. et al. Cancer. 1993; 72:658-62; Sakamoto J., Chin K., Kondo K. et al. AntiCancer Drugs. 2006; 17:2331-6). Існує ряд досліджень для капецитабіну в комбінації з платиною, що показують частоту відповідей у діапазоні від 28 % до 65 %, час до прогресування від 5,8 до 9 місяців і загальну виживаність від 10,1 до 12 місяців (Kang Y., Kang W.K., Shin D.B. et al. J Clin. Oncology, 2006; 24 Suppl 18:abstract LBA4018; Park Y., Kim B., Ryoo B. et al. Proc. Am. Soc. Clin. Oncol. 2006; 24 Suppl 18:abstract 4079; Kim T.W., Kang Y.K., Ahn J.H. et al. Ann Oncol. 2002; 13:1893-8; Park Y.H., Kim B.S., Ryoo B.Y. et al. Br. J. Cancer. 2006; 94:959-63). III. Відбір пацієнтів для терапії Для відбору пацієнтів для лікування відповідно до даного винаходу можна використовувати детекцію HER2. Деякі схвалені FDA комерційні аналізи здатні виявляти пацієнтів з HER2позитивною злоякісною пухлиною. Ці способи включають HERCEPTEST® (Dako) і PATHWAY® HER2® (імуногістохімічні (IHC) аналізи), і PathVysion і HER2 FISH pharmDx™ (FISH-аналізи). Користувачам варто звернути увагу на вкладиші в упаковки наборів для конкретного аналізу для одержання інформації про валідацію і проведення кожного аналізу. Наприклад, надекспресію HER2 можна аналізувати за допомогою IHC, наприклад, з використанням HERCEPTEST® (Dako). Занурені в парафін тканинні зрізи з пухлинних біоптатів можна піддавати аналізу IHC і узгоджувати з критеріями інтенсивності забарвлення білка HER2 наступним чином. Показник 0 - спостерігають відсутність забарвлення або спостерігають забарвлення мембран менше ніж у 10 % пухлинних клітин. Показник 1+ - слабке/ледь помітне забарвлення мембран виявлене більше ніж у 10 % пухлинних клітин. У клітин забарвлена тільки частина мембрани. Показник 2+ - спостерігають повне забарвлення мембран від слабкого до помірного більше ніж у 10 % пухлинних клітин. Показник 3+ - спостерігають повне забарвлення мембран від помірного до сильного більше ніж у 10 % пухлинних клітин. Пухлини з показниками для оцінки надекспресії HER2 0 або 1+ можуть бути охарактеризовані як HER2-негативні, у той час як пухлини з показниками 2+ або 3+ можуть бути охарактеризовані як HER2-позитивні. Пухлини, надекспресуючі HER2, можуть бути оцінені по імуногістохімічних показниках, які відповідають числу копій молекул HER2, що експресуються на клітину, і можуть бути визначені біохімічно: 0=0-10,000 копій/клітину, 1+ = щонайменше приблизно 200000 копій/клітину, 2+ = щонайменше приблизно 500000 копій/клітину, 21 UA 116095 C2 5 10 15 20 25 30 35 40 45 50 55 3+ = щонайменше приблизно 2000000 копій/клітину. Надекспресія HER2 на рівні 3+, що приводить до ліганднезалежної активації тирозинкінази (Hudziak et al. Proc. Natl. Acad. Sci. USA, 84:7159-7163 (1987)), зустрічається приблизно в 30 % раку молочної залози, і у цих пацієнтів безрецидивна виживаність і загальна виживаність знижені (Slamon et al. Science, 244:707-712 (1989); Slamon et al. Science, 235: 177-182 (1987)). Наявність надекспресії білка HER2 і ампліфікація гена сильно корелюють, таким чином, альтернативно, або додатково, для виявлення ампліфікації гена можна також використовувати аналіз гібридизації in situ (ISH), наприклад флуоресцентної гібридизації in situ (FISH), для відбору пацієнтів, придатних для лікування відповідно до даного винаходу. Аналізи FISH, такі як INFORM™ (продається в Ventana, Arizona) або PathVysion® (Vysis, Illinois), можна проводити на фіксованій формаліном, зануреній в парафін пухлинній тканині для визначення ступеня (при наявності) ампліфікації HER2 у пухлині. Найчастіше, HER2-позитивний статус підтверджують з використанням архівної, зануреної в парафін, пухлинної тканини за допомогою будь-якого з зазначених вище способів. Переважно, HER2-позитивні пацієнти, які мають показник IHC 2+ або 3+ або які є FISH- або ISH-позитивними, вибрані для лікування відповідно до даного винаходу. Див. також патент США № 7981418 і приклад 11 для альтернативних аналізів для відбору пацієнтів для терапії пертузумабом. IV. Фармацевтичні склади Терапевтичні склади антитіл до HER2, застосовуваних відповідно до даного винаходу, одержують для зберігання шляхом змішування антитіла з необхідним ступенем чистоти з довільними фармацевтично прийнятними носіями, ексципієнтами або стабілізаторами th (Remington's Phаrmaceutical Sciences 16 edition, Osol, A. Ed. (1980)), в основному у формі ліофілізованих складів або водних розчинів. Розглядаються також кристали антитіла (див. патентна заявка США 2002/0136719). Прийнятні носії, ексципієнти або стабілізатори не токсичні для реципієнтів у використовуваних дозуваннях і концентраціях і включають буфери, такі як фосфатний, цитратний і інші органічні кислоти; антиоксиданти, у тому числі аскорбінову кислоту і метіонін; консерванти (такі як октадецилдиметилбензилхлорид амонію; гексаметонію хлорид; хлорид бензалконію, хлорид бензетонію; фенол, бутил або бензиловий спирт; алкілпарабени, такі як метил- або пропілпарабен; катехол; резорцинол; циклогексанол; 3-пентанол і m-крезол); низькомолекулярні (менше ніж приблизно 10 залишків) поліпептиди; білки, такі як сироватковий альбумін, желатин або імуноглобуліни; гідрофільні полімери, такі як полівінілпіролідон; амінокислоти, такі як гліцин, глутамін, аспарагін, гістидин, аргінін або лізин; моносахариди, дисахариди і інші вуглеводи, включаючи глюкозу, манозу або декстрини; хелатуючі засоби, такі як ЕДТО; цукри, такі як сахароза, маніт, трегалоза або сорбіт; солеутворювальні протиіони, такі як натрій; комплексні сполуки з металами (наприклад, комплекси Zn-білок); і/або неіонні поверхнево-активні речовини, такі як TWEEN™, ПЛЮРОНІКИ™ або поліетиленгліколь (PEG). Ліофілізовані склади антитіл описані в WO 97/04801, прямо включеному в даний документ як посилання. Ліофілізовані склади антитіл описані в патентах США №№ 6267958, 6685940 і 6821515, прямо включених у даний документ як посилання. Переважно склад ГЕРЦЕПТИН® (трастузумаб) є стерильним ліофілізованим порошком від білого до блідо-жовтого кольору без консервантів, призначеним для внутрішньовенного (в/в) введення, що містить 440 мг трастузумабу, 400 мг α,α-трегалози дегідрату, 9,9 мг L-гістидин-HCl, 6,4 мг L-гістидину і 1,8 мг полісорбату 20, Фармакопея США. Відновлення 20 мл бактеріостатичною водою для ін'єкцій (BWFI), що містить 1,1 % бензилового спирту як консерванту, дає багатодозовий розчин, що містить 21 мг/мл трастузумабу, при pН приблизно 6,0. Більш докладно див. інструкцію-вкладиш для трастузумабу. Переважно склад пертузумабу для терапевтичного використання містить 30 мг/мл пертузумабу в 20 мМ гістидину ацетату, 120 мМ сахарози, 0,02 % полісорбату 20, при pН 6,0. Альтернативний склад пертузумабу містить 25 мг/мл пертузумабу, 10 мМ гістидин-HCl буфер, 240 мМ сахарози, 0,02 % полісорбату 20, pН 6,0. Склад плацебо, використаний у клінічних випробуваннях, описаних у прикладах, є еквівалентним пертузумабу без активного засобу. Склад в даному документі може також містити більше ніж одну активну сполуку в міру необхідності для конкретного призначення, яке лікують, переважно активні сполуки з додатковими діями, що не роблять небажаного впливу одна на одну. Різні лікарські засоби, які можна комбінувати з інгібітором димеризації HER, описані в розділі Спосіб нижче. Такі молекули переважно присутні в комбінації в кількостях, які ефективні для наміченого використання. 22 UA 116095 C2 5 10 15 20 25 30 35 40 45 50 55 60 Склади, які будуть використані для введення in vivo, повинні бути стерильними. Це легко досягається шляхом фільтрації через стерильні мембрани для фільтрації. V. Способи лікування У першому аспекті способу лікування в даному документі, пропонується спосіб для продовження виживаності без прогресування (PFS) у популяції пацієнтів з HER2-позитивним раком молочної залози на 6 місяців або більше, який включає введення пертузумабу, трастузумабу і хіміотерапії (наприклад, таксану, такого як доцетаксел) пацієнтам у популяції. Необов'язково, популяція пацієнтів включає придатне число пацієнтів (наприклад, 200 або більше, 300 або більше або 400 або більше пацієнтів), так щоб можна було оцінювати статистично значиме продовження PFS у популяції. Клінічні дані фази III CLEOPATRA у прикладі 3 нижче демонструють, що медіана PFS, обчислена дослідниками, складала 12,4 місяця з плацебо плюс трастузумаб плюс доцетаксел і 18,5 місяця з пертузумабом плюс трастузумаб плюс доцетаксел, таким чином, поліпшення по медіані PFS складало 6 місяців або більше (наприклад, 6,1 місяця) у порівнянні з пацієнтами, що не одержували пертузумаб (тобто пацієнтами, що одержували тільки трастузумаб і доцетаксел). У додатковому або альтернативному варіанті здійснення, пропонується спосіб одержання частоти об'єктивних відповідей 80 % або більше у популяції пацієнтів з HER2-позитивним раком молочної залози, який включає введення пертузумабу, трастузумабу і хіміотерапії (наприклад, таксану, такого як доцетаксел) пацієнтам у популяції. У спорідненому аспекті, пропонується спосіб сполучення двох антитіл до HER2 для лікування HER2-позитивного раку без підвищення кардіотоксичності в популяції пацієнтів з HER2-позитивною злоякісною пухлиною, який включає введення пертузумабу, трастузумабу і хіміотерапії пацієнтам у популяції. Необов'язково, популяція пацієнтів включає придатне число пацієнтів (наприклад, 200 або більше, 300 або більше або 400 або більше пацієнтів), так щоб можна було зробити статистично значиму оцінку відсутності кардіотоксичності, що виникла в результаті прийому комбінації. Клінічні дані з фази III CLEOPATRA у прикладі 3 нижче показують, що сполучення пертузумабу і трастузумабу не загострює кардіотоксичність. Кардіотоксичність можна оцінювати по частоті виникнення симптоматичної лівошлуночкової систолічної дисфункції (СДЛШ) або застійної серцевої недостатності (ЗСН) або по зниженню фракції викиду лівого шлуночка (ФВЛШ), наприклад, як описано в прикладі 3 нижче. Необов'язково, рак молочної залози являє собою метастатичний або місцеворецидивуючий, нерезектабельний рак молочної залози, або стадію IV захворювання de novo, визначені імуногістохімією (IHC) як 3+ і/або по співвідношенню ампліфікації ≥2,0 при флуоресцентній гібридизації in situ (FISH). Необов'язково, пацієнти в популяції не одержували попереднього лікування або в них був рецидив після ад'ювантної терапії, мають вихідну фракцію викиду лівого шлуночка (ФВЛШ) ≥50 % і/або мають показник загального стану відповідно до Східної об'єднаної онкологічної групи (ECOG PS) 0 або 1. В альтернативному варіанті здійснення, винахід стосується способу лікування ранньої стадії HER2-позитивного раку молочної залози, який включає введення пертузумабу, трастузумабу і хіміотерапії пацієнту з раком молочної залози, де хіміотерапія включає в себе хіміотерапію на основі антрацикліну або хіміотерапію на основі карбоплатину. Цей аспект винаходу підтримується клінічними даними в прикладі 5. В одному з варіантів здійснення хіміотерапія включає в себе хіміотерапію на основі антрацикліну, наприклад, що включає 5-ФУ, епірубіцин і циклофосфамід (FEC). В альтернативному варіанті здійснення хіміотерапія включає в себе хіміотерапію на основі карбоплатину, наприклад, що включає таксан (наприклад, доцетаксел), карбоплатин на доповнення до ГЕРЦЕПТИН®/трастузумабу (наприклад, схема лікування TCH). В одному з варіантів здійснення пертузумаб вводять одночасно з хіміотерапією на основі антрацикліну або з хіміотерапією на основі карбоплатину, наприклад, де пертузумаб, трастузумаб і хіміотерапію вводять у тритижневих циклах, де пертузумаб, трастузумаб і хіміотерапію вводяться в перший день кожного циклу. Дані в прикладах у даному документі демонструють, що введення пертузумабу не збільшує кардіотоксичність у порівнянні з лікуванням без пертузумабу (тобто в порівнянні з трастузумабом з хіміотерапією на основі антрацикліну (наприклад, FEC) і без пертузумабу; або в порівнянні з трастузумабом з хіміотерапією на основі карбоплатину і без пертузумабу (тобто TCH)). Розглянута в даному документі терапія ранньої стадії HER2-позитивного раку молочної залози включає неоад'ювантну й ад'ювантну терапію. Винахід у даному документі також стосується способу лікування HER2-позитивного раку у пацієнта, який включає спільне введення пацієнту суміші пертузумабу і трастузумабу з одного 23 UA 116095 C2 5 10 15 20 25 30 35 40 45 50 55 60 пакета для внутрішньовенного введення. Цей варіант здійснення застосовний для лікування будь-якого HER2-позитивного раку, у тому числі HER2-позитивного раку молочної залози, HER2-позитивного раку шлунка, HER2-позитивного метастатичного або місцеворецидивуючого, нерезектабельного раку молочної залози, або стадії IV захворювання de novo, ранньої стадії HER2-позитивного раку молочноїзалози і т. д. Необов'язково, цей спосіб додатково включає введення пацієнту хіміотерапії. У ще одному варіанті здійснення способи лікування за даним винаходом включають, по суті складаються або складаються з введення пертузумабу, трастузумабу і хіміотерапії, такої як препарати платини (наприклад, цисплатин) і/або фторпіримідин (наприклад, капецитабін і/або 5фторурацил (5-ФУ)), для лікування HER2-позитивного раку шлунка. Зокрема, способи лікування за даним винаходом включають, по суті складаються або складаються з введення пертузумабу, трастузумабу і хіміотерапії, такої як препарати платини і/або фторпіримідин, наприклад цисплатин і/або капецитабін, і/або 5-фторурацил (5-ФУ), пацієнту-людині з метастатичним раком шлунка, нерезектабельним місцеворозповсюдженим раком шлунка або рецидивуючим після операції раком шлунка. У певних варіантах здійснення рак шлунка не піддається лікарській терапії. В альтернативному варіанті здійснення пропонується спосіб лікування HER2-позитивного раку молочної залози у пацієнта, який включає введення пацієнту пертузумабу, трастузумабу і вінорелбіну. Рак молочної залози відповідно до цього варіанта здійснення являє собою необов'язково метастатичний або місцеворозповсюджений. Необов'язково, пацієнт раніше не одержував негормональної системної протипухлинної терапії за схемою лікування метастатичних форм. В іншому аспекті винахід стосується способу лікування HER2-позитивного раку молочної залози у пацієнта, який включає введення пацієнту пертузумабу, трастузумабу й інгібітору ароматази (наприклад, анастразолу або летрозолу). Відповідно до цього варіанта здійснення, рак молочної залози являє собою розповсюджений рак молочної залози, у тому числі рак молочної залози, позитивний по рецептору гормону, такому як рецептор естрогену (ERпозитивний) і/або рецептор прогестерону (PgR-позитивний). Необов'язково, пацієнт раніше не одержував негормональної системної протипухлинної терапії за схемою лікування метастатичних форм. Цей спосіб лікування необов'язково додатково включає введення пацієнту індукційної хіміотерапії (наприклад, що містить таксан). Терапія відповідно до даного винаходу продовжує виживаність без прогресування (PFS) і/або загальну виживаність (OS) пацієнта, якого лікують. Антитіла і хемовиди терапевтичного лікування вводять пацієнту-людині відповідно до відомих способів. Конкретні режими введення і сполуки описані в прикладах у даному документі. За одним з варіантів здійснення пертузумаб вводять у дозі, що створює рівноважну концентрацію Cmin≥20 мкг/мл у 90 % пацієнтів, які одержують пертузумаб і трастузумаб. За одним конкретним варіантом здійснення винаходу, вводять приблизно 840 мг пертузумабу (ударна доза), з наступною однією або декількома дозами антитіла приблизно 420 мг (підтримуюча доза(и)). Підтримуючі дози переважно вводять приблизно кожні 3 тижні, загалом щонайменше дві дози, до настання клінічного прогресування захворювання або нерегульованої токсичності, переважно аж до приблизно 6 або 7, або 8, або 9, або 10, або 11, або 12, або 13, або 14, або 15, або 16, або 17, або більше доз. Також розглядаються більш довгі періоди лікування, у тому числі більше циклів лікування. За іншим конкретним варіантом здійснення, пертузумаб вводять у дозі 840 мг для всіх циклів лікування. Трастузумаб, як правило, вводять у вигляді внутрішньовенної ударної дози приблизно 8 мг/кг, з наступним введенням доз 6 мг/кг у наступних циклах. Трастузумаб, як правило, вводять кожні 3 тижні до настання клінічного прогресування захворювання або нерегульованої токсичності, переважно приблизно до 17 або більше доз. У конкретному варіанті здійснення трастузумаб вводять у вигляді внутрішньовенної (в/в) інфузії в перший день кожного циклу лікування до прогресування захворювання по оцінці дослідника або нерегульованої токсичності, в ударній дозі 8 мг/кг для циклу 1 і дозі 6 мг/кг для наступних циклів. В іншому конкретному варіанті здійснення пертузумаб вводять у вигляді в/в інфузії в перший день кожного циклу, загалом протягом шести циклів або до прогресування захворювання по оцінці дослідника або нерегульованої токсичності, щоб не відбулося першим, або в ударній дозі 840 мг для циклу 1 і дозі 420 мг для наступних циклів, або в ударній дозі 840 мг для циклу 1 і дозі 840 мг для наступних циклів. 24 UA 116095 C2 2 5 10 15 20 25 30 35 40 Для лікування раку шлунка, вводять цисплатин 80 мг/м , як правило, у вигляді в/в інфузії в перший день кожного циклу, загалом щонайменше протягом шести циклів. 2 Для лікування раку шлунка, вводять капецитабін 1000 мг/м , як правило, перорально двічі на добу, з вечора першого дня до ранку дня 15 кожного циклу, загалом щонайменше протягом шести циклів. Введення капецитабіну може бути продовжене за розсудом лікуючого лікаря після ретельної оцінки співвідношення ризику і користі для конкретних пацієнтів. Режими дозування і схеми застосування для хіміотерапії, використовуваної для лікування HER2-позитивного раку молочної залози, описані в прикладах нижче, але інші режими дозування і схеми застосування відомі і розглядаються по винаходу в даному документі. VI. Промислові вироби Один з варіантів здійснення промислового виробу в даному документі включає пакет для внутрішньовенного (в/в) введення, що містить стабільну суміш пертузумабу і трастузумабу, придатну для введення пацієнту з раком. Необов'язково, суміш знаходиться у фізіологічному розчині, який, наприклад, містить приблизно 0,9 % NaCl або приблизно 0,45 % NaCl. Приклад пакета для в/в введення являє собою поліолефіновий або полівінілхлоридний пакет для введення, наприклад пакет для в/в введення об'ємом 250 мл. За одним з варіантів здійснення винаходу, суміш містить приблизно 420 мг або приблизно 840 мг пертузумабу і приблизно від 200 мг до приблизно 1000 мг трастузумабу (наприклад, приблизно від 400 мг до приблизно 900 мг трастузумабу). Необов'язково, суміш у пакеті для в/в введення є стабільною аж до 24 годин при 5 °C або 30 °C. Стабільність суміш можна оцінювати за допомогою одного або декількох аналізів, вибраних із групи, що складається з: кольору, зовнішнього вигляду і прозорості (CAC), аналізу концентрації і каламутності, аналізу частинок, ексклюзійної хроматографії (SEK), іонообмінної хроматографії (IEC), капілярного зонного електрофорезу (CZE), капілярного ізоелектричного фокусування з детекцією у капілярі (iCIEF) і тесту для оцінки активності. В альтернативному варіанті здійснення винахід стосується промислового виробу, який містить флакон з пертузумабом і вкладиш в упаковку, де вкладиш в упаковку надає дані по безпеці в таблиці 3 або таблиці 4 і/або дані по ефективності в таблиці 2, таблиці 5, на фігурі 8 або фігурі 10. Необов'язково, флакон являє собою флакон для одноразового застосування, що містить приблизно 420 мг пертузумабу. В одному з варіантів здійснення флакон постачається усередині картонної коробки. У спорідненому аспекті винахід стосується способу одержання промислового виробу, який містить спільно упаковані флакон з пертузумабом і вкладиш в упаковку, де вкладиш в упаковку надає дані по безпеці в таблиці 3 або таблиці 4 і/або дані по ефективності в таблиці 2, таблиці 5, на фігурі 8 або фігурі 10. У додатковому спорідненому аспекті винахід стосується способу забезпечення безпечного й ефективного застосування пертузумабу, який включає спільно упаковані флакон з пертузумабом і вкладиш в упаковку, де вкладиш в упаковку надає дані по безпеці в таблиці 3 або таблиці 4 і/або дані по ефективності в таблиці 2, таблиці 5, на фігурі 8 або фігурі 10. VII. Зберігання біологічних матеріалів Наступні гібридомні клітинні лінії були здані на зберігання в Американську колекцію типових культур (ATCC), 10801 University Boulevard, Manassas, VA 20110-2209, USA: Позначення антитіла 4D5 2C4 ATCC № ATCC CRL 10463 ATCC HB-12697 Дата депонування 24 травня 1990 року 8 квітня 1999 року 45 50 55 Більш докладний винахід проілюстрований наступними необмежувальними прикладами. Розкриття всіх посилань в описі прямо включене в даний документ як посилання. ПРИКЛАД 1 Фаза IIa клінічного дослідження для оцінки пертузумабу в комбінації з трастузумабом і хіміотерапією у пацієнтів з HER2-позитивним розповсюдженим раком шлунка Незважаючи на різке зниження у світі випадків захворюваності і зниження смертності в другій половині двадцятого століття, рак шлунка залишається другою основною причиною смертності від злоякісної пухлини у світі після раку легень (Parkin D. Oncogene, 23:6329-40 (2004)). Захворюваність на рак шлунка широко варіює залежно від географічного регіону (Kelley et al. J. Clin. Epidemiol. 56:1-9 (2003); Plummer et al. Epidemiology of gastric cancer. In: Butlet et al., editors. Mechanisms of Caucinogenesis: contribution of molecular epidemiology. Lyon: LARC Scientific публікації № 157, IARC (2004)). У Японії, Кореї, Китаї і певних країнах Центральної і 25 UA 116095 C2 5 10 15 20 25 30 35 40 45 50 55 60 Південної Америки частота захворюваності складає від 20 до 95 випадків на 100000 чоловік. Навпаки, у Сполучених Штатах Америки, Індії і Таїланді частота захворюваності складає від 4 до 8 випадків на 100000 чоловік. Частота захворюваності в Західній Європі варіює в діапазоні від 37 випадків на 100000 чоловік у деяких частинах Італії до 12 на 100000 чоловік у Франції. Частота захворюваності у жінок відповідає аналогічному географічному патерну, але приблизно на 50 % нижче, ніж у чоловіків. Існують чіткі епідеміологічні відмінності між злоякісною пухлиною, локалізованою в кардіальному відділі шлунка (шлунково-стравохідне з'єднання), і пухлиною, локалізованою в інших частинах шлунка. На злоякісну пухлину кардіального відділу припадає 39 % випадків раку шлунка у білих чоловіків у Сполучених Штатах Америки, але тільки 4 % раку шлунка у чоловіків у Японії. По неясних причинах зустрічальність злоякісних пухлин кардіального відділу шлунка і нижнього відділу стравоходу різко зросла в розвинених країнах з 1970-х років. На сьогоднішній день єдиною потенційно виліковуючою терапією для раку шлунка є хірургія. Коефіцієнти виживаності значно покращилися за останні роки в Японії в результаті більш раннього виявлення і кращих способів хірургії (Inoue et al. Postgrad. Med. J. 81:419-24 (2005)). Однак, у Західній Європі і Північній Америці, рак шлунка часто діагностують на пізніх стадіях, коли резекція більше неможлива. Таким чином, загальна п'ятирічна виживаність у цих популяціях не перевищує 25 % (Ajani, J. The Oncologist 10 Suppl. 3:49-58 (2005); Catalano et al. Clin Rev Oncol/Hematol. 54:209-41 (2005)). Незалежно від географічного регіону, пацієнти з нерезектабельним захворюванням через місцеворозповсюджене розростання або поширення метастазів мають несприятливий прогноз із загальною п'ятирічною виживаністю в діапазоні 5-15 % (Cunningham et al., Annals of Oncology 16 Suppl. 1:і22-3(2005)). Для пацієнтів з нерезектабельним захворюванням при постановці діагнозу і для пацієнтів з рецидивом захворювання після хірургії основним варіантом терапії є хіміотерапія (National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology. Gastric cancer. Version 1. National Comprehensive Cancer Network, (2006)). Було показано, що хіміотерапія, яку дають з паліативною метою перевершує найкращу підтримуючу терапію у пацієнтів з розповсюдженим раком шлунка (Wagner et al. J. Clin. Oncol. 24:2903-9 (2006)). Дослідження BO 18255 (ToGA) являло собою рандомізовану відкриту багатоцентрову міжнародну порівняльну фазу III клінічних досліджень, розроблену для оцінки ефективності і безпеки трастузумабу в комбінації з хіміотерапією в порівнянні з хіміотерапією по окремості як терапією першої лінії у пацієнтів з неоперабельною місцеворозповсюдженою або рецидивуючою і/або метастатичною HER2-позитивною аденокарциномою шлунка або шлунково-стравохідного з'єднання. Первинною задачею дослідження було порівняння загальної виживаності для пацієнтів, яких лікували трастузумабом у сполученні з фторпіримідином (5-ФУ або капецитабін) плюс цисплатин. Результати дослідження BO 18255 продемонстрували значну клінічну перевагу, якщо трастузумаб застосовували в комбінації з хіміотерапією у пацієнтів з раком шлунка. Загальна виживаність, первинна кінцева точка, була значно поліпшена в групі трастузумаб плюс хіміотерапія в порівнянні з групою тільки з хіміотерапією (p=0,0045, логарифмічний ранговий критерій; відношення ризиків, 0,74). Медіана часу виживання складала 13,8 місяця у групі трастузумаб плюс хіміотерапія і 11,1 місяця у групі тільки з хіміотерапією, і ризик смерті був знижений на 26 % для пацієнтів у групі трастузумаб плюс хіміотерапія. Всі інші вторинні кінцеві точки продемонстрували клінічну значимість з аналогічними відношенням ризиків і відношенням шансів (див., наприклад, Bang et al., Lancet, 28; 376(9742):687-97 (2010)). У результаті цього дослідження трастузумаб на даний час показаний, включаючи EU і Сполучені Штати, у комбінації з цисплатином плюс капецитабін або 5-ФУ для лікування пацієнтів з HER2-позитивною метастатичною шлунковою аденокарциномою або аденокарциномою шлунково-стравохідного з'єднання, які не одержували раніше лікування для метастатичного захворювання. На даний час не існує однієї стандартної всесвітньо визнаної схеми хіміотерапевтичного лікування для розповсюдженого раку шлунка. Незважаючи на успіх клінічного дослідження ToGA, існує велика потреба в забезпеченні новими й ефективними варіантами лікування для цього серйозного стану. Зокрема, існує необхідність нових терапевтичних підходів, які націлені на те, щоб уникнути захворюваності, пов'язаної з лікуванням, і/або на підвищення виживаності пацієнтів з раком шлунка. Таким чином, цей приклад являє собою рандомізоване багатоцентрове відкрите дослідження для оцінки двох різних доз пертузумабу у пацієнтів з HER2-позитивною аденокарциномою шлунка або шлунково-стравохідного з'єднання. Пацієнтів рандомізують у співвідношенні 1:1 по групах з різним лікуванням. Пацієнти в групі A одержують ударну дозу пертузумабу 840 мг для циклу 1 і дозу 420 мг для циклів 2-6, а пацієнти в групі B 26 UA 116095 C2 5 10 15 20 25 30 35 40 45 50 55 60 одержують 840 мг пертузумабу 840 мг для всіх шести циклів. Пацієнти в обох групах лікування одержували трастузумаб, цисплатин і капецитабін. Схема дослідження представлена на фіг. 6. Тривалість дослідження складає приблизно 24 місяця (4 місяці для набору пацієнтів і 20 місяців наступне спостереження, після того як набраний останній пацієнт). Дослідження закінчується, коли прогресування захворювання відбувається у всіх пацієнтів або всі пацієнти вибувають або переривають дослідження, щоб не відбулося раніше. Цільова популяція Клінічне дослідження включало приблизно 30 пацієнтів. Пацієнти повинні були відповідати наступним критеріям для включення в дослідження: - гістологічно підтверджена аденокарцинома шлунка або шлунково-стравохідного з'єднання з неоперабельним місцеворозповсюдженим або метастатичним захворюванням, що не піддається радикальному лікуванню; - пацієнти з розповсюдженим захворюванням, у яких присутній постопераційний рецидив (коли метою хірургії було лікування), також придатні для включення; - захворювання, яке можна виміряти відповідно до Критеріїв оцінки відповіді при солідних пухлинах (RECIST), v 1.1, оцінене з використанням способів візуалізації (комп'ютерної томографії (КТ) або магніто-резонансної томографії (МРТ)), або невимірюване захворювання, за яким можна спостерігати; - HER2-позитивна пухлина, визначена або як IHC 3+, або як IHC 2+, у комбінації з ISH+, по оцінці первинної або метастатичної пухлини центральною лабораторією; позитивність по ISH визначають як відношення ≥2,0 для числа копій гена HER2 до числа сигналів для CEP17; - обов'язковою є доступність фіксованої формаліном, зануреної в парафін (FFPE) тканини щонайменше з 5 мм інвазивної пухлини для централізованого підтвердження відбору HER2; - показник загального стану відповідно до Східної об'єднаної онкологічної групи (ECOG) 0 або 1; - вихідна фракція викиду лівого шлуночка (ФВЛШ) ≥55 % (виміряна за допомогою ехокардіограми (ЕхоКГ) або сканограми радіоізотопної вентрикулографії (MUGA)); - очікувана тривалість життя щонайменше 3 місяці; - чоловік або жінка; - вік ≥18 років. - підписана інформована згода; - для жінок дітородного віку й учасників-чоловіків з партнерами дітородного віку: угода про використання пацієнтом і/або партнером високоефективної негормональної форми контрацепції або двох ефективних форм негормональної контрацепції: - прийом контрацептивів має продовжуватися під час лікування в дослідженні і протягом щонайменше шести місяців після останньої дози досліджуваного лікарського препарату. Пацієнтів, що відповідають кожному з наступних критеріїв, виключають з набору в дослідження: - попередня хіміотерапія для розповсюдженого або метастатичного захворювання, за винятком того, що допускається попередня ад'ювантна або неоад'ювантна терапія, якщо пройшло щонайменше 6 місяців між завершенням ад'ювантної або неоад'ювантної терапії і включенням у дослідження; - ад'ювантна або неоад'ювантна терапія препаратами платини не допускається; - втрата фізичної цілісності верхнього відділу шлунково-кишкового тракту або синдром мальабсорбції (наприклад, пацієнтів з частковою або повною гастроектомією можна включати в дослідження, але не з еюностомою); - активна (значна або неконтрольована) шлунково-кишкова кровотеча; - залишкова відносна токсичність у результаті попередньої терапії (наприклад, неврологічна токсичність зі ступенем тяжкості ≥2 (NCI CTCAE)), за винятком алопеції; - інше злоякісне новоутворення протягом останніх п'яти років, за винятком карциноми шийки матки in situ або базальноклітинної карциноми; - будь-який з наступних лабораторних тестів, що не відповідають нормі, безпосередньо перед рандомізацією: загальний сироватковий білірубін у >1,5 разу вище верхньої межі норми (ULN) або для пацієнтів з відомим синдромом Жильбера загальний сироватковий білірубін >2ULN, для пацієнтів без метастазів у печінку і кістки: ААТ або АЛТ >2,5ULN, і лужна фосфатаза (ЛФ) >2,5ULN, для пацієнтів з метастазами в печінці і без метастазів у кістці: ААТ або АЛТ >5ULN, і ЛФ >2,5ULN, для пацієнтів з метастазами в печінці і метастазами в кістці: 27 UA 116095 C2 5 10 15 20 25 30 35 40 45 50 55 60 ААТ або АЛТ >5ULN, і ЛФ >10ULN, для пацієнтів з метастазами в кістці і без метастазів у печінці: ААТ або АЛТ >2,5ULN, і ЛФ >10ULN, альбумін
ДивитисяДодаткова інформація
Назва патенту англійськоюUses for and article of manufacture including her2 dimerization inhibitor pertuzumab
Автори англійськоюAlavattam, Sreedhara, Amler, Lukas C., de Toledo Pelizon, Christina H., Benyunes, Mark C., Clark, Emma L., Kwong Glover, Zephania W., Mitchell, Lada, Ratnayake, Jayantha, Ross, Graham A., Walker, Ru-Amir
Автори російськоюАлаваттам Сридхара, Амлер Лукас К., дэ Толедо Пэлизон Кристина Х., Бэньюнс Марк К., Кларк Эмма Л., Квонг Гловэр Зэфаниа В., Митчелл Лада, Ратнаяк Джаянтха, Росс Грэхам А., Уокер Ру-Амир
МПК / Мітки
МПК: A61K 31/282, A61K 39/395, A61K 31/343
Мітки: пертузумабу, стадії, карбоплатину, залози, застосування, хіміотерапії, нer2-позитивного, раку, основі, пацієнта, неоад'ювантного, молочної, лікування, ранньої, трастузумабу
Код посилання
<a href="https://ua.patents.su/105-116095-zastosuvannya-pertuzumabu-trastuzumabu-i-khimioterapi-na-osnovi-karboplatinu-dlya-neoadyuvantnogo-likuvannya-ner2-pozitivnogo-raku-molochno-zalozi-ranno-stadi-u-paciehnta.html" target="_blank" rel="follow" title="База патентів України">Застосування пертузумабу, трастузумабу і хіміотерапії на основі карбоплатину для неоад’ювантного лікування нer2-позитивного раку молочної залози ранньої стадії у пацієнта</a>
Попередній патент: Панелі з деревноволокнистої плити середньої щільності
Наступний патент: Спосіб приготування зшитої бітум/полімерної композиції зі зниженим виділенням сірководню h2s
Випадковий патент: Стільниковий електрофільтр