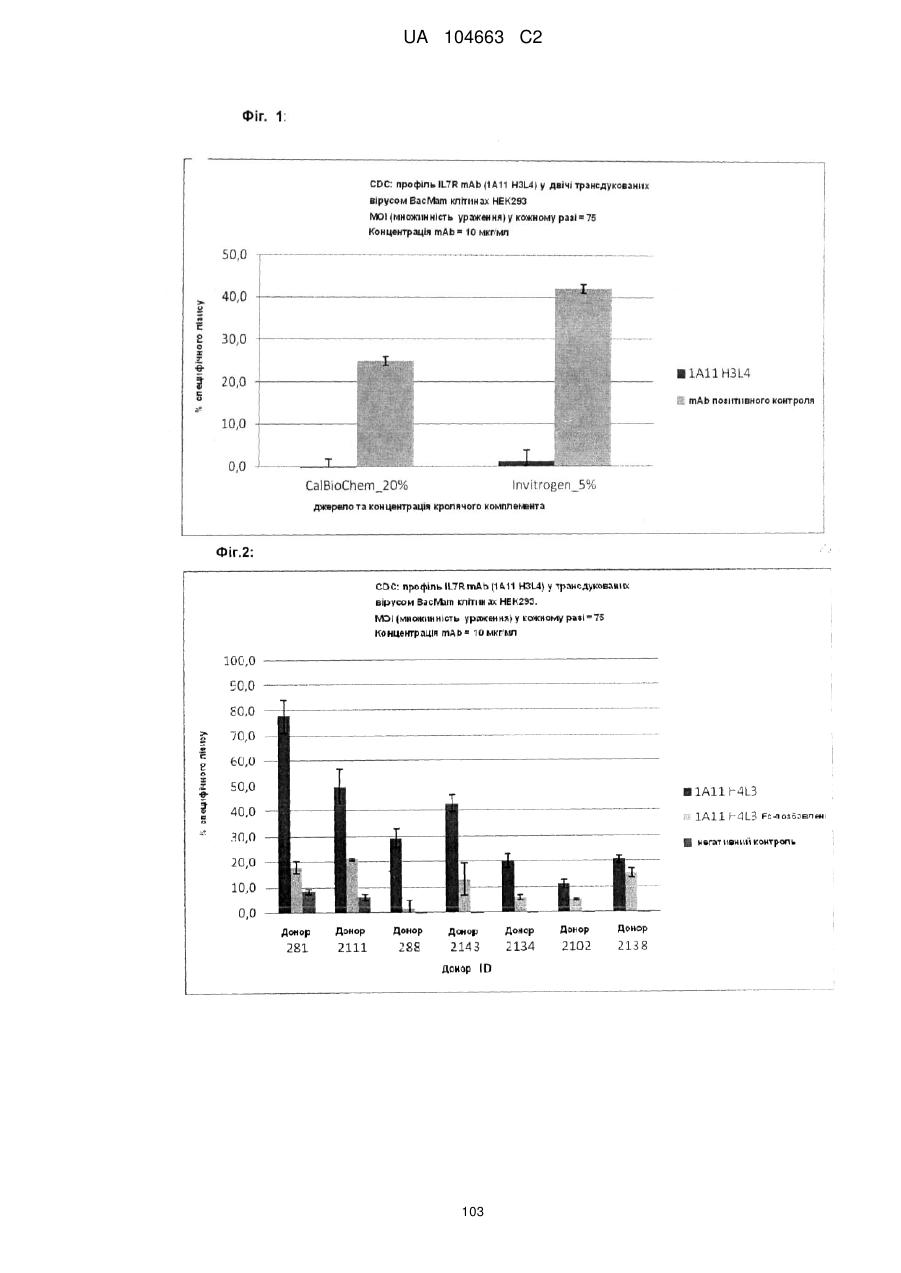
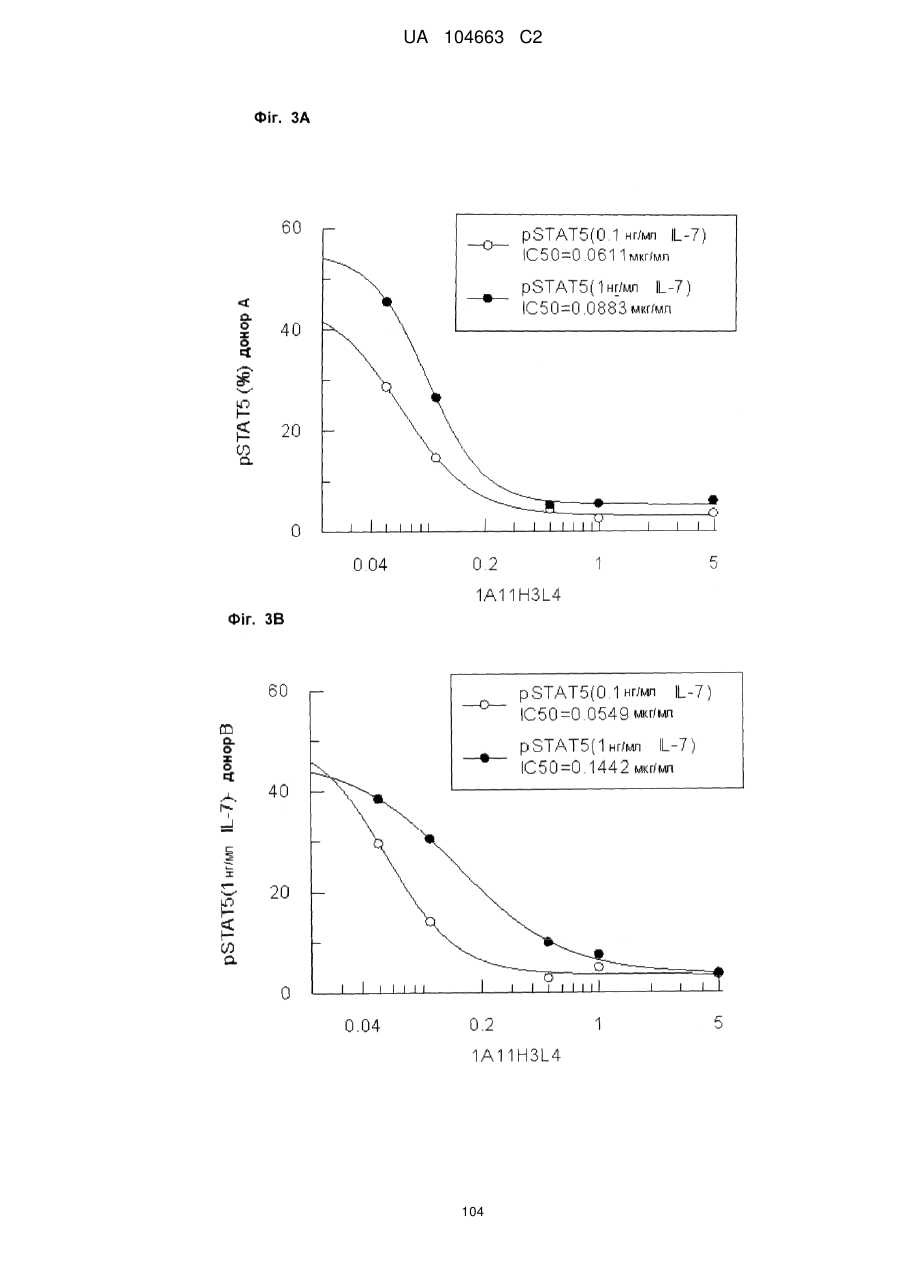
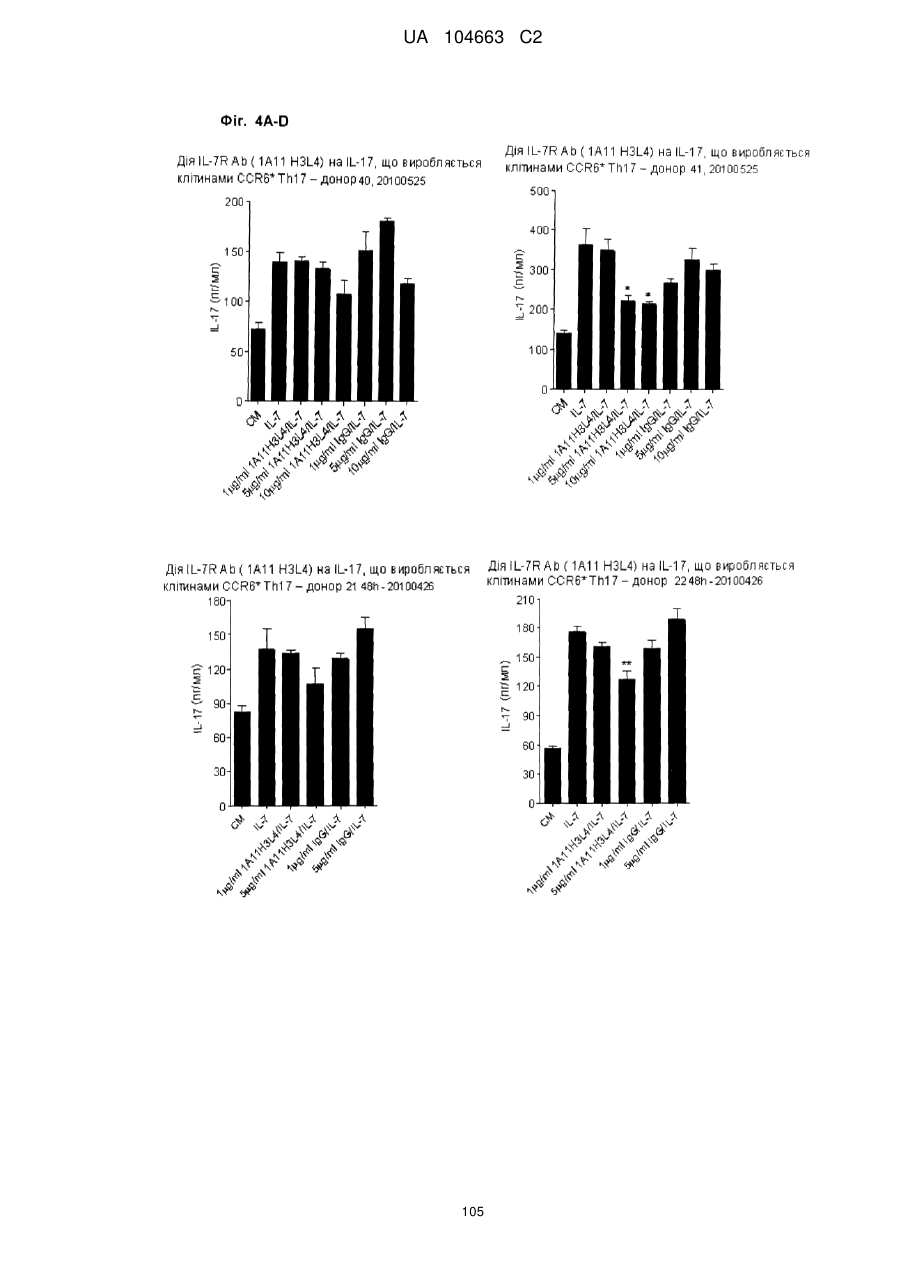
Антитіло, що зв’язує cd127
Номер патенту: 104663
Опубліковано: 25.02.2014
Автори: Вебб Томас Метт'ю, Сюе Юй, Тейлор Александер Г., Кірбі Ян
Формула / Реферат
1. Антитіло, що включає варіабельну ділянку важкого ланцюга послідовності SEQ ID NO:13, 121, 123, 125, 127, 129 або 131 та варіабельну ділянку легкого ланцюга послідовності SEQ ID NO:22.
2. Антитіло за пунктом 1, яке включає варіабельну ділянку важкого ланцюга послідовності SEQ ID NO:13.
3. Антитіло за пунктом 1 або 2, яке включає важкий ланцюг послідовності SEQ ID NO:114 або SEQ ID NO:118.
4. Антитіло за пунктом 1, яке включає варіабельну ділянку важкого ланцюга послідовності SEQ ID NO:121 або SEQ ID NO:123.
5. Антитіло за будь яким з пунктів 1-4, яке включає легкий ланцюг послідовності SEQ ID NO:115.
6. Антигензв'язуючий білок, що включає наступні ділянки, що визначають комплементарність:
(і) CDRH1 послідовності SEQ ID NO:2,
(іі) CDRH2 послідовності SEQ ID NO:3,
(ііі) CDRH3 послідовності SEQ ID NO:132, 133, 134, 135, 136 або 137,
(iv) CDRL1 послідовності SEQ ID NO:5,
(v) CDRL2 послідовності SEQ ID NO:6,
(vi) CDRL3 послідовності SEQ ID NO:7,
де вказаний антигензв'язуючий білок є здатним до зв'язування з CD127.
7. Фармацевтична композиція, що включає антитіло за будь-яким із пунктів 1-5 або антигензв'язуючий білок за пунктом 6 та фармацевтично прийнятний носій або наповнювач.
8. Антитіло за будь-яким з пунктів 1-5 або антигензв'язуючий білок за пунктом 6 для застосування у лікуванні суб'єкта, що страждає на аутоімунне або запальне захворювання.
Текст
Реферат: (56) Перелік документів, взятих до уваги експертизою: Maud Racape et al.. Interleukin 7 receptor alpha as a potential therapeutic target in transplantation. Archivum Immunologiae et Therapiae Experimentalis, August 2009, vol. 57, № 4, p. 253261. US 20090226442 A1, 10.09.2009. US 20100016556 A1, 21.01.2010. US 20030229208 A1, 11.12.2003. US 20050025763 A1, 03.02.2005. US 20100040616 A1, 18.02.2010. US 20020142359 A1, 03.10.2002. US 20080226621 A1, 18.09.2008. US 20070066798 A1, 22.03.2007. Chung Brile et al.. Prevention of graft-versus-host disease by anti IL-7R alpha, antibody. BLOOD. October 2007, vol. 110, № 8, p. 2803-2810. W0 2006052660 A2, 18.05.2006. Vudattu et al.. Increased Numbers of IL-7 Receptor Molecules on CD4+CD25-CD107a+ T-Cells in Patients with Autoimmune Diseases Affecting the Central Nervous System. Plos One. August 2009, vol. 4, p. 1-10. Maud Racape et al.. Interleukin 7 receptor alpha as a potential therapeutic target in transplantation. Archivum Immunologiae et Therapiae Experimentalis, August 2009, vol. 57, № 4, p. 253261. Chung Brile et al.. Prevention of graft-versushost disease by anti IL-7R alpha, antibody. BLOOD. October 2007, vol. 110, № 8, p. 2803-2810. W0 2006052660 A2, 18.05.2006. Vudattu et al.. Increased Numbers of IL-7 Receptor Molecules on CD4+CD25-CD107a+ T-Cells in Patients with Autoimmune Diseases Affecting the Central Nervous System. Plos One. August 2009, vol. 4, p. 1-10. Yamazaki Motomi et al.. Mucosal T cells expressing high levels of IL-7 receptor are potential targets for treatment of chronic colitis. The Journal of Immunology, August 2003, vol. 171, № 3, p. 15561563. UA 104663 C2 (12) UA 104663 C2 Винахід належить до антигензв'язуючого білка, що зв'язується з рецептором IL-7 (CD127) людини та може бути використаним у лікуванні захворювань або розладів у людей, особливо у лікуванні аутоімунних або запальних захворювань. UA 104663 C2 5 10 15 20 25 30 35 40 45 50 55 60 Заявлений винахід стосується антиген - зв'язуючих білків, зокрема, імуноглобулінів, що специфічно зв'язуються з α-ланцюгом рецептора IL-7 людини (CD127). Винахід також стосується способів лікування вказаними білками захворювань або розладів, фармацевтичних композицій, що містять вказані білки та способів їх виробництва. Інші аспекти заявленого винаходу будуть зрозумілі з нижченаведеного опису. Розсіяний склероз (MS) є хронічним, запальним, демієлінізуючим захворюванням, що уражає центральну нервову систему. Вважається, що при цьому захворюванні проникнення запальних імунних клітин бере участь у знищенні олігодендроцитів, клітин, що відповідають за утворення та підтримання жирового шару, відомого, як мієлінова оболонка. MS веде до розрідження або до повної втрати мієліну. При втраті мієліну, нейрони вже не можуть довго ефективно передавати їх електричні сигнали, що веде до численних неврологічних дисфункцій. У осіб з MS продукуються аутореактивні T - клітини, що приймають участь в утворенні вогнищ запалення вздовж мієлінової оболонки нервових волокон. Спинномозкова рідина пацієнтів з активним MS містить активовані Т - клітини, що проникають в тканини головного мозку та викликають характерні запальні ураження, знищуючі мієлін. В той час, як симптоми розсіяного склерозу та перебіг хвороби у різних осіб можуть змінюватися, існують три головні форми захворювання - зворотно - ремітуючий MS, вторинний прогресивний MS, та первинний прогресивний MS. На ранніх стадіях MS запальні напади відбуваються під час коротких проміжків різко підвищеної активності захворювання, після чого наступають періоди відновлення та ремісії. Впродовж періодів ремісії, місцеві набряки в ураженнях нервової системи розсмоктуються, імунні клітини стають менш активними або неактивними та клітини, що виробляють мієлін ремієлінірують аксони. Нервове сигналування покращується та порушення здоров'я, спричинене запаленням стає менш тяжким або повністю проходить. Цю фазу захворювання називають зворотно - ремітуючим MS (RRMS). Однак, не всі ураження повністю загоюються. Деякі залишаються у вигляді "хронічних" уражень, що звичайно мають демієлінізований центральний регіон, що втратив імунні клітини. З часом, клітини у центрі такого ураження зазвичай гинуть, хоча часто запалення в них триває. Мозок може адаптуватися до втрати декількох нейронів та перманентні порушення здоров'я можуть не відбуватися протягом багатьох років. Проте, більш, ніж 50 % пацієнтів з MS зрештою вступають в стадію прогресуючого погіршення, що має назву вторинного прогресивного MS (SPMS). На цій стадії, захворювання не довго добре реагує на ліки, що змінюють перебіг хвороби та порушення здоров'я неухильно погіршуються. Початкове знищення нейронів у природному перебігу MS наводить на думку, що прогресивні погіршення SPMS можуть бути результатом накопиченої втрати нейронів, що зрештою пригнічує компенсаторні можливості мозку. Первинний прогресивний MS є типом розсіяного склерозу без рецидивів, але, через декілька років виникає поступова втрата фізичних та когнітивних функцій. Метою лікування у пацієнтів зі зворотно ремітуючим розсіяним склерозом є скорочення частоти та тяжкості рецидивів (та тим самим запобігання загострень), а також запобігання або затримування початку прогресивної фази захворювання. Раніше, для досягнення цієї мети, головним чином застосовували імуномодуляторні та імуносупресивні ліки, але вони не отримали широкого розповсюдження завдяки їх обмеженій ефективності та значній токсичності. Наприклад, великі рандомізовані контрольовані дослідження успішно проводили з інтерфероном бета - 1a, інтерфероном бета 1b, та глатирамер - ацетатом. Змінені автоімунні T - клітинні відповіді та дисфункція регуляторної мережі імунної системи відіграють важливу роль у таких автоімунних патологіях людини, як MS та ревматоїдний артрит (Kuchroo et al., (2002) Annu. Rev. Immunol. 20:101-123; Sospedra та Martin (2005) Annu. Rev. Immunol. 23: 683-747; Toh та Miossec (2007) Curr. Opin. Rheumatol. 19:284-288). Хоча етіологія та патогенез MS залишаються невідомими, це захворювання звичайно вважають автоімунною патологією, де, як гадають, важливу роль відіграють аутореактивні T клітини з патогенним потенціалом, як - то клітини TH1 та TH17. Існує доказ того, що ці ефекторні T - клітини активуються in vivo протягом процесу захворювання та пов'язані з запаленням центральної нервової системи (CNS) Також є доказ того, що ці T - клітини опосередкують знищення клітин, що експресують мієлін у вогнищах EAE та MS протягом активної фази захворювання. З іншого боку, у пацієнтів з MS спостерігається нестача регуляторних T - клітин (Treg), що звичайно тримають патогенні T H1 та TH17 клітини під контролем, що веде до подальшого нахилу імунної системи до прозапального стану. Нещодавно, три окремі групи дослідників повідомили про результати широких одиничних поліморфізмів геному (SNP) при скануванні загалом 17,947 донорів з MS або без нього. Після -7 сканування 334,923 SNP, був знайдений дуже значний зв'язок (загальний P=2.9 × 10 ) несинонімічного кодуючого SNP у рецепторному альфа - ланцюзі IL-7 людини (IL-7Rα) зі 1 UA 104663 C2 5 10 15 20 25 30 35 40 45 50 55 60 сприйнятливістю до MS. SNP відповідає зміненню з T на C у 6 екзоні CD127 (що також відомий, як IL-7Rα). Це змінення підвищують шанс пропуску цього екзону під час сплайсингу РНК, що веде до отримання розчинної форми CD127. Крім того, рівні експресії РНК CD127 та IL-7 у цереброспінальній рідини (CSF) пацієнтів з MS є значно вищими порівняно до CSF у пацієнтів з іншими неврологічними розладами. Відомо, що IL-7 та IL-7 рецептори (IL-7R) відіграють важливу роль у розвитку та у гомеостазі T - клітин та B - клітин в основному у середовищі тимуса. Дійсно, стромальні клітини тимуса, тимуса плоду та кісткового мозку є місцями продукування IL-7. Рецептор IL-7 складається з двох субодиниць, CD127 та загального ланцюга (гамма - ланцюг або γc) що є загальним для рецепторів IL-2, IL-4, IL-9, IL-15, та IL-21. CD127, також відомий, як альфа - рецептор IL-7 (IL-7Rα) та p90 IL-7R. CD127 людини (інвентарний номер Swiss Prot P16871) дорівнює загалом 459 амінокислот (з сигнальною послідовністю у 20 амінокислот). Він складається з зовнішньоклітинного регіону у 219 амінокислот, трансмембранного регіону у 25 амінокислот та внутрішньоклітинного регіону у 195 амінокислот. Нумерування залишків у CD127, як тут застосовано, (наприклад, для опису епітопів антитіл) наведено на основі повнорозмірного білку, в тому числі залишків сигнальної послідовності. CD127 може існувати у чотирьох ізоформах, де ізоформа H20 (інвентарний номер Swiss Prot P16871-1) має наступну амінокислотну послідовність (в тому числі сигнальна послідовність): MTILGTTFGM VFSLLQVVSG ESGYAQNGDL EDAELDDYSF SCYSQLEVNG SQHSLTCAFE DPDVNTTNLE FEICGALVEV KCLNFRKLQE IYFIETKKFL LIGKSNICVK VGEKSLTCKK IDLTTIVKPE APFDLSVIYR EGANDFVVTF NTSHLQKKYV KVLMHDVAYR QEKDENKWTH VNLSSTKLTL LQRKLQPAAM YEIKVRSIPD HYFKGFWSEW SPSYYFRTPE INNSSGEMDP ILLTISILSF FSVALLVILA CVLWKKRIKP IVWPSLPDHK KTLEHLCKKP RKNLNVSFNP ESFLDCQIHR VDDIQARDEV EGFLQDTFPQ QLEESEKQRL GGDVQSPNCP SEDVVVTPES FGRDSSLTCL AGNVSACDAP ILSSSRSLDC RESGKNGPHV YQDLLLSLGT TNSTLPPPFS LQSGILTLNP VAQGQPILTS LGSNQEEAYV TMSSFYQNQ (SEQ ID NO: 1) CD127 також знайдений у рецепторі лімфопоетину зі строми тимусу (TSLP). Рецептор TSLP є гетеродимером CD127 та подібного до цитокінового рецептора фактору 2 (CRLF2). Зв'язування IL-7 до IL-7R активує численні шляхи сигналування, в тому числі, активування JAK - кіназ 1 та 3 веде до фосфорилування та активування Stat5. Цей шлях є важливим для виживання T - клітинних попередників, що розвиваються у тимусі, тому що активування Stat5 потрібно у індукуванні анти - апоптичного білку Bcl-2 та у запобіганні входження до мітохондрій про - апоптичного білку Bax. Іншим IL-7R - опосередкованим шляхом є активування PI3 кінази, що веде до фосфорилування про - апоптичного білку Bad та до його утримуванню у цитоплазмі. CD127 експресується у периферичних клітинах у стані спокою та у Т - клітинах пам'яті. Механізм регуляції IL-7 T - клітинного виживання та гомеостазу та джерело IL-7 на периферії досі не зовсім зрозумілі. Крім того, його потенційна роль у диференціації та функції патогенних T клітин у автоімунних захворюваннях слабо досліджена та більшим чином невідома. Існують декілька повідомлень, що наводять на думку про те, що IL-7 може приймати участь у патогенезі автоімунних захворювань. Останнім часом, Liu та колеги (Liu et al, (2010) Nature Medicine 16:191-197) описали роль IL-7 у виживанні та поширенні TH17. Мишачі анти - CD127 антитіла (в тому числі, анти - CD127 антитіла 1A11 та 6A3) та їх роль у лікуванні MS та інших автоімунних захворювань описані у заявці PCT application PCT/US2009/053136. Бажаним є виявлення та виділення додаткових моноклональних антитіл, що зв'язуються з та/або інгібують біологічну дію CD127 людини. Подібні антитіла можуть бути терапевтично корисними у лікуванні MS та інших запальних та автоімунних захворювань та розладів, особливо, до яких залучені патогенні клітини TH17. Винахід стосується антиген - зв'язуючих білків, що специфічно зв'язуються з CD127. Білки, що зв'язують антиген можна застосувати у терапії, зокрема, у лікуванні або запобіганні захворювань, до яких залучені патогенні клітини TH17. Антиген - зв'язуючі білки можуть зв'язуватися з CD127 та інгібувати, наприклад, нейтралізувати, біологічну функцію CD127. У першому аспекті, винахід стосується антиген - зв'язуючих білків, як - то антитіл, що містять 1-6 наступних регіонів, що визначають компліментарність або їх варіантів: 1. CDRH1, як наведено у SEQ ID NO:2 2. CDRH2, як наведено у SEQ ID NO:3 3. CDRH3, як наведено у SEQ ID NO:4 або у будь - якій з SEQ ID NO:132-SEQ ID NO:137, 4. CDRL1, як наведено у SEQ ID NO:5 5. CDRL2, як наведено у SEQ ID NO:6 2 UA 104663 C2 5 10 15 20 25 30 35 40 45 50 55 60 6. CDRL3, як наведено у SEQ ID NO:7. У іншому аспекті, винахід стосується антиген - зв'язуючих білків, як - то антитіл, що містять 1-6 наступних регіонів, що визначають компліментарність або їх варіантів: 1. CDRH1, як наведено у SEQ ID NO:39 2. CDRH2, як наведено у SEQ ID NO:40 3. CDRH3, як наведено у SEQ ID NO:41 4. CDRL1, як наведено у SEQ ID NO:42 5. CDRL2, як наведено у SEQ ID NO:43 6. CDRL3, як наведено у SEQ ID NO:44. У одному втіленні, антиген - зв'язуючий білок є антитілом, вибірково химерним, гуманізованим або антитілом людини. Це антитіло може містити один або декілька CDR (SEQ ID NO:2-7 або 39-44 з донорного антитіла) у каркасній основі акцепторного антитіла. Каркас акцепторного антитіла може бути антитілом людини. У одному аспекті, винахід стосується гуманізованого антитіла, що містить змінний регіон важкого ланцюга, що містить один або декілька з наступних регіонів, що визначають компліментарність: 1. CDRH1, як наведено у SEQ ID NO:2 2. CDRH2, як наведено у SEQ ID NO:3 3. CDRH3, як наведено у SEQ ID NO:4 або у будь - якій з SEQ ID NO:132-SEQ ID NO:137, де антитіло додатково містить щонайменш один з: лізинового залишку у позиції 66, фенілаланінового, метіонінового, ізолейцинового, лейцинового або валінового залишку у позиції 69, та валінового, аргінінового, аланінового або лейцинового залишку у позиції 71 змінного регіону важкого ланцюга (нумерування відповідно Kabat). У одному втіленні, гуманізоване антитіло містить лейцин у позиції 69. У одному втіленні, гуманізоване антитіло містить валін у позиції 71. У одному втіленні, гуманізоване антитіло містить лейцин у позиції 69 та валін у позиції 71. У одному втіленні, гуманізоване антитіло містить лізин у позиції 66, лейцин у позиції 69 та валін у позиції 71. За виключенням вищезгаданих точкових мутацій, змінний регіон важкого ланцюга может мати каркасну послідовність змінного регіону ембріональної лінії людини. Наприклад, у одному втіленні, змінний регіон важкого ланцюга походить від каркасної послідовності людини IGHV1_2 (SEQ ID NO:116). Отже, у іншому аспекті, винахід стосується антитіла, що містить один або декілька наступних регіонів, що визначають компліментарність: 1. CDRH1, як наведено у SEQ ID NO:2 2. CDRH2, як наведено у SEQ ID NO:3 3. CDRH3, як наведено у SEQ ID NO:4 або у будь - якій з SEQ ID NO:132 SEQ ID NO:137, У каркасному регіоні VH, якщо він походить від каркасного регіону VH ембріональної лінії людини, він містить принаймні один з: лізинового залишку у позиції 66, фенілаланінового, метіонінового, ізолейцинового, лейцинового або валінового залишку у позиції 69, та валінового, аргінінового, аланінового або лейцинового залишку позиції 71 змінного регіону важкого ланцюга (нумерування відповідно Kabat). У одному втіленні, каркасний регіон V H людини є каркасним регіоном людини IGHV1_2 (SEQ ID NO:116). Антитіло винаходу може містити змінний регіон важкого ланцюга, що містить CDRH1 (SEQ ID NO:2) та CDRH3 (SEQ ID NO:4); CDRH2 (SEQ ID NO:3) та CDRH3 (SEQ ID NO:4); CDRH1 (SEQ ID NO:2) та CDRH2 (SEQ ID NO:3); або CDRH1 (SEQ ID NO:2), CDRH2 (SEQ ID NO:3) та CDRH3 (SEQ ID NO:4). антитіло може містити змінний регіон важкого ланцюга будь - якої з послідовностей SEQ ID NOs:10-17 (1A11.H0 VH-1A11.H7 VH). У одному втіленні, гуманізоване антитіло містить змінний регіон важкого ланцюга SEQ ID NO:13 (1A11.H3 VH). У будь - якому з цих втілень, CDRH3 SEQ ID NO:4 може бути заміщений на CDRH3, що наведений у будь - якій з послідовностей SEQ ID NO:132-SEQ ID NO:137. Альтернативно, змінний регіон важкого ланцюга SEQ ID NO:13 може містити одне або декілька заміщень, вибраних від N98D, N98E, F100bE, F100bH, F100bI та F100bV (Kabat). У іншому втіленні, змінний домен важкого ланцюга має амінокислотну послідовність SEQ ID NOs:121,123,125,127,129, або 131.У одному втіленні, змінний регіон важкого ланцюга знаходиться в парі зі змінним регіоном легкого ланцюга SEQ ID NO:16. Винахід також стосується антитіла, що містить змінний регіон легкого ланцюга, що містить один або декілька наступних регіонів, що визначають компліментарність: 1. CDRL1, як наведено у SEQ ID NO:5 2. CDRL2, як наведено у SEQ ID NO:6 3. CDRL3, як наведено у SEQ ID NO:7 3 UA 104663 C2 5 10 15 20 25 30 35 40 45 50 55 60 де антитіло додатково містить щонайменш один з: лізинового залишку у позиції 45, пролінового залишку у позиції 46, триптофанового залишку у позиції 47, валінового залишку у позиції 58, валінового залишку у позиції 60, серинового залишку у позиції 70, та тирозинового або фенілаланінового залишку у позиції 71 змінного регіону легкого ланцюга (нумерування відповідно Kabat). У одному втіленні, антитіло містить проліновий залишок у позиції 46. У одному втіленні, антитіло містить тирозиновий залишок у позиції 71. У одному втіленні, антитіло містить проліновий залишок у позиції 46 та тирозиновий залишок у позиції 71. Антитіло може містити змінний регіон легкого ланцюга, що містить CDRL1 (SEQ ID NO:5) та CDRL3 (SEQ ID NO:7); CDRL2 (SEQ ID NO:6) та CDRL3 (SEQ ID NO:7); CDRL1 (SEQ ID NO:5) та CDRL2 (SEQ ID NO:6); або CDRL1 (SEQ ID NO:5), CDRL2 (SEQ ID NO:6) та CDRL3 (SEQ ID NO:7). антитіло може містити змінний регіон легкого ланцюга будь - якої з послідовностей SEQ ID NOs:18-27 (1A11.L0 Vκ - 1A11.L9 Vκ). У одному втіленні, антитіло містить змінний регіон легкого ланцюга SEQ ID NO:22 (1A11.L4 Vκ). У іншому аспекті, винахід стосується антитіла, що містить: змінний регіон важкого ланцюга, що містить один, два або три з наступних регіонів, що визначають компліментарність: 1. СDRH1, як наведено у SEQ ID NO:2 2. CDRH2, як наведено у SEQ ID NO:3 3. CDRH3, як наведено у SEQ ID NO:4 або у будь - якій з SEQ ID NO:132-SEQ ID NO:137, де антитіло додатково містить щонайменш один з: лізинового залишку у позиції 66, фенілаланінового, метіонінового, ізолейцинового, лейцинового або валінового залишку у позиції 69, та валіну, аргініну, аланіну або лейцину у позиції 71 змінного регіону важкого ланцюга (нумерування відповідно Kabat); та змінний регіон легкого ланцюга, що містить один, два або три з наступних регіонів, що визначають компліментарність: 1. CDRL1, як наведено у SEQ ID NO:5 2. CDRL2, як наведено у SEQ ID NO:6 3. CDRL3, як наведено у SEQ ID NO:7 де антитіло додатково містить щонайменш один з: лізинового залишку у позиції 45, пролінового залишку у позиції 46, триптофанового залишку у позиції 47, валінового залишку у позиції 58, валінового залишку у позиції 60, серинового залишку у позиції 70, та тирозинового або фенілаланінового залишку у позиції 71 змінного регіону легкого ланцюга (нумерування відповідно Kabat). Антитіло може містити будь - яку комбінацію з CDRH1, CDRH2, CDRH3, CDRL1, CDRL2 та CDRL3, в тому числі, воно може містити від одного CDR важкого ланцюга та одного CDR легкого ланцюга до всіх шести вказаних CDR (тобто, всі три важколанцюгових та три легколанцюгових CDR). У одному втіленні, антитіло містить всі шість CDRH1, CDRH2, CDRH3, CDRL1, CDRL2 та CDRL3. У одному втіленні, антитіло містить змінний регіон важкого ланцюга, що містить наступні регіони, що визначають компліментарність: 1. CDRH1, як наведено у SEQ ID NO:2 2. CDRH2, як наведено у SEQ ID NO:3 3. CDRH3, як наведено у SEQ ID NO:4 або у будь - якій з SEQ ID NO:133-SEQ ID NO:138, та змінний регіон важкого ланцюга, що містить наступні регіони, що визначають компліментарність: 1. CDRL1, як наведено у SEQ ID NO:5 2. CDRL2, як наведено у SEQ ID NO:6 3. CDRL3, як наведено у SEQ ID NO:7 де антитіло додатково містить лейциновий залишок у позиції 69 змінного регіону важкого ланцюга та проліновий залишок у позиції 46 змінного регіону легкого ланцюга. У одному втіленні, антиген - зв'язуючий білок містить змінний регіон важкого ланцюга, що містить амінокислотну послідовність SEQ ID NO:13 (1A11.H3 V H) або амінокислотну послідовність, що має 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, 99 % або більше тотожності до амінокислотній послідовності SEQ ID NO:13 або змінний регіон важкого ланцюга, що містить амінокислотну послідовність, що наведена у будь - якої з SEQ ID NO:121, 123, 125, 127, 129 або 131 та змінний регіон легкого ланцюга, що містить амінокислотну послідовність SEQ ID NO:22 (1A11.L4 Vκ) або амінокислотну послідовність, що має 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, 99 % або більше ідентичності до амінокислотної послідовності SEQ ID NO:22. У одному втіленні, антиген - зв'язуючий білок містить важкий ланцюг, що містить 4 UA 104663 C2 5 10 15 20 25 30 35 40 45 50 55 60 амінокислотну послідовність SEQ ID NO:114 або амінокислотну послідовність, що має 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, 99 % або більше тотожності до амінокислотній послідовності SEQ ID NO:114 або SEQ ID NO:118. Окреме втілення стосується важкого ланцюга, що містить одне або декілька заміщень, вибраних від N98D, N98E, F100bE, F100bH, F100bI та F100bV (Kabat). У одному втіленні, антиген - зв'язуючий білок містить легкий ланцюг, що містить амінокислотну послідовність SEQ ID NO:115 або амінокислотну послідовність, що має 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, 99 % або більше тотожності до амінокислотній послідовності SEQ ID NO:115. У одному втіленні, антиген - зв'язуючий білок містить важкий ланцюг, що містить амінокислотну послідовність SEQ ID NO:114 або 118 або амінокислотну послідовність, що має 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, 99 % або більше тотожності до амінокислотній послідовності SEQ ID NO:114 або 118 та легкий ланцюг, що містить амінокислотну послідовність SEQ ID NO:115 або амінокислотну послідовність, що має 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, 99 % або більше тотожності до амінокислотній послідовності SEQ ID NO:115. Окреме втілення стосується антиген - зв'язуючого білка, що має амінокислотну послідовність важкого ланцюга SEQ ID NO:118 та амінокислотну послідовність легкого ланцюга SEQ ID NO:115. У іншому аспекті, винахід стосується антиген - зв'язуючого білка, що містить одне або декілька з наступного: 1. CDRH1, як наведено у SEQ ID NO:2 або варіант його CDR, 2. CDRH2, як наведено у SEQ ID NO:3 або варіант його CDR, 3. CDRH3 як наведено у SEQ ID NO:4 або варіант його CDR, або 4. CDRH3, як наведено у будь - якій з SEQ ID NO:132-SEQ ID NO:137, 5. CDRL1, як наведено у SEQ ID NO:5 або варіант його CDR, 6. CDRL2, як наведено у SEQ ID NO:6 або варіант його CDR, 7. CDRL3, як наведено у SEQ ID NO:7 або варіант його CDR, та додатково містить каркасний регіон важкого ланцюга, що має щонайменш один з наступних залишків: (a) Val, Ile або Gly у позиції 2 (b) Leu або Val у позиції 4 (c) Leu, Ile, Met або Val у позиції 20 (d) Cys у позиції 22 (e) Thr, Ala, Val, Gly або Ser у позиції 24 (f) Gly у позиції 26 (g) Trp або Tyr у позиції 47 (h) Ile, Met, Val або Leu у позиції 48 (i) Ile, Leu, Phe, Met або Val у позиції 69 (j) Arg, Val, Ala або Leu у позиції 71 (k) Ala, Leu, Val, Tyr або Phe у позиції 78 Leu або Met у позиції 80 (l) Tyr або Phe у позиції 90 (m) Cys у позиції 92 (n) Arg, Lys, Gly, Ser, His або Asn у позиції 94, та/або каркасний регіон легкого ланцюга, що має щонайменш один з наступних залишків: (o) Ile у позиції 2 (p) Leu у позиції 4 (q) Cys у позиції 23 (r) Trp у позиції 35 (s) Tyr у позиції 36 (t) Tyr або Phe у позиції 71 (u) Cys у позиції 88 (v) Phe у позиції 98, де антиген - зв'язуючий білок здатен зв'язуватися з CD127. Антиген - зв'язуючий білок може містити будь - яку комбінацію CDRH1, CDRH2, CDRH3, CDRL1, CDRL2 та CDRL3, в тому числі, від одного CDR до шести вказаних CDR (SEQ ID NOs:27). У одному втіленні, антиген - зв'язуючий білок містить всі шість вказаних CDR (SEQ ID NOs:27). У одному втіленні, антиген - зв'язуючий білок містить разом важколанцюговий каркасний регіон та легколанцюговий каркасний регіон, як описано вище. 5 UA 104663 C2 5 10 15 20 25 30 35 40 45 50 55 60 У одному втіленні, антиген - зв'язуючий білок є антитілом, вибірково, гуманізованим антитілом або антитілом людини, або його фрагментом зв'язування антигену. Один або декілька варіантів CDR цього аспекту винаходу можуть охоплювати: 1. варіант CDRH1 (SEQ ID NO:2), де: a) тирозиновий залишок у позиції 32 заміщено на ізолейцин, гістидин, фенілаланін, треонін, аспарагін, цистеїн, глутамінову або аспарагінову кислоту; b) треоніновий залишок у позиції 33 заміщено на тирозин, аланін, триптофан, гліцин, лейцин або валін; c) метіоніновий залишок у позиції 34 заміщено на ізолейцин, валін або триптофан; та /або d) аспарагіновий залишок у позиції 35 заміщено на гістидин, глютамінову кислоту, глютамін, серин, тирозин або треонін; 2. варіант CDRH2 (SEQ ID NO:3), де: a) лейциновий залишок у позиції 50 заміщено на аргінін, глютамінову кислоту, триптофан, тирозин, гліцин, глютамін, валін, аспарагін, лізин або аланін; b) ізолейциновий залишок у позиції 51 заміщено на лейцин, валін, треонін, серин або аспарагін; c) аспарагіновий залишок у позиції 52 заміщено на аспарагін, лейцин, серин або тирозин; d) тирозиновий залишок у позиції 53 заміщено на аланін, гліцин, серин, лізин, треонін або аспарагін; e) аспарагін у позиції 54 заміщено на серин, треонін, лізин, аспарагін або гліцин; f) валін у позиції 56 заміщено на тирозин, аргінін, глютамінову кислоту, аспарагінову кислоту, гліцин, серин або аланін; та /або g) серин у позиції 58 заміщено на лізин, аспарагін, треонін, аргінін, гліцин, фенілаланін або тирозин; 3. варіант CDRH3 (SEQ ID NO:4), де валін у позиції 102 заміщено на тирозин, гістидин, ізолейцин, серин, аспарагінову кислоту або гліцин; 4. варіант CDRL1 (SEQ ID NO:5), де: a) серин у позиції 29 заміщено на валін; та /або b) метіонін у позиції 33 заміщено на лейцин; та /або 5. варіант CDRL3 (SEQ ID NO:7), що містить один або декілька з наступних заміщень: a) глютамін у позиції 89 заміщено на лейцин; b) глютамінову кислоту у позиції 90 заміщено на глютамін; c) триптофан у позиції 91 заміщено на тирозин; та /або d) тирозин у позиції 93 заміщено на серин або аргінін. Антиген - зв'язуючий білок може містити змінний регіон важкого ланцюга будь - якої з послідовностей SEQ ID NOs:10-17 (1A11.H0 VH-1A11.H7 VH) або змінний регіон важкого ланцюга будь - якої з послідовностей SEQ ID NO:121, 123, 125, 127, 129 або 131. У одному втіленні, антиген - зв'язуючий білок містить змінний регіон важкого ланцюга SEQ ID NO:13 (1A11.H3 V H). Антиген - зв'язуючий білок може містити змінний регіон легкого ланцюга будь - якої з послідовностей з SEQ ID NOs:18-27 (1A11.L0 Vκ to 1A11.L9 Vκ). У одному втіленні, антиген зв'язуючий білок містить змінний регіон легкого ланцюга SEQ ID NO:22 (1A11.L4 Vκ). У окремому втіленні, антиген - зв'язуючий білок містить змінний регіон важкого ланцюга SEQ ID NO:13 (1A11.H3 VH) та змінний регіон легкого ланцюга SEQ ID NO:22 (1A11.L4 Vκ). У іншому втіленні, антиген - зв'язуючий білок містить важкий ланцюг SEQ ID NO: 114 або SEQ ID NO:118, особливо SEQ ID NO:118, та легкий ланцюг SEQ ID NO:115. Додатково, важкий ланцюг може містити будь - яке з наступних заміщень: N98D, N98E, F100bE, F100bH, F100bI та F100bV (Kabat). У іншому втіленні, антиген - зв'язуючий білок містить одну або декілька точкових мутацій у CDRH3, при яких антиген - зв'язуючий білок має більшу зв'язувальну спорідненість до IL-7R, ніж антиген - зв'язуючий білок, що не має вказаної мутації. Наприклад, у одному втіленні, антиген зв'язуючий білок містить CDRH3, як наведено у SEQ ID NOs:132-137. У одному втіленні, антиген - зв'язуючий білок містить змінний регіон важкого ланцюга, як наведено у SEQ ID NOs:121, 123, 125, 127, 129 або 131. У іншому аспекті, винахід стосується антиген - зв'язуючого білка, що містить змінний домен важкого ланцюга, як це наведено у: (a) SEQ ID NO:11 (b) SEQ ID NO:12 (c) SEQ ID NO:13 (d) SEQ ID NO:14 6 UA 104663 C2 5 10 15 20 25 30 35 40 45 50 55 60 (e) SEQ ID NO:15 (f) SEQ ID NO:16 (g) SEQ ID NO:17 (h) SEQ ID NO:121 (i) SEQ ID NO:123 (j) SEQ ID NO:125 (k) SEQ ID NO:127 (l) SEQ ID NO:129 (m) SEQ ID NO:131, або змінний домен важкого ланцюга, що має 70 % або більше тотожності до однієї з SEQ ID NOs:11-17, де антиген - зв'язуючий білок є здатним до зв'язування CD127. У одному втіленні, змінний домен важкого ланцюга має 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, 99 % або більше тотожності до однієї з SEQ ID NOs:11-17. У одному втіленні, антиген - зв'язуючий білок містить змінний домен важкого ланцюга, як наведено у SEQ ID NO:13 або змінний домен важкого ланцюга, що має 70 % або більше, 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, 99 % або більше тотожності до SEQ ID NO:13. У одному втіленні, антиген - зв'язуючий білок має важкий ланцюг, що має 70 % або більше, 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, 99 % або більше тотожності до SEQ ID NO:115 або SEQ ID NO:118. У одному втіленні, важкий ланцюг або змінний домен важкого ланцюга, є варіантом однієї з SEQ ID NOs: 11-17, 121, 123, 125, 127, 129, 131 та де відмінність являє собою одне або декілька з наступного: i. Val, Ile або Gly у позиції 2 ii. Leu або Val у позиції 4 iii. Leu, Ile, Met або Val у позиції 20 iv. Thr, Ala, Val, Gly або Ser у позиції 24 v. Trp або Tyr у позиції 47 vi. Ile, Met, Val або Leu у позиції 48 vii. Ile, Leu, Phe, Met або Val у позиції 69 viii. Arg, Val, Ala або Leu у позиції 71 ix. Ala, Leu, Val, Tyr або Phe у позиції 78 Leu або Met у позиції 80 x. Tyr або Phe у позиції 90; та Arg, Lys, Gly, Ser, His або Asn у позиції 94. У іншому аспекті, винахід стосується антиген - зв'язуючого білка, що містить змінний домен легкого ланцюга, як це наведено у: (a) SEQ ID NO:19 (b) SEQ ID NO:20 (c) SEQ ID NO:21 (d) SEQ ID NO:22 (e) SEQ ID NO:23 (f) SEQ ID NO:24 (g) SEQ ID NO:25 (h) SEQ ID NO:26 (i) SEQ ID NO:27 або змінний домен легкого ланцюга, що має 70 % або більше тотожності до однієї з SEQ ID NOs:19-27, де антиген - зв'язуючий білок є здатним до зв'язування CD127. У одному втіленні, антиген - зв'язуючий білок містить змінний домен легкого ланцюга, як наведено у SEQ ID NO:22 або змінний домен легкого ланцюга, що має 70 % або більше тотожності до SEQ ID NO:22. У одному втіленні, змінний домен легкого ланцюга має 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, 99 % або більше тотожності до однієї з SEQ ID NOs:19-27. У одному втіленні, антиген - зв'язуючий білок має легкий ланцюг, що має 70 % або більше, 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, 99 % або більше тотожності до SEQ ID NO: 115. Винахід розглядає будь - які спарювання описаних важких та легких змінних доменів. Отже, у одному втіленні, винахід стосується антиген - зв'язуючого білка, що містить будь - яку одну з наступних комбінацій змінного домену важкого та легкого ланцюга: змінний домен важкого ланцюга SEQ ID NO:11 (або послідовність, що має 75 % або більше, 80 % або більше, 85 % або 7 UA 104663 C2 5 10 15 20 25 30 35 40 45 50 55 60 більше, 90 % або більше, 95 % або більше, 98 % або більше, 99 % або більше тотожності до нього) зі змінним доменом легкого ланцюга будь - якої однієї з SEQ ID NO:19, SEQ ID NO:20, SEQ ID NO:21, SEQ ID NO:22, SEQ ID NO:23, SEQ ID NO:24, SEQ ID NO:25, SEQ ID NO:26, або SEQ ID NO:27 (або послідовності, що має 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, або 99 % або більше тотожності до будь якої з SEQ ID NO:19, SEQ ID NO:20, SEQ ID NO:21, SEQ ID NO:22, SEQ ID NO:23, SEQ ID NO:24, SEQ ID NO:25, SEQ ID NO:26, або SEQ ID NO:27); змінний домен важкого ланцюга SEQ ID NO:12 (або послідовність, що має 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, 99 % або більше тотожності до нього) зі змінним доменом легкого ланцюга будь - якої однієї з SEQ ID NO:19, SEQ ID NO:20, SEQ ID NO:21, SEQ ID NO:22, SEQ ID NO:23, SEQ ID NO:24, SEQ ID NO:25, SEQ ID NO:26, або SEQ ID NO:27 (або послідовності, що має 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, або 99 % або більше тотожності до будь - якої з SEQ ID NO:19, SEQ ID NO:20, SEQ ID NO:21, SEQ ID NO:22, SEQ ID NO:23, SEQ ID NO:24, SEQ ID NO:25, SEQ ID NO:26, або SEQ ID NO:27); змінний домен важкого ланцюга SEQ ID NO:13 (або послідовність, що має 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, 99 % або більше тотожності до нього) зі змінним доменом легкого ланцюга будь - якої однієї з SEQ ID NO:19, SEQ ID NO:20, SEQ ID NO:21, SEQ ID NO:22, SEQ ID NO:23, SEQ ID NO:24, SEQ ID NO:25, SEQ ID NO:26, або SEQ ID NO:27 (або послідовності, що має 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, або 99 % або більше тотожності до будь - якої з SEQ ID NO:19, SEQ ID NO:20, SEQ ID NO:21, SEQ ID NO:22, SEQ ID NO:23, SEQ ID NO:24, SEQ ID NO:25, SEQ ID NO:26, або SEQ ID NO:27); змінний домен важкого ланцюга SEQ ID NO:14 (або послідовність, що має 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, 99 % або більше тотожності до нього) зі змінним доменом легкого ланцюга будь - якої однієї з SEQ ID NO:19, SEQ ID NO:20, SEQ ID NO:21, SEQ ID NO:22, SEQ ID NO:23, SEQ ID NO:24, SEQ ID NO:25, SEQ ID NO:26, або SEQ ID NO:27 (або послідовності, що має 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, або 99 % або більше тотожності до будь - якої з SEQ ID NO:19, SEQ ID NO:20, SEQ ID NO:21, SEQ ID NO:22, SEQ ID NO:23, SEQ ID NO:24, SEQ ID NO:25, SEQ ID NO:26, або SEQ ID NO:27); змінний домен важкого ланцюга SEQ ID NO:15 (або послідовність, що має 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, 99 % або більше тотожності до нього) зі змінним доменом легкого ланцюга будь - якої однієї з SEQ ID NO:19, SEQ ID NO:20, SEQ ID NO:21, SEQ ID NO:22, SEQ ID NO:23, SEQ ID NO:24, SEQ ID NO:25, SEQ ID NO:26, або SEQ ID NO:27 (або послідовності, що має 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, або 99 % або більше тотожності до будь - якої з SEQ ID NO:19, SEQ ID NO:20, SEQ ID NO:21, SEQ ID NO:22, SEQ ID NO:23, SEQ ID NO:24, SEQ ID NO:25, SEQ ID NO:26, або SEQ ID NO:27); змінний домен важкого ланцюга SEQ ID NO:16 (або послідовність, що має 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, 99 % або більше тотожності до нього) зі змінним доменом легкого ланцюга будь - якої однієї з SEQ ID NO:19, SEQ ID NO:20, SEQ ID NO:21, SEQ ID NO:22, SEQ ID NO:23, SEQ ID NO:24, SEQ ID NO:25, SEQ ID NO:26, або SEQ ID NO:27 (або послідовності, що має 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, або 99 % або більше тотожності до будь - якої з SEQ ID NO:19, SEQ ID NO:20, SEQ ID NO:21, SEQ ID NO:22, SEQ ID NO:23, SEQ ID NO:24, SEQ ID NO:25, SEQ ID NO:26, або SEQ ID NO:27); змінний домен важкого ланцюга SEQ ID NO:17 (або послідовність, що має 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, 99 % або більше тотожності до нього) зі змінним доменом легкого ланцюга будь - якої однієї з SEQ ID NO:19, SEQ ID NO:20, SEQ ID NO:21, SEQ ID NO:22, SEQ ID NO:23, SEQ ID NO:24, SEQ ID NO:25, SEQ ID NO:26, або SEQ ID NO:27 (або послідовності, що має 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, або 99 % або більше тотожності до будь - якої з SEQ ID NO:19, SEQ ID NO:20, SEQ ID NO:21, SEQ ID NO:22, SEQ ID NO:23, SEQ ID NO:24, SEQ ID NO:25, SEQ ID NO:26, або SEQ ID NO:27); змінний домен важкого ланцюга SEQ ID NO:121 (або послідовність, що має 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, 99 % або більше тотожності до нього) зі змінним доменом легкого ланцюга будь - якої однієї з SEQ ID NO:19, SEQ ID NO:20, SEQ ID NO:21, SEQ ID NO:22, SEQ ID NO:23, SEQ ID NO:24, SEQ ID NO:25, SEQ ID NO:26, або SEQ ID NO:27 (або послідовності, що має 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 8 UA 104663 C2 5 10 15 20 25 30 35 40 45 50 55 60 95 % або більше, 98 % або більше, або 99 % або більше тотожності до будь - якої з SEQ ID NO:19, SEQ ID NO:20, SEQ ID NO:21, SEQ ID NO:22, SEQ ID NO:23, SEQ ID NO:24, SEQ ID NO:25, SEQ ID NO:26, або SEQ ID NO:27); змінний домен важкого ланцюга SEQ ID NO:123 (або послідовність, що має 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, 99 % або більше тотожності до нього) зі змінним доменом легкого ланцюга будь - якої однієї з SEQ ID NO:19, SEQ ID NO:20, SEQ ID NO:21, SEQ ID NO:22, SEQ ID NO:23, SEQ ID NO:24, SEQ ID NO:25, SEQ ID NO:26, або SEQ ID NO:27 (або послідовності, що має 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, або 99 % або більше тотожності до будь - якої з SEQ ID NO:19, SEQ ID NO:20, SEQ ID NO:21, SEQ ID NO:22, SEQ ID NO:23, SEQ ID NO:24, SEQ ID NO:25, SEQ ID NO:26, або SEQ ID NO:27); змінний домен важкого ланцюга SEQ ID NO:125 (або послідовність, що має 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, 99 % або більше тотожності до нього) зі змінним доменом легкого ланцюга будь - якої однієї з SEQ ID NO:19, SEQ ID NO:20, SEQ ID NO:21, SEQ ID NO:22, SEQ ID NO:23, SEQ ID NO:24, SEQ ID NO:25, SEQ ID NO:26, або SEQ ID NO:27 (або послідовності, що має 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, або 99 % або більше тотожності до будь - якої з SEQ ID NO:19, SEQ ID NO:20, SEQ ID NO:21, SEQ ID NO:22, SEQ ID NO:23, SEQ ID NO:24, SEQ ID NO:25, SEQ ID NO:26, або SEQ ID NO:27); змінний домен важкого ланцюга SEQ ID NO:127 (або послідовність, що має 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, 99 % або більше тотожності до нього) зі змінним доменом легкого ланцюга будь - якої однієї з SEQ ID NO:19, SEQ ID NO:20, SEQ ID NO:21, SEQ ID NO:22, SEQ ID NO:23, SEQ ID NO:24, SEQ ID NO:25, SEQ ID NO:26, або SEQ ID NO:27 (або послідовності, що має 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, або 99 % або більше тотожності до будь - якої з SEQ ID NO:19, SEQ ID NO:20, SEQ ID NO:21, SEQ ID NO:22, SEQ ID NO:23, SEQ ID NO:24, SEQ ID NO:25, SEQ ID NO:26, або SEQ ID NO:27); змінний домен важкого ланцюга SEQ ID NO:129 (або послідовність, що має 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, 99 % або більше тотожності до нього) зі змінним доменом легкого ланцюга будь - якої однієї з SEQ ID NO:19, SEQ ID NO:20, SEQ ID NO:21, SEQ ID NO:22, SEQ ID NO:23, SEQ ID NO:24, SEQ ID NO:25, SEQ ID NO:26, або SEQ ID NO:27 (або послідовності, що має 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, або 99 % або більше тотожності до будь - якої з SEQ ID NO:19, SEQ ID NO:20, SEQ ID NO:21, SEQ ID NO:22, SEQ ID NO:23, SEQ ID NO:24, SEQ ID NO:25, SEQ ID NO:26, або SEQ ID NO:27); або, змінний домен важкого ланцюга SEQ ID NO:131 (або послідовність, що має 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, 99 % або більше тотожності до нього) зі змінним доменом легкого ланцюга будь - якої однієї з SEQ ID NO:19, SEQ ID NO:20, SEQ ID NO:21, SEQ ID NO:22, SEQ ID NO:23, SEQ ID NO:24, SEQ ID NO:25, SEQ ID NO:26, або SEQ ID NO:27 (або послідовності, що має 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, або 99 % або більше тотожності до будь - якої з SEQ ID NO:19, SEQ ID NO:20, SEQ ID NO:21, SEQ ID NO:22, SEQ ID NO:23, SEQ ID NO:24, SEQ ID NO:25, SEQ ID NO:26, або SEQ ID NO:27). У одному втіленні, антиген - зв'язуючий білок містить змінний домен важкого ланцюга, що містить амінокислотну послідовність, що має 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, 99 % або більше тотожності до послідовності, що наведена у SEQ ID NO:13 та змінний домен легкого ланцюга, що містить амінокислотну послідовність, що має 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, 99 % або більше тотожності до послідовності, що наведена у SEQ ID NO:22. У одному втіленні, антиген - зв'язуючий білок містить змінний домен важкого ланцюга, як наведено у SEQ ID NO:13 та змінний домен легкого ланцюга, як наведено у SEQ ID NO:22. У іншому аспекті, винахід стосується антиген - зв'язуючого білка, що містить один або декілька наступних регіонів, що визначають компліментарність: (i) CDRH1, як наведено у SEQ ID NO:2 або варіант його CDR (ii) CDRH2, як наведено у SEQ ID NO:3 або варіант його CDR (iii) CDRH3, як наведено у SEQ ID NO:4 або варіант його CDR, або CDRH3, як наведено у будь - якої з SEQ ID NO:132-SEQ ID NO:137, (iv) CDRL1, як наведено у SEQ ID NO:5 або варіант його CDR (v) CDRL2, як наведено у SEQ ID NO:6 або варіант його CDR 9 UA 104663 C2 5 10 15 20 25 30 35 40 45 50 55 60 (vi) CDRL3, як наведено у SEQ ID NO:7 або варіант його CDR де принаймні один зі вказаних CDR є варіантним CDR та де вказаний антиген - зв'язуючий білок є здатним до зв'язування CD127. У одному втіленні, антиген - зв'язуючий білок містить принаймні CDRL2, як наведено у SEQ ID NO:6 або його варіант. У одному втіленні, антиген - зв'язуючий білок містить принаймні CDRH3, як наведено у SEQ ID NO:4, або варіант його CDR. Варіанти CDR цього аспекту винаходу можуть охоплювати: 1. Варіант CDRH1 (SEQ ID NO:2), де: a) тирозиновий залишок у позиції 32 заміщено на ізолейцин, гістидин, фенілаланін, треонін, аспарагін, цистеїн, глутамінову або аспарагінову кислоту; b) треоніновий залишок у позиції 33 заміщено на a тирозин, аланін, триптофан, гліцин, лейцин або валін, c) метіоніновий залишок у позиції 34 заміщено на ізолейцин, валін або триптофан; та /або d) аспарагіновий залишок у позиції 35 заміщено на гістидин, глютамінову кислоту, глютамін, серин, тирозин або треонін; 2. Варіант CDRH2 (SEQ ID NO:3), де: a) лейциновий залишок у позиції 50 заміщено на аргінін, глютамінову кислоту, триптофан, тирозин, гліцин, глютамін, валін, аспарагін, лізин або аланін; b) ізолейциновий залишок у позиції 51 заміщено на лейцин валін, треонін, серин або аспарагін; c) аспарагіновий залишок у позиції 52 заміщено на аспарагін, лейцин, серин або тирозин; d) тирозиновий залишок у позиції 53 заміщено на аланін, гліцин, серин, лізин, треонін або аспарагін; e) аспарагін у позиції 54 заміщено на серин, треонін, лізин, аспарагін або гліцин; f) валін у позиції 56 заміщено на тирозин, аргінін, глютамінову кислоту, аспарагінову кислоту, гліцин, серин або аланін; та /або g) серин у позиції 58 заміщено на лізин, аспарагін, треонін, аргінін, гліцин, фенілаланін або тирозин; 3. Варіант CDRH3 (SEQ ID NO:4) де: a) валін у позиції 102 заміщено на тирозин, гістидин, ізолейцин, серин, аспарагінову кислоту або гліцин; 4. Варіант CDRL1 (SEQ ID NO:5) де: a) серин у позиції 29 заміщено на валін; та /або b) метіонін у позиції 33 заміщено на a лейцин; та /або 5. Варіант CDRL3 (SEQ ID NO:7), що містить один або декілька з наступних заміщень: a) глютамін у позиції 89 заміщено на лейцин; b) глютамінову кислоту у позиції 90 заміщено на глютамін; c) триптофан у позиції 91 заміщено на тирозин; та /або d) тирозин у позиції 93 заміщено на серин або аргінін. У іншому аспекті, винахід стосується антиген - зв'язуючого білка, що містить: змінний домен важкого ланцюга, що містить: 1. CDRH1, як наведено у SEQ ID NO:2 або варіант його CDR 2. CDRH2, як наведено у SEQ ID NO:3 або варіант його CDR 3. CDRH3, як наведено у SEQ ID NO:4 або варіант його CDR або CDRH3, як наведено у будь - якої з SEQ ID NO:132-SEQ ID NO:137 у каркасному регіоні змінного домену важкого ланцюга, що містить щонайменш одне з наступного: (a) Val, Ile або Gly у позиції 2 (b) Leu або Val у позиції 4 (c) Leu, Ile, Met або Val у позиції 20 (d) Cys у позиції 22 (e) Thr, Ala, Val, Gly або Ser у позиції 24 (f) Gly у позиції 26 (g) Trp або Tyr у позиції 47 (h) Ile, Met, Val або Leu у позиції 48 (i) Ile, Leu, Phe, Met або Val у позиції 69 (j) Arg, Val, Ala або Leu у позиції 71 (k) Ala, Leu, Val, Tyr або Phe у позиції 78 Leu або Met у позиції 80 (l) Tyr або Phe у позиції 90 (m) Cys у позиції 92 (n) Arg, Lys, Gly, Ser, His або Asn у позиції 94; 10 UA 104663 C2 5 10 15 20 25 30 35 40 45 50 55 60 та змінний домен легкого ланцюга, що містить: 1. CDRL1, як наведено у SEQ ID NO:5 або варіант його CDR 2. CDRL2, як наведено у SEQ ID NO:6 або варіант його CDR 3. CDRL3, як наведено у SEQ ID NO:7 або варіант його CDR у каркасному регіоні змінного домену легкого ланцюга, що містить щонайменш одне з наступного: (a) Ile у позиції 2 (b) Leu у позиції 4 (c) Cys у позиції 23 (d) Trp у позиції 35 (e) Tyr у позиції 36 (f) Tyr або Phe у позиції 71 (g) Cys у позиції 88 (h) Phe у позиції 98; де антиген - зв'язуючий білок є здатним до зв'язування CD127. Варіант CDR цього аспекту винаходу може містити: 1. Варііант CDRH1 (SEQ ID NO:2), де: a) тирозиновий залишок у позиції 32 заміщено на ізолейцин, гістидин, фенілаланін, треонін, аспарагін, цистеїн, глутамінову або аспарагінову кислоту; b) треоніновий залишок у позиції 33 заміщено на a тирозин, аланін, триптофан, гліцин, лейцин або валін, c) метіоніновий залишок у позиції 34 заміщено на ізолейцин, валін або триптофан; та /або d) аспарагіновий залишок у позиції 35 заміщено на гістидин, глютамінову кислоту, глютамін, серин, тирозин або треонін; 2. Варіант CDRH2 (SEQ ID NO:3), де: a) лейциновий залишок у позиції 50 заміщено на аргінін, глютамінову кислоту, триптофан, тирозин, гліцин, глютамін, валін, аспарагін, лізин або аланін; b) ізолейциновий залишок у позиції 51 заміщено на лейцин, валін, треонін, серин або аспарагін; c) аспарагіновий залишок у позиції 52 заміщено на аспарагін, лейцин, серин або тирозин; d) тирозиновий залишок у позиції 53 заміщено на аланін, гліцин, серин, лізин, треонін або аспарагін; e) аспарагін у позиції 54 заміщено на серин, треонін, лізин, аспарагін або гліцин; f) валін у позиції 56 заміщено на тирозин, аргінін, глютамінову кислоту, аспарагінову кислоту, гліцин, серин або аланін; та /або g) серин у позиції 58 заміщено на лізин, аспарагін, треонін, аргінін, гліцин, фенілаланін або тирозин; 3. Варіант CDRH3 (SEQ ID NO:4), де a) валін у позиції 102 заміщено на тирозин, гістидин, ізолейцин, серин, аспарагінову кислоту або гліцин; 4. Варіант CDRL1 (SEQ ID NO:5), де a) серин у позиції 29 заміщено на валін; та /або b) метіонін у позиції 33 заміщено на a лейцин; та /або 5. варіант CDRL3 (SEQ ID NO:7), що містить одне або декілька наступних заміщень: a) глютамін у позиції 89 заміщено на лейцин; b) глютамінову кислоту у позиції 90 заміщено на глютамін; c) триптофан у позиції 91 заміщено на тирозин; та /або d) тирозин у позиції 93 заміщено на серин або аргінін. У одному втіленні, антиген - зв'язуючий білок є антитілом, вибірково, гуманізованим або антитілом людини, або його антиген - зв'язуючим фрагментом. У іншому аспекті, винахід стосується антитіла, що містить змінний регіон важкого ланцюга, що містить один, два або три з наступних регіонів, що визначають компліментарність: 1. CDRH1, як наведено у SEQ ID NO:39 2. CDRH2, як наведено у SEQ ID NO:40 3. CDRH3, як наведено у SEQ ID NO:41 де антитіло додатково містить щонайменш один з наступного: валін у позиції 24, тирозин у позиції 27, серин у позиції 28, ізолейцин у позиції 29, треонін у позиції 30, метіонін у позиції 48, гліцин у позиції 49, ізолейцин у позиції 67, серин у позиції 68, аргінін у позиції 71, треонін у позиції 73 та фенілаланін у позиції 78 змінного регіону важкого ланцюга (нумерування відповідно Kabat). 11 UA 104663 C2 5 10 15 20 25 30 35 40 45 50 55 60 У одному втіленні, антитіло містить принаймні один, два, три, чотири або всі п'ять з наступного: тирозин у позиції 27, треонін у позиції 30, метіонін у позиції 48, ізолейцин у позиції 67 та аргінін у позиції 71. Антитіло може містити змінний регіон важкого ланцюга, що містить CDRH1 (SEQ ID NO:39) та CDRH3 (SEQ ID NO:41); CDRH2 (SEQ ID NO:40) та CDRH3 (SEQ ID NO:41); CDRH1 (SEQ ID NO:39) та CDRH2 (SEQ ID NO:40); або CDRH1 (SEQ ID NO:39), CDRH2 (SEQ ID NO:40) та CDRH3 (SEQ ID NO:41). Антитіло також може містити змінний регіон важкого ланцюга будь якої з SEQ ID NOs:48-56 (6A3IGHV4_61.H1 VH-6A3IGHV4_61.H9) або SEQ ID NOs:58-68 (6A3IGHV3-33.H1 VH to 6A3 IGHV3-33.H11). Винахідом також передбачено антитіло, що містить змінний регіон легкого ланцюга, що містить один, два або три з наступних регіонів, що визначають компліментарність: 1.CDRL1, як наведено у SEQ ID NO:42 2.CDRL2, як наведено у SEQ ID NO:43 3.CDRL3, як наведено у SEQ ID NO:44 де антитіло додатково містить одне або обидва з наступного: a) глютаміновий залишок у позиції 45 та лізиновий залишок у позиції 70 змінного регіону легкого ланцюга, або b) одне або декілька з наступного: лейцин у позиції 4, тирозин у позиції 31, метіонін у позиції 70, треонін у позиції 85, тирозин у позиції 94, гліцин у позиції 100 та валін у позиції 104 (нумерування відповідно Kabat). У одному втіленні, антитіло містить обидва з наступного: глютаміновий залишок у позиції 45 та лізиновий залишок у позиції 70. У іншому втіленні, антитіло включає в себе кожне з наступного: лейцин у позиції 4, тирозин у позиції 31, метіонін у позиції 70, треонін у позиції 85, тирозин у позиції 94, гліцин у позиції 100 та валін у позиції 104. Антитіло може містити змінний регіон важкого ланцюга, що містить CDRL1 (SEQ ID NO:42) та CDRL3 (SEQ ID NO:44); CDRL2 (SEQ ID NO:43) та CDRL3 (SEQ ID NO:44); або CDRL1 (SEQ ID NO:42) та CDRL2 (SEQ ID NO:43); або CDRL1 (SEQ ID NO:42), CDRL2 (SEQ ID NO:43) та CDRL3 (SEQ ID NO:44). Антитіло може містити змінний регіон легкого ланцюга будь - якої з послідовностей SEQ ID NOs:70-72 та 138 (6A3.L1 Vκ, 6A3.L2 Vκ, 6A3.L3 Vκ та 6A3.L27 Vκ). У іншому аспекті, винахід стосується антитіла, що містить змінний регіон важкого ланцюга, що містить один, два або три з наступних регіонів, що визначають компліментарність: 1. CDRH1, як наведено у SEQ ID NO:39 2. CDRH2, як наведено у SEQ ID NO:40 3. CDRH3, як наведено у SEQ ID NO:41 де антитіло додатково містить щонайменш одне з наступного: валін у позиції 24, тирозин у позиції 27, серин у позиції 28, ізолейцин у позиції 29, треонін у позиції 30, метіонін у позиції 48, гліцин у позиції 49, ізолейцин у позиції 67, серин у позиції 68, аргінін у позиції 71, треонін у позиції 73 та фенілаланін у позиції 78 змінного регіону важкого ланцюга, та змінний регіон важкого ланцюга, що містить один, два або три з наступних регіонів, що визначають компліментарність: 1. CDRL1, як наведено у SEQ ID NO:42 2. CDRL2, як наведено у SEQ ID NO:43 3. CDRL3, як наведено у SEQ ID NO:44 де антитіло додатково містить: a) одне або обидва з наступного: глютаміновий залишок у позиції 45 та лізиновий залишок у позиції 70 змінного регіону легкого ланцюга; або b) одне або декілька з наступного: лейцин у позиції 4, тирозин у позиції 31, метіонін у позиції 70, треонін у позиції 85, тирозин у позиції 94, гліцин у позиції 100 та валін у позиції 104 (нумерування відповідно Kabat). Антитіло може містити будь - яку комбінацію з CDRH1, CDRH2, CDRH3, CDRL1, CDRL2 та CDRL3, в тому числі з одним CDR важкого ланцюга та одним CDR легкого ланцюга, а також всі шість вказаних CDR. У одному втіленні, антитіло містить: змінний регіон важкого ланцюга, що містить наступні регіони, що визначають компліментарність: 1. CDRH1, як наведено у SEQ ID NO:39 2. CDRH2, як наведено у SEQ ID NO:40 3. CDRH3, як наведено у SEQ ID NO:41 4. CDRL1, як наведено у SEQ ID NO:42 5. CDRL2, як наведено у SEQ ID NO:43 6. CDRL3, як наведено у SEQ ID NO:44 12 UA 104663 C2 5 10 15 20 25 30 35 40 45 5055 60 де антитіло додатково містить щонайменш одне з наступного: валін у позиції 24, тирозин у позиції 27, серин у позиції 28, ізолейцин у позиції 29, треонін у позиції 30, метіонін у позиції 48, гліцин у позиції 49, ізолейцин у позиції 67, серин у позиції 68, аргінін у позиції 71, треонін у позиції 73 та фенілаланін у позиції 78 змінного регіону важкого ланцюга; та /або принаймні один глютаміновий залишок у позиції 45 та лізиновий залишок у позиції 70 змінного регіону легкого ланцюга, або один або декілька лейцинів у позиції 4, тирозин у позиції 31, метіонін у позиції 70, треонін у позиції 85, тирозин у позиції 94, гліцин у позиції 100 та валін у позиції 104 (нумерування відповідно Kabat). Винахід передбачає буд - яке парування описаних важкого та легкого змінних доменів. Тому, у одному втіленні, винахід стосується антиген - зв'язуючого білку, що містить будь - яку одну з наступних комбінацій змінного домену важкого та легкого ланцюга: змінний домен важкого ланцюга SEQ ID NO:47 (або послідовність, що має 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, 99 % або більше тотожності до нього) зі змінним доменом легкого ланцюга будь - якої однієї з SEQ ID NO:69, SEQ ID NO:70, SEQ ID NO:71, SEQ ID NO:72 або SEQ ID NO:138 (або послідовність, що має 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, або 99 % або більше тотожності до будь - якої з SEQ ID NO:69, SEQ ID NO:70, SEQ ID NO:71, SEQ ID NO:72 або SEQ ID NO:138); змінний домен важкого ланцюга SEQ ID NO:48 (або послідовність, що має 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, 99 % або більше тотожності до нього) зі змінним доменом легкого ланцюга будь - якої однієї з SEQ ID NO:69, SEQ ID NO:70, SEQ ID NO:71, SEQ ID NO:72 або SEQ ID NO:138 (або послідовність, що має 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, або 99 % або більше тотожності до будь - якої з SEQ ID NO:69, SEQ ID NO:70, SEQ ID NO:71, SEQ ID NO:72 або SEQ ID NO:138); змінний домен важкого ланцюга SEQ ID NO:49 (або послідовність, що має 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, 99 % або більше тотожності до нього) зі змінним доменом легкого ланцюга будь - якої однієї з SEQ ID NO:70, SEQ ID NO:71, SEQ ID NO:72, SEQ ID NO:73 або SEQ ID NO:138 (або послідовність, що має 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, або 99 % або більше тотожності до будь - якої з SEQ ID NO:70, SEQ ID NO:71, SEQ ID NO:72, SEQ ID NO:73 або SEQ ID NO:138); змінний домен важкого ланцюга SEQ ID NO:50 (або послідовність, що має 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, 99 % або більше тотожності до нього) зі змінним доменом легкого ланцюга будь - якої однієї з SEQ ID NO:69, SEQ ID NO:70, SEQ ID NO:71, SEQ ID NO:72 або SEQ ID NO:138 (або послідовність, що має 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, або 99 % або більше тотожності до будь - якої з SEQ ID NO:69, SEQ ID NO:70, SEQ ID NO:71, SEQ ID NO:72 або SEQ ID NO:138); змінний домен важкого ланцюга SEQ ID NO:51 (або послідовність, що має 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, 99 % або більше тотожності до нього) зі змінним доменом легкого ланцюга будь - якої однієї з SEQ ID NO:69, SEQ ID NO:70, SEQ ID NO:71, SEQ ID NO:72 або SEQ ID NO:138 (або послідовність, що має 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, або 99 % або більше тотожності до будь - якої з SEQ ID NO:69, SEQ ID NO:70, SEQ ID NO:71, SEQ ID NO:72 або SEQ ID NO:138); змінний домен важкого ланцюга SEQ ID NO:52 (або послідовність, що має 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, 99 % або більше тотожності до нього) зі змінним доменом легкого ланцюга будь - якої однієї з SEQ ID NO:69, SEQ ID NO:70, SEQ ID NO:71, SEQ ID NO:72 або SEQ ID NO:138 (або послідовність, що має 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, або 99 % або більше тотожності до будь - якої з SEQ ID NO:69, SEQ ID NO:70, SEQ ID NO:71, SEQ ID NO:72 або SEQ ID NO:138); змінний домен важкого ланцюга SEQ ID NO:53 (або послідовність, що має 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, 99 % або більше тотожності до нього) зі змінним доменом легкого ланцюга будь - якої однієї з SEQ ID NO:69, SEQ ID NO:70, SEQ ID NO:71, SEQ ID NO:72 або SEQ ID NO:138 (або послідовність, що має 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, або 99 % або більше тотожності до будь - якої з SEQ ID NO:69, SEQ ID NO:70, SEQ ID NO:71, SEQ ID NO:72 або SEQ ID NO:138); змінний домен важкого ланцюга SEQ ID NO:54 (або послідовність, що має 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, 99 % або більше тотожності до нього) зі змінним доменом легкого ланцюга будь - якої однієї з 13 UA 104663 C2 5 10 15 20 25 30 35 40 45 50 55 60 SEQ ID NO:69, SEQ ID NO:70, SEQ ID NO:71, SEQ ID NO:72 або SEQ ID NO:138 (або послідовність, що має 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, або 99 % або більше тотожності до будь - якої з SEQ ID NO:69, SEQ ID NO:70, SEQ ID NO:71, SEQ ID NO:72 або SEQ ID NO:138); змінний домен важкого ланцюга SEQ ID NO:55 (або послідовність, що має 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, 99 % або більше тотожності до нього) зі змінним доменом легкого ланцюга будь - якої однієї з SEQ ID NO:69, SEQ ID NO:70, SEQ ID NO:71, SEQ ID NO:72 або SEQ ID NO:138 (або послідовність, що має 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, або 99 % або більше тотожності до будь - якої з SEQ ID NO:69, SEQ ID NO:70, SEQ ID NO:71, SEQ ID NO:72 або SEQ ID NO:138); змінний домен важкого ланцюга SEQ ID NO:56 (або послідовність, що має 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, 99 % або більше тотожності до нього) зі змінним доменом легкого ланцюга будь - якої однієї з SEQ ID NO:69, SEQ ID NO:70, SEQ ID NO:71, SEQ ID NO:72 або SEQ ID NO:138 (або послідовність, що має 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, або 99 % або більше тотожності до будь - якої з SEQ ID NO:69, SEQ ID NO:70, SEQ ID NO:71, SEQ ID NO:72 або SEQ ID NO:138); змінний домен важкого ланцюга SEQ ID NO:57 (або послідовність, що має 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, 99 % або більше тотожності до нього) зі змінним доменом легкого ланцюга будь - якої однієї з SEQ ID NO:69, SEQ ID NO:70, SEQ ID NO:71, SEQ ID NO:72 або SEQ ID NO:138 (або послідовність, що має 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, або 99 % або більше тотожності до будь - якої з SEQ ID NO:69, SEQ ID NO:70, SEQ ID NO:71, SEQ ID NO:72 або SEQ ID NO:138); змінний домен важкого ланцюга SEQ ID NO:58 (або послідовність, що має 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, 99 % або більше тотожності до нього) зі змінним доменом легкого ланцюга будь - якої однієї з SEQ ID NO:69, SEQ ID NO:70, SEQ ID NO:71, SEQ ID NO:72 або SEQ ID NO:138 (або послідовність, що має 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, або 99 % або більше тотожності до будь - якої з SEQ ID NO:69, SEQ ID NO:70, SEQ ID NO:71, SEQ ID NO:72 або SEQ ID NO:138); змінний домен важкого ланцюга SEQ ID NO:59 (або послідовність, що має 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, 99 % або більше тотожності до нього) зі змінним доменом легкого ланцюга будь - якої однієї з SEQ ID NO:69, SEQ ID NO:70, SEQ ID NO:71, SEQ ID NO:72 або SEQ ID NO:138 (або послідовність, що має 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, або 99 % або більше тотожності до будь - якої з SEQ ID NO:69, SEQ ID NO:70, SEQ ID NO:71, SEQ ID NO:72 або SEQ ID NO:138); змінний домен важкого ланцюга SEQ ID NO:60 (або послідовність, що має 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, 99 % або більше тотожності до нього) зі змінним доменом легкого ланцюга будь - якої однієї з SEQ ID NO:69, SEQ ID NO:70, SEQ ID NO:71, SEQ ID NO:72 або SEQ ID NO:138 (або послідовність, що має 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, або 99 % або більше тотожності до будь - якої з SEQ ID NO:69, SEQ ID NO:70, SEQ ID NO:71, SEQ ID NO:72 або SEQ ID NO:138); змінний домен важкого ланцюга SEQ ID NO:61 (або послідовність, що має 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, 99 % або більше тотожності до нього) зі змінним доменом легкого ланцюга будь - якої однієї з SEQ ID NO:69, SEQ ID NO:70, SEQ ID NO:71, SEQ ID NO:72 або SEQ ID NO:138 (або послідовність, що має 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, або 99 % або більше тотожності до будь - якої з SEQ ID NO:69, SEQ ID NO:70, SEQ ID NO:71, SEQ ID NO:72 або SEQ ID NO:138); змінний домен важкого ланцюга SEQ ID NO:62 (або послідовність, що має 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, 99 % або більше тотожності до нього) зі змінним доменом легкого ланцюга будь - якої однієї з SEQ ID NO:69, SEQ ID NO:70, SEQ ID NO:71, SEQ ID NO:72 або SEQ ID NO:138 (або послідовність, що має 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, або 99 % або більше тотожності до будь - якої з SEQ ID NO:69, SEQ ID NO:70, SEQ ID NO:71, SEQ ID NO:72 або SEQ ID NO:138); змінний домен важкого ланцюга SEQ ID NO:64 (або послідовність, що має 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, 99 % або більше тотожності до нього) зі змінним доменом легкого ланцюга будь - якої однієї з 14 UA 104663 C2 5 10 15 20 25 30 35 40 45 50 55 60 SEQ ID NO:69, SEQ ID NO:70, SEQ ID NO:71, SEQ ID NO:72 або SEQ ID NO:138 (або послідовність, що має 75 %або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, або 99 % або більше тотожності до будь - якої з SEQ ID NO:69, SEQ ID NO:70, SEQ ID NO:71, SEQ ID NO:72 або SEQ ID NO:138); змінний домен важкого ланцюга SEQ ID NO:64 (або послідовність, що має 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, 99 % або більше тотожності до нього) зі змінним доменом легкого ланцюга будь - якої однієї з SEQ ID NO:69, SEQ ID NO:70, SEQ ID NO:71, SEQ ID NO:72 або SEQ ID NO:138 (або послідовність, що має 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, або 99 % або більше тотожності до будь - якої з SEQ ID NO:69, SEQ ID NO:70, SEQ ID NO:71, SEQ ID NO:72 або SEQ ID NO:138); змінний домен важкого ланцюга SEQ ID NO:65 (або послідовність, що має 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, 99 % або більше тотожності до нього) зі змінним доменом легкого ланцюга будь - якої однієї з SEQ ID NO:69, SEQ ID NO:70, SEQ ID NO:71, SEQ ID NO:72 або SEQ ID NO:138 (або послідовність, що має 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, або 99 % або більше тотожності до будь - якої з SEQ ID NO:69, SEQ ID NO:70, SEQ ID NO:71, SEQ ID NO:72 або SEQ ID NO:138); змінний домен важкого ланцюга SEQ ID NO:66 (або послідовність, що має 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, 99 % або більше тотожності до нього) зі змінним доменом легкого ланцюга будь - якої однієї з SEQ ID NO:69, SEQ ID NO:70, SEQ ID NO:71, SEQ ID NO:72 або SEQ ID NO:138 (або послідовність, що має 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, або 99 % або більше тотожності до будь - якої з SEQ ID NO:69, SEQ ID NO:70, SEQ ID NO:71, SEQ ID NO:72 або SEQ ID NO:138); змінний домен важкого ланцюга SEQ ID NO:67 (або послідовність, що має 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, 99 % або більше тотожності до нього) зі змінним доменом легкого ланцюга будь - якої однієї з SEQ ID NO:69, SEQ ID NO:70, SEQ ID NO:71, SEQ ID NO:72 або SEQ ID NO:138 (або послідовність, що має 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, або 99 % або більше тотожності до будь - якої з SEQ ID NO:69, SEQ ID NO:70, SEQ ID NO:71, SEQ ID NO:72 або SEQ ID NO:138); та змінний домен важкого ланцюга SEQ ID NO:68 (або послідовність, що має 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, 99 % або більше тотожності до нього) зі змінним доменом легкого ланцюга будь - якої однієї з SEQ ID NO:69, SEQ ID NO:70, SEQ ID NO:71, SEQ ID NO:72 або SEQ ID NO:138 (або послідовність, що має 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, або 99 % або більше тотожності до будь - якої з SEQ ID NO:69, SEQ ID NO:70, SEQ ID NO:71, SEQ ID NO:72 або SEQ ID NO:138). У окремому втіленні, передбачено антиген - зв'язуючий білок, що містить змінний регіон важкого ланцюга, що має амінокислотну послідовність, як наведено у SEQ ID NO:53, 54 55 або 56, та змінний регіон легкого ланцюга, що має амінокислотну послідовність, як наведено у SEQ ID NO:138. Зв'язуючий білок може бути антитілом, зокрема, гуманізованим антитілом або антитілом людини, або його антиген - зв'язуючим фрагментом. У іншому аспекті, винахід стосується химерного антитіла, що містить змінний домен важкого ланцюга SEQ ID NO:28 та змінний домен легкого ланцюга SEQ ID NO:29 або змінний домен важкого ланцюга SEQ ID NO:73 та змінний домен легкого ланцюга SEQ ID NO:74. Антиген - зв'язуючий білок винаходу може не інгібувати сигналування TSLP. У одному втіленні, антиген - зв'язуючий білок не інгібує сигналування TSLP. Винахід також стосується молекули нуклеїнової кислоти, що кодує антиген - зв'язуючий білок заявленого винаходу. У одному втіленні, винахід стосується молекули нуклеїнової кислоти SEQ ID NO:30-38, SEQ ID NO:75-113, SEQ ID NO:119-120, та SEQ ID NOs:122, 124, 126, 128 та 130. Винахід також передбачає вектор експресії, що містить молекулу нуклеїнової кислоти, як визначено тут та рекомбінантну клітину - хазяїна, що містить вектор експресії, як визначено тут. Вектор експресії може містити молекулу нуклеїнової кислоти будь - якого одного або декількох SEQ ID NO:30-38, SEQ ID NO:75-113, та SEQ ID NO:119-120, та SEQ ID NOs:122, 124, 126, 128 та 130. У одному втіленні, вектор експресії містить молекулу нуклеїнової кислоти, що кодує описаний тут антиген - зв'язуючий білок. У іншому втіленні, винахід стосується клітини - хазяїна, що містить описаний тут вектор експресії. У подальшому втіленні, винахід стосується антитіла, що експресується описаною тут клітиною - хазяїном. 15 UA 104663 C2 5 10 15 20 25 30 35 40 45 50 55 60 Винахід також передбачає спосіб отримання антиген - зв'язуючого білка заявленого винаходу, що полягає у культивуванні описаних тут клітин - хазяїв та у відновленні антиген зв'язуючого білка. Винахід також стосується антитіла або антиген - зв'язуючого білка відповідно до винаходу, що експресується клітиною - хазяїном, що містить послідовність нуклеїнової кислоти або послідовність, що кодує антитіло або антиген - зв'язуючий фрагмент відповідно до винаходу. Винахід також стосується фармацевтичної композиції, що містить антиген - зв'язуючий білок заявленого винаходу та фармацевтично - прийнятний носій або наповнювач. Винахід також стосується способу лікування суб'єкта, що страждає від автоімунного або запального захворювання, що, зокрема, полягає у введенні суб'єкту антиген - зв'язуючого білка заявленого винаходу. Винахід також стосується способу лікування суб'єкта, що страждає від захворювання, до якого залучені патогенні клітини T H17, який, зокрема, полягає у введенні суб'єкту антиген зв'язуючого білка заявленого винаходу. Винахід також стосується способу лікування суб'єкта, що страждає від захворювання, пов'язаного з активуванням експресії IL-17, що, зокрема, полягає у введенні суб'єкту антиген зв'язуючого білка заявленого винаходу. Зокрема, автоімунні або запальні захворювання, захворювання, до яких залучені патогенні клітини TH17 або захворювання, пов'язані з активуванням (підвищеним регулюванням) експресії IL17 можуть охоплювати розсіяний склероз (MS), системний червоний вовчак, ревматоїдний артрит, хворобу Бехчета або астму. У одному втіленні, антиген - зв'язуючий білок винаходу буде корисним у способі лікування розсіяного склерозу. Інші захворювання, що можна лікувати введенням антиген - зв'язуючих білків винаходу описані тут. Винахід також стосується описаного тут антиген - зв'язуючого білка для застосування у лікуванні суб'єкта, що страждає від автоімунного або запального захворювання; захворювання, до якого залучені патогенні клітини TH17; або захворювання, пов'язаного з активуванням експресії IL-17. винахід стосується застосування описаного тут антиген - зв'язуючого білка у виробництві медикаментів для застосування у лікуванні суб'єкта, що страждає від автоімунного або запального захворювання; захворювання, до якого залучені патогенні клітини TH17; або захворювання, пов'язаного з активуванням експресії IL-17. Інші аспекти та втілення винаходу будуть очевидні з наступного докладного опису. Стислий опис фігур. Фіг. 1 показує комплемент - залежну цитотоксичність анти - IL7R mAb 1A11 H3L4 у клітинах HEK293, що експресують hIL-7R. Фіг. 2 показує залежну від антитіла клітинно - опосередковану цитотоксичність гуманізованих анти - IL7R mAb 1A11 H3L4 та Fc - позбавлених анти - IL7R mAb (1A11 H3L4Fc) у клітинах HEK293, що експресують hIL-7R у присутності мононуклеарних клітин периферичної крові. Фіг. 3A та 3B показують інгібування індукованого IL-7 STAT5 фосфорилування за допомогою 1A11 H3L4 у МКПК людини, надане двома окремими донорами. Фіг. 4A-4D показують інгібування індукованого IL-7 продукування IL-17 у диференційованих клітинах Th17 за допомогою 1A11 H3L4 (у чотирьох різних донорів). Фіг. 5A-5E показує, що 1A11 H3L4 не впливають на TSLP - індукування TARC (регульованого хемокіну тимусу та активації). Сигналування IL-7/IL-7R є критично необхідним для виживання та поширення комітованих клітин TH17 у людинних та мишачих системах, в той час, як його роль у диференціації TH17, порівняно з IL-6, є не дуже важливою (Liu et al, (2010) Nature Medicine 16:191-197). Неочікувано, дія антагонізму IL-7R на імунну систему in vivo показала високу вибірковість у EAE, тваринній моделі для розсіяного склерозу, уражаючи клітини TH17 та, у меншій мірі, клітини TH1 переважно фенотипу пам'яті та підтримуючих клітин T reg. Схоже, ця вибірковість відіграє важливу роль у співвідношенні балансу патогенних клітин TH17 та клітин Treg під дією антагонізму IL-7R у EAE та цим пояснюється лікувальна ефективність. Роль сигналування IL-7/IL-7R у виживанні та поширенні клітин T H17 підтримує лікувальну ефективність антагонізму IL-7R у автоімунних захворюваннях людини, як - то MS. Нейтралізування IL-7 або антагонізму IL-7R, ймовірно, мають унікальні терапевтичні переваги. З одного боку, лікування пропонує вибірковість, що відокремлює патогенні клітини T H1 та TH17 від Treg та неспоріднених імунних клітин. З іншого боку, додаткові терапевтичні переваги IL-7R антагонізму залучають його селективну дію до процесу виживання та поширення диференційованих клітин TH17 у порівнянні з диференціацією T H17. Цілком можливо, що таргетинг підтримування in vivo комітованих T H17 у порівнянні з диференціацією TH17 є більш 16 UA 104663 C2 5 10 15 20 25 30 35 40 45 50 55 60 ефективним у терапевтичному контексті. Отже, інгібування сигналування, опосередкованого рецептором IL-7 передбачає перспективне терапевтичне втручання для лікування автоімунних або запальних захворювань. Застосований тут термін "сигналування, опосередковане IL-7", має відношення до біологічної дії, спричиненої рецепторним комплексом IL-7 при його зв'язуванні до свого ліганду IL-7. Отже, сигналування, опосередковане IL-7 охоплює, але без обмеження, одне або декілька або все з наступного, а саме: індуковане IL-7 фосфорилювання STAT-5, індуковане IL-7 поширення TH17 клітин та індуковане IL-7 виживання TH17 клітин. Мишачі антитіла 1A11 та 6A3 описані у патентній заявці PCT/US2009/053136 (WO2010/017468). Ці антитіла специфічно зв'язуються з альфа - ланцюгом рецептора IL-7 людини CD127 (SEQ ID NO:1). Змінні домени цих антитіл описані у SEQ ID NO:8 та 9 (VH, Vκ 1A11, відповідно) та у SEQ ID NO:45 та 46 (VH, Vκ 6A3, відповідно). Заявлений винахід стосується антиген - зв'язуючих білків, що містять один або декілька регіонів, що визначають компліментарність (CDR) 1A11 або 6A3 та їх варіанти. Білки, що зв'язують антиген можуть втручатися до та нейтралізувати сигналування IL-7R. У одному втіленні, винахід стосується гуманізованого антитіла, що містить 1-6 CDR мишачих антитіл 1A11 або 6A3 (донорне антитіло) у акцепторному антитілі людини. Термін "антиген - зв'язуючий білок", як тут застосовано, стосується антитіл, фрагментів антитіл та інших білкових констрактів, як - то доменів, що здатні зв'язуватися з CD127. У одному втіленні, антиген - зв'язуючий білок є антитілом. Термін "антитіло", застосований тут у широкому сенсі, має відношення до молекули з подібним до імуноглобуліну доменом та охоплює моноклональні, рекомбінантні, поліклональні, химерні, гуманізовані, біспеціфічні та гетерокон'югатні антитіла; одиничний змінний домен, доменне антитіло, антиген - зв'язуючі фрагменти, імунологічно ефективні фрагменти, одиноланцюговий змінний фрагмент (single chain Fv), діатіла, Tandabs™, тощо (стосовно переліку альтернативних форматів "антитілa", див. Holliger and Hudson, Nature Biotechnology, 2005, Vol 23, No. 9, 1126-1136). Фраза "одиничний змінний домен" стосується змінного домену антиген - зв'язуючого білка (наприклад, VH, VHH, VL), що специфічно зв'язує антиген або епітоп незалежно від іншого змінного регіону або домену. "Доменне антитіло" або "dAb" може вважатися тим же, що й "одиничний змінний домен", яке є здатним до зв'язування антигену. Одиничний змінний домен може бути змінним доменом антитіла людини, але також охоплює одиничні змінні домени антитіл від інших видів, як - то гризунів (наприклад, як викладено у WO 00/29004), акули - няньки та VHH dAb верблюдових. VHH верблюдових є поліпептидами імуноглобулінового одиничного змінного домену, що походять від видів тварин, як - то, верблюду, лами, альпаки, дромадеру та гуанако, що продукують антитіла важкого ланцюга, природно позбавлені легких ланцюгів. Такі домени V HH можна гуманізовати за допомогою прийнятних у цій галузі способів та подібні домени вважаються "доменними антитілами". Як тут застосовано, термін VH охоплює домени VHH верблюдових. Як тут застосовано, термін "домен" стосується згорнутої білкової структури, що має третинну структуру незалежно від залишку білка. Головним чином, домени відповідають за дискретні функціональні властивості білків та у багатьох випадках їх можна додати, видалити або перенести до інших білків без втрати функції іншої частини білка та/або домену. "Одиничний змінний домен" є згорнутим поліпептидним доменом, що містить характерні послідовності змінних доменів антитіл. У зв'язку з цим, вони охоплюють повні змінні домени антитіла та модифіковані змінні домени, наприклад, де одна або декілька петель заміщені послідовностями, що не є характерними для змінних доменів антитіл або змінні домени антитіл, що усічені або містять N - або C - термінальні розширення, а також згорнуті фрагменти змінних доменів, що зберігають принаймні зв'язувальну активність та специфічність повнорозмірного домену. Домен може зв'язувати антиген або епітоп незалежно від іншого змінного регіону або домену. Антиген - зв'язуючий фрагмент можна отримати розташуванням одного або декількох CDR на білкових каркасних структурах (скафолдах), як - то домен, що не мають відношення до антитіл. Подібна білкова каркасна структура або домен, що не мають відношення до антитіл є суб'єктом, якого можна піддати білковій інженерії для отримання зв'язування з лігандом, що буде іншим, ніж його природний ліганд. Наприклад, домен, що є похідною від скафолда, вибраного від: CTLA-4 (Evibody); ліпокаїну; молекули - похідної білка А, як - то Z - домену білка A (Affibody, SpA), A - домену (Avimer/Maxibody); білків теплового шоку, наприклад, GroEl та GroES; трансферину (trans-body); білку анкірину, що повторюється (DARPin); пептидного аптамеру; лектинового домену C - типу (тетранектин); - кристаліну людини та убіквітину 17 UA 104663 C2 5 10 15 20 25 30 35 40 45 50 55 60 людини (афіліни); PDZ доменів; доменів - інгібіторів протеази людини токсину скорпіону (Кунітц - типу) та фібронектину (аднектин), можна піддати білковій інженерії для отримання зв'язування з лігандом, що буде іншим, ніж його природний ліганд. CTLA-4 (цитотоксичний пов'язаний з Т - лімфоцитами антиген 4) є рецептором родини CD28, що експресується у більшості CD4+T - клітин. Його зовнішньоклітинний домен має змінну подібну до домену Ig - конформацію. Петлі, що відповідні CDR антитіл можуть бути заміщені на гетерологічну послідовність для надання інших зв'язувальних властивостей. Молекули CTLA-4, створені для отримання інших зв'язувальних особливостей також відомі під назвою Евібоді (Evibodies). (більш докладно, див. Journal of Immunological Methods 248 (1-2), 31-45 (2001). Ліпокаїни є родиною зовнішньоклітинних білків, що транспортують маленькі гідрофобні молекули, як - то стероїди, біліни, ретиноїди та ліпіди. Вони мають жорстку - складчасту вторинну структуру з кількома петлями на відкритому кінці канонічної структури, що можна перебудувати для зв'язування з іншими цільовими антигенами. Антикаліни мають розмір біля 160-180 амінокислот та походять від ліпокаїнів. Більш детально див. Biochim Biophys Acta 1482: 337-350 (2000), US7250297B1 та US20070224633. Афібоді (Affibody) є скафолдом, що походить від білка A Staphylococcus aureus, що можна перебудувати для зв'язування з антигеном. Домен складається з трьохспирального вузла у приблизно 58 амінокислот. За допомогою рандомізації поверхневих залишків були отримані бібліотеки. Більш детально, див. Protein Eng. Des. Sel. 17, 455-462 (2004) and EP1641818A1. Авимери є мультидоменними білками, що походять від родини A - доменного скафолду. Нативні домени у приблизно 35 амінокислот мають визначену структуру з дисульфідними зв'язками. Різноманітність утворюється за рахунок перебудування природної варіації, притаманній родині A - доменів. Більш детально, див. Nature Biotechnology 23(12), 1556-1561 (2005) та Expert Opinion on Investigational Drugs 16(6), 909-917 (June 2007). Трансферин є мономерним сироватковим транспортним глікобілком. Трансферини можна сконструювати для зв'язування інших антигенів - мішеней встроюванням пептидних послідовностей, наприклад, одного або декількох CDR, у прийнятну поверхню петлі. Стосовно прикладів побудованих трансферинових скафолдів, в тому числі, транс - тіл (Trans-body) див. у J. Biol. Chem 274, 24066-24073 (1999). Штучні анкіринові білки, що повторюються (DARPins) походять від анкірину, що є родиною білків, яка опосередкує прикріплення інтегральних мембранних білків до цитоскелету. Одиничний анкіриновий повтор являє собою структуру у 33 залишку, що містить дві - спиралі та - вигин. Ці білки можна отримати для зв'язування інших цільових антигенів шляхом: рандомізації залишків у першій - спиралі та - вигині кожного повтору; або встроюванням пептидних послідовностей, наприклад, одного або декількох CDR. Їх зв'язувальний інтерфейс можна розширити за рахунок збільшення кількості модулів (спосіб спорідненого дозрівання). Більш детально, див.J. Mol. Biol. 332, 489-503 (2003), PNAS 100(4), 1700-1705 (2003) and J. Mol. Biol. 369, 1015-1028 (2007) and US20040132028A1. Фібронектин є скафолдом, розробленим для зв'язування до антигену. Аднектини складаються зі скелетної природної амінокислотної послідовності десятого домену у 15 повторів одиниць фібронектину типу III (FN3) людини. Можна сконструювати три петлі на одному кінці сандвіча, щоб дозволити аднектину специфічно впізнавати терапевтичну інтересуючу ціль. Більш детально, див. Protein Eng. Des. Sel. 18, 435-444 (2005), US20080139791, WO2005056764 and US6818418B1. Пептидні аптамери є комбінаторними молекулами визнання, що складаються з постійного скафолд - білка, звичайно, тиреодоксину (TrxA), що містить закріплену змінну пептидну петлю, вставлену у активний сайт. Більш детально, див. Expert Opin. Biol. Ther. 5, 783-797 (2005). Мікротіла походять від мікробілків довжиною у 25-50 амінокислот, що природно зустрічаються та містять 3-4 цистеїнових моста; приклади мікробілків охоплюють KalataB1, конотоксини та інгібітори цистеїнових вузлів (knottins). Мікробілки мають петлю, що можна застосувати для включення до 25 амінокислот без шкоди для загальної структури мікробілка. Стосовно додаткових деталей сконструйованих вузлових доменів, див WO2008098796. Інші зв'язуючі домени охоплюють білки, що можна застосувати у якості скафолда для отримання інших зв'язувальних властивостей цільового антигену, що охоплюють - кристалін та убіквітин (афіліни), домени інгібіторів протеази людини (Кунітц - типу), PDZ - домени Ras зв'язуючого білка AF-6, токсин скорпіону (чарибдотоксин), домен лектину C - типу (тетранектини) розглядаються у Chapter 7-Non-Antibody Scaffolds from Handbook of Therapeutic Antibodies (2007, edited by Stefan Dubel) and Protein Science 15:14-27 (2006). Зв'язуючі домени заявленого винаходу можуть походити від будь - якого з цих альтернативних білкових доменів та будь - якої комбінації CDR заявленого винаходу, щеплених у домен. 18 UA 104663 C2 5 10 15 20 25 30 35 40 45 50 55 60 Антиген - зв'язуючий фрагмент або імунологічно - ефективний фрагмент може містити часткові змінні послідовності важкого або легкого ланцюга. Фрагменти дорівнюють принаймні у 5, 6, 8 або 10 амінокислот довжиною. Альтернативно, фрагменти мають у довжину принаймні 15, принаймні 20, принаймні 50, принаймні 75, або принаймні 100 амінокислот. Термін "специфічно зв'язує", застосований у цій заявці щодо антиген - зв'язуючих білків означає, що антиген - зв'язуючий білок зв'язується з CD127 з відсутністю або незначною прив'язкою до інших (наприклад, неспоріднених) білків, тобто, описані тут антиген - зв'язуючі білки та антитіла можуть специфічно зв'язувати CD127. Однак, цей термін не виключає факту, що білки, що зв'язують антиген можуть також бути перехресно - реактивними з CD127 від інших видів, як - то мишачими CD127, CD127 макаки - крабоїда (Macaca fascicularis) або мармозетки. У одному втіленні, антиген - зв'язуючий білок зв'язує CD127 макаки - крабоїда та CD127 мармозетки. Описані тут антиген - зв'язуючі білки можуть зв'язуватися з CD127 людини з принаймні у 2, 5, 10, 50, 100, або 1000 разів більшою афінністю, ніж вони зв'язуються з CD127 від інших видів. Афінність зв'язування або рівноважна константа дисоціації (K D) взаємодії антиген зв'язуючого білка з CD127 може дорівнювати 100 нM або менше, 10 нM або менше, 2 нM або менше або 1 нM або менше. Альтернативно, KD може дорівнювати 5-10 нM; або 1-2 нM. KD може бути у діапазоні 1 пM-500 пM; або 500 пM-1 нM. Афінність зв'язування антиген зв'язуючого білка визначають константою швидкості асоціації (k a) та константою швидкості TM дисоціації (kd) (KD=kd/ka). Афінність зв'язування можна виміряти за допомогою BIAcore , наприклад, захопленням антигену з CD127, з'єднаним з чіпом CM5 шляхом з'єднання TM первинного аміну та захопленням антитіла на його поверхні. Спосіб BIAcore , описаний у Прикладі 4 можна застосувати для вимірювання афінності зв'язування. Альтернативно, афінність зв'язування можна виміряти за допомогою FORTEbio, наприклад, захопленням антигену з CD127, з'єднаним з голкою CM5 шляхом з'єднання первинного аміну та захопленням антитіла на його поверхні. -3 -1 -4 -1 -5 -1 kd може бути 1 × 10 s або менше, 1 × 10 s або менше, або 1 × 10 s або менше. kd -5 -1 -4 -1 -4 -1 -3 -1 може бути між 1 × 10 s та 1 × 10 s ; або між 1 × 10 s та 1 × 10 s . Низька kd може бути результатом повільної дисоціації антиген - зв'язуючого комплексу білок - ліганд та підвищеної нейтралізації ліганда. Фахівцям зрозуміло, що термін "що походить" призначений для визначення не тільки джерела в сенсі фізичного походження матеріалу, але й для визначення матеріалу, що є структурно ідентичним, але походить від еталонного джерела. Отже, "залишки, знайдені у донорному антитілі" не обов'язково повинні були очищені від донорного антитіла. При виділенні передбачається, що молекули, як - то антиген - зв'язуючий білок, виділяють з середовища, в якому його можна знайти в природі. Наприклад, молекули можна очистити від субстанцій, з якими вони звичайно є присутніми у природі. Наприклад, антиген - зв'язуючий білок можна очистити до принаймні 95 %, 96 %, 97 %, 98 % або 99 % або більше по відношенню до культурального середовища, що містить антиген - зв'язуючий білок. Антиген - зв'язуючі білки та антитіла заявленого винаходу можуть бути виділеними антиген - зв'язуючими білками та антитілами. "Химерне антитіло" стосується типу штучно створеного антитіла, що містить змінний регіон, що зустрічається у природі (легкий ланцюг та важкі ланцюги), отриманий з донорного антитіла у поєднанні з постійними регіонами легкого та важкого ланцюга, отриманого від акцепторного антитіла. "Гуманізоване антитіло" стосується типу штучно створеного антитіла, що має один або декілька CDR, отриманих від донорного імуноглобуліну нелюдинного походження, де - @ частин молекули імуноглобулінового походження є отриманою від одного або декількох імуноглобулін (ів) людини. На додачу, підтримуючі залишки каркасного регіону можна змінити зі збереженням афінності зв'язування (див., наприклад, Queen et al. Proc. Natl Acad Sci USA, 86:10029-10032 (1989), Hodgson et al. Bio/Technology, 9:421 (1991)). Прийнятне людське акцепторне антитіло можна вибрати з загальноприйнятної бази даних, наприклад, з баз даних KABAT® database, Los Alamos database, та Swiss Protein database, по тотожності до нуклеотидної та амінокислотних послідовностей донорного антитіла. Антитіло людини, що характеризується тотожністю до каркасних регіонів донорного антитіла (на амінокислотній основі) може бути прийнятним для надання сталого регіону важкого ланцюга та/або змінного каркасного регіону важкого ланцюга для встроювання донорних CDR. Прийнятне акцепторне антитіло, здатне віддати сталий або змінний каркасний регіони легкого ланцюга можна вибрати подібним чином. Слід зазначити, що 19 UA 104663 C2 5 10 15 20 25 30 35 40 45 важкий та легкий ланцюги акцепторного антитіла не обов'язково можуть походити від того ж самого акцепторного антитіла. Попередні дослідники описують певні шляхи отримання таких гуманізованих антитіл, див. наприклад, EP-A-0239400 та EP-A-054951. Термін "донорне антитіло" стосується антитіла, що надає першому імуноглобуліновому партнеру амінокислотні послідовності своїх змінних регіонів, один або декілька CDR або інші функціональні фрагменти або їх аналоги. Отже, донор надає змінений імуноглобуліновий кодуючий регіон, що веде до експресії зміненого антитіла з антигенною специфічністю та нейтралізування активності, притаманній донорному антитілу. Термін "акцепторне антитіло" стосується антитіла, яке є гетерологічним до донорного антитіла, що надає всі (або будь - яку частину) амінокислотні послідовності, що кодують його каркасні регіони важкого та/або легкого ланцюга та/або його сталі регіони важкого та/або легкого ланцюга першому імуноглобуліновому партнеру. Антитіло людини може бути акцепторним антитілом. Застосовані тут терміни "VH" та "VL" мають відношення до змінного регіону важкого ланцюга та змінного регіону легкого ланцюга відповідно антиген - зв'язуючого білка. Vκ також застосовують відносно змінного домену легкого ланцюга. "CDR" являють собою регіони, що визначають компліментарність амінокислотних послідовностей. Вони ще мають назву гіперваріабельних регіонів імуноглобулінового важкого та легкого ланцюгів. У змінній частині імуноглобуліну існують три CDR важкого ланцюга та три CDR легкого ланцюга (або регіону CDR). Таким чином, "CDR", як тут застосовано, стосується всіх трьох важколанцюгових CDR, всіх трьох легколанцюгових CDR, всіх CDR важкого та легкого ланцюгів або принаймні двох CDR. У цій заявці, амінокислотні залишки послідовностей змінного домену та послідовностей повнорозмірних антитіл пронумеровані, якщо не вказано іншого, відповідно нумерації Kabat. Так само, застосовані у Прикладах терміни "CDR", "CDRL1", "CDRL2", "CDRL3", "CDRH1", "CDRH2", "CDRH3" наведені відповідно нумерації Kabat. Для додаткової інформації, див. Kabat et al., Sequences of Proteins of Immunological Interest, 4th Ed., U.S. Department of Health and Human Services, National Institutes of Health (1987). Фахівцям зрозуміло, що для амінокислотних залишків послідовностей змінного домену та послідовностей повнорозмірних антитіл існують альтернативні системи нумерації. Також існують альтернативні системи нумерації для послідовностей CDR, наприклад, наведені у Chothia et al. (1989) Nature 342: 877-883. Структура та білкова конфігурація (фолдинг) антитіла може означати, що інші залишки розглядаються, як частина послідовності CDR та це буде зрозумілим для фахівця. Отже, застосований тут термін "відповідний CDR" має відношення до послідовності CDR з застосуванням будь - якої прийнятної системи нумерації, наприклад, наведеної у Таблиці 1. Інші доступні фахівцям системи нумерації для послідовностей CDR охоплюють "AbM" (University of Bath) та "Сontact" (University College London). Мінімальний перекриваючийся регіон для забезпечення "мінімальної одиниці зв'язування" може бути визначений з застосуванням щонайменш двох з систем нумерації Kabat, Chothia, AbM та contact. Мінімальною одиницею зв'язування може бути субчастина CDR. Таблиця 1 нижче являє собою одне визначення застосування кожної системи нумерації для кожного CDR або одиниці зв'язування. До номеру амінокислотної послідовності змінного домену у Таблиці 1 застосовано схему нумерації Kabat. Слід зазначити, що деякі з визначень CDR можуть змінюватись в залежності від конкретної застосованої публікації. Таблиця 1 Kabat CDR H1 H2 H3 L1 L2 L3 31-35/35A/35B 50-65 95-102 24-34 50-56 89-97 Chothia CDR 26-32/33/34 52-56 95-102 24-34 50-56 89-97 AbM CDR 26-35/35A/35B 50-58 95-102 24-34 50-56 89-97 Contact CDR 30-35/35A/35B 47-58 93-101 30-36 46-55 89-96 мінімальна одиниця зв'язування 31-32 52-56 95-101 30-34 50-55 89-96 Як тут застосовано, термін "сайт зв'язування антигену" стосується сайту антиген 20 UA 104663 C2 5 10 15 20 25 30 35 40 45 50 55 60 зв'язуючого білка, що здатен специфічно зв'язуватися з антигеном. Це може бути одиничний домен (наприклад, епітоп - зв'язуючий домен) або домени одноланцюгових варіабельних фрагментів (ScFv) або це можуть бути спаровані VH/VL домени, що можна знайти у стандартному антитілі. Термін "епітоп", як тут застосовано, стосується частини антигену, що створює контакт з окремим доменом зв'язування антиген - зв'язуючого білка. Епітоп може бути лінійним, що містить по суті лінійну амінокислотну послідовність антигену. Альтернативно, епітоп може бути конформаційним або преривчастим. Наприклад, конформаційний епітоп містить амінокислотні залишки, що потребують елемент структурного обмеження. Преривчастий епітоп містить амінокислотні залишки, що відокремлені іншими послідовностями, тобто, не являють собою безперервну послідовність у первинній послідовності антигену. У контексті третинної та четвертинної структур антигену, залишки преривчастого епітопу знаходяться достатньо близько один до одного для зв'язування антиген - зв'язуючим білком. Для нуклеотидної та амінокислотної послідовностей, термін "ідентичний" (тотожній) або "ідентичність послідовності" вказує на рівень ідентичності між двома послідовностями нуклеїнової кислоти або двома амінокислотними послідовностями та, в разі необхідності, коли вони піддані оптимальному вирівнюванню та порівнянню з відповідними видаленнями та вставками. Відсоток ідентичності між двома послідовностями є функцією кількості ідентичних позицій, що зустрічаються у послідовностях (тобто, % ідентичності = кількість ідентичних позицій / загальна кількість кількість позицій, помножена на 100), беручи до уваги кількість пробілів та довжину кожного пробілу, що необхідно ввести для оптимального вирівнювання двох послідовностей. Порівняння послідовностей та визначення відсотку тотожності між двома послідовностями можна здійснити з застосуванням математичного алгоритму, як описано нижче. Відсоток тотожності між двома нуклеотидними послідовностями можна здійснити за допомогою програми GAP у наборі програмного забезпечення GCG software package, з застосуванням матриці обчислення по замовчуванню NWSgapdna.CMP з вагою пробілу 40, 50, 60, 70 або 80 та з вагою довжини 1, 2, 3, 4, 5, або 6. Відсоток тотожності між двома нуклеотидними або амінокислотними послідовностями також можна визначити з застосуванням алгоритму від E. Meyers та W. Miller (Comput. Appl. Biosci., 4:11-17 (1988)), включеного у програму ALIGN (версія 2.0), з застосуванням таблиці ваги залишку PAM120, зі штрафом за подовження пробілу, що дорівнює 12 та зі штрафом за пробіл у послідовності, що дорівнює 4. Крім того, відсоток тотожності між двома амінокислотними послідовностями можна визначити з застосуванням алгоритму від Needleman та Wunsch (J. Mol. Biol. 48:444-453 (1970)), включеного у програму GAP у наборі програмного забезпечення GCG software package, з застосуванням або матриці Blossum 62 або матриці PAM250, з вагою пробілу 16, 14, 12, 10, 8, 6, або 4 та з вагою довжини 1, 2, 3, 4, 5, або 6. У одному способі, як тут описано, полінуклеотидна послідовність може бути тотожною до референсної (еталонної) полінуклеотидної послідовності (див., наприклад, SEQ ID NO: 30-39, SEQ ID NO:76-105),що буде мати 100 % тотожності або вона може включати в себе певне ціле число нуклеотидних змінень у порівнянні з еталонною послідовністю, наприклад, мати щонайменше 50, 60, 70, 75, 80, 85, 90, 95, 98, або 99 % тотожності. Такі змінення є вибраними від принаймні однієї нуклеотидної делеції, заміщення, в тому числі транзиції, трансверсії або вставки та вказані змінення можуть траплятися у 5' або 3' термінальних позиціях референсної нуклеотидної послідовності або будь - де між цими термінальними позиціями або індивідуально перемежаючись серед нуклеотидів у референсній послідовності або у одній або у декількох суміжних групах у референсній послідовності. Кількість нуклеотидних заміщень визначають множенням загальної кількості нуклеотидів у референсній полінуклеотидній послідовності, як тут описано (див, наприклад, SEQ ID NO: 30-39, SEQ ID NO:76-105), на чисельний відсоток відповідного відсотку тотожності (поділений на 100) та відніманням цього значення від вказаної загальної кількості нуклеотидів у еталонній полінуклеотидній послідовності, як тут описано (див., наприклад SEQ ID NO: 30-39, SEQ ID NO:76-105), або: nn xn - (xny), де nn є кількістю нуклеотидних змінень, xn є загальною кількістю нуклеотидів у референсній полінуклеотидній послідовності, як тут описано (див., наприклад, SEQ ID NO: 30-39, SEQ ID NO:76-105), та y дорівнює 0.50 для 50 %, 0.60 для 60 %, 0.70 для 70 %, 0.75 для 75 %, 0.80 для 80 %, 0.85 для 85 %, 0.90 для 90 %, 0.95 для 95 %, 0.98 для 98 %, 0.99 для 99 % або 1.00 для 100 %, є символом операції множення та де будь - який нецілий продукт x n та y округлюють до найближчого цілого числа перед його вирахуванням від x n. 21 UA 104663 C2 5 10 15 20 25 30 Так само, поліпептидна послідовність теж може бути тотожною до поліпептидної референсної (еталонної) послідовності, як тут описано (див., наприклад, SEQ ID NO:1-29, SEQ ID NO:40-75), що буде мати 100 % тотожності, або вона може включати в себе певне ціле число амінокислотних змінень у порівнянні з еталонною послідовністю, щоб відсоток тотожності був меншим, ніж 100 %, як - то мав принаймні 50, 60, 70, 75, 80, 85, 90, 95, 98, або 99 % тотожності. Такі змінення є вибраними від групи, що охоплює принаймні oдну амінокислотну делецію, заміщення, в тому числі, консервативне або неконсервативне заміщення або вставку де вказані змінення можуть траплятися у N - або C - термінальних позиціях референсної поліпептидної послідовності або будь - де між цими термінальними позиціями, або індивідуально перемежаючись серед амінокислот у референсній послідовності або у одній або у декількох суміжних групах у референсній послідовності. Кількість амінокислотних змінень для даного відсотку тотожності визначають множенням загальної кількості амінокислот у поліпептидній послідовності у поліпептидної референсної послідовності, як тут описано (див., наприклад, SEQ ID NO:1-29, SEQ ID NO:40-75) на чисельний відсоток відповідного відсотку тотожності (поділений на 100) та відніманням цього значення від вказаної загальної кількості амінокислот у поліпептидній референснійi послідовності, як тут описано (див., наприклад, SEQ ID NO:1-29, SEQ ID NO:40-75) або: na xa - (xay), де na є кількістю амінокислотних змінень, xa є загальною кількістю амінокислот у референсній поліпептидній послідовності, як тут описано (див., наприклад, SEQ ID NO:1-29, SEQ ID NO:40-75), та y дорівнює 0.50 для 50 %, 0.60 для 60 %, 0.70 для 70 %, 0.75 для 75 %, 0.80 для 80 %, 0.85 для 85 %, 0.90 для 90 %, 0.95 для 95 %, 0.98 для 98 %, 0.99 для 99 %, або 1.00 для 100 %, є символом операції множення та де будь - який нецілий продукт xa та y округлюють до найближчого цілого числа перед його вирахуванням від xa. Відсоток ідентичності можна визначити по всій довжині послідовності або її будь - яких фрагментів; та з або без будь - яких вставок або делецій. Кожний з термінів "пептид", "поліпептид" та "білок" стосується молекул, що містять дві або більше амінокислотних залишків. Пептид може бути мономерним або полімерним. Фахівцям добре зрозуміло, що деякі амінокислотні заміщення розглядаються, як "консервативні". Амінокислоти поділяють на групи на основі загальних властивостей бічного ланцюга та заміщення всередині груп, що зберігають всю або практично всю зв'язувальну афінність антиген - зв'язуючого білка розглядаються як консервативні заміщення, див. Таблицю 2 нижче: Таблиця 2 Бічний ланцюг гідрофобні Нейтральні гідрофільні Кислі Основні Залишки, що впливають на орієнтацію ланцюга Ароматичні Члени met, ala, val, leu, ile cys, ser, thr asp, glu asn, gln, his, lys, arg gly, pro trp, tyr, phe 35 40 45 50 Заявлений винахід стосується антиген - зв'язуючого білка, що зв'язується з CD127 та містить CDRH3 SEQ ID NO:4; варіант її CDRH3 або CDRH3 SEQ ID NO:132-SEQ ID NO:137. Антиген - зв'язуючий білок може специфічно зв'язуватися з CD127 та може також нейтралізовувати активність IL-7R. Заявлений винахід також стосується антиген - зв'язуючого білка, що зв'язується з CD127 та містить CDRH2 SEQ ID NO:3; або варіант її CDRH2. Антиген - зв'язуючий білок може специфічно зв'язуватися з CD127 та може також нейтралізовувати активність IL-7R. Антиген - зв'язуючий білок може містити на додачу до описаних вище послідовностей CDRH3 або CDRH2 ще один або декілька CDR, або всі CDR, у будь - якій комбінації, вибрані від: CDRH1 (SEQ ID NO:2), CDRH2 (SEQ ID NO:3), CDRH3 (SEQ ID NO:4 або від будь - якої з SEQ ID NO: 132-SEQ ID NO:137), CDRL1 (SEQ ID NO:5), CDRL2 (SEQ ID NO:6), та CDRL3 (SEQ ID NO:7); або варіанти будь - яких вказаних CDR. Наприклад, антиген - зв'язуючий білок може містити CDRH3 (SEQ ID NO:4) та CDRH1 (SEQ ID NO:2) або їх варіанти. Антиген - зв'язуючий білок може містити CDRH3 (SEQ ID NO:4) та CDRH2 (SEQ ID NO:3) або їх варіанти. Антиген - зв'язуючий білок може містити CDRH1 (SEQ ID NO:2) та CDRH2 (SEQ ID NO:3), та CDRH3 (SEQ ID NO:4) або їх варіанти. 22 UA 104663 C2 5 10 15 20 25 30 35 40 45 50 55 60 Антиген - зв'язуючий білок може містити CDRL1 (SEQ ID NO:5) та CDRL2 (SEQ ID NO:6) або їх варіанти. Антиген - зв'язуючий білок може містити CDRL2 (SEQ ID NO:6) та CDRL3 (SEQ ID NO:7) або їх варіанти. Антиген - зв'язуючий білок може містити CDRL1 (SEQ ID NO:5), CDRL2 (SEQ ID NO:6) та CDRL3 (SEQ ID NO:7) або їх варіанти. Антиген - зв'язуючий білок може містити CDRH3 (SEQ ID NO:4) та CDRL3 (SEQ ID NO:7) або їх варіанти. Антиген - зв'язуючий білок може містити CDRH3 (SEQ ID NO:4), CDRH2 (SEQ ID NO:3) та CDRL3 (SEQ ID NO:7) або їх варіанти. Антиген - зв'язуючий білок може містити CDRH3 (SEQ ID NO:4), CDRH2 (SEQ ID NO:3), CDRL2 (SEQ ID NO:6) та CDRL3 (SEQ ID NO:7) або їх варіанти. Антиген - зв'язуючий білок може містити CDRH1 (SEQ ID NO:2), CDRH2 (SEQ ID NO:3), CDRH3 (SEQ ID NO:4), CDRL1 (SEQ ID NO:5), CDRL2 (SEQ ID NO:6) та CDRL3 (SEQ ID NO:7). Альтернативно, можуть бути присутні варіантні CDR або CDRH3 SEQ ID NO:4 можна замінити будь - яким з CDR SEQ ID NO:132-137. Заявлений винахід стосується антиген - зв'язуючого білка, що зв'язується з CD127 та містить CDRH3 SEQ ID NO:41; або його варіантний CDRH3. Антиген - зв'язуючий білок може також нейтралізовувати активність IL-7R. Заявлений винахід також стосується антиген - зв'язуючого білка, що зв'язується з CD127 та містить CDRH2 SEQ ID NO:40; або його варіантний CDRH2. Антиген - зв'язуючий білок може також нейтралізовувати активність IL-7R… Антиген - зв'язуючий білок може на додачу до вищеописаних послідовністей CDRH3 або CDRH2 містити ще один або декілька CDR або всі CDR у будь - якій комбінації, вибрані з CDRH1 (SEQ ID NO:39), CDRH2 (SEQ ID NO:40), CDRH3 (SEQ ID NO:41), CDRL1 (SEQ ID NO:42), CDRL2 (SEQ ID NO:43), та CDRL3 (SEQ ID NO:44); або варіанти будь - яких вказаних CDR. Наприклад, антиген - зв'язуючий білок може містити CDRH3 (SEQ ID NO:41) та CDRH1 (SEQ ID NO:40) або їх варіанти. Антиген - зв'язуючий білок може містити CDRH3 (SEQ ID NO:41) та CDRH2 (SEQ ID NO:40) або їх варіанти. Антиген - зв'язуючий білок може містити CDRH1 (SEQ ID NO:39) та CDRH2 (SEQ ID NO:40), та CDRH3 (SEQ ID NO:41) або їх варіанти. Антиген - зв'язуючий білок може містити CDRL1 (SEQ ID NO:42) та CDRL2 (SEQ ID NO:43) або їх варіанти. Антиген - зв'язуючий білок може містити CDRL2 (SEQ ID NO:43) та CDRL3 (SEQ ID NO:44) або їх варіанти. Антиген - зв'язуючий білок може містити CDRL1 (SEQ ID NO:42), CDRL2 (SEQ ID NO:43) та CDRL3 (SEQ ID NO:44) або їх варіанти. Антиген - зв'язуючий білок може містити CDRH3 (SEQ ID NO:41) та CDRL3 (SEQ ID NO:44) або їх варіанти. Антиген - зв'язуючий білок може містити CDRH3 (SEQ ID NO:41), CDRH2 (SEQ ID NO:40) та CDRL3 (SEQ ID NO:44) або їх варіанти. Антиген - зв'язуючий білок може містити CDRH3 (SEQ ID NO:41), CDRH2 (SEQ ID NO:40), CDRL2 (SEQ ID NO:43) та CDRL3 (SEQ ID NO:44) або їх варіанти. Антиген - зв'язуючий білок може містити CDRH1 (SEQ ID NO:39), CDRH2 (SEQ ID NO:40), CDRH3 (SEQ ID NO:41), CDRL1 (SEQ ID NO:42), CDRL2 (SEQ ID NO:43) та CDRL3 (SEQ ID NO:44). Альтернативно, можуть бути присутні варіантні CDR. Заявлений винахід також стосується антиген - зв'язуючого білка, що зв'язується з CD127 та містить відповідний CDRH3 послідовності змінного домену SEQ ID NO:8, або варіант її CDRH3, у людинному акцепторному каркасному регіоні. Антиген - зв'язуючий білок може нейтралізовувати активність CD127. Антиген - зв'язуючий білок може бути людинним, химерним або гуманізованим антитілом. Антиген - зв'язуючий білок може додатково містити один або декілька або всі відповідні CDR, вибрані від змінної доменної послідовності SEQ ID NO: 8 та/або SEQ ID NO: 9, або її варіантний CDR. Заявлений винахід також стосується антиген - зв'язуючого білка, що специфічно зв'язується зCD127 та містить відповідний CDRH3 послідовності змінного домену SEQ ID NO:45 або її варіантний CDRH3 у акцепторному каркасному регіоні людини. Антиген - зв'язуючий білок може нейтралізувати активність CD127. Антиген - зв'язуючий білок може бути людинним, химерним або гуманізованим антитілом. Антиген - зв'язуючий білок може додатково містити один або більше, або всі відповідні CDR, вибрані від послідовності змінного домену SEQ ID NO:45 та/або SEQ ID NO:46 або варіант його CDR. Наприклад, антиген - зв'язуючий білок може містити відповідний CDRH3 та відповідний CDRH1 або їх варіанти. Антиген - зв'язуючий білок може містити відповідний CDRH3 та відповідний CDRH2 або їх варіанти. Антиген - зв'язуючий білок може містити відповідний CDRH1, відповідний CDRH2 та відповідний CDRH3 або їх варіанти. 23 UA 104663 C2 5 10 15 20 25 30 35 40 45 50 55 60 Антиген - зв'язуючий білок може містити відповідний CDRL1 та відповідний CDRL2 або їх варіанти. Антиген - зв'язуючий білок може містити відповідний CDRL2 та відповідний CDRL3 або їх варіанти. Антиген - зв'язуючий білок може містити відповідний CDRL1, відповідний CDRL2 та відповідний CDRL3 або їх варіанти. Антиген - зв'язуючий білок може містити відповідний CDRH3 та відповідний CDRL3 або їх варіанти. Антиген - зв'язуючий білок може містити відповідний CDRH3, відповідний CDRH2 та відповідний CDRL3 або їх варіанти. Антиген - зв'язуючий білок може містити відповідний CDRH3, відповідний CDRH2, відповідний CDRL2 та відповідний CDRL3 або їх варіанти. Антиген - зв'язуючий білок може містити відповідний CDRH1, відповідний CDRH2, відповідний CDRH3, відповідний CDRL1, відповідний CDRL2 та відповідний CDRL3 або їх варіанти. Відповідні CDR можна визначити, посилаючись на системи нумерації Kabat (1987), Chothia (1989), AbM або Сontact. Одне визначення кожного з цих способів можна знайти у Таблиці 1 та можна застосувати до референсного змінного домену важкого ланцюга (SEQ ID NO:8 або SEQ ID NO:45) та референсного змінного домену легкого ланцюга (SEQ ID NO:9 та SEQ ID NO:46) для визначення відповідного CDR. Заявлений винахід також стосується антиген - зв'язуючого білка, що зв'язується з CD127 та містить одиницю зв'язування H3, що містить залишки 95-101 SEQ ID NO:8 (Kabat) або варіант H3. Антиген - зв'язуючий білок, як - то і антитіло, може бути людинним, гуманізованим або химерним антиген - зв'язуючим білком. Антиген - зв'язуючий білок може додатково містити один або декілька або всі одиниці зв'язування, вибрані з: H1, що містить залишки 31-32 SEQ ID NO:8, H2, що містить залишки 5256 SEQ ID NO:8, L1, що містить залишки 30-34 SEQ ID NO:9, L2, що містить залишки 50-55 SEQ ID NO:9 та L3, що містить залишки 89-96 SEQ ID NO:9 (всі наведені у Kabat); або варіантну одиницю зв'язування. Заявлений винахід також стосується антиген - зв'язуючого білка, що зв'язується з CD127 та містить одиницю зв'язування H3, що містить залишки 95-101 SEQ ID NO:45 (Kabat) або варіант H3. Антиген - зв'язуючий білок може бути людинним, гуманізованим або химерним антиген зв'язуючим білком, наприклад, антитілом. Антиген - зв'язуючий білок може додатково містити один або декілька або всі одиниці зв'язування, вибрані з: H1, що містить залишки 31-32 SEQ ID NO:45, H2, що містить залишки 5256 SEQ ID NO:46, L1, що містить залишки 30-34 SEQ ID NO:46, L2, що містить залишки 50-55 SEQ ID NO:46 та L3, що містить залишки 89-96 SEQ ID NO:46 (всі наведені у Kabat); або варіантну одиницю зв'язування. Наприклад, антиген - зв'язуючий білок може містити одиницю зв'язування H3 та одиницю зв'язування H1 або їх варіанти. Антиген - зв'язуючий білок може містити одиницю зв'язування H3 та одиницю зв'язування H2 або їх варіанти. Антиген - зв'язуючий білок може містити одиницю зв'язування H1, одиницю зв'язування H2 та одиницю зв'язування H3 або їх варіанти. Антиген - зв'язуючий білок може містити одиницю зв'язування L1 та одиницю зв'язування L2 або їх варіанти. Антиген - зв'язуючий білок може містити одиницю зв'язування L2 та одиницю зв'язування L3 або їх варіанти. Антиген - зв'язуючий білок може містити одиницю зв'язування L1, одиницю зв'язування L2 та одиницю зв'язування L3 або їх варіанти. Антиген - зв'язуючий білок може містити одиницю зв'язування H3 та одиницю зв'язування L3 або їх варіанти. Антиген - зв'язуючий білок може містити одиницю зв'язування H3, одиницю зв'язування H2 та одиницю зв'язування L3 або їх варіанти. Антиген - зв'язуючий білок може містити одиницю зв'язування H3, одиницю зв'язування H2, одиницю зв'язування L2 та одиницю зв'язування L3 або їх варіанти. Антиген - зв'язуючий білок може містити одиницю зв'язування H1, одиницю зв'язування H2, одиницю зв'язування H3, одиницю зв'язування L1, одиницю зв'язування L2 та одиницю зв'язування L3 або їх варіанти. Варіантний CDR або варіантна одиниця зв'язування містить амінокислотну послідовність, модифіковану принаймні однією амінокислотою, де вказана модифікація може бути хімічним або частковим зміненням амінокислотної послідовності (наприклад, не більш, ніж десяти амінокислот) та дозволяє варіанту зберігати біологічні характеристики немодифікованої послідовності. Наприклад, варіант, який є функціональним варіантом, що зв'язується з CD127. Часткові змінення амінокислотної послідовності CDR можна отримати шляхом делеції або заміщення від однієї до декількох амінокислот або за допомогою додавання або встроювання від однієї до декількох амінокислот або комбінацією цих змінень (наприклад, не більш, ніж десяти амінокислот). Варіантний CDR або варіантна одиниця зв'язування може містити 1, 2, 3, 4, 5 або 6 амінокислотних заміщень, додавань або делецій у будь - яких комбінаціях у 24 UA 104663 C2 5 10 15 20 25 30 35 40 45 50 55 60 амінокислотній послідовності. Варіантний CDR або варіантна одиниця зв'язування може містити 1, 2 або 3 6 амінокислотних заміщень, додавань або делецій у будь - яких комбінаціях у амінокислотній послідовності. Заміщення амінокислотних залишків можуть бути консервативними, наприклад, заміщення однієї гідрофобної амінокислоти на альтернативну гідрофобну амінокислоту. Наприклад, лейцин можна замінити на валін або ізолейцин. CDR L1, L2, L3, H1, H2 та H3 як правило, структурно утворюють одну з головних конформацій ланцюга обмеженої кількості (канонічних). Окремий канонічний структурний клас CDR, якого визначають по довжині CDR та по пакуванню петель, характеризується залишками, розташованими у ключових позиціях у CDR та у каркасних регіонах (залишки структурного визначення або SDR). Martin та Thornton (1996; J Mol Biol 263:800-815) створили автоматичний спосіб визначення "ключового залишку" канонічних зразків. Для визначення канонічних класів для наборів CDR застосовують кластерний аналіз та канонічні зразки потім ідентифікують за допомогою аналізу захованої гідрофобності, залишків з водневими зв'язками та консервативних гліцинів та пролінів. CDR послідовностей антитіл можна віднести до канонічних класів за допомогою порівняння послідовностей зі зразками ключових залишків та оцінкою кожного зразка з застосуванням матриць тотожності або подібності. Згідно з канонічним класом антитіла 1A11 H3L4 (SEQ ID NO: 13 (1A11.H3 V H) або SEQ ID NO:22 (1A11.L4 Vκ)), функціональне зв'язування антитіла, як може бути передбачено, буде зберігатися у присутності наступних заміщень CDR, де амінокислота перед номером Kabat є оригінальною амінокислотною послідовністю та амінокислотна послідовність на кінці номера Kabat є заміщеною амінокислотою: Канонічні конформації CDRH1: Y32I, Y32H, Y32F, Y32T, Y32N, Y32C, Y32E, Y32D T33Y, T33A, T33W, T33G, T33L, T33V M34I, M34V, M34W N35E, N35H, N35Q, N35S, N35Y, N35T Канонічні конформації CDRH2: L50R, L50E, L50W, L50Y, L50G, L50Q, L50V, L50N, L50K, N50A I51L, I51V, I51T, I51S, I51N N52D, N52L, N52S, N52Y Y53A, Y53G, Y53S, Y53K, Y53T, Y53N N54S, N54T, N54K, N54D, N54G V56Y, V56R, V56E, V56D, V56G, V56S, V56A S58K, S58N, S58T, S58D, S58R, S58G, S58F, S58Y Канонічні конформації CDRH3: V102Y, V102H, V102I, V102S, V102D, V102G Канонічні конформації CDRL1: S29V M33L Канонічні конформації CDRL3: Q89L E90Q W91Y Y93S, Y93R Таким чином, антиген - зв'язуючий білок може мати або може не мати будь - яких з вищезазначених заміщень у позиціях CDR. Це можуть бути численні заміщення у варіантному CDR, у відповідному CDR, у одиниці зв'язування, у змінному регіоні важкого або легкого ланцюга, у важкому або легкому ланцюзі та у антиген - зв'язуючому білку. Отже, у антиген зв'язуючому білку винаходу можуть бути присутніми будь - які комбінації заміщень, забезпечуючи збереження канонічної структури CDR. Щоб уникнути непорозумінь, вищеописані заміщення не повинні тлумачитися у вигляді обмеження можливих заміщень CDR, що можна отримати зі збереженням функціональності анти - CD127 антитіла. Антиген - зв'язуючий білок, що містить CDR, відповідні CDR, варіантні CDR, одиниці зв'язування або описані варіантні одиниці зв'язування, може відображати ефективність зв'язування до CD127, як продемонстровано за допомогою EC50; 10 або 5 - разову ефективність, що демонструє 1A11c (химерне, VH-SEQ ID NO:28, Vκ - SEQ ID NO:29) або 6A3c (химерне, VH-SEQ ID NO:74, Vκ - SEQ ID NO:75). Ефективність зв'язування до CD127 може бути відображена різним чином, як - то афінністю зв'язування (наприклад, вимірюється за допомогою BIAcore), або EC50 (наприклад, вимірюється за допомогою ІФА). Як обговорювалося вище, окремий канонічний структурний клас CDR, що характеризується довжиною CDR та пакуванням петель, визначається залишками, розташованими у ключових 25 UA 104663 C2 5 10 15 20 25 30 35 40 45 50 55 60 положеннях у CDR та у каркасних регіонах. Таким чином, на додачу до перелічених у SEQ ID NO:2-6 CDR варіантних CDR, відповідних CDR, одиниць зв'язування або їх варіантів, можна також отримати заміщення у залишках каркасного регіону антиген - зв'язуючого білка винаходу, що мають канонічну основу, з одночасним збереженням функціональності антитіла. Вони можуть охоплювати (з застосуванням нумерації по Kabat): Важкий ланцюг: V, I або G у позиції 2; L або V у позиції 4; L, I, M або V у позиції 20; C у позиції 22; T, A, V, G або S у позиції 24; G у позиції 26; I, F, L або S у позиції 29; W у позиції 36; W або Y у позиції 47; I, M, V або L у позиції 48; I, L, F, M або V у позиції 69; V, A, R або L у позиції 71; A, L, V, Y або F у позиції 78; L або M у позиції 80; Y або F у позиції 90; C у позиції 92; та /або R, K, G, S, H або N у позиції 94; та /або Легкий ланцюг: I, L або V у позиції 2; V, Q, L або E у позиції 3; M або L у позиції 4; C у позиції 23; W у позиції 35; Y, L або F у позиції 36; S, L, R або V у позиції 46; Y, H, F або K у позиції 49; Y або F у позиції 71; C у позиції 88; та /або F у позиції 98. Будь - що, будь - яка комбінація або всі вищезазначені позиції у каркасному регіоні можуть бути наведені у антиген - зв'язуючому білку винаходу. Це можуть бути численні варіантні базових канонічних позицій у змінному регіоні важкого або легкого ланцюга, у важкому або легкому ланцюзі та у антиген - зв'язуючому білку. Отже, у антиген - зв'язуючому білку винаходу можуть бути наведені будь - які комбінації, що забезпечують збереження цієї канонічної структури каркасного регіону. Наприклад, змінний каркасний регіон важкого ланцюга може містити V у позиції 2, L у позиції 4, V у позиції 20, C у позиції 22, у позиції 24, G у позиції 26, F у позиції 29, W у позиції 36, W у позиції 47, M у позиції 48, L у позиції 69, R у позиції 71, у позиції 78, M у позиції 80, Y у позиції 90, C у позиції 92, та R у позиції 94 та, наприклад, змінний каркасний регіон легкого ланцюга може містити I у позиції 2, L у позиції 4, C у позиції 23, W у позиції 35, Y у позиції 36, F у позиції 71, C у позиції 88, E у позиції 90, та Y у позиції 93. Один або декілька описаних тут CDR, відповідних CDR, варіантних CDRs або одиниць зв'язування можуть бути присутніми у контексті каркасного регіону людини, наприклад, у вигляді гуманізованого або химерного змінного домену. Гуманізований змінний домен важкого ланцюга може містити перелічені у SEQ ID NO:2-4 або у SEQ ID NO:39-41 CDR; їх варіантні CDR; відповідні CDR; одиниці зв'язування або їх варіанти у каркасному регіоні акцепторного антитіла, що має 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, 99 % або більше або 100 % тотожності у каркасних регіонах до акцепторної змінної доменної послідовності людини у SEQ ID NO: 116. Гуманізований змінний домен легкого ланцюга може містити CDR, що перелічені у SEQ ID NO: 5-7 або SEQ ID NO:42-44; його варіантні CDR; відповідні CDR; одиниці зв'язування або їх варіанти у каркасному регіоні акцепторного антитіла, що має 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, 99 % або більше або 100 тотожності у каркасних регіонах до акцепторної змінної доменної послідовності людини у SEQ ID NO: 117. Винахід також стосується антиген - зв'язуючого білка, що зв'язується з CD127 та містить змінний регіон важкого ланцюга, вибраний від будь - якої одної з послідовностей SEQ ID NO:10, 11, 12, 13, 14, 15, 16, 17, 121, 123, 125, 127, 129 або 131. Антиген - зв'язуючий білок може містити змінний регіон легкого ланцюга вибраний від будь - якої одної з послідовностей SEQID NO:18, 19, 20, 21, 22, 23, 24, 25, 26 або 27. Будь - який зі змінних регіонів важкого ланцюга може бути об'єднаним з будь - яким зі змінних регіонів легкого ланцюга. Антиген - зв'язуючий білок також може нейтралізовувати CD127. Винахід також стосується антиген - зв'язуючого білка, що зв'язується з CD127 та містить змінний регіон важкого ланцюга, вибраний від будь - якої одної з послідовностей SEQID NO:48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68 або 69. Антиген зв'язуючий білок може містити змінний регіон легкого ланцюга, вибраний від будь - якої одної з послідовностей SEQID NO:70, 71, 72, 73 або 138. Будь - який зі змінних регіонів важкого ланцюга може бути об'єднаним з будь - яким зі змінних регіонів легкого ланцюга. Антиген зв'язуючий білок також може нейтралізовувати CD127. Змінний регіон важкого ланцюга антитіла може мати 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, 99 % або більше або 100 % тотожності до будь - якої однієї з SEQ ID NO:10, 11, 12, 13, 14, 15, 16, 17, 121, 123, 125, 127, 129 або 131; або SEQ ID NO:48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68 або 69. Змінний регіон легкого ланцюга антитіла може мати 75 % або більше, 80 % або більше, 85 % 26 UA 104663 C2 5 10 15 20 25 30 35 40 45 50 55 60 або більше, 90 % або більше, 95 % або більше, 98 % або більше, 99 % або більше, або 100 % тотожності до будь - якої однієї з SEQ ID NO:18, 19, 20, 21, 22, 23, 24, 25, 26 або 27; або SEQ ID NO:70, 71, 72, 73 або 138. Відсоток тотожності варіантів SEQ ID NO: 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 121, 123, 125, 127, 129 або 131 може бути визначений по всій довжині послідовності. Змінний регіон важкого ланцюга антитіла може бути варіантом будь - якої однієї з SEQ ID NO:10, 11, 12, 13, 14, 15, 16, 17, 121, 123, 125, 127, 129 або 131, що містить 30, 25, 20, 15, 10, 9, 8, 7, 6, 5, 4, 3, 2 або 1 амінокислотне заміщення, вставку або делецію. Змінний регіон легкого ланцюга антитіла може бути варіантом будь - якої однієї з SEQ ID NO:18, 19, 20, 21, 22, 23, 24, 25, 26 або 27, що містить 30, 25, 20, 15, 10, 9, 8, 7, 6, 5, 4, 3, 2 або 1 амінокислотне заміщення, вставку або делецію. Наприклад, описані вище заміщення канонічних CDR та канонічних залишків каркасного регіону можуть також бути присутніми у варіантних змінних регіонах важкого або легкого ланцюга у вигляді варіантних послідовностей, що мають принаймні 75 % тотожності або що містять до 30 амінокислотних заміщень. У іншому втіленні, змінний регіон важкого ланцюга антитіла може бути варіантом будь - якої однієї з SEQ ID NO: 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68 або 69, що містить 30, 25, 20, 15, 10, 9, 8, 7, 6, 5, 4, 3, 2 або 1 амінокислотне заміщення, вставку або делецію. Змінний регіон легкого ланцюга антитіла може бути варіантом будь - якої однієї з послідовностей SEQ ID NO: 70, 71, 72 або 73, що містить 30, 25, 20, 15, 10, 9, 8, 7, 6, 5, 4, 3, 2 або 1 амінокислотне заміщення, вставку або делецію. Наприклад, вищезазначені заміщення канонічних CDR та канонічних залишків каркасного регіону можуть також бути присутні у варіантних змінних регіонах важкого або легкого ланцюга у вигляді варіантних послідовностей, що мають принаймні 75 % тотожності або що містять до 30 амінокислотних заміщень. Будь - які змінні регіони важкого ланцюга винаходу можуть бути об'єднані з прийнятним сталим регіоном людини. Будь - які змінні регіони легкого ланцюга винаходу можуть бути об'єднані з прийнятним сталим регіоном. Винахід також надає антиген - зв'язуючий білок, що специфічно зв'язується з CD127 та містить будь - які наступні комбінації змінного домену важкого та легкого ланцюга: 1A11.H3.L4 (SEQ ID NO:13 та SEQ ID NO:22) або антиген - зв'язуючий білок, що має змінний домен важкого ланцюга, що має принаймні 75 % тотожності до SEQ ID NO:13 та змінний домен легкого ланцюга, що має принаймні 75 % тотожності до SEQ ID NO:22. Антиген - зв'язуючий білок також може нейтралізувати CD127. Антиген - зв'язуючі білки, як наведено вище, наприклад, варіанти з частковим зміненням послідовності шляхом хімічної модифікації та/або вставлення, видалення або заміщення одного або декількох амінокислотних залишків або тих, що мають 75 % або більше, 80 % або більше, 85 % або більше, 90 % або більше, 95 % або більше, 98 % або більше, або 99 % або більше тотожності до будь - яких вищезазначених послідовностей, можуть відображати ефективність зв'язування до CD127, як показано за допомогою EC50 або BIAcore, ефективність у 10 разів або у 5 разів, що демонструють 1A11 або 6A3. Ефективність зв'язування до CD127 може бути продемонстрована за допомогою EC50 з проведенням ІФА аналізу або дослідженням афінності зв'язування на BIAcore. Винахідники також експериментально визначили, що деякі позиції у CDRH3 можуть бути заміщені, що веде до зменшеної афінності зв'язування (тобто, сильного зв'язування). Такі аналоги CDRH3 наведені у Таблиці 4. Відмічено, що особливо ефективними у підвищенні афінності є заміщення у позиціях N98 та F100b (нумерація Kabat). Окремі заміщення охоплюють N98D, N98E, F100bE, F100bI та F100bV. Послідовності CDRH3, де представлені ці заміщення, є, відповідно, SEQ ID NO:132, 133, 134, 135, 136 та 137. Заявлений винахід передбачає включення таких заміщень у будь - які описані тут антитіла. У одному втіленні, антитіло винаходу має W (Trp) залишок у позиції 100. Може бути бажаним змінення ефекторної функції таким чином, щоб антиген - зв'язуючий фрагмент, наприклад, підсилював ADCC або CDC, підвищував час напівжиття, тощо. У одному втіленні, білки, що зв'язують антиген винаходу може бути Fc - позбавленими. Один шлях досягнення Fc - позбавлення полягає у заміщенні аланінових залишків у позиціях 235 та 237 (індекс нумерації Євросоюзу) сталого регіону важкого ланцюга. Альтернативно, антиген зв'язуючий білок може бути Fc - позбавленим та не містити аланінові заміщення у позиціях 235 та 237. Антиген - зв'язуючий білок може мати час напівжиття принаймні 6 год., принаймні 1 добу, 27 UA 104663 C2 5 10 15 20 25 30 35 40 45 50 55 60 принаймні 2 доби, принаймні 3 доби, принаймні 4 доби, принаймні 5 діб, принаймні 7 діб, або принаймні 9 діб у людині in vivo, або у мишачій тваринній моделі. Антиген - зв'язуючий білок може бути отриманим від щурів, мишей, приматів (наприклад, макаки - крабоїда, представників родини мавпових або людиноподібних приматів) або від людини. Антиген - зв'язуючий білок може бути людинним, гуманізованим або химерним антитілом. Антиген - зв'язуючий білок може містити сталий регіон, що може бути будь - яким ізотипом або субкласом. Сталий регіон може бути ізотипoм IgG, наприклад IgG1, IgG2, IgG3, IgG4 або його варіантами. Сталий регіон антиген - зв'язуючого білка може бути IgG1. Для змінення афінності взаємодії між FcRn та антитілом з метою модулювання обігу антитіла можна застосувати мутаційні змінення у Fc ефекторній частині антитіл. Час напівжиття антитіла може бути подовженим in vivo. Це може бути корисним для популяцій пацієнтів, оскільки в результаті підтримування IC50 in vivo протягом тривалих періодів часу можна досягти рівнів максимальної дози та максимальної частоти прийому лікарського засобу. Можна повністю або частково видалити Fc ефекторну функцію антитіл, тому що її наявність може привести до знищення клітин, що експресують CD127. Це видалення може привести до збільшення профілю безпечності. Антиген - зв'язуючий білок, що містить сталий регіон може мати скорочений ADCC та/або активування комплементу або ефекторної функціональності. Сталий домен може містити природно позбавлений сталий регіон ізотипу IgG2 або IgG4 або мутований сталий домен IgG1. Приклади прийнятних модифікацій наведені у EP0307434. Один шлях досягнення позбавлення Fc полягає у заміщенні аланінових залишків у позиціях 235 та 237 (індекс нумерації Євросоюзу) сталого регіону важкого ланцюга. Антиген - зв'язуючий білок може містити одну або декілька модифікацій, вибраних від мутованого сталого домену таким чином. щоб антитіло мало посилені ефекторні функції/ ADCC та/або активування комплементу. Приклади прийнятних модифікацій описані у Shields et al. J. Biol. Chem (2001) 276:6591-6604, Lazar et al. PNAS (2006) 103:4005-4010 та US6737056, WO2004063351 та WO2004029207. Антиген - зв'язуючий білок може містити сталий домен зі зміненим профілем глікозилювання таким чином, щоб цей антиген - зв'язуючий білок мав посилені ефекторні функції/ ADCC та/або активування комплементу. Приклади прийнятних способів отримання антиген - зв'язуючого білка зі зміненим профілем глікозилювання описані у WO2003/011878, WO2006/014679 та EP1229125. Поліпептид CD127, з яким зв'язується антиген - зв'язуючий білок може бути рекомбінантним поліпептидом та може містити зовнішньоклітинний домен (ECD), вибірково злитий з іншим білком, наприклад. з Fc доменом або може містити повнорозмірний білок CD127. CD127 може знаходитися у розчині або бути прикріпленим до твердої поверхні. Наприклад, CD127 може бути прикріпленим до гранул, наприклад, до магнітних гранул. CD127 може також бути біотінільованим. Для іммобілізації CD127 на твердій поверхні шляхом приєднання біотинстрептавідину до твердій поверхні можна застосувати сполучену зі CD127 біотинову молекулу. Заявлений винахід також стосується молекули нуклеїнової кислоти, що кодує антиген зв'язуючий білок, як тут описано. Молекула нуклеїнової кислоти може містити послідовність, що кодує (i) один або декілька CDRH, змінну послідовність важкого ланцюга або повнорозмірну послідовність важкого ланцюга; та (ii) один або декілька CDRL, змінну послідовність легкого ланцюга або повнорозмірну послідовність легкого ланцюга, з (i) та (ii) тієї самої молекули нуклеїнової кислоти. Альтернативно, молекула нуклеїнової кислоти, що кодує описаний тут антиген - зв'язуючий білок може містити послідовності, що кодують (a) один або декілька CDRH, змінну послідовність важкого ланцюга або повнорозмірну послідовність важкого ланцюга; або (b) один або декілька CDRL, змінну послідовність легкого ланцюга або повнорозмірну послідовність легкого ланцюга, з (a) та (b) у окремих молекулах нуклеїнової кислоти. Молекула нуклеїнової кислоти, що кодує змінний домен важкого ланцюга може містити SEQ ID NO:30-36. Молекула нуклеїнової кислоти, що кодує змінний домен легкого ланцюга може містити SEQ ID NO:10-113. Молекула нуклеїнової кислоти, що кодує змінний домен важкого ланцюга може містити SEQ ID NO:75-96. Молекула нуклеїнової кислоти, що кодує змінний домен легкого ланцюга може містити SEQ ID NO:97-100. Заявлений винахід також стосується вектора експресії, що містить молекулу нуклеїнової кислоти, як тут описано. Також винахід стосується рекомбінантної клітини - хазяїна, що містить вектор експресії, як тут описано. 28
ДивитисяДодаткова інформація
Назва патенту англійськоюCd127 binding proteins
Автори англійськоюKirby, Ian, Taylor, Alexander, H., Webb, Thomas, Matthew, Xue, Yu
Автори російськоюКирби Ян, Тейлор Александер Г., Вебб Томас Меттью, Сюе Юй
МПК / Мітки
МПК: A61K 39/395, A61P 37/06, C12N 5/10, A61P 29/00, C12P 21/08, C07H 21/04, C07K 16/00, C12N 15/63, C12N 1/21
Мітки: антитіло, зв'язує, cd127
Код посилання
<a href="https://ua.patents.su/108-104663-antitilo-shho-zvyazueh-cd127.html" target="_blank" rel="follow" title="База патентів України">Антитіло, що зв’язує cd127</a>
Попередній патент: Спосіб дешифрування оптичних аномалій на аерокосмічних знімках
Наступний патент: Спосіб відновлення зношених поверхонь металевих деталей
Випадковий патент: Спосіб визначення відносного змінення об'єму поперечних магнітних доменів у звитих магнітопроводах