Спосіб експериментального дослідження регенерації кісткового дефекту в умовах системного остеопорозу
Номер патенту: 100354
Опубліковано: 10.12.2012
Автори: Дєльцова Олена Іванівна, Ключівська Ольга Юріївна, Заіченко Олександр Сергійович, Стойка Ростислав Степанович, Годована Олеся Іванівна, Геращенко Сергій Борисович
Формула / Реферат
1. Спосіб експериментального дослідження регенерації кісткового дефекту в умовах системного остеопорозу, що включає утворення штучного кісткового дефекту та підсадку кісткового або кістково-пластичного матеріалів, який відрізняється тим, що у щура попередньо викликають остеопоротичний процес кісткової тканини, а штучний кістковий дефект формують у хвостовому хребці.
2. Спосіб за п. 1, який відрізняється тим, що штучний кістковий дефект формують розміром 2,5×4,5 мм.
Текст
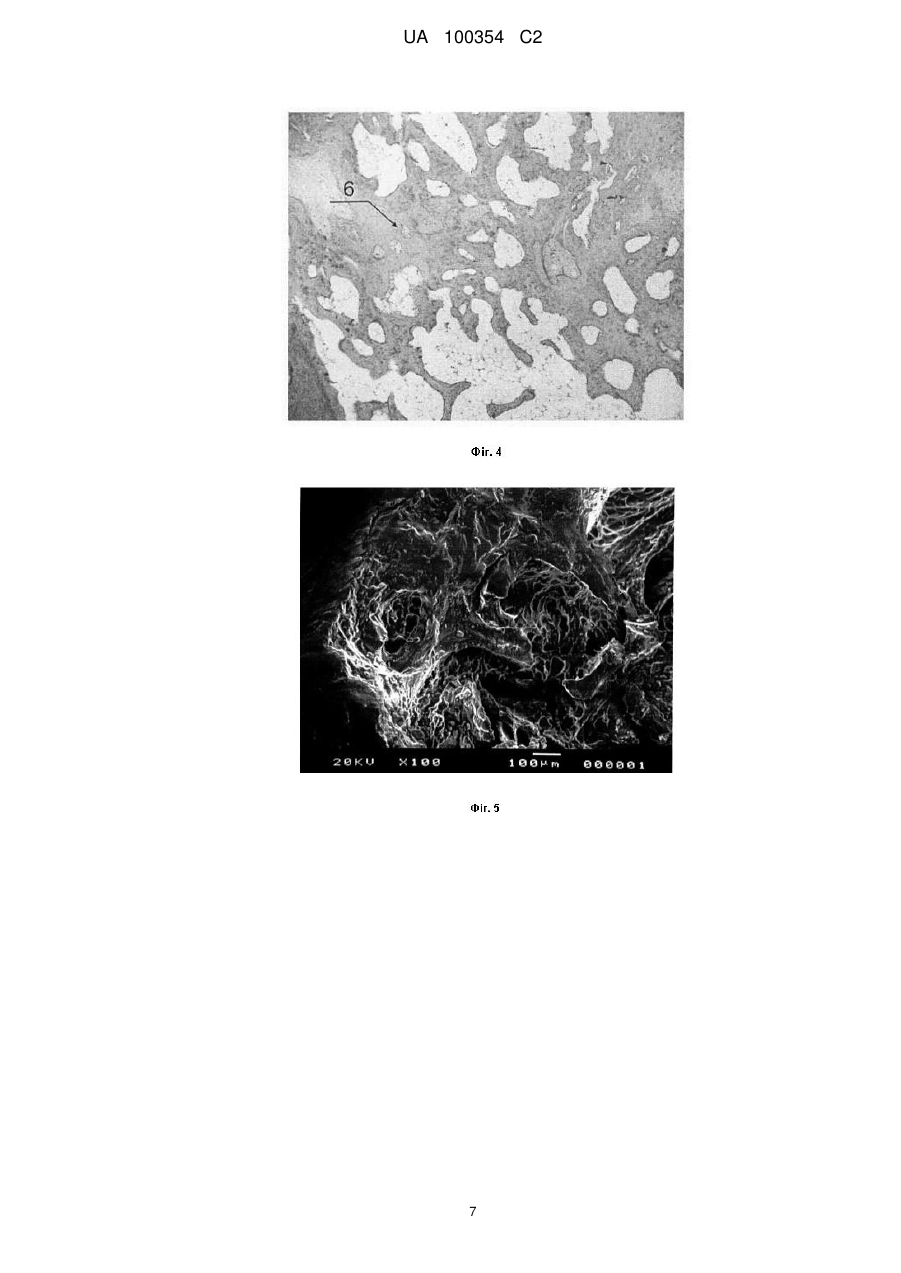
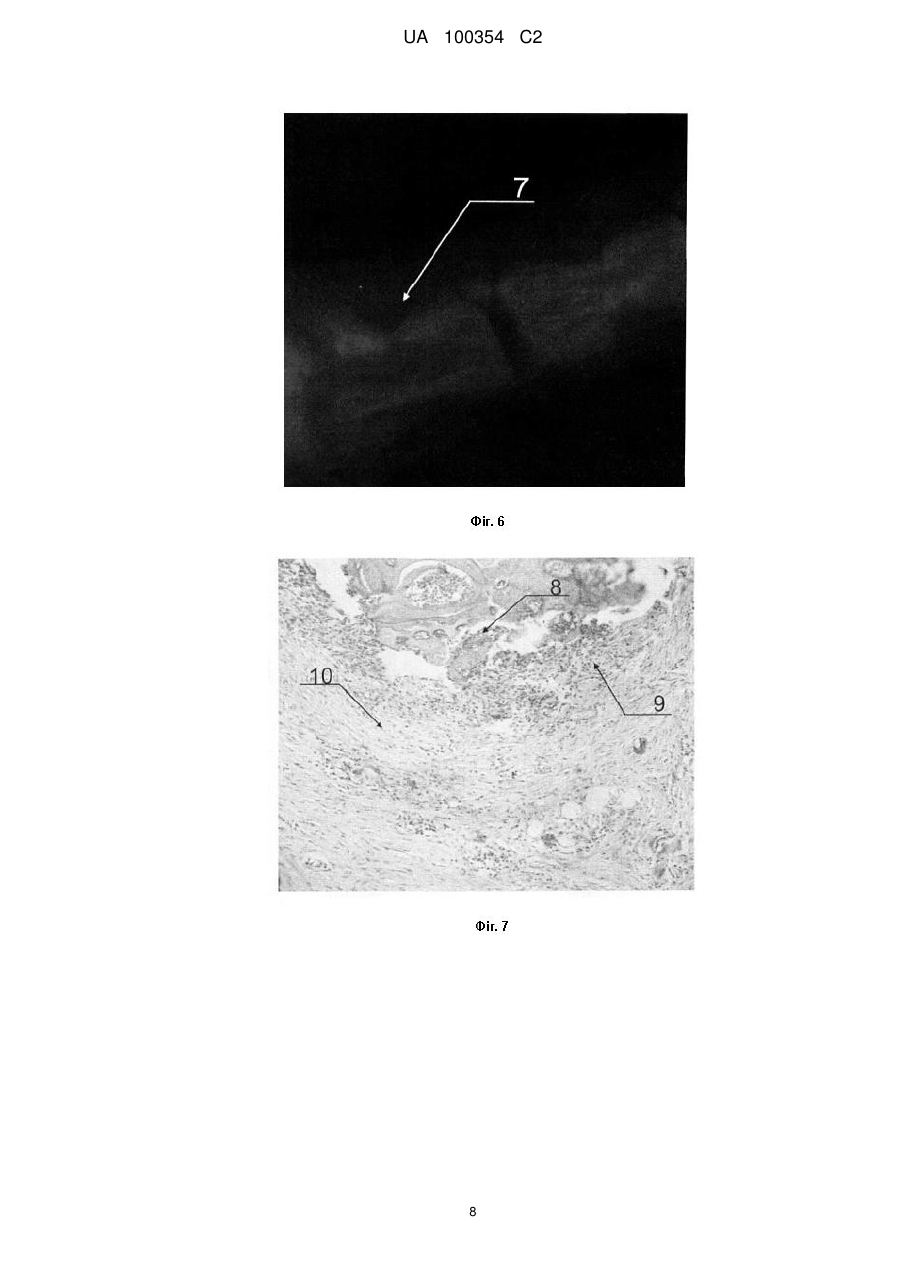
Реферат: Винахід належить до галузі медицини та стосується способу експериментального дослідження регенерації кісткового дефекту в умовах системного остеопорозу. Спосіб за винаходом полягає UA 100354 C2 (12) UA 100354 C2 в тому, що у щура попередньо викликають остеопоротичний процес кісткової тканини, а штучний кістковий дефект формують у хвостовому хребці. UA 100354 C2 5 10 15 20 25 30 35 40 45 50 55 60 Винахід стосується медицини, зокрема способів дослідження регенеративних процесів кісткової тканини (кісткових кіст, вогнищ остеонекрозу, вертикальних кісткових кишень альвеолярного відростка щелеп при дистрофічно-запальних захворюваннях тканин пародонта) на експериментальних тваринах, зокрема щурах, та може бути використаний для хірургічного лікування кісткових дефектів, викликаних остеопорозом. З метою заміщення кісткових дефектів, які утворились внаслідок прогресуючого перебігу того чи іншого патологічного процесу, використовують різноманітні кісткові матеріали, які імплантують в ділянку дефекту. Запобігання виникненню ускладнень у післяопераційному періоді, серед яких - відторгнення імплантованих матеріалів, забезпечується специфічними властивостями цих матеріалів, які постійно вдосконалюються фірмами-виробниками (наприклад, поєднання з антимікробними речовинами, насичення сульфатованими глікозаміногліканами для посилення остеокондуктивних та остеоіндуктивних властивостей і кращої асиміляції з кісткою реципієнтного ложа, висока механічна міцність, що зумовлює відновлення втраченої анатомічної форми дефекту). Відомий спосіб експериментального дослідження процесів регенерації кісткової тканини [Модина Т.Н., Маклакова И.С. Экспериментальное обоснование применения гиалуоста для закрытия костных дефектов в амбулаторной хирургии // Клиническая стоматология. - 2011. - № 4. - С. 30-32], за яким для вивчення процесів регенерації кісткової тканини автори створювали штучні кісткові дефекти та підсадку остеопластичних матеріалів "Палуост" та "Колапан" у верхній третині правої стегнової кістки щура. Недоліком означеного хірургічного втручання є необхідність препарування товстого прошарку м'язової тканини. Крім того, створення цього кісткового дефекту супроводиться оголенням кістково-мозкового каналу, що є достатньо травматичним порушенням кровопостачання в зоні росткової пластинки, що, у свою чергу, призводить до значної дистрофії і навіть до некрозу кістки. Відомий спосіб експериментального дослідження процесів регенерації кісткової тканини [Орлов А.А., Сабурина И.Н., Репин B.C., Новикова Н.И., Мурашов А.Н., Иванов Д.В., Горелик Е.Н. Экспериментальное моделирование 3-D заданного остеогенеза костной ткани на базе аутологичных культур мультипотентных мезенхимальных стромальных клеток крыс и остеопластических материалов для устранения дефектов кости // Вестник новых медицинских технологий. - 2011. - T.XVIII, № 1. - С. 7-11], за яким спрямовану остеоінтеграцію остеопластичного матеріалу "ХРОНОС" (3-D остеогенез кісткової тканини) здійснювали на базі аутологічної культури мультипотентних мезенхімальних стромальних клітин, вирощених на остеоіндуктивному матриксі. Ділянкою втручання в експериментальних тварин (щурі) вибрано кісткову тканину кута нижньої щелепи та міжфасціальний простір міжлопаткової області в межах субкутиса гіподерми. Недоліком цього способу хірургічного втручання в ділянці кута нижньої щелепи є необхідність після розрізу шкіри для візуалізації кута, тіла і гілки нижньої щелепи відсепаровувати товстий прошарок м'язової тканини. Остеопластичний матеріал фіксували металевим дротом, після чого рану ушивали. Високий травматизм такого втручання суттєво позначається на перебігу післяопераційного процесу. Для оцінки шкірної реакції блок остеопластичного матеріалу розташовували у міжфасціальному просторі міжлопаткової області (область гіподерми), що також ослаблює організм тварини, оскільки є вимушеним додатковим втручанням і призводить до підвищеної смертності експериментальних тварин. Найближчим аналогом запропонованого винаходу є відомий спосіб створення штучного дефекту в кістковій тканині для підсадки метеріалів та дослідження регенераційних процесів [Ярова С.П., Брашкин А.П., Слюсарев О.О. Экспериментальное обоснование эффективности метода оптимизации регенерации челюстной кости // Вісник стоматології. - 2006. - № 3. - С. 1318], при якому проводять лінійний розріз у піднижньощелепній ділянці щура для розсікання покривних тканин. Гострим, частково тупим, шляхом здійснюють доступ до нижнього краю нижньої щелепи в ділянці прикріплення жувального м'яза, який відсікають і відшаровують до верху, скелетуючи поверхню гілки нижньої щелепи. Твердосплавним бором кістку просвердлюють на всю товщину гілки щелепи для підсадки матеріалів "Остеопласт" та трикальційфосфат. Тварин виводять з експерименту на 30 добу. Аналогічну операцію, як контроль, без підсадки матеріалу проводять у тієї ж тварини з протилежного боку. Недоліком цього способу є те, що мінімальний розмір альвеолярного відростка нижньої щелепи щура дозволяє формувати лише плиткий кістковий дефект діаметром до 2 мм, що є перешкодою для імплантації матеріалу в кількості, достатній для аналізу результатів. У процесі описаної операції значним чином травмуються жувальні м'язи з обох боків щелепи, докорінно порушуючи харчування, що унеможливлює життєдіяльність тварини до 30 днів. Окрім того, 1 UA 100354 C2 5 10 15 20 25 30 35 40 45 50 55 60 строки біодеградації кісткового матеріалу "Остеопласт" починаються від 120 діб, а у кістковопластичного матеріалу -трикальційфосфату – через ще довший термін, тому за 30 діб не вдається достовірно та повною мірою оцінити отриманий результат. Недоліком усіх вищезгаданих способів є також відсутність у експериментальних тварин станів остеопоротичної резорбції кісткової тканини, що не дозволяє повноцінно простежити динаміку поведінки імплантованого матеріалу в умовах патологічного процесу. В основу винаходу поставлено задачу забезпечити можливість збільшення площі для здійснення штучного кісткового дефекту в умовах остеопорозу, що дозволить достовірніше та легше дослідити регенеративний процес, а також мінімізує рівень загибелі експериментальних тварин. Поставлена задача вирішується тим, що у способі експериментального дослідження регенерації кісткового дефекту в умовах системного остеопорозу, що включає утворення штучного кісткового дефекту і підсадку кісткового або кістково-пластичного матеріалів, згідно з винаходом, у щура попередньо викликають остеопоротичний процес кісткової тканини, а штучний кістковий дефект формують у хвостовому хребці, розміром 2,5-4,5 мм. Новим у вирішенні задачі є те, що запропонований спосіб вперше передбачає експериментальні дослідження в умовах створеного системного остеопорозу, а також включення хвостового хребця в експериментальне дослідження регенеративних процесів кісткової тканини, що забезпечує простий доступ до операційного поля, відсутність складності у формуванні дефекту, добре сприйняття такої операції тваринами, легке спостереження за динамікою процесу загоєння. Все це створює можливість проведення широкомасштабного та довготривалого експерименту із залученням великої кількості різноманітних кісткових матеріалів та їх порівняльної характеристики у післяопераційному періоді. Окрім того, досягається мінімальний рівень загибелі експериментальних тварин (щурів). Спосіб експериментального дослідження регенерації кісткової тканини в умовах змодельованого системного остеопорозу при застосуванні різних за походженням кісткових та кістковопластичних матеріалів полягає у використанні абсолютно нового об'єкта дослідження, а саме хвостового хребця щура, у якому створюють штучний кістковий дефект достатнього розміру (2,5-3,5-4,5 мм) для проведення досліджень. Просте виконання запропонованого способу дозволяє тестувати будь-які кісткові матеріали штучного, тваринного чи іншого походження, зокрема досліджувати їхній максимальний регенераторний потенціал саме в умовах остеопорозу кісткової тканини та простежувати у динаміці місцеву шкірну реакцію, у порівнянні із загоєнням аналогічного дефекту під кров'яним згустком. Винахід ілюструється зображеннями експериментального дослідження. На Фіг. 1 ® представлена рентгенограма хвостового хребця щура з підсадкою матеріалу "Колапан-Л " (120 доба спостереження), де 1 - посилення щільності новосформованої кістки на місці ® імплантованого матеріалу "Колапан-Л »; на Фіг. 2 - рентгенограма хвостового хребця щура з ® підсадкою матеріалу "Остеопласт -К" (120 доба спостереження), де 2 - зрілий характер ® кісткових трабекул на місці імплантованого матеріалу "Остеопласт -К"; на Фіг. 3 - гістологічна ® картина хребця щура на 60 добу після підсадки матеріалу "Остеопласт -К", де 3 - вогнища новоутворення органічної матриці кістки, 4 - проліферація остеобластів, 5 - відкладання остеоїду на поверхні збережених кісткових балок (забарвлення гематоксиліном та еозином; мікрофотографія, збільшення: х150), на Фіг. 4 - гістологічна картина хребця щура на 120 добу ® після підсадки матеріалу "Остеопласт -К", де 6 - ділянки новоутвореної губчастої кістки (забарвлення гематоксиліном та еозином; мікрофотографія, збільшення: х75), на Фіг. 5 сканувальна електронна мікроскопія (СЕМ) хвостового хребця щура на 120 добу спостереження ® після підсадки матеріалу "Остеопласт -К", на Фіг. 6 - рентгенограма хвостового хребця щура, ушитого під кров'яним згустком (60 доба спостереження), де 7 - пустотілий кістковий дефект, на Фіг. 7 - гістологічна картина хвостового хребця щура з кістковим дефектом, ушитим під кров'яним згустком (60 доба спостереження), де 8 - лізис губчастої кістки, 9 - розростання грануляційної тканини, 10 - формування сполучнотканинної капсули (забарвлення гематоксиліном та еозином; мікрофотографія; збільшення: х150), на Фіг. 8 - СЕМ хвостового хребця щура з кістковим дефектом, ушитим під кров'яним згустком (60 доба спостереження) відсутність заповнення кісткового дефекту. Спосіб експериментального дослідження регенерації кісткового дефекту в умовах системного остеопорозу здійснюють таким чином. Для створення системного остеопорозу у раціон щурів на 2 місяці вводили трилон Б (ЕДТА), що викликає в організмі розбалансування білково-мінерального обміну з остеопоротичними змінами у кістках скелету. В умовах місцевого знечулення 2 % розчином новокаїну після 2 UA 100354 C2 5 10 15 20 25 30 35 40 45 50 55 вистригання волосяного покриву і туалету операційного поля антисептиком проводять лінійний поздовжній розріз 10 мм в ділянці верхньої третини хвоста щура, відшаровують сухожилля та м'які тканини. Хвостовий хребець скелетують распатором на площу, необхідну для створення кісткового дефекту. По центру хребця кулястим стоматологічним бором формують кістковий дефект розміром 2,5-4,5 мм і заповнюють його кістковим матеріалом. Рану ушивають поліамідним шовним матеріалом. Туалет рани здійснюють розчином брильянтового зеленого без накладання захисної пов'язки. Профілактику гнійних ускладнень здійснюють з дотриманням правил асептики і антисептики. Стимуляцію процесу загоєння за допомогою антибіотикотерапії чи іншими засобами не проводять з метою простеження ізольованого потенціалу імплантованих матеріалів. Наводимо здійснення запропонованого способу. Експериментальні дослідження були виконані на дорослих 48 щурах-самках лінії "Вістар" середньою масою 320 г, які були розділені на 4 групи по 12 тварин у кожній: дослідна група № 1-12 щурів із хірургічною підсадкою ® матеріалу "Колапан-Л »; дослідна група № 2-12 щурів із хірургічною підсадкою матеріалу ® "Остеопласт -К"; дослідна група № 3-12 щурів із хірургічною підсадкою матеріалу "Easy Graft™»; група контролю № 4-12 щурів із кістковим дефектом, ушитим під кров'яним згустком. Модель системного остеопорозу тварин було отримано згідно з відомою методикою: у раціон щурів на 2 місяці вводили трилон Б (ЕДТА), що викликає в організмі розбалансування білковомінерального обміну з остеопоротичними змінами у кістках скелету [Пат. РФ № 2070031, МПК А61К6/02; опубл. 1996.12.10]. Через 60 і 120 діб по 6 тварин із кожної групи виводили з експерименту шляхом змертвіння збільшеною експозицією ефірного наркозу. Виділяли хвостовий фрагмент, робили знімок цифровою камерою шкірної реакції (стан рубця), проводили рентгенографію макропрепарату. Критеріями макроскопічного дослідження слугували строки загоєння кісткового дефекту, вид загоєння, ускладнення в ділянці операційного поля, розмір кісткового дефекту, наявність і чіткість його контурів, вигляд тканини в центрі кісткового дефекту (щільність, однорідність, диференціювання). Динаміку змін та інтенсивність репаративного остеогенезу в зоні кісткового дефекту оцінювали за 10-кратно збільшеними рентгенограмами. Відділяли шкірний покрив, вилучали хребці з імплантованим матеріалом, фотографували стан окістя над імплантованим матеріалом. Хвостові хребці акуратно відпрепаровували від оточуючих м'язів, три з яких фіксували у 10 % розчині нейтрального формаліну. Декальцинацію здійснювали у 10 % розчині азотної кислоти на 5 % формаліні з додаванням оцтовокислого калію з розрахунку 5 г на 100 мл кислотноформалінового розчину (за Б.А. Віленсоном, 1950). Зневоднення зразків проводили у розчинах етилового спирту зростаючої концентрації, після чого заливали їх у парафін. Зрізи забарвлювали гематоксиліном та еозином за стандартною методикою. Мікрофотографування проводили за допомогою мікроскопа Axioskop, перехідного оптичного пристрою Optem 257010, цифрової камера Nikon Coolpix 5400. Збільшення на мікрофотографіях 13×9 (см) визначали за допомогою тестового зразка "МИРА" (ГК 7.216.028-01, виробництво НДІ "Квант"). Реальне збільшення на мікрофотографіях складало, відповідно, для об'єктива х10 х75, для об'єктива х20 - х150, для об'єктива х40 - х300. Для вивчення морфології поверхні контакту імплантованих матеріалів з кістковою тканиною наступні три хребці фіксували в 4 % розчині глутаральдегіду, послідовно зневоднювали у зростаючих розчинах спиртів 10, 40, 70 %. Зневоднені зразки приклеювали на латунні циліндрики оберненим боком сколу до поверхні столика. На свіжі сколи кісткової тканини проводили напилення тонких шарів міді методом термічного напилення у вакуумному запилювачі ВУП-5. Дослідження металізованих поверхонь сколів фосфоритів проводили на сканувальному електронному мікроскопі JEOL-T220A (JEOL, Японія). У 12 експериментальних щурів дослідної групи № 1 проведено операцію підсадки в ® кістковий дефект хвостового хребця гранул матеріалу "Колапан-Л » ("Интермедапатит", РФ), що складається з синтетичного гідроксіапатиту і склерального колагену з додаванням лінкоміцину гідрохлориду. Після місцевого знечулення, підготовки операційного поля, розрізу, відсепаровування тканин та формування кісткового дефекту хвостового хребця, введено ® гранулу "Колапан-Л ». Рану ушито, опрацьовано антисептично. Було відмічено, що загоєння раневої поверхні відбувалось на 8-10 добу. Шкірна реакція вказувала на нормальний перебіг післяопераційного періоду. Ознаки запального процесу зникали на 11-12 добу. Впродовж двох місяців формувалась рубцева ранева поверхня з поступовим розсмоктуванням рубця. 3 UA 100354 C2 5 10 15 20 25 30 35 40 45 50 55 60 На рентгенограмі через 60 діб відмічали надмірно пухку структуру формування новоутвореної кісткової тканини, яка недостатньо однорідно виповнювала дефект. Впродовж 120 діб (Фіг. 1) щільність 1 новосформованої кістки посилювалась. ® За даними гістологічного дослідження, на 60 добу після імплантації матеріалу "Колапан-Л » вогнищево, в оточенні прошарків зрілої сполучної тканини простежували структури ніжногранулярного вигляду нерівномірного базофільного забарвлення, довкола яких скупчення клітин моноцитарно-макрофагального ряду, розділених прошарками новоутвореної сполучної тканини з великою кількістю клітин фібробластичного ряду. На периферії материнських кісткових балочок визначали активну проліферацію остеобластів. За даними СЕМ, на 60 добу вигляд регенерату корелював із рентгенографічними показниками та гістологічною картиною. Відмічалось нещільне прилягання матеріалу до дна кісткового дефекту, посилене відривом неміцно сформованої структури регенерату від реципієнтного ложа, зумовлене особливостями методики СЕМ, зокрема підготовки зразків. На 120 добу спостереження область регенерату являла собою більш щільну структуру з формуванням остеонних структур. У 12 експериментальних щурів дослідної групи № 2 проведено операцію підсадки матеріалу ® "Остеопласт -К" (НПК "Витаформ-Р", РФ). Створений на основі недемінералізованого кісткового ксеноколагену, насичений сульфатованими глікозаміногліканами матеріал у вигляді крихти має здатність виповнювати та підтримувати об'єм кісткового дефекту за рахунок своєї структури та архітектоніки, виконує остеокондуктивну та остеоіндуктивну функцію. Після місцевого знечулення, підготовки операційного поля, розрізу, відсепаровування тканин ® та формування кісткового дефекту хвостового хребця введено крихту "Остеопласт -К". Рану ушито, опрацьовано антисептично. Стартування процесів загоєння відбувалось вже на 5-6 добу експерименту. Шкірна реакція вказувала на нормальний перебіг післяопераційного періоду. Ознаки запального процесу зникали на 8-9 добу, і рана загоювалась первинним натягом. Рентгенологічно відбувалось активне формування кісткової тканини вже на 60 добу експерименту, хаотично розташовані кісткові трабекули займали велику площу і до 120 доби (Фіг. 2) мали достатньо зрілий характер 2. Згідно з результатами гістологічного дослідження, на 60 добу після введення матеріалу ® "Остеопласт -К" (Фіг. 3) визначались масивні розростання новоутвореної сполучної тканини з великою кількістю тонкостінних капілярів, вираженою периваскулярною змішано клітинною інфільтрацією, які чергувались із зонами відкладання остеоїду у вигляді прошарків ніжноволокнистої будови, оксифільного забарвлення, розділеного остеобластами. В інших полях зору виявляли пучки колагенових волокон, остеобласти з видовженими веретеноподібними ядрами на межі зі збереженою кістковою тканиною. Визначались вогнища новоутворення органічної матриці кістки 3 у вигляді перекладин, посилене скупчення остеобластів 4 у цих ділянках, а також острівці новоутвореної тканини з зачатками остеоїдної структури 5. На 120 добу спостереження (Фіг. 4) виявляли новоутворену губчасту кісткову тканину дрібночарункової структури 6. Колагенові волокна органічної матриці з явищами анізохромії, переважно базофільні, лінії склеювання орієнтовані хаотично, остеокласти локалізовані у вигляді груп. Подекуди, переважно у центрі полів новоутвореної кістки, спостерігали вогнища остеоїда ніжноволокнистої структури з помірною кількістю остеобластів. За даними СЕМ, на 60 добу простежували прошарки фіброретикулярної тканини, тріщини різного розміру з пустими лакунами остеоцитів. По краю порожнини від імплантованого матеріалу поряд з фіброретикулярною тканиною розташовувалась молода кісткова тканина зі значною щільністю остеоцитів. Подекуди простежувалась колагеноволокниста тканина та новоутворена грубоволокниста кістка. На 120 добу (Фіг. 5) відмічали утворення грубоволокнистої кісткової тканини; із судинними каналами різного діаметра та численними прориваючими волокнами. У 12 експериментальних щурів дослідної групи № 3 використано "Easy Graft™» (DS Dental, Швейцарія) - синтетичний остеокондуктивний, на основі чистої фази -трикальційфосфату, остеотропний матеріал. У роботі застосовували гранули розміром від 500 мкм. Після місцевого знечулення, підготовки операційного поля, розрізу, відсепаровування тканин та формування кісткового дефекту хвостового хребця, введено гранули "Easy Graft™». Рану ушито, опрацьовано антисептично. Спостерігали початок процесів загоєння на 5-6 добу експерименту. Шкірна реакція вказувала на нормальний перебіг післяопераційного періоду. Ознаки запального процесу повністю зникали на 8-9 добу, і рана загоювалась первинним натягом. 4 UA 100354 C2 5 10 15 20 25 30 35 40 45 50 Через 60 діб на рентгенограмі простежували конгломерат з часточками нерозсмоктаних гранул матеріалу, а вже на 120 добу свіжосформована кісткова тканина достатньо різко контурувала на фоні сусідніх незадіяних хребців та була вільною від частинок гранул. Гістологічно на 60 добу експерименту частина фрагментів імплантованого матеріалу проходила процес дефрагментації і заміщення кістковою тканиною. Впродовж усього терміну ділянка кісткового дефекту пронизувалась крупними кістковими трабекулами з активними процесами компактизації кісткової тканини та ознаками біодеградації матеріалу. За результатами СЕМ, через 60 діб після операції в проекції кісткового дефекту відмічалась м'якотканинна мозоля з вищим ступенем мінералізації, високої інтенсивності, неоднорідної структури. На цьому терміні відмічався фізіологічний остеосклероз навколо крайового кісткового дефекту, утворювалась пластинчаста кісткова тканина, проходив процес формування окремих трабекул. На 120 добу відмічали відновлення кісткової тканини в проекції кісткового дефекту. Новоутворена кістка виглядала незріло: кісткові балки нерівномірні за формою і величиною, хаотично розташовані. У 12 експериментальних щурів групи контролю створено штучний кістковий дефект хвостового хребця та проведено ушивання рани лише під кров'яним згустком. У перші післяопераційні дні ранова ділянка була набряклою та гіперемованою. Загоєння відбувалось достатньо сповільненими темпами (13-15 діб). Дослідження тканинної реакції вказувало на те, що загоєння кісткової рани під кров'яним згустком у чотирьох випадках супроводилось інфікуванням, розвитком запального процесу та гноєтечею. У решті випадках і на 60 добу, і на 120 добу простежувався келоїдний рубець із явищами западання тканин у сторону кісткового дефекту. Після вилучення хвостових фрагментів через 60 діб на рентгенограмі (Фіг. 6) простежували пустотілі кісткові дефекти 7, відсутність первинної кісткової мозолі, заокруглені краї кісткового дефекту з остеосклеротичною облямівкою. Через 120 діб отримана картина демонструвала хаотично побудовану пухку розмиту структуру в ділянці кісткового дефекту. Гістологічно при ушиванні кісткового дефекту під кров'яним згустком на 60 добу (Фіг. 7) по периферії кісткового дефекту хребця визначалися розростання сполучної тканини, множинні дрібні вогнища хрящової тканини та поодинокі вогнища новоутвореної органічної матриці кістки остеоїдної структури. У центрі пошкодження простежували лізис губчастої кістки 8 з вогнищами розростань грануляційної тканини 9. Виявляли фрагменти губчастої кістки з явищами остеокластичної резорбції, довкола якої сформувалася сполучнотканинна капсула 10. Новоутворена кісткова тканина на поверхні збережених кісткових балочок виражена слабо. На 120 добу у препаратах спостерігалися масивні розростання новоутвореної грануляційної тканини з великою кількістю тонкостінних капілярів із широким просвітом, у центрі - некротичні маси та фрагменти кістки, що лізується, велика кількість нейтрофілів. По периферії спостерігали зрілу фіброзну тканину, в окремих полях зору - посилену проліферацію остеобластів із відкладаннями остеоїда на поверхні відносно неушкоджених балок. За результатами СЕМ, на 60 добу (Фіг. 8) простежувалась відсутність заповнення кісткового дефекту. Шар колагеноволокнистої тканини по периметру порожнини був різним - від тонкого та щільного, до широкого і пухкого. Через 120 діб вздовж периметра порожнини простежували фіброзну тканину, ширина якої на різних ділянках була неоднакова. Спосіб експериментального дослідження регенерації кісткової тканини при застосуванні різних кісткових та кістково-пластичних матеріалів в умовах попередньо реалізованих механізмів остеопоротичного процесу полягає у використанні абсолютно нового об'єкта дослідження, а саме хвостового хребця щура, в якому створюється штучний кістковий дефект достатнього розміру для проведення досліджень. Відтак, використання кісткових та кістковопластичних матеріалів створює можливість оптимізувати процеси репаративної регенерації, забезпечуючи послідовне і повноцінне відновлення тканинних структур із практично відсутніми ознаками запальної інфільтрації. ФОРМУЛА ВИНАХОДУ 55 60 1. Спосіб експериментального дослідження регенерації кісткового дефекту в умовах системного остеопорозу, що включає утворення штучного кісткового дефекту та підсадку кісткового або кістково-пластичного матеріалів, який відрізняється тим, що у щура попередньо викликають остеопоротичний процес кісткової тканини, а штучний кістковий дефект формують у хвостовому хребці. 2. Спосіб за п. 1, який відрізняється тим, що штучний кістковий дефект формують розміром 2,5×4,5 мм. 5 UA 100354 C2 6 UA 100354 C2 7 UA 100354 C2 8 UA 100354 C2 Комп’ютерна верстка І. Скворцова Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 9
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod of experimental study of bone deficiency regeneration in conditions of systemic osteoporosis
Автори англійськоюHodovana Olesia Ivanivna, Stoika Rostyslav Stepanovych, Heraschenko Serhii Borysovych, Dieltsova Olena Ivanivna, Kliuchivska Olha Yuriivna, Zaichenko Oleksandr Serhiiovych
Назва патенту російськоюСпособ экспериментального исследования регенерации костного дефекта в условиях системного остеопороза
Автори російськоюГодована Олеся Ивановна, Стойка Ростислав Степанович, Геращенко Сергей Борисович, Дельцова Елена Ивановна, Ключивская Ольга Юрьевна, Зайченко Александр Сергеевич
МПК / Мітки
МПК: G09B 23/28
Мітки: дефекту, регенерації, умовах, системного, остеопорозу, експериментального, дослідження, кісткового, спосіб
Код посилання
<a href="https://ua.patents.su/11-100354-sposib-eksperimentalnogo-doslidzhennya-regeneraci-kistkovogo-defektu-v-umovakh-sistemnogo-osteoporozu.html" target="_blank" rel="follow" title="База патентів України">Спосіб експериментального дослідження регенерації кісткового дефекту в умовах системного остеопорозу</a>
Попередній патент: Декодування цифрових потоків кодованого багатоканального аудіосигналу з використанням адаптивного гібридного перетворення
Наступний патент: Спосіб отримання морфолінію 3-метил-1,2,4,-триазоліл-5-тіоацетату
Випадковий патент: Засіб для пригнічення дисфункціональної маткової кровотечі