Спосіб отримання резистентної до вірусу трансгенної рослини
Номер патенту: 29438
Опубліковано: 15.11.2000
Автори: Теері Теему, Саарма Март, Труве Ерккі, Келве Мерікке
Текст
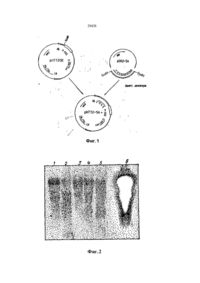
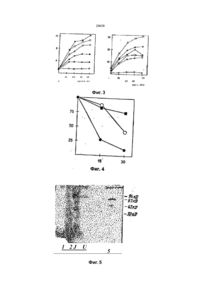
УКРАЇНА UA С2 (11,29438 (із, (51) 6 C12N15/82,15/54, А01Н1/00 МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ ДЕРЖАВНИЙ ДЕПАРТА МЕНТ ІНТЕЛЕК ТУАЛЬНОЇ ВЛАСНОСТІ ОПИС ДО ПАТЕНТУ НА ВИНАХІД (54} СПОСІБ ОТРИМАННЯ РЕЗИСТЕНТНОЇ ДО ВІРУСУ ТРАНСГЕННОЇ РОСЛИНИ (21)94105927 (22)24.09.1992 (24,15.11.2000 ' . (33, ЄР (86) РСТ/ЕР92/02217, 24.09.1992 (46) 15.11.2000, Бюл № б, 2000 р. (72) Саарма Март (FI), Келве Мерікке (ЕЕ), Тр уве Ерккі (ЕЕ), Теері Теему (FI) (73) КЕМІРА БІО ХОЛДІНГ Б.В. (NL) (56) Btachy et.al., Annu. Rev. Ph ytopathol., v. 29, h. 451-^*74, 1990. (57) 1. Способ получения резистентного к вир усу трансгенного растения, включающий генетическое кодирование ДНК-последовательно'сти, содержа щей фрагмент ДНК, кодирующий полипептид, обеспечивающий устойчивость к вирусу, введение полученной ДНК в клетки растений, получение регенераторов и отбор регенератов, экспрессирующи х указанный полипептид, о тли чающийся тем, что конструир уют ДНК-последовательность, содержащую фрагмент, кодирующий полипептид с активностью 2,5 А-синтетазы. 2. Способ по п. 1, о тличающийся тем, что генети чески сконструированную ДНК-последовательность предварительно встраивают а вектор под управле нием промотора, позволяющего осуществить ее экспрессию в данном трансгенном растении. 3. Способ по п 2 , о тлича ющийся тем, что век тор представляет собой рНТТ2-5* (DSM N 6815). 4. Способ по п. 1, о тли чающийся тем, что введе ние в клетки растений осуществляют п утем трано фекций с использованием Agrobacterium. Изобретение относится к способу получения трансгенного растения, проявляющего резистентность к многим вирусам, который содержит генетически сконструированную ДНК-последова тельностъ, содержащую фрагмент, кодирующий полипептид, имеющий активность 2,5А-синтетазы. В литературе описано несколько методов конструирования вирус-резистентных растений. Наиболее близким к способу по изобретению является способ получения резистентных к вирусу трансгенных растений путем экспрессии белка оболочки соответствующего растительного вируса в указанных растениях (Beachy et aL, Annu. Rev. Phytopathol., 28 (1990), 451-474). Существенная вирусная резистентность к нескольким растительным вирусам продемонстрирована путем экспрессии специфической вирусной антисмысловой РНК в трансгенны х растения х (Cuozzo et aL, Bio/Technology, 6 (1988), 549-557; Hemenway et al., EMBO J. 7 (1988), 1273-1280). Вирусная актнсмысловая РНК проявляет свою функцию либо гибридизацией со специфическими последовательностями вир усной ДНК или РНК, тем самым блокируя последующие реакции, которые важны для вирусного размножения, либо активностью рибозима, которая приводит к специфическому расщеплению вирусной РНК после гибридизации с указанной вирусной РНК. Основным недостатком вышеупомянутых методов конструирования вирус-резистентны х трансгенных растений является то, что указанные трансгенные растения резистентны то лько к одному вир усу или специфической группе вирусов. Путь метаболизма 2,5А-олигоаденилата является частью системы антивир усного ответа, индуцир уемой интерферонами в клетках млекопитающи х (Lengyel, Annu. Rev. Biochem., 51 (1982), 251-282). Некоторые компоненты пути метаболизма 2,5А обнаружены также в организмах (помимо млекопитающих) птиц, рептилий и амфибий, насе-1 комых, в дрожжах и даже в бактериях (Stark et al.. Nature, 278 (1979), 471-473; Cayley et al., Biochem. Biophys. Res Com., 108 (1982). 1243-1250; Laurence et al., Proc. Natl. Acad. Sci. U. S. A, 81, (1984), 2322-15 2326). В растениях антивир усный фактор (АВФ), производство которого стим улировано вир усным заражением, частично очищен, и его ген, как оказалось, гомологичен человеческому интерферону; Sela et al., in: Plant Resistance To Viruses: Ciba Symp., 133 (1987), 109-119. Обработка вирусом табачной мозаики (ВТМ) зараженных протопластов табака с помощью человеческого интерферона привела к ингибиро вани ю ВТМ-репликации ; Seta et al .. Me th. in En zymology, 119 (1986), 744752. Кроме того, продемонстировано, что 2,5А мо (31)92104676.9 (32)18.03.1992 м О 29438 жет ингибироватъ ВТМ-репликацию в растениях табака; Devash et al., J. Biol. Chem, 259 (1984), 3482-3486 ДНК-поспедоватепьности, гомологичные человеческой 2,5А-синтезе, также обнаружены в геномной ДНК табака; Sela et al, (1987), (см. выше). Однако в литературе о растениях отсутствуют сведения о 2,5А-эависимой РНКазе, которая является частью пути метаболизма 2,5-олигоаденилата у млекопитающих Это позволяет сделать вывод, что 2,5А не ингибирует вир усную инфекцию в растениях посредством 2,5А-зааисимой эндон уклеазы; Devash et al., Biochemistry, 24 (1985), 593-599 Кроме того, описано, что интерферон, продуцируемый в трансгенных растениях, не ингибирует вир усное размножения; De Zoeten et al., Virology, 172 (1989), 213-222. В основном, известный уровень техники не позволяет сделать вывод о том, что путь метаболизма 2,5А-олигоаденилата может быть использован в качестве основы для конструирования трансгенных растений, проявляющих резистентность к многим вирусам. Таким образом, технической задачей настоящего изобретения является создание трансгенного растения, проявляющего резистентность к многим вирусам, с использованием частей пути метаболизма 2,5А-олигоаденилата Согласно настоящему изобретению предлагается способ получения резистентного к вирусу трансгенного растения, включающий генетическое конструирование ДНК-последовательности, содержащий фрагмент ДНК, кодирующий полипептид, с активностью 2,5А-синтетазы, обеспечивающий устойчивость к. вирусу, введение полученной-ДНК в клетки растений, получение регенерантов и отбор регенерантов, экспрессирующих указанный полипептид. Отличием от указанного известного способа (Ann Rev. Ph ytopatholog.. 28. (1990), 451-490) является то, что конструируют ДНК-последовательность, содержащую фрагмент, кодирующий полипептид с активностью 2,5А-синтетазы. Обычно генетически сконструированную ДНК-последовательность предварительно встраивают в вектор под управлением промотора, позволяющего осуществи ть ее экспрессию в данном трансгенном растении. Как правило, вектор представляет собой рНТТ2-5* (DSM N 6815). (Вектор депонирован в соответствии с требованиями Будапештского договора в "Deutsche Sammiung fur Microorganismen (DSM)" под депозитарным номером DSM 6815). Предпочтительно введение ДНК в клетки растений осуществляют п утем трансфекции с использованием системы Agrobacterium. Полученное трансгенное растение, проявляющее резистентно сть к многим вирусам, содержит генетиче ски сконстр уированн ую ДНКпоследова телъность, кодирующую по крайней мер© один полипептид, имеющий активность 2,5 А-син те тазы, причем указанный полипептид после экспрессии способен акти виро вать эн донуклеаз у, вызывающую разрушение вир усной РНК. Термин "резистентность ко многим вирусам" относится к трансгенным растениям, которые в ос новном резистентны к вариетету вир усных гр упп, таких как потеке-, карла- и тобамовирусы. Термин "генетически сконструированная ДНК-последовательность" относится к ДНК-последовательности, которой манипулируют методами генной инженерии, такими как методы рекомбинантных ДНК. Термин "полипептид, имеющий активность 2,5-синтетазы" относится к любому полипептиду, который способен ферментативно синтезировать 5"-дефосфорилированиые или фосфорилированные 2,5-олигонуклеотиды с, тремя или более остатками аденозина, например, 2,5Аз, который является тримером аденилата, связанного 2',5Ффосфодиэфирными связями, и дефосфорилирован у своего 5'-окончания. Термин "эндонуклеаза, вызывающая разрушение вирусной РНІГ относится к гетерологичной или гомологичной эндонуклеазе, которая способна разрушать вирусную РНК п утем ферментативного расщепления. Указанная эндонуклеаза активи-. руется с помощью 2.5А, который синтезируется полипептидом, имеющим активность 2,5А-синтетазы. Предпочтительно, чтобы указанная ДНКпоследовательность или по крайней мере одна часть указанной ДНК-последовательности была гомологична или гетерологична указанному трансгенному растению. Возможно также, чтобы указанная ДНК-пос- ' ледовательность являлась химерной ДНК-последовательностью. Как правило, указаннэя ДНК-последовательность дополнительно кодирует по крайней мере один селектируемый маркер и/или по крайней мере один дополнительный полипептид, такой как указанная эндонуклеаза. Обычно ДНК-последовательность, кодирующую указанный полипептид, получают из млекопитающего гена, растительного гена или гена микроорганизма, либо она является синтетическим геном. В частности ДНК-последовательность, кодирующая указанный полипептид, представляет собой ген крысиной 2,5А-синтетазы (см. фиг. 1). При этом предпочтительно, чтобы указанная эндонуклеаза представляла собой растительную РНКазу L. Экспрессию указанного полипептида осуществляют под управлением индуцируемого или конститутивного промотора, функционирующего в растениях и позволяющего осуществлять индуцированную и/или повышенную экспрессию указанного полипептида. Примерами таких промоторов являются промотор 35S вируса мозаики цветной капусты, промотор рисового актина, промотор rbc S от различных видов, промотор TR2'.Agrobacter, промотор гена фазеолина или промотор NOS. В предпочтительном варианте настоящего изобретения экспрессию 2,5А-синтезирующего полипептида осуществляют под управлением промотора 35S вируса мозаики цветной капусты. Трансгенное растение является однодольным или двудольным растением. В частности, трансгенное растение, например, представляетсобой табак, рис, пшеницу, ячмень, кукурузу, томат, о гурец, сою, сладкий карто фе ль, виногра д, 29438' капусту, сахарную свеклу, хлопчатник, чай» подсолнечник, землянику, розу, хризантему, перец сладкий или картофель. Из полученного трансгенного растения, проявляюще го резистентность к многим вирусам, можно получить размножающийся материал. Термин "размножающийся материал" относится к интактным растениям, либо дифференцированной или недифференцированной растительной ткани, такой как корень, стебель, лист, каллюс, протопласт, суспензионные культуры и семена. Предлагаемый согласно изобретению способ предусматривает введение генетически сконструированной ДНК-последовательности, кодирующей по крайней мере один полипептид, имеющий активность 2,5А-синтетазы, в генетический материал соответствующего растения. Термин "генетический материал" относится к нуклеарному гену растительной клетки, органоидному геному растительной клетки или экстрахромосомной форме. Термин "введение" относится к методу, который способен ввести (интродуцировать) указанную генетически сконструированную ДНК-последовательность в указанный генетический материал растительной клетки. Предпочтительными примерами указанного метода является АдгоЬасїєгіигл-опосредованньїй перенос, растительным вирусом опосредованный перенос, микроинъекция, микропрожектильная бомбардировка, электролорация, ПЭГ-олосредованная трансформация и трансформация растительных протопластов со стабильными векторами на основе вирусов Ниже приводится описание представленных фигур. Фиг. 1. Конструирование плазмиды рНТТ25А+. Фрагмент EcoRI, содержащий кДНК гена крысиной 2,5А-синтетаэы, отрезают от плазм иды pSK2-5A*, липкие концы заполняют и полученный фр а гм ен т ли гир уют в са й т BamH I век то ра рНТТ2О2 с использованием линкеров BamHI. Это позволяет получить вектор рНТТ2-5А+, содержащий ген крысиной 2,5А-синте тазы под управлением промотора CaMV 35S. Фиг. 2. Назерн-блоттинг целой РНК из трансгенных табачных растений, трансформированных с геном 2,5А-синтетазы. 10 мкг целой РНК на каждую дорожку зондируют с помощью [32Р]-меченой кДНК 2,5А-синтетазы. Дорожки 1-5 являются линиями трансгенного табака, а дорожка 6 является кДНК крысиной 2,5А-синтетазы. Фиг. 3. Эффект различно фосфорилированных форм 1 мкМ тримеров 2.5А (А) и те трамеров 2.5А (В) на трансляцию in vitro РНК ВТМ (вируса табачной мозаики} в экстракте пшеничных зачатков. 0 ,8 мкг ВТМ-РНК транслир уют m vi tro . [^S] меченые белки, полученные из 5 мкл проб, преципицируют на стекловолокнистых фильтрах, после чего измеряют введенн ую радиоактивность: О - без 2,5А, О - p p An , D рррАл. р Ал, Л-An , * - без РН К. Фиг. 4. Влияние различны х тримеров 2 ,5 А на скорость разрушения РНК ВТМ в экстракте пшеничных зачатков. ВТМ-РНК выделяют из проб экстракта пшени чны х за чатков, со держаще го 1 мкМ тримеров 2.5А, подвергают Назерн-бпоттингу 32 и гибридизируют с [ Р] -меченой кДНК ВГМ Величину РНК оценивают из авторадиографических снимков при помощи лазерной денситометрии" - бе з 2 ,5 А, W _ р рр Аэ, О - Аз . Фиг. 5. Связывание 2.5А с белками экстракта растительных клеток f^PJ -меченую 2,5А ковалентно структурируют с белками клеточных экстрактов методом NalOj -окисления и разделяют с помощью 12% электрофореза в полиакриламидных гелях с додецилсульфатом натрия Дорожка 1 представляет лизат ретикулоцитов кролика (получен в соответствии с работой Sambrook et al , "Molecular Cloning: A Laboratory Manual", Cold Spring Harbour Laboratory, Cold Spring Harbour Laboratory Press (1989)), дорожка 2 представляет экстракт мышиных L-клеток с немеченой 2,5А, дорожка 3 представляет экстракт мышиных L-клеток, дорожка 4 представляет лизат ретикулоцитов кролика (Amersham), дорожка 5 представляет экстракт картофельных листьев и дорожка 6 представляет экстракт картофельных листьев с немеченой 2.5А. Фиг. 6. Эффект "сердцевины" тримера 2,5А на белковый синтез в табачных протопластах [14С] меченый белкоэый гидролизат прибавляют в культур у табачных протопластов, после чего измер яют общую р адио ак ти вн ость к ле ток : О - бе з , О- І 2. 5А . W -імк МА з. Фиг. 7. Размножение PVX в трансгенных растениях, содержащих ген 2,5А-синтетазы. Интактные растений инфицируют 10 мкг/мл PVX и пробы листьев анализируют TRFIA с использованием антител 21XD2 и конъюгата европия 21XD2. Концентрацию вирусов определяют по величине флуоресценции европия в секунду; О - контроль S R I, \ J - 4 N 1, D- 4 N 5. + - 4 N1 1 t * - 4 N 12. Фиг. 8. Размножение PVS в трансгенных табачных растениях, содержащих ген 2,5А-синтетазы. Интактные растения инфицируют 10 мкг/мл PVS и пробы .листьев анализируют методом ELISA (ферментным иммуносорбентным анализом) с использованием антител S4A4 и конъюгата пероксидазы из хрена S4A4. Концентрацию вирусов определяют по оптической : \~s плотнос ти цветной реакции при 450 нм: контроль S RI, ш - трансгенные рас тения с геном 2,5А-синтетазы в "смысловой" ориентации, -- фон E Lt S A . Фиг. 9. Размножение PV X в дисках листьев трансгенных растений, содержащих ген 2,5А-синтетазы. Листья инфицируют 10 мкг/мл PVX, диски диаметром 8 мм штампуют и содержат в стерильной воде. Диски анализируют как PVX-инфицированные интактные растения (см. фиг. 7): О -контpo/ ibS RI, \ -S -4N10, + -41112. Фиг. 10. Концентрация вирусов (PVX) в выращенных в поле трансгенных картофельных растениях, содержащих ген 2.5А-синтвтаэы. Интактиыв растения инфицируют соком, собранным с PVX-инфицированных табачных растений. 29438 Пробы листьев анализируют методом EUSA с использованием иммунодиагшстачесшго набора для PVX (Boehringer Mannheim). Концентрацию вирусов определяют по оптической плотности цветной реакции при 405 нм. Контр. = контрольный клон; R101, R102, R104, R106, R107, и R2 =трансгенные клоны. Следующие примеры иллюстрируют изобретение. Дополнительные пояснения в отношении методов молекулярной биологии, применяемых в данном изобретении, можно найти в работе Sambrook et al., "Molecular Cloning: A Laboratory Manual" (см выше). Пример 1. A. Конструирование гена 2,5А, содержащего плазмиду рНТТ2-5 А+ кДНК крысиной 2,5А-синтетаэы выделяют из кДНК-библиотеки крысиного гиппокампа в векторе gl10 в соответствии с про-, токолами Amerscham, используя кДНК мышиной 2,5А-синтетаэы в качестве зонда, кДНК субклонируют в сайт EcoRI вектора экспрессии pBIuescript SK+ (Stratagene). Полученную плазмиду называют pSK2~5A. Для трансформации табачны х растений , кДНК крысиной 2,5А-синтетаэы субклонируют в растительный экспрессирующий вектор рНТТ202. кДНК отрезают от pSK2-5A с помощью EcoRI, липкие концы наполняют и кДНК клонируют в BamHI линеаризованную плазмиду рНТТ202 с использованием синтетических линкеров BamHI (фиг. 1). Полученную ппазмиду рНТТ2-5А+ используют для трансформации клеток Agrobacterium. B. Трансформация Agrobacterium плазмидой рНТТ2-5А+. Плазмида рНТТ202 в большей степени основана на последовательности плазмиды pBR322. Векторы клонирования на основе pBR322 обычно не мобилизуются из клетки-хозяина в другую бактерию, однако они содержат "основу мобилизации", сайт bom. Когда функции "хелпєра", кодируемые генами mob хелперных плазмид, обеспечены, векторы клонирования на основе pBR322 также мобилизуются. Для этой цели используют спаривание двух родителей на основе системы, описанной Van Haute et a!.. EMBO J. 2 (1983), 411-417. Є colt — содержащую плазмиду рНТТ2-5А+ (ampR, spc/str") спаривают на L-чзшках с Є coli хєлперным штаммом GJ23, который содержит плазмиду R64drd11 1 а-типа (tetR, str") для необходимых функций tra и вторую хелперную плазмиду pGJ28 (kanR, neoR), обеспечивающую функции mod в условиях in trans с тем, чтобы комплементировать трансмиссию плазмид mob bom* на основе pBR. Клетки с хелперными плазмидами отбирают на L-чашках, содержащих 5 ампициллин, тетрациклин и канамицин. Эти клетки совместно культиви р уют в L-буль оне со штаммом C58 C I Agrobacterium tumefaciens, содержащим Ті-плазмиду pGV2260 (rif*. cbR), когда гены, отвечающие за туморогенез в растительных клетках, замещены последовательностями плазмиды pBR322. Конъюгированные клетки Agrobacterium отбирают на чашках, содержащих рифампицин, спектиномицин и стрептомицин. Поскольку вектор на основе pBR322 нельзя реплицировать в Agrobacterium, только Agrobacteria, когда рекомбинация между pBR322 с последовательностью pGV2260 и рНТТ202 привела к образованию совместно интегрированной молекулы, могут вырасти на селективных чашках. С целью подтверждения того, что ТДНК рекомбинантных плазмид содержит ген 2.5Асинтетазы, выделяют полную ДНК полученных Agrobacteria (Dhaese et. al., N ycl. Acids Res., 7, (1979), 1837-1849) ,и анализируют блоттинг-методом по Саузерну. Пример 2. Трансформация табачных растений с помощью гена 2„5А-синтетазы. Тр ан сген ные ра стен ия SR I N ico tia na tabacum получают п утем Agrobacterium-onocpe до ва нно го п ере но са (Zambryski , Ann u . Re v. Genet 22 (1988), 1-30). Мето д осно ван на том явлении, что Agrobacterium устойчиво переносит сегмент своей Ti-плазмиды в расти тельный ге ном после взаимо действия с ранеными расти тельными клетками . Сегмен т, называемый ТДНК", определяется его со хранившимися гра ничными последо ва тельностями. Генети ческ ую и н фо рм аци ю м еж ду гра ни чн ыми п о сле до ва -' тельностям можно заменить без воздействия на эффекти вность перено са Т-ДНК. Трансформацию табачных растений с помощью гена 2,5 А-синте тазы осуществляют в со ответствии с работой Horsch et al., Science, 227, (1985), 1229-1231. Листья SRI N. tabacum растений, выращенны х на среде MS/2 (Murashige and Skoog, Phys. Plant, 18 (1962), 437-497) в стериль-. ны х условия х при температуре 24°С в течение 1 6 ча со вы х фо топ ерио до в, поме щают ввер х дном в среду са ха розы КЗ-400 м М (Nag y and Maliga , Z. Pflan zenph ysiology, 78 (1976), 453-455) и разрезают на части размером' 0,5-1 кв. см так, чтобы все края были отрезаны. Agrobacte rium с' со вместным интегра том Т-ДНК, выра щенным в минимальной питательной среде М9 (Sambrook et a!., "Molecular Cloning, A Laboratory Manual" (1989), см. вы ше), добавляют в среду са харозы КЗ-400 мМ, и ча шки сохраняют в течение тре х дней при те х же условия х, что и для растений. Диски листье в промывают и перено сят ввер х дном в твердую среду LS (Linsmaier and Skoog, Phys. Plant, (1965), 100-127), содержащую Кла-форан для уничтожения Agrobacteria, бензилами-нопурин (БАП) для индуцирования корней из дисков листьев и канамицин для отбора на трансформированные клетки, поскольку сегмент плазмиды рНТТ2-5А+, совместно интегрированный в Т-ДНК плазмиды pGV2260, также содержит ген nos-npt2, придающий устойчивость к канамицину для трансформированных клеток. После появления корней их отрезают и высе вают на аналоги чную среду без БАП. Полностью укорененные растения сохраняют на среде MS/2 при условия х, описанных выше. С целью проверки того, что растения являются действительно трансформированными, полные ДНК и РНК из тканей листьев выделяют а соответствии с методом Dellaporta et al.. Plant. Мої. Biol. Rep., 1 (1983) 19-21, и Verwoerd et al., Nucl. Acids Res., 17 (1939), 2362, соответственно. Блоттинг-анализы по Назерну и Саузерну осуществляют в соответствии с протоколами Amersham с использованием [32Р] -меченой кДНК 2,5А-синтетазы в качеств© зонда (фиг. 2). 29438 Пример 3. Идентификация активности 2,5А-зависимой РНКазы. Исследования по воздействию различных 2,5-олигоаденилатных форм под влиянием вируса табачной мозаики (ВТМ) во время трансляции in vitro в экстракте пшеничных зачатков (ЭПЭ) показывают, что нефосфорилированные три- и тетрамеры 2,5А могут эффективно ингибировать трансляцию РНК ВТМ в ЭПЗ (фиг. 3). Скорости разрушения РНК ВТМ во время трансляции in vitro в присутствии и отсутствии 2.5А анализируют путем взятия проб из трансляционной смеси и выделения РНК, как описано в работе Too ts et al, Мо ї. Biof (USSR), 22 (1988), 1473-1481 После электрофореза в агароэно/-формамидном геле и блоттинга по Назерну концентрацию РНК в пробах оценивают путем сканирования авторадиограмм [3 PJ меченных фильтров с помощью лазерного денситометра Прибавление "сердцевины" тримера 2,5А приводит к быстрому разрушению РНК ВТМ, тогда как скорость разрушения РНК ВТМ намного ниже в контрольных экспериментах с применением и без применения трифосфорилированной 2,5А (фиг. 4). В заключение, ингибирующее влияние "сердцевины" 2,5А на трансляцию in vitro в растительном бесклеточном экстракте вызвано быстрым разрушением субстрактной РНК С целью идентификации 2,5А-связывающих белков в растительных экстракта х, 2 ,5 А пигируют к [MPJ рСр, как описано в работе Knight et al.. Methods in Enzymology, 79 (1981), 216-227. [32P]меченую 2,5А ковалентно структурируют с белками картофельных клеточных экстрактов методом №Ю4-оки сления в соо тве тствии с рабо той Wreschner et al, Eur. J. Biochem , 124 (1982), 261268 Специфичность связывания контролируют сравнительным анализом, согласно которому немеченую 2,5А прибавляют в избытке в реакционные смеси. Реакционные смеси разделяют гель электрофорезом в 12% полиакриламиде с додецилсульфатом натрия. Белок размером 70 кД идентифицируют в экстрактах картофельных листьев, которые специфическим образом связываются с меченой 2,5А (фиг. 5). Специфичность связывания показана в конкурентном анализе, где немеченая 2,5А полностью замещает [32Р] 2,5А в картофельных Р экстрактах (фиг. 5). Поскольку 2,5 А-индуцированное ингибирование трансляции in vitro в ЭРЗ вызвано быстрым разрушением РНК ВТМ, 2,5А связывающий белок массой 70 кД из растительного экстракта представляет собой 2,5А-активированную растительную эндорибонуклеазу. Также исследуют воздействие 2.5 А на белковый синтез в протопластах SRI N. tabacum Протопласты получают в соотве тствии с описанием в работе Horkanen et al., "Bio technology in tropical crop improvement: proceedings of the internattonal biotechnology workshop", (1988), из лиственного мезофилла растений, выращенных в стерильных условиях, и со храняют в среде сахарозы КЗ—400 мМ. После прибавления [иС] -меченого аминокислотного гидролизата пробы собирают из смеси протопластов для анализа концентрации белков, синтезированных de no vo. Белки лреципицируют трихлоруксусной кислотой и измеряют инкорпорированную радиоактивность. 2,5А эффективно ингибирует белковый синтез в табачных протоплатах (фиг. 6), что еще раз показывает влияние 2.5А в качестве ингибитора белкового синтеза в ре тительных системах in vi vo. Идентифицировав 2,5А-эависимую активность РНКазы в картофеле и табаке, можно сделать вывод о том, что существует путь метаболизма в растениях, который частично напоминает интерферон - индуцированный путь метаболизма млекопитающих, который вызывает вирусную резистентность. Пример 4. Размножение картофельных вирусов X и S и вируса табачной мозаики в 2,5А трансгенных растениях. С целью исследования размножения раз-' личных вирусов в трансгенных растениях, экспрессирующи х 2,5 А-синтетазу, осуществляют различные эксперименты по заражению. Растения, растущие на среде MS/2, переносят на почву за две недели до заражения. С целью заражения 2-3 нижних листа обрабатывают карборундом, 10*1 мкг/мл вируса вр учн ую инокулир уют на повер хность листьев и карборунд промывают через 30 минут стерильной водой. Растения сохраняют в течение 16-часовых фотопериодов на один месяц. Пробы собирают путем отбора одного из ма- ' леньких верхних листьев каждый пятый день и замораживания их в жидком азоте. Пробы листьев гомогенизируют в ступке, прибавляя 1 мл буфера для иммуноанализа на грамм лиственного материала. Для обнаружения картофельного вируса X (PVX) использ уют моноклональные антите ла 21XD2 и фтороиммуноанализ с разрешением по времени (TRF1A), как описано в работе Sober et. al, J. gen . Virol , 69 (1988), 1799-1807 , и Sinijarvet. al., J. gen. Virol., 69 (1988), 991-998, соответствен но. Концентрацию PVS измеряют методом DAS-ELISA с использованием моноклональных антител S4A4 (Sinijarv et. a!, 1988, выше). Через один месяц после заражения с использованием 10 мкг/мл PVX все трансгенные растения содержат поддающиеся определению уровни PVX, однако вир усная концентрация намного ниже, чем в контрольных растениях (фи г. 7). Кроме того, в этих растениях обнаруживаемое размножение PVX начинается на 1-2 недели позднее, нежели в контрольных растениях. Через один ме сяц после з аражения 10 мкг/мл PVS все трансгенные табачные линии показывают полн ую резистен тность к заражению PVS и 5 содержат едва лишь обнаруживаемый уровень PVS (фиг, 8). Осуществляют также заражение дисков листьев с помощью PVX и дополнительно с помощью ВТМ. Листья трансгенных табачных линий заражают, как описано выше. Диски диаметром 8 мм штампуют из листьев и хранят вверх дном в стерильной воде при температуре 24°С в течение от 16-часовых фотопериодов до пяти дней. Диски замораживают в жидком азоте и гомогенизируют. Заражение 10 мкг/мл PVX дает результаты, аналогичные тем, которые наблюдают у интактных растений. Диски листьев некоторых трансгенных табачны х линий со держат мень ше вир уса, а опре 29438 деляемое размножение картофельных вирусов начинается намного раньше, нежели е интаетных растениях Концентрация ВТМ в дисках листьев через пять дней после заражения показывает явное ингибированив вирусного размножений в отношении контрольных растений. Пример 5. *. Обнаружение 2,5 - олигоаденилатов в трансгенных растениях. С целью определения концентрации 2 .5 А в трансгенны х ра стения х SRt табака, экспрессирующи х 2,5 А-синте таз у, получают экстракты листьев о т зараженных и н взараженных вир усом растений . Сравни тельный анализ проводя т в сравнении с немеченой 2,5 А из расти тельны х экстрактов с помощью 2,5А [33 PJ pCp. Мы шиный экстрак т клеток линии L использ уют в качестве источника для 2,5 А- связывающей эндорибон уклеазы L (РН Казы L). Смесь меченой 2.5 А, экстракта L-клеток и экстракта листьев инкубир уют в течение 90 мин ут на льду. Белки из смеси пре'ципитир уют на нитроце ллюло эны х фильтра х,^ после че го подбчиты вают радиоакти вно сть филь тров и филь трата . Смесь без растительного экстракта используют в качестве положитель ного контроля, то гда как в качестве о трица тель ного контроля используют смесь, в которой 10" 7 М тримера немеченой 2 ,5 А полно стью замещают меченую 2 ,5 А. Результаты показывают, что незаряженные трансгенные растения, эхслрессирующие 2.5Асинтетазу, содержат малое (если только оно есть) обнаруживаемое количество 2,5А аналогично тому, что наблюдается у контрольных растений и трансгенных растений, несущи х ген 2,5А-синтета аы в антисмыслоаой ориентации (Таблица 1). Это вызвано тем, что 2,5А-синтетаза экспрессируется как неактивный фермент, который может быть активирован двухцепочечной РНК. Когда трансгенные растения, экслрессирующие 2,5А-синтетазу, заражены PVX, 2.5 А становится обнаруживаемой и ее внутриклеточные концентрации даже более высокие, чем в контрольных смесях. Такое повышение уровня содержания 2.5А не обнаруживается в контрольных SR I-растения х. Повы шение уровня содержания 2,5А в трансгенных растениях приводит к ингибированию PVX-, PVS- и ВТМразмножения. Из представленных данных видно, что двухцепочечные реплицирующие промежуточные продукты РНК PVX способны активировать неактивную 2,5 А-синте таэу, что приводит к синтезу вн утриклеточной 2,5А. Пример 6. Определение заражения PVX в трансгенных растениях картофеля. Полевое испытание. Интактные растения картофеля, содержащие ген 2,5А-синтетазы, заражают соком, собранным с PVX-зараженных табачных растений и выращенных в поле. Пробы листьев анализируют через пять недель после заражения методом EJJSA с использованием иммунодиагностического комплекса для PVX (Boehnnger Mannheim). Вирусную концентрацию определяют по оптической плотности цветной реакции при 405 нм (см. фиг. 10). Концентрация PVX в растениях, содержащи х ген 2,5 А-син тетазы, заметно снижается по сравнению с контрольными растениями. Таблица 1 Сравнительный радиосвязующий анализ для определения концентраций 2,5-олигоаденилатов в 2,5А-синтета за-трансгенных растениях до и после заражения с применением PVX F Растения Нормализированный % фильтрата (положительный контроль без растительного материала взят эа 100%) 29,2 65,5 47,2 54.6 191,7 100,0 Контрольное SRI Трансгенное 2,5А, антисмысловая конструкция Трансгенное 2.5А, смысловая конструкция Контрольное SRI х PVX Трансгенное 2.5А+ х PVX Без растительного экстракта в 29438 Фиг. 1 Фиг. 2 29438 IS ЗО А 49 60 45 врем я, ют Фиг. 3 30 1 2J U 5 Фиг. 5 30 60 вре т, нйн 29438 0.5 1.0 1.5 еооооо Фиг. 7 О 25 і о.г f 0 15 4сл б О 1 б O.OS Ifl Фиг. 8 10 29438 70 22 64 28 34 40 вре мя, ц 46 58 Фиг. 9 3000 2500 R2 концен трация вируса нг/ овеї ут ыаосу Тираж 50 екэ. Відкрите акціонерне товариство «Патент» Україна, 88000, м. Ужгород, вул. Гагаріна, 101 (031 22 )3- 72- 89 (0 312 2) 2-5 7-0 3 10 Контр.
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod of obtaining virus-resistant transgenic plant
Автори англійськоюSaarma Marth, Kelve Merikke, Truve Erkki, Teeri Teemu
Назва патенту російськоюСпособ получения резистентного к вирусу трансгенного растения
Автори російськоюСаарма Март, Келве Мерикке, Труве Эркки, Теери Теему
МПК / Мітки
МПК: C12N 9/12, C12N 15/54, C12N 5/10, C12N 15/09, A01H 5/00, C12N 15/82
Мітки: рослини, спосіб, резистентної, вірусу, отримання, трансгенної
Код посилання
<a href="https://ua.patents.su/11-29438-sposib-otrimannya-rezistentno-do-virusu-transgenno-roslini.html" target="_blank" rel="follow" title="База патентів України">Спосіб отримання резистентної до вірусу трансгенної рослини</a>
Попередній патент: Інерційний двигун
Наступний патент: Спосіб одержання сиру на основі молока, концентрованого ультрафільтруванням
Випадковий патент: Спосіб консервування гепатоцитів