Азольні сполуки з протигрибковою активністю, спосіб одержання цих сполук, спосіб одержання проміжних сполук та фармацевтична композиція
Номер патенту: 55405
Опубліковано: 15.04.2003
Автори: Альбіні Енріко, Фраіре Крістіна, Скіоппакассі Джованна, Наполетано Мауро
Формула / Реферат
1. Сполука формули (ІІ-А)
, (ІІ-А)
де:
R1 являє собою хлор, фтор, бром або трифторметил;
R2 являє собою водень, хлор, фтор, бром або трифторметил;
Z являє собою СН або N;
R3, R4, R5, які можуть бути однаковими або різними, являють собою водень або С1-С4 алкіл при умові, що R4 відрізняється від R5, якщо R3 - водень;
Х являє собою О, S, SO або SO2;
R6 являє собою С1-С5 поліфторалкільну групу, яка містить щонайменше два атоми фтору і за вибором інші атоми галогенів, вибрані з групи, яка складається з хлору та брому; та їх фармацевтично прийнятні кислі солі.
2. Сполука за пунктом 1, де:
R1 являє собою хлор або фтор;
R2 являє собою водень, хлор або фтор;
R3 являє собою метил або етил;
R4 та R5, однакові або різні, являють собою водень, метил або етил;
Z являє собою N;
R6 являє собою 1,1,2,2-тетрафторетильну групу.
3. Сполука за пунктом 2, де:
R1 являє собою хлор або фтор;
R2 являє собою водень, хлор або фтор;
R3 являє собою метил або етил;
R4 та R5, однакові або різні, являють собою водень, метил або етил;
Z являє собою N;
R6 являє собою 1,1,2,2-тетрафторетильну групу;
Х являє собою О або SO2;
4. Спосіб одержання сполуки за пунктом 1, при якому проводять взаємодію поліфторолефіну формули
,
де Х1 та Х2, які можуть бути різними або однаковими, являють собою F, Сl або СF3;
або взаємодію поліфторованого спирту формули (IV)
R7 = СН2-ОН , (IV)
де R7 являє собою С1-С4 поліфторалкільну групу, яка містить щонайменше два атоми фтору і за вибором інші атоми галогенів, вибрані з групи, яка містить хлор та бром;
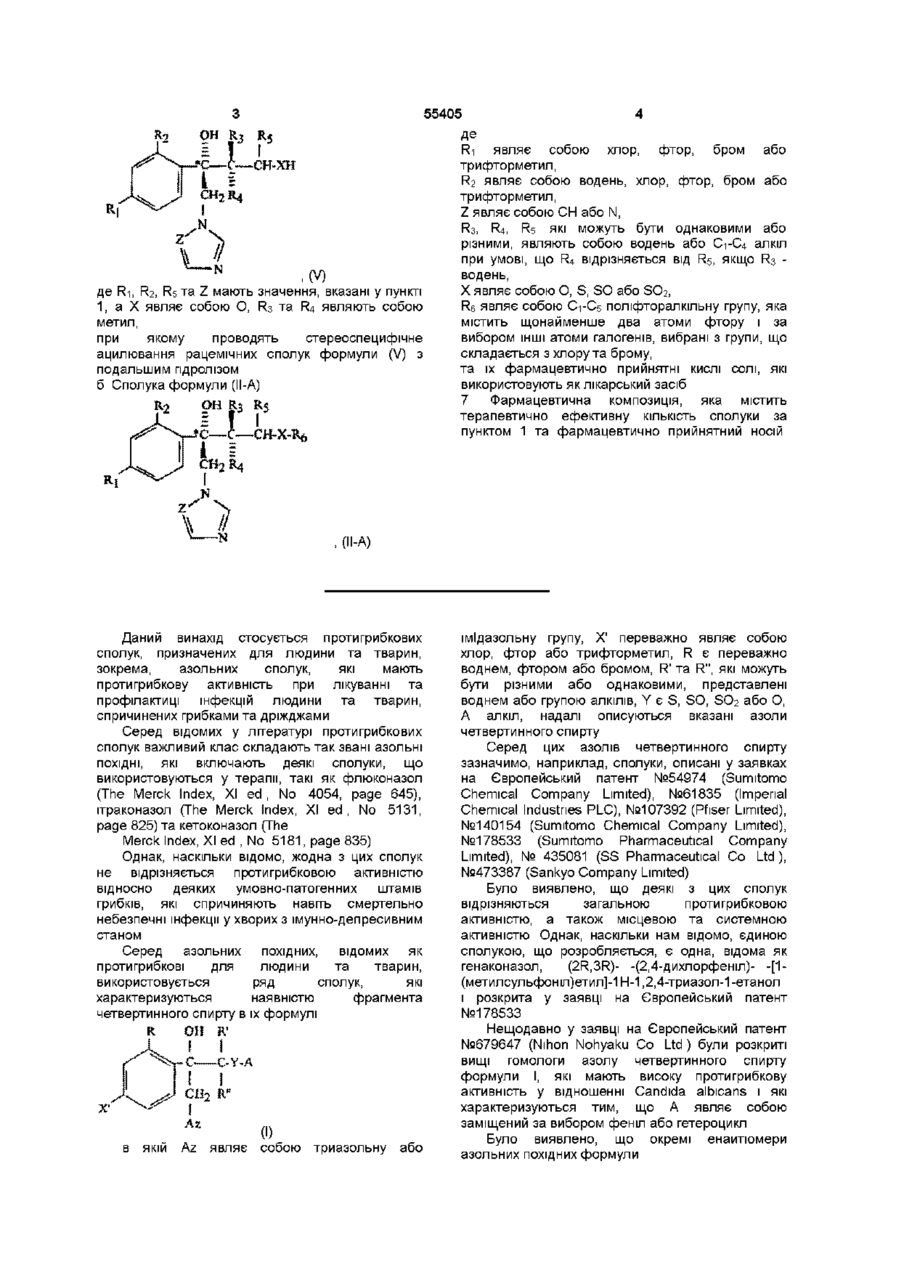
з оптично активною проміжною сполукою формули (V)
, (V)
де R1, R2, R3, R4, R5 та Z мають значення, вказані у пункті 1, а Х являє собою О або S;
або з їх реакційноздатним похідним, після якого за необхідністю проводять окиснення.
5. Спосіб ферментного розщеплення для одержання сполук формули (V)
, (V)
де R1, R2, R5 та Z мають значення, вказані у пункті 1, а Х являє собою О; R3 та R4 являють собою метил;
при якому проводять стереоспецифічне ацилювання рацемічних сполук формули (V) з подальшим гідролізом.
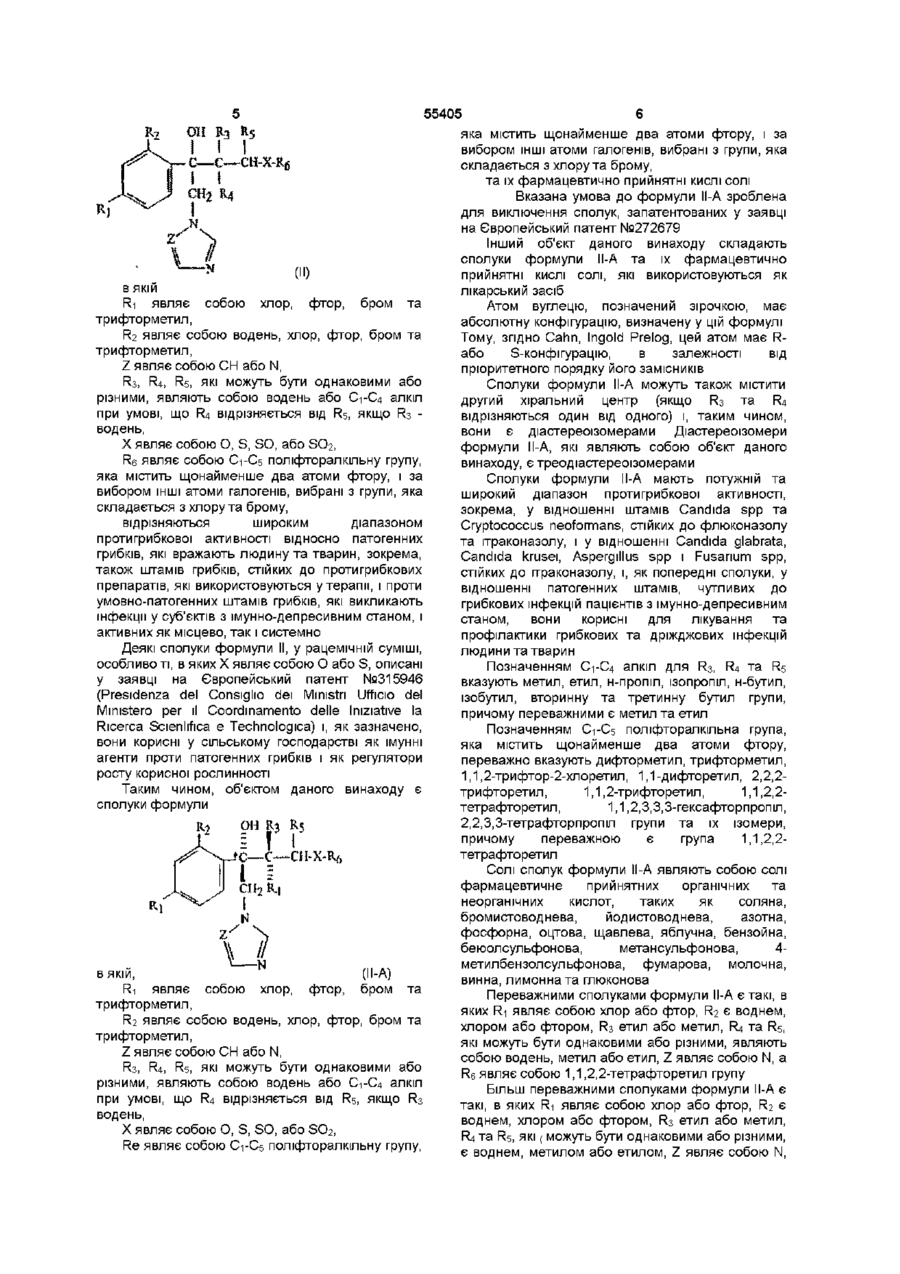
б. Сполука формули (II-A)
, (II-A)
де
R1 являє собою хлор, фтор, бром або трифторметил;
R2 являє собою водень, хлор, фтор, бром або трифторметил;
Z являє собою СН або N;
R3, R4, R5, які можуть бути однаковими або різними, являють собою водень або С1-С4 алкіл при умові, що R4 відрізняється від R5, якщо R3 - водень;
Х являє собою О, S, SO або SO2;
R6 являє собою С1-С5 поліфторалкільну групу, яка містить щонайменше два атоми фтору і за вибором інші атоми галогенів, вибрані з групи, що складається з хлору та брому;
та їх фармацевтично прийнятні кислі солі, які використовують як лікарський засіб.
7. Фармацевтична композиція, яка містить терапевтично ефективну кількість сполуки за пунктом 1 та фармацевтично прийнятний носій.
Текст
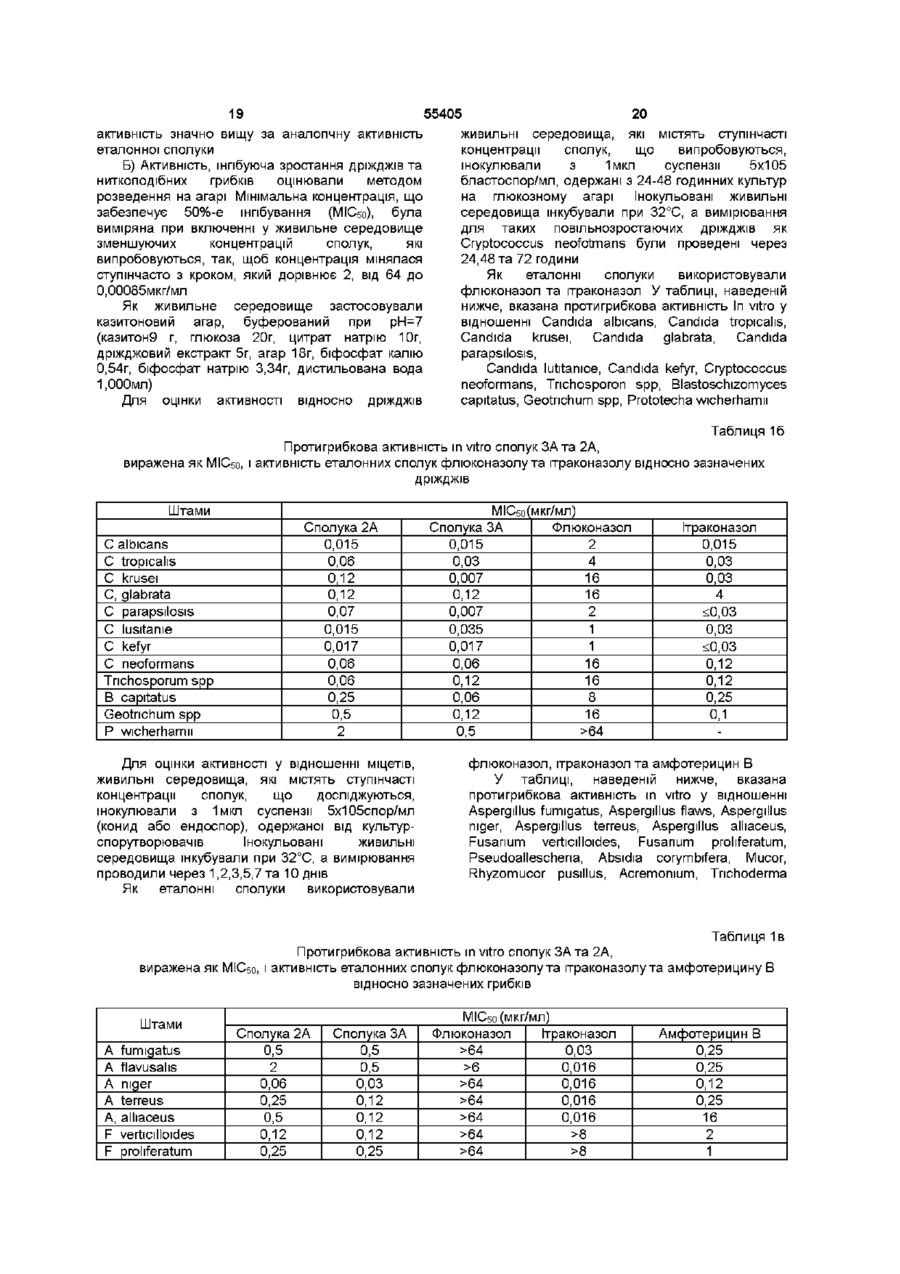
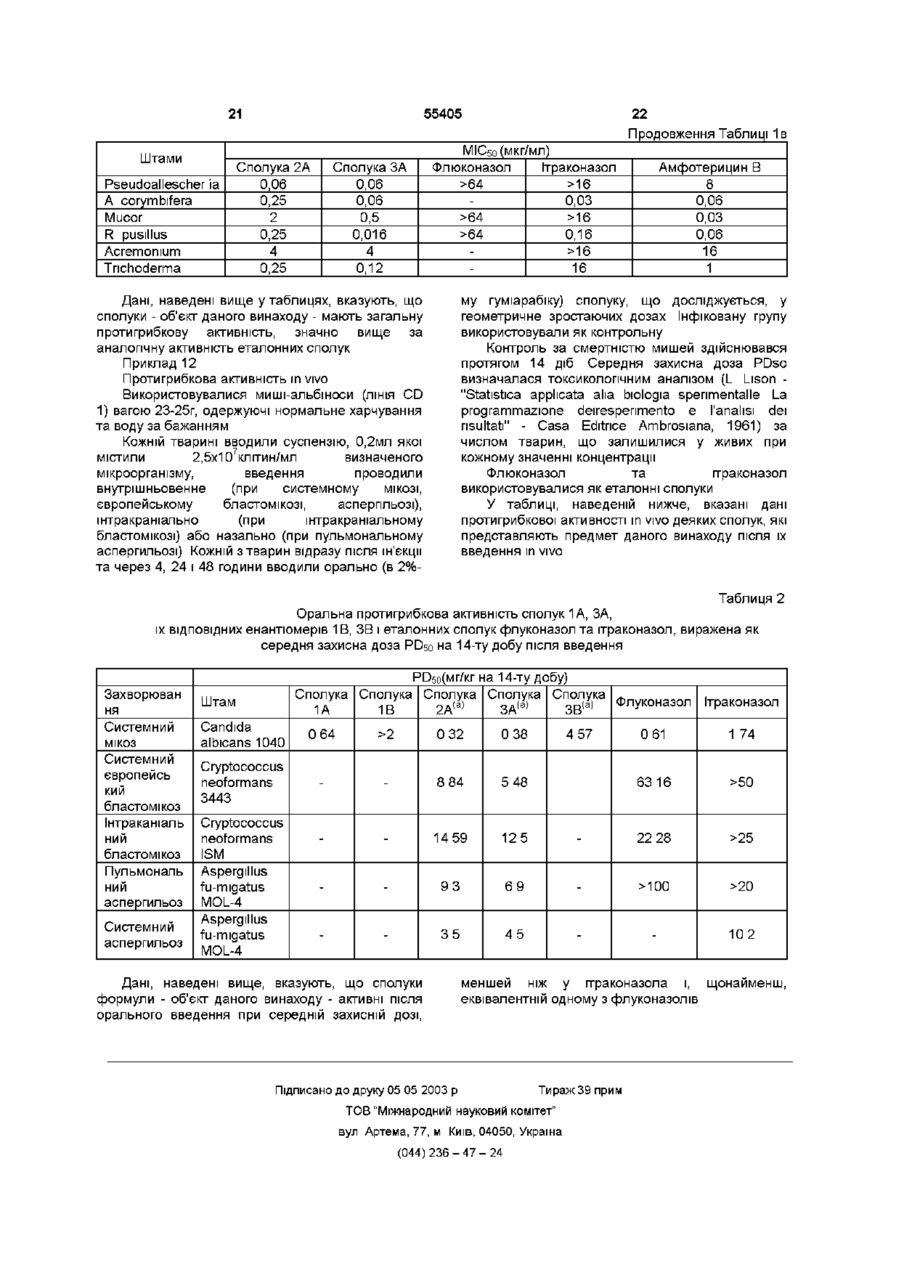
1 Сполука формули (ІІ-А) к2 ^v ^v щX^J R4 та R5, однакові або різні, являють собою водень, метил або етил, Z являє собою N, R6 являє собою 1,1,2,2-тетрафторетильну групу 3 Сполука за пунктом 2, де Ri являє собою хлор або фтор, R2 являє собою водень, хлор або фтор, R3 являє собою метил або етил, R4 та R5, однакові або різні, являють собою водень, метил або етил, Z являє собою N, R6 являє собою 1,1,2,2-тетрафторетильну групу, X являє собою О або SO2, 4 Спосіб одержання сполуки за пунктом 1, при якому проводять взаємодію поліфторолефіну формули о н в.3 Щ — I -— ^ j ^ [— _ С 24 НІ ^ > , (11-А) Де Ri являє собою хлор, фтор, бром або трифторметил, F?2 являє собою водень, хлор, фтор, бром або трифторметил, Z являє собою СН або N, R3, R4, R5, які можуть бути однаковими або різними, являють собою водень або С1-С4 алкіл при умові, що R4 відрізняється від R5, якщо R3 водень, X являє собою О, S, SO або SO2, R6 являє собою С1-С5 поліфторалкільну групу, яка містить щонайменше два атоми фтору і за вибором ІНШІ атоми галогенів, вибрані з групи, яка складається з хлору та брому, та їх фармацевтично прийнятні кислі солі 2 Сполука за пунктом 1, де Ri являє собою хлор або фтор, R2 являє собою водень, хлор або фтор, R3 являє собою метил або етил, де Хі та Х2, які можуть бути різними або однаковими, являють собою F, СІ або CF3, або взаємодію поліфторованого спирту формули (IV) R7 = СН 2 -ОН , (IV) де R7 являє собою С1-С4 поліфторалкільну групу, яка містить щонайменше два атоми фтору і за вибором ІНШІ атоми галогенів, вибрані з групи, яка містить хлор та бром, з оптично активною проміжною сполукою формули (V) Г 5 сн-хн .00 де R-і, R2, R3, R4, RsTa Z мають значення, вказані у пункті 1, а X являє собою О або S, або з їх реакційноздатним похідним, після якого за необхідністю проводять окиснення 5 Спосіб ферментного розщеплення для одержання сполук формули (V) о ю о ю ю 55405 K-7 де R-i, R2, R5 та Z мають значення, вказані у пункті 1, а X являє собою О, R3 та R4 являють собою метил, при якому проводять стереоспецифічне ацилювання рацемічних сполук формули (V) з подальшим гідролізом б Сполука формули (ІІ-А) R2 OH R3 R$ її І С—С—CH-X-R6 і Де Ri являє собою хлор, фтор, бром або трифторметил, R2 являє собою водень, хлор, фтор, бром або трифторметил, Z являє собою СН або N, R3, R4, Rs які можуть бути однаковими або різними, являють собою водень або С1-С4 алкіл при умові, що R4 відрізняється від Rs, якщо R3 водень, X являє собою О, S, SO або SO2, R6 являє собою С1-С5 поліфторалкільну групу, яка містить щонайменше два атоми фтору і за вибором ІНШІ атоми галогенів, вибрані з групи, що складається з хлору та брому, та їх фармацевтично прийнятні кислі солі, які використовують як лікарський засіб 7 Фармацевтична композиція, яка містить терапевтично ефективну КІЛЬКІСТЬ сполуки за пунктом 1 та фармацевтично прийнятний носій і СВ 2 ЇЦ N • N 1-А) Даний винахід стосується протигрибкових сполук, призначених для людини та тварин, зокрема, азольних сполук, які мають протигрибкову активність при лікуванні та профілактиці інфекцій людини та тварин, спричинених грибками та дріжджами Серед відомих у літературі протигрибкових сполук важливий клас складають так звані азольні ПОХІДНІ, які включають деякі сполуки, що використовуються у терапії, такі як флюконазол (The Merck Index, XI ed , No 4054, page 645), ітраконазол (The Merck Index, XI ed , No 5131, page 825) та кетоконазол (The Merck Index, XI ed , No 5181, page 835) Однак, наскільки відомо, жодна з цих сполук не відрізняється протигрибковою активністю відносно деяких умовно-патогенних штамів грибків, які спричиняють навіть смертельно небезпечні інфекції у хворих з імунно-депресивним станом Серед азольних похідних, відомих як протигрибкові для людини та тварин, використовується ряд сполук, які характеризуються наявністю фрагмента четвертинного спирту в їх формулі R ОН К C-Y-A Ctl2 в якій Az ft" являє (І) собою триазольну або імідазольну групу, Xі переважно являє собою хлор, фтор або трифторметил, R є переважно воднем, фтором або бромом, R' та R", які можуть бути різними або однаковими, представлені воднем або групою алкілів, Y є S, SO, SO2 або О, А алкіл, надалі описуються вказані азоли четвертинного спирту Серед цих азолів четвертинного спирту зазначимо, наприклад, сполуки, описані у заявках на Європейський патент №54974 (Sumitomo Chemical Company Limited), №61835 (Imperial Chemical Industries PLC), №107392 (Pfiser Limited), №140154 (Sumitomo Chemical Company Limited), №178533 (Sumitomo Pharmaceutical Company Limited), № 435081 (SS Pharmaceutical Co Ltd), №473387 (Sankyo Company Limited) Було виявлено, що деякі з цих сполук відрізняються загальною протигрибковою активністю, а також місцевою та системною активністю Однак, наскільки нам відомо, єдиною сполукою, що розробляється, є одна, відома як генаконазол, (2R.3R)- -(2,4-дихлорфеніл)- -[1(метилсульфоніл)етил]-1Н-1,2,4-триазол-1-етанол і розкрита у заявці на Європейський патент №178533 Нещодавно у заявці на Європейський патент №679647 (Ninon Nohyaku Co Ltd) були розкриті вищі гомологи азолу четвертинного спирту формули І, які мають високу протигрибкову активність у відношенні Candida albicans і які характеризуються тим, що А являє собою заміщений за вибором феніл або гетероцикл Було виявлено, що окремі енаитюмери азольних похідних формули 55405 в якій RI являє собою хлор, фтор, бром та трифторметил, R2 являє собою водень, хлор, фтор, бром та трифторметил, Z являє собою СН або N, R3, R4, R5, які можуть бути однаковими або різними, являють собою водень або С1-С4 алкіл при умові, що R4 відрізняється від R5, якщо R3 водень, X являє собою О, S, SO, або SO2, R6 являє собою С1-С5 поліфторалкільну групу, яка містить щонайменше два атоми фтору, і за вибором ІНШІ атоми галогенів, вибрані з групи, яка складається з хлору та брому, відрізняються широким діапазоном протигрибкової активності відносно патогенних грибків, які вражають людину та тварин, зокрема, також штамів грибків, стійких до протигрибкових препаратів, які використовуються у терапії, і проти умовно-патогенних штамів грибків, які викликають інфекції у суб'єктів з імунно-депресивним станом, і активних як місцево, так і системно Деякі сполуки формули II, у рацемічній суміші, особливо ті, в яких X являє собою О або S, описані у заявці на Європейський патент №315946 (Presidenza del Consigho dei Mmistri Ufficio del Mimstero per il Coordmamento delle Imziative la Ricerca Scienhfica e Technologica) і, як зазначено, вони корисні у сільському господарстві як імунні агенти проти патогенних грибків і як регулятори росту корисної рослинності Таким чином, об'єктом даного винаходу є сполуки формули R2 в якій, OH Р-з R 5 (ІІ-А) RI являє собою хлор, фтор, бром та трифторметил, R2 являє собою водень, хлор, фтор, бром та трифторметил, Z являє собою СН або N, R3, R4, Re, які можуть бути однаковими або різними, являють собою водень або С1-С4 алкіл при умові, що R4 відрізняється від R5, якщо R3 водень, X являє собою О, S, SO, або SO2, Re являє собою С1-С5 поліфторалкільну групу, яка містить щонайменше два атоми фтору, і за вибором ІНШІ атоми галогенів, вибрані з групи, яка складається з хлору та брому, та їх фармацевтично прийнятні кислі солі Вказана умова до формули ІІ-А зроблена для виключення сполук, запатентованих у заявці на Європейський патент №272679 Інший об'єкт даного винаходу складають сполуки формули ІІ-А та їх фармацевтично прийнятні кислі солі, які використовуються як лікарський засіб Атом вуглецю, позначений зірочкою, має абсолютну конфігурацію, визначену у цій формулі Тому, згідно Cahn, Ingold Prelog, цей атом має Rабо S-конфігурацію, в залежності від пріоритетного порядку його замісників Сполуки формули ІІ-А можуть також містити другий хіральний центр (якщо R3 та R4 відрізняються один від одного) і, таким чином, вони є діастереоізомерами Діастереоізомери формули ІІ-А, які являють собою об'єкт даного винаходу, єтреодіастереоізомерами Сполуки формули ІІ-А мають потужній та широкий діапазон протигрибкової активності, зокрема, у відношенні штамів Candida spp та Cryptococcus neoformans, стійких до флюконазолу та ітраконазолу, і у відношенні Candida glabrata, Candida krusei, Aspergillus spp і Fusanum spp, стійких до ітраконазолу, і, як попередні сполуки, у відношенні патогенних штамів, чутливих до грибкових інфекцій пацієнтів з імунно-депресивним станом, вони корисні для лікування та профілактики грибкових та дріжджових інфекцій людини та тварин Позначенням С1-С4 алкіл для R3, R4 та Rs вказують метил, етил, н-пропіл, ізопропіл, н-бутил, ізобутил, вторинну та третинну бутил групи, причому переважними є метил та етил Позначенням С1-С5 поліфторалкільна група, яка містить щонайменше два атоми фтору, переважно вказують дифторметил, трифторметил, 1,1,2-трифтор-2-хлоретил, 1,1-дифторетил, 2,2,2трифторетил, 1,1,2-трифторетил, 1,1,2,2тетрафторетил, 1,1,2,3,3,3-гексафторпропіл, 2,2,3,3-тетрафторпропіл групи та їх ізомери, причому переважною є група 1,1,2,2тетрафторетил Солі сполук формули ІІ-А являють собою солі фармацевтичне прийнятних органічних та неорганічних кислот, таких як соляна, бромистоводнева, йодистоводнева, азотна, фосфорна, оцтова, щавлева, яблучна, бензойна, беюолсульфонова, метансульфонова, 4метилбензолсульфонова, фумарова, молочна, винна, лимонна та глюконова Переважними сполуками формули ІІ-А є такі, в яких Ri являє собою хлор або фтор, R2 є воднем, хлором або фтором, R3 етил або метил, R4 та Rs, які можуть бути однаковими або різними, являють собою водень, метил або етил, Z являє собою N, а R6 являє собою 1,1,2,2-тетрафторетил групу Більш переважними сполуками формули ІІ-А є такі, в яких Ri являє собою хлор або фтор, R2 є воднем, хлором або фтором, R3 етил або метил, R4 та R5, які ( можуть бути однаковими або різними, є воднем, метилом або етилом, Z являє собою N, 55405 F 6 являє собою 1,1,2,2-тетрафторетил групу, а X ? являє собою О або SO2 Нижче наведені хараісгерні приклади переважних сполук формули ІІ-А, (2R.3S) 1-(1Н-1,2,4-триазоліл)-2-(2,4дифторфеніл)-3-етил-4-(1,1,2,2-тетрафторетокси)2-бутанол (2R.3S) 1-(1Н-1,2,4-триазоліл)-2-(2,4дихлорфеніл)-3 -метил-4-(1,1,2,2тетрафторетокси)-2-бутанол (2R.3R) 1-(1Н-1,2,4-триазоліл)-2-(2,4дихлорфеніл)-3-метил-4-(1,1,2,2тетрафторетилтю)-2-бутанол (2R.3S) 1-(1Н-1,2,4-триазоліл)-2-(2,4дифторфеніл)-3-метил-4-(1,1,2,2-тетрафторетокси)-2-бутанол (2R.3R) 1-(1Н-1,2,4-триазоліл)-2-(2,4дифторфеніл)-3-метил-4-(1,1,2,2-тетрафторетилтю)-2-бутанол (2R.3S) 1 -(1Н-1,2,4-триазоліл)-2-(4дихлорфеніл)-3-метил-4-(1,1,2,2тетрафторетокси)-2-бутанол (2R.3R) 1 -(1 Н-1,2,4-триазоліл)-2-(4дихлорфеніл)-3-метил-4-(1,1,2,2тетрафторетилтю)-2-бутанол (2R) 1-(1Н-1,2,4-триазоліл)-2-(2,4дифторфеніл)-3,3-диметил-4-(1,1,2,2тетрафторетокси)-2-бутаиол (2R 3S) 1 -(1 Н-1,2,4-триазоліл)-2-(4фторфеніл)-3-метил-4-(1,1,2,2-тетрафторетокси)2-бутанол (2R 3R) 1 -(1 Н-1,2,4-триазоліл)-2-(4фторфеніл)-3-метил-4-(1,1,2,2-тетрафторетилтю)2-бутанол (2S) 1 -(1 Н-1,2,4-триазоліл)-2-(4-хлорфеніл)3,3-диметил-4-(1,1,2,2-тетрафторетокси)-2бутанол (2S) 1 -(1 Н-1,2,4-триазоліл)-2-(4-хлорфеніл)3,3-диэдетил-4-(1,1,2,2-тетрафторетилтю)-2бутанол (2S) 1-(1Н-1,2,4-триазоліл)-2-(4-фторфеніл)353-диметил-4-(1,1,2,2-тетрафторетокси)-2бутанол (2S) 1 -(1 Н-1,2,4-триазоліл)-2-(4-фторфеніл)3,3-диметил-4-(1,1,2,2-тетрафторетилтю)-2бутанол (2R.3R) 1-(1Н-1,2,4-триазоліл)-2-(2,4дихлорфеніл)-3-метил-4-(1,1,2,2тетрафторетилсульфоніл)-2-бутанол Одержання сполук формули ІІ-А, в якій X являє собою О або S, може бути проведене за схемою синтезу, вже описаною у вказаній заявці на Європейський патент №315946, використовуючи ВІДПОВІДНІ проміжні сполуки в оптично активній формі Сполуки формули ІІ-А, в якій X являє собою SO або SO2, можуть бути одержані з ВІДПОВІДНИХ сполук формули ІІ-А, в якій X являє собою S при використанні відповідної технології окиснення Як окислювальні агенти переважним є використання перекису водню, ппогалогенидів або надкислот, можливо в присутності каталізаторів Переважне одержання сполук формули ІІ-А, в якій X являє собою О або S, проводять додаванням поліфторолефіну формули A 2 (IN) в якій Хі та Хг, які можуть бути різними або однаковими, являють собою F, СІ або CF3, або взаємодією поліфторованого спирту формули R7=CH2-OH, (IV) в якій R7 є С1-С4 поліфторалкільною групою, яка містить щонайменше Два атоми фтору і за вибором ІНШІ атоми галогенів, вибрані з групи, яка містить хлор та бром, з оптично активною проміжною сполукою формули ОМ К3 Rj І -СЇГ-ХІІ \ N (V) де R-i, R2, R3, R4, Rs та Z були визначені вище, а X являє собою О або S, або з їх реакційноздатним похідним, таким як складний ефір, наприклад, мезилат, тозилат або трифторметаисульфонат Оптично активні проміжні сполуки формули V можуть бути одержані відомими методами Наприклад, сполуки формули V можна одержати розділенням ВІДПОВІДНИХ рацемічних сумішей, таких, як описані вище у заявці на Європейський патент №315946 або у патенті США №5134152 З іншого боку, сполуки формули V, в якій X являє собою S, можуть бути одержані відомими методами з ВІДПОВІДНИХ сполук формули V, де X являє собою О Більш ТОГО було виявлено, що ферментне розщеплення при селективному ацилюванні з подальшим гідролізом має ряд переваг для одержання сполук формули V, в якій X являє собою О, a R3 та R4 - метил Хоча відоме ферментне розщеплення при селективному ацилгованні для одержання нижчих гомологів третинного спирту сполук формули V (див , наприклад, заявку на Міжнародний патент WO 94/24305 - Zeneca Limited), дивним є той факт, що воно може застосовуватися також для одержання сполук формули V, в якій X являє собою О, a R3 та R4 - метил Дійсно, у цих сполуках два атоми вуглецю не тільки знаходяться між тим фрагментом, який буде ацильований, і асиметричним атомом вуглецю, але, крім того, один з цих атомів вуглецю не заміщений, що спричиняє помітне просторове ускладнення Тому наступний об'єкт даного винаходу являє собою процес ферментного розщеплення сполук формули V, в якій X являє собою О, a R3 та R4 являють собою метил, цей процес включає їх стереоселективне ацилювання з подальшим гідролізом З іншого боку, сполуки формули V, в якій X 55405 являє собою О, a Rs • атом водню, можна одержати відновленням ВІДПОВІДНИХ кислот формули соои N (VI) в якій R-i, R2, R3, R4Ta Z були визначені вище Сполуки формули VI ВІДОМІ або їх можна легко одержати відомими методами (Bartroh J et al , J Org Chem , 1995,60,3000-3012) Одержання солей сполук формули ІІ-А можна здійснити за загальноприйнятою технологією, наприклад, змішуванням у розчині еквімолярних кількостей сполук формулиІІ-А і вибраної кислоти, і відділенням одержаних солей осадженням та фільтрацією або випаровуванням розчинника Сполуки формулі ІІ-А та їх солі є протигрибковими сполуками, корисними для лікування та профілактики грибкових та дріжджових інфекцій людини та тварин Дійсно, сполуки формули ІІ-А, що є об'єктом даного винаходу, характеризуються протигрибковою активністю відносно дріжджів, ниткоподібних грибків, дерматофітів та диморфних грибків Протигрибкову активність оцінювали in vitro як ІС50 і як МІС (мінімальна шпбіторна концентрація) на ряді штамів, таких, наприклад, як Candida albicans, Cryptococcus neoformans, Tnchophyton mentagrophytes, Aspergillus fumigatus, Candida parapsilosis, Candida lusitamae, Candida kefyr, Candida tropicahs, Candida krusei, Candida glabrata, Aspergillus підегта Fusanum spp Важливо підкреслити, що сполуки формули IIА об'єкта даного винаходу ефективні у відношенні всіх штамів Candida spp та Cryptococcus neoformans, які розглядаються, і, які містять штами, СТІЙКІ до флюконазолу, ітраконазолу та генаконазолу Особливо зазначена протигрибкова активність була виявлена у відношенні штамів Candida glabrata та Fusanum spp , стійких до флюконазолу та ітраконазолу, і штамів Candida krusei та Aspergillus fumigatus, стійких до флюконазолу та генакозолу, причому всі вони є патогенними агентами, що викликають інфекції суб'єктів з імунно-депресивним станом Протигрибкову активність сполук формули ІІ-А об'єкта даного винаходу також оцінювали у порівнянні з активністю ВІДПОВІДНИХ енантюмерів У деяких випадках активність цих енантюмерів була порівнянна з активністю вказаних сполук, проте, загалом вона значно нижче, ніж енантюмер сполук формули ІІ-А об'єкта даного винаходу Протигрибкову активність in vivo оцінювали при штраперитонеальному та пероральному введенні зразка Candida штама Candida albicans, чутливого до флюконазолу та ітраконазолу, мишам 10 50%-а захисна доза (PDso) сполук формули IIА була установлена у тестах in vivo, і вони показали, щонайменше, порівнянність з однією з вказаних сполук Тому об'єкт даного винаходу - сполуки формули ІІ-А активні у широкому діапазоні глибоких МІКОЗІВ, але особливо проти умовнопатогенних агентів, що викликають інфекції у суб'єктів з імунно-депресивним станом, вони можуть бути такими, що вводяться місцеве, перорально та парентерально і мають надійний терапевтичний показник Сполуки формули ІІ-А корисні при лікуванні та профілактиці людини і тварин від системних інфекцій та інфекцій слизових оболонок, викликаних грибками та дріжджами Як було підкреслено, дослідження фармакологічної активності сполук формули ІІ-А показало також активність у відношенні штамів, стійких до протигрибкових препаратів, які використовуються у терапії і проти нещодавно виділених штамів, які викликають інфекції суб'єктів з імунно-депресивним станом Це є особливо дивним, якщо брати до уваги, що сполуки, розкриті у заявці на Європейський патент №315946, були названі імунізуючими агентами при грибкових патолопях корисної рослинності при грибкових патолопях і регуляторами росту рослинного походження, причому їх активність у цих якостях обмежувалася використанням у сільському господарстві Фармакологічна активність сполук формули IIА ще більш дивна, якщо брати до уваги те, що ці сполуки мають деякі структурні фрагменти, загальні для азольних четвертинних спиртів, описаних у літературі, у той самий час характеризуються наявністю двох атомів вуглецю у ланцюгу між атомом вуглецю, зв'язаним з гідрокси групою, і киснем або атомом сірки, і простим пол фторованим алкілом в ефірі або фрагментом, який містить сірку Наскільки відомо, комбінація цих структурних характеристик ніколи не була описана у літературі для представників класу сполук азольних четвертинних спиртів з протигрибковою активністю, призначених для людини та тварин Сполуки формули ІІ-А, призначені для людини та тварин, можна вводити у суміші з ВІДПОВІДНИМ НОСІЄМ, вибраним з урахуванням способу введення Таким чином, ще один об'єкт даного винаходу включає фармацевтичну композицію, яка містить терапевтичне ефективну КІЛЬКІСТЬ ОДНІЄЇ ЗІ сполук формули ІІ-А у суміші з фармацевтичне прийнятним носієм Наприклад, сполуки формули ІІ-А або їх солі можна вводити орально у вигляді таблеток, капсул, розчинів або суспензій Для парентерального введення (наприклад, внутрішньовенного, внутрішньом'язового або підшкірного введення) сполуки формули ІІ-А або їх солі використовують у формі стерильного водного розчину Або, сполуки формули ІІ-А або їх солі можна вводити як супозиторії та песарм При місцевому введенні сполуки формули ІІ-А 12 11 55405 або їх солі використовуються переважно у вигляді (1 Н-1,2,4-триазол-1 -іл)-1,3-бутандюл (1,20г, вихід кремів та порошків 80%) у вигляді білої твердої речовини При оральному та парентеральному введенні [a] D --46,2° (с=1%, метанол), щоденна доза сполук формули ІІ-А звичайно хіральна ВЕРХ= е е 98,4%, коливається від 0,1 до 50мг/кг (переважно від 1 до тпл 117-118°С, 1 20мг/кг), розділена на один або більше прийомів 'Н- ЯМР ідентичний спектру рацемічної Для кращої ілюстрації даного винаходу суміші пропонуються наступні приклади Приклад 2 Приклад 1 Одержання (-)(2S 3R-3-(2 4-дифторфеніл)-2Ферментативне кінетичне розщеплення (- +) 3метил-4-(1 Н-1,2,4-триазол-1 -іл)-1,3-бутандюлу (2,4-дифторфеніл-2,2-диметил )-4-( 1Н-1,2,4Розчин (23,ЗР)-3-(2,4-дифторфеніл)-3триазол-1-іл)-1,3-бутандюл у пдрокси-2-метил-4-(1 Н-1,2,4-триазол-1 а) Ізомер (+) іл)бутановоі кислоти (0,88г, 2,97 ммоль) у Фермент (Зг, ліпаза з Candida cilmdracea тип безводному тетрапдрофурані (6,5мл) по краплях VII Sigma) додали при енергійному перемішуванні додавали до трифторефірату бору (0,365мл, 2,97 при 30°С до розчину (- +)3-(2,4-дифторфеніл)-2,2ммоль) і суміш переганяли ЗОхв диметил-4-(1 Н-1,2,4-триазол-1 -іл)1,3-бутандюлу Одержаний розчин додавали по краплях при (2,97г, 10 ммоль) у хлороформі (60 мл) та 55°С до 10М розчину диметилсульфату бору у вінілацетаті (1,9мл, 20 ммоль) тетрапдрофурані (0,356мл, 3,56 ммоль), перегонку Через 72 години одержану суспензію продовжували протягом 6 годин відфільтрували, а потім додали Зг ферменту, Після охолоджування до 4°С додали розчин причому перемішування продовжували ще 24 вода тетрапдрофуран = 1 1 (Змл), а потім 5М години при 30°С соди (8мл) і суміш переганяли 12 годин Суспензію відфільтрували, тверду речовину Тетрапдрофуран випарили при зниженому промили хлороформом (20мл), а органічну фазу тиску, одержану суміш екстрагували хлороформом випаровували при зниженому тиску (5,10мл), потім органічну фазу збезводнили та випарили Кристалізацією твердого залишку з Одержаний залишок хроматографували на бензол гексан = 11 (20мл) був одержаний (силікагелі (елюент етилацетат гексан = 60 40) для )(23,ЗР)-3-(2,4-дифторфеніл)-2-метил-4-(1 Р-1,2,4одержання (-)3-(2,4-дифторфеніл)-3-пдрокси-2,2триазол-іл)-1,3-бутандюл (0,76г, вихід 90%) диметил-4-(1Н-1,2,4-триазол-1-іл)бутилацетату (1,63г, є є 88% хіральна ВЕРХ колонка Т пл 93-95°С, CHIRACEL-OD, елюент гексан ізопропанол = [a] D --59,6° (с=1%, метанол), 70 ЗО) і (+)3-(2,4-дифторфеніл)-2,2-диметил]-4-(1НЪ- ЯМР (CDCI3) 7,93 (s, 1H), 7,74 (s, 1H), 1,2,4-триазол-1-іл)-1,3-бутандюлу (1,3г, е е 79% 7,48-7,33 (m, 1Н), 6,83-6,68 (m, 2Н), 5,40 (s-ушир , хіральна ВЕРХ) 1Н), 4,97 (d, 1H), 4,78 (d, 1H), 4,00 (dd, 1H), 3,80 Одержаний ізомер (+) (1,3г) знову обробляли (dd, 1Н), 3,10 (s-ушир , 1Н), 2,45-2,25 (m, 1H), 0,85 ліпазою при тих самих умовах протягом 17 годин (d, ЗН) Після ЦІЄЇ обробки та виділення з Аналогічно були одержані наступні сполуки використанням тонкошарової хроматографії (-)(2S 3R-3-(2 4-дихлорфеніл)-2-метил-4-(1Нодержали (+)3-(2,4-дифторфеніл)-2,2-диметил-41,2 4-триазол-1-іл)-1 3-бутандюл (1 Н-1,2,4-триазол-1 -іл)-1,3-бутандюл (0,92г, вихід вихід 87%, 62%) у вигляді білої твердої речовини тпл 108-110°С, [a] D -+43,4° (с=1%, метанол), [a] D =-90,7°(с=1%, метанол), хіральна ВЕРХ= е е 95%, (+)(23,ЗР-3-(2,4-дихлорфеніл)-2-метил-4-(1Нтпл 116,5-117,5°С, 1,2,4-триазол-1-іл)-1,3-бутандюл 1 Н- ЯМР ідентичний спектру рацемічної суміші вихід 91%, б) ізомер (-) тпл 110-111 °С, (-)3-(2,4-дифторфеніл)-3-пдрокси-2,2-диметил[a] D =+87,0 °(с=1%, метанол), 4-(1Н-1,2,4-триазол-1-іл)-бутилацетат, одержаний (-) (2S ЗР-2-етил-3-(2,4-дифторфеніл)-4-(1 Нна попередній стадії (а) (1,63г) розчинили у 0.05М 1 2 4-триазол-1-іл)-1 3-бутандюл рН7 фосфатного буфера (400мл) та ацетоні вихід 90%, (50мл) т пл 75-77°С, Одержаний розчин при перемішуванні при [a]D20=-41,1°(c=l%, метанол), 30°С додали до ферменту (1,6г, ліпаза з Candida хіральна ВЕРХ (гексан ізопропанол = 70 ЗО) = cilmdracea тип VII), а значення рН підтримували е е 92%, 1 подальшим додаванням 0,1 М гідроксиду натрію Н- ЯМР (CDCI3) 7,89 and 7,71 (2s, 2H, 2СНЧерез 5 годин значення рН довели до 4 за Tnaz), 7,40-6,62 (m, ЗН, Аг), 5,30 (s-ушир , 1Н, ОН), допомогою концентрованої соляної кислоти, а 4,98-4,70 (ш, 2Н, CH2-Tnaz), 4,12-3,87 (m, 2Н, СН2екстракцію здійснювали етилацетатом (ЗхЮОмл) ОН), 2,80 (s-ушир, 1Н, СН2-ОН), 2,05-1,93 (m, 2H, Органічну фазу збезводнювали над *СН-СН2-СН3), 1,60-0,98 (ш, 2Н, СН-*СН2-СН3), сульфатом натрію та випаровували при 0,81 (t, ЗН, СН-СН2-*СН3) зниженому тиску до одержання маслянистого Приклад З залишку Одержання (-)2-(2,4-дифторфеніл)-4-(1,1,2,2Після тонкошарової хроматографії на тетрафторетокси)-3 3-диметил-1-(1Н-1,2,4силікагелі (елюент етилацетат гексан = 60 40) був триазол-1-іл)-2-бутанол (Сполука ІА) виділений (-)3-(2,4-дифторфеніл)-2,2-диметил-4Розчин (-)3-(2,4-дифтофеніл)-2,2-диметил-4 13 (1Н-1,2,4-триазол-1 -іл)-1,3-бутандюлу (5г, 16,8 ммоль), одержаний, як це описане у прикладі 1, і д и мети л сульфоксид (8мл) у толуолі (60мл) при перемішуванні при 5°С додали до порошку гідроксиду калію (533г, 9,5 ммоль) Реакційне середовище замістили тетрафторетилепом і одержану суміш перемішували при 5°С протягом 90хв Після додавання води (120мл) органічну фазу промили 5%-ою соляного кислотою (80мл) і обробили безводним гідрокарбонатом натрію (6,5г) при перемішуванні протягом ЗОхв Рідку фазу відфільтрували, а розчинник випарили при зниженому тиску Одержаний маслянистий залишок очистили тонкошаровою хроматографією (елюент гексан етилацетат = 6 4), у результаті одержали вказану вище сполуку ІА (5,2г, вихід 79%) у вигляді білої твердої речовини [a] D --48,5° (с=1%, метанол), хіральна ВЕРХ = є є > 99,8%, т пл 46-47°С, 1 ТН- ЯМР (CDCI 3 ) 8,01 (d, 1Н, CH-Tetr), 7,69 (s, 1Н, CH-Cat), 7,63-6,56 (m, ЗН, Аг), 5,70 (tt, 1Н, JHF = 53,4 Hz, CHF 2 ), 5,33 (s-ушир , 1H, OH), 5,29-4,41 (m, 2H, CH2-Tnaz), система AB VA = 4,19, VB = 3,75, JAB = 9,8 Hz, CH 2 -O, 1,06 (d, 3H, JHF = 2,4 Hz, СНз), 0,98 (s, ЗН, СНз) Аналогічно були одержані наступні сполуки (+)2-(2,4-дифторфеніл)-4-(1,1,299% [a] D 2 2 =-83,6° (с=1%, метанол), 15 хіральна ВЕРХ (гексан ізопропанол = 90 10) = е е 99,5%, т п л 79-80°С, 1 Н- ЯМР (CDCI 3 ) 7,80 and 8,05 (2s, 2Н, Tnaz), 7,42 (d, 1H, JHH = 8,6 Hz, C-*CH-CH-C-CI), 7,27 (d, 1H, JHH = 2,1 Hz, C-CI-CH-C-CI), 7,05 (dd, 1H, CCH-*CH-C-CI), 5,75 (tt, 1H, JHF = 53,4 Hz, CHF 2 ), система AB = VA = 5,48, VB = 4,54, JAB =14,4 Hz, *CH 2 -Tnaz), 5,09 (ушир, сигнал, 1Н, ОН), 4,54-3,98 (m, 2H, СНз-О), 3,14-2,97 (m, 1H, *СН-СН 3 ), 0,67 (d, ЗН, JHH = 7,1 Hz, *СН 3 -СН) Приклад 5 Одержання бутилового ефіру 3-(2,4дихлорфеніл)-3-пдрокси-2-метил-4-(1Н-1 2 4триазол-1-іл) метансульфонової кислоти Розчин (+)(2Р,33)-3-(2,4-дихлорфеніл)-2метил-4-(1 Н-1,2,4-триазол-1 -іл)-1,3-бутандюлу (2,95г, 9,31 ммоль), одержаного як описано у прикладі 2, у метиленхлориді (90мл) додають в атмосфері азоту, спочатку до триетиламшу (1,94мл, 13,9 ммоль), а потім до мезилхлориду (0,735мл, 9,46 ммоль) при 0°С Реакцію проводять протягом 20хв , зберігаючи температуру 0°С, потім реакційну суміш виливають у воду (60мл) Фази розділяють і водну фазу потім ДВІЧІ екстрагують метилхлоридом Зібрані органічні фази промивають 5%-м водним розчином гідрокарбонату натрію, потім гранично насиченим водним розчином хлориду натрію та збезводнюють над сульфатом натрію Після випаровування розчинника було одержано 3,64г (100%) бутилового ефіру 3-(2,4дихлорфеніл)-3-пдрокси-2-метил-4-(1 Н-1,2,4триазол-1-іл)метансульфоновоі кислоти у вигляді білої твердої речовини, яка використовується на наступній стадії 1 ТН- ЯМР (CDCI 3 ) 7,84 and 7,79 (2s, 2Н, НTnaz), 7,50-7,00 (m, ЗН, H-phenyl), 5,56 and 4,56 (2d, 2H, CH 2 -Tnaz ), 4,77 and 4,28 (2dd, 2H, CH 2 OMs), 3,20-3,10 (m, 1H, CH), 3,10 (s, 3H, C H 3 mesylate), 0,70 (d, 3H, CH 3 ) Приклад 6 Одержання тюацетатного ефіру S-[3-(2,4дихлорФеніл)-3-пдрокси-2-метил-4-(1 Н-1,2,4триазол-1 -іл)бутилу] Бутиловий ефір 3-(2,4-дихлорфеніл-3-пдрокси2-метил-4-(1 Н-1,2,4-триазол-1 -іл) метансульфонової кислоти (9,3 ммоль), одержаний, як описано у прикладі 5, розчиняють в етанолі (95мл) і додають до тюацетату калію (2,12г) Суміш переганяють протягом 2 годин, потім охолоджують на льоду і одержаний осад відфільтровують і промивають льодяним метиленхлоридом Фільтрат концентрують при зниженому тиску, додають воду (60 мл) і екстрагують декілька разів метиленхлоридом Органічні фази збирають та збезводнюють над сульфатом натрію Таким чином, вихід червонуватого сирого продукту становить 3,5г, його очищають за допомогою тонкошарової хроматографії на силікагелі (елюент етилацетат гексан = 1 1 ) , і вихід становить 1,72г (49%) тюацетатного ефіру 3-[3-(2,4-дихлорфеніл)-3пдрокси-2-метил-4-(1 Н-1,2,4-триазол-1 -іл)бутилу] 1 ТН- ЯМР (CDCI 3 ) 7,85 and 7,76 (2s, 2Н, НTnaz), 7,50-7,00 (m, ЗН, H-phenyl), 5,62 and 4,75 55405 16 (2d, 2H, CH 2 -Tnaz), 3,60-3,45 and 2,80-2,65 (2m, 2H, CH 2 -SCOCH 3 ), 2,75 (m, 1H, CH), 2,39 (s, 3H, CH 3 thioacetate), 0,70 (d, 3H, CH 3 ) Приклад 7 Одержання (2Р,ЗР-3-(2,4-дихлорфеніл)-3пдрокси-2-метил-4-(1 Н-1,2128 0,25 8 0,0625 2 16 >128 16 >128 Дані, наведені у таблиці, вказують, що сполуки - об'єкт даного винаходу - мають протигрибкову 19 55405 активність значно вищу за аналогічну активність еталонної сполуки Б) Активність, інгібуюча зростання дріжджів та ниткоподібних грибків оцінювали методом розведення на агарі Мінімальна концентрація, що забезпечує 50%-е інгібування (MICso), була виміряна при включенні у живильне середовище зменшуючих концентрацій сполук, які випробовуються, так, щоб концентрація мінялася ступінчасто з кроком, який дорівнює 2, від 64 до 0,00085м кг/мл Як живильне середовище застосовували казитоновий агар, буферований при рН=7 (казитонЭ г, глюкоза 20г, цитрат натрію 10г, дріжджовий екстракт 5г, агар 18г, біфосфат калію 0,54г, біфосфат натрію 3,34г, дистильована вода 1,000мл) Для оцінки активності відносно дріжджів 20 живильні середовища, які містять ступінчасті концентрації сполук, що випробовуються, інокулювали з 1мкл суспензії 5x105 бластоспор/мл, одержані з 24-48 годинних культур на глюкозному агарі Інокульовані живильні середовища шкубували при 32°С, а вимірювання для таких повіл ьнозростаючих дріжджів як Cryptococcus neofotmans були проведені через 24,48 та 72 години Як еталонні сполуки використовували флюконазол та ітраконазол У таблиці, наведеній нижче, вказана протигрибкова активність In vitro у відношенні Candida albicans, Candida tropicahs, Candida krusei, Candida glabrata, Candida parapsilosis, Candida lutitamoe, Candida kefyr, Cryptococcus neoformans, Tnchosporon spp, Blastoschizomyces capitatus, Geotnchum spp, Prototecha wicherhamii Таблиця 16 Протигрибкова активність in vitro сполук ЗА та 2А, виражена як MICso, і активність еталонних сполук фліоконазолута ітраконазолу відносно зазначених дріжджів Штами Сполука 2 A 0,015 0,06 0,12 0,12 0,07 0,015 0,017 0,06 0,06 0,25 0,5 2 С albicans С tropicahs С krusei С, glabrata С parapsilosis С lusitame С kefyr С neoformans Tnchosporum spp В capitatus Geotnchum spp P wicherhamii Для оцінки активності у відношенні міцетів, живильні середовища, які містять ступінчасті концентрації сполук, що досліджуються, інокулювали з 1мкл суспензії 5х105спор/мл (конид або ендоспор), одержаної від культурспорутворювачів Інокульовані живильні середовища шкубували при 32°С, а вимірювання проводили через 1,2,3,5,7 та 10 днів Як еталонні сполуки МІСбо(м кг/мл) Сполука ЗА Флюконазол 0,015 2 0,03 4 0,007 16 0,12 16 0,007 2 0,035 1 0,017 1 0,06 16 0,12 16 0,06 8 0,12 16 0,5 >64 Ітраконазол 0,015 0,03 0,03 4 6 0,016 >64 0,016 >64 0,016 >64 0,016 >64 >8 >64 >8 Амфотерицин В 0,25 0,25 0,12 0,25 16 2 1 55405 21 22 Продовження Таблиці 1 в Штами Сполука 2 A 0,06 0,25 Pseudoallescher ia A corymbifera Mucor R pusillus Acremomum Tnchoderma Сполука ЗА 0,06 0,06 2 >64 >64 >64 0,5 0,25 MIC50 (мкг/мл) Флюконазол Ітраконазол 0,016 4 4 0,25 0,12 Дані, наведені вище у таблицях, вказують, що сполуки - об'єкт даного винаходу - мають загальну протигрибкову активність, значно вище за аналогічну активність еталонних сполук Приклад 12 Протигрибкова активність in vivo Використовувалися миші-альбіноси (ЛІНІЯ CD (при системному 8 0,03 0,16 0,06 0,03 0,06 >16 16 16 1 >16 му гуміарабіку) сполуку, що досліджується, у геометричне зростаючих дозах Інфіковану групу використовували як контрольну Контроль за смертністю мишей здійснювався протягом 14 діб Середня захисна доза PDso визначалася токсикологічним аналізом (L Lison "Statistica apphcata aha biologia spenmentalle La programmazione deirespenmento e I'anahsi dei nsultati" - Casa Editnce Ambrosiana, 1961) за числом тварин, що залишилися у живих при кожному значенні концентрації Флюконазол та ітраконазол використовувалися як еталонні сполуки У таблиці, наведеній нижче, вказані дані протигрибкової активності in vivo деяких сполук, які представляють предмет даного винаходу після їх введення in vivo 1) вагою 23-25г, одержуючі нормальне харчування та воду за бажанням Кожній тварині вводили суспензію, 0,2мл якої 2,5x10 клітин/мл містили визначеного мікроорганізму, введення проводили внутрішньовенне Амфотерицин В >16 МІКОЗІ, європейському бластомікозі, аспергільозі), штракраніально (при штракраніальному бластомікозі) або назально (при пульмональному аспергильозі) Кожній з тварин відразу після ін'єкції та через 4, 24 і 48 години вводили орально (в 2% Таблиця 2 Оральна протигрибкова активність сполук 1А, ЗА, їх ВІДПОВІДНИХ енантюмерів 1 В, ЗВ і еталонних сполук флуконазол та ітраконазол, виражена як середня захисна доза PDso на 14-ту добу після введення Захворюван ня Системний МІКОЗ Системний європейсь кий бластомікоз Інтраканіаль ний бластомікоз Пульмональ ний аспергильоз Системний аспергильоз Штам Candida albicans 1040 Cryptococcus neoformans 3443 Cryptococcus neoformans ISM Aspergillus fu-migatus MOL-4 Aspergillus fu-migatus MOL-4 РОбо(мг/кг на 14-ту добу) Сполука Сполука Сполука Сполука Сполука Флуконазол 1A 1B 3A (a| 2 д(а) зв (а| 0 64 >2 0 32 8 84 5 48 14 59 125 93 35 4 57 0 38 Дані, наведені вище, вказують, що сполуки формули - об'єкт даного винаходу - активні після орального введення при середній захисній дозі, Ітраконазол 0 61 1 74 63 16 >50 22 28 >25 69 >100 >20 45 102 меншеи ніж у ітраконазола і, щонаименш, еквівалентній одному з флуконазолів Підписано до друку 05 05 2003 р Тираж 39 прим ТОВ "Міжнародний науковий комітет" вул Артема, 77, м Київ, 04050, Україна (044)236-47-24
ДивитисяДодаткова інформація
Назва патенту англійськоюAzole compounds having an antifungal activity, a method for preparation thereof a method for preparation of intermediate compounds and a pharmaceutical composition
Назва патенту російськоюАзольные соединения с противогрибковой активностью, способ получения этих соединений, способ получения промежуточных соединений и фармацевтическая композиция
МПК / Мітки
МПК: A61K 31/4196, C07D 521/00, A61K 31/41, A61K 31/415, A61P 31/00, C07D 249/08, A61P 31/10, A61K 31/4164, A61K 31/00, C07D 233/60
Мітки: композиція, сполуки, цих, азольні, активністю, фармацевтична, сполук, протигрибковою, проміжних, одержання, спосіб
Код посилання
<a href="https://ua.patents.su/11-55405-azolni-spoluki-z-protigribkovoyu-aktivnistyu-sposib-oderzhannya-cikh-spoluk-sposib-oderzhannya-promizhnikh-spoluk-ta-farmacevtichna-kompoziciya.html" target="_blank" rel="follow" title="База патентів України">Азольні сполуки з протигрибковою активністю, спосіб одержання цих сполук, спосіб одержання проміжних сполук та фармацевтична композиція</a>
Попередній патент: Верстат для заточування бурякорізальних ножів
Наступний патент: Композиція вуглеводневого палива
Випадковий патент: Спосіб ранньої діагностики деструктивного панкреатиту