Моноклональне антитіло до поверхневого глікопротеїну сперматозоїдів saga-1, антиген, що виявляється таким антитілом, та вакцина і сперміцид, які його містять
Номер патенту: 74765
Опубліковано: 15.02.2006
Автори: Херр Джон К., Уестбрук-Кейс Енн, Нортон Елізабет, Дікман Алан Б.
Формула / Реферат
1. Моноклональне антитіло, що експресується гібридомою за номером доступу АТСС НВ 12144, та є специфічним до поверхневого глікопротеїну сперматозоїдів SAGA-1.
2. Очищений поверхневий глікопротеїн сперматозоїдів SAGA-1, зв’язаний з моноклональним антитілом за п. 1.
3. Контрацептивна вакцина, що містить поверхневий глікопротеїн сперматозоїдів SAGA-1 за п. 2 в кількості, ефективній для індукції продукування антитіл до нього при уведенні ссавцю жіночої статі, у фармацевтично прийнятному носії.
4. Вакцина за п. 3, яка відрізняється тим, що глікопротеїн присутній в достатній кількості так, що по закінченні протоколу вакцинації ссавець жіночої статі демонструє титр антитіл, достатньо високий для забезпечення принаймні 95 відсоткового інгібування запліднення.
5. Спосіб визначення достатності титру антитіл для інгібування запліднення у вакцинованого пацієнта, який одержує вакцину по п. 3, що включає змішування проби зазначеного пацієнта з відомою кількістю глікопротеїну SAGA-1, іммобілізованого на твердій підкладці, та визначення зв’язування між зазначеним глікопротеїном SAGA-1, іммобілізованим на твердій підкладці, і антитілом, присутнім у пробі, причому повне зв’язування всього зазначеного іммобілізованого глікопротеїну SAGA-1 є показником того, що титр антитіл у пробі є достатнім для інгібування запліднення у зазначеного пацієнта.
6. Сперміцид, що включає як активний компонент моноклональне антитіло за п. 1 у фармацевтично прийнятному носії.
7. Сперміцид за п. 6, який відрізняється тим, що концентрація моноклональних антитіл є достатньою для того, щоб одна доза зазначеного сперміциду зв’язувала 100 відсотків всіх сперматозоїдів, присутніх в еякуляті.
8. Сперміцид за п. 7, який відрізняється тим, що моноклональні антитіла знаходяться на поверхні ліпосом.
9. Сперміцид за п. 8, який відрізняється тим, що ліпосоми являють собою нефосфоліпідні позитивно заряджені ліпосоми.
10. Спосіб визначення титру антитіл у пацієнта, який одержує вакцину за п. 3, що включає змішування проби, одержаної від зазначеного пацієнта, з певною кількістю глікопротеїну SAGA-1 та визначення кількості антитіл у пробі, що зв’язалась з глікопротеїном SAGA-1.
Текст
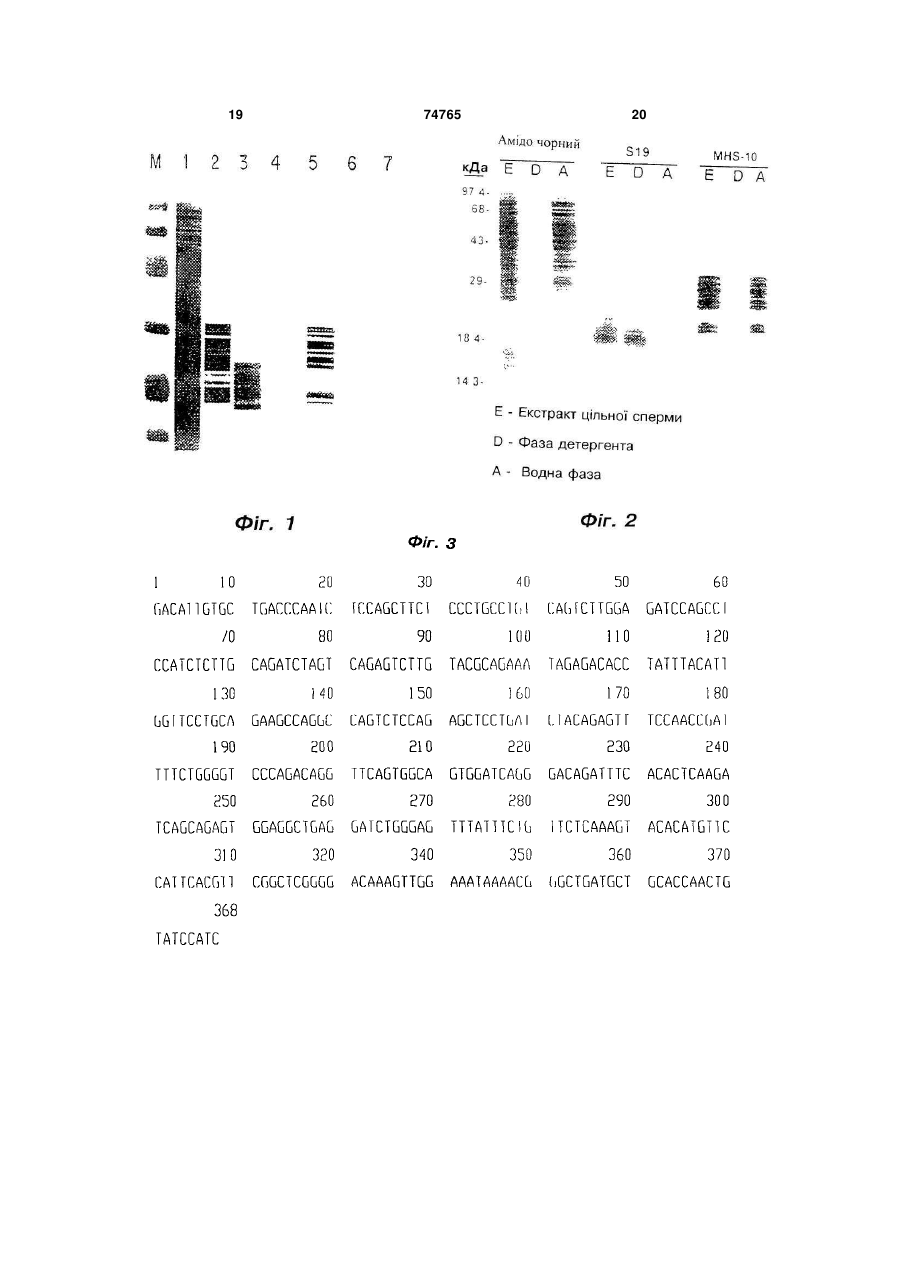
1. Моноклональне антитіло, що експресується гібридомою за номером доступу АТСС НВ 12144, та є специфічним до поверхневого глікопротеїну сперматозоїдів SAGA-1. 2. Очищений поверхневий глікопротеїн сперматозоїдів SAGA-1, зв’язаний з моноклональним антитілом за п. 1. 3. Контрацептивна вакцина, що містить поверхневий глікопротеїн сперматозоїдів SAGA-1 за п. 2 в кількості, ефективній для індукції продукування антитіл до нього при уведенні ссавцю жіночої статі, у фармацевтично прийнятному носії. 2 (19) 1 3 74765 4 10. Спосіб визначення титру антитіл у пацієнта, з певною кількістю глікопротеїну SAGA-1 та визнаякий одержує вакцину за п. 3, що включає змішучення кількості антитіл у пробі, що зв’язалась з вання проби, одержаної від зазначеного пацієнта, глікопротеїном SAGA-1. Даний винахід стосується поверхневого антигену сперми, моноклонального антитіла до нього та використання як даного моноклонального антитіла, так і даного антигену. Більш конкретно пропонується контрацептивна вакцина, яка використовує даний антиген як імуноген, а також стандарт для імунологічних тестів, а моноклональне антитіло знаходить використання як сперміцид та діагностичний реагент. Довгий час увагу приділяли розвитку удосконалених способів контрацепції. Однією з широко використовуваних технологій є використання сперміцидів, що є по суті хімічним бар'єром, який запобігає прониканню сперми в матку або яйцеклітину, або інгібує активність, тим самим запобігаючи заплідненню. Одним з найбільш широко використовуваних сперміцидів є детергент Ноноксинол-9. Дані висвітлюють збільшену кількість випадків урогенітальних інфекцій та шийково-піхвових запалень у жінок, які використовують такий сперміциддетергент. [McGroarty et al, Journal of Urology, 152(3): 831-833 (1994)]. Як альтернативу хімічним детергентам автори запропонували використовувати моноклональні антитіла як порівняно безпечний активний агент для місцевого використання, такого як використання в сперміцидах місцевої дії. [Див. наприклад, Соnе et al., Am. J Reprod. Immunol., 32:114-131 (1994)]. На основі досліджень прийшли до висновку, що крім зниження або усунення небажаних імунологічних реакцій моноклональні антитіла людини могли б виступати у ролі безпечних сперміцидів, оскільки їх дозу та час використання можна легко контролювати, локальне нанесення зменшує до мінімуму системну воздію, та дане моноклональне антитіло можна обирати по безпеці та ефективності. З цієї причини спермаактивне моноклональне антитіло, що використовують як сперміцид місцевої дії, можуть давати бажаний протизапліднюючий ефект без негативних побічних ефектів, що супроводжують сперміциди-детергенти. [Див., загалом, Alexander, Scientific American, Sept.:136-141 (1995)]. Відповідно, задачею рівня техніки залишається розробка безпечного та ефективного сперміциду на основі моноклональних антитіл. Як потенційні сперма-реактивні агенти вивчали широкий спектр моноклональних антитіл. Серед інших, що вивчали, моноклональне антитіло S19 проти людської сперми. Одержання цього моноклонального антитіла відображено у [Anderson et al., J. Reprod. Immunol.. 10:231-257 (1987)]. Це антитіло одержували імунізацією мишей гомогенатами сперми людини Виявилось, що це моноклональне lgG1 антитіло добре аглютинує сперму людини в лабораторії даних винахідників, та надалі воно було передано для подальшого вивчення до Групи по анти-спермальних моноклональних антитілах, спонсором якої є Всесвітня Організація Охорони Здоров'я Моноклональне антитіло S19 проти людської сперми добре аглютинуює сперму людини, інгібує щільне зв'язування між спермою людини та прозорою зоною та блокує проникання сперми в цервікальний слиз Anderson, вищевказане посилання, Соnе, вищевказане посилання, [Mahoney et al, J. Reprod. Immunol., 19:269-285 (1991)]. Швидка аглютинація сперми цим антитілом показана візуально на відеозапису. Ці дослідження показують, що антиген, який розпізнається S19, бере участь у взаємодії гамет при заплідненні та може служити як мішень для аутоантитіл, які вносять вклад до імунологічної неплідності, та може бути кандидатом при розробці контрацептивної вакцини. Однак, дане антитіло S19 надалі не використовували ні як інструмент досліду, ні як контрацептивний реагент. Не було зроблено ні депонування антитіл S19, ні "олюднення" антитіл для зменшення вірогідності імунної реакції. З цим моноклональним антитілом не проводили детальних експериментів, і на сьогодні воно залишається лише епізодом в науковому дослідженні. Відомі і інші моноклональні антитіла та спермальні антигени. Тут робиться посилання на моноклональне антитіло MHS-10 та антиген головки сперматозоїда SP-10, який вони зв'язують, які є кандидатом для використання при діагностиці сперми, так і як контрацептивної вакцини, що обговорюється в [Патенті США 5,436,137, Herr et al.], включеному сюди як посилання. Однак, на відміну від антигена SP-10, виявилось, що даний антиген, що зв'язується моноклональним антитілом S19, і аглютинуючий спермуантиген-1 (SAGA-1), очевидно, локалізований на всій поверхні сперматозоїда людини. Це чітко показує, що дане моноклональне антитіло буде зв'язувати та аглютинувати по множинних місцях на усій поверхні сперми. Продовжується робота по розробці вакцин, в яких використовують антиген SP-10. Аналогічно, багато винахідників в усьому світі шукають можливість розробки контрацептивних вакцин на основі спермальних антигенів. [Див., наприклад, Aitken et al., British Medical Journal. 49:88-99 (1993), Freemerman et al, Biol. Reprod.. 50:615-621 (1994), Herr, Fertility Control, PP-431-452 (Second Edition 1994)]. У зв'язку з цим продовжується робота з людським хоріонічним гонадотропіном (hCG) як контрацептивною вакциною для жінок. [Talwar, Current Opinion in Immunology. 6:698-704 (1994) та Європейський Патент 86304274.3]. В той час, коли клінічні випробовування вакцини знаходяться на стадії розробки з даною потенціальною вакциною, імуноген hCG, що використовують, функціонує як засіб, що викликає аборт, тобто, імунна відповідь, викликана інокуляцією цією вакциною, викликає аборт раннього ембріону або зародка. Це, можливо, для багатьох є неприйнятною формою контра 5 74765 6 цепції. Для створення ефективного сперміцидного геЯк альтернативу в досліденнях, які включають ля чи крему моноклональні антитіла треба забезмоделі з приматами та гризунами використовують печити ефективним носієм. Серед інших носіїв, цілий ряд спермальних поверхневих антигенів. доступних для вивчення, є нефосфоліпідні ліпосоТак, знижені показники фертильності одержані ми, спеціально розроблені для доставки антигена внаслідок імунізації дослідних тварин такими спеабо антитіл. Нещодавно стало доступним один рмальними поверхневими антигенами, як [LDH-C4, комерційний продукт від фірми Novavax, Inc., О'Неrn et al, Biol. Reprod., 52:331-339 (1995), РНRockville, Maryland під знаком NOVASOMES . Мо20, Primakoff et al, Nature, 335: 543, 546 (1988), ноклональні антитіла S19 можуть бути зв'язаними RSA-1, О'Rand et al, J. Reprod.-lmmunol. 25:89-102 з поверхнею цих позитивно заряджених ліпосом. (1993) та фертилін, Ramarao et al, Mol Reprod Можна приготувати і інші засоби доставки та спеDev., 43:70-75 (1995)]. На жаль, у приматів найвирма-аглютинуючі композиції. щій рівень ефективності, що спостерігають з сперОчищення антигена SAGA-1 є першим кроком мальним антигеном, є приблизно 75 відсотковим одержання ефективної вакцини. Очищений антиінгібуванням фертильності, O'Hern et al., вищевкаген, уведений у фармацевтично прийнятний носій, зане посилання. Таким чином, на сьогодні не іденможна уводити пацієнтам, що бажають провести тифікували людський спермальний антиген, який вакцинацію з метою контрацепції. Повторна вакфункціонує як контрацептивна вакцина з рівнем цинація призводить до вироблення антитіл проти ефективності, який можна порівняти з рівнем орасперми, які зв'язують сперму з високою ефективнільної контрацепції. Так, розробка безпечної та стю. Для виявлення досягнення ефективного рівня ефективної контрацептивною вакцини з високим антитіл, в традиційних діагностикумах можна вирівнем інгібування фертильності, який буде на користовувати очищений антиген як тестовий старівні ефективності, яку забезпечують оральні конндартний реагент для того, щоб дослідити наявтрацептиви, залишається задачею для спеціалісність та кількість антитіл, присутніх у пацієнта. тів у даній галузі. Фігура 1 є фотографією результатів вестернКрім того, внаслідок того, що індивіди, які одеблотингу, одержаного при реакції моноклональних ржують контрацептивну вакцину, будуть потребуантитіл (мАТ) S19 с SAGA-1. вати періодичної перевірки сироваточних антитіл Фігура 2 є фотографією результатів імуноблодля дослідження того, чи є вона "безпечною", витингу в ДСН-ПААГ з розділеними фазами SAGA-1 користання антигена SAGA-1 як мішені в дослідах в Triton X-114. для вимірювання концентрації антитіл у людей, що Фігура 3 є нуклеотидною послідовністю легкого приймають цю вакцинує бажаним. капа ланцюга S19 мАТ, яку одержано при секвенуПродукти "без рецептів" або діагностичні наванні. бори для детекції гормонів, зв'язаних з вагітністю Фігура 4 є фотографією вестерн-блотингу пре(hCG та ін.) досягли великого успіху на ринку, як парату SAGA-1 при зв'язуванні на колонці з імуноальтернатива або перший крок від потенційно сорбентом з мАТ S19. дратуючих незручних та дорогих відвідувань меФігура 5 є нуклеотидною послідовністю важкодичних установ. В останні роки увагу сфокусували го ланцюга S19 мАТ, що одержана при секвенуна аналізах присутності та концентрації сперми в ванні. еякуляті суб'єкта. З точки зору як запобігання вагіВинахід заявника охоплює моноклональне антності, так і клінічної діагностики у випадку зґвалтитіло S19, антиген SAGA-1, який воно зв'язує, тувань, або з метою дослідження присутності та сперміцид, який використовує дане моноклональефективності вазектомії (видалення сім'явивідного не антитіло в фармацевтично прийнятнимому нопротоку), зручний набір для аналізу, який можна сії, контрацептивну вакцину, яка використовує безпечно та надійно використовувати вдома, для SAGA-1 як імуноген, та діагностичний аналіз та детекції сперми в пробах, став конче бажаним. набір, який використовує зв'язані S19 як діагностиТакий тестовий набір, який включає моноклональкум для визначення концентрації сперми, та не антитіло MHS-10 до спермального антигена SAGA-1 як стандартний реагент для визначення головки сперматозоїда SP-10, описують в заявці вироблення антитіл у відповідь на вакцинацію ним, на патент США 08/231,675, яку тут згадують. Антита пов'язані з ними використання. Кожний з об'єктіло S19 показує ефективне, порівняно з антитілом тів обговорюється надалі. MHS-10, зв'язування для використання в диагносВ той час, як антитіло, білок та їх використання тикумах сперми людини. розглядаються окремо, даний винахід витікає з Наведені вище задачі вирішують при використого факту, що білок SAGA-1 широко розповсютанні "олюдненої" рекомбінантної версії моноклоджується по поверхні сперми та позитивно зв'язунального антитіла S19, очищенням та використанється моноклональними антитілами S19, які оченям відповідного антигену SAGA-1, який вони видно блокують функцію сперми на багатьох зв'язують, як активних агентів. Це моноклональне етапах в процесі запліднення, включаючи інгібуантитіло, імобілізоване у придатному засобі досвання рухомості сперми та взаємодію гамет. тавки, є ефективним зв'язуючим агентом як сперΜоноклональне антитіло S 19. міцид та діагностикум сперми людини. Антиген Як відмічалось вище, хоча немає попередньої SAGA-1, глікопротеїн сперми людини, розподіледоступної літератури, моноклональне антитіло ний по всій поверхні сперми, представляє собою було об'єктом дослідження та попередніх публікаефективний імуноген, а також стандарт для аналіцій. Спочатку антитіло S19 було одержано при зу дегенерації контрацептивних антитіл у тих, хто імунізації мишей гомогенатами сперми людини. використовує вакцину. Таке анти-людське моноклональне антитіло добре 7 74765 8 аглютинує сперму людини, інгібує щільне зв'язурофобні емульсії та сапоніни, для процесінгу та вання між спермою людини та прозорою зоною, презентації специфічних пептидів, які можуть виблокує проникання сперми до цервікального слизу користовуватись у зв'язку з антитілами даного та викликає явище струшування сперми. описаного тут сперміциду. [Див., напр., Моноклональне антитіло S19 було депоновано Raychaudhuri et al, Proceeding of the National за умов Будапештської угоди у АТСС 26 червня Academy of Science, U.S.A. 89:8308-8312 (1992) та 1996, депозит №НВ 12144. Наскільки відомо ЗаявNewman et al, J. Immunol. 148:2357-2362 (1992)]. нику, таке депонування здійснили вперше. Можна використовувати інші засоби транспорЗдатність моноклонального антитіла S19 добтування, які передбачають поміщення антитіл на ре аглютинувати сперму людини показали in vitro. мембрану, так, як це експресує рекомбінантний Аглютинацію аналізували відео-мікроскопією. Був вірус (тобто, рекомбінантні вірусні схеми, в яких зроблений відеофільм. ДНК, яка кодує дані антитіла, див., Infra, експресоДемонстрування аглютинації. вана в рекомбінантній клітині разом з структурним В кожному експерименті сперму людини розмембранним білком). З доступних варіантів крім водили до кінцевої концентрації 20млн сперматонефосфоліпідних ліпосом, що описані вище, прозоїдів/мл, а асцити розводили 1:10. Сперму та аспонують бажані форми ISCOM, що звичайно викоцити змішували в пробірках Eppendorf, а потім ристовують у вакцинах для презентації антигенів. вміщували в гемацитометр. Результати з асцитаISCOM утворюють клітиноподібну мембранну ми S19 фіксували цейтраферною кінозйомкою. структуру, в якій або на якій можна помістити анРезультати з контрольними (нульовими) асцитами титіла. Раніше ISCOM використовували у зв'язку з відображали в реальному часі. презентацією антигенів, але вони можуть аналогіВ час 0 сперма була вільно плаваючою. Через чним чином презентувати і антитіла в доступній 10хв сперма була повністю аглютинована. Якконвірусоподібній структурі. В цьому плані відомі і інші троль використовували рідину контрольних асцизасоби представлення активних білків, які вклютів. (Час 0 відповідає вміщенню сперми на плівку чають сфери сополімерів та вірусоподібні частки та початку фотографування). Сперма є вільно (VLPs), з метою одержання результатів, подібних плаваючою. Присутніми є шматки та круглі клітидо імуностимулюючих комплексів або ISCOM. Звіни. В контролі не виявляли змін в рухливості або сно, систему посадки антитіл через зшиваючий ступені аглютинації через 10хв. агент до поверхні мікросфери, звичайну для екстЦі дані показують, що моноклональне антитіло ремальних умов, можна зручно використовувати S19 зв'язує та аглютинує сперму людини по мноразом з придатним способом одержання композижинним місцям по всій поверхні сперматозоїду. цій гелів та кремів відповідно до даного підходу. Повна аглютинація всієї сперми вказує, що антиТаким чином, суть сперміциду даного винахоSAGA-1 мАТ будуть діяти як ефективні отримувачі ду є вміщення в зручному носії достатньої конценфункції сперми та, внаслідок цього, запліднення. трації мАТ S19 у придатному засобі транспортуОдержання сперміциду. вання з метою ефективно інгібувати (аглютинувати Як відмічалось, в літературі обговорюється чи зв'язувати) всі сперматозоїди, присутні в еякустворення різноманітних сперміцидів на основі ляті. моноклональних антитіл. Зручні засоби транспорту Виділення, характеристика та клонування мАТ описані у Соnе та Alexander, вищевказане посиS19. лання. Заявники розробили особливий засіб досКлітини гібридоми MHS-8, які секретують S19, тавки для представлення мАТ S19 в аглютинуючій вирощували та розраховували так, щоб 10млн формі, використовуючи доступну на ринку ліпосоклітин підтримувати для колекції РНК, використомальну систему доставки фірми Novamax, Inc., вуючи набір FastTrack 2.0 (Invitrogen). Всю РНК Rockville, Maryland, що відома на ринку під назвою безпосередньо виділяли з клітин, використовуючи Novasomes®. Ці ліпосоми спеціально одержують буфер з детергентом для лізису та деградації білдля доставки антигена чи антитіл. Novasomes®, ка. Полі(А)+РНК виділяли, використовуючи модищо містить нативні молекули моноклональних анфікований протокол Aviv та Leder, в якому мРНК титіл S19, зв'язані з поверхнею цих нефосфоліпідзв'язана з оліго dT смолою. Цю смолу потім проних позитивно заряджених ліпосом, ефективно мивали низьким сольовим буфером для видалендіють як сперміцид в сперміцидному гелі. Препаня зайвої загальної РНК, а полі(А)+РНК елюювали рат Novasomes® тестували, використовуючи опизі смоли. Спектрофотометричний аналіз при саний аналіз аглютинації сперми. При розведенні 260нм та 280нм дав кінцеву концентрацію по1:10 засіб доставки S19-Novasomes® аглютинував лі(А)+РНК 1,84мкг/мкл. сперму з такою самою ефективністю, що і асцитна Зворотна транскрипція та ампліфікація порідина S19 в розведенні 1:20. Цей результат покалі(А)+РНК. зує, що моноклональні антитіла S19 мають той S19, бівалентне антитіло, функціонує як аглюсамий ефект на функцію сперми при вміщені у тинін сперматозоїдів людини завдяки його здатнодоступну у продажу систему доставки, як і в натисті перехресно зв'язувати епітопи на поверхні спевній рідині. рми. Для збереження даної функції в Спеціалістам у цій галузі доступні альтернатирекомбінантному білку ідентифікували ділянки вні системи доставки. Кращими серед них є кон'юантитіла, що розпізнають епітоп, або ділянки, що говані з ліпідами пептиди, [див., напр., Deres et al, визначають комплементарність (CDR). ОдержуваNature. 342:561-564 (1989) та ISCOMs, див., напр., ли чотири мишачих олігонуклеотида для lgG1Takahashi, Nature, 344:873-875 (1990)]. В минулому специфічних субодиниць важкого ланцюга та легбули розроблені інші композиції, які включали гідкого (каппа) ланцюга. Ці олігонуклеотиди констру 9 74765 10 ювали так, щоб вони ампліфікували тільки варіа1мкл 10х реакційного буфера та 7мкл дист. Н2О бельні ділянки (приблизно перші 360 пар основ) протягом 1 години при 37°С. Жоден фрагмент не S19, які містять CDR. розщеплювався даним ферментом. 1. 5"-кінець важкого ланцюга: Потім проводили клонування шляхом змішуACTAGTCGACATGAGAGTGCTGATTCTTTTGTG вання 1мкл вектора pCR-Script, 1мкл 10х буфера 2. 3'-кінець важкого ланцюга: pCR-Script, 0,5мкл 10мМ гАТФ, 5,5мкл кДНК легкоCCCAAGCTTCCAGGGRCCARKGGATARACIGRTG го або важкого ланцюга, 1мкл ферменту Srfl та G 1мкл ДНК-лігази Т4. Реакційні пробірки інкубували 3. 5'-кінець легкого ланцюга: при кімнатній температурі протягом 1год та, потім, CCCCCCGGGGACATTGTGCTGACCCAATCTCCA нагрівали при 65°С протягом 10хв. GCTTCT Суперкомпетентні клітини Epicurean Coli XL14. 3'-кінець легкого ланцюга: Blue MRF' Kan розморожували на льоду, та 40мкл CCCCCCGGGgATGGATACAGTTGGTGCAGCATCA розливали на аліквоти по 15мл у завчасно охолоGCCCG джені пробірки. До клітин додавали 0,7мкл 1,44Μ Олігонуклеотиди важкого ланцюга одержували β-меркаптоетанолу та інкубували на льоду протяз набору Ig-Prime (Novagen), а нуклеотидні скорогом 10хв. Для усіх вищезгаданих реакційних сумічення є такі: R=A або G, І=інозин, K=G або Т. Всі шей для клонування 2мкл з них додавали до кліолігонуклеотиди розводили дистильованою Н2О тин та залишали на льоду протягом додаткових до кінцевої концентрації 1,0мкг/мкл. 30хв. Ці клітини та суміш кДНК нагрівали на бані Зворотну транскрипцію та ампліфікацію ланпри 42°С протягом 45 с та переносили на лід на цюговою полімеразною реакцією полі(А)+РНК гіб2хв. Після додавання 0,45мл середовища SOC ридоми S19 проводили в одній реакції, використоклітини стряхували у водяній бані при 37°С протявуючи систему Acces RT-PCR від Promega. гом 1год. Ці клітини наносили на чашки Петрі Коротко, 5мкл полі(А)+РНК гібридоми S19, 1мкг LВ/ампіцилін/метіцилін/Х-gal/ІРТС для селекції кожного відповідного праймера (праймери 1 та 2 колоній, чутливих до антибіотиків, та інкубували для важкого ланцюга, праймери 3 та 4 для легкого протягом ночі при 37°С. Відбирали позитивні кололанцюга), 1мкл 10мМ суміші dNTP, 10мкл 5Х бунії з кожного клону та вирощували у 5мл культури фера зворотної транскрипції AMV, 2мкл 25мМ SOC для очистки плазміди. MgSO4, 1мкл зворотної транскриптази AMV, 1мкл Плазміди очищали, використовуючи колонки полімерази Tfl та 30мкл дист. Н2О, вільної від нукQiagen-tip 20 (Qiagen) 5мл клітин центрифугували леази, об'єднували у 0,5мл пробірці для мікрофупротягом 5хв при 10000об/хв Надлишок середогування. Реакційну суміш інкубували при 48°С провища відсмоктували, а осад клітин ресуспендуватягом 45хв, а потім інкубували при 94°С протягом ли в 0,3мл буфера Р1 Додавали буфер Р2 та інку2хв. Реакцію повторювали 40 разів: 94°С протягом бували суміш при кімнатній температурі протягом 30с, 60°С протягом 1хв, 68°С протягом 2хв. Після 5хв. Додавали 0,3мл охолодженого буфера Р3 та останнього циклу проводили 7 хвилинну інкубацію суміш витримували на льоду протягом 10хв. Під при 68°С. Ампліфіковані продукти аналізували в час цієї інкубації колонки Qiagen врівноважували 2% агарозному гелі (Фіг.1). Лінія 1, 1т.п.н. маркер нанесенням 1мл буфера QBT. Зразки клітин потім ДНК від Stratagene; лінія 2, фрагмент легкого ланцентрифугували протягом 15хв при 10000об/хв та цюга та лінія 3 - фрагмент важкого ланцюга. Як і супернатант видаляли та наносили на колонки очікувалось, зразки важкого та легкого ланцюгів Qiagen-tip 20. Після того, як супернатанти повністю проходять з приблизно однаковою рухливістю, що увійшли в смолу колонки під дією сили тяжіння, і маркер з 396п.о., оскільки дані праймери для легколонки промивали 4мл буфера QC та елюювали кого ланцюга амплифікують перші 384п.о. (360п.о. 0,8мл буфера QF. Для осадження ДНК плазміди з додатковими сайтами рестрикції ферментами), до елюату з колонки додавали ізопропанол в об'єта праймери для важкого ланцюга ампліфікують мі 0,56мл, ι суміш центрифугували при 10000об/хв додаткові 60п.о. протягом 30 хвилин. Одержаний осад ДНК ресусКлонування амплифікованих фрагментів антипендували в 25мкл дист Н2О. тіла S19 у вектор. Для підтвердження наявності вставки кДНК в Лінії важкого та легкого ланцюгів з Фіг.1 виріочищеній плазміді кожний клон гідролізували двозали з геля та елювали, використовуючи фільтрума ферментами рестрикції Для розщеплення вивальний пристрій Ultrafree MC (Millipore). Ці очикористовували ферменти Not1 та EcoR1, що мащені фрагменти послідовно ампліфікували ще 40 ють сайти рестрикції на 5" та 3" кінці, відповідно, циклами або PCR з полімеразою Pfu замість полівід pCR-Script клонуючого вектора Якщо вставка мерази Tfl. Знову фрагменти очищали в гелі та присутня, гідроліз цими ферментами призведе до ресуспендували в 25мкл дист. Н2О. ексцизії п з вектора-хазяїна 1,5мкл кожного клону Клонування проводили, використовуючи сисоб'єднували з 0,75мкл Not1, 0,75мкл EcoR1, 1,5мл тему pCR-Script SK(+) (Stratagene). Цей вектор 10Х буфера, 10,5мкл дН2О та інкубували при 37°С використовує лігування по тупим кінцям на ампліпротягом 90хв. Гідролізати потім пропускали через фікованих в PCR Pfu-c фрагментів для введення 2% агарозний гель, та клони, що містили вставку, кДНК у сайт рестрикції Srfl вектора. Srfl є новим секвенували. слабо розщеплюючим ферментом рестрикції, який Аналіз послідовності клонів важкого та легкого впізнає послідовність 5"GCCCGGGC3". Для того, ланцюгів. щоб впевнитись у тому, що фрагменти важкого та Позитивні клони, одержані вище, секвенували, легкого ланцюгів не будуть гідролізуватись Srfl, використовуючи набір Fidelity (Oncor) Кожна реак1мкл кожної кДНК змішували з 1мкл ферменту Srfl, ція секвенування складалася з 5мкл плазмідної 11 74765 12 ДНК, 1мкл праймера Т3 (який розташований в Секвенування нових клонів легкого ланцюга зворотному напрямку від клонуючого сайта 5 в проводили в University of Virginia Biomolecular векторі pCR-Script) та 2мкл дист Н2О. Суміш нагріResearch Facility, використовуючи Автоматичний вали до 95°С протягом 5хв., швидко центрифугуДНК-секвенатор ABI Prism 377. Для кожного клону вали, додавали 2мкл буфера для ренатурації та об'єднували 100нг кДНК та 3,2 пмоль праймера ТЗ реакційну суміш витримували при 37°С протягом у загальному об'ємі 12мкл та загружали у прилад. 15хв. В реакції уводили мітку при додаванні 3мкл В той самий реакційний контейнер додавали чотири мічених барвником дидезоксинуклеотида та FS реакційного буфера Т4, 1мкл 33Р АТФ, 2мкл Т4 полімеразу AmpliTag. Всі продукти реакції заванДНК-полімерази та 2мкл дН2О. Цю суміш інкубуватажували на одну електрофоретичну лінію в 36см ли при 40°С протягом 15хв та потім додавали 6мкл 5,0% акриламідному гелі, зручному для зчитуванТ4 додаткову (вторинну) суміш. З цієї реакції міня. Детекції електрофоретичних індивідуальних чення 5,5мкл додавали до кожної з 4 пробірок, які фрагментів в реальному часі досягали при лазермістили 2мкл суміші А, С, G або Τ термінації, та ному скануванні у CCD телекамері, яка фіксувала інкубували при 40°С протягом 5хв. Реакції зупиняпродукт. Результати секвенування даним прилали додаванням 5мкл розчину Протеінази К та надом близько відповідає легким капа ланцюгам грівали до 95°С перед нанесенням на 6% акриламишей з бази даних Gen Bank, а вірна нуклеотидмідний розділяючий гель. Електрофорез на послідовність легкого ланцюга показана на проводили протягом 2 годин при напрузі 2000В, Фіг.3. Можна використовувати послідовності кДНК гель висушували на фільтрувальному папері важкого та легкого ланцюгів S19 у AT, використоWatman 3MM у вакуумі та експонували на рентгевуючи звичайну технологію, для створення рекомнівській плівці протягом ночі при кімнатній темпебінантних антитіл, включаючи антитіла з делеціяратурі. Після одержання плівки гелі прораховували ми сайтів та делеціями доменів та додатками. на лічильнику. При порівнянні розрахованих посліБілок SAGA-1 довностей клонів з відомими послідовностями Вже депоновані мАТ S19 ефективно зв'язують мишачих lgG1 було виявлено, що клони легкого та аглютинують сперму людини. Результати досланцюга демонструють аберантний легкий ланцюг, лідів з фотографуванням аглютинації чітко покаампліфікований з гібридоми sp2/0. Виділяли послізують, що зв'язування та аглютинація проходить довність важкого ланцюга, і його нуклеотидну поспо множинним місцям по всій поверхні сперми. На лідовність зображено на Фіг.5. додаток до ефективного сперміциду, яким є мАТ Гідроліз кДНК ферментами рестрикції для виS19, чітко показано, що зв'язаний антиген SAGA-1 далення ендогенних антитіл. є ефективним вакциногеном. Особливо, здатність Для видалення легкого ланцюга капа S19 з виробляти антитіла до білка SAGA-1 як антигеаберантного гібридомного легкого ланцюга повтона/імуногена повинна забезпечити жінок ефективрювали реакції RT-PCR. Аберантну послідовність ним засобом проти запліднення, тобто, контрацепаналізували та виявили, що вона мала рідкий сайт тивною вакциною. Цей самий антиген можна рестрикції Van91l (5'CCANNNNNTGG3') в одному з використовувати як стандартний тестовий реагент CDR. Припускаючи, що легкий ланцюг S19 був для моніторинга ефективності протоколу вакцини. присутній в амплифікованій RT-PCR суміші кДНК з Таким чином, вакцинованих жінок можна періодигібридоми, цю суміш гідролізували за допомогою чно обстежувати та перевіряти рідкі проби проти Van91l (New England Biolabs). Реакційна суміш для відомої кількості SAGA-1 в традиційних формах гідролізу складалася з 1мкл Van91l, 3мкл кДНК, аналізу, включаючи ІФА і вестерн- та саузерн1мкл 10Х реакційного буфера та 5мкл дН2О. Реакблотінги. Позитивне зв'язування відображає факт ційну суміш витримували протягом ночі при 37°С вироблення антитіл, які зв'язують білок SAGA-1, для того, щоб бути впевненим у повному гідролізі. та, отже, захист від вагітності. Використовуючи Будь-яка кДНК, яка не розрізана ферментом, поSAGA-1 як стандартизований тест та тестування винна бути правильним легким ланцюгом капа на кількість зв'язування, можна виміряти титр або S19. концентрацію одержаних антитіл. Оскільки адекваЯк показано на Фіг.2, гідролізат аналізували в тні титри можна встановити на основі дослідів по 2% агарозному гелі. (Лінія 1 є маркером ДНК аглютинації, обговорених вище, аналіз з викорис1т.п.о. Stratagene, лінія 2 є 3мкл нерозщепленої танням білка SAGA-1 як стандарт, відображаючого кДНК та лінія 3 є продуктом реакції гідролізу). В адекватні титри, є підтвердженням досягнення лінії 3 більшість з продуктів реакції гідролізували стану анти-фертильності, який потім потрібен тільна 2 фрагмента, але присутня слаба смуга, яка ки бути встановленим протягом бажаного періоду відповідає 396п.о., що представляє, можливо, ненеплідності. розщеплений легкий ланцюг S19. Цю смугу виріІдентифікація білка SAGA-1: зали з геля та очищали так, як описано вище, а Моноклональне антитіло S19 ідентифікує потім ампліфікували у 40 циклах PCR з полімераSAGA-1 як серію низькомолекулярних глікопротеїзою Pfu так, як описано раніше. Цю кДНК надалі нів у вестерн-блотингу (Фіг.1). Екстракт промитої клонували у вектор pCR-Script як і раніше та відсперми людини готували в 1 відсотковому ДСН та бирали шість позитивних колоній таким самим розділяли у редукуючому ДСН-ПААГ. Моноклонаспособом з чашками. Знову ці позитивні колонії льні антитіла S19 реагували з рядом перекриваювирощували, очищали плазміду та рестрикційно чихся смуг, які простягалися від приблизно 15 до гідролізували для підтвердження присутності 25кДа (Лінія 3). Імунореактивність S19 по відновставки. шенню до антигена, який він розпізнає, усували Автоматичне секвенування легкого ланцюга шляхом обробки 10мМ перйодатною кислотою капа. 13 74765 14 (Лінія 6), в той час як реактивність моноклональношається розчинними у водній фазі, тоді як декілька го антитіла MHS-10 з пептидним епітопом на білку протеїнів розділяються Triton X-114. Отже, роздіSP-10 залишалась без змін (Лінії 2 та 5). Ці релення фаз Triton X-114 буде корисним як початкозультати свідчать, що епітоп, який розпізнається вий етап при очистці нативного SAGA-1. моноклональним антитілом S19 є вуглеводневим Заміщення детергента необхідно для очистки. залишком. (Фіг.1, смуга 1, забарвлювання амідо Біохімічні властивості детергента Triton X-114 чорним, Лінії 2 та 5, MHS-10, лінії 3 та 6, S19, лінії не відповідають подальшим способам очистки При 4 та 7, контрольні асцити, лінії 2-4 без обробки потрібній концентрації даного детергента Triton Хперйодатною кислотою, лінії 5-7 - стріпи імунобло114 включає білок у великі міцели детергента, які тингу, оброблені перйодатною кислотою, Μ - мармаскують зв'язування білку з афінним сорбентом. кери молекулярної маси, кДа: 97,4, 68, 43, 29, 18,4, Тому, Triton X-114 не можна використовувати при 14,3). Більш того, обробка ДСН-екстракта сперми кімнатній температурі. Більш того, білок в екстракті протеіназою К порушує імунореактивність S19 (даTriton X-114 був осаджений при -20°С ацетоном та ні не наведені), показуючи тим самим, що, можлиресуспендований в 0,5 відсотковому октилглюково, антиген S19 є глікопротеїном. Ідентифікований зиді, TBS (10мМ Трис-НСІ (pH 7,4), 150мМ NaCI) S19 глікопротеін був названий антигеном аглютиОктилглюкозид можна використовувати при кімнанації сперми-1 (SAGA-1) на підставі його здібності тній температурі, а потрібні концентрації не інгібушвидко аглютинувати сперму людини. ють реакції білок-імуносорбент. Спосіб високого збагачення SAGA-1: Моноклональне антитіло S19 перехресно зшиХарактеристики розчинності SAGA-1 показували з Білок G-Сефарозою за допомогою гідрохють, що він є гідрофобним, інтегральним мемлориду диметилпімелімідату, як детально наведебранним білком. Реактивність S19 не спостерігали но нижче Цей імуносорбент та зерна. Білок Gв екстрактах сперми людини з високим вмістом Сефарози без перехресно зшитих моноклональсолей (1Μ NaCI або 0,6Μ КСІ) та/або м'яким неіонних антитіл, негативний контроль для специфічноним детергентом (0,1 відсоток ΝΡ-40 або Triton Xсті антитіл, інкубували з екстрактом октилглюкози114). Ці дані показують, що SAGA-1 не буде екстду. Зв'язані фракції вивчали у вестерн-блотингу з рагуватись при класичній обробці для видалення моноклональними антитілами S19 (Фіг.4). SAGA-1 периферійних білків. ідентифікували в екстракті октилглюкозида та у Надалі той факт, що SAGA-1 існує як інтеграфракції, яка зв'язується імуносорбентом, але не у льний мембранний білок, був перевірений при фракціях, елюйованих з гранул. Білок G-Сефарози використанні розділення фаз Triton X-114, як опибез антитіл. Ці результати свідчать, що SAGA-1 сано Bordier (1981). Такі неіонні детергенти, як зв'язаний специфічно з імуносорбентом. Показано, Triton X-114, розчиняють мембранні білки шляхом що смужка приблизно 42кДа, що присутня в кожній заміни нормального ліпідного оточення Triton Xлінії забарвленого сріблом геля, є забрудненням, 114 утворює малі міцели при 0°С при диспергуяке присутнє в гелевому буфері для завантаження ванні у водному розчині вище його критичної кон(Фіг.3, смуги 1-3, окрашування сріблом; смуги 4-6, центрації міцелоутворення. Гідрофобні інтегральні вестерн-блотинг; смуги 1 та 4, екстракт октилглюмембранні білки включаються в ці міцели, в той козида, інкубований з імуносорбентом, лінії 3 та 6час як гідрофільні білки залишаються у водному білкова фракція, яка одна зв'язується з гранулами оточенні. При нагріванні такого розчину міцели Білок G-Сефарози. збільшуються у розмірі та виходять з розчину, Протокол імуноафінної очистки SAGA-1 від утворюючи збагачену детергентом фазу, яку можсперми людини. на виділити з водного розчину центрифугуванням Одержання екстракту сперми: Від двадцяти до Bordier (1981) використовував цей спосіб для детридцяти еякулятів людини залишали розріджамонстрації того, що більшість інтегральних мемтись при кімнатній температурі, промивали двічі бранних білків виділяється фазою детергента, в при центрифугуванні при 400Xg з середовищем той час, як гідрофільні білки залишаються у водній Ham's F-10, забуференим 0,1Μ Hepes (pH 7,4) та фазі. зберігали в замороженому стані до використання. Для вивчення розділення фаз Triton X-114 Фаза відокремлення: розтанувші осади об'єдSAGA-1 промиту сперму людини екстрагували 1 нували та екстрагували при 4°С в TBS (10мМ відсотковим Triton X-114, 10мМ Трис-НСІ, pH 7,4, Трис-НСІ (pH 7,4), 150мМ NaCI), який містив 1,7 150мМ NaCI при 4°С та центрифугували для вивідсотків Triton Х-114, та центрифугували при далення обривків. Після трьох циклів розділення 13000 g для видалення обривків Нагрівали екстфаз еквивалентну кількість початкового екстракту ракт при 30°С протягом 3хв та центрифугували сперми, детергентної фази та водної фази аналіпри 300 g протягом 3хв для розділення детергензували в ДСН-ПААГ та імуноблотингу (Фіг.2). Спетної та водної фази. Повторювали розділення корма/яєчко-специфічний білок людини SP-10, пежної фази двічі для того, щоб впевнитись в повнориферійний білок мембрани головки му розділенні. Освітляли кінцеву фазу з сперматозоїда використовували як контроль, реадетергентом при ультрацентрифугуванні при ктивність моноклональних антитіл MHS-10 з SP-10 100000 g для видалення нерозчинних обривків виявляли в початковому екстракті сперми та у фаІмуноблотінг з S19 повинен підтвердити, що зі детергента, але не у водній фазі Ці результати SAGA-1 відшаровується з фазою детергента. свідчать, що моноклональні антитіла S19 реагують Осадження ацетоном та ресуспендування в з гідрофобним інтегральним мембранним глікопоктилглюкозиді: Для осадження білку з екстракту ротеїном. Окрашування амідо чорним показало, Triton-X 114 додавали 8 об'ємів ацетону при -20°С, що більшість загальних спермальних білків зализмішували та залишали на 4 години або на ніч при 15 74765 16 -20°С. Осад відділяли центрифугуванням при блотинг. Для визначення чистоти зрівнювали молекулярну вагу та кількість смуг білка, одержаних 3000 g, супернатант відбирали декантацією та при забарвленні сріблом та реактивності по відзалишали осад висушуватись на повітрі. Осад реношенню до S19. суспендували у 0,5 відсотковому октиглюкозиді, Вакцина. TBS в об'ємі, що складав два об'єми початкового Даний винахід включає контрацептивну вакциекстракту Triton Х-114. Ультрацентрифугували при ну, що використовує SAGA-1, та, особливо, будь100000 g протягом 1 години при 4°С для видаленякий білок, який, як імуноген, зв'язується мАТ S19. ня нерозчинних білків. Супернатант відбирали для Імунізація SAGA-1 буде приводити до вироблення використання в афінній хроматографії. антитіл в хазяїні, достатніх для задач інгібування Одержання імуносорбенту з S19: Частково запліднення. Одержання вакцини як такої слідує очищали імуноглобуліни з об'єднаних асцитів, що традиційній схемі. Очищений імуноген, переважно, містили S19, шляхом осадження 50 відсотковим рекомбінантний імуноген, що несе епітопні ділянки сульфатом амонію. Осад промивали двічі 50 відS19, розташовують в зручному фармацевтичному сотковим сульфатом амонію та ресуспендували в носії. PBS (20мМ Na3PO4, 150мМ NaCI, pH 7,4) у 1/10 від Приготувати прийнятну вакцину, використовувихідного об'єму асцитів. Діалізували проти PBS ючи новітній імуноген апліканта, можна за допомодля видалення сульфату амонію Визначали конгою по слідуючого традиційного способу. Вакцини, центрацію білка, використовуючи набір реагентів описані Aitken, Freemerman and Herr, вищевказане ВСА (Pierce Chemical Company) Інкубували осапосилання, можна просто пристосувати для білка джений сульфатом амонію білок з зернами Білок SAGA-1 та його похідних, що зв'язуються мАТ S19. G-Сефарози (Pharmacia, Piscataway, NJ) у PBS, pH Конкретніше, контрацептивні вакцини, що викорис7,4, протягом ночі при 4°С для того, щоб IgG зв'ятовують PH-білок, одержаний [Primakoff, вищевказався. Уводили 15мг осадженого сульфатом амозане посилання, та Primakoff et al., та Primakoff, нію білка намл зерен Білок G-Сефарози Суспензію Am.J.Reprod.Immunol., 31:208-210 (1994)], відогранул поміщали у хроматографічну колонку та бражають успішну адаптацію спермального білкопромивали PBS (pH 8,2) до тих пір, доки білок не вого антигена до імуногена вакцини в зручному детектували в елюаті, що спостерігали по УФ погносії. В той час, як білки, що використовували линанню при А280. Для ковалентної зшивки IgG з Primakoff та інші, були, на жаль, нездатні давати гранулами з білком G колонку врівноважували високий ступінь (вище за 95 відсотків) інгібування 0,2Μ триетаноламіном (pH 8,2), ресуспендували запліднення у приматів, специфічний характер сорбент у 20 об'ємах 20мМ дипдрохлориду димебілка SAGA-1, особливо, його широке розповсютилпімелідату, 0,2Μ триетаноламіну (pH 8,2) та дження по всій поверхні клітин сперми та багатоінкубували протягом 45хв при обережному перечисельні шляхи взаємодії між ним та моноклонамішуванні при кімнатній температурі Для зупинки льними антитілами, що за це відповідні, дає реакції перехресної зшивки гранули центрифугуможливість досягнення інгібування запліднення на вали (500 g протягом 3хв), ресуспендували гранурівні оральних контрацептивів (тобто, 99 відсотків). ли в рівному об'ємі 20мМ етаноламіна та інкубуваДля досягнення адекватного титра антитіл вірогідли цю суспензію при кімнатній температурі но, що більшість обстежених індивідів, включаючи протягом 5хв. Рідину з гранулами загружали в жінок, будуть потребувати вакцинації згідно з прохроматографічну колонку, врівноважену 0,2 відсотоколом з великим інтервалом між ін'єкціями, для тковим азидом натрію, PBS (pH 8,2) та зберігали того, щоб дати час на виробку придатного титру при 4°С до використання. антитіл після кожної ін'єкції. Ін'єкції, уведені з інтеАфінна хроматографія: Врівноважували одеррвалом в місяць, після яких проводять аналіз з жану імуноафінну колонку 0,5 відсотковим октилгвикористанням білка SAGA-1 як стандартна для люкозидом, TBS. Пропускали розчин октилглюковизначення титру антитіл, повинні бути адекватзиду, що містив гідрофобні білки сперми, через ними після періоду біля трьох місяців, для того, колонку при 1,3мл/хв безперервно протягом 16 щоб надати достатнє інгібування запліднення з годин при 4°С. Промивали колонку 0,5 відсотковим метою реального використання. Звісно, якщо діагоктилглюкозидом, TBS для видалення незв'язаноностичний аналіз відображає більш низький титр го матеріалу та визначали концентрацію білка у антитіл, коли не досягається повне інгібування промивних водах по УФ поглинанню. Після видазапліднення, повинно розпочати подальшу пролення незв'язаного білку зв'язаний матеріал елюграму вакцинації або інше тестування для визнаювали 0,1Μ гліцином, 0,15Μ NaCI (pH 2,4), 0,5 відчення причини низького титру антитіл. сотковим ДСН. Збирали фракції по 3мл та Використання імуногена для одержання антивизначали концентрацію білка за допомогою натіл до антигена природного стану або рекомбінанбору реактивів ВСА та по УФ поглинанню Об'єднутного антигена, обидва з яких охоплюються форвали фракції, які містили білок, та концентрували, мулою винаходу, є, per se, звичайною справою використовуючи концентратор Amicon з мембрандля спеціалістів в даній галузі. Новітня розробка ним фільтром. заявника поширюється на включення та впевнеАналіз чистоти препарата: Виділяли білок ність в унікальності білка SAGA-1, який тут вперше очищений на імуноафінній колонці з S19, в ДСНповністю охарактеризували. Звичайна оптимізація ПААГ у 15 відсотковому акриламіді та або забарвдози, засобів доставки, способів уведення та т.п. лювали сріблом, або переносили на нітроцелюлоне є аспектом даного винаходу, per se. Все ж таки, зу. Після аналізу імуноблотом на реактивність до припускається, що звичайною є доза від 100мкг SAGA-1 шляхом інкубації з моноклональними анбілка SAGA-1 до 500мкг білка SAGA-1 в об'ємі титілами S19 проводили стандартний вестерн 17 74765 18 0,5мл буде зручною як стандартна доза. Внаслідок виданому 25 лютого 1997, який тут включений як того, що антитіла, одержані при даній програмі посилання. Діагностикуми, описані в ньому, виковакцинації, будуть аглютинувати сперму більш ристовують зв'язуючі антитіла SP-10, MHS-10 або ефективно, ніж інші специфічні анти-спермальні антитіла, які мають такі характеристики зв'язуванантитіла, завдяки зв'язуванню по всій поверхні, ня, що і антитіла, які експресуються лінією клітин одержують більшу ефективність цієї вакцини. гібридоми з АТСС під Ідентифікаційним номером Як є звичайним з багатьма вакцинами, муль№НВ 10039. Як описано у включеній заявці, такий тивалентна вакцина часто є більш ефективна, ніж тип діагностикумів без рецептів знаходить викориодинична. Як вказувалось раніше, окрім SAGA-1 стання у судовому середовищі, можуть бути коривідомі численні сперма-специфічні антигени. Хоча, сними при визначенні присутності клітин зародка індивідуально ці антигени не призводять до висонормального походження, викликав суттєвий інтекого ступеню впевненості в інгібуванні заплідненрес у тих, хто стикається з труднощами у досягня, їх можна додавати до вакцини на основі SAGAненні запліднення, у чоловіків з видаленням сім'я1 для надання більшої ефективності. Особливо, вивідного протоку а також при тестуванні чоловіків комбінація SAGA-1 та S19 як імуногена бажана з видаленим сім'явивідним протоком, для визнадля мультивалентної вакцини. Оскільки експеричення успіху хірургічної реконнекції. Для будь-якої мент показав, що антитіла до цих білків швидко з різноманіття причин визначення присутності спевиробляються, можлива генерація здатності сумірми в біологічній пробі, будь то в еякуляті або в сного зв'язування з двома білками, також як і з пробі, що походить з еякуляту або з репродуктивіншими відомими в рівні техніки білками, які можна ного тракту чоловіка, представляє велике медичне додати як імуногенний компонент мультивалентної значення. Антиген, що зв'язується мАТ S19, білок вакцини. Суттєво, однак, що білок SAGA-1 або SAGA-1 та відповідні варіанти та рекомбінантні будь-який інший білок, що зв'язується антитілами похідні, що мають S19 CDR-відповідний епітоп, S19, буде центральним елементом такої вакцини, можуть використовуватись в схемах таких досліоскільки антитіла до них забезпечують високо подів, що описані у включеному патенті США силені зв'язуючи можливості, і, отже, більш висо5,605,803, виданому 25 лютого 1997. кий ступінь впевненості у інгібуванні запліднення. Таким чином, антитіло S19 можна зв'язати з Діагностика. твердою фазою та використовувати для захопВластивості білків, зв'язаних з мАТ S19, вклюлення білка SAGA-1. Визначення присутності античаючи білок SAGA-1, утворюють два різних типи гена SAGA-1 можна виконати при використанні можливих діагностикумів. Спершу, необхідно видругого моноклонального або поліклонального значити виробку антитіл до імуногену вакцини, реагенту. [Див., наприклад, Shen et al, Am. J. білку SAGA-1 або його варіантів. Декілька потенReprod. Immunol., 29:231-240 (1993)]. Інші схеми ційних кандидатів можуть не мати придатної сисдослідів можуть використовувати губки або трубки теми імунної відповіді, а багато індивідів мають та кодовані антитілами забарвлені шарики. В усіх різний титр антитіл, вироблених у відповідь на цих варіантах основним реагентом є мАТ S19 або будь-який імуноген, або протокол уведення імуноподібні антитіла до білка SAGA-1. Будь-який білок, гена. Викликання адекватного титру антитіл можна присутній в пробі, що тестують, зв'язують або засуттєво підтримувати, використовуючи білок хоплюють імобілізованими антитілами. Таким чиSAGA-1 як антигенний стандарт. Використовуючи ном, в діагностикумі, що повинен визначати вироаналіз аглютинації, описаний вище у зв'язку з мАТ бку адекватного титру антитіл, білок SAGA-1 або S19, можна легко визначити концентрацію, необподібний білок використовують як стандартний хідну для 100 відсоткової аглютинації. Цю концентестовий реагент. В "домашньому наборі для тестрацію білка SAGA-1, належним чином імобілізотування", де потрібно перевірити присутність антиваного та уведеного, аналізують проти проби, гена, для перевірки присутності сперми реагентом взятої у пацієнта. Досягнення 100 відсоткового є відповідні за це моноклональні антитіла. зв'язування свідчить про адекватний титр антитіл. Заявник описав даний винахід як з загальної, Внаслідок того, що будь-яка така програма вакцитак і з специфічної точок зору. У спеціалістів в цій нації повинна проводитись під клінічним керівницгалузі виникатимуть варіанти, а винахід не обметвом, процедура тестування може бути звичайжується прикладами та специфічними втіленнями, ною, використовуючи ІФА, вестерн-блотинг або якщо це не вказано в описі. У спеціалістів в даній інші визнані в рівні техніки методи. галузі виникатимуть варіанти без здійснення винаІснує, крім того, підвищений інтерес простого у хідницького кроку. Особливо спеціалісти в даній використанні "близьких споживачу" комерційних галузі вноситимуть зміни в рівень концентрацій, діагностикумів, а саме, діагностикумів без рецеппротокол уведення, рекомбінантну практику та тів. Причина інтересудо такого типу діагностикуваріації, та т.п., що буде знаходитись в рамках мів та різноманіття його використання обговорюданого винаходу, межі якого визначаються надалі ються детально в патенті США 5,605,803, формулою винаходу. 19 74765 20 21 Комп’ютерна верстка О.Воробєй 74765 Підписне 22 Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюMonoclonal antibody agglutinating sperm surface glycoprotein saga-1, antigen detected by this antibody, vaccine and spermicide containing this antigen
Назва патенту російськоюМоноклональные антитела к поверхностному гликопротеину сперматозоидов saga-1, антиген, выявляемый этими антителами, вакцина и спермицид, содержащие этот антиген
МПК / Мітки
МПК: C07K 14/705, A61K 39/00, G01N 33/577, C07K 16/28, A61P 43/00, A61P 15/18, C12P 21/08, G01N 33/53, C12N 15/02, A61K 39/395
Мітки: сперматозоїдів, містять, вакцина, глікопротеїну, таким, сперміцид, saga-1, поверхневого, виявляється, антиген, антитілом, моноклональне, антитіло
Код посилання
<a href="https://ua.patents.su/11-74765-monoklonalne-antitilo-do-poverkhnevogo-glikoprotenu-spermatozodiv-saga-1-antigen-shho-viyavlyaehtsya-takim-antitilom-ta-vakcina-i-spermicid-yaki-jjogo-mistyat.html" target="_blank" rel="follow" title="База патентів України">Моноклональне антитіло до поверхневого глікопротеїну сперматозоїдів saga-1, антиген, що виявляється таким антитілом, та вакцина і сперміцид, які його містять</a>
Попередній патент: Спосіб магнітно-імпульсної обробки тонкостінних металевих заготовок
Наступний патент: Система мовлення і приймання, а також система умовного доступу до неї
Випадковий патент: Спосіб одержання поліуретанів у розчині