Моноклональне антитіло, яке має здатність розпізнавати антиген, який викликає апоптоз мієлоїдних клітин, фрагмент f(ab)2 моноклонального антитіла, гібридома ferm bp-4382
Формула / Реферат
1. Моноклональное антитело, способное распознавать антиген, вызывающий апоптоз миелоидных клеток, полученное путем иммунизации млекопитающего стромальными клетками селезенки, предварительно иннокулированного rG-CSF и способного экспрессировать упомянутый антиген, при этом моноклональное антитело обладает способностью вызывать апоптоз миелоидных клеток.
2. Моноклональное антитело по п. 1, отличающееся тем, что оно относится к классу иммуноглобулинов G.
3. Моноклональное антитело по п. 1, отличающееся тем, что иммунизацию упомянутого животного проводят спленоцитами стромальных клеток селезенки.
4. Моноклональное антитело по п. 1, отличающееся тем, что упомянутое антитело является ВМАР-1, которое продуцируется гибридомой FERM BP-4382 (Национальный институт биологической науки и человеческой технологии Агентства промышленной науки и технологии Японии).
5. Моноклональное антитело по п. 1, отличающееся тем, что оно предназначено для лечения миелоцитной лейкемии.
6. Фрагмент F(ab)2 моноклонального антитела, способного распознавать антиген, вызывающий апоптоз миелоидных клеток, полученного путем иммунизации млекопитающего стромальными клетками селезенки, предварительно иннокулированного rG-CSF и способного экспрессировать упомянутый антиген, при этом моноклональное антитело обладает способностью вызывать апоптоз миелоидных клеток.
7. Гибридома FERM BP-4382, продуцирующая моноклональное антитело по п. 1 (Национальный институт биологической науки и человеческой технологии Агентства промышленной науки и технологии Японии).
Текст
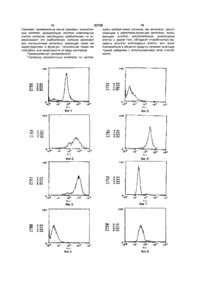
1 Моноклоналыное антитело, способное распознавать антиген, вызывающий апоптоз миелоидных клеток, полученное путем иммунизации млекопитающего стромальными клетками селезенки, предварительно иннокулированного rG-CSF и способного экспрессировать упомянутый антиген, при этом моноклональное антитело обладает способностью вызывать апоптоз миелоидных клеток 2 Моноклональное антитело по п 1 , отличающееся тем, что оно относится к классу иммуноглобулинов G 3 Моноклональное антитело по п 1 , отличаю щееся тем, что иммунизацию упомянутого животного проводят спленоцитами стромальных клеток селезенки 4 Моноклональное антитело по п 1 , отличающееся тем, что упомянутое антитело является ВМАР-1, которое продуцируется гибридомой FERM BP-4382 (Национальный институт биологической науки и человеческой технологии Агентства промышленной науки и технологии Японии) 5 Моноклональное антитело по п 1 , отличающееся тем, что оно предназначено для лечения миелоцитной лейкемии 6 Фрагмент F(ab)2 моноклонального антитела, способного распознавать антиген, вызывающий апоптоз миелоидных клеток, полученного путем иммунизации млекопитающего стромальными клетками селезенки, предварительно иннокулированного rG-CSF и способного экспрессировать упомянутый антиген, при этом моноклональное антитело обладает способностью вызывать апоптоз миелоидных клеток 7 Гибридома FERM BP-4382, продуцирующая моноклональное антитело по п 1 (Национальный институт биологической науки и человеческой технологии Агентства промышленной науки и технологии Японии) Настоящее изобретение относится к новым монотонным антителам, обладающим способностью вызывать апоптоз миелоидных клеток и служащим лекарственным средством при миелоцитозной лейкемии, и их фрагментам, а также относится к гибридоме, вырабатывающей монотонное антитело Поскольку монотонные антитела по настоящему изобретению полезны как антитела, распознающие и идентифицирующие антигены, вызывающие апоптоз исключительно миелоидных теток и, кроме того, обладают способностью вызывать апоптоз миелоидных теток, они могут применяться как лекарство, относящееся к сред ствам для лечения миелоцитознои лейкемии с использованием этой способности Предыстория изобретения Факторы, стимулирующие колонии гранулоцитов, например, рекомбинантные факторы, стимулирующие колонии гранулоцитов (rG-CSF), были известны прежде всего как гуморальные факторы, стимулирующие видоизменение и размножение гранулоцитных теток, и в эксперименте на мышах in vivo было показано, что применение rGCSF усиливает кроветворение костным мозгом и, кроме того, вызывает значительное сверхмедуллярное кроветворение в селезенке с размножением кроветворных стволовых теток и всех теток О 0 0 о 1^ о ю 50708 4 фаги, моноциты и эритробласты, и миелоидные тетки согласно настоящему изобретению также включают упомянутые выше Таких монотонных антител, способных вызывать апоптоз миелоидных теток, до сих пор не было известно, и поэтому монотонные антитела настоящего изобретения по определению включают все монотонные антитела, обладающие свойством вызывать апоптоз миелоидных теток Монотонное антитело по настоящему изобретению в основном может быть получено как описано ниже А именно, монотонное антитело по настоящему изобретению может быть получено, например, путем использования стромальных теток селезенки, взятых от животного, получавшего rGCSF в качестве антигенов, иммунизации их обычным способом иммунизации, слияния иммунизированных теток обычным способом клеточного слияния и тонирования слитых теток обычным способом тонирования Однако, хотя была выведена клеточная линия В качестве способа получения монотонного из специфических стромальных клеток селезенки антитела по настоящему изобретению может слуи были исследованы их цитологические характежить предпочтительным примером способ, вклюристики, но особых антител, распознающих почающий использование клеток CF-1, стромальных верхностные антигены клеток, выделено не было, теток селезенки животного, получавшего rG-CSF, и их характеристики были практически неизвествыведенных авторами настоящего изобретения в ны виде культуры клеточной линии, как антигена [Blood, т 80, 1914 (1992)], слияния теток соедиВ связи с этим, на основе приведенной выше нительной плазмы (иммуноцитов) млекопитающеинформации о стромальных клетках селезенки и го, иммунизированного антигеном, с тетками результатов исследований, авторы настоящего миеломы млекопитающего, например, мыши, т о изобретения провели скрупулезное исследование нирования полученных слитых теток (гибридом), с целью выделения особых антител, способных отбор тонов, вырабатывающих антитело, котораспознавать стромальные клетки селезенки, и рое, согласно настоящему изобретению, распосоздали препарат монотонных антител, использнает среди них вышеупомянутую клеточную лизуя линии стромальных клеток селезенки в качению, и культивирование их для извлечения стве антигенов для иммунизации, в результате целевого антитела Однако, этот способ является были получены новые монотонные антитела, до только примером, и в этом случае, например, мосих пор не описанные гут использоваться не только упомянутые тетки В результате исследования свойств полученCF-1, но также и клеточные линии, полученные так ных монотонных антител авторы изобретения же, как в случае теток CF-1, из стромальных т е неожиданно обнаружили, что они обладают свойток селезенки человека, для получения антител, ством вызывать апоптоз миелоидных теток, это требуемых для человеческих миелоидных теток, завершило работу над данным изобретением таким же способом, как в случае вышеупомянутых Описание изобретения теток CF-1 Объектом и целью настоящего изобретения является создание нового монотонного антитела, В способе получения таких монотонных анобладающего свойством вызывать апоптоз миетител виды млекопитающих, которые должны лоидных теток и применимого в качестве лекарбыть иммунизированы вышеупомянутыми антигественного препарата при миелоцитозной лейкенами, строго не ограничиваются, предпочтительно мии, а также его фрагментов, а кроме того, делать выбор, принимая в расчет соответствие гибридомы, вырабатывающей монотонное антитеткам миеломы, которые будут использоваться тело при слиянии клеток, и предпочтительнее использование мышей, крыс и хомяков Монотонное антитело настоящего изобретения весьма полезно в качестве антитела, распоИммунизация выполняется обычным спосознающего антигены, вызывающие апоптоз [назыбом, например, введением стромальных теток ваемый также саморазрушением теток - явление, селезенки, таких как вышеупомянутые тетки CFпри котором ядерный хроматин ДНК превращает1, в брюшную полость млекопитающего путем ся в некоторое ядерное образование (так назыинъекции В особом случае, предпочтительно ваемое ступенчатое образование), что приводит к введение животному препарата в разбавленном гибели теток] миелоидных теток и имеющего виде или в виде суспензии в соответствующем функцию идентификации их или функцию вызыколичестве физиологического раствора с фосфатвать апоптоз миелоидных теток Между тем, ным буфером (PBS) или изотоническом растворе миелоидные клетки включают клетки, отличные от хлорида натрия несколько раз каждый месяц лимфоидных, такие как нейрофилы, мегакариоциПредпочтительно использовать тетки селезенки, ты, миелобласты, миелоциты, мастоциты, макроизвлеченные после последнего введения вышеселезенки, участвующих в процессах, предшествующих кроветворению Предполагалось, что механизм сверхмедуллярного кроветворения в селезенке обусловлен модификациями селезеночной кроветворной микросреды благодаря стимуляции rG-CSF, увеличивающих кроветворную способность В соответствии с этим авторы настоящего изобретения исследовали стромальные клетки селезенки, подвергающиеся воздействию rG-CSF для выяснения кроветворной способности селезенки, и вывели линию стромальных кроветворных клеток (клеток CF-1) селезенки мыши, получавшей rG-CSF с целью анализа увеличения кроветворной способности стромальных клеток при действии rG-CSF, и исследовали потенциальное влияние использования стромальных кроветворных клеток на кроветворение, в результате были выяснены возможности стимулирования колоний in vitro и поддержания кроветворных стволовых клеток in vivo [Blood, 80, 1914 (1992)] 50708 упомянутых клеток в качестве иммуноцитов В качестве клетки миеломы млекопитающих, как другой родительской клетки, сливаемой с вышеупомянутыми иммуноцитами, можно использовать различные наиболее известные клетки, включая РЗ(РЗХ63Ад8 653) [J Immunol , 123, 1548 (1978)], P3-U1 [Current Topics in Micro-biology and Immunology, 81, 1-7 (1978)], NS-1 [Eur J Immunol, 6, 511-519 (1976)], MPC-11 [Cell, 8, 405-415 (1976)], Sp2/0-Agl4 [Nature, 276, 269-270 (1978)], FO [J Immunol Meth , 35, 1-21 (1980)], S194 [J Exp Med , 148, 313-323 (1978)] и R210 [Nature, 277, 131-133 (1979)] Слияние клеток вышеупомянутого иммуноцита и клетки миеломы может быть в основном выполнено обычным способом, например, способом по Milstem и др [Methods Enzymol , 73, 3-46 (1981)] В особом случае, вышеупомянутое слияние клеток может быть выполнено, например, в обычной питательной среде в присутствии ускоряющего слияние агента В качестве такого агента может добавляться полиэтиленгликоль (PEG) и вирус Sendai (HVJ) и, кроме того, активизирующие вещества, такие как диметилсульфоксид, если требуется для усиления эффекта слияния Что касается соотношения иммуноцитов и клеток миеломы, предпочтительно использовать первые в количестве в 1-10 раз большем, чем вторые Примеры среды, используемой при вышеупомянутом слиянии клеток, включают среду RPMI-1640 и среду MEM, подходящие для размножения вышеупомянутых клеток миеломы, и другие среды, обычно используемые для культур такого типа клеток, кроме того, также может использоваться дополнительное количество сыворотки, например, зародышевая бычья сыворотка (FBS) Слияние клеток выполняется смешиванием предписанных количеств вышеуказанных иммуноцитов и клеток миеломы в вышеупомянутой среде, при добавлении в среду раствора PEG, предварительно нагретого до температуры около 37°С, например, PEG со средним молекулярным весом порядка 1000 - 6000, обычно до концентрации около 30 - 60% (вес/об) и их перемешивания Затем путем повторения операций добавления соответствующих сред друг за другом, центрифугирования реакционной смеси и удаления надосадочных жидкостей могут быть образованы целевые гибридомы Указанные гибридомы подвергаются отбору путем культивирования в обычной избирательной среде, например, среде HAT (среда с добавлением гипоксантина, аминоптерина и тимидина) Культура продолжает находиться в среде HAT в течение времени, достаточного для гибели гибридом, отличных от целевой (неслитые клетки) обычно от нескольких дней до нескольких недель Затем согласно обычному анализу предельного разбавления выполняется отсев и моноклонирование гибридом, вырабатывающих целевые антитела Полученные гибридомы, вырабатывающие монотонные антитела по настоящему изобретению могут быть субкультивированы в обычной среде и сохранены в жидком азоте на длительное время Чтобы собрать из гибридом монотонные антитела по настоящему изобретению, может быть применен способ, включающий культивирование гибридом обычным способом и получение их из надосадочных жидкостей, или способ, включающий введение гибридомы соответствующему млекопитающему для размножения и получение их из его асцита Первый способ удобен для получения антител высокой степени чистоты, а второй - для массового производства антител Кроме того, антитела, полученные вышеописанными способами, могут быть очищены до высокой степени с применением обычных средств очистки, таких как высаливание, гель-фильтрация и аффинная хроматография Монотонным антителом по настоящему изобретению может быть любое, если оно обладает особым свойством, которое будет подробно описано в приведенном далее примере, а именно, свойством вызывать апоптоз миелоидных теток, и антитела, обладающие данным свойством, включаются в сферу данного изобретения, независимо от вида антигенов, монотонное антитело по настоящему изобретению может применяться в качестве лекарства, полезного при миелоцитозной лейкемии, благодаря использованию этого свойства Нет необходимости говорить, что создание особой системы для идентификации и распознавания антигенов, вызывающих апоптоз миелоидных теток благодаря использованию монотонного антитела по настоящему изобретению, или для применения его в качестве лекарства при миелоцитозной лейкемии благодаря использованию его специфического свойства, а также его модификация и прикладное применение включаются в сферу настоящего изобретения в том случае, если они осуществляются на практике обычными способами, известными специалистам Краткое описание фигур Фиг 1 показывает исследование (контрольный образец в отсутствие антител, тетка CF-1) методом иммунофлуоресценции Фиг 2 показывает исследование связующих свойств антитела GSPST-1 по отношению к т е т кам CF-1 методом иммунофлуоресценции Фиг 3 показывает исследование связующих свойств антитела ВМАР-1 по отношению к теткам CF-1 методом иммунофлуоресценции Фиг 4 показывает исследование (контрольный образец в отсутствие антител, тетка костного мозга) методом иммунофлуоресценции Фиг 5 показывает исследование связующих свойств антитела GSPST-1 по отношению к т е т кам костного мозга методом иммунофлуоресценции Фиг 6 показывает исследование связующих свойств антитела ВМАР-1 по отношению к теткам костного мозга методом иммунофлуоресценции Фиг 7 показывает исследование (контрольный образец в отсутствие антител, NFS-60) методом иммунофлуоресценции Фиг 8 показывает исследование связующих свойств антитела GSPST-1 с тетками NFS-60 методом иммунофлуоресценции 50708 Фиг 9 показывает исследование (контрольный образец в соответствии с lgG1 крысы, NFS-60) методом иммунофлуоресценции Фиг 10 показывает исследование связующих свойств антитела ВМАР-1 с клетками NFS-60 методом иммунофлуоресценции Фиг 11 показывает испытание монотонного антитела (ВМАР-1) на способность ингибировать размножение клетки NFS-60 Фиг 12 показывает испытание монотонного антитела (GSPST-1) на способность ингибировать трансплантацию костного мозга Фиг 13 показывает испытание монотонного антитела (ВМАР-1) на способность ингибировать трансплантацию костного мозга Фиг 14 представляет собой иллюстрацию [микрофотография (окрашенная Н Е) образцов костного мозга (х 400)], показывающую мертвые тетки костного мозга (2) на 6-й день после применения монотонного антитела ВМАР-1 настоящего изобретения, и контрольный образец в отсутствие антител Фиг 15 представляет собой иллюстрацию (миграционная фотография электрофоретической хроматографии), показывающую лестничное образование ДНК клеток костного мозга, наблюдаемое при применении монотонного антитела ВМАР-1 настоящего изобретения Фиг 16 показывает испытание на цитотоксичность TNF а с использованием теток L929 Фиг 17 показывает испытание на цитотоксичность монотонного антитела (ВМАР-1) Фиг 18 показывает исследование (контрольный образец в соответствии с lgG2a крысы, BWV1) методом иммунофлуоресценции Фиг 19 показывает исследование связующих свойств антимышиного антитела МНС класса 1 по отношению к теткам BWV1 методом иммунофлуоресценции Фиг 20 показывает исследование (контрольный образец в соответствии с lgG1 крысы, BWV1) методом иммунофлуоресценции Фиг 21 показывает исследование связующих свойств антитела ВМАР-1 по отношению к теткам BWV1 методом иммунофлуоресценции Пояснение символов а ДНК тимуса мыши, получавшей ВМАР-1 (24 часа) b ДНК костного мозга мыши, получавшей ВМАР-1 (24 часа) с ДНК костного мозга мыши, получавшей ВМАР-1 (8 часов) d ДНК костного мозга мыши, получавшей ВМАР-1 (4 часа) е ДНК костного мозга мыши, не получавшей препарата (тетки костного мозга) f Маркер молекулярного веса Далее настоящее изобретение будет описано подробно на эталонном примере и примере, но настоящее изобретение не ограничивается примером Эталонный пример Выявление стромальных теток селезенки и их характеристик 1) Выявление стромальных теток селезенки Линия стромальных теток селезенки была 8 выведена из первичной культуры теток селезенки мыши C57BL/6J, получавшей rG-CSF в количестве 100мкг/кг в течение 5 дней А именно, эта селезенка была удалена после применения rG-CSF в стерильных условиях, культивирована в 25-см2 пластиковой колбе (Corning Со) в течение 6 недель и в среде Dulbecco, модифицированной Isocove (IMDM) (BoehnngerMannheim Co) с 10% тепло-инактивированной зародышевой бычьей сывороткой (FBS) (Sanko Jimyaku, Tokyo), 100ед/мл пенициллина и 100мкг/мл стрептомицина в термостате в условиях 37°С и 5% СІІ2, среда сменялась свежей питательной средой дважды в неделю В полученной культуре сросшиеся популяции теток (стромальные тетки) были собраны из колбы с использованием 0,05% трипсина плюс 0,02% EDTA (Sigma Chemical Со) в PBS, не содержащем кальция и магния, и пересажены в новые колбы Такие пересадки повторялись приблизительно один или два раза в неделю На ранних пересадках (1-10 пересадки) коэффициент деления теток составлял от 1/4 до 1/8, а далее коэффициент составил 1/16-1/32 Стромальные тетки стали гомогенными и фибробластообразными приблизительно после 10-й пересадки На 20-й пересадке эти стромальные тетки были собраны, как описано выше, и подвергнуты клеточному тонированию с использованием технологии предельного разбавления, клеточное тонирование повторялось дважды для выведения стромальной клеточной линии (клеточная линия CF-1) Затем эти тетки были обработаны в 5 мл среды IMDM, дополненной 10% теплоинактивированного FBS в 25-см2 пластиковой колбе (Corning Co), и субкультивированы раз в 5 дней при коэффициенте деления 1/32 Линии стромальных теток селезенки могут быть выведены от других животных, кроме мыши, например линии стромальных теток селезенки человека могут быть выведены при использовании того же метода, описанного выше, путем трансформирования теток аденовирусным вектором SV-40 [J Cell Physiol, 148, 245(1991)] 2) Характеристики теток CF-1 Клетки CF-1, выведенные в виде клеточной линии, как описано выше, были исследованы на щелочную фосфатазу, кислую фосфатазу, рглюкуронидазу, а-нафтилацетатэфиразу и олеин О с использованием стандартных цитохимических методик Клетки CF-1 были также исследованы на иммуноэнзимную гистохимию с использованием следующих монотонных и политонных антител macl (Sero Tec), фактор Vlll-зависимый антиген (Dakopatts), коллаген типа I, коллаген типа III и фибронектин (Chtmicon International Inc) Анализ на фагоцитоз был проведен методом поглощения латексных капель (диаметр частиц 1,09мкм, Sigma), а склонность теток CF-1 превращаться в адипоциты была проверена экспозицией в 10 6 моль/л гидрокортизонфосфате (Sigma) в 25-см2 колбе в течение 4 недель после получения слитой культуры ным Результат для теток CF-1 был отрицательна щелочную фосфатазу, фактор VIII 50708 зависимый антиген, mad и фагоцитоз, и положительным на коллаген типа I, коллаген типа III и фибронектин Клетки CF-1 не превращались в адипоциты в течение 4 недель в слитой культуре в 10 6моль/л гидрокортизона, хотя клетки CF-1 содержали лишь следы липидов Из этих данных следует, что клетки CF-1 не имеют характеристик преадипоцитов, макрофагов и эндотелиальных клеток, и поэтому стало очевидным, что они получены из стромальных клеток, отличных от них 3) Обработка кроветворных стволовых клеток клетками CF-1 Чтобы проверить, действуют ли клетки CF-1 на кроветворные стволовые клетки были взяты образцы CFU-S (образцы образующих колонии клеток селезенки) по методике Till и McCulloch 10 мышей на группу были облучены ЭООсГр (MBR1520R, Hitachi, Tokyo) и получили внутривенно одноядерные клетки костного мозга (клетки ВМ) (1,0 х 105/особь, 5,0 х 104/особь или 2,5 х 104/особь) и клетки CF-1 (1,0 х 105/особь), и на 12й день были подсчитаны колонии в селезенке как клоны CFU-S (колонии селезенки) В результате, когда одноядерные клетки костного мозга (ВМ-клетки) и клетки CF-1 были трансплантированы облученным мышам, количество колоний селезенки в каждой группе ВМ-клеток значительно увеличилось (в 1,4-1,8 раза) по сравнению с мышами без клеток CF-1, и, на 12-й день после трансплантации, коэффициент выживания мышей с трансплантированными ВМ-клетками и клетками CF-1 был выше, чем у мышей только с клетками ВМ, причем при низкой скорости умирания, следовательно, стало очевидно, что на кроветворные стволовые клетки оказали действие клетки CF-1 Оптимальный режим для осуществления изобретения Вариант реализации изобретения будет описан в деталях ниже Пример Получение монотонных антител 1) Антигены и иммунизация Иммунизация была выполнена с использованием клеток CF-1, полученных в вышеописанном Эталонном примере в качестве антигенов Эти клетки культивировали в термостате в условиях 5% СОг и 37°С, используя среду Dulbecco, модифицированную Isocove (IMDM) (BoehnngerMannheim Co) с 10% зародышевой бычьей сывороткой (FBS, Sanko Junyaku) Клетки обработали 1мМ EDTA/PBS и пипетированием извлекли из колбы для культивирования Из клеток приготовили суспензию в 1 мМ EDTA/PBS, где количество клеток составило около 1 х 107/мл, и ввели крысе Wistar Imamich (возраст 7 недель, самка, Animal Breeding Research Laboratory) Один мл клеток, содержащий их около 1 х 10/мл, ввели в качестве окончательной иммунизации в брюшную полость крысы в виде первичной иммунизации, и 1мл клеток, содержащий их около 1 х 107/мл, были введены дополнительно через месяц Позднее 1мл клеток, содержащий их около 1 х 107/мл, были введены дополнительно несколько раз с интервалом один месяц, и после того, как было установлено взаимодействие меж 10 ду антителами иммунизированной крысы и клетками CF-1, 1мл клеток, содержащий их около 1 х 108/мл, было введено в качестве окончательной иммунизации Через три дня после окончательной иммунизации крысу умертвили для извлечения селезенки 2) Слияние клеток После того как селезенка, извлеченная из крысы, была измельчена, отделенные клетки селезенки центрифугировали, суспендировали в среде IMDM (Boehrmger-Mannheim Co) и тщательно промыли С другой стороны, клетки, полученные культивированием клеточной линии миеломы мыши Sp2/0-Agl4 [Nature, 276, 269-270 (1978)] в IMDM (Boehrmger-Mannheim Co), с добавкой 10% зародышевой бычьей сыворотки (FBS, Sanko Junyaku), промыли в вышеупомянутой среде IMDM тем же способом и затем 1 х 108 этих клеток и 2 х 108 вышеупомянутых клеток селезенки поместили в центрифугу и перемешивали для слияния клеток в полиэтиленгликоле 4000 (Nakarai Kagaku) в соответствии с обычной методикой [Clm Exp Immunol , 42, 458 - 462 (1980)] Далее, полученные слитые клетки распределили по пластине с 96 отсеками в среде IMDM с 20% FBS и культивировали в термостате в условиях 37°С и 5% СОг- Затем постепенно, со следующего дня, их перенесли в избирательную среду HAT и продолжили культивирование После начала культивирования надосадочные жидкости переносили в новую среду HAT дважды в неделю для продолжения культивирования и размножения Далее, полученные слитые клетки клонировали по обычной методике, используя анализ методом предельного разбавления А именно, только клоны, обладающие сильными связующими свойствами по отношению к антигенам, были клонированы по обычной методике, включающей метод предельного разбавления, путем исследования их связующих свойств по отношению к антигенам, используя антитела в надосадочных жидкостях вышеупомянутых слитых клеток 3) Отсев Отсев слитых клеток (гибридом) выполнялся в соответствии с косвенной флуоресцентной методикой исследования антител с использованием проточной цитометрии Отсев клонов, вырабатывающих целевые антитела, выполнялся с использованием клеток CF1 как клеток-мишеней А именно, суспензию клеток в реакционной буферной среде (PBS с 2% FBS и 0,02% NaNs) центрифугировали и извлекли в виде шариков, затем превратили в суспензию в ЮОмкл надосадочных жидкостей культуры гибридомы (около 1 х 106/100мкл) и проводили реакцию в течение 1 часа при 4°С После этого их промыли один раз вышеупомянутым буферным раствором, добавили козье (FITC-маркированное) антикрысиное IgG (FC) антитело (Chemicon) и выдерживали в термостате в течение 1 часа После однократного промывания их проанализировали методом проточной цитометрии (FACScan, Becton Dickinson) 4) Очистка антител Слитые клетки, отсеянные вышеописанным 50708 12 11 способом 3), культивировали в по обычной метопо отношению к клеткам CF-1 На фигурах вертидике, а антитела, полученные в надосадочных кальные оси показывают относительное число жидкостях, отделили по обычной методике и подтеток, а горизонтальные оси - интенсивность вергли очистке флуоресценции А именно, гибридомы извлекли из отсеков с Как хорошо видно на фиг 1-3, было выяснено, высокими титрами антител по отношению к античто монотонные антитела GSPST-1 и ВМАР-1 по генам, распределили по пластиковому блюдцу для отношению к теткам CF-1 обладают связующими тканевых культур (Corning Co), культивировали в свойствами и распознают поверхностные антигеусловиях 37°С и 5% СОг, размножили и очистили ны т е т о к CF-1 по обычной методике, получив монотонные анти(Реакционная способность по отношению к тела GSPST-1 и ВМАР-1 теткам костного мозга) Что касается GSCST-1, полученные клетки Результаты анализа реакционной способности были введены в брюшную полость бесшерстной GSPST-1 и ВМАР-1 по отношению к нормальным мыши BALB/cAJcl-nu (возраст 8 недель, самец, теткам костного мозга, полученные проточной Nippon Kurea) Выработанный асцит был удален цитометрией (FACScan, Becton Dickinson), показачерез 1 0 - 1 4 дней, высолен 33%-ным сульфатом ны на фиг 4-6 Фиг 4 показывает результаты анааммония и подвержен диализу PBS Что касается лиза контрольного образца в отсутствие антител, антитела ВМАР-1, он был культивирован в больфиг 5 результаты анализа связующих свойств шом масштабе в среде MEM, модифицированной GSPST-1 по отношению к теткам костного мозга, Iscove, с 10% FBS, надосадочные жидкости были и фиг 6 - результаты анализа связующих свойств концентрированы, высолены 33%-ным сульфатом ВМАР-1 по отношению к теткам костного мозга аммония, подвержены диализу PBS, снова очиНа фигурах вертикальные оси показывают относищены посредством набора колонок с протеином А тельное число теток, а горизонтальные оси - ин(Amersham) и подвергли диализу PBS Между тенсивность флуоресценции прочим, в вышеописанном примере был описан Как показано на фиг 4-6, было выяснено, что случай, в котором в качестве антигенов для иммуGSPST-1 вообще не обладает связующим свойстнизации использовались клетки CF-1, однако, тем вом по отношению к теткам костного мозга, а же способом можно вывести монотонное антитеВМАР-1 обладает связующим свойством ко всем ло также и в случае использования других стротеткам костного мозга мальных клеток, обладающих способностью под(Реакционная способность по отношению к держивать кроветворные стволовые клетки и клеточной линии миелоцитозной лейкемии (NFSнастоящее изобретение не ограничено вышеупо60)) мянутыми монотонными антителами, но включаРезультаты анализа реакционной способности ет также все монотонные антитела, имеющие GSPST-1 и ВМАР-1 по отношению к теткам NFSтакие же характеристики, и все гибридомы, выра60 [Proc Natl Acad Sci USA, 82, 6687-6691 батывающие такие монотонные антитела (1985)], полученные проточной цитометрией (FACScan, Becton Dickinson), показаны на фиг 7Гибридома, вырабатывающая монотонное 10 Фиг 7 показывает результаты анализа конантитело ВМАР-1 по настоящему изобретению, трольного образца в отсутствие антител, фиг 8 представляет собой новую, неизвестную ранее, результаты анализа связующих свойств GSPST-1 слитую тетку, полученную из клетки селезенки по отношению к теткам NFS-60, фиг 9 - результакрысы Wistar Imamich и клеточной линии миеломы ты анализа контрольных образцов с использовамыши SP2/0-Ag14 в качестве родительских теток, нием приобретенной IgGI крысы (Zymed) и фиг 10 и зарегистрирована 9 августа 1993 г под названирезультаты анализа связующих свойств ВМАР-1 ем ВМАР-1 (крысино-мышиная гибридома) под по отношению к клеткам NFS-60 На фигурах веррегистрационным номером FERM ВР-4382 в Натикальные оси показывают относительное число циональном институте биологической науки и чететок, а горизонтальные оси -интенсивность ловеческой технологии, Агентстве промышленной флуоресценции науки и технологии в Японии [адрес 1-3, Higashi 1chome, Tsukuba-shi, Ibaraki 305, Japan], полномочКак показано на фиг 7-10, было выяснено, что ным международным депозитарием по БудапештGSPST-1 не реагируют с тетками NFS-60, a скому договору о международном признании деВМАР-1 обладают связующим свойством по отпозитов на микроорганизмы для целей патентных ношению к теткам NFS-60 (Проба для ВМАР-1 процедур на ингибирование размножения т е т о к NFS-60) 5) Свойства антител (і) Реакционная способность антител (Реакционная способность по отношению к теткам CF-1) Результаты исследования реакционной способности полученных монотонных антител GSPST-1 и ВМАР-1 по отношению к теткам CF-1, полученные иммунофлуоресцентным анализом показаны на фиг 1-3 Фиг 1 показывает результаты анализа контрольного образца в отсутствие антител, фиг 2 результаты анализа связующих свойств GSPST-1 по отношению к клеткам CF-1 и фигЗ результаты анализа связующих свойств ВМАР-1 Результаты исследования действия ВМАР-1 на тетки NFS-60 в присутствии 100нг/мл G-CSF и 10 9 М циклогексимида, полученные по методике проб МТТ, показаны на фиг 11 Используя пластины для культивирования с 96-ю отсеками, добавляли Юмкл/отсек раствора ВМАР-1 с концентрацией 0, 10, 100нг/мл и 1, 10, 100мкг/мл к 4 х 103/отсек/ ЮОмкл т е т о к NFS-60, и через два дня было измерено количество живых т е т о к в соответствии с методикой МТТ Было выяснено, как показано на фиг 11, что размножение клеток NFS60 ингибируется ВМАР-1 в очень большой степени 50708 14 13 (м) Определение типа антител относительно антигена Fas, его мРНК встречаются в тимусе, сердце, печени, легких и яичниках, но Далее, в результате определения подкласса некоторые его мРНК найдены в костном мозге [J IgG полученных монотонных антител [с испольImmunol, 148, 1274-1279 (1992)], и поэтому очезованием крысиного набора Mono Ab-ID-Sp видно, что антигены, распознаваемые ВМАР-1, (Zymed) и биотин-маркированного мышиного антиотличаются от обычных известных антигенов Fas крысиного антитела lgG1 (Zymed)], стало очевидно, что GSPST-1 относится к типу lgG2a, a BMAP-1 Кроме того, чтобы выяснить, являются ли ан- ктипу lgG1 тигены, распознаваемые ВМАР-1, рецепторами TNF, функция ВМАР-1 была исследована с ис(ш) Способность ингибирования трансплантапользованием т е т о к L-929, реагирующих с TNF, ции костного мозга вызывая гибель тетки Далее, был проведен тест на ингибирование трансплантации костного мозга с использованием Окончательная концентрация TNF мыши а данных антител для исследования их характери(Genzyme) составляла 0, 1, 10, 100пг/мл, 1, 10, стик Результаты показаны на фиг 12 и 13 Как 100нг/мл и 1мкг/мл, а концентрации ВМАР-1 - 0, видно из фиг 12 и 13, в то время как ВМАР-1 об10, 100пг/мл, 1, 10, 100нг/мл и 1, 10мкг/мл, число ладает эффектом ингибирования трансплантации живых т е т о к L-929 было измерено по методике костного мозга, для GSPST-1 этот эффект не был МТТ на второй день после добавления TNF а и обнаружен А именно, вышеупомянутые результаВМАР-1 В результате, как показано на фиг 16, 17, ты были получены путем введения 1,0 х 105/особь в то время как количество т е т о к L-929 было знаклеток костного мозга и монотонных антител чительно снижено при воздействии TNF a, BMAPмышам C57BL/6J, облученным смертельной дозой 1 никак не воздействовали на тетки L-929 Слерадиации (ЭООсГр), в вены хвостов и подсчета довательно, стало очевидно, что антиген, распоколичества колоний селезенки Вариант "Необразнаваемый ВМАР-1, не является рецептором TNF ботанные" на фиг 13 показывает опыт без введеРезультаты исследования, являются ли антиния клеток костного мозга гены, распознаваемые ВМАР-1, антигенами МНС Как показано на фиг 13, подтвердилось, что класса I, проведенного по методике проточной именно благодаря реакции ВМАР-1 с клетками цитометрии (FACScan, Becton Dickinson), показакостного мозга, вызывающей апоптоз, монотонны на фиг 18-21 Фиг 18 показывает результаты ное антитело полностью ингибирует трансплантаанализа контрольного образца, использующего цию в тесте на ингибирование трансплантации lgG1 крысы (Zymed), фиг 19 показывает результакостного мозга А именно, когда гибридома, выраты анализа связующих свойств анти мышиного батывающая ВМАР-1, была введена в брюшную антитела МНС класса I (lgG2a, В МА) по отношеполость бесшерстной мыши, она погибла, когда ее нию к теткам BWV1 (лимфома мыши, полученная асцит был накоплен в небольшом размере Вдоиз т е т о к BW5147), фиг 20 показывает результаты бавок было установлено, что все тетки костного анализа контрольного образца, использующего мозга погибли вследствие внутривенного введеlgG1 крысы (Zymed), и фиг 21 показывает резульния нормальной мыши C57BL/6J 50мкг/особь таты анализа связующих свойств ВМАР-1 по отВМАР-1, и на фиг 14 показана микрофотография, ношению к клеткам BWV1 На фигурах вертикальотражающая тот факт, что тетки костного мозга ные оси показывают относительное число клеток, на 6-й день после внутривенного введения ВМАРа горизонтальные оси -интенсивность флуорес1 погибли Как ясно видно и из микрофотографии, ценции В результате обнаружено, что ВМАР-1 не было сделано наблюдение, что не только лимфораспознают клетки BWV1, а антитела МНС класса идные тетки, но и нейрофилы, мегакариоциты, I реагируют с тетками BWV1 миелобласты, миелоциты, мастоциты, макрофаги, Как описано выше, экспериментально было моноциты и эритробласты (так называемые миеподтверждено, что ВМАР-1 имеет функцию вызылоидные тетки) также погибают Кроме того, в вать апоптоз миелоидных теток, насколько изрезультате исследования ДНК т е т о к костного вестно авторам настоящего изобретения, до сих мозга мыши, получившей ЗОмкг/особь ВМАР-1, пор не было описано монотонных антител, облаясно наблюдалось ступенчатое образование, как дающих свойством вызывать апоптоз миелоидных показано на фиг 15, и было установлено, что выт е т о к до такой степени, как описано выше, и, шеупомянутая реакция ВМАР-1 с тетками костноследовательно, монотонные антитела, имеющие го мозга происходит вследствие апоптоза такую функцию, являются новыми, найденными авторами настоящего изобретения И, поскольку IgG антитела ВМАР-1 расщепили пепсином предполагается, что монотонные антитела по (Sigma) и очистили от участка Fc посредством настоящему изобретению, представленные колонки GPC с получением F(ab')2, 33,5мкг/особь ВМАР-1, могут вызывать гибель т е т о к миелоид(в соответствии с 50мкг/особь для IgG в целом) ной лейкемии, содержащих, как принято считать, ввели внутривенно мыши C57BL/6J, в результате большое количество антигенов, путем использобыло сделано наблюдение, что тетки костного вания функции монотонного антитела вызывать мозга погибают в костном мозге В соответствии с апоптоз при воздействии на тетки костного мозга, вышеупомянутым фактом стало очевидно, что ни монотонное антитело по настоящему изобретецитотоксичность клеток, обусловленная антитению, имеющее свойство вызывать апоптоз миелолами, ни комплементарно-обусловленная цитоидных теток, полезно в качестве лекарства при токсичность не принимают участия в гибели т е миелоцитозной лейкемии ток костного мозга при действии ВМАР-1 В качестве антигена, вызывающего апоптоз, описан антиген Fas белка поверхности тетки, Монотонные антитела по настоящему изобретению подробно описаны в вышеизложенном 15 16 щему изобретению полезны как антитела, распознающие и идентифицирующие антигены, вызывающие апоптоз исключительно миелоидных клеток и, кроме того, обладают способностью вызывать апоптоз миелоидных клеток, они могут применяться в области средств лечения миелоцитозной лейкемии с использованием этой способности 50708 Примере, приведенные выше примеры монотонных антител, вызывающих апоптоз миелоидных клеток согласно настоящему изобретению не ограничивают это изобретение, которое включает все монотонные антитела, имеющие такие же характеристики и функции, полученные таким же способом, вне зависимости от вида антигенов Промышленная применимость Поскольку монотонные антитела по настоя 4BQ Г5С S&C П-| Л_2 гас й. В, p. Э. 2S5 =£5 E5S ZSS 5SC FL2 Й 255 23с /Li в. ass FLZ а пі TLi гз а І! ac s а 3. £55 /і їй1" із : н л ja' FLl Фиг.З F C QS S S .5 B C QE S B ,S П.І FI_S S.SSS 4 . 255 18 50708 17 oso 0.И 0.20 O.I0 FSC SSC e.ass 0.00 в.ass гтттп]—j • W T I Концекщащи мошжлонного ш ш ш {BMAP-lt Испытание БМАР-1 на янгибированис размножения | 2 1В FL3 ioieKiKNFS-60 Фиг.11 Фиг.9 m Г2 (О в Б
ДивитисяДодаткова інформація
Назва патенту англійськоюMonoclonal antibody that is able to recognize an antigen that induces apoptosis in the myelocytic cell, the fragment f(ab)2 of the monoclonal antibody, the hybridoma ferm bp-4382
Автори англійськоюFukushima Naoshi
Назва патенту російськоюМоноклональное антитело, которое обладает способностью распознавать антиген, который вызывает апоптоз миелоидных клеток, фрагмент f(ab)2 моноклонального антитела, гибридома ferm bp-4382
Автори російськоюФукушима Наоши
МПК / Мітки
МПК: C12P 21/08, C12N 5/20, C07K 16/28
Мітки: яке, антитіла, здатність, розпізнавати, гібридома, фрагмент, антиген, моноклонального, має, мієлоїдних, клітин, моноклональне, апоптоз, bp-4382, антитіло, викликає, f(ab)2
Код посилання
<a href="https://ua.patents.su/11-50708-monoklonalne-antitilo-yake-maeh-zdatnist-rozpiznavati-antigen-yakijj-viklikaeh-apoptoz-miehlodnikh-klitin-fragment-fab2-monoklonalnogo-antitila-gibridoma-ferm-bp-4382.html" target="_blank" rel="follow" title="База патентів України">Моноклональне антитіло, яке має здатність розпізнавати антиген, який викликає апоптоз мієлоїдних клітин, фрагмент f(ab)2 моноклонального антитіла, гібридома ferm bp-4382</a>
Попередній патент: Інгібітори матричних металопротеаз та фармацевтична композиція на їх основі
Наступний патент: Пневмоімпульсний сепаратор зерна
Випадковий патент: Спосіб визначення магнію в гранулоцитах крові