Спосіб кількісної та якісної оцінки апоптозу в клітинних суспензіях
Номер патенту: 64090
Опубліковано: 16.02.2004
Автори: Білий Ростислав Олександрович, Білий Олександр Іванович, Стойка Ростислав Степанович, Гетьман Василь Богданович
Формула / Реферат
Спосіб кількісної та якісної оцінки апоптозу в клітинних суспензіях, який включає подачу біологічних клітин в потоці рідини з постійною швидкістю, проходження променя лазера через потік рідини з досліджуваними клітинами і реєстрацію імпульсів розсіяного світла, який відрізняється тим, що попередньо калібрують вимірювальний пристрій, після чого реєструють імпульси розсіяного світла під кутом в інтервалі від 2 до 358 градусів, нормують результати вимірювання, визначають розмірний розподіл клітин, параметр - апоптичний індекс та його функціональну залежність шляхом розв'язування рівняння
![]()
де і - кількість вибраних для калібрування сферичних синтетичних частинок з відомими розмірами і однаковим показником заломлення, j - порядковий номер елементу та ![]() ,
, ![]() - квадратична матриця, елемент якої
- квадратична матриця, елемент якої ![]() виражає статистичні характеристики інтенсивності розсіяного світла для окремо вибраної сферичної синтетичної частинки із заданим розміром і показником заломлення,
виражає статистичні характеристики інтенсивності розсіяного світла для окремо вибраної сферичної синтетичної частинки із заданим розміром і показником заломлення, ![]() - стала величина, в межах від 0,00001 до 1.
- стала величина, в межах від 0,00001 до 1.
Текст
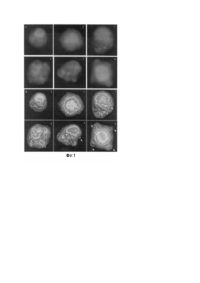
Винахід відноситься до області біології та медицини, зокрема, до оптичних способів контролю явища апоптозу, і може знайти застосування для діагностичних цілей в медицині. Кількісна оцінка вмісту апоптичних клітин звичайно здійснюється за параметром, відомим як апоптичний індекс (АІ), який характеризує кількість клітин з морфологічними ознаками апоптозу і визначається як відсоток кількості апоптичних клітин від загальної кількості клітин, які спостерігаються в експерименті [А.А. Фильченков, Р.С. Стойка./ Апоптоз и рак. -К.: Морион. -1999. -184с.]. Відомий оптичний спосіб кількісної оцінки апоптичних клітин в клітинних суспензіях, названий як автоматизований мікрокультуральний кінетичний аналіз [ Kravtsov V.D. A novel microculture kinetic assay (MiCK assay) for malignant cell growth and chemosentivity./ Eur. J Cancer. 1994. V.30A. P.1564 -1570], в якому кількісна оцінка наявних апоптичних клітин в досліджуваному середовищі проводиться за часовими змінами оптичної густини культурального середовища, яке містить досліджувані клітини, на вибраному інтервалі довжин хвиль оптичного діапазону спектру. При цьому, часову зміну оптичної густини цього середовища, яке пов'язують зі зміною інтенсивності розсіяного світла клітинами, яке виникає через морфологічні зміни, викликані апоптозом. За цим способом якісна оцінка апоптозу, викликана дією лікарських хеміотерапевтичних препаратів, включає виконання наступних дій: одержання зразка клітин з досліджуваного об'єкту; виділення із зразка суспензії однорідних клітин; поміщення клітин в культуральне середовище; дія на клітини в культуральному середовищі хеміотерапетичного препарату, який індукує апоптоз; інкубація культури клітин; почергове вимірювання оптичної густини культурального середовища з клітинами, підданих дії хеміотерапетичного препарату, і культурального середовища з тими ж клітинами, які не піддавались дії хеміотерапетичного препарату, на довжині хвилі, вибраної з інтервалу від 590 до 650 нанометрів; визначення тангенса кута нахилу прямої, побудованої за різницевими значеннями даних часових змін оптичної густини культурального середовища, яке піддавали дії хеміотерапетичного препарату, і даних часових змін оптичної густини культурального середовища, яке не піддавалось дії хеміотерапетичного препарату, на часовому періоді від початку наростання оптичної густини до досягнення максимуму оптичної густини; наявність позитивного значення тангенса кута нахилу вказує протікання апоптозу культивованих клітин [Patent 6258553 USA від 10.07.2001., МКП C12Q1/24. Assay for measuring apoptosis in cell culture]. Недоліком даного способу є складність проведення аналізу, довготривалість проведення аналізу, необхідність використання спеціальних культуральних середовищ, які не поглинають в оптичному інтервалі спектру від 590 до 650 нанометрів. Найбільш близьким за технічною суттю до запропонованого є спосіб проточної цитометрії, який для аналізу і сортування клітин використовує і розсіяння світла під малими кутами від 0° до 2° , або інакше пряме розсіяне світло, і один з вказаних способів: розсіяння світла під кутом 90 градусів, або інакше бокове розсіяне світло [Kravtsov V.D., Daniel Т.О., Коurу М.J. Comparative analysis of different methodological approaches to the in vitro study of drug-induced apoptosis. /Amer. J. Pathology. 1999. V.155, №4. P.1327-1339], або електричний імпеданс [Нuaі Na Li, Yun Xiang Сі. Electrochemical method for analyzing intracellular redox activity changes of the etoside-induced apoptosis in HL-60 cells./ Anal. Chim. Acta. 2000. V.416. P.221-226], або флуоресценцію забарвлених барвником цитоплазми досліджуваних клітин [Patent 5834196 USA від 10.11. 1998, МКП C12Q1/68. Method for detecting and/or optionally quantifying and/or separating apoptotic cells in or from a sample; Patent 5945291 USA від 31.08. 1999, МКП G01N033/53. Method for distinguishing viable, early apoptotic, late apoptotuc, and necrotic cells]. У всіх вказаних випадках протікання апоптозу супроводжувалось падінням інтенсивності розсіяного світла під кутом 0 градусів І зростанням інтенсивності розсіяного світла під кутом 90 градусів. При цьому кількісна оцінка компонент апоптичних клітин за параметром апоптичногр індексу лише за даними змінами інтенсивності прямого розсіяного світла з великою точністю неможлива. Метод калібрування або стандартизації проточного цитометра передбачає використання сферичних синтетичних частинок, які характеризуються заданим об'ємом і значенням показника заломлення, а пристрій забезпечує два вимірні сигнали: один сигнал прямого розсіяного світла калібрувальними частинками, а другий, принаймі один з вказаних: бокове розсіяне світло, електричний імпеданс, поглинання світла, флуоресценція світла, радіочастотний сигнал [Patent 6074879 USA від 13.06.2000., МКП G01N31/00. Synthetic polymer particles for use as standarts and calibrators in flow cytometry]. Процедура калібрування проточного цитометра включає виконання наступних дій: а) проведення калібрування стандартними синтетичними частинками, які мають середні величини діаметрів і значень показників заломлення, аналогічні за значеннями відтворюваності частинками, які досліджуються, при цьому, в потоці рідини лише одна частинка в часі проходить через пучок світла; б) детектування першого і другого вимірного сигналу від вказаних калібрувальних частинок, які перетинають пучок світла; в) визначення значень інтенсивностей першого і другого сигналів, таким чином, видаючи пару взаємовідповідних за інтенсивностями сигналів; г) перетворення пари взаємовідповідних за інтенсивностями сигналів в значення об'єму і показника заломлення, з метою виділення стандартизованих амплітуд сигналів проточного цитометра; д) калібрування проточного цитометра за зміною інтенсивності прямого розсіяного світла, для чого виміряють об'єм і показник заломлення частинок, а по отриманих значеннях перераховують аналізовані частинки у відповідності сигналу для відповідних значень об'єму і показника заломлення. Поєднання двох вимірних сигналів дозволяє більш точно оцінювати розмір клітин та їх зміни, здійснювати розподіл клітин за розмірами, сортувати клітини. Спосіб вимірювання розмірів і сортування клітин методом проточної цитометрії включає виконання наступних дій [Patent 4765737 USA від 08.23. 1988., МКП G01N15/14. Cell size measurements using light in flow cytometry and cell sorting]: а) подачу біологічних клітин, які досліджуються, в потоці рідини з постійною швидкістю; б) проходження променя лазера через потік рідини з досліджуваними клітинами таким чином, щоб поперечний переріз променя в місці перетину його клітинами був більший, ніж поперечний переріз досліджуваних клітин, і його в часі могла перетинати лише одна клітина; в) вимірювання часу прольоту кожної біологічної клітини в потоці рідини через промінь, одержуючи при цьому електричний сигнал, який пропорційний ширині (або об'єму) біологічної клітини; г) формування першого електричного сигналу по величині інтенсивності прямого розсіяного світла або вторинного флуоресцентного випромінювання одною біологічною клітиною, яка з потоком рідини перетинає лазерний промінь; д) формування другого електричного сигналу, амплітуда якого визначається інтегралом по часу від першого електричного сигналу; е) формування третього електричного сигналу, амплітуда якого дорівнює максимальному значенню амплітуди першого електричного сигналу; є) формування четвертого електричного сигналу, який визначається відношенням амплітуди др угого сигналу до амплітуди третього сигналу і характеризує ширину кожної біологічної клітини плюс ширину перерізу лазерного променя; і) формування п'ятого електричного сигналу, який є пропорційний ширині біологічної клітини, шляхом віднімання від четвертого сигналу постійного сигналу, пропорційного ширині лазерного променя. Недоліком даного способу є складність вимірювань, зумовлена необхідністю одночасного використання принаймні двох різних методів, один з яких: пряме розсіяння світла є обов'язковим. Точність методу є невисокою з наступних причин. Для калібрування проточного цитометра необхідно підібрати частинки, показник заломлення яких рівний досліджуваному об'єкту, в даному випадку біологічним клітинам, а показник заломлення рідини, в яку поміщені частинки, по можливості був якнайбільше відмінний. Показник заломлення для складових компонент біологічної клітини має значення: для ядра n=1.39, цитоплазми n=1.37, мембрани клітини n=1.46, оточуючого середовища n=1.35 [Dunn A., Smithpeter С., Welch A. J., Richards-Kortum R. Finite-difference time-domain simulation of light scattering from single cells. / J Biomed. Optics. 1997. V.2, №3. P.262-266 ], залежить від осмолярного тиску води і концентрації глюкози у клітині в межах від 1.330 до 1.344 (для клітин печінки) [Liu Н., Beauvoit В., Kimura M., Chance В. Dependence of tissue optical properties on solute-induced changes in refractive index and osmolarity. J Biomed. Optics. 1996. V.1, №2. P.200-211]. Як правило, клітини досліджують у водних розчинах, показник заломлення яких близький до показника заломлення води, який в інтервалі довжин хвиль від 400 до 800нм змінюється від 1.339 до 1.329 [Hale G.M., Querry M.R. Optical constants of water in the 200-nm to 200- m m wavelength region. /Appl. Optics. 1973. V.12, №З. Р.555-563]. В основу винаходу поставлено завдання удосконалити спосіб кількісної та якісної оцінки апоптозу в клітинних суспензіях шля хом забезпечення використання лише одного кута для вимірювання інтенсивності розсіяного світла, визначення розмірного розподілу клітин та параметру апоптичний індекс, що дозволить спростити схему вимірювань і розширити арсенал відомих засобів дослідження. Поставлене завдання вирішується тим, що у відомому способі кількісної та якісної оцінки апоптозу в клітинних суспензіях, який включає подачу біологічних клітин в потоці рідини з постійною швидкістю, проходження променя лазера через потік рідини з досліджуваними клітинами і реєстрацію імпульсів розсіяного світла, згідно з винаходом, попередньо калібрують вимірювальний пристрій, після чого реєструють імпульси розсіяного світла під кутом в інтервалі від 2 до 358 градусів, нормують результати вимірювання, визначають розмірний розподіл клітин, параметр апоптичний індекс та його функціональну залежність шляхом розв'язку рівняння å j A (m, n) i ij |B(m,n) - i = 0, де і - кількість вибраних для калібрування сферичних синтетичних частинок з відомими розмірами і однаковим показником заломлення, j порядковий номер елементу та j £ i, Aij(m,n,) - квадратична матриця, елемент якої aij(m,n,) виражає статистичні характеристики інтенсивності розсіяного світла для окремо вибраної сферичної синтетичної частинки із заданим розміром і показником заломлення, jі - стала величина, в межах від 0 до 1. Дослідження протікання апоптозу клітинних суспензій методом проточної цитометрії супроводжується падінням інтенсивності прямого розсіяного світла і зростанням інтенсивності бокового розсіяного світла. Це зумовлено морфологічними змінами клітин, характерними для протікання апоптозу, зокрема агрегація хроматину, конденсація ядра та цитоплазми та їх фрагментація на апоптичні тільця, розмір яких менший за розмір нормальних клітин, які не зазнали морфологічних змін внаслідок апоптозу. При цьому в розмірному розподілі клітин спостерігаються два максимуми: перший, який знаходиться в інтервалі розмірів менших значень, відповідає апоптичним клітинам; другий, який знаходиться в інтервалі розмірів більших значень, відповідає нормальним клітинам. Параметр, відомий як апоптичний індекс, визначається з розмірного розподілу клітин як відношення кількості апоптичних клітин до сумарної кількості клітин з розмірного розподілу клітин, підданих апоптозу. Пропонований спосіб кількісної та якісної оцінки апоптозу в клітинних суспензіях в потоці рідини допускає лише використання бокового розсіяння світла, забезпечуючи можливість кількісної та якісної оцінки апоптозу в клітинних суспензіях за параметром, відомим як апоптичний індекс, який визначається з розмірного розподілу клітин, підданих апоптозу. При цьому відпадає необхідність використання другого розмірного каналу для калібрування пристрою, який здійснює аналіз апоптозу клітинних суспензій, так як процедура визначення розмірного розподілу клітин пропонованим способом передбачає попереднє калібрування пристрою по зміні інтенсивності розсіяного світла сферичними синтетичними частинками під тим же кутом, який вибраний визначення розмірного розподілу досліджуваних клітин. На фіг.1 зображено апоптоз в лейкемійних клітинах лінії К562, індукований дією цисплатин. А - зображення в ультрафіолетовому світлі імерсійного препарату клітин, фарбованих акридиновим оранжевим, збільшення ´ 900. Б - комп'ютерний аналіз зображення А. Стадії апоптозу: 1- нормальна клітина, 2,3,4,5 - послідовні етапи розвитку апоптозу, 6 апоптоз клітини. На фіг.2 зображено апоптоз в лейкемійних клітинах лінії L1210(S), індукований дією цисплатин. Для підтвердження наявності апопточних клітин проводили мікроскопування клітин при А,В - зображення у звичайному освітленні та після фарбування акридиновим оранжевим. Стрілками позначені клітини, піддані апоптозу. С - зображення при ультрафіолетовому світлі, D - зображення при змішаному (звичайному та ультрафіолетовому) освітленні. На С, D виділені: внизу - нормальна клітина, вгорі - апоптична клітина розпадається на 3 апоптичні тільця. На фіг.3 зображено електрофореграму ДНК лейкемійних клітин лінії К562, апоптоз яких індукований дією цисплатини через 48 годин концентраціями: 1 - контроль, 2-0.1мкг/мл, 3-0.5мкг/мл, 4 - маркер ДНК. На фіг.4 зображено електрофореграму ДНК лейкемійних клітин лінії L 1210(8), апоптоз яких індукований дією цисплатини через 48 годин концентраціями: 1 - контроль 2-0.05мкг/мл, 3-0.25мкг/мл, 4 - маркер ДНК. На фіг.5 зображено розподіл за розмірами клітин лінії К562 в потоці рідини, одержаний вимірюванням розсіяння світла під кутом 90 градусів, апоптоз яких індукований дією цисплатини концентраціями 0 (крива 1), 0.1 (крива 2), 0.25 (крива 3), 0.5мкг/мл (крива 4). На фіг.6 зображено відсотковий склад апоптичних клітин лінії К562, індукованих дією цисплатини концентраціями 0 (стовпчик 1), 0.1 (стовпчик 2), 0.25 (стовпчик 3), 0.5мкг/мл (стовпчик 4). На фіг.7 зображено функціональні залежності зміни відсоткового вмісту апоптичних клітин лінії К562, апоптоз яких індукований дією цисплатину концентраціями 0, 0.1, 0.25 і 0.5мкг/мл., одержані з розмірного розподілу клітин вимірюванням розсіяння світла під кутом 90 градусів згідно фіг.5. На фіг.8 зображено розподіл за розмірами клітин лінії L1210(S) в потоці рідини, одержаний вимірюванням розсіяння світла під кутом 90 градусів, апоптоз яких індукований дією цисплатини концентраціями 0 (крива 1), 0.05 (крива 2), 0.1 (крива 3), 0.25 (крива 4). На фіг.9 зображено відсотковий склад апоптичних клітин лінії L1210(8), індукованих дією цисплатини концентраціями 0 (стовпчик 1), 0.05 (стовпчик 2), 0.1 (стовпчик 3), 0.25 (стовпчик 4). На фіг.10 зображено функціональні залежності зміни відсоткового вмісту апоптичних клітин лінії L1210(S), апоптоз яких індукований дією цисплатину концентраціями 0, 0.05, 0.1 і 0.25мкг/мл., одержані з розмірного розподілу клітин вимірюванням розсіяння світла під кутом 90 градусів згідно фіг.8. Кількісна оцінка апоптозу в клітинних суспензіях передбачає забезпечення подачі біологічних клітин в потоці рідини з постійною швидкістю, проходження променя лазера через потік рідини з досліджуваними клітинами так, щоб поперечний переріз променя в місці перетину його клітинами був більший ніж поперечний переріз досліджуваних клітин і його в часі могла перетинати лише одна клітина з подальшим визначенням розмірного розподілу клітин, підданих апоптозу. Для цього попередньо здійснюється процедура калібрування пристрою. Вона полягає в побудові двомірного розподілу нормованих значень амплітуд та тривалостей реєстрованих імпульсів для кожної окремо взятої для калібрування сферичної синтетичної частинки з відомим розміром і однаковим показником заломлення, для чого з потоком рідин за вибраний проміжок часу всі частинки при перетині перерізу променя реєструються шляхом вимірювання амплітуди і тривалості імпульсів, після чого реєстровані імпульси сортуються за амплітудою і тривалістю, для чого інтервал амплітуд поділяється на m піддіапазонів і обмежуються знизу напругою рівня шумів фотоелектричної системи реєстрації, а зверху напругою насичення вхідного підсилювача, а інтервал тривалостей поділяється на n піддіапазонів і обмежується часом проходження поперечного перерізу лазерного променя. Процедура находження розмірного розподілу клітин в потоці рідини полягає у забезпеченні проведення вимірювань за однакових умов, як у випадку процедури калібрування, побудові на основі результатів вимірювань функції, яка б визначала статистичні характеристики розсіяного клітинами світла, і математичним способом розкласти дану функцію на складові, одержані в результаті процедури калібрування. Для того щоб виключити залежність кінцевих результатів від часу вимірювання, проводиться операція нормування. У випадку, коли процедура вимірювання передбачає для одержання результату вимірювання проведення лише однієї операції заміру, процедура нормування полягає в проведенні операції ділення чисельного значення величини в кожному з піддіапазонів на суму чисельних значень величин в усіх піддіапазонах, на які розбиті інтервали амплітуд і тривалостей зареєстрованих імпульсів. У випадку, коли процедура вимірювання передбачає для одержання результату вимірювання проведення принаймні двох операцій заміру: основного і повірочного, процедура нормування полягає в операції ділення чисельних значень величин в кожному з піддіапазонів, на які розбиті інтервал амплітуд і тривалостей зареєстрованих імпульсів для операцій заміру основної і повірочної на час заміру даної операції, і подальшим відніманням в кожному піддіапазоні чисельних значень величин, отриманих для повірочного заміру від контрольного заміру і проведенні операції ділення чисельного значення величини в кожному з піддіапазонів на суму чисельних значень величин в усі х піддіапазонах, на які розбиті інтервали амплітуд і тривалостей зареєстрованих імпульсів. По нормованих значеннях чисельних величин амплітуд та тривалостей реєстрованих імпульсів будується матрицястовбець виду Aj(m,n,), елемент якої aj(m,n,) рівний нормованому значенню амплітуд та тривалостей реєстрованих імпульсів. Визначення розподілу клітин по розмірах в потоці рідини здійснюється шляхом побудови двомірного розподілу амплітуд і тривалостей зареєстрованих імпульсів розсіяного світла клітинами у піддіапазонах з межами, як у випадку зондування частинок, вибраних для калібрування, нормуванням чисельних значень величин амплітуди та тривалості імпульсів в кожному з піддіапазонів, побудовою по нормованих значеннях матриці виду B(m,n). Розподіл клітин за розмірами в потоці рідини визначається шляхом розв'язку рівняння å j A (m, n) i ij |B(m,n) - i = 0, де і - кількість вибраних для калібрування сферичних синтетичних частинок з відомими розмірами і однаковим показником заломлення, j порядковий номер елементу та j £ i, Aij(m,n,) - квадратична матриця, елемент якої aij(m,n,) виражає статистичні характеристики інтенсивності розсіяного світла для окремо вибраної сферичної синтетичної частинки з заданим розміром і показником заломлення, jі - стала величина, в межах від 0 до 1. Кількісна оцінка апоптозу в клітинних суспензіях досягається визначенням параметра апоптичний індекс, який рівний значенню jі , яке в розмірному розподілі досліджуваних клітин виражає кількісний вміст вибраних для калібрування сферичних синтетичних частинок, максимум яких з двох можливих максимумів в одержаному розмірному розподілі клітин рівний мінімальному значенню. Якісна оцінка апоптозу в клітинних суспензіях полягає в побудові функціональної залежності зміни параметра апоптичний індекс. У випадку, коли апоптоз індукується субстанцією, визначають функціональну залежність зміни параметра апоптичний індекс від концентрації субстанції. У випадку, коли функціональна залежність зміни параметра апоптичний індекс має монотонно зростаючий вид, стверджують про апоптозо-індуковану активність субстанції. Можливість реалізації способу покажемо на наступних прикладах. Приклад 1. Дослідження апоптозу лімфобластичних клітин лінії К562 лімфоцитарної лейкемії людини, АТСС номер: CCL-219, індукованого цисплатином. Нормальні клітини лінії К562 є округлими суспензійними частинками із середнім діаметром 4,6мкм. Клітини висівали у флакони Кароля в концентрації 200000од/мл, використовуючи культуральне середовище RPMI-1640 з додаванням 10% ембріональної бичачої сироватки, при цьому ретельно суспендовували 10-15 разів для уникнення утворення клітинних агрегатів. Через 24 години для індукції апоптозу до клітин додавали протипухлинний препарат цисплатин (цис-диамінодихлороплатина), у зростаючих концентраціях 0, 0,1 0,25 і 0,5мкг/мл клітинної суспензії. Клітини знову суспендовували. В подальшому для підтвердження апоптозу клітини фарбували акридиновим оранжевим, який при збудженні ультрафіолетовим світлом викликає флюоресценцію РНК в червоній області спектра і флюоресценцію ДНК у жовто-зеленій області спектра. На фіг.1(А) зображено апоптоз лейкемійних клітин лінії К562, індукований дією препарату цисплатин, одержаних зображенням в ультрафіолетовому світлі імерсійного препарату клітин, фарбованих акридиновим оранжевим, збільшення ´ 900. На фіг.1(Б) - комп'ютерний аналіз зображення на фіг.1(А). Цифрами позначено морфологічні зміни клітин лінії К562 в процесі апоптозу: 1- нормальна клітина; 2, 3, 4, 5 - послідовні етапи розвитку апоптозу, 6 - апоптоз клітини. Бачимо фрагментацію ядра та цитоплазми клітини, чотири апоптичні тільця на стадії розділення. Підтвердженням апоптозу є дані електрофорезу клітинної ДНК на агарному гелі. На фіг.3 зображено електрофореграма ДНК лейкемійних клітин лінії К562, апоптоз яких індукований дією цисплатини через 48 годин концентраціями: 1 контроль, 2-0.1мкг/мл, 3-0.5мкг/мл, 4 - маркер ДНК. Як бачимо, під дією цисплатини спостерігається виражена і виключно апоптична картина загибелі, що відображає фрагментацію ДНК з утворенням так званої "драбини ДНК" - характерного біохімічного маркера апоптозу. Кількісна оцінка апоптичних клітин лінії К562 за аналізом розсіяного світла клітинами під кутом 90 градусів проводилась так. Суспендовані клітини лінії К562, після додавання для індукції апоптозу препарату цисплатини у зростаючих концентраціях 0, 0.1 0.25 і 0.5мкг/мл клітинної суспензії, розводили у стерильному фізіологічному розчині (0,9% розчин натрію хлориду) до концентрації 25000кл/мл. Для цього брали стерильний 0,9% розчин натрію хлориду для ін'єкцій у вену в посудині ємністю 200мл, герметично закритий гумовим корком з алюмінієвим ободом, який серійно випускається фармацевтичною промисловістю (в нашому випадку використовувався фізіологічний розчин виробництва ДП "Львівдіалік", м. Львів). Набирали стерильним шприцом 2 міллілітри клітинної суспензії, вводили його у посудин у з 0,9% розчином натрію хлориду і поміщали у пристрій, що забезпечує подачу потоку рідини з постійною швидкістю в інтервалі від 0,01мл/сек до 1,0мл/сек через поперечний переріз променя НеNe лазера на довжині випромінювання 632,8нм. При цьому поперечний переріз променя в місці перетину його потоком рідини фокусувався в пляму діаметром 55...60мкм, є більшим ніж поперечний переріз досліджуваних клітин і його в часі могла перетинати лише одна клітина. Результати вимірювань розмірного розподілу клітин лінії К562 в потоці рідини пристроєм, який попередньо калібрований синтетичними сферичними полістирольними частинками з показником заломлення n=1.56, апоптоз яких індукований дією цисплатини концентраціями 0 (крива 1), 0.1 (крива 2), 0.25 (крива 3) і 0.5мкг/мл (крива 4), наведені на фіг.5. Оцінка апоптозу за параметром апоптичний індекс проводилась шляхом визначення відсоткового вмісту апоптичних клітин для кожної з наведених концентрацій цисплатини. Для цього для кожної кривої розмірного розподілу клітин розраховувалась площа під кожним з двох максимумів на кривих розподілу. Відсотковий вміст апоптичних клітин визначався шляхом відношення розрахованої площі під максимумом в області менших розмірів до загальної площі під обома максимумами. На фіг.6 наведено відсотковий вміст апоптичних клітин лінії К562, індукованих до апоптозу дією цисплатини концентраціями 0 (стовпчик 1), 0.1 (стовпчик 2), 0.25 (стовпчик 3) і 0.5мкг/мл (стовпчик 4). Якісна оцінка апоптозу клітин лінії К562, індукованого дією цисплатини, проводилась по виду функціональної залежності зміни параметра апоптичний індекс від концентрації цисплатини. Для цього будувалась графічна залежність розрахованих значень параметра апоптичний індекс згідно процедури кількісна оцінка апоптозу, описаної вище, від концентрації індукуючої апоптоз субстанції. На фіг.7 наведена побудована по одержаних даних графічна залежність відсоткового вмісту апоптичних клітин лінії К562 від концентрації цисплатини. Бачимо поступово зростаючий характер функціональної залежності зміни кривої, що свідчить про апоптозоіндуковану активність цисплатини стосовно клітин лінії К562. Приклад 2. Дослідження апоптозу лімфобластичних клітин лінії L1210(S)лімфоцитарної лейкемії миші, АТСС номер: CCL-219, індукованого цисплатином. Нормальні клітини лінії L1210(S) являють собою округлі суспензійні частинки із середнім діаметром 4,6мкм. Клітини висівали у флакони Кароля в концентрації 200000кл/мл, використовуючи культуральне середовище RPMI-1640 з додаванням 10% ембріональної бичачої сироватки, при цьому ретельно суспендовували 10-15 разів для уникнення утворення клітинних агрегатів. Через 24 години для індукції апоптозу до клітин додавали протипухлинний препарат цисплатин (цисдиамінодихлороплатина), у зростаючих концентраціях 0, 0.05, 0.1 і 0.25мкг/мл клітинної суспензії. Клітини знову суспендовували. Через 48 годин проводили мікроскопічні дослідження клітин під люмінесцентним мікроскопом шляхом їх фарбування акридиновим оранжевим та етидій бромідом. На фіг.2 зображено апоптоз лейкемійних клітин лінії L1210(8), індукований дією цисплатин. А, В - зображення у звичайному освітленні та після фарбування акридиновим оранжевим. Стрілками позначені клітини, піддані апоптозу. С - зображення при ультрафіолетовому світлі, D зображення при змішаному (звичайному та ультрафіолетовому) освітленні. На С, D виділені: внизу -нормальна клітина, вгорі - апоптична клітина розпадається на 3 апоптичні тільця. Для підтвердження апоптозу використовували електрофорез в агарному гелі клітинної ДНК. На фіг.4 зображено електрофореграма ДНК лейкемійних клітин лінії L1210(8), апоптоз яких індукований дією цисплатини через 48 годин концентраціями: 1 - контроль, 2-0.05мкг/мл, 3-0.25мкг/мл, 4 - маркер ДНК. Як бачимо, під дією цисплатини спостерігається чітка апоптична картина загибелі клітин з утворенням так званої "драбини ДНК" -характерного біохімічного маркера апоптозу. Кількісна оцінка апоптичних клітин лінії L1210(S) за аналізом розсіяного світла клітинами під кутом 90 градусів проводилась так. Суспендовані клітини лінії L1210(S), після додавання для індукції апоптозу препарату цисплатини у зростаючих концентраціях 0, 0.05, 0.1 і 0.25мкг/мл клітинної суспензії, розводили у стерильному фізіологічному розчині (0,9% розчин натрію хлориду) до концентрації 25000кл/мл. Для цього брали стерильний 0,9% розчин натрію хлориду для ін'єкцій у вену в посудині ємністю 200мл, герметично закритий гумовим корком з алюмінієвим ободом, який серійно випускається фармацевтичною промисловістю (в нашому випадку використовувався фізіологічний розчин виробництва ДП "Львівдіалік", м.Львів). Набирали стерильним шприцом 2 міллілітри клітинної суспензії, вводили його у посудин у з 0,9% розчином натрію хлориду і поміщали у пристрій, що забезпечує подачу потоку рідини з постійною швидкістю в інтервалі від 0,1мл/сек до 10мл/сек через поперечний переріз променя HeNe лазера на довжині випромінювання 632,8нм. При цьому поперечний переріз променя в місці перетину його потоком рідини фокусувався в пятно діаметром 55...60мкм, був більший ніж поперечний переріз досліджуваних клітин і його в часі могла перетинати лише одна клітина. Результати вимірювань розмірного розподілу клітин лінії L1210(S) в потоці рідини пристроєм, який попередньо калібрований синтетичними сферичними полістирольними частинками з показником заломлення n=1.56, апоптоз яких індукований дією цисплатини концентраціями 0 (крива 1), 0.1 (крива 2), 0.25 (крива 3) і 0.5мкг/мл (крива 4), наведені на фіг.8. Оцінка апоптозу за параметром апоптичний індекс проводилась шляхом визначення відсоткового вмісту апоптичних клітин для кожної з наведених концентрацій цисплатини. Для цього для кожної кривої розмірного розподілу клітин розраховувалась площа під кожним з двох максимумів на кривих розподілу. Відсотковий вміст апоптичних клітин визначався шляхом відношення розрахованої площі під максимумом в області менших розмірів до загальної площі під обома максимумами. На фіг.9наведено відсотковий вміст апоптичних клітин лінії L1210(S), індукованих до апоптозу дією цисплатини концентраціями 0 (стовпчик 1), 0.1 (стовпчик 2), 0.25 (стовпчик 3) і 0.5мкг/мл (стовпчик 4). Якісна оцінка апоптозу клітин лінії L1210(S), індукованого дією цисплатини, проводилась по виду функціональної залежності зміни параметра апоптичний індекс від концентрації цисплатини. Для цього будувалась графічна залежність розрахованих значень параметра апоптичний індекс згідно процедури кількісна оцінка апоптозу, описаної вище, від концентрації індукуючої апоптоз субстанції. На фіг. 6(В) наведена побудована по одержаних даних графічна залежність відсоткового вмісту апоптичних клітин лінії L1210(S) від концентрації цисплатини. Бачимо поступово зростачий характер функціональної залежності зміни кривої, що свідчить про апоптозо-індуковану активність цисплатини стосовно клітин лінії L1210(S).
ДивитисяДодаткова інформація
Назва патенту англійськоюA method for quantitative and qualitative evaluation of apoptosis in cellular suspensions
Автори англійськоюBilyi Oleksandr Ivanovych, Bilyi Rostyslav Oleksandrovych, Hetman Vasyl Bohdanovych, Stoika Rostyslav Stepanovych
Назва патенту російськоюСпособ количественной и качественной оценки апоптоза в клеточных суспензиях
Автори російськоюБелый Александр Иванович, Билый Ростислав Александрович, Гетьман Василий Богданович, Стойка Ростислав Степанович
МПК / Мітки
МПК: G01N 15/14, G01N 1/28, G01N 33/48, G09B 23/28
Мітки: оцінки, апоптозу, клітинних, спосіб, кількісної, суспензіях, якісної
Код посилання
<a href="https://ua.patents.su/12-64090-sposib-kilkisno-ta-yakisno-ocinki-apoptozu-v-klitinnikh-suspenziyakh.html" target="_blank" rel="follow" title="База патентів України">Спосіб кількісної та якісної оцінки апоптозу в клітинних суспензіях</a>
Попередній патент: Підвіска штанги обприскувача
Наступний патент: Пристрій для роботи з льодом
Випадковий патент: Спосіб кількісного визначення агрегації клітин периферичної крові методом поверхневого плазмонного резонансу