Карбенові комплекси паладію
Номер патенту: 77420
Опубліковано: 11.02.2013
Автори: Попов Анатолій Федорович, Кисельов Артем Вікторович, Коротких Микола Іванович, Швайка Олексій Павлович, Сабєров Вагіз Шамільович, Глиняна Наталія Валеріївна
Формула / Реферат
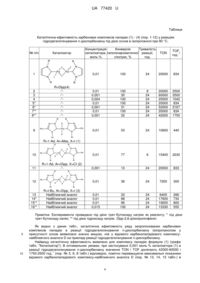
Карбенові комплекси паладію загальної формули
(LnPdXm)p,
де L означає карбеновий ліганд, вибраний з ряду (І, II):
1,3-дизаміщений імідазол-2-іліден загальної формули (І)
 , (I)
, (I)
де R, R1 означає алкіл, арил, гетерил,
1,3,4-тризаміщений 1,2,4-триазол-5-іліден загальної формули (II)
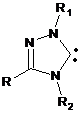 , (II)
, (II)
де R, R1, R2 означає алкіл, арил, гетерил,
X означає некарбеновий ліганд - хлорид, бромід, йодид,
m дорівнює 1, 2,
n дорівнює 1, 2,
р дорівнює 1, 2.
Текст
Реферат: Карбенові комплекси паладію загальної формули (LnPdXm)p. (72) Винахідник(и): Короткіх Микола Іванович (UA), Сабєров Вагіз Шамільович (UA), Глиняна Наталія Валеріївна (UA), Кисельов Артем Вікторович (UA), Попов Анатолій Федорович (UA), Швайка Олексій Павлович (UA) (73) Власник(и): ІНСТИТУТ ФІЗИКО-ОРГАНІЧНОЇ ХІМІЇ І ВУГЛЕХІМІЇ ІМ. Л.М. ЛИТВИНЕНКА НАН УКРАЇНИ, вул. Р. Люксембург, 70, м. Донецьк, 83114 (UA) (74) Представник: Короткiх Лiна Михайлiвна, реєстр. №43 UA 77420 U (12) UA 77420 U UA 77420 U 5 10 15 20 25 Корисна модель належить до органічної хімії, точніше стосується нових карбенових комплексів паладію, що можуть застосуватись як каталізатори реакції відновного дегалогенування (гідродегалогенування) галогенароматичних сполук (галогенаренів). Карбени - це сполуки двовалентного вуглецю загальної формули R1R2C:, де R1, R2 - алкільні, арильні або гетероциклічні радикали. R1, R2 також можуть складати карбо- та гетероцикли. Карбени дають з атомами металів координаційні зв'язки, утворюючи карбенові комплекси металів. Карбенові комплекси металів можуть застосовуватися як каталізатори органічних реакцій, в т.ч. реакцій відновлення. Останнім часом став розвиватися один з найпростіших промислово перспективних способів відновлення галогенароматичних сполук, в якому галоген замінюється на водень (гідродегалогенування) і який полягає у взаємодії ароматичної сполуки (субстрату), що містить галоген (хлор, бром, йод, флуор), з основою (алкоксидом або гідроксидом металу) в спиртах в присутності карбенокомплексного каталізатора реакції гідродегалогенування (N-Heterocyclic Carbenes in Synthesis / Ed. by S.P. Nolan. Weinheim: Wiley VCH Verlag GmbH & Co KgaA. 2006. P. 68). Ефективність каталізу оцінюється за максимальними значеннями показників TON і TOF (TON (turnover number) - число каталітичних циклів, що дорівнює числу моль продукту реакції на моль каталізатора; TOF (turnover frequency) - число каталітичних циклів за годину, тобто, відношення кількості каталітичних циклів до тривалості реакції (Poyatos M, Mas-Marza E., Mata J.A. et al. / Eur. J. Inorg. Chem. - 2003. - № 6. - P. 1215). Відомі карбенові комплекси паладію, які синтезують in situ на основі дибензиліденацетонового комплексу паладію Pd(dba)2 й 1,3-дизаміщених імідазолін-2-іліденів і використовують як каталізатори реакції гідродегалогенування. Вони дають можливість отримувати високі виходи продуктів гідродегалогенування при температурі 100 °C в діоксані [Viciu M.S., Grasa G.A., Nolan S.P. Organometallics. - 2001. - Vol. 20, № 16. - P. 3607]. Але -1 каталітична ефективність комплексів невисока (TON до 28-50, TOF до 28-50 год. ). Відомий карбеновий комплекс паладію структури A [Davies С.J.E., Page М. J., Ellul С.E., Mahon M.F., Whittlesey M.K. Chem. Commun, 2010 - Vol. 46. - P. 5151]. Mes N Br N Mes Ni PPh3 .А 30 35 Відомий комплекс А показує в реакції дебромування n-бромфлуоро-бензену та дехлорування n-хлорфлуоробензену невисоку каталітичну ефективність при 25 °C (TON 15-22 і -1 TOF 4-44 год. і концентрації каталізатора 4,5 моль %), не зважаючи на те, що вказані субстрати є активованими (електроноакцепторний вплив атомів флуору). Відомий карбеновий комплекс паладію формули В забезпечує помірну ефективність каталізу в реакціях гідродегалогенування монохлорбензенів при кімнатній температурі (TON -1 100, TOF 200 год. ) [Navarro O., Marion N., Oonishi Y., Kelly R.A., Nolan S.P.J. Org. Chem. - 2006. Vol. 71, № 2. - P. 685]. N Cl Pd N 40 NMe2 .B 1 UA 77420 U 5 Але відома сполука В не дозволяє досягти високої ефективності каталізу для ди- і полізаміщених хлорбензенів. Відомий карбеновий комплекс паладію С дозволяє проводити гідродегалогенування дигалогензаміщених аренів, наприклад n-дихлорбензену [Navarro О., Kaur Н., Mahjoor P., Nolan S.P.J. Org. Chem. - 2004. - Vol. 69, № 9. - P. 3173]. N All Pd N Cl .C 10 15 20 Недоліком відомої сполуки С є недостатня ефективність каталізу (при 60 °C TON 200, TOF -1 110 год ). В цій же роботі наведено ще один варіант виконання каталізу комплексом С при застосуванні мікрохвильового опромінювання при 120 °C, що дає найвищу швидкість реакції, причому майже кількісний вихід продукту досягається всього за 2 хв. (TON 4000, TOF 120000 -1 -1 год. для n-хлортолуену; TON 1900, TOF 57000 год. для n-дихлорбензену). Але наведений варіант застосування відомого карбенового комплексу паладію С є енергоємним і пов'язаний з поки що нетехнологічним мікрохвильовим обладнанням. Тому така технологія на сьогодні не може бути промисловою. Найближчим за суттю та досягнутим результатом до пропонованого є вибраний за найближчий аналог відомий карбеновий комплекс паладію структури D, Cl N Pd Pd N Cl Cl N Cl N .D 25 30 який застосовано як каталізатор в реакції гідродегалогенування поліхлорбіфенілів при 80 °C в ізопропанолі [Akzinnay S., Bisaro F., Cazin C. S. J. Chem. Commun. - 2009. - Vol. 45. - P. 5752]. Відомий карбеновий комплекс паладію D дозволяє досягти найвищих TON і TOF у вказаних -1 умовах (10000 і 417 год. відповідно), вищих за такі для структур А - С. За нашими даними у дехлоруванні n-дихлорбензену в присутності відомого комплексу-найближчого аналога D -1 значення TON і TOF складають 6400 і 266 год (реагент - трет-бутоксид натрію), 17600 і 734 -1 -1 год. (реагент - тpeт-бутоксид калію), 19200 і 800 год. (реагент - гідроксид натрію). Недоліком відомого комплексу-найближчого аналога D є недостатньо висока ефективність й економічність використання як каталізатора (довготривалість процесу - до 24 год., що позначається на показникові TOF, знижуючи його). 2 UA 77420 U 5 10 В основу корисної моделі поставлено задачу запропонувати нові карбенові комплекси паладію, які проявляють високу каталітичну активність при короткій тривалості процесу, низьких витратах каталізатора та високому виході продукту каталітичної реакції відновлення галогенароматичних сполук. Запропоновані нові карбенові комплекси є економічними, виходи продуктів каталітичної реакції сягають 100 %, показники TON і TOF для найкращих варіантів -1 нових каталізаторів досягають значень 42000-60000 і 1750-2500 год. відповідно (за -1 найближчим аналогом 6400-19200 і 266-800 год. ), витрати каталізатора при кількісних конверсіях n-дихлорбензену в 3,75 разу нижчі, ніж за найближчим аналогом (0,004 моль % проти 0,015 моль %), тривалість процесу каталізу при концентрації каталізатора 0,01 моль % при кількісних конверсіях n-дихлорбензену скорочується втричі (8 год. проти 24). Поставлена задача вирішується тим, що створено карбенові комплекси паладію загальної формули (LnPdXm)p, де L означає карбеновий ліганд, вибраний з ряду (І, II): 1,3-дизаміщений імідазол-2-іліден загальної формули (І) 15 R N N R1 , (I) де R, R1 означає алкіл, арил, гетерил, 1,3,4-тризаміщений 1,2,4-триазол-5-іліден загальної формули (II) R1 N R 20 25 30 35 N N R2 , (II) де R, R1, R2 означає алкіл, арил, гетерил, X означає некарбеновий ліганд - хлорид, бромід, йодид, m дорівнює 1, 2, n дорівнює 1, 2, р дорівнює 1,2. Між сукупністю ознак корисної моделі та технічним результатом, якого можна досягти при її реалізації, існує причинно-наслідковий зв'язок. Запропоновані нові карбенові комплекси мають переваги перед відомим (найближчим аналогом) карбенопаладієвим комплексом D: - вища каталітична ефективність (в оптимальному варіанті TON 42000-60000 і TOF 1750-1 2500 проти 6400-19200 і 266-800 год. відповідно), - вища економічність каталізу через в 3,75 разу нижчі витрати каталізатора (0,004 моль % проти 0,015 моль %) при кількісних конверсіях n-дихлорбензену. - втричі коротша тривалість процесу каталізу (8 год. проти 24) при кількісних конверсіях nдихлорбензену. Результати оцінки каталітичної ефективністі синтезованих сполук (1) - (4) наведено в табл. (приклади 1-12). 3 UA 77420 U Таблиця Каталітична ефективність карбенових комплексів паладію (1) - (4) (пор. 1-12) у реакціях гідродегалогенування n-дихлорбензену під дією основ в ізопропанолі при 80 °C. № п/п Концентрація Конверсія Тривалість каталізатора, галогенароматичної реакції, моль % сполуки, % год. Каталізатор R I Pd N N I Pd I 0,01 N 100 24 20000 834 0,01 0,001 0,004 0,01 0,001 0,01 0,001 I R 100 30 100 100 31 100 32 8 24 24 24 24 24 24 20000 60000 25000 20000 52000 20000 42000 2500 2500 1042 834 2167 834 1750 0,01 53 24 10600 440 0,01 77 6 15400 2230 0,001 10 24 20000 833 0,01 36 24 7200 300 0,01 0,01 0,01 0,015 32 88 96 100 24 24 24 24 6400 17600 19200 13330 266 734 800 555 R R=Dipp(4) -“-“-“-“-“-“-“ 2 3 4 5* 6* 7** 8** R R N N X N Ph 9 TOF, -1 год. R N 1 TON N Ph Pd N N X Ar Ar R=1-Ad, Ar=Mes, X=I (1) R R N 10 N X Ph Pd N X X N Ph N X Ar Ar 11 R=1-Ad, Ar=Dipp, X=CI (2) -“R R N 12 N X Ph Pd N Ar 13 14* 15** 16** N Pd X X N N Ph Pd X N Ar R=t-Bu, Ar=Dipp, X=I (3) Найближчий аналог Найближчий аналог Найближчий аналог Найближчий аналог Примітка: Експерименти проведено під дією трет-бутоксиду натрію як реагенту; * під дією трет-бутоксиду калію; ** під дією гідроксиду натрію. Dipp-2,6-діізопропілфеніл. 5 10 Як видно з даних табл., каталітична ефективність ряду запропонованих карбенових комплексів паладію в реакції гідродегалогенування n-дихлорбензену ізопропанолом у присутності основ виявилася значно вищою, ніж у відомого карбенопаладієвого комплексунайближчого аналога D на прикладі реакції гідродегалогенування n-дихлорбензену. Найвищу каталітичну ефективність виявлено для комплексу паладію формули (1) (графа табл. "Каталізатор"). В оптимальних умовах, при застосуванні 0,001 моль % каталізатора (1) в реакції гідродегалогенування n-дихлорбензену значення TON і TOF досягають 42000-60000 і -1 1750-2500 год. (пор. № 3, 6, 8 табл.) відповідно, помітно перевищуючи максимальні показники відомого карбенопаладієвого комплексу-найближчого аналога D (пор. № 13, 14, 15 табл.) в 4 UA 77420 U -1 5 10 15 реакції гідродегалогенування n-дихлорбензену (TON 6400-19200, TOF 266-800 год. ). Економічність процесу із запропонованим каталізатором (1) вища, ніж із найближчим аналогом. Для досягнення кількісної конверсії n-дихлорбензену при 80 °C необхідна в 3,75 разу менша концентрація каталізатора (0,004 моль % проти 0,015 моль % у разі застосування каталізаторанайближчого аналога (пор. № 4 і 16 табл.). При зіставленні у рівних умовах тривалість процесу при застосуванні каталізатора (1) менша, ніж в процесі із найближчим аналогом. Так, при концентрації 0,01 моль % каталізатора (1) кількісна конверсія n-дихлорбензену досягається вже за 8 год., а в процесі з найближчим аналогом за 24 год. конверсія складає 96 % (пор. № 2, 15 табл.). Ефективність споріднених карбенопаладієвих комплексів (2)-(4) дещо нижча, ніж сполуки (1) -1 (TON 7200-20000; TOF 300-833 год. при концентрації каталізатора 0,01 моль % з третбутоксидом натрію як реагентом) (пор. № 9-12 табл.), але перевищує дані TON і TOF за -1 найближчим аналогом (6400 і 266 год. ) (пор. № 13). Механізм каталізу карбеновими комплексами паладію реакції гідродегалогенування галогенаренів точно не встановлено. Однак, на основі спостережень утворення в ході реакції сполук паладію(0) та їхніх каталітичних властивостей у реакції можна передбачити, що реакція перебігає через проміжні карбенові комплекси паладію(0) (схема каталізу): LnPdXm -OPri ArX ArH LnPd(0) Ar Ar LnPd LnPd H X Ar OPri LnPd (CH3)2CO OPri X Схема каталізу. 20 25 30 35 40 У випадку карбенових комплексів паладію спочатку, ймовірно, відбувається відновлення комплексу паладію(II) LnPdXm алкоксид-аніоном до комплексу паладію(0) LnPd. Далі, перебігає приєднання галогенарену до паладію(0) з утворенням активованого аддукту галогенарену та сполуки паладію LnPd(Ar)X, обмін галогену на ізопропоксид-аніон з утворенням комплексу LnPd(Ar)(O-i-Pr) і розклад останнього на аддукт паладію та Н-арену LnPd(ArH) з відщепленням ацетону. Розпад останнього на арен АrН і комплекс паладію(0) LnPd регенерує каталізатор у вигляді комплексу паладію(0). Таким чином, пропоновані карбенові комплекси перехідних металів загальної формули (LnPdXm)p з лігандами І, ІІ є ефективними каталізаторами реакції гідродегалогенування галогенароматичних сполук. В оптимальному варіанті використання карбенопаладієвого комплексу (1) концентрацію каталізатора можна вибирати на рівні від сотих до тисячних -1 мольного відсотка (TON до 25000-60000, TOF до 1040-2500 год ) при високих ступенях конверсії галогенароматичних сполук, що свідчить про високу ефективність каталізу та дає можливість застосувати каталізатори в промисловості. Способи одержання сполук відповідно до пропонованої корисної моделі. Запропоновані сполуки одержують за відомими або новими методиками з використанням вихідних речовин, що наявні у продажу, які отримують відповідно до звичайних хімічних способів. Застосовувана методика одержання сполуки за корисною моделлю залежить від конкретної необхідної сполуки. Так, димеризований монокарбеновий комплекс (1) (ліганд загальної структури І) отримано шляхом взаємодії 1,3-(2,6-діізопропілфеніл)імідазол-2-ілідену (5), що генерується з відповідної солі - 1,3-(2,6-діізопропілфеніл)імідазолій хлориду - дією трет-бутоксиду калію, з йодидом паладію у мольному співвідношенні 1:1 у тетрагідрофурані згідно зі схемою 1 (див. методики одержання сполук відповідно до корисної моделі, приклад 1). 5 UA 77420 U R R + N R 2 Cl N R R R I N 2 PdI2 2 N -2 KCl R R N 2 t-BuOK R R Pd N R R I Pd I R R I N N R R (1) (5) R=i-Pr Схема 1 5 Біскарбеновий комплекс 1-(1-адамантил)-3,4-діарил-1,2,4-триазол-5-ілідену (ліганд загальної структури II) йодиду паладію (2) отримували шляхом взаємодії індивідуального 1-(1адамантил)-3-феніл-4-мезитил-1,2,4-триазол-5-ілідену (5) з йодидом паладію у мольному співвідношенні 2:1 в толуені з добавкою диметилсульфоксиду згідно зі схемою 2 (див. методики одержання сполуки відповідно до корисної моделі, приклад 2). Ad N N 2 PdI2 N N Me Me I Pd N N N Me Me Me (6) 15 N I MeMe Me Me 10 Ad Ad N (2) Схема 2 Димеризовані монокарбенові комплекси (3), (4) (ліганд загальної структури II) синтезовано шляхом взаємодії індивідуальних 1-алкіл-3-феніл-4-(2,6-діізопропілфеніл)-1,2,4-триазол-5іліденів (7), (8) з хлоридом або йодидом паладію у мольному співвідношенні 1:1 в толуені з добавкою диметилсульфоксиду згідно зі схемою 3 (див. методики одержання сполук відповідно до корисної моделі, приклади 3, 4). 6 UA 77420 U R N N 2 PdX2 2 N N R' R' R R N N X N X Pd X Pd X R' R' (7), (8) R' N N R' (3), (4) (3),(7) R=1-Ad, X=Cl; (4),(8) R=t-Bu, X=I; (3),(4),(7),(8) R'=i-Pr Схема 3 5 10 15 20 25 30 35 40 45 Приклади одержання сполук відповідно до корисної моделі. 1 Спектри протонного ядерного магнітного резонансу ( Н ЯМР) знімали на спектрометрі Bruker 13 Avance II 400 (400 МГц) з використанням стандарту Me4Si ( 0,00). Спектри С ЯМР (100 МГц) знімали на спектрометрі Bruker Avance II 400 (400 МГц) з використанням стандарту Me4Si ( 0,00). Позначення в спектрах ЯМР: с - синглет,д - дублет, м - мультиплет. Приклад 1. Одержання димерного [1,3-ди(2,6-діізопропілфеніл)імідазол-2-іліден]паладій йодиду (1). Розчин 0,98 г (2,0 ммоль) 1,3-(2,6-діізопропіл-феніл)імідазолій перхлорату і 0,24 г (2,1 ммоль) трет-бутоксиду калію в 15 мл безводного тетрагідрофурану перемішували протягом 2 год. До реакційної суміші додавали 0,72 г (2 ммоль) йодиду паладію та перемішували при кімнатній температурі протягом 6 год. Розчинник випаровували, продукт розтирали з петролейним етером. Утворений осад розчиняли в суміші циклогексану та діетилового етеру (1:1) і фільтрували через тонкий шар силікагелю. Розчинник випаровували, залишок розтирали з петролейним етером, утворений осад відфільтровували, сушили. Вихід 1,3 г (87 %). Т.пл. 288289 °C (циклогексан). Знайдено, %: С 43,2; Н 4,8; І 34,0; N 3,7; Pd 14,3. C54H72l4N4Pd2. 1 Обчислено, %: С 43,3; Н 4,9; I 33,9; N 3,7; Pd 14,2. Н ЯМР (CDCl3), , м.ч.: 0,93 (д, 12Н, 6,8 Гц), 1,07 (д, 12Н, 6,8 Гц), 1,24 (д, 12Н, 6,8 Гц), 1,46 (д, 12Н, 6,8 Гц)(СН 3С, i-Рr), 2,75 (т, 4Н, 6,8 Гц), 4,5 3,29 (т, 4Н, 6,8 Гц) (СНС, i-Рr), 7,09 (с, 2Н, C N), 7,25 (д, 4Н, 7,6 Гц), 7,33 (д, 4Н, 7,6 Гц), 7,51 13 (дд, 4Н, 7,6 Гц)(Аr). С ЯМР (CDCl3), , м.ч.: 23,3, 25,8, 28,4 (СН3С, i-Рr), 23,4 (СНС, i-Рr), 124,5, 4,5 1N 2C,6C 2 124,9 (С , Im), 125,6, 130,5 (Аr), 135,6 (ipso-C ), 145,1, 146,2 (ipso-C ), 165,7 (C -Pd). Приклад 2. Одержання біс[(1-адамантил)-3-феніл-4-мезитил-1,2,4-триазол-5-іліден)] паладій хлориду (2). Стадія 1. Одержання 3-феніл-4-мезитил-1,2,4-триазолу. До розчину 5 г (0,034 моль) 2-феніл1,3,4-оксадіазолу та 4,6 г (0,034 моль) 2,4,6-триметил-аніліну в 3,2 мл о-дихлорбензену додавали 2,6 мл трифлуорооцтової кислоти та нагрівали при 190 °C протягом 16 год. Отриману реакційну масу промивали петролейним етером, водою. Осад відфільтровували, сушили. Вихід 4,5 г (50 %). Т. пл. 118-120 °C (бензен). Знайдено, %: С 77,6; Н 6,4; N 16,0. C17H17N3. Обчислено, 1 %: С 77,5; Н 6,5; N 16,0. Н ЯМР (CDCl3), , м.ч.: 1,86 (с, 6Н, о-СН3С), 2,31 (с, 3Н, n-СН3С), 7,09 5 (м, 2Н), 7,39 (м, 5Н)(Аr), 8,73 (с, 1H, C N). Стадія 2. Одержання (1-адамантил)-3-феніл-4-мезитил-1,2,4-триазолій перхлорату. Суміш 2,36 г (8,9 ммоль) 3-феніл-4-мезитил-1,2,4-триазолу і 2 г (9,33 ммоль) 1-бромадамантану в 2,1 мл оцтової кислоти кип'ятили протягом 6 год., додавали воду до розчинення утвореної при кипінні солі, активоване вугілля та фільтрували розчин, додавали надлишок 1,23 г (10 ммоль) перхлорату натрію. Після охолодження осад відфільтровували, промивали сумішшю ізопропанолу та петролейного етеру (1:3) і сушили. Вихід солі 3,7 г (85 %). Т. пл.>300 °C (оцтова кислота - вода, 1:1). Знайдено, %: С 65,2; Н 6,4; Сl 7,1; N 8,3. С27Н32СlN3O4. Обчислено, %: С 1 65,1; Н 6,5; СІ 7,1; N 8,4. Н ЯМР (DMSO-d6), , м.ч.: 1,79 (м, 6Н), 2,02 (м, 6Н), 2,30 (м, 3H)(Ad), 2,35 (с, 6Н, о-СН3С), 2,36 (с, 3Н, n-СН3С), 7,19 (с, 2Н), 7,44 (д, 2Н, 7,6 Гц), 7,53 (дд, 2Н, 7,6 Гц), 5 7,62 (дд, 1H, 7,2 Гц)(Аr), 10,59 (с, 1Н, C HN). Стадія 3. Одержання 1-(1-адамантил)-3-феніл-4-мезитил-1,2,4-триазол-5-ілідену (6). Суспензію 1 г (2 ммоль) (1-адамантил)-3-феніл-4-мезитил-1,2,4-триазолій перхлорату та 0,23 г (2 ммоль) трет-бутоксиду калію перемішували в 10 мл суміші ізопропанол - толуен (1:3) при кімнатній температурі протягом 1,5 год. Розчинник випаровували, смолоподібний продукт розтирали з петролейним етером, отриманий осад відфільтровували й сушили. Для того, щоб 7 UA 77420 U 5 10 15 20 25 30 35 40 45 50 55 повністю розкласти отриманий алкокситриазолін, продукт екстрагували 20 мл толуену, неорганічну сіль відділяли фільтрацією, розчинник випаровували. Осад карбену (6) розтирали з петролейним етером, відфільтровували й сушили. Вихід 0,6 г (76 %). Т. пл. 168-169 °C (толуен). 1 Знайдено, %: С 81,5; Н 7,8; N 10,7. C27H31N3. Обчислено, %: С 81,6; Н 7,9; N 10,6. Н ЯМР (C6D6), , м.ч.: 1,64 (м, 3Н), 1,73 (м, 3Н), 2,13 (м, 3Н), 2,66 (м, 6H)(Ad), 1,97 (с, 6Н, o-СН3С), 2,07 (с, 3Н, 13 n-СН3С), 6,69 (с, 2Н), 6,93 (м, 3Н), 7,61 (м, 2Н)(Аr). С ЯМР (C6D6), , м.ч.: 18,3 (о-СН3С), 21,0 (nСН3С), 30,2 (СН, Ad), 36,7, 44,2 (СН2, Ad), 59,4 (ipso-C, Ad), 127,9, 128,4, 128,6, 130,2, 134,4 (Аr), 5 135,4, 136,8, 137,9, 151,1 (ipso-C, Ar), 211,5 (C N). Стадія 4. Одержання біс[(1-адамантил)-3-феніл-4-мезитил-1,2,4-триазол-5-іліден)]паладій хлориду (2). До суспензії 0,095 г (0,264 ммоль) паладій йодиду в 4 мл безводного толуену додавали 0,21 г (0,529 ммоль) 1-(1-адамантил)-3-феніл-4-мезитил-1,2,4-триазол-5-ілідену (6) в 1 мл толуену та 0,01 мл безводного диметилсульфоксиду. Перемішували суміш при кімнатній температурі протягом 2 год., потім кип'ятили протягом 1 год. Осад сполуки (1) відфільтровували й сушили. Вихід 0,21 г (68 %). Т. пл.>300 °C (субл.). Знайдено, %: С 47,4, Н 4,2, І 27,6, N 9,2, Pd 13 11,6. C36H38I2N6Pd. Обчислено, %: С 47,3, Н 4,2,1 27,7, N 9,2, Pd 11,6. С ЯМР (тв. стан), , м.ч.: 21,3, 23,7, 24,6 (СН3С), 30,9, 37,6, 45,3 (Ad), 64,1 (ipso-C, Ad), 127,7, 130,0, 131,2, 133,1, 133,3, 1N 3 2 135,7, 139,8, 140,7 (Аr), 143,2 (C ), 154,8 (С ), 168,2 (C -Pd). Приклад 3. Одержання димерного [(1-адамантил)-3-феніл-4-(2,6-діізопропілфеніл)-1,2,4триазол-5-іліден]паладій хлориду (3). Стадія 1. Одержання 3-феніл-4-(2,6-діізопропілфеніл)-1,2,4-триазолу. До розчину 6 г (0,04 моль) 2-феніл-1,3,4-оксадіазолу та 7,08 г (0,034 моль) 2,6-діізопропіланіліну в 4 мл одихлорбензену додавали 2,5 мл трифлуороцтової кислоти та нагрівали при 190 °C протягом 16 год. Отриману реакційну масу розтирали з петролейним етером, водним розчином гідроксиду калію та водою. Осад відфільтровували, сушили. Вихід 4,38 г (50 %). Т. пл. 83-85 °C (бензен). 1 Знайдено, %: С 78,5; Н 7,6; N 13,9. C20H23N3. Обчислено, %: С 78,6; Н 7,6; N 13,8. Н ЯМР (CDCl3), , м.ч.: 0,87 (д, 6Н, 6,8 Гц), 1,09 (д, 6Н, 6,8 Гц)(СН3С i-Рr), 2,25 (т, 2Н, 6,8 Гц, СНС, i-Рr), 5 7,37 (м, 7Н), 7,58 (дд, 1Н, 7,6 Гц)(Аr), 8,87 (с, 1Н, C N). Стадія 2. Отримання (1-адамантил)-3-феніл-4-(2,6-діізопропілфеніл)-1,2,4-триазолій перхлорату. Синтезували за методикою одержання (1-адамантил)-3-феніл-4-мезитил-1,2,4триазолій перхлорату (приклад 2, стадія 2) з 3,6 г (0,012 моль) 3-феніл-4-діізопропілфеніл-1,2,4триазолу, 2,78 г (0,013 моль) 1-бромадамантану у 3 мл оцтової кислоти. Тривалість кип'ятіння 18 год. Вихід 3,19 г (59 %). Т. пл. 210-212 °C (оцтова кислота-вода, 1:1). Знайдено, %: С 66,8; Н 1 7,0; Сl 6,7; N 7,7. C30H38CIN3O4. Обчислено, %: С 66,7; Н 7,1; СІ 6,6; N 7,8. Н ЯМР (DMSO-d6), , м.ч.: 0,91 (д, 6Н, 6,8 Гц), 1,16 (д, 6Н, 6,8 Гц)(СН3С, i-Рr), 1,80 (м, 6Н, Ad), 2,35 (м, 2Н, СНС, i-Рr; 9Н, Ad), 7,43 (д, 2Н, 7,6 Гц), 7,50 (д, 2Н, 7,6 Гц), 7,54 (д, 2Н, 7,6 Гц), 7,62 (дд, 1Н, 7,6 Гц), 7,73 5 (дд, 1H, 7,6 Гц) (Аr), 10,87 (с, 1Н, C HN). Стадія 3. Отримання (1-адамантил)-3-феніл-4-(2,6-діізопропіл феніл)-1,2,4-триазол-5-ілідену (7). Синтезували за методикою одержання (1-адамантил)-3-феніл-4-мезитил-1,2,4-триазол-5ілідену (6) (приклад 2, стадія 3) з 1 г (1,85 ммоль) (1-адамантил)-3-феніл-4-(2,6діізопропілфеніл)-1,2,4-триазолій перхлорату, 0,2 г трет-бутоксиду калію у 6 мл толуену і 2 мл ізопропанолу. Вихід 0,56 г (68 %). Т. пл. 151-153 °C (толуен). Знайдено, %: С 82,1; Н 8,4; N 9,6. 1 C30H37N3. Обчислено, %: С 82,0; Н 8,5; N 9,6. Н ЯМР (C6D6), , м.ч.: 0,87 (д, 6Н, 6,8 Гц), 1,20 (д, 6Н, 6,8 Гц)(СН3С, i-Рr), 2,73 (м, 2Н, 7,2 Гц, СНС, i-Рr), 1,65 (м, 3Н), 1,70 (м, 3Н), 2,12 (м, 3Н), 2,63 (м, 6Н) (Ad), 2,75 (кв, 2Н, СНС, і-Рr, 6,8 Гц), 6,94 (м, 3Н), 7,12 (д, 2Н, 7,6 Гц), 7,27 (дд, 1Н, 7,6 Гц), 13 7,62 (м, 2Н) (Аr). С ЯМР (C6D6), , м.ч.: 22,5, 24,5 (СН3С, i-Рr), 28,9 (СН, i-Рr), 30,2 (СНС), 36,6, 44,1 (СН2С) (Ad), 59,3 (ipso-C, Ad), 124,0, 127,9, 128,3, 129,2, 129,3 (Аг), 127,6, 136,5, 145,8, 151,2 5 (ipso-C, Ar), 211,9 (C N). Стадія 4. Одержання димерного [(1-адамантил)-3-феніл-4-(2,6-діізопропілфеніл)-1,2,4триазол-5-іліден]паладій хлориду (3). До суспензії 0,08 г (0,455 ммоль) хлориду паладію в 4 мл безводного толуену додавали розчин 0,2 г (0,455 ммоль) 1-(1-адамантил)-3-феніл-4-(2,6діізопропілфеніл)-1,2,4-триазол-5-ілідену (7) в 1 мл толуену протягом 10 хв., 0,03 мл безводного диметилсульфоксиду і перемішували протягом 8 год. Утворений осад відфільтровували, промивали петролейним етером, сушили. Вихід 0,19 г (68 %). Т.пл. 146 °C (розкл.) (ацетонітрил). Знайдено, %: С 58,3; Н 6,1; СІ 11,5; N 6,9; Pd 17,2. C60H74Cl4N6Pd2. Обчислено, %: 13 С 58,4; Н 6,0; СІ 11,5; N 6,8; Pd 17,3. С ЯМР (тв. стан, 100 МГц): 26,2, 27,1, 29,6 (СН 3С, i-Рr), 48,2 (СНС, i-Рr), 31,0, 36,6, 44,5 (Ad), 65,6 (ipso-C, Ad), 126,0, 127,2, 130,5, 131,9, 133,2 (Аr), 3 4 5 154,9 (С ), 148,2 (ipso-CN , C -Pd). Приклад 4. Одержання димерного [1-трет-бутил-3-феніл-4-(2,6-діізопропілфеніл)-1,2,4триазол-5-іліден]паладій йодиду (4). 8 UA 77420 U 5 10 15 20 25 30 35 Стадія 1. Одержання 1-трет-бутил-3-феніл-4-(2,6-діізопропілфеніл)-1,2,4-триазолій перхлорату. Синтезували за методикою одержання (1-адамантил)-3-феніл-4-мезитил-1,2,4триазолій перхлорату (приклад 2, стадія 2) з 4 г (0,013 моль) 3-феніл-4-(2,6-діізопропілфеніл)1,2,4-триазолу, 6 г (0,04 моль) йодиду натрію і 4 г (0,04 моль) трет-бутилхлориду в 6 мл оцтової кислоти. Вихід 1-трет-бутил-3-феніл-4-(2,6-діізопропілфеніл)-1,2,4-триазолій перхлорату 3,86 г (64 %). Т. пл. 232-234 °C (оцтова кислота-вода, 1:1). Знайдено, %: С 62,5; Н 6,9; СІ 7,6; N 9,2. 1 C24H32CIN3O4. Обчислено, %: С 62,4; Н 7,0; СІ 7,7; N 9,1. Н ЯМР (DMSO-d6), , м.ч.: 0,91 (д, 6Н, 6,8 Гц), 1,16 (д, 6Н, 6,8 Гц)(СН3С, i-Рr), 1,81 (с, 9Н, СН3С, t-Bu), 2,40 (кв, 2Н, СНС, i-Рr, 6,8 Гц), 7,44 (д, 2Н, 7,6 Гц), 7,51 (д, 2Н, 7,6 Гц), 7,54 (д, 2Н, 7,6 Гц), 7,65 (дд, 1Н, 7,6 Гц), 7,73 (дд, 1Н, 7,6 5 Гц) (Аr), 10,91 (с, 1Н, C HN). Стадія 2. Одержання 1-трет-бутил-3-феніл-4-(2,6-діізопропілфеніл)-1,2,4-триазол-5-ілідену (8). Синтезували за методикою одержання (1-адамантил)-3-феніл-4-мезитил-1,2,4-триазол-5ілідену (6) (приклад 2, стадія 3) з 2,5 г (5,38 ммоль) 1-трет-бутил-3-феніл-4-(2,6діізопропілфеніл)-1,2,4-триазолій перхлорату, 0,6 г (5,38 ммоль) трет-бутоксиду калію в 9 мл толуену і 3 мл ізопропанолу. Вихід 1,38 г (70 %). Т. пл. 112-114 °C (толуен). Знайдено, %: С 79,8; 1 Н 8,5; N 11,7. C24H31N3. Обчислено, %: С 79,7; Н 8,6; N 11,6. Н ЯМР (C6D6), , м.ч.: 0,85 (д, 6Н, 7,2 Гц), 1,18 (д, 6Н, 7,2 Гц)(СН3С, i-Рr), 2,74 (кв, 2Н, 7,2 Гц, СНС, i-Рr),1,83 (с, 9Н, СН3С, t-Bu), 13 6,90 (м, 3Н), 7,10 (д, 2Н, 7,6 Гц), 7,25 (дд, 1Н, 7,6 Гц), 7,61 (м, 2Н) (Аr). С ЯМР (C6D6), , м.ч.: 22,5, 24,5 (СН3С, i-Рr), 28,9 (СН, i-Рr), 30,9 (СН3С, t-Bu), 59,3 (ipso-C, t-Bu), 127,8, 128,0, 128,2, 5 128,3, 129,6 (Аr), 124,2, 136,6, 146,1, 151,8 (ipso-C, Ar), 212,7 (C N). Стадія 3. Одержання димерного [1-трет-бутил-3-феніл-4-(2,6-діізопропілфеніл)-1,2,4триазол-5-іліден]паладій йодиду (4). До суміші 0,246 г (0,68 ммоль) йодиду паладію в 5 мл толуену додавали при перемішуванні розчин 0,25 г (0,68 ммоль) 1-трет-бутил-3-феніл-4-(2,6діізопропілфеніл)-1,2,4-триазол-5-ілідену (8) в 1 мл безводного толуену протягом 10 хв., 0,03 мл безводного диметилсульфоксиду і перемішували протягом 8 год. Кип'ятили реакційну суміш протягом 2,5 год. Утворений осад відфільтровували, промивали петролейним етером, сушили. Вихід 0,40 г (81 %). Т.пл. 254-255 °C (циклогексан). Знайдено, %: С 40,0; Н 4,2; І 35,1; N 5,9; Pd 13 14,3. C48H62I4N6Pd2. Обчислено, %: С 40,0; Н 4,3; І 35,2; N 5,8; Pd 14,7. С ЯМР (тв. стан, 100 МГц): 23,7, 25,8, 26,5, 27,2, 29,6, 30,1 (СН3С, i-Рr), 47,3 (СНС, i-Рr), 31,7, 32,3 (t-Bu), 64,5 (ipso-C, 4 t-Bu), 126,0, 127,8, 128,6, 131,0, 131,5, 132,7, 134,2, 136,3, 137,3 (Аr), 146,6, 147,2 (ipso-CN , ipso26 3 5 C ' C), 154,2, 156,1, 157,6 (С ), 167,0, 168,2, 171,1 (C -Pd). Приклад 5. Методика проведення каталітичної реакції. До 1 ммоль субстрату (n-дихлорбензену) додавали 11 мл 0,1 М розчину основи (третбутоксиду калію, трет-бутоксиду натрію або гідроксиду натрію) в ізопропанолі та необхідну кількість каталізатора (див. таблицю). Реакційну суміш кип'ятили, контролюючи хід реакції ваговим методом за масою хлориду натрію або калію, що виділявся. ФОРМУЛА КОРИСНОЇ МОДЕЛІ 40 Карбенові комплекси паладію загальної формули (LnPdXm)p, де L означає карбеновий ліганд, вибраний з ряду (І, II): 1,3-дизаміщений імідазол-2-іліден загальної формули (І) R N N R1 45 , (I) де R, R1 означає алкіл, арил, гетерил, 1,3,4-тризаміщений 1,2,4-триазол-5-іліден загальної формули (II) R1 N R N N R2 , (II) 9 UA 77420 U 5 де R, R1, R2 означає алкіл, арил, гетерил, X означає некарбеновий ліганд - хлорид, бромід, йодид, m дорівнює 1, 2, n дорівнює 1, 2, р дорівнює 1, 2. Комп’ютерна верстка Д. Шеверун Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 10
ДивитисяДодаткова інформація
Назва патенту англійськоюPalladium carbene complexes
Автори англійськоюKorotkikh Mykola Ivanovych, Saberov Vahiz Shamilovych, Hlyniana Natalia Valeriivna, Kyselov Artem Viktorovych, Popov Anatolii Phedorovych, Shvaika Oleksii Pavlovych
Назва патенту російськоюКарбеновые комплексы палладия
Автори російськоюКоротких Николай Иванович, Саберов Вагиз Шамильевич, Глиняна Наталия Валериевна, Киселев Артем Викторович, Попов Анатолий Федорович, Швайка Алексей Павлович
МПК / Мітки
МПК: C07D 235/00, C07C 209/00, C07D 239/00, C07D 249/00, C07D 277/00, C07D 233/00
Мітки: комплекси, карбенові, паладію
Код посилання
<a href="https://ua.patents.su/12-77420-karbenovi-kompleksi-paladiyu.html" target="_blank" rel="follow" title="База патентів України">Карбенові комплекси паладію</a>
Попередній патент: Дезінфікуючий та охолоджуючий елемент
Наступний патент: Спосіб реєстрації та обліку інформації про тварин “анімал айді”
Випадковий патент: Поглинальний апарат